-
香榧Torreya grandis ‘Merrillii’是红豆杉科Taxaceae榧树属Torreya的大型常绿乔木,为中国南方特有的珍稀坚果,其种仁营养丰富,不仅不饱和脂肪酸含量丰富(占78.9%),还富含生育酚、金松酸、丁香烯、谷甾醇、烟酸等多种生物活性物质,具有一定的药用价值[1-2]。常见的坚果加工方式有炒制和烘烤2种,炒制是香榧的传统加工方式,作为高油坚果,香榧炒制加工过程极易发生油脂氧化酸败,导致品质下降,成品价格下跌,严重影响榧农的经济收入,成为限制香榧产业健康发展的瓶颈。有研究表明:不同的加工方式会影响香气成分,如烹煮的板栗Castanea mollissima清香味消失,而烘烤的板栗具有特有的焦香甜味[3-4];烘烤会破坏脂质细胞结构,导致脂质氧化,从而使得坚果的质量下降、储存期缩短和不良风味的产生[5]。酸价和过氧化值是评价油脂品质的重要指标[6],烘烤后的香榧种仁酸价和过氧化值明显高于烘烤前的[7]。相比炒制型葵花籽,烘烤型葵花籽的储藏时间较长,其主要原因是高温炒制诱导了自由基的产生,加快氧化反应[8]。还有研究表明:烘烤还会产生具有抗氧化活性的产物,如多酚类、维生素E等[9-10]。高温烘烤澳洲坚果Macadamia integrifolia不仅可以改善产品的口感,还能提高香气风味,但如果过度烘烤,则会使果仁发生深度褐变[11]。因此,适宜的烘烤工艺对坚果的加工品质极其重要。除此之外,盐作为添加剂,通过浸泡的方式进入到种子的内部,不仅可以改善食品的风味,还可以延长食品的储藏时间[12]。盐浸是香榧炒制过程的一个重要步骤[13],然而盐浸时间仅凭经验。因此,本研究通过对未加工香榧原料(原料香榧)、传统炒制工艺加工的香榧(炒制香榧)和烘烤工艺加工香榧(烘烤香榧)香气组分的分析及油脂氧化与抗氧化能力之间的差异比较,试图找出烘烤过程中的关键呈香成分;通过对单因素因子(第1次烘烤时间、盐渍时间和第2次烘烤时间)的设定,以果仁的色度和感官评价得分为因变量,优化香榧的烘烤加工工艺,并结合运用Design Expert 8.0软件程序,选取3因素3水平进行响应面分析,以过氧化值和酸价作为响应值,确定香榧的最佳烘烤加工工艺。
-
于2017年10月在浙江省绍兴市嵊州市谷来镇下郭村采集香榧,香榧脱蒲后,选择形状、颜色相近且无瑕疵的种籽,按照当地传统方法进行堆沤、水洗及晾晒,晾晒完成时种籽水分含量为(10±2)%。晾晒后的种籽储存在4 ℃冰箱中备用。
-
设置3个处理:①炒制香榧处理,即按当地的传统炒制方式加工;②烘烤香榧处理,即按参考文献[22]烘烤方式加工;③原料香榧处理,即不进行任何加工。每个处理设置3个重复,每个重复30个种籽。香榧的烘烤温度与盐溶液浓度参考文献[13],稍作修改,第1次烘烤温度设定为200 ℃,浸泡液为质量分数为20%的饱和盐溶液,第2次烘烤温度为120 ℃。设计单因素试验:①第1次烘烤时间设为6、8、10、12、14 min,盐浸时间为10 min,第2次烘烤时间为90 min;②盐浸时间设为5、10、15、20、25 min,第1次烘烤时间为10 min,第2次烘烤时间为90 min;③第2次烘烤时间设为30、60、90、120 min,第1次烘烤时间为10 min,盐浸时间为10 min。
-
参考文献[14],剥去外壳,种仁切片,用研磨机将种仁研磨成粉末,取样品2 g置于15 mL样品萃取瓶中,置于电热恒温水浴锅(80 ℃)预热;然后推出吸附头使其暴露于萃取瓶顶空蒸汽中,在此条件下保持30 min。当样品萃取完成后,缩回纤维头,迅速将针管插入气相色谱仪的进样口,推出纤维头解析3 min,同时启动气相色谱仪采集数据。气相色谱(GC)条件:进样口温度为250 ℃;毛细管柱:HP-5MS (30.0 m×250.00 μm×0.25 μm);质谱(MS)条件:辅助接口温度为280 ℃,离子源温度230 ℃,四极杆离子源温度为150 ℃;程序升温:起始温度60 ℃,保持1 min,以5 ℃·min−1的速度升温至280 ℃,保持2 min。定性分析:根据所得的峰谱图以及给定的香气成分报告,在NIST08质谱库中进行检索比对,最终确定香榧的香气成分物质。定量分析:样品中萜烯类、醇类、醛类、烷烃类、酯类、吡嗪类和苯类化合物释放量分别参考D-柠檬烯、十二烷醇、壬醛、十七烷、肉豆蔻酸异丙酯、2,6-二甲基吡嗪和间异丙基甲苯进行计算,醚类、酮类、酸类化合物均参考邻苯二甲醚。通过其浓度与峰面积计算每克样品中相应物质的释放量,具体计算参考KOZIEL等[15]。
-
使用CR-400型色差仪(日本柯尼卡美能达公司)测定黄度(+b*),每个样品重复测定3次。
-
请10名经过培训的感官评定员反映烘烤香榧的形态、香气、口感、滋味、色泽等5个因素在风味感官评价中的权重,并打分。每人10分。统计所有分数,所得每个因素得分除以所有指标总分(100分),得到各因素权重因子,依次赋权重12%、18%、36%、21%和13%。按表1标准对各因素打分,重新计算权重总分值。烘烤香榧的权重总分值越大,表明香榧的感官质量越好。
表 1 烘烤香榧感官评定标准
Table 1. Standard of baking T. grandis ‘Merrillii’ seeds’ sensory analysis
分值 形态 香气 口感 滋味 色泽 90~100 种仁十分饱满,无破损 香气浓郁 酥脆度很优,易于咀嚼 无涩味,无苦味,咸味适合 金黄色 80~90 种仁较饱满,有轻微破损 香气较浓 酥脆度良好,较好咀嚼 淡涩,淡苦,咸味偏淡 深黄色 70~80 种仁略饱满,破损 有香气 酥脆度一般,咀嚼度一般 稍涩,稍苦,略带咸味 淡黄色 70~60 种仁不饱满,破损很大 香气较淡 稍微不酥脆,较难咀嚼 涩,苦,无咸味 微黄色 <60 种仁干瘪,外观很差 无香气 不酥脆,很难咀嚼 很涩,很苦,咸味很重 焦黄色 -
总酚的测定采用福林酚法[18],结果以mg·g−1干质量表示。1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率的测定参考文献[18]。
-
不同处理各重复3次结果,采用Excel 2010对数据进行整理,数值为平均值±标准误,用SPSS 20.0软件对数据进行方差分析,利用LSD法进行多重比较;使用SigmaPlot 12.5软件进行图表绘制;利用Design Expert 8.0进行数据处理与分析。
-
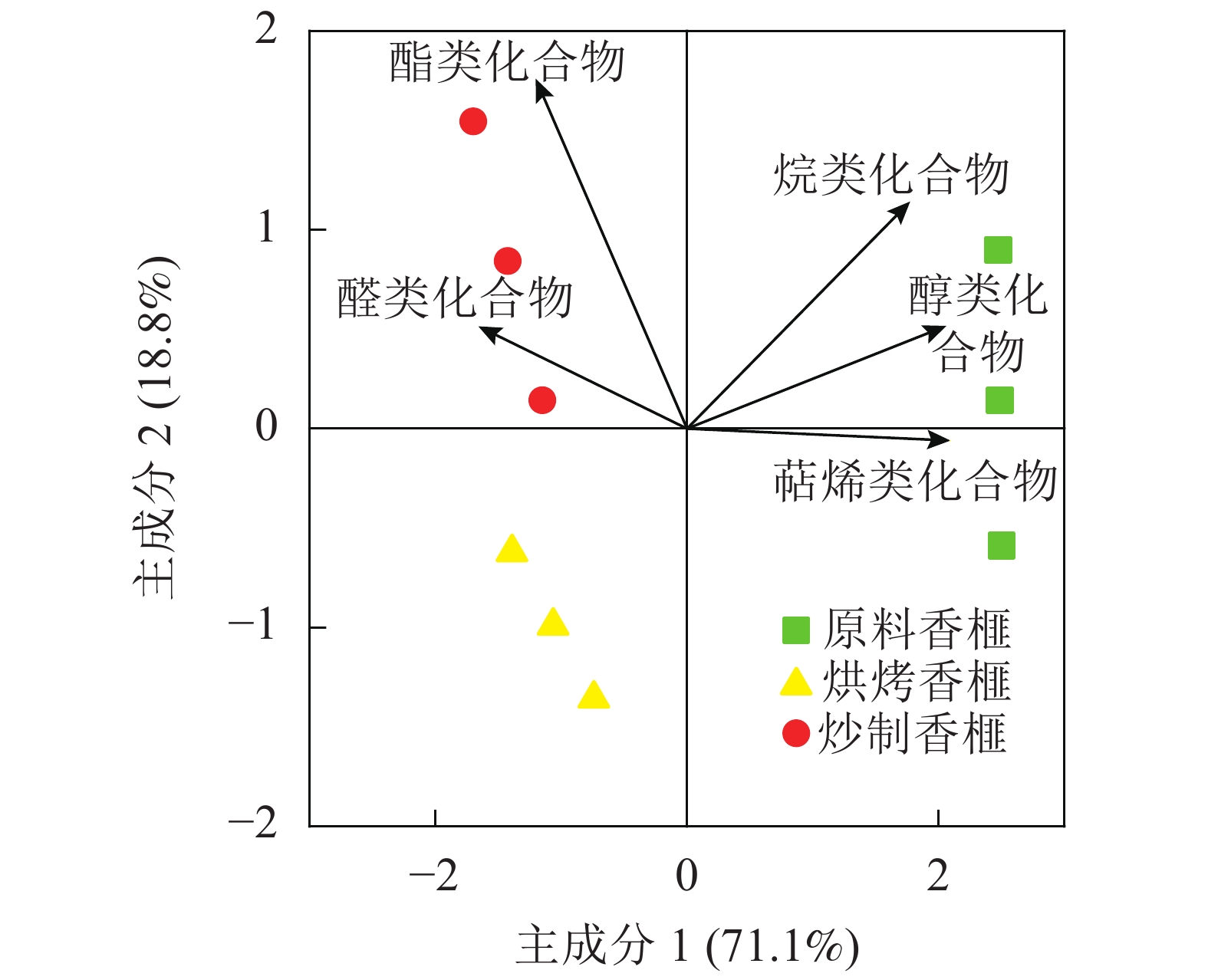
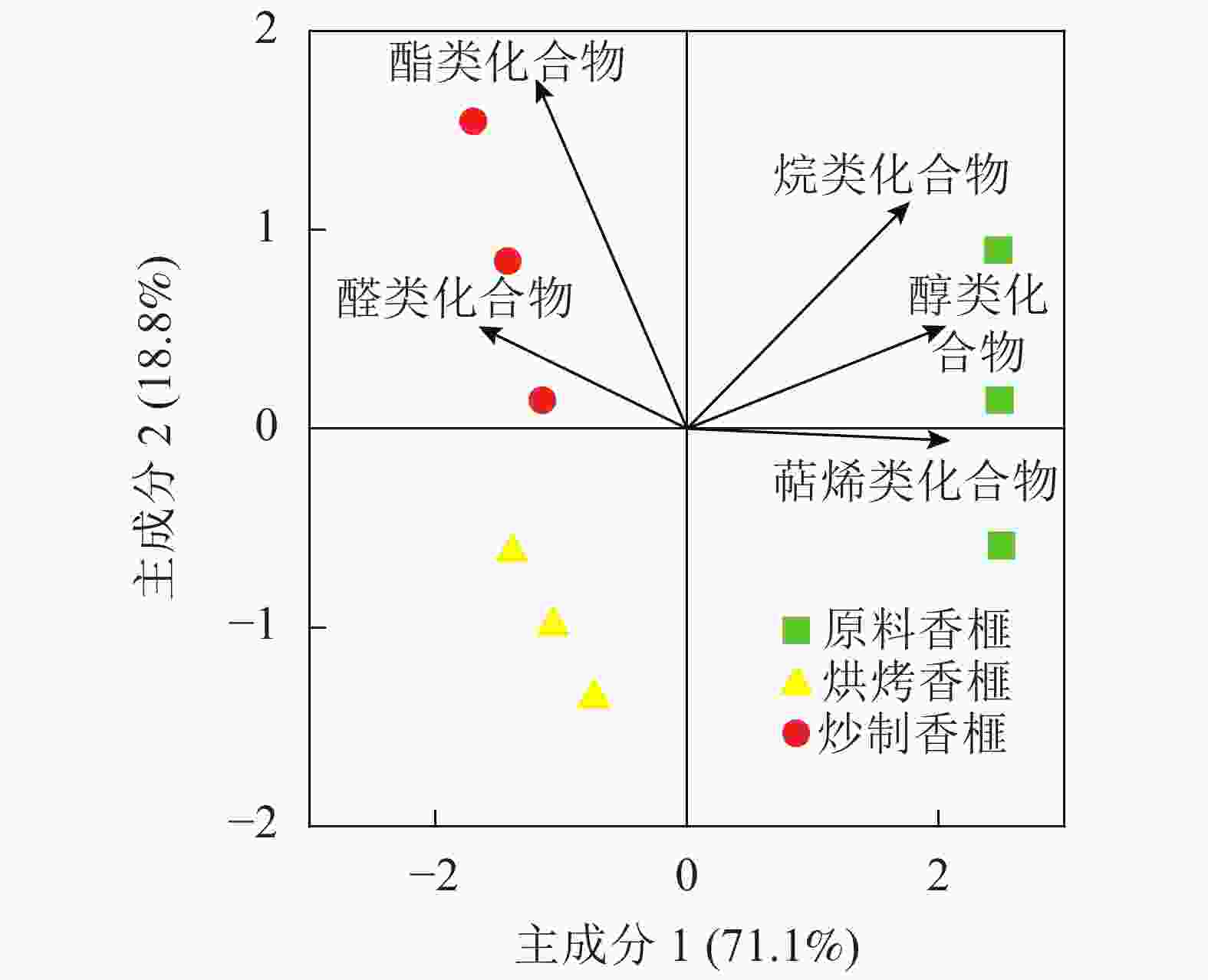
如表2所示:原料香榧共检测出60种化合物,其中萜烯类17种,醇类20种,醛类5种,苯类6种等;烘烤香榧检测出61种化合物,其中萜烯类15种,醇类20种,醛类5种,苯类化合物6种等;而炒制香榧测定出56种化合物,其中萜烯类15种,醇类16种,醛类4种,苯类6种等。与原料香榧相比,加工处理(炒制和烘烤)后萜烯类物质种类减少,但也会形成新物质(7种)。烘烤香榧比炒制香榧多产生3种醇类、2种醛类和1种醚类香气物质。与原料香榧相比,烘烤香榧和炒制香榧的萜烯类物质分别减少了69.4%和76.9%;醇类物质分别减少了78.7%和83.1%;苯类物质分别增加47.6%和57.4%。3个处理的香气物质中萜烯类化合物含量均最高,为57.7%~70.5%,其次是醇类化合物,约9.9%~19.9%。
表 2 3种香榧材料主要香气成分及其质量分数
Table 2. Main aroma composition and content of T. grandis ‘Merrillii’
大类 编号 成分 香气成分质量分数/(μg·g−1) 原料香榧 烘烤香榧 炒制香榧 萜烯类化合物 1 α-蒎烯à-pinene 12.76±0.09 a 0.51±0.08 c 0.73±0.12 b 2 月桂烯myrcene 10.93±0.08 a 6.89±0.56 b 3.80±0.19 c 3 D-柠檬烯D-limonene 118.66±0.03 a 80.81±0.58 b 49.42±0.11 c 4 2,4-二甲基苯乙烯 2,4-dimethylstyrene − 1.88±0.07 8.16±0.05 5 萜品油烯terpinolene 6.29±0.38 a 1.53±0.24 c 2.40±0.81 b 6 3-蒈烯3-carene 26.51±0.03 a 0.24±0.04 c 0.65±0.22 b 7 1-十三烯1-tridecene 25.74±0.03 a 0.19±0.02 c 3.82±0.01 b 8 异丁香烯(-)-isocaryophyllene 0.13±0.05 a 0.04±0.01 c 0.07±0.01 b 9 反式-β-金合欢烯trans-β-farnesene 0.19±0.01 b 0.28±0.03 a 0.09±0.01 c 10 衣兰油烯muurolene 0.06±0.01 b 0.07±0.01 b 0.15±0.02 a 11 δ-杜松烯δ-cadinene 0.17±0.06 0.06±0.01 − 12 A-二去氢菖蒲烯A-dihydrohomocem 0.18±0.02 a 0.09±0.01 b 0.09±0.01 b 13 长叶烯longifolene 0.15±0.03 b 0.19±0.05 b 0.30±0.01 a 14 柏木脑cedrol 0.39±0.03 b 0.17±0.02 c 0.52±0.1 a 15 左旋β-蒎烯L-β-pinene 62.83±0.07 − − 16 二甲基苯乙烯dimethyl styrene 25.84±0.09 − − 17 双戊烯dipentene 14.03±0.02 a 0.18±0.07 b 0.12±0.04 b 18 莰烯comphene 0.35±0.01 − − 萜烯类化合物总和 305.21 93.13 70.32 醇类化合物 1 十一醇undecyl alcohol 0.48±0.04 b 0.86±0.01 a 0.27±0.02 c 2 二氢香芹醇dihydrocarvyl alcohol 3.51±0.67 a 0.27±0.03 c 1.66±0.12 b 3 3-癸烯-1-醇3-decen-1-ol 0.46±0.15 b 1.21±0.05 a 0.32±0.07 c 4 芳樟醇linalool − 0.23±0.12 b 0.59±0.05 a 5 4-萜烯醇4-nonenol 11.29±0.18 0.18±0.02 − 6 α-松油醇alpha-terpineol 12.89±0.19 a 0.46±0.04 c 4.03±0.16 b 7 紫苏醇perillol 1.25±0.05 0.43±0.01 − 8 十六烷醇1-hexadecanol 9.24±0.08 a 0.38±0.12 b 0.19±0.08 c 9 2-茨醇2-propanol 0.86±0.08 a 0.06±0.01 b 0.09±0.01 b 10 橙花叔醇nerolidol 38.43±0.25 a 0.44±0.04 c 7.33±0.09 b 11 十七烷醇heptadecyl alcohol 0.29±0.01 c 1.12±0.08 b 1.50±0.12 a 12 十二烷醇dodecano 1.79±0.09 0.23±0.03 − 13 雪松醇cedrol 1.29±0.14 a 0.60±0.04 b 0.65±0.04 b 14 2-甲基十六烷醇 2-methyl cetyl alcohol 0.64±0.01 b 0.76±0.07 a 0.61±0.09 b 15 2-十四烷醇 2-tetradecanol 1.36±0.09 a 0.44±0.18 b 0.06±0.01 c 16 1-十四烷醇myristyl alcohol 0.08±0.01 b 0.08±0.01 b 0.28±0.03 a 17 骨化醇calcitonin 0.15±0.04 a 0.05±0.09 b 0.20±0.07 a 18 叔十六硫醇tert-hexadecane 0.49±0.08 0.30±0.09 − 19 2-(十八氧基)乙醇2-(octadecyloxy)ethanol 0.37±0.04 b 0.54±0.08 a 0.06±0.12 c 20 6-仲辛醇6-octanol 0.99±0.14 − − 21 维生素A 0.62±0.06 b 5.92±0.08 a 0.58±0.13 c 醇类化合物总和 86.48 14.56 18.42 醛类化合物 1 糠醛2-furaldehyde − 3.99±0.04 5.59±0.12 2 2-乙基己烯醛2-ethylhexenal 0.42±0.06 6.48±0.12 − 3 癸醛camphor 4.99±0.8 a 0.87±0.11 c 1.69±0.30 b 4 壬醛1-nonanal 5.11±0.16 b 2.71±0.21 c 9.56±0.26 a 5 十二醛dodec aldehyde 0.74±0.05 0.19±0.02 − 6 2-十一碳烯醛2-undecenal 1.43±0.11 − 0.37±0.05 醛类化合物总和 12.69 14.24 17.21 烷类化合物 1 正十四烷tetradecane 2.49±0.04 a 0.47±0.06 b 0.88±0.05 b 2 正十七烷heptadecane 0.09±0.01 c 0.16±0.01 b 0.38±0.05 a 3 正十九烷ninecane 0.44±0.15 a 0.26±0.02 b 0.16±0.02 c 4 正二十七烷N-hexadecane − 0.16±0.01 0.18±0.06 烷类化合物总和 3.02 1.05 1.60 酯类化合物 1 肉豆蔻酸异丙酯isopropyl myristate 0.07±0.01 b 0.12±0.01 a 0.09±0.01 b 2 邻苯二甲酸二异丁酯diisobutyl phthalate 0.18±0.02 b 0.15±0.01 b 0.49±0.01 a 3 棕榈酸甲酯methyl palmitate 0.02±0.01 b 0.02±0.01 b 0.04±0.01 a 4 邻苯二甲酸正丁异辛酯N-butyl octyl phthalate 0.17±0.01 b 0.16±0.01 b 0.56±0.01 a 酯类化合物总和 0.44 0.45 1.18 醚类化合物 1 邻苯二甲醚1,2-dimethoxybenzene 12.03±0.04 a 3.18±0.04 b 0.56±0.04 c 2 对苯二甲醚1,4-dimethoxybenzene 0.21±0.03 b 0.26±0.01 b 1.01±0.09 a 3 乙二醇十二烷基醚2-(dodecyloxy)ethanol 1.49±0.01 − 0.09±0.06 醚类化合物总和 13.73 3.44 1.66 酮类化合物 1 右旋香芹酮D(+)-carvone − 0.31±0.01 1.24±0.01 2 2-莰酮camphor − 0.44±0.02 0.21±0.01 3 3-甲基-6-(1-甲基亚乙基)-2-环己酮3-methyl-6-
(1-methylethylidene)-2-cyclohexene-1-one4.5±0.04 a 0.63±0.02 c 2.30±0.01 b 酮类化合物总和 4.50 1.38 3.75 酸类化合物 1 棕榈酸palmitic acid 1.68±0.09 2.50±0.04 − 酸类化合物总和 1.68 2.50 − 吡嗪类化合物 1 2,6-二甲基吡嗪2,6-dimethyl piperazune − 3.28±0.07 0.09±0.01 吡嗪类化合物总和 0 3.28 0.09 苯类化合物 1 丙基苯propylbenzene 0.25±0.02 c 6.91±0.05 a 6.15±0.11 b 2 间异丙基甲苯P-isopropyltoluene 0.27±0.03 b 0.30±0.01 a 0.31±0.01 a 3 1-甲氧基-4-丙烯基苯1-methoxy-4-propenylbenzene 1.13±0.05 b 2.16±0.03 a 0.25±0.01 c 4 1,2,3-三甲氧基苯1,2,3-trimethoxybenzene 0.29±0.01 b 0.67±0.02 a 0.29±0.07 b 5 3,4,5-三甲氧基甲苯3,4,5-triMethoxytoluene 2.84±0.04 a 1.63±0.07 c 1.71±0.01 b 6 3,3′,5,5′-四甲基联苯3,3′,5,5′-tetramethylbiphenyl 0.31±0.01 c 0.89±0.01 b 1.02±0.01 a 苯类化合物总和 5.09 12.56 9.73 说明:−表示未检出。不同小写母表示不同处理间差异显著(P<0.05) 从图1可知:主成分1和主成分2总和达89.9%,解释率很好。未加工香榧(原料香榧)与加工香榧(炒制香榧和烘烤香榧)之间存在明显的分离。其中,主成分1主要贡献的物质为萜烯类、醇类和烷类化合物;成分2主要贡献的物质为酯类化合物。
-
如表3所示:与原料香榧相比,炒制香榧和烘烤香榧的酸价、过氧化值和总酚质量分数均呈显著上升的趋势,而DPPH则呈显著下降的趋势。烘烤香榧的酸价和过氧化值均小于炒制香榧;而烘烤香榧和炒制香榧总酚质量分数分别为6.984和6.214 mg·g−1,DPPH自由基清除能力分别为58.93%和50.43%。
表 3 不同加工方式对香榧脂质氧化和抗氧化活性的影响
Table 3. Effects of processing techniques on oxidation ability and antioxidant activity of T. grandis‘Merrillii’seeds
加工方式 酸价/(mg·g−1) 过氧化值/(mmol·kg−1) 总酚/(mg·g−1) DPPH自由基清除活性/% 原料香榧 0.421±0.0222 c 1.194±0.032 c 4.328±0.132 c 79.43±2.42 a 烘烤香榧 0.521±0.0323 b 2.329±0.028 b 6.984±0.273 a 58.93±3.13 b 炒制香榧 0.772±0.0382 a 7.382±0.273 a 6.214±0.243 b 50.43±2.42 c 说明:不同小写字母表示不同处理之间差异显著(P<0.05) -
随着第1烘烤时间的的延长,香榧种仁颜色由浅黄白色到焦黄色,再呈现明显焦黑色,其色度值则在12 min时达到最大;而感官评价呈先增后降的趋势,当第1次烘烤时间为14 min时,感官评价得分骤降(图2A1和A2)。盐浸的香榧种仁均呈现出一定的焦黄色,当浸泡时间少于10 min时,种仁表面的光泽感较佳;其感官评价则呈先升后降的趋势(图2B1和B2)。第2次烘烤时间对色泽外观的影响显著,第2次烘烤时间为30或60 min时,种仁表面呈黄白色,而当烘烤时间达到90 min,则呈现出明显的焦黄色(图2C1);其感官评价呈上升趋势,烘烤时间超过90 min时,感官评价分数略有下降(图2C2)。综上所述,根据感官评价和色度指标,第1次烘烤的最佳时间为10~14 min,最佳盐浸时间为10~15 min,第2次烘烤的最佳时间为90~120 min。
-
表4所示:应用Design-Expert软件对试验的响应值进行回归拟合,得到酸价(AV)与3个因素[第1次烘烤时间(A)、盐浸时间(B)、第2次烘烤时间(C)]之间的拟合方程:AV=0.640+0.150A+0.068B+0.042C−0.019AB−0.005AC+0.009BC+0.082A2+0.068B2+0.021C2;过氧化值(POV)与3个因素之间的拟合方程:POV=2.610+0.180A+0.075B+0.056C−0.030AB+0.021AC+0.016BC+0.110A2+0.061B2+0.024C2。所有模型拟合的P<0.05,模型显著,失拟项P>0.05,不显著,模型的拟合系数分别为0.969 6和0.984 4,变异系数分别为1.96%和1.11%,说明模型拟合度高,结果可信。响应面图能够反映最优取值点及各参数之间的相互作用,其曲线越陡,则该因素影响越大。从图3A~3F可知:对酸价和过氧化值的影响从大到小依次为第1次烘烤时间、盐浸时间、第2次烘烤时间。
表 4 香榧烘烤工艺优化实验设计与结果
Table 4. Results and design of Box-Behnken RSM experiment of baking T. grandis ‘Merrillii’ seeds
编号 第1次烘烤时间/min 盐浸时间/min 第2次烘烤时间/min 过氧化值/(mmol·kg−1) 酸价/(mg·g−1) 1 10.00 10.00 105.00 2.478±0.06 0.514±0.02 2 10.00 12.50 90.00 2.562±0.04 0.561±0.03 3 10.00 12.50 120.00 2.618±0.02 0.654±0.04 4 10.00 15.00 105.00 2.693±0.03 0.729±0.03 5 12.00 10.00 90.00 2.581±0.03 0.645±0.03 6 12.00 10.00 120.00 2.675±0.03 0.710±0.04 7 12.00 15.00 90.00 2.693±0.08 0.720±0.04 8 12.00 15.00 120.00 2.852±0.06 0.823±0.02 9 14.00 10.00 105.00 2.936±0.03 0.879±0.03 10 14.00 12.50 90.00 2.833±0.03 0.832±0.06 11 14.00 12.50 120.00 2.973±0.03 0.907±0.06 12 14.00 15.00 105.00 3.029±0.03 1.019±0.02 13 12.00 12.50 105.00 2.581±0.03 0.645±0.03 -
香气是消费者在购买坚果产品时候非常直观有效评判其品质的依据之一[19]。核桃Juglans regia中共含有29类挥发性化合物,其中醛类物质11种,烷类物质4种,醇类物质3种,酯类物质3种,酚类物质1种,酸类物质4种[20]。澳洲坚果Macadamia spp. 中共鉴定出23种挥发性物质,其中醛类化合物9种,吡嗪类化合物9种,呋喃类化合物2种,其他化合物3种,烘焙后的澳洲坚果共含有33种香气成分,而未进行加工的的原料果仁中仅有4种香气成分,特别是吡嗪类和呋喃类2类物质上升非常显著[21]。LASEKAN等[22]在烤杏仁Terminalia catappa中鉴定出醛、酮、吡嗪和醇类是杏仁烘烤后主要香气组成成分。本研究结果表明:原料香榧、炒制香榧和烘烤香榧的主要香气挥发性风味物质均是萜类化合物,其中D-柠檬烯含量最为丰富(38.87%~86.77%),这与王衍彬等[14]从香榧油中鉴定出的主要香味物质一致。D-柠檬烯呈令人愉悦的新鲜柠檬香气,常被作为天然的食品添加剂。与香榧原料相比,炒制香榧的萜类物质和醇类物质的损失程度明显大于烘烤香榧,这可能是由于高温热物理的影响。烘烤香榧的主要香气物质——萜类物质总量均明显高于炒制香榧,表明烘烤工艺更有利于保留香榧的特征香气。
除挥发性香气物质外,香榧作为油料作物,其油脂品质也是评价香榧产品品质的重要指标。过氧化值和酸价水平通常被用来评估坚果食品的油脂氧化程度[23]。本研究结果显示:炒制香榧的酸败程度显著高于烘烤香榧的,高达0.767 mg·kg−1,表明烘烤香榧的油脂氧化速率低于炒制香榧。这与颜小平[8]的结果一致,葵花籽炒制过后,虽风味物质增加,但保质期非常短,主要原因为炒制时的高温使得葵花籽油过氧化值升高,发生明显酸败,而烘烤后葵花籽的保存时间则更长。为了防止氧化损伤,植物常利用酶调节或细胞凋亡来清除氧化成分[24],其中酚类化合物是强大的自由基清除剂[25]。宫长荣等[26]在对烟叶的烘烤过程中发现:烟叶内的多酚类物质随着烘烤时间延长而增加。DPPH自由基清除能力是抗氧化活性的重要指标[27]。在对板栗的加工过程中,发现烘烤和蒸煮这2种加工方式均能提高DPPH自由基清除力[28]。本研究结果表明:烘烤香榧的总酚质量分数和DPPH明显高于炒制香榧,表明烘烤香榧的抗氧化活性显著高于炒制香榧。综上所述,烘烤香榧的油脂酸败程度明显低于炒制香榧,这可能与较强的抗氧化活性有关。
虽然烘烤时间的延长会使得香味物质丰富,但颜色和口感也会发生变化,美拉德反应和焦糖化反应等是导致颜色发生变化的重要原因,颜色的加深通常伴随品质的下降,从而影响感官评分。VÁZQUEZ-ARAÚJO等[29]研究发现:长时间烘烤杏仁,杏仁色泽变黑,风味变得苦涩。本研究结果表明:随着烘烤时间的延长,香榧种仁的颜色逐渐变成焦黑色,口感变差。此外,盐浸广泛应用于果蔬、蜜饯、肉制品等领域。本研究利用Design-Expert软件分析烘烤工艺对香榧种仁油脂氧化和抗氧化能力的回归响应模型,进一步优化烘烤香榧的最佳条件,得出第1次烘烤的最佳时间为12 min (200 ℃),最佳盐浸时间为10 min,第2次烘烤的最佳时间为95 min (120 ℃)。
Comparative analysis of aroma components and oil quality of Torreya grandis ‘Merrillii’ nuts with different processing techniques
-
摘要:
目的 研究不同加工工艺(炒制和烘烤)的香榧Torreya grandis ‘Merrillii’种仁香气成分、油脂氧化和抗氧化能力的变化,揭示不同加工方式对香榧香气物质和油脂品质形成的影响,探讨香榧的最优烘烤工艺。 方法 比较炒制香榧(传统的炒制方式加工)、烘烤香榧(烘烤方式加工)和原料香榧(未加工前的原料)香气组分的差异,并测定3种香榧材料的酸价、过氧化值、总酚质量分数和1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性,明确适宜的香榧加工方式;并在此基础上,进一步设计以第1次烘烤时间、盐浸时间、第2次烘烤时间作为变量因子的单因素试验,结合种仁感官评价、过氧化值、酸价、总酚和DPPH自由基清除活性的测定,再通过Design-Expert软件对酸价和过氧化值响应面优化分析,明确最优的香榧烘烤加工工艺。 结果 萜烯类化合物为香榧香气主要物质,高达57.7%~70.5%;烘烤香榧的香气物质种类和总量均明显大于炒制香榧,且烘烤香榧种仁的油脂酸败程度明显低于炒制香榧。根据不同烘烤因子对感官评价和色度指标的影响试验,确定第1次烘烤的最佳时间为10~14 min (200 ℃),最佳盐浸时间为10~15 min,第2次烘烤的最佳时间为90~120 min (120 ℃)。 结论 烘烤方式加工的香榧种仁香气成分及油脂品质均明显优于炒制方式加工的香榧;香榧最佳烘烤条件为:先在200 ℃下烘烤12 min,再在20%质量分数盐溶液中浸泡10 min,最后在120 ℃下烘烤95 min。图3表4参29 Abstract:Objective The objective is to investigate the aroma components, oil oxidation and antioxidant capacity of Torreya grandis ‘Merrillii’ nuts with different processing techniques, reveal the influence mechanism of different processing techniques on the formation of aroma substances and oil quality of the nuts, and test the effects of different variables on chromaticity, sensory evaluation and oil quality, so as to explore the optimal baking process. Method The aroma components of the nuts with three processing techniques (fried , roasted, and raw) were compared, and the acid value, peroxide value, total phenol content and DPPH free radical scavenging activity of the three T. grandis ‘ Merrillii’ materials were measured to determine the appropriate processing technique. Furthermore, a single factor experiment with the first baking time, salt soaking time and the second baking time as the variable factors was designed. Combined with sensory evaluation of seeds, and determination of peroxide value, acid value, total phenol and DPPH radical scavenging activity, the best baking processing was optimized by Design-Expert software. Result Terpenes were the main aroma components of the nuts, up to 57.7%–70.5%. The types and total amount of aroma components in roasted nuts were significantly higher than those in fried nuts, and the degree of oil rancidity of roasted kernel was significantly lower than that of fried nuts. According to the effects of different baking factors on sensory evaluation and chromaticity index, it was found that the optimal time for the first baking was 10–14 min(200 ℃), the optimal salting time was 10–15 min, and the optimal time for the second baking was 90–120 min(120 ℃). Conclusion The aroma components and oil quality of T. grandis ‘ Merrillii’ kernels processed by baking are significantly better than those processed by frying. The best baking conditions are as follows: baking at 200 ℃ for 12 min, then soaking in 20% salt solution for 10 min, and finally baking at 120 ℃ for 95 min. [Ch, 3 fig. 4 tab. 29 ref.] -
Key words:
- Torreya grandis ‘Merrillii’ /
- baking /
- aroma /
- oil oxidation /
- antioxidant capacity
-
表 1 烘烤香榧感官评定标准
Table 1. Standard of baking T. grandis ‘Merrillii’ seeds’ sensory analysis
分值 形态 香气 口感 滋味 色泽 90~100 种仁十分饱满,无破损 香气浓郁 酥脆度很优,易于咀嚼 无涩味,无苦味,咸味适合 金黄色 80~90 种仁较饱满,有轻微破损 香气较浓 酥脆度良好,较好咀嚼 淡涩,淡苦,咸味偏淡 深黄色 70~80 种仁略饱满,破损 有香气 酥脆度一般,咀嚼度一般 稍涩,稍苦,略带咸味 淡黄色 70~60 种仁不饱满,破损很大 香气较淡 稍微不酥脆,较难咀嚼 涩,苦,无咸味 微黄色 <60 种仁干瘪,外观很差 无香气 不酥脆,很难咀嚼 很涩,很苦,咸味很重 焦黄色 表 2 3种香榧材料主要香气成分及其质量分数
Table 2. Main aroma composition and content of T. grandis ‘Merrillii’
大类 编号 成分 香气成分质量分数/(μg·g−1) 原料香榧 烘烤香榧 炒制香榧 萜烯类化合物 1 α-蒎烯à-pinene 12.76±0.09 a 0.51±0.08 c 0.73±0.12 b 2 月桂烯myrcene 10.93±0.08 a 6.89±0.56 b 3.80±0.19 c 3 D-柠檬烯D-limonene 118.66±0.03 a 80.81±0.58 b 49.42±0.11 c 4 2,4-二甲基苯乙烯 2,4-dimethylstyrene − 1.88±0.07 8.16±0.05 5 萜品油烯terpinolene 6.29±0.38 a 1.53±0.24 c 2.40±0.81 b 6 3-蒈烯3-carene 26.51±0.03 a 0.24±0.04 c 0.65±0.22 b 7 1-十三烯1-tridecene 25.74±0.03 a 0.19±0.02 c 3.82±0.01 b 8 异丁香烯(-)-isocaryophyllene 0.13±0.05 a 0.04±0.01 c 0.07±0.01 b 9 反式-β-金合欢烯trans-β-farnesene 0.19±0.01 b 0.28±0.03 a 0.09±0.01 c 10 衣兰油烯muurolene 0.06±0.01 b 0.07±0.01 b 0.15±0.02 a 11 δ-杜松烯δ-cadinene 0.17±0.06 0.06±0.01 − 12 A-二去氢菖蒲烯A-dihydrohomocem 0.18±0.02 a 0.09±0.01 b 0.09±0.01 b 13 长叶烯longifolene 0.15±0.03 b 0.19±0.05 b 0.30±0.01 a 14 柏木脑cedrol 0.39±0.03 b 0.17±0.02 c 0.52±0.1 a 15 左旋β-蒎烯L-β-pinene 62.83±0.07 − − 16 二甲基苯乙烯dimethyl styrene 25.84±0.09 − − 17 双戊烯dipentene 14.03±0.02 a 0.18±0.07 b 0.12±0.04 b 18 莰烯comphene 0.35±0.01 − − 萜烯类化合物总和 305.21 93.13 70.32 醇类化合物 1 十一醇undecyl alcohol 0.48±0.04 b 0.86±0.01 a 0.27±0.02 c 2 二氢香芹醇dihydrocarvyl alcohol 3.51±0.67 a 0.27±0.03 c 1.66±0.12 b 3 3-癸烯-1-醇3-decen-1-ol 0.46±0.15 b 1.21±0.05 a 0.32±0.07 c 4 芳樟醇linalool − 0.23±0.12 b 0.59±0.05 a 5 4-萜烯醇4-nonenol 11.29±0.18 0.18±0.02 − 6 α-松油醇alpha-terpineol 12.89±0.19 a 0.46±0.04 c 4.03±0.16 b 7 紫苏醇perillol 1.25±0.05 0.43±0.01 − 8 十六烷醇1-hexadecanol 9.24±0.08 a 0.38±0.12 b 0.19±0.08 c 9 2-茨醇2-propanol 0.86±0.08 a 0.06±0.01 b 0.09±0.01 b 10 橙花叔醇nerolidol 38.43±0.25 a 0.44±0.04 c 7.33±0.09 b 11 十七烷醇heptadecyl alcohol 0.29±0.01 c 1.12±0.08 b 1.50±0.12 a 12 十二烷醇dodecano 1.79±0.09 0.23±0.03 − 13 雪松醇cedrol 1.29±0.14 a 0.60±0.04 b 0.65±0.04 b 14 2-甲基十六烷醇 2-methyl cetyl alcohol 0.64±0.01 b 0.76±0.07 a 0.61±0.09 b 15 2-十四烷醇 2-tetradecanol 1.36±0.09 a 0.44±0.18 b 0.06±0.01 c 16 1-十四烷醇myristyl alcohol 0.08±0.01 b 0.08±0.01 b 0.28±0.03 a 17 骨化醇calcitonin 0.15±0.04 a 0.05±0.09 b 0.20±0.07 a 18 叔十六硫醇tert-hexadecane 0.49±0.08 0.30±0.09 − 19 2-(十八氧基)乙醇2-(octadecyloxy)ethanol 0.37±0.04 b 0.54±0.08 a 0.06±0.12 c 20 6-仲辛醇6-octanol 0.99±0.14 − − 21 维生素A 0.62±0.06 b 5.92±0.08 a 0.58±0.13 c 醇类化合物总和 86.48 14.56 18.42 醛类化合物 1 糠醛2-furaldehyde − 3.99±0.04 5.59±0.12 2 2-乙基己烯醛2-ethylhexenal 0.42±0.06 6.48±0.12 − 3 癸醛camphor 4.99±0.8 a 0.87±0.11 c 1.69±0.30 b 4 壬醛1-nonanal 5.11±0.16 b 2.71±0.21 c 9.56±0.26 a 5 十二醛dodec aldehyde 0.74±0.05 0.19±0.02 − 6 2-十一碳烯醛2-undecenal 1.43±0.11 − 0.37±0.05 醛类化合物总和 12.69 14.24 17.21 烷类化合物 1 正十四烷tetradecane 2.49±0.04 a 0.47±0.06 b 0.88±0.05 b 2 正十七烷heptadecane 0.09±0.01 c 0.16±0.01 b 0.38±0.05 a 3 正十九烷ninecane 0.44±0.15 a 0.26±0.02 b 0.16±0.02 c 4 正二十七烷N-hexadecane − 0.16±0.01 0.18±0.06 烷类化合物总和 3.02 1.05 1.60 酯类化合物 1 肉豆蔻酸异丙酯isopropyl myristate 0.07±0.01 b 0.12±0.01 a 0.09±0.01 b 2 邻苯二甲酸二异丁酯diisobutyl phthalate 0.18±0.02 b 0.15±0.01 b 0.49±0.01 a 3 棕榈酸甲酯methyl palmitate 0.02±0.01 b 0.02±0.01 b 0.04±0.01 a 4 邻苯二甲酸正丁异辛酯N-butyl octyl phthalate 0.17±0.01 b 0.16±0.01 b 0.56±0.01 a 酯类化合物总和 0.44 0.45 1.18 醚类化合物 1 邻苯二甲醚1,2-dimethoxybenzene 12.03±0.04 a 3.18±0.04 b 0.56±0.04 c 2 对苯二甲醚1,4-dimethoxybenzene 0.21±0.03 b 0.26±0.01 b 1.01±0.09 a 3 乙二醇十二烷基醚2-(dodecyloxy)ethanol 1.49±0.01 − 0.09±0.06 醚类化合物总和 13.73 3.44 1.66 酮类化合物 1 右旋香芹酮D(+)-carvone − 0.31±0.01 1.24±0.01 2 2-莰酮camphor − 0.44±0.02 0.21±0.01 3 3-甲基-6-(1-甲基亚乙基)-2-环己酮3-methyl-6-
(1-methylethylidene)-2-cyclohexene-1-one4.5±0.04 a 0.63±0.02 c 2.30±0.01 b 酮类化合物总和 4.50 1.38 3.75 酸类化合物 1 棕榈酸palmitic acid 1.68±0.09 2.50±0.04 − 酸类化合物总和 1.68 2.50 − 吡嗪类化合物 1 2,6-二甲基吡嗪2,6-dimethyl piperazune − 3.28±0.07 0.09±0.01 吡嗪类化合物总和 0 3.28 0.09 苯类化合物 1 丙基苯propylbenzene 0.25±0.02 c 6.91±0.05 a 6.15±0.11 b 2 间异丙基甲苯P-isopropyltoluene 0.27±0.03 b 0.30±0.01 a 0.31±0.01 a 3 1-甲氧基-4-丙烯基苯1-methoxy-4-propenylbenzene 1.13±0.05 b 2.16±0.03 a 0.25±0.01 c 4 1,2,3-三甲氧基苯1,2,3-trimethoxybenzene 0.29±0.01 b 0.67±0.02 a 0.29±0.07 b 5 3,4,5-三甲氧基甲苯3,4,5-triMethoxytoluene 2.84±0.04 a 1.63±0.07 c 1.71±0.01 b 6 3,3′,5,5′-四甲基联苯3,3′,5,5′-tetramethylbiphenyl 0.31±0.01 c 0.89±0.01 b 1.02±0.01 a 苯类化合物总和 5.09 12.56 9.73 说明:−表示未检出。不同小写母表示不同处理间差异显著(P<0.05) 表 3 不同加工方式对香榧脂质氧化和抗氧化活性的影响
Table 3. Effects of processing techniques on oxidation ability and antioxidant activity of T. grandis‘Merrillii’seeds
加工方式 酸价/(mg·g−1) 过氧化值/(mmol·kg−1) 总酚/(mg·g−1) DPPH自由基清除活性/% 原料香榧 0.421±0.0222 c 1.194±0.032 c 4.328±0.132 c 79.43±2.42 a 烘烤香榧 0.521±0.0323 b 2.329±0.028 b 6.984±0.273 a 58.93±3.13 b 炒制香榧 0.772±0.0382 a 7.382±0.273 a 6.214±0.243 b 50.43±2.42 c 说明:不同小写字母表示不同处理之间差异显著(P<0.05) 表 4 香榧烘烤工艺优化实验设计与结果
Table 4. Results and design of Box-Behnken RSM experiment of baking T. grandis ‘Merrillii’ seeds
编号 第1次烘烤时间/min 盐浸时间/min 第2次烘烤时间/min 过氧化值/(mmol·kg−1) 酸价/(mg·g−1) 1 10.00 10.00 105.00 2.478±0.06 0.514±0.02 2 10.00 12.50 90.00 2.562±0.04 0.561±0.03 3 10.00 12.50 120.00 2.618±0.02 0.654±0.04 4 10.00 15.00 105.00 2.693±0.03 0.729±0.03 5 12.00 10.00 90.00 2.581±0.03 0.645±0.03 6 12.00 10.00 120.00 2.675±0.03 0.710±0.04 7 12.00 15.00 90.00 2.693±0.08 0.720±0.04 8 12.00 15.00 120.00 2.852±0.06 0.823±0.02 9 14.00 10.00 105.00 2.936±0.03 0.879±0.03 10 14.00 12.50 90.00 2.833±0.03 0.832±0.06 11 14.00 12.50 120.00 2.973±0.03 0.907±0.06 12 14.00 15.00 105.00 3.029±0.03 1.019±0.02 13 12.00 12.50 105.00 2.581±0.03 0.645±0.03 -
[1] LOU Heqiang, DING Mingzhu, WU Jiasheng, et al. Full-length transcriptome analysis of the genes involved in tocopherol biosynthesis in Torreya grandis [J]. J Agric Food Chem, 2019, 20(67): 1877 − 1888. [2] SUO Jinwei, TONG Ke, WU Jiasheng, et al. Comparative transcriptome analysis reveals key genes in the regulation of squalene and β-sitosterol biosynthesis in Torreya grandis [J]. Ind Crops Prod, 2019, 131: 182 − 193. [3] MORINI G. Volatile compounds in roasted and boiled Chinese chestnuts (Castane) mollissima [J]. Lebens-mittel-Wissenschaft und-Technologie, 1995, 28(6): 638 − 640. [4] KRIST S, UNTERWEGER H, BANDION F, et al. Volatile compound analysis of SPME headspace andextract samples from roasted Italian chestnuts (Castanea Mill.) using GC-MS [J]. Eur Food Res Technol, 2004, 219(5): 470 − 473. [5] CÄMMERER B, KROH L K. Shelf life of linseeds and peanuts in relation to roasting [J]. LWT-Food Sci Technol, 2008, 42(2): 545 − 549. [6] CHEN Baoqiong, CUI Xiangyu, ZHAO Xin, et al. Antioxidative and acute antiinflammatory effects of Torreya grandis [J]. Fitoterapia, 2006, 77(4): 262 − 267. [7] 葛林梅, 郜海燕, 陈杭君, 等. 加工工艺对香榧油脂氧化和抗氧化活性的影响[J]. 中国粮油学报, 2011, 26(5): 42 − 46. GE Linmei, GAO Haiyan, CHEN Hangjun, et al. Effect of processing on lipid oxidation and antioxidant ability of Torreya grandis [J]. J Chin Cereals Oils Assoc, 2011, 26(5): 42 − 46. [8] 颜小平. 烘炒葵花籽品质改良及抗氧化研究[D]. 广州: 华南理工大学, 2011. YAN Xiaoping. Research on Quality Improvement and Antioxidant of Roasted Sunflower Seeds[D]. Guangzhou: South China University of Technology, 2011. [9] AMARAL J S, CASAL S, SEABRA R M, et al. Effects of roasting on hazelnut lipids [J]. J Agric Food Chem, 2006, 54(4): 1315 − 1321. [10] MÜLLER A K, SCHÖNE F, GLEI M. Influence of roasting conditions on health-related compounds in different nuts [J]. Food Chem, 2015, 180(1): 77 − 85. [11] WALL M M, GENTRY T S. Carbohydrate composition and color development during drying and roasting of macadamia nuts (Macadamia integrifolia) [J]. LWT-Food Sci Technol, 2007, 40(4): 587 − 593. [12] THAMMAPAT P, MEESO N, SIRIAMORNPNP S. Effects of NaCl and soaking temperature on the phenolic compounds, α-tocopherol, γ-oryzanol and fatty acids of glutinous rice [J]. Food Chem, 2015, 175(15): 218 − 224. [13] 汪瑶, 余勇, 郭磊, 等. 利用正交实验和模糊评价改进香榧加工工艺[J]. 食品与发酵工业, 2013, 39(10): 151 − 155. WANG Yao, YU Yong, GUO Lei, et al. Application of orthgonal experiment and fuzzy evaluation in development of Torreya grandis processing technology [J]. Food Ferment Ind, 2013, 39(10): 151 − 155. [14] 王衍彬, 刘本同, 秦玉川, 等. 不同品种香榧种子油脂肪酸及香味物质组成分析[J]. 中国油脂, 2016, 41(2): 101 − 105. WANG Yanbin, LIU Bentong, QING Yuchuan, et al. Analysis of fatty acid and aroma substances in seed oil of different species of Torreya grandis [J]. Chin Oil, 2016, 41(2): 101 − 105. [15] KOZIEL J A, NGUYEN LT, GLANVILLE T D, et al. Method for sampling and analysis of volatile biomarker in process gas from aerobic digestion of poultry carcasses using time-weighted average SPME and GC-MS [J]. Food Chem, 2017, 232: 799 − 807. [16] ZHANG Zuying, JIN Hangbiao, SUO Jinwei, et al. Effect of temperature and humidity on oil quality of harvested Torreya grandis cv. Merrillii nuts during the after-ripening stage [J]. Front Plant Sci, 2020, 11: 573 − 681. [17] 宋丽丽, 郜海燕, 葛林梅, 等. 包装对香榧坚果贮藏中的油脂酸败和抗氧化能力的影响[J]. 林业科学, 2009, 45(3): 49 − 53. SONG Lili, GAO Haiyan, GE Linmei, et al. Effects of different packaging on lipid peroxidation and antioxidant ability ofTorreya grandis nuts during storage at room temperature [J]. Sci Silv Sin, 2009, 45(3): 49 − 53. [18] 李巨秀, 张小宁, 李伟伟. 不同品种石榴花色苷、总多酚含量及抗氧化活性比较研究[J]. 食品科学, 2011, 32(23): 143 − 146. LI Juxiu, ZHANG Xiaoning, LI Weiwei. Comparative studies of total anthocyanins, total polyphenols and antioxidant activities of different pomegra [J]. Food Sci, 2011, 32(23): 143 − 146. [19] ZHOU Yan, SUN Shanshan, BEI Weiya, et al. Preparation and antimicrobial activity of oregano essential oil pickering emulsion stabilized by cellulose nanocrystals [J]. Int J Biol Macromolecs, 2018, 112(3/4): 7 − 13. [20] 石天磊, 李晓颍, 左波, 等. 8份核桃资源坚果主要香气物质分析[J]. 果树学报, 2020, 37(7): 1016 − 1024. SHI Tianlei, LI Xiaoying, ZUO Bo, et al. Analysis of the main aroma substances in eight walnut accessions [J]. J Fruit Sci, 2020, 37(7): 1016 − 1024. [21] 静玮, 苏子鹏, 林丽静. 澳洲坚果焙烤过程中挥发性成分的特征分析[J]. 热带作物学报, 2016, 37(6): 1223 − 1231. JING Wei, SU Zipeng, LIN Lijing. Volatile profiling of Macadamia nuts during roasting [J]. Chin J Trop Crops, 2016, 37(6): 1223 − 1231. [22] LASEKAN O, ALFI K, ABBAS K A. Volatile compounds of roasted and steamed malaysian tropical almond nut (Terminalia catappa L.) [J]. Int J Food Prop, 2012, 15(5): 1120 − 1132. [23] CHUN J Y, LEE J S, EITENMILLER R R. Vitamin E and oxidative stability during storage of raw and dry roasted peanuts packaged under air and vacuum [J]. J Food Sci, 2005, 70(4): 292 − 297. [24] ASHRAF M. Biotechnological approach of improving plant salt tolerance using antioxidants as markers [J]. Biotechnol Adv, 2009, 27(1): 84 − 93. [25] 刘慧琳, 陈晓默, 张瑛, 等. 多酚类化合物对饼干中羧甲基赖氨酸的抑制作用[J]. 中国食品学报, 2018, 18(1): 95 − 103. LIU Huilin, CHEN Xiaomo, ZHANG Ying, et al. Inhibitory effects of polyphenolic compounds on Nε-carboxymethyl-lysine in biscuits [J]. J Chin Inst Food Sci Technol, 2018, 18(1): 95 − 103. [26] 宫长荣, 王爱华, 王松峰. 烟叶烘烤过程中多酚类物质的变化及与化学成分的相关分析[J]. 中国农业科学, 2005, 38(11): 2316 − 2320. GONG Changrong, WANG Aihua, WANG Songfeng. Changes of polyphenols in tobacco leaves during the flue-curing process and relative analysis of some chemical components [J]. Sci Agric Sin, 2005, 38(11): 2316 − 2320. [27] DUDONNE S, VITRAC X, COUTIERE P. Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH, ABTS, FRAP, SOD, and ORAC assays [J]. J Agric Food Chem, 2009, 57(5): 1768 − 1774. [28] 常虹, 周家华, 张利燕, 等. 加工处理对板栗雄花序总黄酮抗氧化活性的影响[J]. 食品工业, 2014, 35(10): 120 − 123. CHANG Hong, ZHOU Jiahua, ZHANG Liyan, et al. Effects of processing methods on antioxidant activity of flavonoids from Chinese chestnut male inflorescence [J]. Food Ind, 2014, 35(10): 120 − 123. [29] VÁZQUEZ-ARAÚJO L, VERDÚ A, NAVARRO P, et al. Changes in volatile compounds and sensory quality during toasting of Spanish almonds [J]. Int J Food Sci Technol, 2009, 44(11): 2225 − 2233. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210304






 下载:
下载: