-
砷是人类Ⅰ级致癌物,为表土污染五大有害元素之一[1],对动植物具有强烈毒害作用。据报道,南亚和东南亚地区[2]是目前全球受砷毒害最为严重的地区之一。长期以来,由于自然环境与气候影响,以及采矿、含砷地下水灌溉等人类作业活动加剧了土壤中砷的过量积累[3]。特别是近年来,随着工农业生产的快速发展,环境质量不断下降,中国土壤尤其水稻田等耕地呈现砷污染区域和污染程度进一步扩大和恶化的态势,严重影响到农产品质量安全。水稻Oryza sativa对砷的吸收与富集能力显著大于小麦Triticum aestivum和玉米Zea mays等旱粮作物[4],这使得水稻砷污染已成为以稻米为主食人群砷暴露为害的主要途径之一。比如,在中国土壤砷污染严重的衡阳、湘潭等地,水稻籽粒中砷含量明显增高[5]。水稻对砷的吸收、积累和耐受性等存在显著的基因型差异[6-9]。NORTON等[10]发现,300多个供试水稻基因型中,其籽粒砷浓度相差3~34倍,遗传变异占总变异的40%~64%。另外发现,与耐砷基因型相比,砷敏感水稻往往在根部积累较少量的砷[11]。因此,若以不同砷耐性基因型为材料,研究植株对砷的积累、分布及耐受性等[12-13],可揭示水稻对砷耐性差异的内在生理与分子机制。miRNA是生物体内源产生的一种长度约20~24 nt的非编码小核糖核酸(RNA),它们通过序列互补配对的方式在转录后或翻译水平上调控靶基因的表达[14-15]。大量研究发现,miRNA在生物体应对外界环境因子胁迫中发挥着重要作用[15-18]。比如,水稻基因组中存在特异miRNA分别应答镉、过氧化氢、干旱和高温等逆境胁迫[16, 19-20]。砷作为重要的环境污染物之一,植物基因组亦编码特异miRNA来调控其对该胁迫因子的适应性。近年来,采用miRNA芯片技术,SRIVASTAVA等[17],PANDEY等[21]以及SHARMA等[22]分别从芥菜Brassica juncea和水稻幼苗中鉴定到69,46和280个亚砷酸盐或砷酸盐响应特异表达的miRNA。另外,采用新一代高通量测序结合定量逆转录聚合酶链式反应(RT-PCR)技术,YU等[23]以及LIU等[20]分别发掘出36和67个水稻亚砷酸盐响应相关的miRNA。但目前为止,鲜见有关miRNA在调控水稻砷胁迫应答中的生物学功能方面的研究报道。miR3979是LI等[19]在研究水稻对过氧化氢胁迫应答时鉴定到的一个新miRNA。随后,LIU等[20]研究发现,在亚砷酸盐胁迫下,miR3979在籼稻明恢86根系中被明显抑制表达。除此之外,再未见到有关该miRNA的研究报道。从miRBase数据库(Release 21)的注释可以看出,该miRNA可编码2个成熟序列,即miR3979-5p和miR3979-3p,但其生物学功能未知,尤其是该miRNA是否参与调控水稻对亚砷酸盐的应答反应等尚不清楚。基于此,我们获得了miR3979的过表达转基因水稻植株,拟在此基础上探讨miR3979与水稻砷耐性的关系,并试图揭示由其介导的水稻应答砷胁迫的初步生理机理。
-
本研究以粳稻品种中花11(野生型对照,WT),miR3979过表达转基因株系(As21-2和As21-3),中国普通野生稻以及籼稻品种93-11和明恢86为试材。首先分别挑选各供试材料饱满种子,用质量浓度为5 g·L-1次氯酸钠消毒15 min,然后用蒸馏水冲洗3~5次,最后在蒸馏水中浸泡过夜。将浸泡后的种子转移到铺有滤纸的发芽盒里,加入质量浓度为5.0 g·L-1氯化钙溶液催芽5~7 d。待幼苗长至约4 cm时,将其转移至含有营养液的盆钵中继续培养,期间每3 d更换1次营养液(配方如下:0.274 mmol·L-1硫酸镁,0.091 mmol·L-1硝酸钾,0.5 μmol·L-1氯化锰,0.100 mmol·L-1磷酸二氢钾,0.4 μmol·L-1硫酸锌,0.183 mmol·L-1硫酸铵,0.2 μmol·L-1硫酸铜,3.0 μmol·L-1硼酸,0.1 μmol·L-1钼酸铵,0.183 mmol·L-1硝酸钙,40.0 μmol·L-1乙二胺四乙酸铁(Ⅲ)钠[NaFe(Ⅲ)-EDTA],2.000 mmol·L-12-吗啉磺酸(MES),并用氢氧化钠将pH值调至pH 5.5)。整个过程都在培养箱中进行,条件为16 h光照/8 h黑暗。
实验采取随机区组设计。设对照和亚砷酸钠(As)胁迫2种处理,3次重复。待苗龄21 d时,将幼苗分别转移到3 L的小培养桶中,8株·桶-1,利用25.0 μmol·L-1亚砷酸钠进行胁迫处理。在处理的第3天和第6 天时分别对根系和叶片取样,鲜样保存在-80 ℃冰箱中备用,其余样品在烘箱中105 ℃杀青30 min,然后在75 ℃下处理48 h以充分干燥后使用。
-
利用正向引物5′-AAA GAG CTC AGT CAT TCC ACT CCA TGT GCT TTG-3′和反向引物5′-AAA GGA TCC TGT TGC TTA ACT CCA GTA GCC ATG-3′,从中花11基因组中扩增出约310 bp的包含miR3979前体序列的DNA片段。将PCR扩增产物经Sac Ⅰ和BamH Ⅰ双酶切后,连接至pCAMBIA1300载体上,然后分别采用热激法和电击法转化大肠埃希菌Escherichia coli和农杆菌Agrobacterium EHA105。最后,将目标基因经农杆菌介导侵染中花11愈伤组织,并经卡那霉素抗性筛选后获得转基因植株。采用十六烷基三甲基溴化铵(CTAB)法提取水稻基因组DNA。分别采用载体通用引物及miR3979基因特异引物进行聚合酶链式反应(PCR)扩增,筛选出阳性T2代转基因植株用于后续研究。PCR反应体系为:94 ℃预变性3 min,94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸80 s,30个循环,72 ℃总延伸10 min。
-
采用RNAiso for small RNA Kit(TaKaRa)提取水稻小RNA。参照PrimeScript miRNA RT-PCR Kit (TaKaRa)使用说明,以U6为内参,在Mastercycler ep realplex system(Eppendorf)上进行实时定量RT-PCR扩增。反应体系包括5.0 μL cDNA,5.0 μL引物(表 1),10.0 μL的2× SYBR混合物。PCR扩增条件为:先95 ℃预变性1 min,然后95 ℃变性15 s,60 ℃复性30 s,40个循环。重复3次·试验-1。采用2-△△CT法估测基因的相对表达量。
表 1 miR3979 实时定量 RT-PCR 的引物名称及序列
Table 1. Real-time RT-PCR primer sequences for miR3979-5p and miR3979-3p
引物名称 引物序列(5'→3') U6-F 5'-CGTGCTTGGGCGAGAGTAGTA-3' U6-R 5'-GGGATGCAACACAAGGACTTC-3' miR3979-5p-F 5'-GCCGTCTCTCTCTCCCTT-3' miR3979-5p-R 5'-GTGCAGGGTCCGAGGT-3' miR3979-5p Stem-loop primer 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGCCTTC-3' miR3979-3p-F 5'-GTCGCTTCGGGGGAGGAG-3' miR3979-3p-R 5'-GTGCAGGGTCCGAGGT-3' miR3979-3p Stem-loop primer 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGCTTCT-3' -
将砷胁迫后的幼苗放在解吸液中处理10 min后,将根系和茎干分别取样。待充分烘干后,用研磨机将样品研磨成粉末。取0.3 g样品,加入2.0 mL硝酸和0.5 mL过氧化氢,于120 ℃条件下硝化24 h。待冷却后,加入去离子水至20.0 mL。最后,采用电感耦合等离子体质谱仪(ICP-MS,Agilent 7500a)对样品中的总砷质量分数进行测定。水稻根系对砷的吸收能力是衡量各基因型对砷吸收能力的常用指标,常用根系和茎干中砷的总吸收量与根系干质量的比值表示。SAU=(Troot-As×Rbiomass+Tshoot-As×Sbiomass)/Rbiomass。在公式中,SAU表示水稻根系对砷的吸收能力。Troot-As和Tshoot-As分别代表根系和茎干中砷的总质量分数。/Rbiomass和Sbiomass分别代表根系和茎干的干质量。另外,采用转移速率(TF)来评估砷从根系转移到茎干的能力,用茎干与根系中砷的总质量分数比值来表示。
-
采用茚三酮染色法[24]测定处理6 d时各材料中游离脯氨酸质量浓度。使用分光光度计测定萃取液在520 nm处吸光值。使用10.0 mg·L-1的脯氨酸溶液制作标准曲线。
-
采用考马斯亮蓝染色法,对处理3和6 d时各材料根系和叶片中的可溶性蛋白质质量浓度进行测定。记录595 nm处吸光值。使用100 mg·L-1的牛血清蛋白制作标准曲线。
-
称取处理3和6 d的根系及叶片各0.2 g,与3.0 mL 50.00 mmol·L-1磷酸钠缓冲液(pH 7.8,包含0.20 mmol·L-1乙二胺四乙酸EDTA)和质量浓度2.0 g·L-1的聚乙烯砒咯烷酮(PVP)混合后,冰浴条件下研磨成匀浆。然后,在4 ℃下12 000 r·min-1离心20 min。取上清液以用于抗氧化酶活性的测定。超氧化物歧化酶(SOD),过氧化氢酶(CAT)以及过氧化物酶(POD)的活性测定分别参照GIANNOPOTITIS和RIES[25],CAKMAK和MARSCHNER[26]以及P?譈TTER[27]等方法。抗坏血酸过氧化物酶(APX)活性的测定则根据抗坏血酸的氧化率来进行估计[28]。
-
所有数据均为3次实验重复的平均值 ± 标准误。采用最小显著性差数法(LSD)对数据进行方差分析,在5%水平上分析不同指标间的差异显著水平(SPSS 19.0)。
-
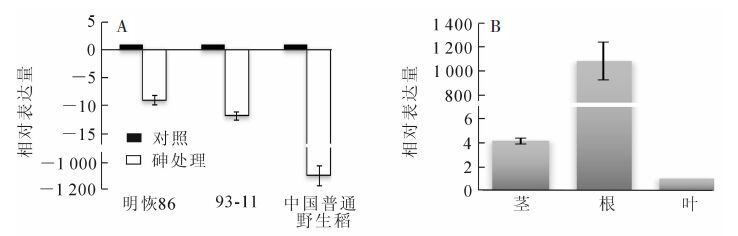
HU等[29]曾系统比较了3种不同基因型水稻对亚砷酸盐的耐受性,发现中国普通野生稻对亚砷酸盐的耐受性最强,其次为93-11和明恢86。为初步明确miR3979与水稻砷耐受性的关系,分析了它在上述3个不同砷耐性水稻基因型中的表达情况。结果发现:在亚砷酸盐处理后,miR3979在3个水稻基因型根部的表达均受到抑制,但受抑制程度明显不同(分别下降了8.89,11.66和1 198.36倍,图 1A),暗示随着水稻对亚砷酸盐耐受程度的增强,miR3979相对表达量呈现整体下降态势。此外,我们分析了miR3979在明恢86根系、茎干和叶片等不同组织中的表达模式发现,在受到亚砷酸盐胁迫后,miR3979在其根部高度富集,其表达丰度是茎干和叶片的254.63和1 057.84倍,而在茎部的相对表达量又显著高于叶片(4.15倍,图 1B)。这些结果表明:该miR3979在水稻应答亚砷酸盐胁迫过程中发挥着重要作用。
-
利用农杆菌介导法获得了miR3979过表达的转化中花11的转基因植株。采用 pCAMBIA1300载体通用引物对T2代转基因植株进行PCR检测(图 2)。对8个转基因株系的检测结果发现,400个过表达转基因植株中,352株为阳性,阳性率为88%。
-
采用miR3979特异引物,分析了miR3979-5p和-3p在各转基因株系中的表达情况。我们发现,在正常生长条件下,与野生型中花11相比,各转基因株系叶片中,miR3979-5p的表达水平都显著升高;miR3979-3p的表达水平也明显增加但增幅不及miR3979-5p(图 3)。值得注意的是,在株系As21-2和As21-3中,miR3979-5p和miR3979-3p的表达水平与中花11相比都呈现显著上调。基于此,我们选择这2个株系开展后续研究。
-
在正常田间试验条件下,各转基因株系(As21-2和As21-3)的21 d龄幼苗与中花11并无明显表型差异,但是在25.0 μ mol·L-1亚砷酸钠处理6 d时,转基因植株幼苗表现出典型的砷中毒症状,即大部分叶片卷曲、萎蔫、黄化,而中花11在砷胁迫下却无明显叶片卷曲等现象(图 4),表明miR3979被过表达后增加了水稻对亚砷酸盐的敏感程度。
-
从表 2可以看出:经亚砷酸盐处理后,各转基因株系(As21-2和As21-3)根系和茎干中砷的积累量显著高于中花11植株。与中花11相比,转基因植株根系中砷的积累量分别上升了403.0%和147.3%。如图 5所示,miR3979过表达株系对砷的吸收能力显著高于中花11。但转基因植株砷的转移速率与中花11相比有较大不同,其中As21-2向地上部分的转移速率低于中花11,而As21-3株系却显著高于中花11。这一现象需在其他转基因株系中进行验证。

图 5 中花11和转基因植株对砷的吸收能力(A)和转移速率(B)的比较
Figure 5. Specific arsenic uptake (SAU; A) and As translocation factor (TF; B) of Zhonghua 11 and transgenic rice plants
表 2 各供试植株根系和茎干中的总砷质量分数
Table 2. Comparison of total arsenic concentration in the root and stem of each tested rice genotypes
供试植株 总砷质量分数/(mg.kg-l) 根系 茎干 中花 11 170.04 ± 4.91 c 10.14 ± 0.29 c As21-2 685.56 ± 19.79 a 16.71 ± 0.48 b As21-3 250.58 ± 7.23 b 18.09 ± 0.52 a -
在亚砷酸盐胁迫下,转基因植株根系和叶片以及中花11对照叶片中的脯氨酸质量浓度显著增加(图 6A和图 6B),但中花11根系中的脯氨酸质量浓度却呈现下降趋势。在根系中,胁迫处理后转基因植株中的脯氨酸质量浓度上升趋势显著高于中花11植株,而在叶片中,各材料中的脯氨酸质量浓度也显著增加,但中花11植株中的质量浓度明显高于转基因植株(图 6B)。
-
在25.0 μmol·L-1亚砷酸盐处理下,各供试材料根系中的可溶性蛋白质质量浓度显著性下降(图 7A)。在处理第6 天时,转基因株系根系中可溶性蛋白质质量浓度显著显著高于中花11。在处理3和6 d时,各转基因植株叶片中的可溶性蛋白质质量浓度显著高于中花11植株。值得注意的是,在砷处理3 d时,转基因材料中叶片中的可溶性蛋白质质量浓度明显升高,而中花11植株中的质量浓度却显著性降低(图 7B)。
-
处理第3天时,中花11植株根系中的SOD活性显著增加,且其活性明显高于转基因植株;但在转基因植株中却呈现相反趋势。到处理第6天时,各材料中SOD的活性均显著性升高(图 8A)。在叶片中,砷处理的第3天,各材料中的SOD的活性均显著性下降,但中花11材料中的SOD活性明显高于转基因植株。至处理6天时,中花11中SOD活性显著性增强,而在转基因植株中的活性却显著性减弱。砷胁迫第3天时,各供试材料根系中POD活性显著性降低,且转基因材料中的POD活性明显高于中花11植株;处理了6 d后,中花11植株中的POD活性有升高趋势,而在转基因植株中的表现依旧显著降低,且明显低于中花11(图 8C)。在亚砷酸盐处理3 d时,各供试材料叶片中的POD活性显著性升高,随着处理时间的延长(第6天时),中花11和As21-3的POD活性依旧呈现升高趋势,但在As21-2中却开始降低。在砷胁迫下,各供试材料根系中APX酶的活性一直受到抑制。在处理第3天,转基因植株的APX的活性显著高于中花11植株,随着处理时间的延长,其间的差距逐渐减弱(图 8E)。在叶片中,转基因植株经砷处理后,APX的活性显著性增强,而中花11植株却受到强烈抑制。随着处理时间的延长,As21-2与中花11植株的APX的活性明显升高,而在As21-3中活性却受到抑制(图 8F)。另外,我们发现,在处理第3天时,各供试材料根系中的CAT活性显著升高,但随着处理时间的延长,其活性又被明显抑制,然而转基因材料中的CAT的活性却明显高于中花11植株(图 8G)。 在叶片中,砷胁迫后转基因材料中的CAT活性明显高于中花11植株(图 8H)。经砷处理3 d后,各供试材料中CAT活性均有所升高,处理6 d后,As21-3中的CAT的活性依旧显著升高,而其他材料中CAT活性却受到明显抑制。
-
如图 9所示:在亚砷酸盐处理的不同时间点(0,6和72 h),miR3979在各供试材料叶片中的表达模式存在一定差异:miR3979-5p在中花11中的表达量一直呈现下调趋势;而在2个过表达转基因株系中的表达量显著高于中花11,且在砷胁迫6 h时表达量最高,但随着处理时间的增加(72 h),其表达量开始下降,因而呈现出先上升后逐渐降低的表达趋势;而miR3979-3p的表达模式与miR3979-5p正好相反:在砷胁迫处理6 h时,其在中花11叶片中的表达量开始上调,随后表达受到明显抑制,而在转基因材料中一直处于被抑制状态(图 9)。
-
近年来,有关水稻对砷吸收、转运、积累及代谢相关重要功能基因的鉴定与作用机制研究等方面取得了重要进展[30],但有关水稻砷耐受性相关基因的鉴定及其应答砷胁迫分子机制等方面进展缓慢。目前,仅有少数蛋白编码基因被发现或与水稻的砷耐受性有关[31-32],而鲜见miRNA与水稻砷耐受性关联方面的研究报道。另外,虽然越来越多的证据表明,miRNA应参与了水稻对砷胁迫响应与应答过程[17, 20-23],但它们在调控水稻砷耐性方面的生物学功能尚有待深入研究。基于此,本研究采用过表达转基因策略初次证明,miR3979应在调控水稻砷耐性过程中起着重要作用,但是它究竟如何与其靶基因互作进而参与调节水稻植株对砷胁迫做出应答反应的机理等尚有待进一步深入探究。
尽管近几年多个研究组对水稻应答亚砷酸盐或砷酸盐相关miRNA进行了初步探索,但是经比较分析发现,各研究之间鉴定到的共有的差异表达miRNA的数量却相对较少[17, 20-23]。比如,LIU等[20]将miR3979鉴定为亚砷酸盐胁迫特异表达miRNA,但在其他研究中却未见报道[21-23]。经检索miRBase数据库[33]及序列同源性搜索发现,miR3979应为水稻特有的,它在水稻应答亚砷酸盐[20]和过氧化氢胁迫[19]过程中起作用。因此,各研究组的结果差异主要可归结为他们所采用的供试水稻基因型、砷胁迫供体(亚砷酸盐和砷酸盐)、胁迫处理时间以及所采用的研究策略(miRNA芯片[17, 21-22]和高通量测序[20, 23])等不同所致。尤其是,与miRNA芯片相比[34],高通量测序不仅可鉴定到表达丰度较低的miRNA,更可发掘出一些新的、砷胁迫特异应答相关的miRNA[20, 35]。这可为水稻抗逆育种提供新的靶基因资源。
研究发现:不同基因型水稻对砷的耐受性差异明显[8-9,29]。基于此,以耐砷和砷敏感基因型为试材,一些研究组对水稻砷耐性差异的内在机制进行了初步探索[11, 23, 36]。比如,TRIPATHI等[36]发现,与IET-4786(砷敏感)相比,耐砷品种‘Triguna’在砷胁迫下,一些胁迫响应氨基酸包括脯氨酸以及植物螯合肽和硫醇类物质的含量大幅增加。本研究发现:miR3979过表达转基因植株比野生型中花11对砷胁迫反应更敏感,但其根系和叶片中却积累了更多的脯氨酸,这与前人的报道[36]不一致。已知,脯氨酸是植物体内重要的渗透调节物质,它的积累有着对逆境适应的意义[37]。但是越来越多的证据表明,脯氨酸的积累仅仅是植物对逆境胁迫的一种生理响应,并无明显保护作用[38]。因此,miR3979过表达转基因植株脯氨酸含量显著升高或许是其应对砷胁迫的一种应激性反应。
与动物相比,植物更容易遭受外界逆境因子胁迫。因此,在进化过程中,植物衍生出通过调节miRNA及抗氧化酶系活性等机制以耐受或适应外界胁迫[39]。在本研究中,miR3979过表达转基因植株对砷的耐受性显著下降,但砷吸收与转移能力上升。这除了可能触发基因组中与水稻砷吸收、转运以及耐性相关基因[30-32]表达谱的改变外,极有可能引发了其他miRNA包括一些靶基因为SOD,APX或CAT酶的miRNA表达水平的变化。TRIPATHI等[36]发现:与砷敏感品种IET-4786相比,耐砷水稻Triguna在砷胁迫下其植株内SOD等抗氧化酶活性被明显上调,这与本研究的结论一致。miR3979被过表达后导致抗氧化酶活性显著降低,致使植株内产生严重过氧化胁迫而导致膜通透性增大并伴随大分子物质损失[36],进而造成了转基因植株对砷的耐受性改变。
miR3979-mediated arsenite tolerance in rice
-
摘要: miR3979可能参与水稻Oryza sativa应答亚砷酸盐和过氧化氢胁迫,但其具体的生物学功能未知。以miR3979过表达转基因株系(As21-2,As21-3)和野生型品种中花11为试材,系统研究了转基因植株对亚砷酸盐的耐受性表现及其初步生理机制。结果表明:与野生型相比,miR3979过表达转基因植株对亚砷酸盐更加敏感,其对砷的吸收与转移能力明显增强;转基因植株在砷胁迫下,其根部脯氨酸、可溶性蛋白质量浓度显著升高,但各抗氧化酶活性却受到明显抑制,miR3979在亚砷酸盐处理后的野生型和转基因植株叶片中的表达谱截然不同。这些结果可为进一步揭示由该基因介导的水稻对砷耐性改变的分子机制以及抗逆育种提供理论参考。Abstract: It was reported that miR3979 might be involved in the responses to arsenite and hydrogen peroxide stresses in rice, but its biological function remains unclear. In this study, using transgenic plants overexpressing miR3979 As21-2 and As21-3, and wild-type (WT) Zhonghua 11 as materials, we investigated its physiological functions in response to arsenite stress in rice. The results showed that, compared with WT, transgenic plants were more sensitive to arsenite, which has a greater arsenic absorption and translocation. Under arsenite stress, the proline and soluble protein contents were significantly increased, while the activity of most of the antioxidant enzymes SOD, POD, APX, and CAT was inhibited extensively in roots of transgenic plants. Furthermore, it was found that miR3979 exhibited distinct gene expression profiles in leaves of WT and transgenic plants after exposure to arsenite. These results may be very significative for further investigation the molecular mechanisms of miR3979-mediated arsenic tolerance in rice, and also providing some useful clues for rice stress resistance breeding.
-
Key words:
- crop genetic and breeding /
- miR3979 /
- rice /
- arsenite /
- transgenic /
- physiological mechanism
-
表 1 miR3979 实时定量 RT-PCR 的引物名称及序列
Table 1. Real-time RT-PCR primer sequences for miR3979-5p and miR3979-3p
引物名称 引物序列(5'→3') U6-F 5'-CGTGCTTGGGCGAGAGTAGTA-3' U6-R 5'-GGGATGCAACACAAGGACTTC-3' miR3979-5p-F 5'-GCCGTCTCTCTCTCCCTT-3' miR3979-5p-R 5'-GTGCAGGGTCCGAGGT-3' miR3979-5p Stem-loop primer 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGCCTTC-3' miR3979-3p-F 5'-GTCGCTTCGGGGGAGGAG-3' miR3979-3p-R 5'-GTGCAGGGTCCGAGGT-3' miR3979-3p Stem-loop primer 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGCTTCT-3' 表 2 各供试植株根系和茎干中的总砷质量分数
Table 2. Comparison of total arsenic concentration in the root and stem of each tested rice genotypes
供试植株 总砷质量分数/(mg.kg-l) 根系 茎干 中花 11 170.04 ± 4.91 c 10.14 ± 0.29 c As21-2 685.56 ± 19.79 a 16.71 ± 0.48 b As21-3 250.58 ± 7.23 b 18.09 ± 0.52 a -
[1] JOHNSON B L, DEROSA C T. Chemical mixtures released from hazardous waste sites:Implications for health risk assessment[J]. Toxicology, 1995, 105(2/3):145-156. [2] BRAMMER H, RAVENSCROFT P. Arsenic in groundwater:a threat to sustainable agriculture in South and South-East Asia[J]. Environ Int, 2009, 35(3):647-654. [3] ZHAO Fangjie, MA J F, MEHARG A A, et al. Arsenic uptake and metabolism in plants[J]. New Phytol, 2009, 181(4):777-794. [4] SU Yuhong, McGRATH S P, ZHAO Fangjie. Rice is more efficient in arsenite uptake and translocation than wheat and barley[J]. Plant Soil, 2010, 328(1):27-34. [5] 雷鸣, 曾敏, 王利红, 等. 湖南市场和污染区稻米中As, Pb, Cd污染及其健康风险评价[J]. 环境科学学报, 2010, 30(11):2314-2320. LEI Ming, ZENG Min, WANG Lihong, et al. Arsenic lead and cadimium pollution in rice from Hunan markets and contaminated areas and their health risk assessment[J]. Acta Sci Circumst, 2010, 30(11):2314-2320. [6] MEHARG A A, LOMBI E, WILLIAMS P N, et al. Speciation and localization of arsenic in white and brown rice grains[J]. Environ Sci Technol, 2008, 42(4):1051-1057. [7] LIANG Feng, LI Yulan, ZHANG Guilin, et al. Total and speciated arsenic levels in rice from China[J]. Food Addit Contam Part A Chem Anal Control Exp Risk Ass, 2010, 27(6):810-816. [8] 董飞, 卢瑛, 王兴祥, 等. 华南地区不同品系水稻积累砷特征及其影响因素[J]. 农业环境科学学报, 2011, 30(2):214-219. DONG Fei, LU Ying, WANG Xingxiang, et al. Characteristics of arsenic accumulation in different rice (Oryza sativa L.) cultivars and its influencing factors in southern China[J]. J Agro-enviroment Sci, 2011, 30(2):214-219. [9] 王林友, 竺朝娜, 王建军, 等. 水稻镉、铅、砷低含量基因型的筛选[J]. 浙江农业学报, 2012, 24(1):133-138. WANG Linyou, ZHU Channa, WANG Jianjun, et al. Screening for rice (Oryza sativa L.) genotyeps with Cd Pb and As contents[J]. Acta Agric Zhejiang, 2012, 24(1):133-138. [10] NORTON G J, PINSON S R M, ALEXANDER J, et al. Variation in grain arsenic assessed in a diverse panel of rice (Oryza sativa) grown in multiple sites[J]. New Phytol, 2012, 193(3):650-664. [11] RAI A, TRIPATHI P, DWIVEDI S, et al. Arsenic tolerances in rice (Oryza sativa) have a predominant role in transcriptional regulation of a set of genes including sulphur assimilation pathway and antioxidant system[J]. Chemosphere, 2011, 82(7):986-995. [12] TRIPATHI R D, SRIVASTAVA S, MISHRA S, et al. Arsenic hazards:strategies for tolerance and remediation by plants[J]. Trends Biotechnol, 2007, 25(4):158-165. [13] BHATTACHARYA P, WELCH A H, STOLLENWERK K G, et al. Arsenic in the environment:Biology and chemistry[J]. Sci Total Environ, 2007, 379(2/3):109-120. [14] IWAKAWA H O, TOMARI Y. Molecular insights into microRNA-mediated translational repression in plants[J]. Mol Cell, 2013, 52(4):591-601. [15] BARTEL D P. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297. [16] GUPTA O P, SHARMA P, GUPTA R K, et al. MicroRNA mediated regulation of metal toxicity in plants:present status and future perspectives[J]. Plant Mol Biol, 2014, 84(1/2):1-18. [17] SRIVASTAVA S, SRIVASTAVA A K, SUPRASANNA P, et al. Identification and profiling of arsenic stress-induced microRNAs in Brassica juncea[J]. J Exp Bot, 2013, 64(1):303-315. [18] CAMPO S, PERIS-PERIS C, SIRÉC, et al. Identification of a novel microRNA (miRNA) from rice that targets an alternatively spliced transcript of the Nramp6(Natural resistance-associated macrophage protein 6) gene involved in pathogen resistance[J]. New Phytol, 2013, 199(1):212-227. [19] LI Ting, LI Hui, ZHANG Yunxiao, et al. Identification and analysis of seven H2O2-responsive miRNAs and 32 new miRNAs in the seedlings of rice (Oryza sativa L. ssp. indica)[J]. Nucl Acid Res, 2011, 39(7):2821-2833. [20] LIU Q, ZHANG H. Molecular identification and analysis of arsenite stress-responsive miRNAs in rice[J]. J Agric Food Chem, 2012, 60(26):6524-6536. [21] PANDEY C, RAGHURAM B, SINHA A K, et al. miRNA plays a role in the antagonistic effect of selenium on arsenic stress in rice seedlings[J]. Met Int Biom Sci, 2015, 7(5):857-866. [22] SHARMA D, TIWARI M, LAKHWANI D, et al. Differential expression of microRNAs by arsenate and arsenite stress in natural accessions of rice[J]. Metallomics, 2015, 7(1):174-187. [23] YU Lujun, LUO Yingfeng, LIAO Bin, et al. Comparative transcriptome analysis of transporters, phytohormone and lipid metabolism pathways in response to arsenic stress in rice (Oryza sativa)[J]. New Phytol, 2012, 195(1):97-112. [24] 张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸含量的方法[J]. 植物生理学通讯, 1990(4):62-65. ZHANG Dianzhong, WANG Peihong, ZHAO Huixian. Determination of the content of free proline in wheat leaves[J]. Plant Physiol Commu, 1990(4):62-65. [25] GIANNOPOTITIS C N, RIES S K. Superoxide dismutase (Ⅰ) occurrence in higher plants[J]. Plant Physiol, 1977, 59(2):309-314. [26] CAKMAK I, MARSCHNER H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiol, 1992, 98(4):1222-1227. [27] PÜTTER J. Peroxidases[G]//BERGRNEYER H U. Methods of Enzymatic Analysis. New York:Academic Press, 1974:685-690. [28] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1981, 22(5):867-880. [29] HU Haicao, ZHANG Junting, WANG Hong, et al. Effect of silicate supplementation on the alleviation of arsenite toxicity in 93-11(Oryza sativa L. indica)[J]. Environ Sci Pollut Res, 2013, 20(12):8579-8589. [30] KUMAR S, DUBEY R S, TRIPATHI R D, et al. Omics and biotechnology of arsenic stress and detoxification in plants:current updates and prospective[J]. Environ Int, 2015, 74(74):221-230. [31] MOSA K A, KUMAR K, CHHIKARA S, et al. Members of rice plasma membrane intrinsic proteins subfamily are involved in arsenite permeability and tolerance in plants[J]. Transgenic Res, 2012, 21(6):1265-1277. [32] TIWARI M, SHARMA D, DWIVEDI S, et al. Expression in Arabidopsis and cellular localization reveal involvement of rice NRAMP, OsNRAMP1, in arsenic transport and tolerance[J]. Plant Cell Environ, 2014, 37(1):140-152. [33] KOZOMARA A, GRIFFITHS-JONES S. miRBase:annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acid Res, 2014, 42:D68-D73. [34] GIT A, DVINGE H, SALMON-DIVON M, et al. Systematic comparison of microarray profiling, real-time PCR, and next-generation sequencing technologies for measuring differential microRNA expression[J]. RNA, 2010, 16(5):991-1006. [35] LIU Qingpo. Noverl miRNAs in the control of arsenite levels in rice[J]. Funct Integr Genom, 2012, 12(4):649-658. [36] TRIPATHI P, TRIPATHI R D, SINGH R P, et al. Arsenite tolerance in rice (Oryza sativa L.) involves coordinated role of metabolic pathways of thiols and amino acids[J]. Environ Sci Pollut Res, 2013, 20(2):884-896. [37] 彭志红, 彭克勤, 胡家金, 等. 渗透胁迫下植物脯氨酸积累的研究进展[J]. 中国农学通报, 2002, 18(4):80-83. PENG Zhihong, PENG Keqin, HU Jiajin, et al. Research progress on accumulation of proline under osmotic stress in plants[J]. Chin Agric Sci Bull, 2002, 18(4):80-83. [38] LIU Jiping, ZHU Jiankang. Proline accumulation and salt-stress-induced gene expression in a salt-hypersensitive mutant of Arabidopsis[J]. Plant Physiol, 1997, 114(2):591-596. [39] SRIVASTAVA M, MA L Q, RATHINASABAPATHI B, et al. Effects of selenium on arsenic uptake in arsenic hyperaccumulator Pteris vittata L.[J]. Bioresour Technol, 2009, 100(3):1115-1121. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2016.04.004







 下载:
下载: