-
无性繁殖和克隆可塑性作为克隆植物特有的生活史性状[1],存在资源与能量的权衡制约[2-3]。生物量分配贯穿于克隆植物的整个生活史,并直观表达植物的生态对策,克隆表型及构件的生物量分配可对环境资源条件的变化做出可塑性响应,促使植物采取相应的适应策略以利用有限的资源,使生长与繁殖获得高度协调[4]。因此,克隆植物表型及生物量分配变化可反映植株在不同资源水平的生态适应性、生长与繁殖及资源储存策略。植物克隆性主要体现在多种类型的营养繁殖习性中,克隆分株的输出数量直接表征克隆繁殖能力的大小,而地下芽库的动态也与此密切相关[5]。研究发现:克隆植物地上器官的生产力和种群的更新主要依赖地下芽库[6],如芦苇Phragmites australis分株均由根茎芽萌发形成,根茎芽对分株的贡献率达100%[7]。光强和氮素是植物生长发育的重要限制因子,一定程度上影响植物的自然分布[8-10]。同时,植物亦会采取不同的策略适应光照和氮素的变化,其中,形态生长指标和生物量分配格局的改变是生态适应策略之一。如杉木Cunninghamia lanceolata幼苗通过形态可塑性适应不同光环境,提高生存适合度[11];而披针叶茴香Illicium lanceolatum分配较多的生物量于枝条和树干,以应对光强的降低[12];草珊瑚Sarcandra glabra通过改变营养器官的形态特征,依靠调节生物量的积累及分配来适应光强及氮素的变化[13]。芒萁Dicranopteris dichotoma生活史世代中以孢子体占绝对优势地位,借助根状茎完成克隆繁殖[14-15]。作为亚热带低山丘陵区退化植被的标志种之一,芒萁能够适应从暖性针叶群落下层遮光生境到次生裸地、从植被退化后土壤资源剩余到资源流失等多种生境,在马尾松Pinus massoniana、杉木等单优群落下层及杜鹃Rhododendron simsii灌草丛下层形成单优草本层片[16-17]。本研究在不同光照和氮素水平下,分析了芒萁克隆繁殖及各构件生物量分配的影响,以期为解释芒萁单优层片形成机制提供依据。
-
在浙江省杭州市临安区青山湖国家森林公园玲珑山景区(30°13′05″N,119°40′23″E),选取芒萁克隆分株为材料。采用盆栽法(以下盆栽芒萁简称芒萁),选择带芽且长势基本一致的芒萁克隆分株苗1株,保留10 cm左右的根状茎,移栽至40 cm×21 cm×17 cm的塑料盆内。栽植基质为马尾松单优群落下层表土,并置于2层遮光棚内缓苗1个月。
-
试验设置3个遮光棚,分别覆盖3层(L3)、2层(L2)、1层(L1)黑色尼龙遮阳网。选择3个晴天,每隔2 h,利用光量子仪测定光量子通量密度,每个点测定30个数据,最后计算与无遮阳网相比的透光率分别为4.75%(L3)、13.00%(L2)和35.96%(L1)。将盆栽苗随机分成6组,每组10盆,分别置于3个遮光棚内,每棚2组,对2组进行施氮(N1)和不施氮(N0)处理。施氮量依据彭扬等[18]对草本植物的研究确定。每盆施0.6 g纯氮,将3 g硫酸铵[(NH4)2SO4]分析纯溶解于200 mL纯水中,均匀喷入盆内土壤表面,未施氮处理组喷入等量的纯水。
-
当芒萁克隆分株几乎不再出土时,利用标尺测定各处理组分株植株高度、羽叶长和羽叶宽。记录克隆分株数量,克隆分株的辨别标准为株高至少距地面10 cm,羽叶完全展开不卷曲。将芒萁整盆倒出,用水洗净并记录根状茎的芽数,以得到芽库的大小数据。分别称取羽叶、茎、根状茎及细根的质量,细根的判别标准为除根状茎以外的所有不定根。然后放入烘箱105 ℃杀青30 min,80 ℃烘干至恒量,分别测定其干质量。每个处理重复测定5次。
各器官含水量为:含水量=(鲜质量−干质量)/鲜质量×100%;生物量分配比为:各器官生物量分配比=某器官生物量干质量/总生物量干质量×100%
-
所有数据利用Excel 2010、SPSS 19.0进行处理,使用Origin Pro 8.0制图。采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较各处理(L1N0、L1N1、L2N0、L2N1、L3N0、L3N1)在显著性水平0.05下的差异性,采用双因素方差分析检验光照、氮素及其交互作用在显著性水平0.001、0.01和0.05水平对繁殖特性、分株形态生长指标及生物量分配影响的显著性。
-
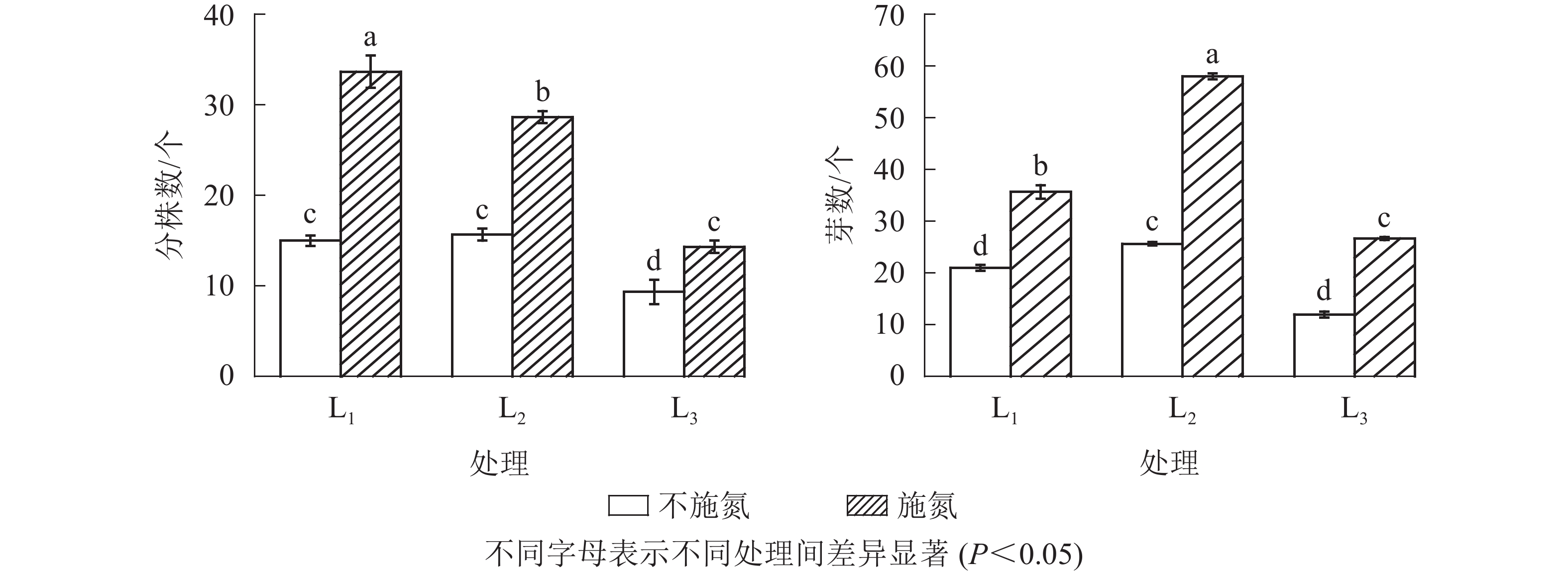
图1显示:随遮光程度增加,N0水平下克隆分株数在L1与L2处理间无显著差异(P>0.05),但显著高于L3处理(P<0.05),说明强度遮光降低芒萁克隆分株数量。N1与N0相比,各遮光处理下克隆分株数均显著增加(P<0.05),分别增加了124.7%(L1)、82.8%(L2)和53.8%(L3),3个遮光处理的克隆分株数从大到小依次为L1、L2、L3,且3个遮光处理间差异显著(P<0.05)。
无论施氮与否,根状茎芽数均在L2处理出现最大值,芽数由大到小依次为L2、L1、L3。N0水平下,根状茎芽数在L1与L3处理间差异不显著(P>0.05);N1水平下的根状茎芽数显著高于N0(P<0.05)。
-
由图2可知:分株株高随遮光程度增加呈不断增加的趋势,其中L1和L3处理下N1显著高于N0(P<0.05),L2处理下2种氮素水平之间差异不显著(P>0.05)。
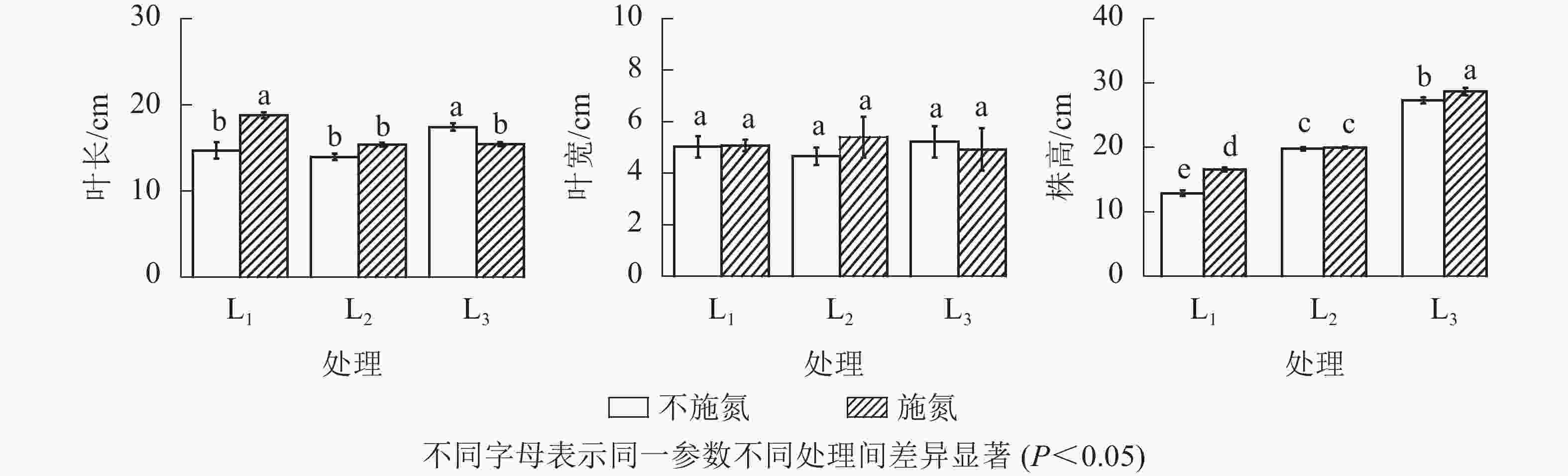
图 2 不同处理下芒萁克隆分株高度、叶长及叶宽
Figure 2. Height, leaf length and leaf width of the cloned ramets under different treatments
在N0水平下,分株羽叶长在L1与L2处理间无显著差异(P>0.05),L3呈显著增大(P<0.05)的变化特征。N1水平下,分株羽叶长表现为L1显著高于L2和L3(P<0.05),且L2与L3的羽叶长几乎接近。N1与N0相比,L1分株羽叶长显著增加(P<0.05),L3显著减小(P<0.05),而L2无显著性变化(P>0.05)。就芒萁克隆分株羽叶宽变化而言,同一遮光处理下N0与N1处理无显著差异(P>0.05)。因此,芒萁克隆分株叶片形态对光照和氮素的响应,主要表现在羽叶长度的变化。
-
从表1可见:N0水平下,分株羽叶、茎、根状茎和细根以及地上部分与地下部分的鲜质量生物量均在L2出现最大值,且显著高于L1和L3(P<0.05),L1、L2和L3的根状茎鲜质量间均差异显著(P<0.05)。在L1和L2处理下,分株鲜质量生物量分配于细根、根状茎、茎、羽叶的大小顺序表现为先升后降再上升的变化,分别在根状茎和羽叶出现最大值。L3则表现为不断增加,在羽叶出现最大值。3种遮光处理下地上部分与地下部分鲜质量生物量之比从大到小依次为L3、L2、L1,比值大小分别为2.66±0.11、1.36±0.06、0.94±0.05,且差异显著(P<0.05),说明随着遮光程度的增加,芒萁将更多的能量或光合产物投资地上部分,其中对羽叶的投资显著高于茎,遮光程度较低时,芒萁将更多的能量或光合产物积累于地下部分,特别是地下根状茎。
表 1 不同处理下芒萁植株各器官鲜质量
Table 1. Fresh weight of each organ of D. dichotoma under different treatments
氮素 光照 羽叶/g 茎/g 根状茎/g 细根/g 地上部分鲜质量/g 地下部分鲜质量/g 地上鲜质量/地下鲜质量 N0 L1 7.47±0.62 d 2.36±0.09 c 8.58±0.12 d 1.85±0.09 d 9.84±0.69 cd 10.43±0.22 d 0.94±0.05 d L2 17.03±1.26 c 3.41±0.09 b 11.97±0.28 b 3.03±0.02 c 20.45±1.29 b 15.00±0.30 b 1.36±0.06 c L3 6.86±0.46 d 2.42±0.12 c 2.06±0.05 f 1.41±0.03 e 9.28±0.56 d 3.47±0.07 f 2.66±0.11 a N1 L1 19.58±0.71 b 5.03±0.23 a 14.47±0.15 a 9.58±0.28 a 24.61±0.56 a 24.04±0.36 a 1.03±0.03 d L2 21.86±0.88 a 3.73±0.23 b 10.54±0.18 e 3.68±0.11 b 25.59±1.07 a 14.22±0.10 c 1.80±0.09 b L3 8.80±0.25 d 3.37±0.10 b 7.38±0.20 e 1.48±0.02 de 12.17±0.21 c 8.86±0.23 e 1.38±0.06 c 说明:同列不同字母表示同一器官不同处理间差异显著(P<0.05) N1水平下,芒萁地上部分鲜质量生物量显著增大(P<0.05),地下部分鲜质量生物量除L2显著降低外(P<0.05),其余均显著增加(P<0.05),L2地下部分鲜质量生物量的降低主要在于根状茎鲜质量生物量的降低。随着遮光程度的增大,细根、根状茎、茎、羽叶生物量的变化均表现为先升后降再上升的规律,且均在羽叶出现最大值。
由表2可知:在N0水平下,除茎生物量干质量L3超过L1和L2外,羽叶、根状茎和细根以及地上部分与地下部分的生物量干质量以L2最大,地上部分超过地下部分。在N1水平下,羽叶、茎、根状茎和细根以及地上部分与地下部分的生物量干质量从大到小依次为L1、L2、L3,且不同处理间差异显著(P<0.05),L1和L2的地上部分与地下部分比值显著增加(P<0.05),L3降低但差异不显著(P>0.05)。无论施氮与否,芒萁植株各器官生物量干质量分配格局基本与鲜质量一致,即地上生物量超过地下生物量,其中地上部分以羽叶生物量高于茎,地下部分以根状茎高于细根。
表 2 不同处理下芒萁植株各器官干质量
Table 2. Dry weight of each organ of D. dichotoma under different treatments
氮素 光照 羽叶/g 茎/g 根状茎/g 细根/g 地上部分干质量/g 地下部分干质量/g 地上干质量/地下干质量 N0 L1 3.53±0.05 d 1.25±0.00 d 3.04±0.00 d 1.08±0.03 e 4.78±0.05 d 4.12±0.02 c 1.16±0.01 d L2 6.77±0.35 c 1.60±0.06 c 4.33±0.15 b 1.53±0.06 c 8.37±0.29 c 5.85±0.10 b 1.43±0.06 c L3 5.95±0.39 c 2.01±0.06 b 1.91±0.11 e 1.11±0.05 e 7.97±0.45 c 3.03±0.07 d 2.63±0.11 a N1 L1 12.82±0.22 a 3.11±0.10 a 5.09±0.05 a 2.70±0.04 a 15.93±0.20 a 7.80±0.04 a 2.04±0.02 b L2 9.33±0.42 b 2.04±0.04 b 3.96±0.14 c 1.84±0.07 b 11.37±0.42 b 5.80±0.17 b 1.97±0.09 b L3 6.54±0.15 c 1.59±0.04 c 1.92±0.04 e 1.28±0.02 d 8.13±0.12 c 3.20±0.05 d 2.54±0.07 a 说明:同列不同字母表示同一器官不同处理间差异显著(P<0.05) -
表3表明:光照、氮素以及交互作用对芒萁鲜质量和干质量生物量分配均产生显著影响。光照除对茎鲜质量的影响达到显著外(P<0.05),其余器官均达到极显著水平(P<0.01)。光照和光照×氮素对分株数有显著影响(P<0.05),对株高具有极显著影响(P<0.001);氮素对分株数和株高无显著影响(P>0.05);芽库大小均受光照、氮素及其交互作用的极显著影响(P<0.001);光照、氮素及其交互作用对分株羽叶的长与宽均未达到显著程度(P>0.05)。
表 3 光强和氮素对芒萁各测定参数的F值和显著性分析
Table 3. F-value and significance analysis of light intensity and nitrogen level on each parameter of D. dichotoma
参数 光照 氮素 光照×氮素 分株数 5.5* 0.7 4.3* 芽数 513.0*** 1267.6*** 104.0*** 株高 53.1*** 2.2 38.2*** 叶长 1.0 0.8 1.8 叶宽 0.0 0.1 0.4 羽叶鲜质量 37.7*** 35.5*** 7.1*** 茎鲜质量 5.5* 37.2*** 10.2** 根状茎鲜质量 316.8*** 173.7*** 87.8*** 细根鲜质量 197.4*** 257.7*** 195.9*** 地上部分鲜质量 37.7*** 46.1*** 9.4** 地下部分鲜质量 434.4*** 362.4*** 168.5*** 羽叶干质量 17.1*** 103.2*** 38.0*** 茎干质量 33.0*** 60.8*** 68.7*** 根状茎干质量 115.1*** 18.9** 30.2*** 细根干质量 46.6*** 106.7*** 47.8*** 地上部分干质量 26.9*** 138.2*** 61.1*** 地下部分干质量 223.4*** 103.2*** 90.0*** 说明:*P<0.05;**P<0.01;***P<0.001 -
由表4可知:不同光照和氮素处理下芒萁各器官含水量不同。N0水平时,地上部羽叶和茎含水量均在L2最大,L3最小,且显著小于L1和L2(P<0.05);地下部分根状茎和细根同样表现为L3显著低于L1、L2(P<0.05)。N1与N0相比,地上部分器官含水量除L3显著升高外(P<0.05),其余均有所降低;根状茎含水量表现为L1、L2变化不显著(P>0.05),L3显著升高(P<0.05);细根含水量表现为L2无显著变化,L1显著升高(P<0.05),L3显著降低(P<0.05)。
表 4 不同处理下芒萁各器官含水量
Table 4. Moisture content of each organ of D. dichotoma under different treatments
氮素 光照 羽叶含水量/% 茎含水量/% 根状茎含水量/% 细根含水量/% N0 L1 51.58±0.04 b 47.01±0.02 ab 64.49±0.01 b 41.24±0.03 c L2 60.00±0.01 a 52.39±0.03 a 63.74±0.02 b 49.59±0.02 b L3 13.08±0.03 e 16.30±0.02 d 7.33±0.04 c 20.89±0.04 d N1 L1 34.35±0.01 c 37.55±0.03 c 64.76±0.01 b 71.61±0.01 a L2 57.35±0.00 ab 44.58±0.03 bc 62.46±0.01 b 49.98±0.02 b L3 25.53±0.01 d 52.82±0.02 a 73.89±0.01 a 13.54±0.00 e 说明:同列不同字母表示同一器官不同处理间差异显著(P<0.05) 由表5可知:N0水平时,L3处理的羽叶和茎干生物量分配比例显著高于L1、L2处理(P<0.05),但根状茎和细根干生物量分配比例显著低于L1、L2(P<0.05)。
表 5 不同处理下芒萁各器官生物量分配比例
Table 5. Biomass distribution ratio of each organ of D. dichotoma under different treatments
氮素 光照 羽叶分配比例/% 茎分配比例/% 根状茎分配比例/% 细根分配比例/% N0 L1 39.69±0.00 dA 14.00±0.00 bC 34.20±0.00 aB 12.12±0.00 aD L2 47.48±0.02 cA 11.29±0.01 cC 30.44±0.01 bB 10.79±0.01 abC L3 54.00±0.01 bA 18.37±0.00 aB 17.36±0.00 dB 10.31±0.01 cC N1 L1 54.00±0.00 bA 13.13±0.00 bC 21.47±0.00 cB 11.40±0.00 abD L2 54.27±0.01 bA 11.92±0.00 cC 23.12±0.01 cB 10.70±0.00 abC L3 57.71±0.01 aA 14.01±0.00 bC 17.00±0.00 dB 11.30±0.00 abD 说明:不同小写字母表示各器官干生物量分配比例在不同处理间差异显著(P<0.05);不同大写字母表示同一处理下各器官干生物量 分配比例差异显著(P<0.05) N1与N0相比,各遮光处理下羽叶生物量分配比例显著增加;茎生物量分配比例除L3显著降低外(P<0.05),其余均变化不显著(P>0.05);L1、L2处理下根状茎生物量分配比例显著降低(P<0.05),细根无显著变化(P>0.05),L3根状茎生物量分配比例无显著变化(P>0.05),细根显著升高(P<0.05)。同一处理下,各器官的生物量干质量分配比例均表现为羽叶显著高于根状茎(P<0.05),根状茎显著高于茎和细根(P<0.05)。
-
资源异质性是生物生境普遍存在的基本属性[19]。异质生境中,克隆植物能够主动搜寻生长所需的资源,通过表型可塑性、调节生物量分配格局,缓解局部资源匮乏带来的压力并加速逃避不利生境,实现在异质生境中扩散定居的目的[20]。作为克隆植物特有的等级结构,克隆分株的数量能够直观呈现克隆植物的克隆繁殖能力[21],而克隆分株来源于克隆器官上的芽库,芽库的动态决定了克隆植物的潜在克隆性[22]。本研究中,光照及光照×氮素对芒萁克隆分株有显著影响(P<0.05),氮素对克隆分株无显著影响,光照、氮素及光照×氮素对根状茎芽数均有极显著影响(P<0.001)。说明光照是影响芒萁克隆分株输出的主要因素,无论是光照还是氮素,还是两者的复合因素均会对芽库动态产生影响,具体表现为L3处理的克隆分株输出量显著小于L1、L2(P<0.05),施氮显著提高各遮光处理的分株数(P<0.05),但增加比例随遮光程度增加而减小,分株数总体表现为随遮光程度的增加而显著降低(P<0.05)。表明强度遮光(L3)中光资源不足,在一定程度上抑制了克隆分株的输出和地下芽库的水平。
氮素输入在一定程度上提高分株数和芽库水平,但氮素对分株输出的提高同样受光资源的影响,即强度遮光下输出显著降低,对芽库水平的提高也只在适宜光照环境(L2)下获得显著效应。有研究发现:土壤氮素能够扩充芽库,促使分蘖节芽优先形成子株[23-24]。本研究结果也支持该结论。大量研究发现:光照不足条件下,植物可通过向上生长增加株高并扩大叶面积,来捕获更多的太阳辐射能,增强对光资源的竞争能力[25-27]。本研究中,芒萁株高、羽叶长随遮光程度的增加显著增加(P<0.05),这种形态变化也体现了芒萁适应弱光的生态策略。
-
植物体内含水量与植物生理生化作用能力密切相关。本研究中,同一氮素水平下,L2处理下的芒萁羽叶含水量均显著高于其他处理(P<0.05),说明L2处理下芒萁的光合生理代谢最旺盛,最有利于植物光合产物的合成;L3处理下的细根含水量显著低于其他处理(P<0.05),说明L3处理下芒萁对土壤水分的吸收能力都不及L1和L2。施氮处理导致L3处理下的芒萁羽叶代谢增强,根系吸水能力下降,同时根状茎的代谢增强,说明L3处理下,施氮有利于芒萁根状茎的生长以实现将克隆分株放置最优资源环境的可能。
-
生物量分配格局是植物适应环境的一种生存策略,是对生长、繁殖和维持等功能间进行资源分配的权衡,也反映了植物在生长过程中对环境的响应规律及能量分配策略[28-29]。根据最优分配理论(optimal partitioning theory,OPT),自然环境中,由于地上和地下资源空间上的分离,陆生植物需要调整地上和地下部分的生物量分配以平衡对资源的吸收[30-31],而克隆植物可借助其特殊的等级构件和地下储藏器官,完成养分传输和营养物质的储存,协调资源在时间上分布的不均匀性[32]。
针对芒萁各器官的分配比例,在光资源、养分充足的生境和光资源、养分贫乏的生境中,首先芒萁都倾向于将能量分配于羽叶片,其次是根状茎。这可能是芒萁将能量优先分配羽叶,以便合成更多的碳水化合物,最大限度地覆盖地表,有利于形成单优草本层片;其次将能量用于根状茎的分配,以占据有利生境和搜索土壤养分、水分资源,最终提高芒萁克隆分株在异质生境的生态适合度。与L1、L2处理相比,芒萁在L3处理下,更优先将能量分配给羽叶,而对根状茎的投资显著低于L1、L2(P<0.05)。
分析地上与地下生物量之比可知:地上生物量的投资随遮光程度的增大而增加。一般认为,弱光下克隆植物将生物量优先分配于地上部分,利于摄取更多的光资源[33-35]。本研究结果也符合前人研究的结论,但未表现出克隆植物的趋富专化特征[36]。有研究发现:根状茎类克隆植物七瓣莲Trientail europaea根茎生物量分配随土壤氮的增加而增加[37],而对扁秆荆三棱Bolboschoenus planiculmis的研究发现:根茎分配对养分并未发生可塑性反应[38]。本研究则发现:施氮反而造成芒萁根状茎生物量分配的降低,可能是氮素含量梯度设置不利于芒萁根状茎提高储藏功能,具体何种含量有利芒萁将能量投资根状茎的生长有待进一步探索。
-
综上所述,得出以下结论:①光照是影响芒萁克隆分株输出的主要因素,L2处理下分株输出和芽库最大;光照和氮素均对芽库动态有显著性影响,施氮对根状茎芽数有显著促进作用;②芒萁能够通过增加株高适应弱光环境,施氮一定程度有利于增加株高;③无论是光资源和养分充足生境还是光资源和养分贫乏生境,芒萁羽叶为光合产物优先分配中心,根状茎属于次优先分配中心。羽叶光合产物的积累有利于芒萁快速覆盖地表,根状茎生物量的积累有利于根状茎芽的形成和觅食行为的表达,对芒萁拓殖新的生境有一定促进作用。
Effects of light and nitrogen on clonal reproduction characteristics and biomass allocation of Dicranopteris dichotoma
-
摘要:
目的 研究不同光照和施氮水平对芒萁Dicranopteris dichotoma克隆繁殖特性和生物量分配的影响,旨在为芒萁单优层片发育过程提供理论依据。 方法 采用盆栽控制试验,设置3种光照[透光率35.96%(L1)、13.00%(L2)和4.75%(L3)]和2种氮素水平[施氮(N1)和不施氮(N0)],比较分析光照和氮素对芒萁克隆繁殖特性及生物量分配的影响。 结果 ①在2种氮素水平下,L2处理的根状茎芽数出现最大值,L3处理的克隆分株数显著低于L1和L2(P<0.05)。施氮显著提高了各遮光下克隆分株数和芽数(P<0.05),分别增加了124.7%(L1)、82.8%(L2)、53.8%(L3)和70.0%(L1)、125.7%(L2)、122.5%(L3)。②在2种氮素水平下,克隆分株株高随遮光程度增加显著增加(P<0.05),L3处理的羽叶长显著高于L1和L2(P<0.05),叶宽无显著差异(P>0.05)。施氮水平下,L1和L3处理的克隆分株株高显著增加(P<0.05),L1处理的羽叶长显著增加(P<0.05),L3处理的羽叶长显著降低(P<0.05),L2处理的株高和叶长增加均不显著(P>0.05)。③在2种氮素水平下,L3处理的克隆分株地上与地下生物量(干质量)比、生物量羽叶分配比例显著高于L1和L2处理(P<0.05),根状茎分配比例显著低于L1和L2(P<0.05),各遮光处理芒萁克隆分株生物量羽叶分配比例显著高于根状茎(P<0.05),根状茎显著高于茎和细根(P<0.05)。 结论 L2处理更有利于芒萁克隆分株的形成,施氮有利于芒萁克隆繁殖能力的增强;L3处理的克隆分株可通过增加株高、叶长以及生物量叶分配比例适应弱光生境;无论何种光强资源及氮素水平,芒萁均优先保证羽叶的生长,其次保证根状茎生长。图2表5参38 Abstract:Objective To study the effect of different light and nitrogen application on the clonal propagation characteristics and biomass distribution of Dicranopteris dichotoma, aiming to provide a theoretical basis for the development of monolayers of D. dichotoma. Method Three light intensities[light transmittance 35.96%(L1), 13.00%(L2) and 4.75% (L3)], and two nitrogen levels[nitrogen application (N1) and no nitrogen application(N0)]were set up in pot experiments. The effects of light intensity and nitrogen on clonal reproduction characteristics and biomass allocation were analyzed. Result (1) Under the two nitrogen levels, the number of rhizome buds in L2 treatment was the highest. The number of clonal ramets of L3 treatment was significantly lower than that of L1 and L2 (P<0.05). Nitrogen application significantly increased the number of clonal ramets and buds of D. dichotoma under different shading conditions (P<0.05), with an increase rate of 124.7%(L1), 82.8%(L2) and 53.8%(L3) and 70.0%(L1), 125.7%(L2), 122.5%(L3), respectively. (2) Under the two nitrogen levels, the height of clonal ramets increased significantly (P<0.05) with the increase of shading degree, and the length of leaves in L3 shading condition was significantly higher than that in L1 and L2 (P<0.05), but there was no significant difference in leaf width (P>0.05). Under nitrogen application level, the clonal ramet height of L1 and L3 treatments increased significantly (P<0.05), the leaf length in the L1 treatment increased significantly (P<0.05), and the leaf length in L3 treatment decreased significantly (P<0.05). Both plant height and leaf length in L2 treatment did not increase significantly (P>0.05). (3) Under the two nitrogen levels, the aboveground and underground biomass (dry weight) ratio and biomass allocation ratio of clonal ramets in L3 treatment were significantly higher than those in L1 and L2 shading treatments (P<0.05). The rhizome distribution ratio was significantly lower than that of L1 and L2 (P<0.05). The percentage of biomass and leaf allocation of each shading treatment was significantly higher than that of rhizomes (P<0.05), and rhizomes were significantly higher than stems and fine roots (P<0.05). Conclusion L2 treatment is more conducive to the formation of clonal ramets, and nitrogen application is conducive to the enhancement of clonal reproduction capacity. Clonal ramets of L3 treatment can adapt to low-light habitat by increasing plant height, leaf length and biomass leaf allocation ratio. Regardless of the light intensity and nitrogen level, D. dichotoma gives priority to ensuring the growth of feather leaves, followed by rhizomes. [Ch, 2 fig. 5 tab. 38 ref.] -
Key words:
- botany /
- Dicranopteris dichotoma /
- clonal reproduction /
- biomass /
- illumination /
- nitrogen /
- feather leaf /
- rhizome
-
表 1 不同处理下芒萁植株各器官鲜质量
Table 1. Fresh weight of each organ of D. dichotoma under different treatments
氮素 光照 羽叶/g 茎/g 根状茎/g 细根/g 地上部分鲜质量/g 地下部分鲜质量/g 地上鲜质量/地下鲜质量 N0 L1 7.47±0.62 d 2.36±0.09 c 8.58±0.12 d 1.85±0.09 d 9.84±0.69 cd 10.43±0.22 d 0.94±0.05 d L2 17.03±1.26 c 3.41±0.09 b 11.97±0.28 b 3.03±0.02 c 20.45±1.29 b 15.00±0.30 b 1.36±0.06 c L3 6.86±0.46 d 2.42±0.12 c 2.06±0.05 f 1.41±0.03 e 9.28±0.56 d 3.47±0.07 f 2.66±0.11 a N1 L1 19.58±0.71 b 5.03±0.23 a 14.47±0.15 a 9.58±0.28 a 24.61±0.56 a 24.04±0.36 a 1.03±0.03 d L2 21.86±0.88 a 3.73±0.23 b 10.54±0.18 e 3.68±0.11 b 25.59±1.07 a 14.22±0.10 c 1.80±0.09 b L3 8.80±0.25 d 3.37±0.10 b 7.38±0.20 e 1.48±0.02 de 12.17±0.21 c 8.86±0.23 e 1.38±0.06 c 说明:同列不同字母表示同一器官不同处理间差异显著(P<0.05) 表 2 不同处理下芒萁植株各器官干质量
Table 2. Dry weight of each organ of D. dichotoma under different treatments
氮素 光照 羽叶/g 茎/g 根状茎/g 细根/g 地上部分干质量/g 地下部分干质量/g 地上干质量/地下干质量 N0 L1 3.53±0.05 d 1.25±0.00 d 3.04±0.00 d 1.08±0.03 e 4.78±0.05 d 4.12±0.02 c 1.16±0.01 d L2 6.77±0.35 c 1.60±0.06 c 4.33±0.15 b 1.53±0.06 c 8.37±0.29 c 5.85±0.10 b 1.43±0.06 c L3 5.95±0.39 c 2.01±0.06 b 1.91±0.11 e 1.11±0.05 e 7.97±0.45 c 3.03±0.07 d 2.63±0.11 a N1 L1 12.82±0.22 a 3.11±0.10 a 5.09±0.05 a 2.70±0.04 a 15.93±0.20 a 7.80±0.04 a 2.04±0.02 b L2 9.33±0.42 b 2.04±0.04 b 3.96±0.14 c 1.84±0.07 b 11.37±0.42 b 5.80±0.17 b 1.97±0.09 b L3 6.54±0.15 c 1.59±0.04 c 1.92±0.04 e 1.28±0.02 d 8.13±0.12 c 3.20±0.05 d 2.54±0.07 a 说明:同列不同字母表示同一器官不同处理间差异显著(P<0.05) 表 3 光强和氮素对芒萁各测定参数的F值和显著性分析
Table 3. F-value and significance analysis of light intensity and nitrogen level on each parameter of D. dichotoma
参数 光照 氮素 光照×氮素 分株数 5.5* 0.7 4.3* 芽数 513.0*** 1267.6*** 104.0*** 株高 53.1*** 2.2 38.2*** 叶长 1.0 0.8 1.8 叶宽 0.0 0.1 0.4 羽叶鲜质量 37.7*** 35.5*** 7.1*** 茎鲜质量 5.5* 37.2*** 10.2** 根状茎鲜质量 316.8*** 173.7*** 87.8*** 细根鲜质量 197.4*** 257.7*** 195.9*** 地上部分鲜质量 37.7*** 46.1*** 9.4** 地下部分鲜质量 434.4*** 362.4*** 168.5*** 羽叶干质量 17.1*** 103.2*** 38.0*** 茎干质量 33.0*** 60.8*** 68.7*** 根状茎干质量 115.1*** 18.9** 30.2*** 细根干质量 46.6*** 106.7*** 47.8*** 地上部分干质量 26.9*** 138.2*** 61.1*** 地下部分干质量 223.4*** 103.2*** 90.0*** 说明:*P<0.05;**P<0.01;***P<0.001 表 4 不同处理下芒萁各器官含水量
Table 4. Moisture content of each organ of D. dichotoma under different treatments
氮素 光照 羽叶含水量/% 茎含水量/% 根状茎含水量/% 细根含水量/% N0 L1 51.58±0.04 b 47.01±0.02 ab 64.49±0.01 b 41.24±0.03 c L2 60.00±0.01 a 52.39±0.03 a 63.74±0.02 b 49.59±0.02 b L3 13.08±0.03 e 16.30±0.02 d 7.33±0.04 c 20.89±0.04 d N1 L1 34.35±0.01 c 37.55±0.03 c 64.76±0.01 b 71.61±0.01 a L2 57.35±0.00 ab 44.58±0.03 bc 62.46±0.01 b 49.98±0.02 b L3 25.53±0.01 d 52.82±0.02 a 73.89±0.01 a 13.54±0.00 e 说明:同列不同字母表示同一器官不同处理间差异显著(P<0.05) 表 5 不同处理下芒萁各器官生物量分配比例
Table 5. Biomass distribution ratio of each organ of D. dichotoma under different treatments
氮素 光照 羽叶分配比例/% 茎分配比例/% 根状茎分配比例/% 细根分配比例/% N0 L1 39.69±0.00 dA 14.00±0.00 bC 34.20±0.00 aB 12.12±0.00 aD L2 47.48±0.02 cA 11.29±0.01 cC 30.44±0.01 bB 10.79±0.01 abC L3 54.00±0.01 bA 18.37±0.00 aB 17.36±0.00 dB 10.31±0.01 cC N1 L1 54.00±0.00 bA 13.13±0.00 bC 21.47±0.00 cB 11.40±0.00 abD L2 54.27±0.01 bA 11.92±0.00 cC 23.12±0.01 cB 10.70±0.00 abC L3 57.71±0.01 aA 14.01±0.00 bC 17.00±0.00 dB 11.30±0.00 abD 说明:不同小写字母表示各器官干生物量分配比例在不同处理间差异显著(P<0.05);不同大写字母表示同一处理下各器官干生物量 分配比例差异显著(P<0.05) -
[1] 董鸣, 于飞海, 陈玉福, 等. 克隆植物生态学[M]. 北京: 科学出版社, 2011: 5 − 34. [2] 乌仁, 秦小静, 孙健. 放牧对藏北高寒草地优势种和伴生种生物量分配的影响[J]. 草地学报, 2018, 26(6): 1313 − 1321. WU Ren, QIN Xiaojing, SUN Jian. Effect of grazing on biomass allocation of dominant species and associated species in the Alpine Grassland, Northern Tibet [J]. Acta Agrestia Sin, 2018, 26(6): 1313 − 1321. [3] 古勇波, 潘艳文, 陈方圆, 等. 水位和氮浓度对三江藨草幼苗生长和生物量分配的影响[J]. 生态学杂志, 2019, 38(8): 2302 − 2309. GU Yongbo, PAN Yanwen, CHEN Fangyuan, et al. Effects of water level and nitrogen concentration on growth and biomass allocation of Scirpus nipponicus seedlings [J]. Chin J Ecol, 2019, 38(8): 2302 − 2309. [4] CLARIDGE K, FRANKLIN S B. Compensation and plasticity in an invasive plant species [J]. Biol Invasions, 2002, 4(4): 339 − 347. [5] MENEY K, DIXON K, PETE J. Reproductive potential of obligate seeder and resprouter herbaceous perennial monocats (Restionaceae, Anarthriaceae, Ecdeiocoleaceae) from South-western Western Australia [J]. Aust J Bot, 1997, 45(5): 771 − 782. [6] BENSON E J, HARTENTT D C, MANN K H. Belowground bud banks and meristem limitation in tallgrass prairie plant population [J]. Am J Bot, 2004, 91(3): 416 − 421. [7] 焦德志, 闫秋月, 姜秋旭, 等. 黑龙江扎龙湿地芦苇种群构建数量特征及其相关性[J]. 生态学杂志, 2018, 37(7): 1983 − 1989. JIAO Dezhi, YAN Qiuyue, JIANG Qiuxu, et al. The quantitative characteristics and interrelation of module of Phragmites australis popolation in Zhalong Wetland in Heilongjiang [J]. Chin J Ecol, 2018, 37(7): 1983 − 1989. [8] 安慧, 上官周平. 光照强度和氮水平对白三叶幼苗生长与光合生理特性的影响[J]. 生态学报, 2009, 29(11): 6017 − 6024. AN Hui, SHANGGUAN Zhouping. Effects of light intensity and nitrogen application on the growth and photosynthetic characteristics of Trifolium repens L. [J]. Acta Ecol Sin, 2009, 29(11): 6017 − 6024. [9] 宋创业, 刘高焕, 刘庆生, 等. 黄河三角洲植物群落分布格局及其影响因素[J]. 生态学杂志, 2008, 27(12): 2042 − 2048. SONG Chuangye, LIU Gaohuan, LIU Qingsheng, et al. Distribution patterns of plant communities in the Yellow River Delta and related affecting factors [J]. Chin J Ecol, 2008, 27(12): 2042 − 2048. [10] ALERIC K M, KIRKMAN L K. Growth and photosynthetic responses of the federally endangered shurb, Lindera melissifolia (Lauraceae), to varied light environments [J]. Am J Bot, 2005, 92(4): 682 − 689. [11] 刘青青, 马祥庆, 黄智军, 等. 光强对杉木幼苗形态特征和叶片非结构性碳含量的影响[J]. 生态学报, 2019, 39(12): 4455 − 4462. LIU Qingqing, MA Xiangqing, HUANG Zhijun, et al. Effects of light intensity on the morphology characteristics and leaf non-structural carbohydrate content of Chinese fir seedlings [J]. Acta Ecol Sin, 2019, 39(12): 4455 − 4462. [12] 成向荣, 邢文黎, 苑海静, 等. 披针叶茴香对变化光环境的表型可塑性[J]. 生态学报, 2019, 39(6): 1935 − 1944. CHENG Xiangrong, XING Wenli, YUAN Haijing, et al. Phenotypic plasticity of Illicium lanceolatum in response to varied light environments [J]. Acta Ecol Sin, 2019, 39(6): 1935 − 1944. [13] 李盛婷, 杨城, 王冉, 等. 草珊瑚植株表型对光照和氮素营养的响应[J]. 植物营养与肥料学报, 2019, 25(8): 1441 − 1450. LI Shengting, YANG Cheng, WANG Ran, et al. Plant phenotype response of Sarcandra glabra to light intensity and nitrogen nutrition supply [J]. J Plant Nutr Fert, 2019, 25(8): 1441 − 1450. [14] 王佳佳, 张明如, 许焱, 等. 光强和氮素对芒萁光响应及叶绿素荧光参数的影响[J]. 浙江农林大学学报, 2019, 36(6): 1199 − 1207. WANG Jiajia, ZHANG Mingru, XU Yan, et al. Light response and chlorophyⅡ fluorescence parameters in Dicranopteris dichotoma with light intensity and nitrogen treatments [J]. J Zhejiang A&F Univ, 2019, 36(6): 1199 − 1207. [15] 张明如, 何明, 温国胜, 等. 芒萁种群特征及其对森林更新影响评述[J]. 内蒙古农业大学学报, 2010, 31(4): 303 − 308. ZHANG Mingru, HE Ming, WEN Guosheng, et al. The characteristics of Dicranopteris dichotoma popolation and its effects on the forest regeneration [J]. J Inn Mong Agric Univ, 2010, 31(4): 303 − 308. [16] 张明如, 翟明普, 王学勇. 太行山低山丘陵区植被恢复构建的生态对策和途径[J]. 中国水土保持科学, 2006, 4(2): 75 − 81. ZHANG Mingru, ZHAI Mingpu, WANG Xueyong. Ecological strategies and aproaches of vegetation restoration in the hilly area of Taihang Mountain [J]. Sci Soil Water Conserv, 2006, 4(2): 75 − 81. [17] 王佳佳, 张明如, 高磊, 等. 遮荫和氮素添加对芒萁光合特性与抗氧化酶活性的影响[J]. 西南林业大学学报(自然科学), 2019, 39(6): 24 − 32. WANG Jiajia, ZHANG Mingru, GAO Lei, et al. Effects of light intensity gradient and nitrogen addition on photosynthetic characteristics and antioxidant enzyme activities of Dicranopteris dichotoma [J]. J Southwest For Univ Nat Sci, 2019, 39(6): 24 − 32. [18] 彭扬, 彭培好, 李景吉. 模拟氮沉降对矢车菊属植物Centaurea stoebe种群生长和竞争能力的影响[J]. 植物生态学报, 2016, 40(7): 679 − 685. PENG Yang, PENG Peihao, LI Jingji. Simulated nitrogen deposition influences the growth and competitive ability of Centaurea stoebe populations [J]. Chin J Plant Ecol, 2016, 40(7): 679 − 685. [19] HUTCHING M J, JOHN E A. The effects of environmental heterogeneity on root growth and root/shoot partitioning [J]. Ann Bot, 2004, 94(1): 1 − 8. [20] 向运蓉, 张芳, 段静, 等. 异质性水分环境中克隆整合对活血丹生物量分配及叶片结构特征的影响[J]. 植物研究, 2019, 39(2): 200 − 207. XIANG Yunrong, ZHANG Fang, DUAN Jing, et al. Effects of clonal integration on biomass allocation and leaf structure of Glechoma longituba (Nakai) Kupr in different water availability [J]. Bull Bot Res, 2019, 39(2): 200 − 207. [21] 董鸣, 于飞海, 安树青, 等. 植物克隆性的生态学意义[J]. 植物生态学报, 2007, 31(4): 549 − 551. DONG Ming, YU Feihai, AN Shuqing, et al. Ecological significance of plant clonality [J]. Chin J Plant Ecol, 2007, 31(4): 549 − 551. [22] 李卓琳, 穆春生, 吴春英. 气候变化对草原多年生克隆植物无性繁殖的影响[J]. 草业科学, 2017, 34(8): 1694 − 1704. LI Zhuolin, MU Chunsheng, WU Chunying. Review of the effects of climate change on the propagation of perennial clonal plants [J]. Pratacultural Sci, 2017, 34(8): 1694 − 1704. [23] BAI Wenming, SUN Xiaoqin, WANG Zhengwen, et al. Nitrogen addition and rhizome severing modify clonal growth and reproductive modes of Leymus chinensis population [J]. Plant Ecol, 2009, 205: 13 − 21. [24] 杨允菲, 张宝田. 松嫩平原羊草种群营养繁殖的季节动态及其生物量与密度关系的分析[J]. 植物学报, 1992, 34(6): 443 − 449. YANG Yunfei, ZHANG Baotian. An analysis of seasonal variation of vegetative propagation and the relationships between biomass and population density of Aneurolepidium chinense in Songnen Plain of China [J]. Acta Bot Sin, 1992, 34(6): 443 − 449. [25] 周海燕, 王金牛, 付秀琴, 等. 不同光环境对中国南方草地3种灌木表型可塑性的影响[J]. 应用与环境生物学报, 2014, 20(6): 962 − 970. ZHOU Haiyan, WANG Jinniu, FU Xiuqin, et al. Effeces of light environments on the phenotypic plasticity of three shrubs in southern China grassland [J]. Chin J Appl Environ Biol, 2014, 20(6): 962 − 970. [26] 殷东生, 沈海龙. 森林植物耐荫性及其形态和生理适应性研究进展[J]. 应用生态学报, 2016, 27(8): 2687 − 2698. YIN Dongsheng, SHEN Hailong. Shade tolerance and the adaptability of forest plants in morphology and physiology: a review [J]. Chin J Appl Ecol, 2016, 27(8): 2687 − 2698. [27] 刘从, 田甜, 李珊, 等. 中国木本植物幼苗生长对光照强度的响应[J]. 生态学报, 2018, 38(2): 518 − 527. LIU Cong, TIAN Tian, LI Shan, et al. Growth response of Chinese woody plant seedlings to different light intensities [J]. Acta Ecol Sin, 2018, 38(2): 518 − 527. [28] 黄慧敏, 董蓉, 钱凤, 等. 紫耳箭竹克隆形态可塑性对典型冠层结构及光环境的响应[J]. 生态学报, 2018, 38(19): 6835 − 6845. HUANG Huimin, DONG Rong, QIAN Feng, et al. Response of clonal morphological plasticity of Fargesia decurvata to different forest canopy structures and light conditions [J]. Acta Ecol Sin, 2018, 38(19): 6835 − 6845. [29] 吴志庄, 杨志和, 厉月桥, 等. 木本能源植物黄连木苗期生物量分配规律与构成因素分析[J]. 西北林学院学报, 2015, 30(6): 28 − 32. WU Zhizhuang, YANG Zhihe, LI Yueqiao, et al. Comprehensive analysis on the distribution pattern and constituent factors affecting seedling biomass of woody energy plant Pistacia chinensis [J]. J Northwest For Univ, 2015, 30(6): 28 − 32. [30] 王满堂, 赵全科, 程栋梁. 黄帚橐吾基株克隆生长对不同光照的响应[J]. 草业科学, 2018, 35(2): 357 − 362. WANG Mantang, ZHAO Quanke, CHENG Dongliang. Response on the clonal growth of Ligularia virgaurea genets to light intensity [J]. Pratacultural Sci, 2018, 35(2): 357 − 362. [31] 王杨, 徐文婷, 熊高明, 等. 檵木生物量分配特征[J]. 植物生态学报, 2017, 41(1): 105 − 114. WANG Yang, XU Wenting, XIONG Gaoming, et al. Biomess allocation patterns of Loropetalum chinense [J]. Chin J Plant Ecol, 2017, 41(1): 105 − 114. [32] 郭海霞, 徐波, 石福孙, 等. 遮光和施氮对暗紫贝母形态特征和生物量分配的影响[J]. 植物资源和环境学报, 2016, 25(3): 118 − 120. GUO Haixia, XU Bo, SHI Fusun, et al. Effects of shading and applying nitrogen on morphological characteristics and biomass allocation of Fritillaria unibracteata [J]. J Plant Resour Environ, 2016, 25(3): 118 − 120. [33] 樊星, 蔡捡, 刘金平, 等. 局部遮光对鹅绒委陵菜基株形态可塑性及生物量配置的影响[J]. 草业学报, 2016, 25(3): 172 − 180. FAN Xing, CAI Jian, LIU Jinping, et al. Effect of partial shading on the morphological plasticity and biomass allocation of Potentilla anserina [J]. Acta Prataculturae Sin, 2016, 25(3): 172 − 180. [34] DONG Ming. Morphological responses to local light conditions in clonal herbs from contrasting habitats, and their modification due to physiological integration [J]. Oecologia, 1995, 101(3): 282 − 288. [35] 徐波, 王金牛, 石福孙, 等. 青藏高原东缘野生暗紫贝母生物量分配格局对高山生态环境的适应[J]. 植物生态学报, 2013, 37(3): 187 − 196. XU Bo, WANG Jinniu, SHI Fusun, et al. Adaptation of biomass allocation patterns of wild Fritillaria unibracteata to alpine environment in the eastern Qinghai-Xizang Plateau [J]. Chin J Plant Ecol, 2013, 37(3): 187 − 196. [36] 王浩, 李德志, 程立丽, 等. 光资源强度变化对结缕草植株克隆生长特征的影响[J]. 生态科学, 2014, 33(4): 664 − 671. WANG Hao, LI Dezhi, CHENG Lili, et al. Effects of light intensity variation on the clonal growth characteristics of Zoysia japonica [J]. Ecol Sci, 2014, 33(4): 664 − 671. [37] DONG M, DURING H J, WERGER M J A. Clonal plasticity in response to nutrient availability in the pseudoannual herb, Trientalis europaea L. [J]. Plant Ecol, 1997, 131(2): 233 − 239. [38] 王沫竹, 董必成, 李红丽, 等. 根茎型植物扁秆荆三棱对光照强度和养分水平的生长响应及资源分配策略[J]. 生态学报, 2016, 36(24): 8091 − 8101. WANG Mozhu, DONG Bicheng, LI Hongli, et al. Growth and bilmass allocation responses to light intensity and nutrient availability in the rhizomatous herb Bolboschoenus planiculmis [J]. Acta Ecol Sin, 2016, 36(24): 8091 − 8101. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200199






 下载:
下载: