-
汶川地震引发了成千上万的山体滑坡。滑坡导致土壤流失和植被破坏,影响生物多样性和生态系统服务功能[1];滑坡体形成后极易再次发生地质灾害,造成区域内植被恢复困难[2-3]。植被恢复是震后灾区重建的重要组成部分[4],能够对区域内土壤质量、植物群落的空间分布格局和生物多样性等产生影响[5-8]。恢复过程中土壤条件和植物群落相互影响,相互促进,存在较好的耦合效应[9],运用数学方法可定量分析植被恢复过程中群落植物分布格局与环境因子的关系[10-13]。本研究以四川省北川县擂鼓镇凤凰山震后滑坡迹地的植物群落为研究对象,对比2013和2019年滑坡区、过渡区和未滑坡区的植物群落结构以及植物多样性,并用典范对应分析(CCA)排序法探讨植物群落组成与环境因子之间的关系,以期为滑坡迹地的植被恢复工作提供参考。
-
研究区位于四川盆地西北部北川羌族自治县擂鼓镇凤凰山(31°14′~32°14′N,103°44′~104°42′E),属北亚热带湿润季风气候,多年平均气温为15.6 ℃,平均降水量为1 399 mm,主要集中在6—9月,占全年降水量的71%~76%。擂鼓镇全境皆山,土壤质地以砾石为主,土壤类型主要为黄壤土、黄棕壤、暗棕壤等,地质条件差,水文条件复杂,山体岩石破碎。植被主要有常绿阔叶林、常绿落叶混交林、针阔叶混交林、高山和亚高山草甸,各类森林面积约1.5×105 hm2,其中天然林1.1×105 hm2,人工林4.0×104 hm2,森林覆盖率为76%。滑坡迹地(31°46′24″N,104°25′24″E)位于擂鼓镇凤凰山,滑坡体平面形态呈不规则“撮箕”形,主滑方向南偏西44°,体积1.08×107 m3,为特大整体滑移型滑坡体。滑坡体顺滑动方向整体呈上陡、中缓、下陡的形态,可分为两阶滑移平台。堆积体属强风化灰岩和白云质灰岩的风化块体,土壤类型为砾质石灰土。
-
设置滑坡区、过渡区和未滑坡区。滑坡区为2008年震后形成的滑坡迹地,地表裸露;过渡区为滑坡区与未滑坡区的扭曲地带,有少量滑坡,原地貌受到了一定程度上的破坏;未滑坡区受地震影响较小,植被保持原状,郁闭度较高。3个区域在未滑坡前均为柏木Cupressus funebris次生林,郁闭度相似,均处于整片林分较为中间的位置。样地情况如表1。每个区域各设置3个20 m×20 m乔木样方(共计9个),每个乔木样方内选取具有代表性的6个5 m×5 m灌木样方(共计54个)和12个1 m×1 m草本样方(共计108个)。2013年7月和2019年10月,记录乔木样方中胸径(BDH)≥3 cm的乔木个体物种名、数量、株高及冠幅,灌木及草本样方记录物种名、株数或丛数、株高及盖度,计算物种重要值及每个区域的多样性指数[14]。采集土壤样品时,去除表面覆盖物,用土铲取表层20 cm×20 cm×10 cm的原状土,带回实验室。待风干后,剔除残根、砾石等杂质待测。土壤理化性质的测定依据森林土壤分析方法[15]进行。
表 1 样地基本情况
Table 1. General condition of the sample plots
样地 海拔/m 坡度/(°) 坡向/(°) 备注 滑坡区 735~762 32~38 北偏西24~30 2011年采用宾格护坡,并按2 m×4 m的株行距栽植刺槐Robinia pseudoacacia幼苗 过渡区 723~757 32~38 北偏西21~27 自然恢复,沟蚀明显,主要为灌草植被 未滑坡区 732~764 30~38 北偏西22~29 柏木次生林,植被保持原状,郁闭度90%以上 -
研究区水文气象条件差异较小,故选择与植被分布、生长紧密相关的环境因子(pH、养分指标及团聚体指标)矩阵与物种重要值矩阵进行CCA排序分析,各样地土壤环境因子情况如表2。采用SPSS 20.0对数据进行单因素方差分析并进行最小显著差异法(LSD)检验,采用Origin 9.5绘图,采用Canoco 4.5进行排序分析及排序图的绘制。
表 2 滑坡迹地土壤环境因子情况
Table 2. Soil environmental factors in landslide site
年份 区域 有机碳/(g·kg−1) 全氮/(g·kg−1) 全磷/(g·kg−1) 全钾/(g·kg−1) pH 碱解氮/(mg·kg−1) 2013 滑坡区 28.212 b 0.884 d 0.314 de 0.232 cd 8.197 a 52.232 b 过渡区 40.752 b 1.728 c 0.235 e 0.331 b 8.147 a 119.577 b 未滑坡区 45.813 b 1.919 c 0.352 d 0.430 a 8.033 a 118.408 b 2019 滑坡区 38.936 b 2.913 b 0.566 c 0.202 d 8.043 a 129.531 b 过渡区 33.572 b 2.333 bc 0.689 b 0.202 d 7.977 a 138.130 b 未滑坡区 97.188 a 4.382 a 0.914 a 0.267 c 7.953 a 350.595 a 年份 区域 有效磷/
(mg·kg−1)速效钾/
(mg·kg−1)风干性团聚体
分形维数水稳性团聚体
分形维数风干性团聚体
平均几何直径/mm水稳性团聚体
平均几何直径/mm2013 滑坡区 0.496 c 166.695 b 2.278 a 2.665 a 1.456 d 0.849 e 过渡区 0.693 c 126.246 bc 2.225 ab 2.626 a 1.570 c 0.803 e 未滑坡区 3.288 b 238.029 a 2.209 ab 2.519 b 1.624 c 0.974 d 2019 滑坡区 0.920 c 137.305 bc 1.981 c 2.488 b 1.961 b 1.291 c 过渡区 1.450 c 108.980 c 2.142 b 2.496 b 1.972 b 1.397 b 未滑坡区 4.561 a 151.193 bc 1.971 c 2.394 c 2.092 a 1.571 a 年份 区域 风干性团聚体
平均质量直径/mm水稳性团聚体
平均质量直径/mm团聚体破坏
率/%不稳定团粒
系数/%2013 滑坡区 3.764 d 1.764 e 16.297 a 21.853 a 过渡区 4.127 cd 1.433 d 12.718 b 17.138 b 未滑坡区 4.458 c 1.958 d 8.823 c 12.803 c 2019 滑坡区 5.659 b 3.390 c 13.101 b 14.680 c 过渡区 5.969 ab 3.831 b 11.291 b 14.032 c 未滑坡区 6.262 a 4.404 a 9.016 c 10.350 d 说明:不同小写字母表示不同样地间差异显著(P<0.05) -
2013年植被调查中,滑坡区共记录到植物7科39属41种,过渡区25科45属50种,未滑坡区37科69属77种;2019年植被调查中,滑坡区共记录到植物41科77属92种,过渡区49科78属90种,未滑坡区56科86属96种。
如表3所示:2013—2019年,滑坡区和过渡区的乔木、灌木和草本层植物的科属种数量均有增加,未滑坡区乔木层的科属种数和草本层的属、种数有所减少,灌木层科属种数和草本层的科数量有所增加。
表 3 滑坡迹地植物群落物种组成变化情况
Table 3. Changes in species composition of plant communities in landslide sites
植被层 区域 科 属 种 2013年 2019年 2013年 2019年 2013年 2019年 乔木层 滑坡区 0 5 0 6 0 6 过渡区 4 7 4 7 4 7 未滑坡区 8 5 9 6 9 6 灌木层 滑坡区 6 21 6 31 6 35 过渡区 7 27 8 33 8 35 未滑坡区 16 28 20 37 23 42 草本层 滑坡区 18 23 32 47 34 55 过渡区 25 26 39 42 45 48 未滑坡区 28 31 46 44 50 49 -
如表4所示:2013—2019年,滑坡迹地3个区域的优势乔木、灌木和草本植物的重要值变化情况不同。乔木层2013年滑坡区、2019年滑坡区和过渡区重要值第1位均为刺槐,未滑坡区则均为柏木。灌木层滑坡区和过渡区的第1位均从2013年的刺槐变成了西南绣球Hydrangea davidii,未滑坡区从柏木变为铁仔Myrsine africana,但柏木的重要值有所增加。草本层滑坡区和过渡区茅叶荩草Arthraxon prionodes的重要值均有所下降,细叶薹草Carex duriuscula subsp. stenophylloides在3个区域均为优势草本植物,此外,3个区域优势草本植物中菊科Asteraceae和禾本科Poaceae植物所占比例也都有所下降。
表 4 滑坡迹地优势植物重要值
Table 4. The important values of the dominant plants in landslide sites
植被层 滑坡区 过渡区 未滑坡区 2013年 2019年 2013年 2019年 2013年 2019年 物种 重要值 物种 重要值 物种 重要值 物种 重要值 物种 重要值 物种 重要值 乔木层 刺槐 0.484 8 刺槐 0.424 6 刺槐 0.269 5 柏木 0.645 8 柏木 0.649 5 柏木 0.229 8 漆树 0.314 2 柏木 0.204 0 桤木 0.113 2 杜仲 0.094 6 南酸枣 0.158 7 醉鱼草 0.198 4 枫杨 0.188 9 香椿 0.104 7 榆树 0.072 2 灌木层 刺槐 0.382 2 西南绣球 0.236 4 刺槐 0.349 6 西南绣球 0.218 5 柏木 0.160 2 铁仔 0.182 1 马桑 0.230 7 地果 0.175 7 雀儿舌头 0.183 9 卵果蔷薇 0.111 7 铁仔 0.157 6 柏木 0.164 8 漆树 0.140 0 火棘 0.124 5 插田泡 0.148 8 豪猪刺 0.106 8 刺槐 0.111 1 雀儿舌头 0.076 2 醉鱼草 0.129 1 马桑 0.060 7 构树 0.099 2 地果 0.077 4 卵果蔷薇 0.096 0 枫杨 0.071 3 草本层 小蓬草 0.222 3 茅叶荩草 0.158 9 茅叶荩草 0.2829 细叶薹草 0.189 3 卷柏 0.261 1 细叶薹草 0.312 6 茅叶荩草 0.164 0 细叶薹草 0.102 5 野棉花 0.109 1 茅叶荩草 0.122 7 野棉花 0.087 3 卷柏 0.105 6 鬼针草 0.088 0 打破碗花花 0.094 0 千里光 0.054 3 打破碗花花 0.075 8 粗齿冷水花 0.056 3 斑茅 0.055 7 千里光 0.061 9 冷水花 0.054 5 艾 0.052 8 老鹳草 0.051 0 白茅 0.051 7 打破碗花花 0.039 5 香薷 0.060 0 白茅 0.052 4 野菊 0.046 9 斑茅 0.050 7 艾 0.050 3 冷水花 0.037 2 说明:马桑Coriaria nepalensis;漆树Toxicodendron vernicifluum;醉鱼草Buddleja lindleyana;小蓬草Erigeron canadensis;鬼针草
Bidens pilosa;千里光Senecio scandens;香薷Elsholtzia ciliata;南酸枣Choerospondias axillaris;地果Ficus tikoua;火棘
Pyracantha fortuneana;打破碗花花Anemone hupehensis;冷水花Paederia foetida;白茅Imperata cylindrica;雀儿舌头Leptopus
chinensis;插田泡Rubus coreanus;构树Broussonetia papyrifera;野棉花Anemone vitifolia;艾Artemisia argyi;野菊
Chrysanthemum indicum;枫杨Pterocarya stenoptera;卵果蔷薇Rosa helenae;豪猪刺Berberis julianae;老鹳草Geranium
wilfordii;斑茅Saccharun arundinaceum;桤木Alnus cremastogyne;香椿Toona sinensis;卷柏Selaginella tamariscina;粗齿冷
水花Pilea sinofasciata;杜仲Eucommia ulmoides;榆树Ulmus pumila -
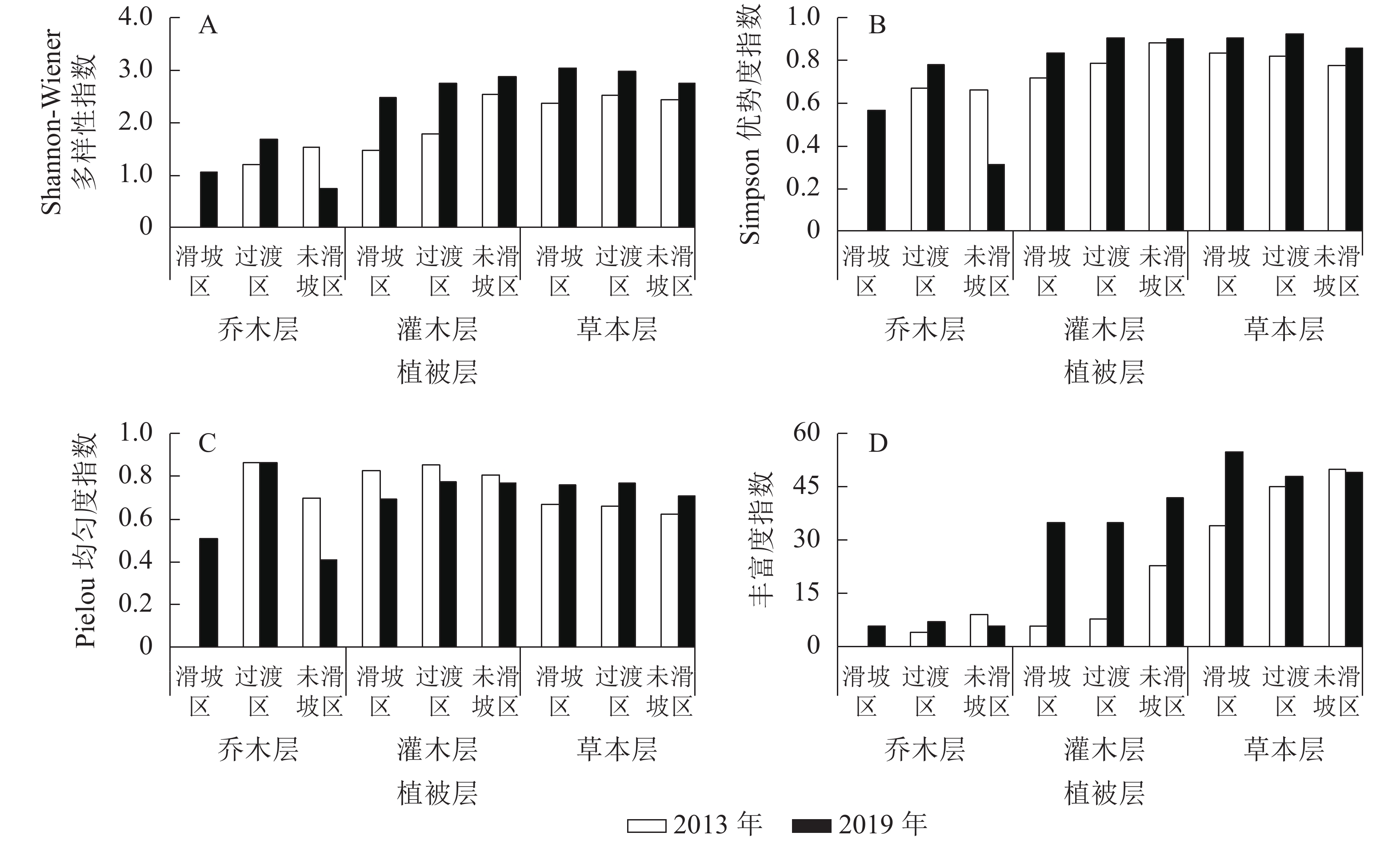
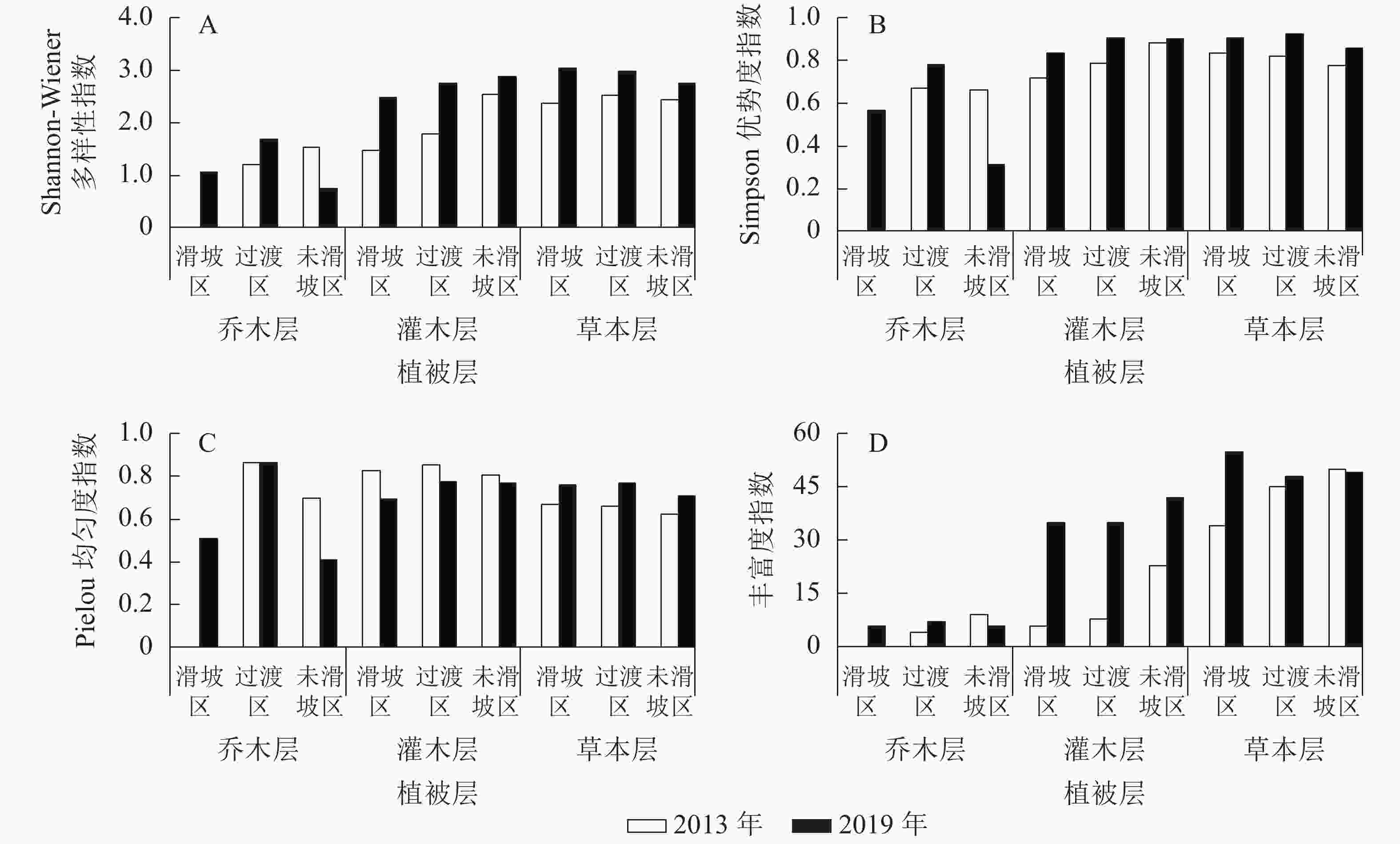
由图1可知:2013—2019年,未滑坡区乔木层Shannon-Wiener多样性指数减小(减幅为52.12%),其他区域各植被层均增加,其中增幅最小的是未滑坡区草本层(12.92%),最大的是滑坡区灌木层(68.20%)。除未滑坡区乔木层Simpson优势度指数有所减小(减幅为52.94%)外,其他各区域各植被层均有增加,其中增幅最小的是未滑坡区灌木层(2.34%),最大的是滑坡区灌木层(16.46%)。Pielou均匀度指数表现为3个区域灌木层和未滑坡区乔木层有所减小,其中未滑坡区灌木层减幅最小(4.86%),未滑坡区乔木层减幅最大(41.28%);其余表现为增加,增幅最小的为过渡区乔木层(0.02%),最大的为过渡区草本层(16.10%)。丰富度指数表现为未滑坡区乔木层(33.33%)和草本层(减幅2.00%)有所下降,其余表现为增加,其中过渡区草本层增幅最小,为6.67%,滑坡区灌木层增幅最大,达483.33%。
-
乔木层、灌木层和草本层CCA排序前2轴的累积贡献率分别为77.90%、74.40和66.30%,特征值之和分别占总特征值的77.85%、65.54%和54.64%,包含了排序的绝大部分信息,因此可以采用前2轴的数据来分析植物群落与环境因子之间的关系。如表5所示:乔木层中,与CCA第1轴存在极显著正相关(P<0.01)关系的环境因子是团聚体破坏率(PAD)和不稳定团粒系数(ELT),呈显著正相关(P<0.01)的是pH和水稳性团聚体分形维数(D2),极显著负相关(P<0.01)的是有效磷(AP);与CCA第2轴呈显著负相关(P<0.05)的是全钾(TK)。灌木层中,与CCA第1轴呈极显著正相关(P<0.01)的是pH、D2和ELT,显著正相关(P<0.05)的是风干性团聚体分形维数(D1)和PAD,显著负相关(P<0.05)的是风干性团聚体平均质量直径(MWD1)、风干性团聚体平均几何直径(GMD1)、水稳性团聚体平均质量直径(MWD2)、水稳性团聚体平均几何直径(GMD2)、全氮(TN)以及全磷(TP)。草本层中,与CCA第1轴存在极显著正相关(P<0.01)的环境因子是pH、D2和ELT,呈显著正相关(P<0.05)的是D1,呈极显著负相关(P<0.05)的是MWD1、GMD1和GMD2,呈显著负相关(P<0.05)的是MWD2、TN和TP,与CCA第2轴存在极显著正相关的环境因子是TK和速效钾(AK)。
表 5 各CCA排序轴与环境因子相关系数
Table 5. Correlation coefficients of each CCA ranking axis and environmental factors
植被层 排序轴 pH MWD1 GMD1 D1 MWD2 GMD2 D2 乔木层 第1轴 0.768 5* −0.390 5 −0.361 1 0.301 5 −0.437 9 −0.491 2 0.757 7* 第2轴 −0.447 6 0.6691 0.661 3 −0.546 0 0.619 7 0.5895 −0.392 5 灌木层 第1轴 0.961 1** −0.874 4* −0.866 0* 0.793 3* −0.822 7* −0.861 3* 0.960 6** 第2轴 0.088 9 0.134 5 0.123 2 −0.057 4 0.1239 0.072 4 0.162 2 草本层 第1轴 0.967 1** −0.950 1** −0.946 8** 0.814 5* −0.874 5* −0.905 1** 0.953 6** 第2轴 −0.172 9 −0.242 1 −0.258 7 0.239 5 −0.274 0 −0.204 2 −0.144 6 植被层 排序轴 PAD ELT SOC TN TP TK AN 乔木层 第1轴 0.900 5** 0.925 5** −0.556 9 −0.491 4 −0.515 9 −0.271 4 −0.504 7 第2轴 0.380 9 −0.0487 −0.305 8 0.212 7 0.4562 −0.816 1* −0.128 0 灌木层 第1轴 0.769 0* 0.898 0** −0.540 6 −0.799 5* −0.797 9* 0.031 3 −0.641 2 第2轴 0.495 4 0.319 5 −0.684 7 −0.254 2 −0.035 7 −0.665 8 −0.514 7 草本层 第1轴 0.728 5 0.913 3** −0.576 8 −0.8745* −0.8515* 0.1834 −0.733 7* 第2轴 −0.648 0 −0.382 5 0.269 6 −0.026 1 −0.181 6 0.896 8** 0.103 0 植被层 排序轴 AP AK 特征值占比/% 累积贡献率/% 乔木层 第1轴 −0.886 8** −0.660 9 51.97 52.00 第2轴 −0.317 7 −0.426 2 25.88 77.90 灌木层 第1轴 −0.708 4 −0.095 3 43.77 43.80 第2轴 −0.696 3 −0.495 9 30.67 74.40 草本层 第1轴 −0.590 9 0.241 5 40.15 40.20 第2轴 0.650 6 0.909 1** 26.09 66.30 说明:pH. 土壤酸碱度;MWD1. 风干性团聚体平均质量直径;GMD1. 风干性团聚体平平均几何直径;D1. 风干性团聚体分形
维数;MWD2. 水稳性团聚体平均质量直径;GMD2. 水稳性团聚体平均几何直径;D2. 水稳性团聚体分形维数;PAD. 团
聚体破坏率;ELT:不稳定团粒系数;SOC. 土壤有机碳;TN. 土壤全氮;TP. 土壤全磷;TK. 土壤全钾;AN. 土壤碱解
氮;AP. 土壤速效磷;AK. 土壤速效钾。*表示显著相关(0.01<P<0.10),**表示极显著相关(P<0.01)由图2A可知:桤木、西南木荷Schima wallichii、香椿和黄连木Pistacia chinensis的生境条件相似,仅在2013年未滑坡区有分布。这些乔木对土壤有机质和速效钾的要求较高;漆树和醉鱼草仅在2013年过渡区有分布,距离质心最远,对土壤pH和水稳性团聚体分形维数的变化更为敏感;枇杷Eriobotrya japonica和银杏Ginkgo biloba距离质心较近,对土壤环境因子的要求较低。由图2B可知:地果、柏木和枫杨生境条件相似,对有机质和有效磷的要求较高;卵果蔷薇和马桑距离质心较近,对土壤环境因子的要求较低,漆树和醉鱼草对pH和团聚体分形维数的要求更高。由图2C可知:粗齿冷水花、绣线菊和猪毛蒿对土壤全钾和速效钾的要求较高;位于排序轴左下部的草本植物如茜草、狭叶凤尾蕨、老鹳草等高度聚集并分布于团聚体平均几何直径、质量直径的附近,表明这些草本植物对土壤团聚体稳定性的要求更高。
-
组成群落的植物种类的数量决定群落的复杂程度,反映了群落的稳定性[16]。本研究中,2013—2019年,滑坡迹地 3个区域乔木层、灌木层和草本层科属种数量增加,但禾本科与菊科植物的种数下降,说明随着群落结构的发展,菊科和禾本科的先锋草本植物有所退化[14]。滑坡迹地不同区域受损程度不同,物种组成也存在一定的差异,草本层以小蓬草、茅叶荩草等菊科和禾本科的植物为主,灌木层以刺槐等豆科Fabaceae植物为主。这与李波等[17]对虹口地震滑坡体自然恢复的研究结果较为一致。随着群落的发展,滑坡区和过渡区均出现柏木,可能的原因是滑坡导致此2个区域之前存在的乔木受到损毁,但其种子留存在土壤中,随着时间的推移,迹地上原来的优势种又重新生长并发展起来。未滑坡区乔木层的科属种数均减小,可能是优势种柏木的生长占据了更多的光热条件,导致林下其他植物种减少,引起该区域乔木层均匀度指数的大幅减少[18-20]。王树森等[21]也认为:随着植被恢复的进行,群落的物种多样性会先升高后降低。
中度干扰理论认为:在无干扰或轻度干扰下,植物会在有限的资源条件下进行生存竞争,导致植物多样性较低;适度干扰时,植物自身之间的竞争力减弱,个体竞争力强的物种能够生存下来,干扰也会增加环境因子的差异性,多方面的因素导致植物多样性增加;但在高度干扰下,受多种因素影响植物多样性反而降低[22]。本研究发现:2013年3个区域草本层多样性指数从大到小表现为过渡区、滑坡区、未滑坡区,2019年表现为滑坡区、过渡区、未滑坡区,大致符合干扰理论。2013年滑坡区受干扰程度大,土壤条件差,因此植物多样性较低;而过渡区受干扰程度较滑坡区小,因此多样性较高;未滑坡区几乎不受影响,植物种间竞争强,因此多样性反而比过渡区小。2019年随着土壤条件的改善,滑坡区植物多样性大幅度升高,这与陈小雪等[5]、吴旭东等[23]结果相似,而过渡区和未滑坡区由于植物种间竞争较强,多样性只是小幅度升高,证实了群落总是朝着草本—灌木—乔木的方向发展[24]。滑坡区2013年无乔木,因此草本层受乔木和灌木生长的影响最小,过渡区其次,未滑坡区最大。乔木层和草本层的群落均匀度指数增加,但灌木层减小,可能由优势物种减少而其他伴生物种增加所导致[25]。
-
植物群落应对复杂生存环境的结果是形成不同的群落分布格局,而分布格局的可塑性能够客观表达植物对生存环境的适应性[26]。在较大空间尺度上,降水和温度等地带性气候被认为是影响植物群落空间分布的主要因素[27],而中等空间尺度上,海拔和坡向对植物群落分布格局的影响较大[28]。在小空间尺度上由于海拔差异小且坡向一致,土壤环境因子被认为是植被分布格局的主导因子[29]。2013—2019年,随着植被恢复,滑坡区和过渡区对环境因子变化的响应较未滑坡区更加明显,物种分布特点受到多重环境因子的影响[30]。MA等[31]提出氮磷钾是影响区域物种组成的主要因素,同时养分的分布特征能够在一定程度上解释草本植物和灌木的不均匀分布。丛静等[32]发现pH与植物的生长和分布存在一定关系,如打破碗花花喜腐殖质丰富的酸性至中性土壤,土壤条件过酸过碱都会导致植株死亡,因此,2013年只有过渡区有打破碗花花分布,2019年随着研究区pH减小,打破碗花花在3个区域均有分布。植被和土壤作为一个有机整体,植物的生长能对土壤起到一定的改良作用,使土壤性质向着良性方向发展[33]。
-
2019年滑坡迹地3个区域菊科和禾本科草本植物所占比例较2013年均有所下降;未滑坡区的乔木层科属种数和草本层的属数及种数减少,其他均增加;Shannon-Wiener多样性指数和Simpson优势度指数均表现为未滑坡区乔木层减小,其余增大;各区域草本层的Pielou均匀度指数均增大;未滑坡区乔木层和草本层的丰富度指数减小,其余增大。
CCA排序分析中乔木、灌木和草本层的前2轴累积解释量分别为77.9%、74.4%和66.3%,包含了CCA排序的绝大部分信息。不同植物对环境因子的敏感性不同,pH和土壤团聚体特征对植物群落分布的影响较大。排序结果反映了各个环境因子的实际生态意义,对滑坡迹地植物群落分布具有较好的解释能力。
Changes of plant community diversity and environmental interpretation in Beichuan landslide site
-
摘要:
目的 研究震后滑坡迹地生态恢复过程中群落植物多样性变化情况及环境解释。 方法 以北川县凤凰山滑坡迹地土壤和植物群落为对象,将滑坡迹地分为滑坡区、过渡区和未滑坡区,通过典范对应分析(CCA)排序法对3个区域植被变化情况进行分析,并对植物群落分布进行环境解释。 结果 ①2013—2019年,滑坡区和过渡区总体上植物科属种数量增加了4.00%~483.33%,未滑坡区减少了2.00%~37.50%。②滑坡区和过渡区的植物多样性增加了0.02%~483.33%,未滑坡区减少了2.00%~52.94%,且均匀度也有降低。③乔灌草层的CCA排序前2轴特征值之和占总特征值的60%~80%,表明前2轴包含了排序的大部分信息。④土壤pH和团聚体特征对植被分布的影响较大。 结论 滑坡迹地植物群落的多样性有所提高,且环境因子对植物群落有重要影响。图2表5参33 Abstract:Objective The objective is to study the variation of community plants diversity in the process of ecological rehabilitation of landslide slashed after earthquake and and make environmental interpretation. Method Taking the soil and plant communities in Mt. Fenghuang landslide slash in Beichuan County as the objects, the landslide slashes were divided into landslide area, transition area and non-landslide area. The vegetation changes in the three areas were analyzed by CCA (canonical correspondence analysis) method, and environmental interpretation was made with regard to the distribution of the plant community. Result (1) From 2013 to 2019, the number of plant families, genera and species in landslide area and transition area increased by 4.00%−483.00%, and that in non-landslide area decreased by 2.00%−37.50%. (2) The plant diversity in landslide area and transition area increased by 0.02%−483.33% while in non-landslide area decreased by 2.00%−52.94%, and the evenness also decreased. (3) The sum of the eigenvalues of the first two axes related to CCA ranking in arbor, shrub and grass layer accounted for 60%−80% of the total value, indicating that the first two axes contained most of the ranking imformation. (4) Soil pH and aggregate characteristics had a great impact on the vegetation distribution. Conclusion The diversity of plant communities in landslide slash has been improved to some extent, and the environmental factors have crucial influence on plant communities. [Ch, 2 fig. 5 tab. 33 ref.] -
Key words:
- landslide /
- vegetation restoration /
- species diversity /
- environmental interpretation
-
表 1 样地基本情况
Table 1. General condition of the sample plots
样地 海拔/m 坡度/(°) 坡向/(°) 备注 滑坡区 735~762 32~38 北偏西24~30 2011年采用宾格护坡,并按2 m×4 m的株行距栽植刺槐Robinia pseudoacacia幼苗 过渡区 723~757 32~38 北偏西21~27 自然恢复,沟蚀明显,主要为灌草植被 未滑坡区 732~764 30~38 北偏西22~29 柏木次生林,植被保持原状,郁闭度90%以上 表 2 滑坡迹地土壤环境因子情况
Table 2. Soil environmental factors in landslide site
年份 区域 有机碳/(g·kg−1) 全氮/(g·kg−1) 全磷/(g·kg−1) 全钾/(g·kg−1) pH 碱解氮/(mg·kg−1) 2013 滑坡区 28.212 b 0.884 d 0.314 de 0.232 cd 8.197 a 52.232 b 过渡区 40.752 b 1.728 c 0.235 e 0.331 b 8.147 a 119.577 b 未滑坡区 45.813 b 1.919 c 0.352 d 0.430 a 8.033 a 118.408 b 2019 滑坡区 38.936 b 2.913 b 0.566 c 0.202 d 8.043 a 129.531 b 过渡区 33.572 b 2.333 bc 0.689 b 0.202 d 7.977 a 138.130 b 未滑坡区 97.188 a 4.382 a 0.914 a 0.267 c 7.953 a 350.595 a 年份 区域 有效磷/
(mg·kg−1)速效钾/
(mg·kg−1)风干性团聚体
分形维数水稳性团聚体
分形维数风干性团聚体
平均几何直径/mm水稳性团聚体
平均几何直径/mm2013 滑坡区 0.496 c 166.695 b 2.278 a 2.665 a 1.456 d 0.849 e 过渡区 0.693 c 126.246 bc 2.225 ab 2.626 a 1.570 c 0.803 e 未滑坡区 3.288 b 238.029 a 2.209 ab 2.519 b 1.624 c 0.974 d 2019 滑坡区 0.920 c 137.305 bc 1.981 c 2.488 b 1.961 b 1.291 c 过渡区 1.450 c 108.980 c 2.142 b 2.496 b 1.972 b 1.397 b 未滑坡区 4.561 a 151.193 bc 1.971 c 2.394 c 2.092 a 1.571 a 年份 区域 风干性团聚体
平均质量直径/mm水稳性团聚体
平均质量直径/mm团聚体破坏
率/%不稳定团粒
系数/%2013 滑坡区 3.764 d 1.764 e 16.297 a 21.853 a 过渡区 4.127 cd 1.433 d 12.718 b 17.138 b 未滑坡区 4.458 c 1.958 d 8.823 c 12.803 c 2019 滑坡区 5.659 b 3.390 c 13.101 b 14.680 c 过渡区 5.969 ab 3.831 b 11.291 b 14.032 c 未滑坡区 6.262 a 4.404 a 9.016 c 10.350 d 说明:不同小写字母表示不同样地间差异显著(P<0.05) 表 3 滑坡迹地植物群落物种组成变化情况
Table 3. Changes in species composition of plant communities in landslide sites
植被层 区域 科 属 种 2013年 2019年 2013年 2019年 2013年 2019年 乔木层 滑坡区 0 5 0 6 0 6 过渡区 4 7 4 7 4 7 未滑坡区 8 5 9 6 9 6 灌木层 滑坡区 6 21 6 31 6 35 过渡区 7 27 8 33 8 35 未滑坡区 16 28 20 37 23 42 草本层 滑坡区 18 23 32 47 34 55 过渡区 25 26 39 42 45 48 未滑坡区 28 31 46 44 50 49 表 4 滑坡迹地优势植物重要值
Table 4. The important values of the dominant plants in landslide sites
植被层 滑坡区 过渡区 未滑坡区 2013年 2019年 2013年 2019年 2013年 2019年 物种 重要值 物种 重要值 物种 重要值 物种 重要值 物种 重要值 物种 重要值 乔木层 刺槐 0.484 8 刺槐 0.424 6 刺槐 0.269 5 柏木 0.645 8 柏木 0.649 5 柏木 0.229 8 漆树 0.314 2 柏木 0.204 0 桤木 0.113 2 杜仲 0.094 6 南酸枣 0.158 7 醉鱼草 0.198 4 枫杨 0.188 9 香椿 0.104 7 榆树 0.072 2 灌木层 刺槐 0.382 2 西南绣球 0.236 4 刺槐 0.349 6 西南绣球 0.218 5 柏木 0.160 2 铁仔 0.182 1 马桑 0.230 7 地果 0.175 7 雀儿舌头 0.183 9 卵果蔷薇 0.111 7 铁仔 0.157 6 柏木 0.164 8 漆树 0.140 0 火棘 0.124 5 插田泡 0.148 8 豪猪刺 0.106 8 刺槐 0.111 1 雀儿舌头 0.076 2 醉鱼草 0.129 1 马桑 0.060 7 构树 0.099 2 地果 0.077 4 卵果蔷薇 0.096 0 枫杨 0.071 3 草本层 小蓬草 0.222 3 茅叶荩草 0.158 9 茅叶荩草 0.2829 细叶薹草 0.189 3 卷柏 0.261 1 细叶薹草 0.312 6 茅叶荩草 0.164 0 细叶薹草 0.102 5 野棉花 0.109 1 茅叶荩草 0.122 7 野棉花 0.087 3 卷柏 0.105 6 鬼针草 0.088 0 打破碗花花 0.094 0 千里光 0.054 3 打破碗花花 0.075 8 粗齿冷水花 0.056 3 斑茅 0.055 7 千里光 0.061 9 冷水花 0.054 5 艾 0.052 8 老鹳草 0.051 0 白茅 0.051 7 打破碗花花 0.039 5 香薷 0.060 0 白茅 0.052 4 野菊 0.046 9 斑茅 0.050 7 艾 0.050 3 冷水花 0.037 2 说明:马桑Coriaria nepalensis;漆树Toxicodendron vernicifluum;醉鱼草Buddleja lindleyana;小蓬草Erigeron canadensis;鬼针草
Bidens pilosa;千里光Senecio scandens;香薷Elsholtzia ciliata;南酸枣Choerospondias axillaris;地果Ficus tikoua;火棘
Pyracantha fortuneana;打破碗花花Anemone hupehensis;冷水花Paederia foetida;白茅Imperata cylindrica;雀儿舌头Leptopus
chinensis;插田泡Rubus coreanus;构树Broussonetia papyrifera;野棉花Anemone vitifolia;艾Artemisia argyi;野菊
Chrysanthemum indicum;枫杨Pterocarya stenoptera;卵果蔷薇Rosa helenae;豪猪刺Berberis julianae;老鹳草Geranium
wilfordii;斑茅Saccharun arundinaceum;桤木Alnus cremastogyne;香椿Toona sinensis;卷柏Selaginella tamariscina;粗齿冷
水花Pilea sinofasciata;杜仲Eucommia ulmoides;榆树Ulmus pumila表 5 各CCA排序轴与环境因子相关系数
Table 5. Correlation coefficients of each CCA ranking axis and environmental factors
植被层 排序轴 pH MWD1 GMD1 D1 MWD2 GMD2 D2 乔木层 第1轴 0.768 5* −0.390 5 −0.361 1 0.301 5 −0.437 9 −0.491 2 0.757 7* 第2轴 −0.447 6 0.6691 0.661 3 −0.546 0 0.619 7 0.5895 −0.392 5 灌木层 第1轴 0.961 1** −0.874 4* −0.866 0* 0.793 3* −0.822 7* −0.861 3* 0.960 6** 第2轴 0.088 9 0.134 5 0.123 2 −0.057 4 0.1239 0.072 4 0.162 2 草本层 第1轴 0.967 1** −0.950 1** −0.946 8** 0.814 5* −0.874 5* −0.905 1** 0.953 6** 第2轴 −0.172 9 −0.242 1 −0.258 7 0.239 5 −0.274 0 −0.204 2 −0.144 6 植被层 排序轴 PAD ELT SOC TN TP TK AN 乔木层 第1轴 0.900 5** 0.925 5** −0.556 9 −0.491 4 −0.515 9 −0.271 4 −0.504 7 第2轴 0.380 9 −0.0487 −0.305 8 0.212 7 0.4562 −0.816 1* −0.128 0 灌木层 第1轴 0.769 0* 0.898 0** −0.540 6 −0.799 5* −0.797 9* 0.031 3 −0.641 2 第2轴 0.495 4 0.319 5 −0.684 7 −0.254 2 −0.035 7 −0.665 8 −0.514 7 草本层 第1轴 0.728 5 0.913 3** −0.576 8 −0.8745* −0.8515* 0.1834 −0.733 7* 第2轴 −0.648 0 −0.382 5 0.269 6 −0.026 1 −0.181 6 0.896 8** 0.103 0 植被层 排序轴 AP AK 特征值占比/% 累积贡献率/% 乔木层 第1轴 −0.886 8** −0.660 9 51.97 52.00 第2轴 −0.317 7 −0.426 2 25.88 77.90 灌木层 第1轴 −0.708 4 −0.095 3 43.77 43.80 第2轴 −0.696 3 −0.495 9 30.67 74.40 草本层 第1轴 −0.590 9 0.241 5 40.15 40.20 第2轴 0.650 6 0.909 1** 26.09 66.30 说明:pH. 土壤酸碱度;MWD1. 风干性团聚体平均质量直径;GMD1. 风干性团聚体平平均几何直径;D1. 风干性团聚体分形
维数;MWD2. 水稳性团聚体平均质量直径;GMD2. 水稳性团聚体平均几何直径;D2. 水稳性团聚体分形维数;PAD. 团
聚体破坏率;ELT:不稳定团粒系数;SOC. 土壤有机碳;TN. 土壤全氮;TP. 土壤全磷;TK. 土壤全钾;AN. 土壤碱解
氮;AP. 土壤速效磷;AK. 土壤速效钾。*表示显著相关(0.01<P<0.10),**表示极显著相关(P<0.01) -
[1] 牛莉芹, 程占红, 赵蒙. 旅游干扰下五台山不同植被景观区物种多样性特征[J]. 应用与环境生物学报, 2012, 18(4): 559 − 564. NIU Liqin, CHENG Zhanhong, ZHAO Meng. Plant species diversities of tourism disturbed landscapes in Wutai Mountains, China [J]. Chin J Appl Environ Biol, 2012, 18(4): 559 − 564. [2] 孙丽文, 史常青, 赵廷宁, 等. 汶川地震滑坡治理区植被恢复效果研究[J]. 中国水土保持科学, 2015, 13(5): 86 − 92. SUN Liwen, SHI Changqing, ZHAO Tingning, et al. Vegetation recovery in the landslide-tackling area of Wenchuan earthquake [J]. Sci Soil Water Conserv, 2015, 13(5): 86 − 92. [3] 孙丽文, 史常青, 李丹雄, 等. 汶川地震滑坡迹地植物群落与环境的关系[J]. 生态学报, 2016, 36(21): 6794 − 6803. SUN Liwen, SHI Changqing, LI Danxiong, et al. Relationship between plant communities and environment after landslide of Wenchuan earthquake [J]. Acta Ecol Sin, 2016, 36(21): 6794 − 6803. [4] 刘尧尧, 辜彬, 王丽. 北川震后植被恢复工程植物群落物种多样性及优势种生态位[J]. 生态学杂志, 2019, 38(2): 309 − 320. LIU Yaoyao, GU Bin, WANG Li. Species diversity of plant community and the niche of dominant species in Beichuan after earthquake engineering [J]. Chin J Ecol, 2019, 38(2): 309 − 320. [5] 陈小雪, 李红丽, 董智, 等. 不同造林模式下火烧迹地的土壤修复效果及植物多样性变化[J]. 水土保持学报, 2019, 33(3): 332 − 339. CHEN Xiaoxue, LI Hongli, DONG Zhi, et al. Effects of soil remediation and changes of plant diversity in burned areas under different afforestation patterns [J]. J Soil Water Conserv, 2019, 33(3): 332 − 339. [6] WANG Lihong, FU Qiang. Soil quality assessment of vegetation restoration after a large forest fire in Daxing’anling, northeast China [J]. Can J Soil Sci, 2020, 100: 1 − 13. [7] WANG Huanhuan, YUE Chao, MAO Qinqin, et al. Vegetation and species impacts on soil organic carbon sequestration following evological restoration over the Loess Plateau, China [J/OL]. Geoderma, 2020, 371: 114389[2021-01-25]. doi: 10.1016/j.geoderma.2020.114389. [8] 崔艳红, 史常青, 孙丽文, 等. 5·12地震后北川次生灾害迹地植被的自然恢复与更新[J]. 浙江农林大学学报, 2018, 35(2): 219 − 226. CUI Yanhong, SHI Changqing, SUN Liwen, et al. Vegetation restoration and regeneration of the secondary disaster area in Beichuan after the May 12, 2008 earthquake [J]. J Zhejiang A&F Univ, 2018, 35(2): 219 − 226. [9] FINNEGAN L, PIGEON K E, MACNEARNEY D. Predicting patterns of vegetation recovery on seismic lines: informing restoration based on understory species composition and growth [J]. For Ecol Manage, 2019, 446: 175 − 192. [10] 白晓航, 张金屯, 曹科, 等. 河北小五台山国家级自然保护区森林群落与环境的关系[J]. 生态学报, 2017, 37(11): 3683 − 3696. BAI Xiaohang, ZHANG Jintun, CAO Ke, et al. Relationship between forest communities and the environment in the Xiaowutai Mountain National Nature Reserve, Hebei [J]. Acta Ecol Sin, 2017, 37(11): 3683 − 3696. [11] 钟娇娇, 陈杰, 陈倩, 等. 秦岭山地天然次生林群落MRT数量分类、CCA排序及多样性垂直格局[J]. 生态学报, 2019, 39(1): 277 − 285. ZHONG Jiaojiao, CHEN Jie, CHEN Qian, et al. Quantitative classification of MRT, CCA odination, and species diversity along elevation gradients of a natural secondary forest in the Qinling mountains [J]. Acta Ecol Sin, 2019, 39(1): 277 − 285. [12] 任晴, 袁位高, 吴初平, 等. 浙江省红楠生境地群落数量分类和环境解析[J]. 生态学报, 2020, 40(15): 5277 − 5287. REN Qing, YUAN Weigao, WU Chuping, et al. Community quantitative classification and environmental analysis of the Machilus thunbergii habitat in Zhejiang Province [J]. Acta Ecol Sin, 2020, 40(15): 5277 − 5287. [13] 张志敏, 杨国栋, 谢梦梦, 等. 江苏龙池山自然保护区红楠(Machilus thunbergii)生存群落结构及其环境解释[J]. 生态学杂志, 2019, 38(6): 1637 − 1645. ZHANG Zhimin, YANG Guodong, XIE Mengmeng, et al. Community structure and environmental interpretation of Machilus thunbergii in mountains Longchi, Jiangsu Province [J]. Chin J Ecol, 2019, 38(6): 1637 − 1645. [14] 廖峰, 郑江坤, 赵廷宁, 等. 柏木次生林震后滑坡迹地物种多样性变化特征[J]. 应用与环境生物学报, 2018, 24(6): 1404 − 1410. LIAO Feng, ZHENG Jiangkun, ZHAO Tingning, et al. Species diversity variation of Cupressus funebirs secondary forest in landslide site after 5.12 Wenchuan Earthquake [J]. Chin J Appl Environ Biol, 2018, 24(6): 1404 − 1410. [15] 张万儒, 杨光滢, 屠南星. 森林土壤分析方法[M]. 北京: 中国标准出版社, 2000: 57 − 70. ZHANG Wanru, YANG Guangying, TU Nanxing. Forest Soil Analysis Method[M]. Beijing: China Standards Press, 2000: 57 − 70. [16] 夏威, 安明态, 陈龙, 等. 贵州北盘江不同强度石漠化区木本植物多样性及生态功能群研究[J]. 西北植物学报, 2020, 40(3): 524 − 531. XIA Wei, AN Mingtai, CHEN Long, et al. Study on woody plant diversity and ecological function groups of different rocky desertification gradients in Beipan river basin of Guizhou [J]. Acta Bot Boreal-Occedent Sin, 2020, 40(3): 524 − 531. [17] 李波, 张曼, 赵璐玲, 等. 汶川地震滑坡体自然植被恢复及影响因子: 以龙溪-虹口自然保护区为例[J]. 应用与环境生物学报, 2014, 20(3): 468 − 473. LI Bo, ZHANG Man, ZHAO Luling, et al. Vegetation recovery on landslide of the Wenchuan earthquake and its influencing factors: a case study in Longxi-Hongkou Nature Reserve [J]. Chin J Appl Environ Biol, 2014, 20(3): 468 − 473. [18] 朱涛, 周世强, 黄金燕, 等. 卧龙自然保护区冷杉-铁杉林木本植物多样性在冷箭竹更新恢复过程中的变化特征[J]. 应用与环境生物学报, 2019, 26(2): 442 − 450. ZHU Tao, ZHOU Shiqiang, HUANG Jinyan, et al. Woody plant dicersity changes of Abies-Tsuga forests during the natural regeneration of arrow bamboo (Bashania faberi) in Wolong Nature Reserve [J]. Chin J Appl Environ Biol, 2019, 26(2): 442 − 450. [19] MOHAMMADI M F, JALALI S G, KOOCH Y, et al. The influence of landform on the understory plant community in a temperate Beech forest in northern Iran [J]. Ecol Res, 2015, 30(2): 385 − 394. [20] PETERSEN S L, STRINGHAM T K. Development of GIS-based models to predict plant community structure in relation to western juniper establishment [J]. For Ecol Manage, 2008, 256(5): 981 − 989. [21] 王树森, 余新晓, 班嘉蔚, 等. 华北土石山区天然森林植被演替中群落结构和物种多样性变化的研究[J]. 水土保持研究, 2006, 13(6): 48 − 50. WANG Shusen, YU Xinxiao, BAN Jiawei, et al. Community structure and species diversity changes of forest vegetation with succession in rocky mountain area of north of China [J]. Res Soil Water Conserv, 2006, 13(6): 48 − 50. [22] 陈乙实, 孙海荣, 李娜娜, 等. 绵羊放牧绢蒿荒漠草地植物群落多样性及其环境解释[J]. 草业学报, 2019, 28(11): 1 − 11. CHEN Yishi, SUN Hairong, LI Nana, et al. Plant community diversity in grazed Seriphidium semidesert grassland and its relationships with encironmental factors [J]. Acta Pratac Sin, 2019, 28(11): 1 − 11. [23] 吴旭东, 宋乃平, 潘军. 沙质草地生境中植物群落对土壤质地演进的响应[J]. 水土保持学报, 2016, 30(3): 285 − 290. WU Xudong, SONG Naiping, PAN Jun. Responses of plant commumities to the soil texture evolution in sandy grassland [J]. J Soil Water Conserv, 2016, 30(3): 285 − 290. [24] LI Liguang, HE Xingyuan, LI Xiuzhen, et al. Depth of edge influence of the agricultural-forest landscape boundary, Southwestern China [J]. Ecol Res, 2007, 22(5): 774 − 783. [25] 时连俊, 徐建, 林叶彬, 等. 谢家店植物群落恢复中种类组成及物种多样性分析[J]. 水土保持研究, 2016, 23(2): 83 − 88. SHI Lianjun, XU Jian, LIN Yebin, et al. Analysis on species composition and species diversity of plant community recovery in Xiejiadian [J]. Res Soil Water Conserv, 2016, 23(2): 83 − 88. [26] 马俊逸, 赵成章, 苟芳珍, 等. 甘肃金塔北海子国家湿地公园植物群落数量分类及其环境解释[J]. 湿地科学, 2020, 18(3): 328 − 336. MA Junyi, ZHAO Chengzhang, GOU Fangzhen, et al. Numerical classification of plant communities in Jinta Beihaizi National Wetland Park in Gansu and its environmental interpretation [J]. Wetland Sci, 2020, 18(3): 328 − 336. [27] 张树斌, 王襄平, 吴鹏, 等. 吉林灌木群落物种多样性与气候和局域环境因子的关系[J]. 生态学报, 2018, 38(22): 7990 − 8000. ZHANG Shubin, WANG Xiangping, WU Peng, et al. Relationship between shrub species diversity and climate and local environmental factors across Jilin [J]. Acta Ecol Sin, 2018, 38(22): 7990 − 8000. [28] 许传阳, 陈志超, 郝成元, 等. 暖温带和北亚热带过渡区白云山植物物种多样性与环境因子相关性[J]. 生态环境学报, 2014, 23(3): 371 − 376. XU Chuanyang, CHEN Zhichao, HAO Chengyuan, et al. Research on the correlation between plant species diversity and its main environmental factors of Mt. Baiyunshan in the transitional region from warm temperate zone to subtropical zone [J]. Ecol Environ Sci, 2014, 23(3): 371 − 376. [29] 黄庆阳, 曹宏杰, 谢立红, 等. 五大连池火山熔岩台地草本层物种多样性及环境解释[J]. 生物多样性, 2020, 28(6): 658 − 667. HUANG Qingyang, CAO Hongjie, XIE Lihong, et al. Species diversity and environmental interpretation of herb layer in lava platform of Wudalianchi, China [J]. Biodiversity Sci, 2020, 28(6): 658 − 667. [30] 黄润霞, 徐明锋, 刘婷, 等. 亚热带5种森林类型林下植物物种多样性及其环境解释[J]. 西南林业大学学报(自然科学), 2020, 40(2): 53 − 62. HUANG Runxia, XU Mingfeng, LIU Ting, et al. Environmental interpretation and species diversity of understory vegetation in 5 subtropical forest types [J]. J Southwest For Univ, 2020, 40(2): 53 − 62. [31] MA Tianshu, DENG Xiangwen, CHEN Liang, et al. The soil properties and their effects on plant diversity in different degrees of rocky desertification[J/OL]. Sci Total Environ, 2020, 736: 139667[2021-01-25]. doi: 10.1016/j.scitotenv.2020.139667. [32] 丛静, 尹华群, 卢慧, 等. 神农架保护区典型植被的物种多样性和环境解释[J]. 林业科学, 2013, 49(5): 30 − 35. CONG Jing, YIN Huaqun, LU Hui, et al. Species diversity and envirnmental interpretation of typical vegetation types in the Shennongjia Natural Reserve [J]. Sci Silv Sin, 2013, 49(5): 30 − 35. [33] 刘洋, 侯占山, 赵爽, 等. 太行山片麻岩山区造地边坡植被恢复过程中植物多样性与土壤特性的演变[J]. 生态学报, 2018, 38(15): 5331 − 5339. LIU Yang, HOU Zhanshan, ZHAO Shuang, et al. Evolution of plant species diversity and soil characteristics on hillslopes during vegetation restoration in the gneiss region of the Taihang mountains after reclamation [J]. Acta Ecol Sin, 2018, 38(15): 5331 − 5339. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210188






 下载:
下载: