-
枇杷黄毛虫Melanographia flexilineata,又名枇杷瘤蛾,属鳞翅目Lepidoptera灯蛾科Arctiidae[1],是中国南方枇杷Eriobotrya japonica上最主要的害虫。除危害枇杷外,枇杷黄毛虫还危害梨Pyrus spp.,李Prunus spp.,合欢Albizzia julibrissin,紫薇Lagerstroemia india等果树和绿化树。浙江省杭州市余杭区塘栖镇从唐代起就以盛产枇杷而著称于世[2]。近年来,鲜果枇杷价格快速上升,对品质的要求日益提高,枇杷产业迅速发展。枇杷黄毛虫在浙江余抗塘栖1 a发生4代,幼虫危害枇杷嫩芽和嫩叶,发生多时也危害老叶、嫩茎表皮和花果,严重时全树叶片被吃尽,削弱树势[3-4],影响产量。国内对枇杷黄毛虫的寄主分布、形态、生物学特征等有一定的报道[5-9],但开展系统监测调查、对其种群动态的研究及应用统计学方法建立预测模型等方面鲜有报道。本研究采用测报灯诱集与田间调查相结合的方法,通过对塘栖枇杷黄毛虫成虫灯下逐日系统监测结合田间定期系统调查,选择不同时期虫口基数、气象资料(气温、相对湿度、降水量)作为预测因子,使用逐步回归法开展其发生期和发生量的预测预报模型研究,对保障枇杷产量和品质,促进枇杷产业发展具有重要意义。
-
自动虫情测报灯由河南省佳多科工贸有限公司生产,灯下接诱导漏斗和接虫袋。
-
试验地设在余杭区塘栖枇杷研究所试验基地,枇杷品种为‘红娘子’‘Hongniangzi’和‘白沙’‘Baisha’,试验时期为2008-2013年。枇杷黄毛虫成虫采用频振式测报灯进行逐日诱集,每年开灯时间为4月1日至9月30日,历时约183 d,幼虫隔3 d左右田间调查1次,选取样树5株进行调查,树冠按东南西北划分4个方位,各个方位分上层、中层、下层等3层,将样树划分为12个资源单位,选取新梢枝条1枝·资源单位-1,记载各枝条上的幼虫数量。统计、记录每天诱捕的黄毛虫成虫数量及每周田间查见的黄毛虫幼虫,进行系统监测。
-
利用2008-2013年枇杷黄毛虫在余杭区塘栖镇监测的系统历史资料,将前5 a的诱虫数据、田间系统调查数据和气象资料用来建模,应用SPSS 17.0软件,采取逐步回归分析方法[10],建立发生期和发生量的预测预报模型,最后1 a的资料用来检验。原始调查数据不作任何转换,所用气象资料由杭州市气象局提供。
-
将2014年的实况资料,应用唐启义等[11]提出的病虫测报应验程度判定模式进行验证,从而判断组建模型的可行性。发生期预报应验程度判定模式:
$${{T}_{s}}={{100}_{e}}^{\frac{-\pi }{\ln t}{{\left( \frac{{{a}_{1}}-{{a}_{2}}}{\delta } \right)}^{2}}}。$$ 发生量预报应验程度判定模式:
$${{D}_{s}}=100e\frac{-2a\pi }{\left( a+{{a}_{1}} \right)\ln t}\bullet \left( \frac{{{a}_{1}}-{{a}_{2}}}{\delta } \right)。$$ 其中:Ts和Ds分别为发生期和发生量判定模式的分值,Ts和Ds<40表明预报不准确,40≤Ts和Ds< 60表明预报比较准确,Ts和Ds≥60表明预报准确;a为预报对象常年平均值,a1为实测值,a2为预测值;δ为预报对象常年标准差,t 为自预报发出至实际发生时的期距(d)。
-
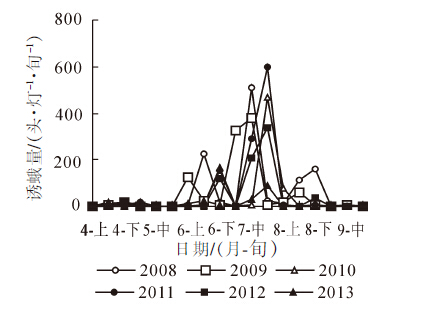
2008-2013年枇杷黄毛虫灯下成虫诱集量监测结果(图 1)显示:2008年以来,枇杷黄毛虫种群动态特征和数量结构发生了一定的变化:一是越冬代成虫始见期年度间差异较大,其中2008年、2009年和2013年成虫始见期较早,均为4月中旬,以2013年最早(4月14日),2010-2012年相对较迟。二是主害代灯下成虫峰期时间、蛾量年度间有差异,总体均以第3代峰期诱蛾量最高,其次为第2代;峰期持续时间、蛾量受当年气候等条件的影响呈相应的变化,2008年和2009年于7月中旬出现全年诱蛾最高峰,2010-2013年诱蛾最高峰出现在7月下旬;主害期危害程度年度间差异大,2011年7月下旬诱蛾量596头·灯-1·旬-1,与历年同期比第3代成虫峰期蛾量明显偏高,占全年诱集总量的55.18%,2013年7月高峰期蛾量为87头·灯-1·旬-1,明显低于历年同期,分析其原因可能与当年夏季出现罕见高温干旱天气,不利于枇杷黄毛虫生长发育有关。有研究表明:气候较为暖湿的条件下成虫产卵量多、幼虫发生量大[6],低于20 ℃和高于32 ℃的温度条件下对枇杷黄毛虫世代存活率不利[12],7月和8月干旱对黄毛虫的发生有抑制作用[6],也印证了这个可能性;第4代成虫诱集量普遍下降较快,可能与第3代幼虫发生期正值高温天气、成虫在高温下产卵少、卵孵化率下降使幼虫虫量不高有关。
-
2008-2013年田间幼虫系统调查(图 2)结果表明:年度间枇杷黄毛虫均以第2代幼虫危害最重,发生期为6月中下旬至7月上旬,高峰期主要出现在6月下旬,少数年份持续至7月上旬危害重,第2代幼虫期正值枇杷成熟阶段,除叶、芽外,果实也受害,对枇杷生产影响最大,2008-2013年高峰期平均虫量140.0~188.9头·株-1·旬-1,占全年总量的32.57%~47.23%。第1代幼虫发生期为5月上旬至6月上旬,高峰期主要出现在5月中旬,少数年份推迟至5月下旬,峰期平均虫量30.6~95.0头·株-1·旬-1,以2008年最高,2013年虫量最低。第3代幼虫发生于7月下旬至8月中旬,此时正值1 a中气温最高、雨水相对较少的季节,特别是2013年为持续高温干旱的年份,成虫产卵少,卵存活率低,发生期总虫量及高峰期虫量均下降,年度间发生量差别较大,2008年高峰期虫量49.0头·株-1·旬-1,高于其他年份,而2013年由于持续高温干旱,虫量明显低于其他年份。第4代幼虫田间查见幼虫较少,与前几代次比虫量下降较快,9月中旬后,幼虫陆续化蛹越冬。
-
枇杷黄毛虫主要以幼虫啃食幼芽、叶片、嫩茎表皮和果实等,对产量和品质影响大。为开展枇杷黄毛虫的适期防治,加强危害风险监测,以第1代至第3代幼虫发生高峰期(y1,y2,y3)和高峰期发生量(y4,y5,y6)为预报对象,初选前期灯下诱蛾量、田间幼虫密度等虫情基数因子及上年12月至当年1月、4月至9月每旬平均气温、平均相对湿度、降水量等相关性较大的气象因子共56个指标作为预报因子,采用逐步回归分析,建立预测预报模型。结果表明:枇杷黄毛虫幼虫发生高峰期、高峰期虫量与前期虫口基数、气象因子密切相关,各有15个因子入选预测模型(表 1和表 2)。发生期预测模型表明:前期田间幼虫虫口密度、降水量对发生高峰期影响最大,各有5个因子入选预测模型,前期灯下诱蛾量、平均相对湿度、气温等也有一定的影响。发生量预测模型表明:枇杷黄毛虫第1代至第3代幼虫旬高峰期虫量与前期田间幼虫密度、灯下诱蛾量呈显著正相关,气象因子中平均相对湿度和降水量分别有5个和4个因子入选预测模型,气温因子中5月下旬、6月上旬、7月上旬平均气温也作为预测因子入选发生量预测模型。
表 1 枇杷黄毛虫发生期预测因子历史数据
Table 1. Predictive factors for occurrence period of Melanographia flexilineata
年 份 x2 x5 x9 x10 x12 x20 x21 x22 x28 x31 x38 x40 x43 x46 x53 2008 15 77 91.7 15.8 27.5 28 8 3 9.4 66.6 157 22 508 84.7 60.2 2009 20 61.3 36.3 19.2 50.7 9 11 48 31.4 35.8 148 14 380 74.2 0 2010 2 69.5 37.1 12.7 70.6 61 40 9 24.9 24.7 43 15 5 84.2 173.9 2011 5 60.6 68 16.9 16.3 36 25 8 33.8 29.4 165.9 14 289 75 42 2012 19 64.8 148.5 17.8 30.1 25.5 10 9 36 105.3 188.9 9 210 83.3 37.8 2013 3 69.3 23 18.6 12 24.5 8.1 6 53.9 9.9 106.5 5 29 79.7 0 x2,x43分别为4月下旬、7月中旬诱蛾量(头·灯-1·旬-1);x20,x21,x22,x38,x40分别为5月下旬、6月上旬、6月中旬、6月下旬、7月下旬幼虫量(头·株-1·旬-1);x5,x46分别为上年12月、当年6月下旬相对湿度(%);x10为4月中旬气温(℃);x9,x12,x28,x31,x53分别为1月、4月中旬、5月中旬、5月下旬、7月中旬降水量(mm)。 表 2 枇杷黄毛虫发生量预测因子历史数据
Table 2. Predictive factors for occurrence quantity of Melanographia flexilineata
年 份 x5 x9 x11 x14 x17 x20 x27 x29 x31 x32 x40 x42 x48 x50 x53 2008 77 91.7 78.7 57.1 64.6 28 54.4 25.3 66.6 24.2 22 0 30.8 26.9 60.2 2009 61.3 36.3 75.8 53.2 49.8 9 60.6 22.6 35.8 24.8 14 328 29.1 58.1 0 2010 69.5 37.1 80.3 60.4 61.3 61 76 22.3 24.7 21.8 15 0 28.9 38.4 173.9 2011 60.6 68 60.1 57.9 63.7 36 52.5 20.8 29.4 24.2 14 0 30.8 2.4 42 2012 64.8 148.5 72.7 66.4 66.3 25.5 70.6 21.1 105.3 24.1 9 0 31.7 15.1 37.8 2013 69.3 23 49 63.7 70.4 24.5 70.1 25.4 9.9 22.9 5 0 31.6 1.5 0 x5,x11,x14,x17,x27分别为上年12月、当年4月中旬、4月下旬、5月上旬、5月中旬相对湿度(%);x9,x31,x50,x53分别为1月、5月下旬、7月上旬、7月中旬降水量(mm);x29,x32,x48分别为5月下旬、6月上旬、7月上旬气温(℃);x20,x40分别为5月下旬、7月下旬幼虫量(头·株-1·旬-1);x42为7月上旬诱蛾量(头·灯-1·旬-1)。 表 3 枇杷黄毛虫发生期、发生量预测模型
Table 3. Forecasting model for occurrence quantity and period of Melanographia flexilineata
模型编号 预测模型 R2 1 y1=19.146+0.007x2-0.067 x5 -0.034 x9-0.486 x10+0.028 x12 1.000** 2 y2=-90.562+0.190 x5+0.142 x9+1.119 x11-0.044 x14+0.749 x17 1.000** 3 y3=3.005+0.245 x20+0.005 x21+0.085 x22-0.086 x28+0.010 x31 1.000** 4 y4=389.386+0.238 x20-1.230 x27-7.494 x29 +0.539 x31-0.763 x32 1.000** 5 y5= 34.876-0.139 x38-0.028 x40-0.004 x43-0.048 x46-0.043 x53 1.000** 6 y6=-492.071+2.252 x40+0.010 x42+15.380 x48-0.525 x50+0.061 x53 1.000** y1为第1代幼虫发生高峰期(5月15日为1);y2为第2代幼虫发生高峰期(6月21日为1);y3为第3代幼虫发生高峰期(8月1日为1);y4为第1代幼虫高峰期发生量(头);y5为第2代幼虫高峰期发生量(头);y6为第3代幼虫高峰期发生量(头)。 -
将2013年的虫情、气象数据,应用1.4节的应验程度判定模式,分别对枇杷黄毛虫第1代至第3代幼虫的发生高峰期、高峰期发生量预测结果进行检验(表 4和表 5)。结果表明:用逐步回归法拟合的枇杷黄毛虫幼虫发生期、发生量模型,评分分值高,均大于99分,在准确的范围内。根据模拟结果,第1代、第2代和第3代枇杷黄毛虫幼虫发生高峰期模型拟合值分别为5月19日、6月25日、8月16日,实际分别为5月19日、6月25日、8月16日;第1代、第2代和第3代幼虫高峰期发生量模型拟合值分别为30.62,106.28和5.83头·株-1·旬-1,实际分别为31,107和6头·株-1·旬-1。模型拟合值接近实测值,拟合结果准确。
表 4 枇杷黄毛虫发生期预测模型验证
Table 4. Verification of forecastin model for occurrence period of Melanographia flexilineata
预测对象 a1 a2 t δ Ts 结论 第1代幼虫 5 5.04 10 2.11 99.95 准确 第2代幼虫 5 5.02 5 3.77 99.99 准确 第3代幼虫 16 15.99 15 5.81 100 准确 表 5 枇杷黄毛虫发生量预测模型验证
Table 5. Verification of forecastin model for occurrence quantity of Melanographia flexilineata
预测对象 a a1 a2 t δ Ts 结论 第1代幼虫 53.75 31 30.62 10 15.03 100 准确 第2代幼虫 152.55 107 106.28 5 26.27 99.98 准确 第3代幼虫 22.67 6 5.83 15 13.22 99.97 准确 -
本研究对枇杷黄毛虫进行了灯下诱蛾及田间幼虫系统调查。结果表明:枇杷黄毛虫在浙江余杭塘栖田间虫量与越冬期温湿度条件、主害代前期虫口基数及气候条件等密切相关,灯下诱蛾年度间总虫量2008年和2011年最高,2013年明显低于历年同期,与当年夏季持续高温干旱、不利于枇杷黄毛虫生长发育有关。田间幼虫量也呈现出相似的趋性,以2011年最高,2013年最低。关于枇杷黄毛虫在中国南方枇杷产区的每年发生代数、种群动态等,国内相关文献主要为福建[3, 5]、浙江[6-7, 12]等地的调查研究,在福建福州1 a发生5代[5],上海地区1 a发生3代[13]。本研究表明枇杷黄毛虫在余杭塘栖1 a发生4代,与前人报道一致[6-7],越冬代成虫始见期2008-2013年在4月中旬至下旬(4月14日至4月29日),2008年、2009年、2013年较早,2010-2012年相对较迟,与王恩等[6]的研究结果较一致(4月20日),比何富泉等[7]报道的(5月上旬)约早15~20 d。塘栖枇杷黄毛虫田间幼虫量年度间均以第2代危害最重,发生高峰期主要出现在6月下旬,少数年份推迟至7月上旬,主害代灯下成虫峰期时间、蛾量年度间有差异,总体均以第3代峰期诱蛾量最高,其次为第2代,第4代灯下成虫与田间幼虫量均下降较快,9月中旬后,幼虫陆续在树皮裂缝中、分枝处或树干基部和附近灌木上吐丝、结茧、化蛹越冬。
-
本研究对枇杷黄毛虫发生的相关因素进行了调查和统计分析,筛选出发生期和发生量各15个因子,建立了种群动态预测模型,为预测各代次枇杷黄毛虫的发生高峰、开展适期防治提供了依据。枇杷黄毛虫发生高峰期受前期田间幼虫虫口密度、降水量影响最大;田间幼虫高峰期发生量与前期虫口基数呈极显著正相关,是枇杷黄毛虫发生的最重要因素,平均相对湿度、降水量、气温等气象因子也有一定的相关性,春夏气候较为暖湿的年份,成虫产卵量多,第1代和第2代幼虫田间发生量大,气温过高则卵孵化率、幼虫存活率下降[12],特别是2013年夏季高温干旱对黄毛虫的发生有抑制作用,而比较暖湿的季节有利于黄毛虫发生。本研究引入了多年来枇杷黄毛虫发生期每旬平均气温、相对湿度、降水量等气象因子及前期虫口基数进行建模,应用唐启义等[11]提出的应验程度判定模式进行拟合率检验,评分分值均在90以上,模型拟合值与实测值接近,拟合结果准确,对今后枇杷黄毛虫的适时、准确预报具有一定的实用价值,可供杭州地区及气象等环境条件总体较为相似的地区应用。
-
建立枇杷黄毛虫种群动态模型的目的是为了预测预报更为适时准确、更有效地为生产服务,以减少因该虫危害造成的损失。枇杷黄毛虫年度间发生期和发生量受当年气候条件等因素影响,在每年发生盛期内又呈季节性消长,采用多年数据建立种群动态模型可实行较准确的预测。本模型主要依据2008年以来的数据资料,为更充分地显现其年度间的周期性规律,增强预报结果的准确性,笔者将逐年追加监测资料,使样本总数增多,校正模型,使预测精度不断提高,更好地服务于生产实际。
Quantitative population characteristics and a prediction model for Melanographia flexilineata from Tangqi, Zhejiang
-
摘要: 采用灯下诱蛾和田间幼虫系统调查相结合的方法,研究枇杷黄毛虫Melanographia flexilineata种群数量特征和消长动态,并建立其发生趋势预测模型。结果表明:2008-2013年灯下诱蛾越冬代成虫始见期在4月中旬至下旬(4月14日至29日),其中2010-2012年相对较迟,峰期持续时间、蛾量受当年气候等条件的影响呈相应的变化,2008年和2011年为最高峰期虫量,2013年明显低于历年同期;田间幼虫发生量也呈现出相似的趋势,年度间均以第2代幼虫危害最重,峰期主要出现在6月下旬,少数年份推迟至7月上旬,第4代灯下成虫与田间幼虫量均下降较快。在此基础上,以枇杷黄毛虫的田间系统监测资料及气温、相对湿度、降水量等气象因素作为预测因子,采用逐步回归分析法,筛选出了具有显著回归影响的24个因子进入回归模型,建立了第1代至第3代枇杷黄毛虫发生期和发生量预测模型,其中影响枇杷黄毛虫种群数量消长的关键因子为种群基数和降水量、气温和相对湿度。经检验,各代次发生期、发生量预测模型均达到99分以上的历史符合率和预测准确度,模型拟合值与实测值相符,能准确地预测出其发生量和发生高峰期。Abstract: To improve the forecasting and sustained prevention level of Melanographia flexilineata, population dynamics and quantitative characteristics were observed, then a forecast model was established by method of lamplight moth-trapping and a systematic larvae investigation from 2008-2013. Then, based on monitoring data including insect population and weather factors, such as temperature, humidity, and precipitation, a mathematical prediction model for quantity of occurrence and period of the 1st to 3rd generation of M. flexilineata was established using stepwise regression. Results by lamplight moth-trapping showed that the start for overwintering adult trappings was from middle to late April (from April 14th to 29th), but it was relatively late from 2010-2012 in contrast to other years. The peak period and quantity were affected by environmental factors such as climate, which led to peak quantities in 2008 and 2011 but a low ebb in 2013. Population dynamics of the larvae were similar trends with the 2nd generation causing the extremely serious harm; larval peak period occurred in late June but seldom in early July. The fourth-generation quantity of moth and larvae decreased rapidly. Based on the monitoring data collected from 2008 to 2013 including insect quantity and weather factors, the prediction mathematical models of occurrence quantity and period for the pest were established using the method of stepwise regression. Twenty-four factors which had a significant effect (P<0.05 or 0.01) on the regression forecasting model were screened out. Among them, population cardinal number, precipitation, humidity, and temperature were the key factors influencing pest population dynamics. Predicted values agreed well with measured values by inspection and application with the scores which could reflect the historical coincident rate and prediction accuracy of these models being over 99. Thus, this model could accurately predict the quantity and period of occurrence for M. flexilineata. The established prediction technique in this paper was signality to the accurate prediction and scientific prevention of M. flexilineata, which provided scientific basis for supervisors in production.
-
表 1 枇杷黄毛虫发生期预测因子历史数据
Table 1. Predictive factors for occurrence period of Melanographia flexilineata
年 份 x2 x5 x9 x10 x12 x20 x21 x22 x28 x31 x38 x40 x43 x46 x53 2008 15 77 91.7 15.8 27.5 28 8 3 9.4 66.6 157 22 508 84.7 60.2 2009 20 61.3 36.3 19.2 50.7 9 11 48 31.4 35.8 148 14 380 74.2 0 2010 2 69.5 37.1 12.7 70.6 61 40 9 24.9 24.7 43 15 5 84.2 173.9 2011 5 60.6 68 16.9 16.3 36 25 8 33.8 29.4 165.9 14 289 75 42 2012 19 64.8 148.5 17.8 30.1 25.5 10 9 36 105.3 188.9 9 210 83.3 37.8 2013 3 69.3 23 18.6 12 24.5 8.1 6 53.9 9.9 106.5 5 29 79.7 0 x2,x43分别为4月下旬、7月中旬诱蛾量(头·灯-1·旬-1);x20,x21,x22,x38,x40分别为5月下旬、6月上旬、6月中旬、6月下旬、7月下旬幼虫量(头·株-1·旬-1);x5,x46分别为上年12月、当年6月下旬相对湿度(%);x10为4月中旬气温(℃);x9,x12,x28,x31,x53分别为1月、4月中旬、5月中旬、5月下旬、7月中旬降水量(mm)。 表 2 枇杷黄毛虫发生量预测因子历史数据
Table 2. Predictive factors for occurrence quantity of Melanographia flexilineata
年 份 x5 x9 x11 x14 x17 x20 x27 x29 x31 x32 x40 x42 x48 x50 x53 2008 77 91.7 78.7 57.1 64.6 28 54.4 25.3 66.6 24.2 22 0 30.8 26.9 60.2 2009 61.3 36.3 75.8 53.2 49.8 9 60.6 22.6 35.8 24.8 14 328 29.1 58.1 0 2010 69.5 37.1 80.3 60.4 61.3 61 76 22.3 24.7 21.8 15 0 28.9 38.4 173.9 2011 60.6 68 60.1 57.9 63.7 36 52.5 20.8 29.4 24.2 14 0 30.8 2.4 42 2012 64.8 148.5 72.7 66.4 66.3 25.5 70.6 21.1 105.3 24.1 9 0 31.7 15.1 37.8 2013 69.3 23 49 63.7 70.4 24.5 70.1 25.4 9.9 22.9 5 0 31.6 1.5 0 x5,x11,x14,x17,x27分别为上年12月、当年4月中旬、4月下旬、5月上旬、5月中旬相对湿度(%);x9,x31,x50,x53分别为1月、5月下旬、7月上旬、7月中旬降水量(mm);x29,x32,x48分别为5月下旬、6月上旬、7月上旬气温(℃);x20,x40分别为5月下旬、7月下旬幼虫量(头·株-1·旬-1);x42为7月上旬诱蛾量(头·灯-1·旬-1)。 表 3 枇杷黄毛虫发生期、发生量预测模型
Table 3. Forecasting model for occurrence quantity and period of Melanographia flexilineata
模型编号 预测模型 R2 1 y1=19.146+0.007x2-0.067 x5 -0.034 x9-0.486 x10+0.028 x12 1.000** 2 y2=-90.562+0.190 x5+0.142 x9+1.119 x11-0.044 x14+0.749 x17 1.000** 3 y3=3.005+0.245 x20+0.005 x21+0.085 x22-0.086 x28+0.010 x31 1.000** 4 y4=389.386+0.238 x20-1.230 x27-7.494 x29 +0.539 x31-0.763 x32 1.000** 5 y5= 34.876-0.139 x38-0.028 x40-0.004 x43-0.048 x46-0.043 x53 1.000** 6 y6=-492.071+2.252 x40+0.010 x42+15.380 x48-0.525 x50+0.061 x53 1.000** y1为第1代幼虫发生高峰期(5月15日为1);y2为第2代幼虫发生高峰期(6月21日为1);y3为第3代幼虫发生高峰期(8月1日为1);y4为第1代幼虫高峰期发生量(头);y5为第2代幼虫高峰期发生量(头);y6为第3代幼虫高峰期发生量(头)。 表 4 枇杷黄毛虫发生期预测模型验证
Table 4. Verification of forecastin model for occurrence period of Melanographia flexilineata
预测对象 a1 a2 t δ Ts 结论 第1代幼虫 5 5.04 10 2.11 99.95 准确 第2代幼虫 5 5.02 5 3.77 99.99 准确 第3代幼虫 16 15.99 15 5.81 100 准确 表 5 枇杷黄毛虫发生量预测模型验证
Table 5. Verification of forecastin model for occurrence quantity of Melanographia flexilineata
预测对象 a a1 a2 t δ Ts 结论 第1代幼虫 53.75 31 30.62 10 15.03 100 准确 第2代幼虫 152.55 107 106.28 5 26.27 99.98 准确 第3代幼虫 22.67 6 5.83 15 13.22 99.97 准确 -
[1] 陈福如,陈元洪,杨秀娟,等. 枇杷害虫发生与防治技术研究[J]. 华东昆虫学报,2003,12(1):66-70. CHEN Furu, CHEN Yuanhong, YANG Xiujuan, et al. The occurrence and control technology of insect pests of Eriobotrya japonica[J]. Entomol J East China, 2003, 12(1):66-70. [2] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 19908-2005地理标志产品:塘栖枇杷[S]. 北京:中国标准出版社,2005. [3] 傅丽君. 农药对枇杷园生态系的影响与主要害虫生态控制研究[D]. 福州:福建农林大学,2005. FU Lijun. Effect of Pesticide on Loquat Orchard Ecosystem and Ecological Control of Major Pests[D]. Fuzhou:Fujian Agriculture and Forestry University, 2005. [4] 徐凯,魏胜林,管良明. 8种杀虫剂防治枇杷瘤蛾的药效试验[J]. 农药,1997,36(10):37. XU Kai, WEI Shenglin, GUAN Liangming. The control effects of 8 insecticides to Melanographia flexilineata Hampson[J]. Pesticides, 1997, 36(10):37. [5] 罗佳,谢嫦,谢慧峰,等. 枇杷食叶害虫调查及枇杷黄毛虫室内药效试验[J]. 亚热带植物科学,2007,36(3):27-30. LUO Jia, XIE Chang, XIE Huifeng, et al. Defoliating insects of loquat and the efficacy trials of Melanographia flexilineata in the laboratory[J]. Subtrop Plant Sci, 2007, 36(3):27-30. [6] 王恩,李学骝,钟梅兴,等. 枇杷瘤蛾若干生物学特性的观察[J]. 植物保护,1990(增刊1):36-37. WANG En, LI Xueliu, ZHONG Meixing, et al. Observation on some biological characteristics of Melanographia flexilineata[J]. Plant Prot, 1990(supp 1):36-37. [7] 何富泉,蒋水荣, 吴学素,等. 枇杷瘤蛾生活史的观察[J]. 中国果树,1988(1):43-44. HE Fuquan, JIANG Shuirong, WU Xuesu, et al. Observation on life history of Metanographia flexilineata[J]. China Fruits, 1988(1):43-44. [8] 刘东泽,赵杰,刘志诚,等. 20种植物提取物对几种昆虫的拒食作用[J]. 农药学学报,2003,5(3):89-93. LIU Dongze, ZHAO Jie, LIU Zhicheng, et al. Studies on antifeedant activity of 20 plant crude extracts against several pest insects[J]. Chin J Pest Sci, 2003, 5(3):89-93. [9] 邱良妙,占志雄,郑琼华,等. 枇杷园生态系统节肢动物群落特征研究[J]. 江西农业大学学报,2004, 26(3):458-460. QIU Liangmiao, ZHAN Zhixiong, ZHENG Qionghua, et al. A study on arthropod community in Eriobotrya japonica orchard[J]. Acta Agric Univ Jiangxi, 2004, 26(3):458-460. [10] 王道泽,洪文英,吴燕君,等. 杭州地区地下害虫成虫发生规律及其预测模型研究[J]. 浙江农业学报,2012,24(6):1050-1057. WANG Daoze, HONG Wenying, WU Yanjun, et al. Study on the occurrence regularity and prediction model of underground pest adults in Hangzhou District[J]. Acta Agric Zhejiang, 2012, 24(6):1050-1057. [11] 唐启义,李绍石. 病虫测报应验程度判定模式[J]. 病虫测报,1988,8(1):1-5. TANG Qiyi, LI Shaoshi. Response determination model of pest forecasting[J]. China Plant Prot, 1988, 8(1):1-5. [12] 王恩,李学骝. 温度对枇杷瘤蛾生长发育的影响[J]. 中国果树,1992(2):26-28. WANG En, LI Xueliu. Effects of temperature on Metanographia flexilineata growth and development[J]. China Fruits, 1992(2):26-28. [13] 张秀龙,孙兴全,夏如铁,等. 枇杷黄毛虫生物学特性及其防治[J]. 上海交通大学学报:农业科学版,2003,21(3):242-245. ZHANG Xiulong, SUN Xingquan, XIA Rutie, et al. Bionomics and control of Selepa celtis Moore[J]. J Shanghai Jiaotong Univ Agric Sci, 2003, 21(3):242-245. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2016.04.022







 下载:
下载: