-
生态化学计量学己成为连接分子、细胞、种群、群落和生态系统等不同尺度生物学的新工具[1]。生态化学计量学也在消费者驱动的养分循环、限制性养分元素判别以及全球碳、氮、磷循环等方面发挥重要作用[2]。氮、磷是陆地生态系统中限制植物生长最普遍的2种元素[3-4],对植物各种功能起着非常重要的作用[5],而碳氮比、碳磷比、氮磷比化学计量特征可以为生态系统中营养结构变化[6]、生物多样性和生物地球化学循环研究提供基本依据。森林凋落叶是土壤动物、微生物的重要物质和能量来源,也是土壤养分循环的重要参与者[7]。有90%以上植被的氮、磷养分通过凋落叶向土壤归还[8]。根系不仅是植物固定和机械支持的器官,也在水分和养分吸收、同化物分配方面至关重要[9]。中国人工林面积居世界之首,因林分结构单一、培育措施不健全导致生物多样性较低和林分生产力下降等问题日益严重[10]。目前,国内外已经开展了大量有关人工林植物和土壤的生态化学计量特征研究,主要是探究不同森林类型、区域、演替阶段的植物叶片、凋落叶、土壤单独或者两两甚至是三者耦合的生态化学计量特征[11-14]。但是,根系作为连接地上部分和地下部分重要的植物器官,往往被忽略重要性,大部分是凋落叶-土壤的研究[15-16]。目前,凋落叶-根系-土壤三者的耦合在国内已在杉木Cunninghamia lanceolata中被研究[17]。研究不同林分凋落叶-根-土生态化学计量特征,有助于全面、系统地了解森林生态系统养分循环规律,对当地的土壤养分和林分健康状况具有指导意义。红锥Castanopsis hystrix是中国南亚热带重要的乡土树种,速生树种,也是优良的家具用材。关于红锥的生态化学计量已有报道,但多集中在枝叶[18]、土壤[19]等。乐昌含笑Michelia chapensis是木兰科Magnoliaceae含笑属Michelia植物,具有很高的经济价值,是南方重要的阔叶树种,种子含有丰富的油脂,且人体中必须的亚油酸含量高达64.53%[20]。已有学者在乐昌含笑不同植物器官的养分含量[21]、土壤养分特征[22]等方面做了相关研究。有关南亚热带次生林和人工林凋落叶-根系-土壤的碳、氮、磷含量和生态化学计量特征的研究较少。本研究以粤北乐昌市龙山林场为研究区,对红锥林、乐昌含笑林和次生林为研究对象,通过对不同林分养分质量分数及化学计量的定量比较,分析人工林和次生林在养分分布方面的异同点及其诱因,掌握养分现状和变化规律及其在不同部位的存在情况,为该地区的林分经营提供理论依据。
-
研究区位于广东省乐昌市(24°57′~25°31′N,112°51′~113°34′E)龙山林场,该区属中亚热带季风气候,主要为流水地貌和岩溶地貌。年平均气温为19.9 ℃,无霜期约300.0 d,雨水丰沛,年平均降水量为1 460.0 mm。土壤类型为红壤土,偏酸性。在2018年3月选取红锥林、乐昌含笑林和次生林3种林分,每种林分3个重复,海拔高度和坡面基本一致,样地面积为20 m × 30 m。
红锥林林下植被灌木层主要有红锥、杉木、深山含笑Michelia maudiae;草本层主要有石楠藤Piper wallichii、阔片短肠蕨Allantodia matthewii、扇叶铁线蕨Adiantum flabellulatum。乐昌含笑林林下植被灌木层主要有石楠藤、粗叶榕Ficus hirta、杜茎山Maesa japonica、常山Dichroa febrifuga;草本层主要有华山姜Alpinia chinensis、火炭母Polygonum chinense、柳叶箬Isachne globosa。次生林乔木层主要有润楠Machilus pingii、木荷Schima superba、酸枣Ziziphus jujube var. spinosa、新木姜子Neolitsea aurata、鹅掌柴Schefflera octophylla;林下植被灌木层主要有石楠藤、爬藤榕Ficus sarmentosa var. impressa、草珊瑚Sarcandra glabra、小叶女贞Ligustrum quihoui;草本层主要有石楠藤、华山姜、草珊瑚、小叶女贞。
表 1 不同林分乔木层基本情况
Table 1. Basic conditions of arbor layers in different forest stands
林分 树高/m 胸径/cm 密度/(株·hm-2) 枝下高/m 郁闭度 海拔/m 红锥林 12.49 ± 0.91 17.44 ± 1.77 706.00 ± 48.95 6.65 ± 1.30 0.83 ± 0.09 366.00 ± 28.44 乐昌含笑林 9.66 ± 1.98 14.20 ± 2.68 978.00 ± 127.33 4.27 ± 1.31 0.80 ± 0.08 284.33 ± 52.64 次生林 8.83 ± 0.46 11.54 ± 0.48 1 419.50 ± 71.85 4.83 ± 0.39 0.70 ± 0.05 353.33 ± 26.16 说明:数值为平均值±标准误 表 2 不同林分土壤(0~20cm)的理化性质
Table 2. Soil physical and chemical properties of different forest stands
林分 pH 有机质/
(g·kg-1)阳离子交换量/(emol·kg-1) 容重/
(g·cm-3)含水量/
(g·kg-1)毛管孔隙度/
%总孔隙度/% 田间持水量/
(g·kg-1)红锥林 4.18±0.10 38.40±3.13 14.22±4.49 1.01±0.10 446.67±73.04 57.19±4.64 64.66±2.86 544.24±99.00 乐昌含笑林 4.26±0.05 29.74±1.39 10.57±5.60 1.13±0.09 346.04±49.85 51.41±3.16 56.69±2.94 431.56±53.86 次生林 4.37±0.07 33.89±3.10 6.98±1.31 1.34±0.11 243.45±34.39 39.97±2.07 45.33±2.06 258.77±43.49 说明:数值为平均值±标准误 -
在每个样地内按照“梅花”五点法设置凋落物收集框,收集框规格由孔径1 mm的尼龙网布制成,上端1 m × 1 m,下端距离地面0.25 m,用聚氯乙烯(PVC)管固定在泥土中的容器。根系和土壤样品均采用6 cm根钻及“梅花”五点取样法采集:根系用钻土芯法在样地内采集0~20土层的所有根系,土壤的采样也采用“梅花”五点取样法用直径6 cm的根钻采集0~20 cm土层的土壤,编号保存带回实验室。凋落叶放入烘箱中70 ℃烘至恒量,研磨过40目筛,用于全碳、全氮、全磷养分分析。带有根系的土壤用40目的网筛在流水下冲洗,收集所有根系,未分级。土壤一部分用于测量物理性质,另一部分过60目筛,用于测定全碳、全氮、全磷养分。
-
依据《土壤农化分析》[23]对植物和土壤进行元素全碳、全氮、全磷质量分数的检测。植物、土壤有机碳采用重铬酸钾-外加热法测定;植物全氮、全磷采用浓硫酸-过氧化氢(H2SO4-H2O2)消煮法,消解后的待测液供全氮、全磷的测定,其中全氮采用蒸馏滴定法测定,全磷采用钒钼黄比色法测定;土壤全氮、全磷分别采用开氏-蒸馏滴定法和氢氧化钠融熔-钼锑抗比色法。数据为平均值±标准误。
-
用Excel 2007进行数据记录与整理,SPSS 19.0进行数据分析。对3种林分优势树种进行正态检验,不符合正态分布的数据进行对数转换,使之符合正态分布,再检验方差齐性。对样品全碳、全氮、全磷以及碳氮比、碳磷比、氮磷比采用单因素方差分析(one-way ANOVA)的最小显著(LSD)法进行差异性检验,利用Pearson相关性分析和回归分析对样品碳氮比、碳磷比、氮磷比进行相关性分析和线性回归,用Origin 9.1作图。
-
由表 3可知:红锥林全碳、全氮质量分数在凋落叶、根系和土壤中差异均显著(P<0.05),而全磷质量分数无显著性差异(P>0.05);乐昌含笑林全碳质量分数在凋落叶、根系和土壤中均存在显著差异(P<0.05);次生林全碳、全氮、全磷质量分数在凋落叶、根系和土壤中均为差异显著(P<0.05)。凋落叶中的全碳和全磷质量分数在3种林分间均无显著性差异(P>0.05);3种林分的凋落叶、根系和土壤的全碳质量分数均为根系>凋落叶>土壤;而全氮质量分数则均为凋落叶>根系>土壤;红锥林和次生林的全磷质量分数均为凋落叶>根系>土壤,而乐昌含笑的全磷质量分数则为根系>凋落叶>土壤。对于全碳质量分数,3种凋落叶的全碳为乐昌含笑林>次生林>红锥林,根系和土壤中的全碳则分别表现为次生林>乐昌含笑>红锥林和红锥林>次生林>乐昌含笑;对于全氮质量分数,乐昌含笑林的凋落叶和根系无显著差异(P>0.05),而红锥林和次生林差异显著(P<0.05);凋落叶和土壤中的全氮质量分数均为红锥林>次生林>乐昌含笑林,根系中全氮质量分数大小为乐昌含笑林>次生林>红锥林人工林;对于全磷质量分数,凋落叶中的全磷为次生林>红锥林>乐昌含笑林,根系中的全磷为乐昌含笑林>次生林>红锥林,土壤中的全磷为红锥林>乐昌含笑和次生林。
表 3 3种林分凋落叶-根系-土壤的全碳、全氮、全磷质量分数
Table 3. C, N and P contents of litter-root-soil of three forest stands
林分类型 全碳/(mg·g-1) 全氮/(mg·g-1) 全磷/(mg·g-1) 凋落叶 根系 土壤 凋落叶 根系 土壤 凋落叶 根系 土壤 红锥林 445.22+4.23 465.10+2.81 38.40+3.13 10.60+0.30 5.67+0.33 1.56+0.09 0.39+0.03 0.37+0.04 0.38+0.02 Ba Ca Ab Cb Ba Ab Aa Aa Ab 乐昌含笑林 463.76+6.23 484.18+9.47 29.74+1.39 9.08+0.28 8.86+0.97 1.21+0.05 0.38+0.02 0.54+0.07 0.27+0.02 Ba Cab Aa Ba Bb Aa Aa Bb Aa 次生林 455.80+7.98 486.81+6.65 33.89+3.00 10.37+0.54 7.48+0.36 1.44+0.10 0.45+0.03 0.37+0.02 0.27+0.01 Ba Cb Aab Cb Bab Aab Ca Ba Aa 说明:不同大写字母表示同一林分不同组分间差异显著, 不同小写字母表示相同组分不同林分间差异显著(P < 0.05) -
由表 4可知:红锥林的碳氮比和氮磷比在凋落叶、根系和土壤中均差异显著(P<0.05),碳磷比在红锥林凋落叶与根系无显著差异(P>0.05),而在土壤与根系和凋落物之间显著性差异(P<0.05);乐昌含笑林的碳氮比和碳磷比在根系和凋落叶中差异不显著(P>0.05),而在土壤与根系和凋落物中差异显著(P<0.05),氮磷比在凋落叶、根系和土壤中均差异显著(P<0.05);次生林的碳氮比、碳磷比和氮磷比在凋落叶、根系和土壤中均差异显著(P<0.05)。碳氮比在3种林分中均为根系>凋落叶>土壤;碳磷比在红锥林和次生林中均为根系>凋落叶>土壤,而在乐昌含笑林中为凋落叶>根系>土壤;氮磷比在红锥林、乐昌含笑林和次生林中均为凋落叶>根系>土壤。土壤碳氮比在红锥林、乐昌含笑林和次生林中均值分别为24.48、24.60和23.41,且在3种林分间均为差异不显著(P>0.05);凋落叶、土壤和根系的碳磷比在3种林分间均为差异不显著(P>0.05);土壤氮磷比在红锥林、乐昌含笑林和次生林均值分别为4.19、4.95和5.39,且在3种林分间差异不显著(P>0.05),而凋落叶和根系氮磷比在3种林分间均为差异显著(P<0.05)。
表 4 3种林分凋落叶-根系-土壤的碳氮比、氮磷比、碳磷比
Table 4. C/N, N/P, C/P stoichiometry of three forest stands of litter-root-soil
林分 碳氮比 碳磷比 氮磷比 凋落叶 根系 土壤 凋落叶 根系 土壤 凋落叶 根系 土壤 红锥林 42.21+1.03 83.94+4.10 24.48+0.76 1 178.37+83.39 1 382.40+132.19 103.94+9.43 27.93+1.98 16.37+1.22 4.19+0.25 Ba Cb Aa Ba Ba Aa Cb Ba Aa 乐昌含笑林 51.51+1.87 62.52+9.61 24.60+1.05 1 239.61+467.34 1 145.32+235.05 118.08+12.94 23.99+0.67 17.66+1.25 4.95+0.70 Bb Ba Aa Ba Ba Aa Ca Bab Aa 次生林 45.20+3.18 66.19+2.91 23.41+0.77 1 071.28+102.14 1 330.84+52.26 126.83+9.62 23.44+40.95 20.17+0.45 5.39+0.31 Bab Ca Aa Ba Ca Aa Ca Bb Aa 说明:不同大写字母表示同一林分不同组分间差异显著, 不同小写字母表示相同组分不同林分间差异显著(P < 0.05) -
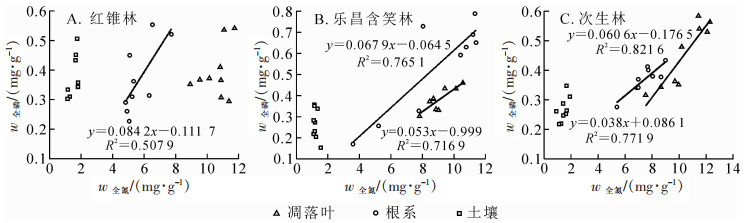
由图 1A可知:研究区域红锥林根系全氮和全磷质量分数呈显著正相关关系(R2=0.507 9,P<0.05),凋落叶与土壤的全氮和全磷相关不显著(R2=0.135 4,P>0.05;R2=0.274 7,P>0.05)。乐昌含笑林凋落叶和根系的全氮和全磷均极显著正相关(R2=0.716 9,P<0.01;R2=0.765 1,P<0.01)(图 1B)。次生林凋落叶和根系中的全氮和全磷也呈极显著正相关(R2=0.821 6,P<0.01;R2=0.771 9,P<0.01)(图 1C)。3种林分的土壤全氮和全磷质量分数相关性均不显著(P>0.05)。
图 1 3种林分凋落叶-根系-土壤全氮和全磷质量分数的相关关系
Figure 1. Correlations between N and P concentrations in litter-root-soil of three forest stands
经过对数转换,红锥林土壤碳氮比与氮磷比呈极显著正相关(R2=0.721 2,P<0.01),凋落叶和根系的碳氮比与氮磷比相关关系不显著(图 2A);凋落叶、根系和土壤三者的碳磷比与氮磷比均呈极显著正相关(R2=0.747 9,P<0.01;R2=0.893 6,P<0.01;R2=0.663 5,P<0.01)(图 3A)。乐昌含笑林和次生林凋落叶、根系和土壤的碳氮比与氮磷比相关关系均不明显(图 2B和图 2C),而碳磷比与氮磷比均呈显著正相关(R2=0.602 5,P<0.05;R2=0.527 6,P<0.05;R2=0.911 6,P<0.01)(图 3B)。次生林凋落叶和土壤碳磷比与氮磷比呈显著正相关(R2=0.676 4,P<0.05;R2=0.824 3,P<0.01)(图 3C)。
-
凋落叶养分作为土壤外来养分的主要来源,在植物生长过程中发挥着重要作用。凋落叶通过物理作用淋溶阶段和化学作用地下微生物的分解将有机物分解成无极小分子供给植物吸收。凋落叶养分与分解速率及初始养分含量有关,甚至通过新鲜叶片养分含量的转移影响凋落叶的养分含量,也可能与叶片形态和解剖结构有关。比如叶片厚度、气孔密度、叶肉细胞栅栏组织和海绵组织的层数及厚度等都会影响养分的分布情况。红锥林、乐昌含笑林和次生林3种林分凋落叶全氮、全磷质量分数均低于在全球尺度上研究的10.93和0.85 mg·g-1[24],但是全磷质量分数明显低于全球平均全磷。这可能与不同树种的生理生态特征以及当地的小气候等有关。凋落叶的全碳、全磷在3种林分间无显著差异,但红锥林凋落叶全氮质量分数明显高于含笑林和次生林,凋落叶作为植物和土壤养分之间的基本载体,说明红锥林在养分归还能力方面较含笑林和次生林强。
根系是植物吸收氮、磷等养分的重要器官[25]。VOGT等[26]发现:通过细根周转归还到土壤中的全氮、全磷超过了地上凋落叶。红锥林、含笑人工林和次生林的根系全氮和全磷质量分数平均值低于中国陆地植物根系平均水平(9.2和1.0 mg·g-1)。乐昌含笑林根系的全碳、全氮、全磷质量分数均高于红锥林,这可能与根系的形态特征(表面积、体积等)有很大的关系。本研究中红锥林根系全碳质量分数为(465.10±2.81)mg·g-1,而邵梅香[19]研究的红锥细根(直径<0.5 mm)全碳质量分数平均值为(514.25±9.65)mg·g-1,这与两者研究选择的根系直径范围不同以及不同的环境基底有关。红锥林根系的全碳、全氮、全磷质量分数低于其他2种林分,而土壤的全碳、全氮、全磷质量分数高于其他2种林分,与红锥林根系养分状况相比,其他2种林分呈相反关系。这可能与红锥是菌根营养性树种有关[27],可以利用菌根菌获取养分,相应的根系获得的养分较少。郭大立等[28]对土壤氮的有效性与细根生产量和周转率研究表明:随着土壤全氮有效性的增加,细根生产量和周转率都提高或下降,具体提高还是下降,可以将其与养分含量相联系。本研究可能会从侧面论证随着土壤全氮有效性的增加,细根生产量和周转率都下降这一观点的可靠性,因此可以初步确定乐昌含笑林的根系吸收并储存养分的能力比红锥林和次生林要好。
土壤作为植物养分直接来源库,养分含量的多少关系到植物生长状况、森林健康情况以及景观生态评估质量的好坏。红锥林全碳、全氮、全磷质量分数均值分别为38.40、1.56和0.38 mg·g-1;乐昌含笑林土壤全碳、全氮、全磷质量分数均值分别为29.74、1.21和0.27 mg·g-1;次生林土壤全碳、全氮、全磷质量分数均值分别为33.89、1.44和0.27 mg·g-1,与杉木林[29](土壤碳为22.57 mg·g-1,土壤氮为1.33 mg·g-1,土壤磷为0.46 mg·g-1)相比,呈高全碳低全磷的格局,说明红锥林、乐昌含笑林和次生林对土壤碳库的维持较强,而对土壤磷的固持较弱。土壤全碳、全氮、全磷质量分数均为红锥林最高,说明红锥林的养分维持和养分归还能力较含笑林和次生林强。
-
凋落叶的氮磷比影响其分解和养分归还速率,且氮磷比与分解速率呈负相关关系,氮磷比大于25时分解主要受全磷限制[30]。红锥林凋落叶的氮磷比(27.93)大于25,表明红锥凋落叶在分解过程中主要受磷元素的限制,而乐昌含笑林和次生林凋落叶的氮磷比小于25,说明乐昌含笑林和次生林的凋落叶分解时主要受氮限制。该地区的土壤碳、氮、磷范围分别为29.74~38.40、1.21~1.56和0.27~0.38 mg·g-1,与全国土壤碳(11.12 mg·g-1)、氮(1.06 mg·g-1)、磷(0.65 mg·g-1)相比[31],这3种林分的土壤表现出高氮低磷的现状,与热带和亚热带地区养分状况相似。“生长速率假说”认为:植物在快速生长过程中需要大量的磷使核糖体能够快速合成大量蛋白质,因此会表现出较高的氮磷比[32]。本研究的红锥林、乐昌含笑林和次生林的根系氮磷比分别16.37、17.66、20.17,高于中国的平均水平14.27。说明生长速率为次生林>乐昌含笑林>红锥林,而前期是3种林分的土壤养分大致相同,造成根系氮磷比不同的主要原因是林分树种的不同,树种不同的本质间接就是根系形态特征不同,从而影响对土壤养分吸收。3种林分的碳氮比和碳磷比均为根系>凋落叶>土壤,而氮磷比均为凋落叶>根系>土壤。凋落叶中的碳氮比和碳磷比以乐昌含笑林最高,这可能与乐昌含笑植物叶面积较大,呈革质叶较厚有关。土壤的氮磷比也为次生林>乐昌含笑林>红锥林,说明根系和土壤的氮磷比表现相同的变化趋势。土壤中的碳氮比、碳磷比和氮磷比在3种林分中均无显著性差异(P>0.05),CHEN等[33]对同一林龄不同人工林的土壤研究表明:土壤全碳含量没有明显不同。而土壤中的营养元素主要来源于岩石风化,对于同一区域的土壤养分变化不会表现出过大的差异。碳磷比在3种林分的凋落叶、根系和土壤中也无显著性差异。
-
全氮和全磷是各种蛋白质和遗传物质的重要组成元素,植物体内的全氮和全磷往往随着植物体的生长发生变化[34]。一般认为植物在代谢过程中,全碳的固定需要大量蛋白酶和核酸的参与,在全氮和全磷共同参与植物生理代谢过程中,往往表现出一致性[35]。植物养分的主要来源是凋落物的归还,而凋落叶又是凋落物的主要组成部分,碳、氮、磷养分循环在“凋落叶-根系-土壤”间相互转换,其中养分元素含量和计量特征以及相关性都可以反映森林生态系统养分状况、养分循环和利用情况[36]。3种林分的根系全氮和全磷质量分数均显著正相关,凋落叶和根系的全氮质量分数和碳氮比均显著相关;3种林分凋落叶和根系全磷质量分数和碳氮比、碳磷比均为显著负相关,红锥林和乐昌含笑林的凋落叶和根系全磷质量分数也与氮磷比呈显著负相关。红锥林和乐昌含笑林的凋落叶、根系和土壤的碳磷比和氮磷比均为显著正相关;次生林的凋落叶和土壤中的碳磷比和氮磷比显著正相关,而根系中的碳磷比和氮磷比无相关性,这可能是次生林根系取样为混合样品,涉及的树种种类较多,没有一定的规律性。但是凋落叶和根系的全氮和全磷质量分数在一定程度上表现出相似性,说明凋落叶养分和根系养分有一定的关联。大多数陆地生态系统植物吸收的养分,有90%以上是凋落叶向土壤的归还,而根系又是植物吸收养分的重要器官,因此凋落叶养分和根系养分表现出类似的规律可以得到合理的解释[7]。相比较次生林,本研究的2种人工林在生态化学计量相关性方面比次生林更强烈直观,最重要的原因是次生林涉及到的树种变量更多,人工林树种单一,研究对象明确,更能定量准确地反映化学计量特征相关性。
-
同一地区不同林分的全碳、全氮、全磷生态化学计量特征主要与所用的树种有关。本研究土壤碳氮比、碳磷比、氮磷比在3种林分间无显著差异,说明同一区域的碳:氮:磷维持在一定的范围。通过比较凋落叶、根系和土壤的养分情况可知:研究地全氮偏高、全磷明显偏低,营林过程中可以适当地施用磷肥改善土壤养分。红锥林土壤养分和凋落叶养分回归状况优于乐昌含笑林和次生林,研究地可以选择红锥林作为合适的人工林树种。
Characteristics of litter-root-soil ecological stoichiometry of three forest stands in northern Guangdong
-
摘要:
目的 分析人工林和次生林在养分分布方面的异同点和诱因,以掌握养分现状和变化规律及其在不同部位的存在情况。 方法 以粤北南亚热带地区相近林龄的红锥Castanopsis hystrix人工林、乐昌含笑Michelia chapensis人工林和次生林为研究对象,对凋落叶、根系及土壤(0~20 cm)全碳、全氮、全磷的质量分数进行了测定。 结果 ① 凋落叶全碳和全磷质量分数在3种林分间无显著差异(P>0.05),但红锥林凋落叶全氮质量分数显著高于乐昌含笑林和次生林;根系的全碳、全氮、全磷质量分数在3种林分间差异显著(P < 0.05),且全氮和全磷质量分数均为乐昌含笑林>次生林>红锥林;土壤的全碳、全氮、全磷质量分数差异显著,且均为红锥林>次生林>乐昌含笑林。②碳氮比在3种林分中均为根系>凋落叶>土壤;碳磷比在红锥林和次生林中均为根系>凋落叶>土壤,而在乐昌含笑林中为凋落叶>根系>土壤;氮磷比在红锥林、乐昌含笑林和次生林中均为凋落叶>根系>土壤。而土壤的碳氮比、碳磷比、氮磷比在3种林分中均无显著差异(P < 0.05);凋落叶的碳氮比、碳磷比均为乐昌含笑林最高,根系的碳氮比、碳磷比均为红锥林>次生林>乐昌含笑林。③红锥林根系全氮和全磷质量分数、乐昌含笑林和次生林凋落物全氮和全磷质量分数以及根系全氮和全磷质量分数呈显著正相关(P < 0.05);3种林分凋落叶和根系的碳氮比和氮磷比无相关性(P>0.05);红锥林和乐昌含笑林的凋落叶、根系和土壤的碳磷比与氮磷比均呈显著正相关(P < 0.05),而次生林仅有凋落叶和土壤的碳磷比与氮磷比呈显著正相关(P < 0.05)。 结论 不同林分根系吸收土壤养分规律不同;与全国土壤养分均值相比,研究区域呈高氮低磷的格局,说明当地土壤受全磷限制,因此,可以根据需求适当施磷改善土壤养分。 Abstract:Objective The similarities, differences and inducements of nutrient distribution between plantation and secondary forest were analyzed, in order to master the situation and dynamic law of nutrients in different parts. Method The leaves, roots and soil (0-20 cm) of the Castanopsis hystrix plantation(CHP), the Michelin chapensis plantation(MCP) and the secondary forest(SF) were investigated in the southern subtropical region of northern Guangdong. Total C, total N and total P concentrations of litter, roots and soil were measured. Result (1) There was no significant difference in the concentrations of C and P in the litter among the three stands (P>0.05), but the concentrations of litter N in the CHP were significantly higher than those in MCP and the secondary forest. The roots of C, N and P concentrations were significantly different among the three stands (P < 0.05) and both N and P concentrations were MCP > SF > CHP. The C, N, and P concentrations in the soil were significantly different and both were CHP > SF > MCP. (2) All the three stands showed a C/N ratios of roots > litter > soil; while CSP and the secondary forest showed a C/P ratios of roots > litter > soil. C/P ratios was litter > root > soil in the MCP. N/P ratios was litter > root > soil in the three stands. C/N, C/P, and N/P ratios were not significantly different among the three types of forests; C/N and C/P ratios of litter were highest in MCP. All C/N and C/P ratios of roots were CHP > SF > MCP. (3) The N and P concentrations of roots in CSP, the N and P concentrations of litter and roots in MCP and the secondary forest displayed a significantly positive correlation (P < 0.05). There was no correlation between C/N and N/P ratios in litter and roots of the three stands (P>0.05). There was a significant positive correlation between C/P and N/P ratios in litter, roots and soil of CHP and MCP (P < 0.05), while C/P and N/P ratios of the secondary forest only showed a significant positive correlation (P < 0.05) between litter and soil. Conclusion Roots of different stands displayed different laws of soil nutrient absorption. Compared with the national average value of soil nutrients, the study area showed a pattern of high N and low P, indicating that local soil was limited by P. Therefore, P can be appropriately applied according to demand to improve soil nutrient quality. -
表 1 不同林分乔木层基本情况
Table 1. Basic conditions of arbor layers in different forest stands
林分 树高/m 胸径/cm 密度/(株·hm-2) 枝下高/m 郁闭度 海拔/m 红锥林 12.49 ± 0.91 17.44 ± 1.77 706.00 ± 48.95 6.65 ± 1.30 0.83 ± 0.09 366.00 ± 28.44 乐昌含笑林 9.66 ± 1.98 14.20 ± 2.68 978.00 ± 127.33 4.27 ± 1.31 0.80 ± 0.08 284.33 ± 52.64 次生林 8.83 ± 0.46 11.54 ± 0.48 1 419.50 ± 71.85 4.83 ± 0.39 0.70 ± 0.05 353.33 ± 26.16 说明:数值为平均值±标准误 表 2 不同林分土壤(0~20cm)的理化性质
Table 2. Soil physical and chemical properties of different forest stands
林分 pH 有机质/
(g·kg-1)阳离子交换量/(emol·kg-1) 容重/
(g·cm-3)含水量/
(g·kg-1)毛管孔隙度/
%总孔隙度/% 田间持水量/
(g·kg-1)红锥林 4.18±0.10 38.40±3.13 14.22±4.49 1.01±0.10 446.67±73.04 57.19±4.64 64.66±2.86 544.24±99.00 乐昌含笑林 4.26±0.05 29.74±1.39 10.57±5.60 1.13±0.09 346.04±49.85 51.41±3.16 56.69±2.94 431.56±53.86 次生林 4.37±0.07 33.89±3.10 6.98±1.31 1.34±0.11 243.45±34.39 39.97±2.07 45.33±2.06 258.77±43.49 说明:数值为平均值±标准误 表 3 3种林分凋落叶-根系-土壤的全碳、全氮、全磷质量分数
Table 3. C, N and P contents of litter-root-soil of three forest stands
林分类型 全碳/(mg·g-1) 全氮/(mg·g-1) 全磷/(mg·g-1) 凋落叶 根系 土壤 凋落叶 根系 土壤 凋落叶 根系 土壤 红锥林 445.22+4.23 465.10+2.81 38.40+3.13 10.60+0.30 5.67+0.33 1.56+0.09 0.39+0.03 0.37+0.04 0.38+0.02 Ba Ca Ab Cb Ba Ab Aa Aa Ab 乐昌含笑林 463.76+6.23 484.18+9.47 29.74+1.39 9.08+0.28 8.86+0.97 1.21+0.05 0.38+0.02 0.54+0.07 0.27+0.02 Ba Cab Aa Ba Bb Aa Aa Bb Aa 次生林 455.80+7.98 486.81+6.65 33.89+3.00 10.37+0.54 7.48+0.36 1.44+0.10 0.45+0.03 0.37+0.02 0.27+0.01 Ba Cb Aab Cb Bab Aab Ca Ba Aa 说明:不同大写字母表示同一林分不同组分间差异显著, 不同小写字母表示相同组分不同林分间差异显著(P < 0.05) 表 4 3种林分凋落叶-根系-土壤的碳氮比、氮磷比、碳磷比
Table 4. C/N, N/P, C/P stoichiometry of three forest stands of litter-root-soil
林分 碳氮比 碳磷比 氮磷比 凋落叶 根系 土壤 凋落叶 根系 土壤 凋落叶 根系 土壤 红锥林 42.21+1.03 83.94+4.10 24.48+0.76 1 178.37+83.39 1 382.40+132.19 103.94+9.43 27.93+1.98 16.37+1.22 4.19+0.25 Ba Cb Aa Ba Ba Aa Cb Ba Aa 乐昌含笑林 51.51+1.87 62.52+9.61 24.60+1.05 1 239.61+467.34 1 145.32+235.05 118.08+12.94 23.99+0.67 17.66+1.25 4.95+0.70 Bb Ba Aa Ba Ba Aa Ca Bab Aa 次生林 45.20+3.18 66.19+2.91 23.41+0.77 1 071.28+102.14 1 330.84+52.26 126.83+9.62 23.44+40.95 20.17+0.45 5.39+0.31 Bab Ca Aa Ba Ca Aa Ca Bb Aa 说明:不同大写字母表示同一林分不同组分间差异显著, 不同小写字母表示相同组分不同林分间差异显著(P < 0.05) -
[1] ELSER J J, STERNER R W, GOROKHOVA E, et al. Biological stoichiometry from genes to ecosystems[J]. Ecol Lett, 2000, 3(6):540-550. [2] 曾德慧, 陈广生.生态化学计量学:复杂生命系统奥秘的探索[J].植物生态学报, 2005, 29(6):1007-1019. ZENG Dehui, CHEN Guangsheng. Ecological stoichiometry:a science to explore the complexity of living systems[J]. Acta Phytoecol Sin, 2005, 29(6):1007-1019. [3] ZHANG Jiahui, ZHAO Ning, LIU Cong, et al. C:N:P stoichiometry in China's forests:from organs to ecosystems[J]. Funct Ecol, 2018, 32(1):50-60. [4] VITOUSEK P M, HOWARTH R W. Nitrogen limitation on land and in the sea:how can it occur?[J]. Biogeochemistry, 1991, 13(2):87-115. [5] 贺金生, 韩兴国.生态化学计量学:探索从个体到生态系统的统一化理论[J].植物生态学报, 2010, 34(1):2-6. HE Jinsheng, HAN Xingguo. Ecological stoichiometry:searching for unifying principles from individuals to ecosystems[J]. Chin J Plant Ecol, 2010, 34(1):2-6. [6] ELSER J J, DOBBERFUHL D R, MACKAY N A, et al. Organism size, life history, and N:P stoichiometry[J]. BioScience, 1996, 46(9):674-684. [7] 马志良, 高顺, 杨万勤, 等.亚热带常绿阔叶林凋落叶分解过程中氮和磷在不同雨热季节的释放动态[J].应用与环境生物学报, 2015, 21(2):308-315. MA Zhiliang, GAO Shun, YANG Wanqin, et al. Dynamics of nitrogen and phosphorus release in decomposing foliar litter at different rainy stages in the subtropical evergreen broad-leaved forest[J]. Chin J Appl Environ Biol, 2015, 21(2):308-315. [8] 曾昭霞, 王克林, 曾馥平, 等.桂西北喀斯特区原生林与次生林凋落叶降解和养分释放[J].生态学报, 2012, 32(9):2720-2728. ZENG Zhaoxia, WANG Kelin, ZENG Fuping, et al. Litter decomposition and nutrient release in typical secondary and primary forests in Karst Region, Northwest of Guangxi[J]. Acta Ecol Sin, 2012, 32(9):2720-2728. [9] 黄建辉, 韩兴国, 陈灵芝.森林生态系统根系生物量研究进展[J].生态学报, 1999, 19(2):270-277. HUANG Jianhui, HAN Xingguo, CHEN Lingzhi. Advances in the research of (fine) root biomass in forest ecosystems[J]. Acta Ecol Sin, 1999, 19(2):270-277. [10] 许雨星, 王志超, 竹万宽, 等.雷州半岛3种速生人工林下土壤生态化学计量特征[J].浙江农林大学学报, 2018, 35(1):35-42. XU Yuxing, WANG Zhichao, ZHU Wankuan, et al. Ecological stoichiometric characteristics of soil C, N, P, and K in three types of plantations on the Leizhou Peninsula[J]. J Zhejiang A&F Univ, 2018, 35(1):35-42. [11] TANG Zhiyao, XU Wenting, ZHOU Guoyi, et al. Patterns of plant carbon, nitrogen, and phosphorus concentration in relation to productivity in China's terrestrial ecosystems[J]. Proc Natl Acad Sci, 2018, 115(16):4033-4038. [12] ÅGREN G I. Stoichiometry and nutrition of plant growth in natural communities[J]. Annu Rev Ecol Evol Syst, 2008, 39(1):153-170. [13] YANG Xuejun, HUANG Zhenying, ZHANG Keliang, et al. C:N:P stoichiometry of Artemisia species and close relatives across northern China:unravelling effects of climate, soil and taxonomy[J]. J Ecol, 2015, 103(4):1020-1031. [14] SARDANS J, PENUELAS J. Trees increase their P:N ratio with size[J]. Global Ecol Biogeogr, 2015, 24(2):147-156. [15] 聂兰琴, 吴琴, 尧波, 等.鄱阳湖湿地优势植物叶片-凋落物-土壤碳氮磷化学计量特征[J].生态学报, 2016, 36(7):1898-1906. NIE Lanqin, WU Qin, YAO Bo, et al. Leaf litter and soil carbon, nitrogen, and phosphorus stoichiometry of dominant plant species in the Poyang Lake wetland[J]. Acta Ecol Sin, 2016, 36(7):1898-1906. [16] 马文济, 赵延涛, 张晴晴, 等.浙江天童常绿阔叶林不同演替阶段地表凋落物的C、N、P化学计量特征[J].植物生态学报, 2014, 38(8):833-842. MA Wenji, ZHAO Yantao, ZHANG Qingqing, et al. C:N:P stoichiometry in forest floor litter of evergreen broad-leaved forests at different successional stages in Tiantong, Zhejiang, eastern China[J]. Chin J Plant Ecol, 2014, 38(8):833-842. [17] 陈安娜, 王光军, 陈婵, 等.亚热带不同林龄杉木林叶-根-土氮磷化学计量特征[J].生态学报, 2018, 38(11):4027-4036. CHEN Anna, WANG Guangjun, CHEN Chan, et al. Variation in the N and P stoichiometry of leaf-root-soil during stand development in a Cunninghamia lanceolata plantation in subtropical China[J]. Acta Ecol Sin, 2018, 38(11):4027-4036. [18] 刘万德, 苏建荣, 李帅锋, 等.云南普洱季风常绿阔叶林优势物种不同生长阶段叶片碳、氮、磷化学计量特征[J].植物生态学报, 2015, 39(1):52-62. LIU Wande, SU Jianrong, LI Shuaifeng, et al. Leaf carbon, nitrogen and phosphorus stoichiometry at different growth stages in dominant tree species of a monsoon broad-leaved evergreen forest in Pu'er, Yunnan Province, China[J]. Chin J Plant Ecol, 2015, 39(1):52-62. [19] 邵梅香.南亚热带红椎与西南桦生态化学计量学特征研究[D].南宁: 广西大学, 2012. SHAO Meixiang. Ecology Stoichiometry Characteristics of Castanopsis hystrix and Atula alnoides in South Subtropical Area of China[D]. Nanning: Guangxi University, 2012. [20] 郑万均.中国树木志:第1卷[M].北京:中国林业出版社, 1983:479-494. [21] 梁瑞, 许松葵, 梁丽丽, 等. 5种阔叶树幼苗的养分积累和分配规律[J].林业与环境科学, 2007, 23(2):16-19. LIANG Rui, XU Songkui, LIANG Lili, et al. Accumlation and distributio of nutrients in seedings of five broad-leaved tree species[J]. For Environ Sci, 2007, 23(2):16-19. [22] 许松葵, 薛立. 6种阔叶树幼林的林地土壤特性[J].华南农业大学学报, 2010, 31(4):76-81. XU Songkui, XUE Li. Soil characteristics of six young broad leaved stands[J]. J South China Agric Univ, 2010, 31(4):76-81. [23] 鲍士旦.土壤农化分析[M]. 3版.北京:中国农业出版社, 1981:25-79. [24] KANG Hongzhang, XIN Zaijun, BERG B, et al. Global pattern of leaf litter nitrogen and phosphorus in woody plants[J]. Ann For Sci, 2010, 67(8):811. doi:10.1051/forest/2010047. [25] McCLAUGHERTY C A, ABER J D, MELILLO J M. The role of fine roots in the organic matter and nitrogen budgets of two forested ecosystems[J]. Ecology, 1982, 63(5):1481-1490. [26] VOGT K A, GRIER C C, GOWER S T, et al. Overestimation of net root production:a real or imaginary problem?[J]. Ecology, 1986, 67(2):577-579. [27] 陈应龙, 弓明钦, 陈羽, 等.外生菌根菌接种对红椎生长及光合作用的影响[J].林业科学研究, 2001, 14(5):515-522. CHEN Yinglong, GONG Mingqin, CHEN Yu, et al. Effects of inoculation with 11 ectomycorrhizal fungal isolates on growth and photosynthesis of Castanopsis hystrix saplins[J]. For Res, 2001, 14(5):515-522. [28] 郭大立, 范萍萍.关于氮有效性影响细根生产量和周转率的四个假说[J].应用生态学报, 2007, 18(10):2354-2360. GUO Dali, FAN Pingping. Four hypotheses about the effects of soil nitrogen availability on fine root production and turnover[J]. Chin J Appl Ecol, 18(10):2354-2360. [29] 李明军, 喻理飞, 杜明凤, 等.不同林龄杉木人工林植物-凋落叶-土壤C、N、P化学计量特征及互作关系研究[J].生态学报, 2018, 38(21):1-10. LI Mingjun, YU Lifei, DU Mingfeng, et al. C, N, and P stoichiometry and litter interaction with plants, litter, and soil in a Cunninghamia lanceolata plantation with diffierent ages[J]. Acta Ecol Sin, 2018, 38(21):1-10. [30] 任悦, 高广磊, 丁国栋, 等.沙地樟子松人工林叶片-枯落物-土壤氮磷化学计量特征[J].应用生态学报, 2019, 30(3):743-750. REN Yue, GAO Guanglei, DING Guodong, et al. Stoichiometric characteristics of nitrogen and phosphorus in leaf-litter-soil system of Pinus syvestris var. mongolica plantations[J]. Chin J Appl Ecol, 2019, 30(3):743-750. [31] TIAN Hanqin, CHEN Guangsheng, ZHANG Chi, et al. Pattern and variation of C:N:P ratios in China's soils:a synthesis of observational data[J]. Biogeochemistry, 2010, 98(1/3):139-151. [32] ELSER J J, ACHARYA K, KYLE M, et al. Growth rate-stoichiometry couplings in diverse biota[J]. Ecol Lett, 2003, 6(10):936-943. [33] CHEN Yuanqi, YU Shiqin, LIU Suping, et al. Reforestation makes a minor contribution to soil carbon accumulation in the short term:evidence from four subtropical plantations[J]. For Ecol Manage, 2017, 384:400-405. [34] KERKHOFF A J, ENQUIST B J, ELSER J J, et al. Plant allometry, stoichiometry and the temperature-dependence of primary productivity[J]. Global Ecol Biogeogr, 2005, 14(6):585-598. [35] 刘泽彬, 程瑞梅, 肖文发, 等.三峡库区库首森林生态系统植物叶片碳氮磷化学计量特征研究[J].南京林业大学学报(自然科学版), 2017, 41(2):27-33. LIU Zebin, CHENG Ruimei, XIAO Wenfa, et al. Stoichiometric characteristics of leaf carbon, nitrogen and phosphorus in forest ecosystems in the head of the Three Gorges Reservoir Area[J]. J Nanjing For Univ Nat Sci Ed, 2017, 41(2):27-33. [36] 曾昭霞, 王克林, 刘孝利, 等.桂西北喀斯特森林植物-凋落物-土壤生态化学计量特征[J].植物生态学报, 2015, 39(7):682-693. ZENG Zhaoxia, WANG Kelin, LIU Xiaoli, et al. Stoichiometric characteristics of plants, litter and soil in karst plant communities of Northwest Guangxi[J]. Chin J Plant Ecol, 2015, 39(7):682-693. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2020.01.003






 下载:
下载: