-
杉木Cunninghamia lanceolata是中国特有的优良速生针叶树种,也是中国亚热带地区的主要造林树种,占全国人工林面积的17.33%[1]。由于片面追求速生丰产,杉木人工林出现了生产力下降、地力衰退等问题;而且杉木林树种单一,结构不稳定,生物多样性相对较低[2],导致其应对全球变化的能力不足。酸雨是全球变化的主要表现形式之一,而中国已经是欧洲、北美后的世界第三大酸雨区。近年来,长江三角洲地区已经开始控制二氧化硫(SO2)的排放,但汽车数量的激增引起更高的氮氧化物(NOx)排放量,导致硝酸盐(NO3 −)沉淀增加[3]。2003—2010年,酸雨中硫酸根(SO4 2−)与硝酸根(NO3 −)比值从7.5降到2.0[4],预计未来会继续下降。可见,酸雨类型正逐渐由硫酸雨(SAR)转变为硝酸雨(NAR),这将对该区域生态系统带来新的威胁,尤其是遭受酸雨危害严重的中国南方地区。
杉木林土壤是生态系统中受酸沉降影响最大的部分,其中酸雨会直接改变土壤pH[5],影响土壤化学性质[6]。酸雨输入增加土壤氢离子(H+)负荷[7],并与交换络合物上的钙离子(Ca2+)、镁离子(Mg2+)或钾离子(K+)进行交换,但这些离子难以被植物吸收。此外,一些有毒重金属离子,如铝离子(Al3+)、铅离子(Pb2+)、汞离子(Hg2+)、镉离子(Cd+)等也被H+取代[8],对植物产生毒害作用。总碳、总氮、总硫、有效磷和速效钾等同样受到土壤酸化影响,造成土壤养分流失[9],引起杉木林地力衰退。土壤微生物在参与土壤养分循环和维持生态系统平衡中发挥重要作用[10],是土壤活性碳氮库的重要成分[11],也是生态系统碳氮转化进程的生物指标,可以用微生物量碳氮表示[12]。前期研究发现:土壤pH也对微生物量碳氮变化具有重要影响[13]。
酸雨胁迫是影响杉木林地力衰退的主要环境因子之一,然而关于酸雨类型转变对杉木林土壤养分流失及微生物响应机制研究相对较少,而且研究对象集中在马尾松Pinus massoniana及阔叶林[14]。因此,本研究以南方杉木人工林为研究对象,探究酸雨类型转变对杉木林土壤养分及微生物特征的影响,以期为南方酸雨胁迫地区杉木人工林可持续发展提供理论基础。
-
研究区位于南京市20 km外的国有东善桥林场铜山分场(31°37′N,118°51′E)。该区年平均降水量为1 117.2 mm,年均气温为15.1 ℃,无霜期为229.0 d,年日照时数为2 199.5 h。地形以丘陵为主,海拔为38~388 m,属北亚热带季风气候区,气候温和湿润,土壤类型以黄棕壤为主。森林类型以毛竹Phyllostachys edulis、杉木、麻栎Quercus aeutissima和马尾松等为主。本研究以杉木人工纯林为研究对象,该林分海拔为311 m,坡度为22°,西北坡向,林分密度为850株·hm−2,郁闭度为0.61,平均树高、胸径、冠幅分别为10.8 m、13.2 cm和2.4 m。
-
随机在杉木林的上、中、下坡选定长2 m,宽60 cm的样地,在树干下1 m处采样,共计120个采样点,每月进行2次酸溶液喷施,并采集样方表层0~10 cm土壤,用于土壤各项指标测定。
-
利用0.5 mol·L−1硫酸(H2SO4)与0.5 mol·L−1硝酸(HNO3)配制3种酸雨类型(SO4 2−/NO3 −的体积比分别为5∶1、1∶1和1∶5)和3种酸度(pH 4.5、pH 3.5、pH 2.5)的酸雨溶液,分别为硫酸型酸雨(S1:SO4 2−/NO3 −的体积比为5∶1,pH 4.5;S2:SO4 2−/NO3 −的体积比为5∶1,pH 3.5;S3:SO4 2−/NO3 −的体积比为5∶1,pH 2.5)、混合型酸雨(E1:SO4 2−/NO3 −的体积比为1∶1,pH 4.5;E2:SO4 2−/NO3 −的体积比为1∶1,pH 3.5;E3:SO4 2−/NO3 −的体积比为1∶1,pH 2.5)和硝酸型酸雨(N1:SO4 2−/NO3 −的体积比为1∶5,pH 4.5;N2:SO4 2−/NO3 −的体积比为1∶5,pH 3.5;N3:SO4 2−/NO3 −的体积比为1∶5,pH 2.5),同时设置对照处理(ck,山间防火池水,pH 6.6),共10个处理组。根据南京地区全年月平均降水量,分配每月喷施模拟酸雨量,模拟酸雨量占南京月均降水量的2/3,约占全年降水量的5.55%。每月月初和月中使用花洒各喷施1次[15],共计4个季度:春季(3—5月),喷施酸雨总量为12.79 mm,比例为20.62%;夏季(6—8月),喷施酸雨总量为32.35 mm,比例为52.11%;秋季(9—11月),喷施酸雨总量为9.35 mm,比例为15.08%;冬季(12月至翌年2月),喷施酸雨总量为7.57 mm,比例为12.19%。
-
采用电位法测定土壤pH;氟化氨-盐酸浸提法测定土壤有效磷(AP);乙酸铵-火焰光度法测定土壤速效钾(AK);元素分析仪测定土壤碳(TC)、氮(TN)、硫(TS)[16];使用1 mol·L−1氯化钾交换-中和滴定法测定土壤交换性H+、Al3+[17];使用氯仿熏蒸浸提法测定土壤微生物量碳氮质量分数。
-
各类型酸雨处理对土壤化学性质和微生物量碳氮的影响用单因素方差分析,酸雨pH与硝酸根离子对各因素的影响,采用双因素方差分析。利用R语言(V3.5.1)分析酸雨胁迫下各因素之间的相关性。结构平衡方程(structural equation model,SEM)来解释酸雨pH与硝酸根离子对土壤微生物量碳氮的直接和间接影响。
-
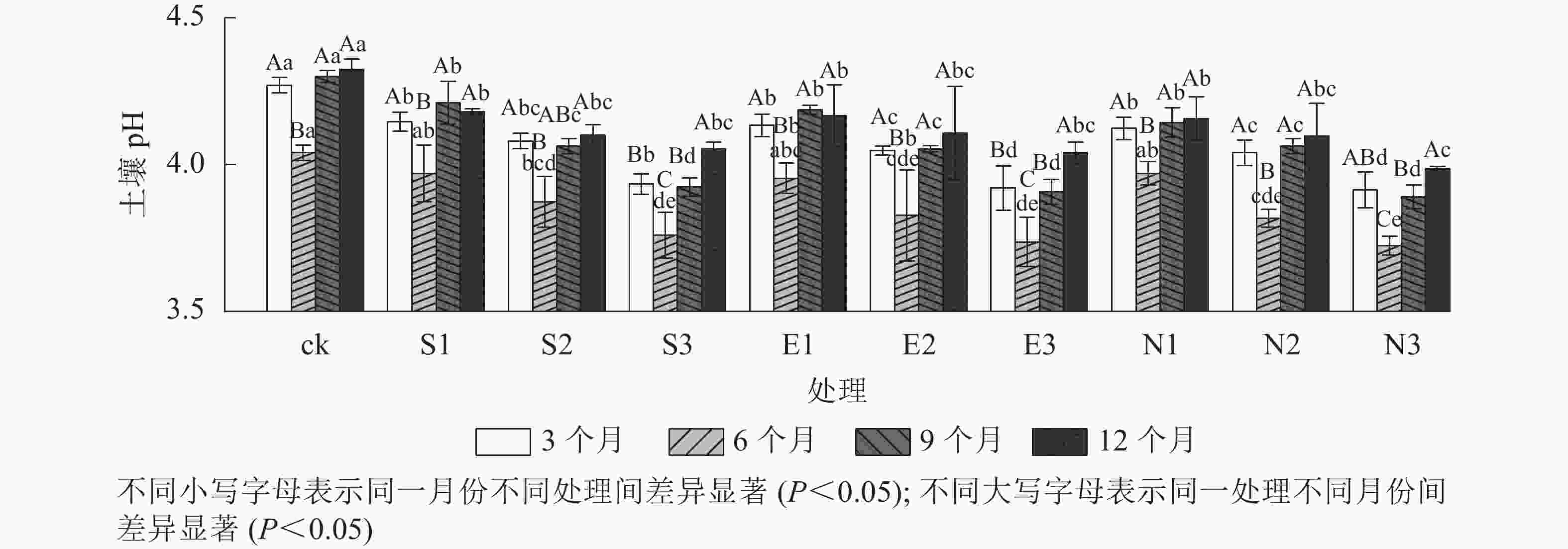
由表1可见:3种类型酸雨胁迫下,随着酸雨酸度增加,土壤pH呈显著下降趋势,且受胁迫时间的影响显著(P<0.001),但酸雨类型对土壤pH影响不显著。由图1可见:施加酸雨6个月后各处理土壤的pH显著低于其他时间(P<0.05)。与ck相比,3和12个月酸雨处理均显著降低了土壤pH (P<0.05)。
表 1 不同酸雨类型与酸雨酸度下土壤pH的方差分析
Table 1. P values of soil pH under different acid rain types and acid rain stress
影响因子 3个月 6个月 9个月 12个月 酸雨类型 0.403 0.672 0.220 0.703 酸雨酸度 <0.001*** <0.001*** <0.001*** 0.006** 酸雨类型×酸雨酸度 0.992 0.981 0.657 0.966 时间 <0.001*** 酸雨类型×酸雨酸度×时间 0.999 说明:数值为显著性P值。**P<0.01;***P<0.001 -
由图2和表2可见:随着酸雨酸度的增加,土壤交换性H+、Al3+质量摩尔浓度均呈显著上升趋势,且胁迫时间差异显著(P<0.001)。施加酸雨3个月后,酸雨类型显著影响交换性H+(P<0.001)和交换性Al3+(P<0.05)。施加酸雨9和12个月后,S1、S3处理土壤交换性H+和Al3+质量摩尔浓度均小于N1、N3处理;与对照相比,酸雨pH为2.5时,S3、E3和N3处理的土壤交换性H+质量摩尔浓度均值分别增长了275%、254%和246%,交换性Al3+质量摩尔浓度均值分别增长了240%、246%和249%。
表 2 不同酸雨类型与酸雨胁迫下土壤各指标的方差分析
Table 2. P values of soil acidity index under different acid rain types and acid rain stress
影响因子 土壤指标 3个月 6个月 9个月 12个月 酸雨类型 <0.001*** 0.534 0.787 0.278 酸雨酸度 <0.001*** <0.001*** <0.001*** <0.001*** 酸雨类型×酸雨酸度 交换性H+ <0.001*** 0.855 0.816 0.605 时间 <0.001*** 酸雨类型×酸雨酸度×时间 <0.001*** 酸雨类型 0.013* 0.496 0.902 0.990 酸雨酸度 <0.001*** <0.001*** <0.001*** <0.001*** 酸雨类型×酸雨酸度 交换性Al3+ <0.001*** 0.669 0.227 0.052 时间 <0.001*** 酸雨类型×酸雨酸度×时间 <0.001*** 酸雨类型 0.805 0.721 0.531 0.635 酸雨酸度 0.371 0.306 0.070 0.710 酸雨类型×酸雨酸度 总碳 0.961 0.379 0.320 0.782 时间 0.018* 酸雨类型×酸雨酸度×时间 0.688 酸雨类型 0.517 0.896 0.704 0.861 酸雨酸度 0.333 0.315 0.344 0.924 酸雨类型×酸雨酸度 总氮 0.942 0.957 0.975 0.118 时间 0.009** 酸雨类型×酸雨酸度×时间 0.862 酸雨类型 0.783 0.840 0.496 0.907 酸雨酸度 0.232 0.900 0.190 0.904 酸雨类型×酸雨酸度 碳氮比 0.951 0.249 0.592 0.598 时间 0.513 酸雨类型×酸雨酸度×时间 0.816 酸雨类型 0.550 0.880 0.990 0.382 酸雨酸度 0.395 0.770 0.409 0.640 酸雨类型×酸雨酸度 总硫 0.986 0.708 0.987 0.675 时间 <0.001*** 酸雨类型×酸雨酸度×时间 0.995 酸雨类型 0.315 0.340 0.379 0.447 酸雨酸度 0.379 0.049* 0.430 0.121 酸雨类型×酸雨酸度 有效磷 0.768 0.012* 0.648 0.482 时间 <0.001*** 酸雨类型×酸雨酸度×时间 0.159 酸雨类型 0.058 0.246 0.274 0.481 酸雨酸度 <0.001*** 0.012* 0.492 0.104 酸雨类型×酸雨酸度 速效钾 0.809 0.029* 0.651 0.707 时间 0.276 酸雨类型×酸雨酸度×时间 0.534 酸雨类型 0.900 0.959 0.842 0.971 酸雨酸度 0.334 0.383 0.449 0.497 酸雨类型×酸雨酸度 土壤微生物量碳 0.977 0.998 0.989 0.997 时间 <0.001*** 酸雨类型×酸雨酸度×时间 1.000 酸雨类型 0.886 0.820 0.990 0.993 酸雨酸度 0.101 0.171 0.274 0.100 酸雨类型×酸雨酸度 土壤微生物量氮 0.972 0.998 0.994 0.990 时间 <0.001*** 酸雨类型×酸雨酸度×时间 1.000 说明:数值为显著性P值。*P<0.05;**P<0.01;***P<0.001 -
由图3和表2可见:随着酸雨酸度的增加,土壤总碳、总氮、总硫和有效磷质量分数存在显著的时间差异(P<0.05)。施加酸雨3和6个月后,酸雨酸度显著影响速效钾质量分数,6个月后,酸雨酸度显著影响有效磷质量分数,且酸雨酸度与酸雨类型对有效磷和速效钾的交互效应显著(P<0.05)。施加酸雨6个月后,N1处理的土壤总碳质量分数显著低于S1和ck (P<0.05)。9个月后,N1处理的土壤总碳质量分数显著高于S1和ck (P<0.05)。S3处理的有效磷质量分数显著低于ck和N3 (P<0.05)。在3、6、9和12个月,S3处理的速效钾质量分数均最低,分别为(25.03±4.17)、(25.09±3.97)、(29.47±2.57)和(27.69±4.44) mg·kg−1。
-
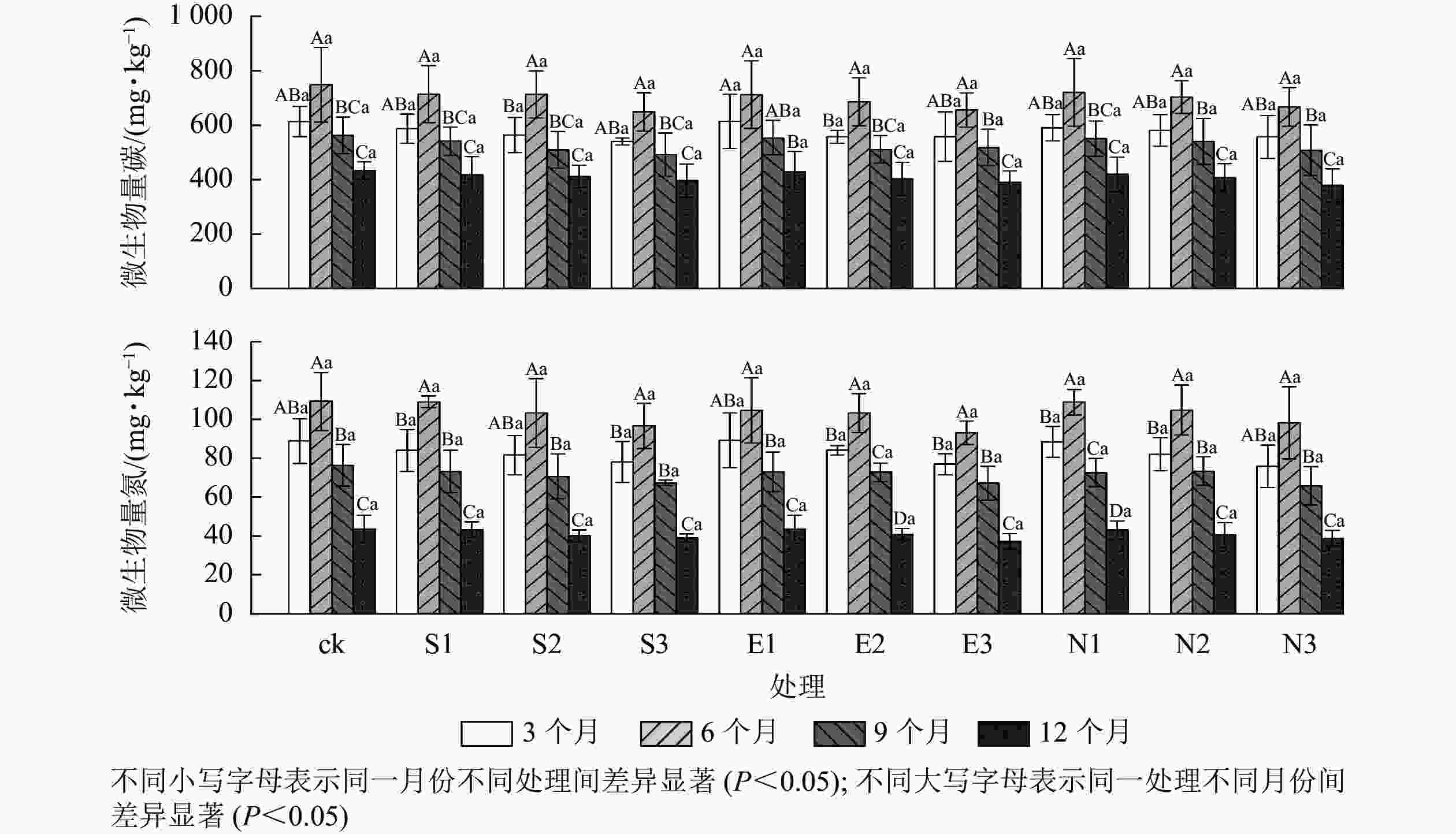
由图4和表2可见:随着酸雨酸度的增加,土壤微生物量碳氮呈显著下降趋势,且胁迫时间差异显著(P<0.05)。施加酸雨6个月后,对照处理组的土壤微生物量碳氮最高,分别为(748.64±136.66)和(109.28±14.88) mg·kg−1。与对照相比,S3、E3和N3处理均显著降低了土壤微生物量碳氮,其中,胁迫12月后N3处理的微生物量碳和微生物量氮质量分数达到最低值,分别为(378.89±60.69)和(38.67±4.10) mg·kg−1。
-
由图5可见:酸雨pH与土壤pH、速效钾呈显著正相关(P<0.05);总碳与碳氮比、有效磷与微生物量碳氮、微生物量碳与微生物量氮之间均表现出显著的正相关(P<0.05)。而酸雨pH与交换性H+、Al3+表现出显著的负相关(P<0.05);交换性H+、Al3+与速效钾、微生物量碳、微生物量氮之间呈显著负相关(P<0.05)。
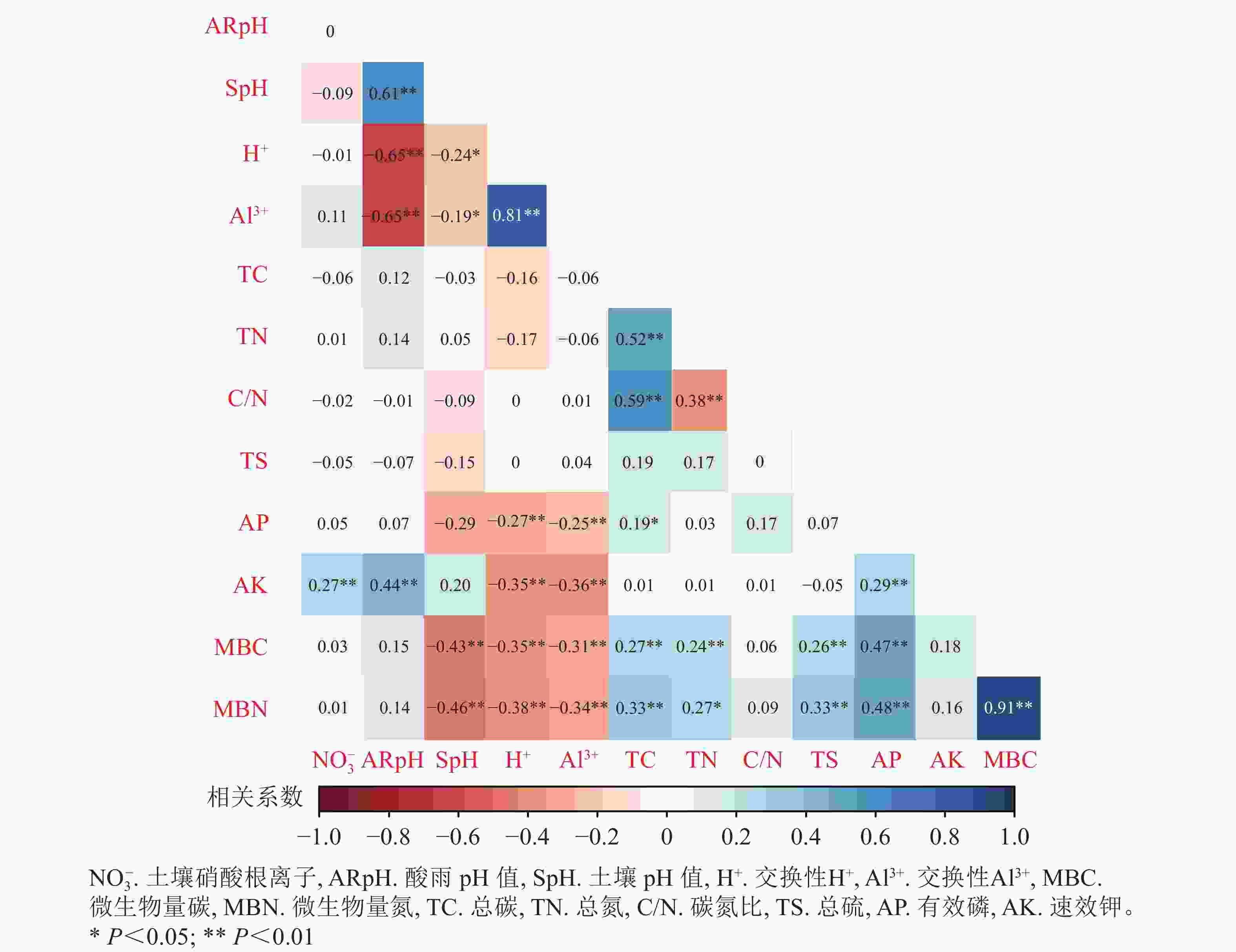
图 5 酸雨胁迫下土壤化学性质与微生物量碳氮的相关关系
Figure 5. Correlation analysis of soil chemical properties and microbial carbon and nitrogen under acid rain stress
结构方程模型(SEM)通过AMOS软件构建。该模型卡方检验P为0.336(>0.050),近似误差均方根为0.029,拟合优度指数为0.994,参数均符合建模要求(图6)。与相关性分析结果一致,酸雨酸度对微生物量碳的直接影响要高于酸雨类型。酸雨酸度对微生物量碳和微生物量氮的间接影响系数分别为−0.412、0.025,综合影响系数分别为0.154、0.141;酸雨类型对微生物量碳和微生物量氮的间接影响系数分别为0.065和0.032,综合影响系数分别为0.025、0.009 (表3)。另外,从图6可以看出:酸雨酸度主要通过土壤pH、总碳和有效磷间接影响微生物量碳氮,而酸雨类型主要通过土壤pH、总碳和有效磷间接影响微生物量碳氮,酸雨酸度又主要通过土壤pH影响总碳和有效磷而间接影响微生物量碳氮。

图 6 不同酸雨类型和酸雨酸度对微生物量碳氮影响的SEM分析
Figure 6. SEM analysis of the effects of different acid rain types and acid rain stress on microbial carbon and nitrogen
表 3 结构方程中各因子与微生物量碳氮之间的相关性
Table 3. Correlation of parameters and microbial carbon and nitrogen
自变量 酸雨
pH值土壤酸
根离子土壤
pH有效磷 总碳 微生物
量碳总效应 微生物量碳 0.154 0.025 −0.855 0.204 0.139 间接效应 −0.412 0.065 −0.132 总效应 微生物量氮 0.141 0.009 −0.879 0.201 0.200 0.776 间接效应 0.025 0.032 −0.702 0.158 0.108 -
土壤作为森林生态系统的最终受体,对酸雨具有较强的敏感性[9]。酸雨导致土壤pH和盐基饱和度下降,溶出土壤中交换性H+、Al3+,加剧土壤酸化[18],这与本研究结果一致。表明交换性阳离子充当土壤中重要的缓冲剂作用,当土壤pH为4.2~3.8时,已经降到土壤阳离子缓冲范围内[19],土壤中矿物成分释放出充足的交换性Al3+缓冲酸沉降。本研究中,随着酸雨酸度的增加,有效磷质量分数在施加酸雨6个月后显著变化,速效钾质量分数在3和6个月后均有显著变化,同时施加酸雨6个月后,酸雨类型和酸度对有效磷和速效钾交互效应显著。这可能是因为夏季植物生长迅速,杉木林土壤表层的凋落物较少,对酸雨缓冲作用减弱,夏季雨水相比其他季节多,淋溶作用增加,进而导致土壤有效磷和速效钾的流失。然而,酸雨对土壤总碳、总氮、总硫的影响不显著[16]。表明短期的酸雨胁迫不会导致碳、氮、硫的变化,土壤养分的流失需要长时间的积累。
土壤微生物在维持全球生态系统中充当重要角色[6],土壤pH、植被类型、土壤养分、气候条件等的变化直接或间接影响土壤微生物量碳氮的活性[20]。研究发现:微生物对土壤pH有最适宜的区间,过低的土壤pH对微生物活性起到抑制作用[21-22]。本研究在模拟酸雨持续胁迫下,土壤pH呈显著下降,土壤微生物量碳氮在强酸(pH 2.5)处理下显著下降。由于土壤对酸雨的缓冲作用,pH 4.5和pH 3.5对土壤微生物量碳氮没有显著影响,随着酸度的增加及实验周期的延长,各类型酸雨处理对微生物量碳氮的影响显著,这可能是真菌和细菌对强酸更加敏感[23],也可以说明酸雨对土壤微生物量碳氮的影响是一个循序渐进的过程。有研究表明:酸雨胁迫下土壤持续酸化与土壤微生物量碳氮活性的抑制作用有关,H+的毒害作用导致土壤分解者的微生物种类、生物活性和结构均随之发生变化[24]。
土壤微生物量碳氮随着酸雨时间的递增,发生着动态、复杂的变化过程,这也是森林生态系统的研究重点[25]。本研究的土壤微生物存在着显著的月份差异,6—8月土壤微生物量碳氮质量分数最高,12月至翌年2月出现最低值。这可能是因为春季气温回升后,春坝作用[26]使得植物生长恢复,6月土壤微生物活性增强,7—8月达到高峰。而后因为植物和微生物生长对养分的大量需求产生养分物质的竞争[27],导致微生物量碳氮降低。而冬季因为天气寒冷潮湿,使得真菌和细菌数量减少,土壤呼吸作用减弱,导致微生物量碳氮质量分数达到最低值。由于秋冬季大量凋落物掉落,为春季微生物提供较多的代谢物而使得春季微生物量碳氮质量分数相比冬季而言有较大的提升。
酸雨类型变化不仅对土壤养分影响显著,也对土壤微生物影响显著。混合型和硝酸型酸雨减缓了土壤碳氮和磷的矿化,降低了土壤微生物量[28]。本研究中,不同酸雨类型之间对杉木林影响并没有显著区分,NO3 −与SO4 2−没有显著的区别。这可能与试验时间有关,因本研究时间仅1 a,周期较短,导致NO3 −对杉木林影响没有显著表现出来。早期研究发现:硝酸雨对土壤pH和微生物活性的抑制作用比硫酸雨大[15],硝酸雨减缓了土壤碳、氮、磷的矿化作用[29]。
-
1 a的短期酸雨胁迫后,土壤pH随着酸雨酸度的增加而显著降低,硝酸根对土壤pH影响大于硫酸根。酸雨对土壤有效磷和速效钾质量分数影响显著,对土壤总碳、总氮和总硫质量分数影响较小。酸雨酸度和酸雨类型均对微生物量碳氮质量分数影响显著,酸雨酸度对微生物碳氮的影响一方面直接影响,另一方面通过对土壤化学性质的间接影响完成。酸雨类型的转变加剧了酸雨酸度对杉木林土壤特性的抑制作用。
Effects of acid rain type change on soil nutrient characteristics and microbial C and N in the Cunninghamia lanceolata plantation
-
摘要:
目的 探究酸雨类型转变对杉木Cunninghamia lanceolata林土壤养分及微生物量碳氮的影响,为不同类型酸雨区杉木人工林可持续经营提供理论依据。 方法 以南京市东善桥林场杉木人工林为研究对象,在对照处理(ck,山间防火池水,pH 6.6)、不同酸雨类型[包括酸雨类型(硫酸型、硝酸型和混合型)和酸雨酸度(模拟溶液pH 4.5、3.5和2.5)]胁迫1 a后,探究酸雨类型转变对杉木林土壤养分及微生物的影响。 结果 随着酸雨酸度增加,不同类型酸雨处理土壤pH呈显著下降趋势(P<0.05),而土壤交换性氢离子(H+)和铝离子(Al3+)呈显著上升趋势(P<0.05);与对照相比,酸雨pH为2.5时,土壤交换性H+、Al3+均在硫酸型酸雨处理下分别增长了275%和240%,在混合型酸雨处理下分别增长了254%和246%,在硝酸型酸雨处理下分别增长了246%和249%。此外,酸雨胁迫时间显著影响土壤总碳、总氮、总硫、有效磷和微生物量碳氮(P<0.05),但酸雨类型对土壤微生物量碳氮影响不显著;酸雨胁迫1 a后,pH 2.5硝酸型酸雨处理下土壤微生物量碳氮质量分数最低,分别为(378.89±60.69)和(38.67±4.10) mg·kg−1。通过结构方程模型可知:酸雨酸度对杉木林土壤微生物量碳氮的影响强于酸雨类型,其主要通过影响土壤pH、有效磷和总碳间接影响微生物量碳氮。 结论 1 a的短期酸雨胁迫后,酸雨酸度仍然是影响杉木林土壤特性的主要因子,而酸雨类型转变将会加剧酸雨酸度对杉木林土壤特性的抑制作用。图6表3参29 Abstract:Objective The purpose of this study is to investigate the effects of acid rain type change on soil nutrients and microbial C and N of the Cunninghamia lanceolata plantation, with a view to providing a theoretical basis for sustainable management of the C. lanceolata plantation in areas with different types of acid rain. Method Taking C. lanceolata plantation in Dongshanqiao Forest Farm in Nanjing as the research object, a control treatment (ck, mountain fire pool water, pH 6.6) was set. After 1 year of stress of different types of acid rain (sulfuric acid type, nitric acid type and mixed type) and acid rain acidity (simulated solution pH 4.5, 3.5 and 2.5), the effects of acid rain type change on soil nutrients and microorganisms in the C. lanceolata plantation were explored. Result With the increase of acid rain acidity, soil pH value of different types of acid rain treatment decreased significantly (P<0.05), while soil exchangeable hydrogen ions (H+) and aluminum ions (Al3+) increased significantly (P<0.05). Compared with the control (ck), when the pH value of acid rain was 2.5, the mean values of soil exchangeable H+ and Al3+ increased by 275% and 240% under sulfuric acid rain treatment, 254% and 246% under mixed acid rain treatment, and 246% and 249% under nitric acid rain treatment, respectively. In addition, the time of acid rain stress significantly affected the contents of soil total carbon, total nitrogen, total sulfur, available phosphorus and microbial C and N (P<0.05), but the type of acid rain had no significant effect on soil microbial C and N. After acid rain stress for 1 year, soil microbial C and N contents were the lowest under the treatment of pH 2.5 nitric acid rain, which were (378.89±60.69) and (38.67±4.10) mg·kg−1 respectively. According to the structural equation model, the effect of acid rain acidity on soil microbial C and N in the C. lanceolata plantation was stronger than that of acid rain type, which indirectly influenced microbial C and N mainly by affecting soil pH, available phosphorus and total carbon. Conclusion After 1 year of short-term acid rain stress, acid rain acidity is still the main factor affecting soil characteristics of C. lanceolata, and the change of acid rain type will intensify the inhibition effect of acid rain acidity on soil characteristics of C. lanceolata plantation. [Ch, 6 fig. 3 tab. 29 ref.] -
表 1 不同酸雨类型与酸雨酸度下土壤pH的方差分析
Table 1. P values of soil pH under different acid rain types and acid rain stress
影响因子 3个月 6个月 9个月 12个月 酸雨类型 0.403 0.672 0.220 0.703 酸雨酸度 <0.001*** <0.001*** <0.001*** 0.006** 酸雨类型×酸雨酸度 0.992 0.981 0.657 0.966 时间 <0.001*** 酸雨类型×酸雨酸度×时间 0.999 说明:数值为显著性P值。**P<0.01;***P<0.001 表 2 不同酸雨类型与酸雨胁迫下土壤各指标的方差分析
Table 2. P values of soil acidity index under different acid rain types and acid rain stress
影响因子 土壤指标 3个月 6个月 9个月 12个月 酸雨类型 <0.001*** 0.534 0.787 0.278 酸雨酸度 <0.001*** <0.001*** <0.001*** <0.001*** 酸雨类型×酸雨酸度 交换性H+ <0.001*** 0.855 0.816 0.605 时间 <0.001*** 酸雨类型×酸雨酸度×时间 <0.001*** 酸雨类型 0.013* 0.496 0.902 0.990 酸雨酸度 <0.001*** <0.001*** <0.001*** <0.001*** 酸雨类型×酸雨酸度 交换性Al3+ <0.001*** 0.669 0.227 0.052 时间 <0.001*** 酸雨类型×酸雨酸度×时间 <0.001*** 酸雨类型 0.805 0.721 0.531 0.635 酸雨酸度 0.371 0.306 0.070 0.710 酸雨类型×酸雨酸度 总碳 0.961 0.379 0.320 0.782 时间 0.018* 酸雨类型×酸雨酸度×时间 0.688 酸雨类型 0.517 0.896 0.704 0.861 酸雨酸度 0.333 0.315 0.344 0.924 酸雨类型×酸雨酸度 总氮 0.942 0.957 0.975 0.118 时间 0.009** 酸雨类型×酸雨酸度×时间 0.862 酸雨类型 0.783 0.840 0.496 0.907 酸雨酸度 0.232 0.900 0.190 0.904 酸雨类型×酸雨酸度 碳氮比 0.951 0.249 0.592 0.598 时间 0.513 酸雨类型×酸雨酸度×时间 0.816 酸雨类型 0.550 0.880 0.990 0.382 酸雨酸度 0.395 0.770 0.409 0.640 酸雨类型×酸雨酸度 总硫 0.986 0.708 0.987 0.675 时间 <0.001*** 酸雨类型×酸雨酸度×时间 0.995 酸雨类型 0.315 0.340 0.379 0.447 酸雨酸度 0.379 0.049* 0.430 0.121 酸雨类型×酸雨酸度 有效磷 0.768 0.012* 0.648 0.482 时间 <0.001*** 酸雨类型×酸雨酸度×时间 0.159 酸雨类型 0.058 0.246 0.274 0.481 酸雨酸度 <0.001*** 0.012* 0.492 0.104 酸雨类型×酸雨酸度 速效钾 0.809 0.029* 0.651 0.707 时间 0.276 酸雨类型×酸雨酸度×时间 0.534 酸雨类型 0.900 0.959 0.842 0.971 酸雨酸度 0.334 0.383 0.449 0.497 酸雨类型×酸雨酸度 土壤微生物量碳 0.977 0.998 0.989 0.997 时间 <0.001*** 酸雨类型×酸雨酸度×时间 1.000 酸雨类型 0.886 0.820 0.990 0.993 酸雨酸度 0.101 0.171 0.274 0.100 酸雨类型×酸雨酸度 土壤微生物量氮 0.972 0.998 0.994 0.990 时间 <0.001*** 酸雨类型×酸雨酸度×时间 1.000 说明:数值为显著性P值。*P<0.05;**P<0.01;***P<0.001 表 3 结构方程中各因子与微生物量碳氮之间的相关性
Table 3. Correlation of parameters and microbial carbon and nitrogen
自变量 酸雨
pH值土壤酸
根离子土壤
pH有效磷 总碳 微生物
量碳总效应 微生物量碳 0.154 0.025 −0.855 0.204 0.139 间接效应 −0.412 0.065 −0.132 总效应 微生物量氮 0.141 0.009 −0.879 0.201 0.200 0.776 间接效应 0.025 0.032 −0.702 0.158 0.108 -
[1] 徐雪蕾. 间伐对杉木人工林的生长调控作用研究[D]. 北京: 北京林业大学, 2020. XU Xuelei. Regulation of Thinning on the Tree Growth in Chinese Fir Plantations[D]. Beijing: Beijing Forestry University. 2020. [2] 盛炜彤. 关于我国人工林长期生产力的保持[J]. 林业科学研究, 2018, 31(1): 1 − 14. SHENG Weitong. On the maintenance of long-term productivity of plantation in China [J]. For Res, 2018, 31(1): 1 − 14. [3] ZHAO Yu, DUAN Lei, JIA Xing, et al. Soil acidification in China: is controlling SO2 emissions enough? [J]. Environ Sci Technol, 2009, 43(21): 8021 − 8026. [4] TU Jun, WANG Hesheng, ZHANG Zifang, et al. Trends in chemical composition of precipitation in Nanjing, China, during 1992–2003 [J]. Atmos Res, 2005, 73(3/4): 283 − 298. [5] LIU Xin, LI Chong, MENG Miaojing, et al. Comparative effects of the recovery from sulfuric and nitric acid rain on the soil enzyme activities and metabolic functions of soil microbial communities [J/OL]. Sci Total Environ, 714: 136788[2022-01-10]. doi: 10.1016/j.scitotenv.2020.136788. [6] HAMER U, POTTHAST K, MAKESCHIN F. Urea fertilisation affected soil organic matter dynamics and microbial community structure in pasture soils of Southern Ecuador [J]. Appl Soil Ecol, 2009, 43(2/3): 226 − 233. [7] LIU Xingmei, ZHOU Jian, LI Wanlu, et al. The combined effects of urea application and simulated acid rain on soil acidification and microbial community structure [J]. Environ Sci Pollut Res Int, 2014, 21(10): 6623 − 6631. [8] QIU Qingyan, WU Jianping, LIANG Guohua, et al. Effects of simulated acid rain on soil and soil solution chemistry in a monsoon evergreen broad-leaved forest in southern China[J/OL]. Environ Monit Assess, 2015, 187(5): 272[2022-01-11]. doi: 10.1007/s10661-015-4492-8. [9] LING Dajiong, HUANG Qianchun, YING Ouyang. Impacts of simulated acid rain on soil enzyme activities in a latosol [J]. Ecotoxicol Environ Saf, 2010, 73(8): 1914 − 1918. [10] 刘源月, 江洪, 李雅红, 等. 模拟酸雨对杉木幼苗-土壤复合体系土壤呼吸的短期效应[J]. 生态学报, 2010, 30(8): 2010 − 2017. LIU Yuanyue, JIANG Hong, LI Yahong, et al. A short-term effect of simulated acid rain on the soil respiration of the compound system of Chinese fir seedling-soil [J]. Acta Ecol Sin, 2010, 30(8): 2010 − 2017. [11] 周正虎, 王传宽. 生态系统演替过程中土壤与微生物碳氮磷化学计量关系的变化[J]. 植物生态学报, 2016, 40(12): 1257 − 1266. ZHOU Zhenghu, WANG Chuankuan. Changes of the relationships between soil and microbes in carbon, nitrogen and phosphorus stoichiometry during ecosystem succession [J]. Chin J Plant Ecol, 2016, 40(12): 1257 − 1266. [12] 何容, 汪家社, 施政, 等. 武夷山植被带土壤微生物量沿海拔梯度的变化[J]. 生态学报, 2009, 29(9): 5138 − 5144. HE Rong, WANG Jiashe, SHI Zheng, et al. Variations of soil microbial biomass across four different plant communities along an elevation gradient in Wuyi Mountains, China [J]. Acta Ecol Sin, 2009, 29(9): 5138 − 5144. [13] 漆良华, 张旭东, 周金星, 等. 湘西北小流域不同植被恢复区土壤微生物数量、生物量碳氮及其分形特征[J]. 林业科学, 2009, 45(8): 14 − 20. QI Lianghua, ZHANG Xudong, ZHOU Jinxing, et al. Soil microbe quantities microbial carbon and nitrogen and fractal characteristics under different vegetation restoration patterns in watershed northwest Hunan [J]. Sci Silv Sin, 2009, 45(8): 14 − 20. [14] DU Enzai, DONG Dan, ZENG Xuetong, et al. Direct effect of acid rain on leaf chlorophyll content of terrestrial plants in China [J]. Sci Total Environ, 2017, 605/606: 764 − 769. [15] 王轶浩, 陈展, 周建岗, 等. 重庆酸雨区马尾松纯林改造对土壤酸化特征及团聚体稳定性的影响[J]. 生态学报, 2021, 41(13): 5184 − 5194. WANG Yihao, CHEN Zhan, ZHOU Jiangang, et al. Effects of transformation of Masson pine forest on characteristics of soil acidification and aggregate stability within polluted areas of Chongqing [J]. Acta Ecol Sin, 2021, 41(13): 5184 − 5194. [16] LIU Xin, ZHANG Bo, ZHAO Wenrui, et al. Comparative effects of sulfuric and nitric acid rain on litter decomposition and soil microbial community in subtropical plantation of Yangtze River Delta region [J]. Sci Total Environ, 2017, 601/602: 669 − 678. [17] 刘鑫. 长三角区域典型林分土壤及树木细根对酸雨的响应[D]. 南京: 南京林业大学, 2018. LIU Xin. Effects of Acid Rain on Soil and Fine Root of Typical Plantation in Yangtze Delta Region[D]. Nanjing: Nanjing Forestry University, 2018. [18] LI Junhui, JIA Chongjian, LU Yin, et al. Multivariate analysis of heavy metal leaching from urban soils following simulated acid rain [J]. Microchem J, 2015, 122: 89 − 95. [19] 房焕英, 肖胜生, 潘萍, 等. 湿地松林土壤生化特性和酶活性对模拟硫沉降的响应[J]. 水土保持学报, 2019, 33(6): 318 − 325. FANG Huanying, XIAO Shengsheng, PAN Ping, et al. Effects of sulphur deposition on soil biochemical properties and enzymes activities in Pinus elliottii plantation [J]. J Soil Water Conserv, 2019, 33(6): 318 − 325. [20] 胡波, 张会兰, 王彬, 等. 重庆缙云山地区森林土壤酸化特征[J]. 长江流域资源与环境, 2015, 24(2): 300 − 309. HU Bo, ZHANG Huilan, WANG Bin, et al. Characteristics of forest soil acidification in Jinyun Mountain area of Chongqing [J]. Resour Environ Yangtze Basin, 2015, 24(2): 300 − 309. [21] 刘俐, 宋存义, 李发生. 模拟酸雨对红壤中硅铝铁释放的影响[J]. 环境科学, 2007(10): 2376 − 2382. LIU Li, SONG Cunyi, LI Fasheng. Release of Si, Al and Fe in red soil under simulated acid rain [J]. Environ Sci, 2007(10): 2376 − 2382. [22] JOERGENSEN R G, ANDERSON T H, WOLTERS V. Carbon and nitrogen relationships in the microbial biomass of soils in beech (Fagus sylvatica L. ) forests [J]. Biol Fertil Soils, 1995, 19(2/3): 141 − 147. [23] 王国兵, 郝岩松, 王兵, 等. 土地利用方式的改变对土壤呼吸及土壤微生物生物量的影响[J]. 北京林业大学学报, 2006, 28(增刊 2): 73 − 79. WANG Guobing, HAO Yansong, WANG Bing, et al. Influence of land-use change on soil respiration and soil microbial biomass [J]. J Beijing For Univ, 2006, 28(suppl 2): 73 − 79. [24] RAMIREZ K S, CRAINE J M, FIERER N. Consistent effects of nitrogen amendments on soil microbial communities and processes across biomes [J]. Global Change Biol, 2012, 18(6): 1918 − 1927. [25] 周世兴, 邹秤, 肖永翔, 等. 模拟氮沉降对华西雨屏区天然常绿阔叶林土壤微生物生物量碳和氮的影响[J]. 应用生态学报, 2017, 28(1): 12 − 18. ZHOU Shixing, ZHOU Cheng, XIAO Yongxiang, et al. Effects of simulated nitrogen deposition on soil microbial biomass carbon and nitrogen in natural evergreen broad-leaved forest in the rainy area of west China [J]. Chin J Appl Ecol, 2017, 28(1): 12 − 18. [26] 李素新, 覃志杰, 刘泰瑞, 等. 模拟氮沉降对华北落叶松人工林土壤微生物碳和微生物氮的动态影响[J]. 水土保持学报, 2020, 34(1): 268 − 274. LI Suxin, TAN Zhijie, LIU Tairui, et al. Effects of simulated nitrogen deposition on soil microbial carbon and nitrogen dynamics of Larix principis-rupprechtii plantation [J]. J Soil Water Conserv, 2020, 34(1): 268 − 274. [27] 王宁, 王美菊, 李世兰, 等. 降水变化对红松阔叶林土壤微生物生物量生长季动态的影响[J]. 应用生态学报, 2015, 26(5): 1297 − 1305. WANG Ning, WANG Meiju, LI Shilan, et al. Effects of precipitation variation on growing seasonal dynamics of soil microbial biomass in broadleaved Korean pine mixed forest [J]. Chin J Appl Ecol, 2015, 26(5): 1297 − 1305. [28] POTILA H, SARJALA T. Seasonal fluctuation in microbial biomass and activity along a natural nitrogen gradient in a drained peatland [J]. Soil Biol Biochem, 2004, 36(7): 1047 − 1055. [29] LÜ Yanna, WANG Congyan, JIA Yanyan, et al. Effects of sulfuric, nitric, and mixed acid rain on litter decomposition, soil microbial biomass, and enzyme activities in subtropical forests of China [J]. Appl Soil Ecol, 2014, 79: 1 − 9. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220132






 下载:
下载: