-
植物化感作用是一种活或死的植物通过适当的途径向环境释放特定的化学物质而直接或间接影响邻近或下茬植物萌发或生长的效应[1]。在自然条件下,水溶性的化感物质主要随着雨水等的冲刷从凋落物淋溶进入土壤中,对周围植物生长产生影响。凋落物的化感作用是影响林木自然更新的一个重要因子,凋落物产生的化感物质对种子萌发和胚生长具有重要影响[2]。刺槐Robinia pseudoacacia为落叶乔木,具有适应性强、耐干旱贫瘠、易繁殖、生长快、固氮等特性,是中国广泛栽培的阔叶乔木树种之一。伐后萌蘖更新是刺槐人工林的主要更新方式[3],利用刺槐具有根系发达、萌蘖能力强等特性,快速更新成为林分。但随着皆伐后萌蘖再皆伐再萌蘖的多代连作,在三代、四代及以后刺槐萌生形成的次生林中出现生产力逐代下降、生长迟缓以及树干弯曲等连栽障碍[4],影响刺槐林的生产效率,因此刺槐的实生更新问题受到人们关注。有研究表明,在近自然条件下,刺槐实生更新困难,林下种子天然萌发率及胚生长存活率均较低[5]。森林内的林木种子主要分布在凋落物以及腐殖质层[6],刺槐的凋落物层会加速种子损失率[6],凋落物分解过程中会产生一些次生代谢产物[7],对刺槐种子的萌发和胚生长可能会产生影响。因此,本研究主要探讨连栽刺槐人工林下凋落物是否具有化感作用影响自身种子萌发。研究表明杨树Populus的化感作用随着连栽代数的增加而增加[8],随着马尾松Pinus massoniana连栽代数以及林龄的增加,浸提液中化感物质的种类增加[9]。
刺槐化感作用的研究集中在刺槐凋落物与根际土壤对其他的植物生长的影响。已有研究表明:刺槐凋落叶的浸提液对绿豆Vigna radiata具有较强的抑制作用,对甜瓜Cucumis melo具有较弱的促进作用[10];随刺槐凋落物浸提液质量浓度的升高,对马尾松生长的促进作用转变为抑制作用,刺槐凋落物的浸提液对马尾松胚的地径、苗高、主根长、地上部鲜质量和地下部鲜质量均表现为促进效应[11−12];刺槐根际土壤的水浸提液对5种园林植物的生长表现为抑制作用[13],刺槐叶片混合土壤对食用植物以及杂草生长具有抑制作用[14];刺槐根际土壤以及刺槐凋落物的浸提液对刺槐种子萌发呈低促进高抑制的趋势,刺槐根际土的浸提液对刺槐苗木生长也呈现低促高抑的趋势[15];在黄土地区,刺槐凋落物的浸提液对刺槐自身种子萌发和胚生长具有抑制作用,刺槐根系、根际土壤的浸提液对刺槐的生长呈现低促进高抑制的化感作用,并检测出37种化感物质[16−17]。
不同经营世代和不同林龄刺槐凋落物对自身种子萌发的影响研究极少。本研究针对不同刺槐林下凋落物的浸提液,研究其对种子萌发及胚生长的影响,以期揭示刺槐多代连作培育经营下实生更新困难与刺槐自身化感效应关系,为刺槐人工林高效培育与可持续经营提供科学依据。
-
刺槐人工林位于河南省洛阳市洛宁县马店镇国有吕村林场(34°06′~34°38′N,111°08′~111°50′E),选取刺槐一代幼龄林(F1-1)、一代中龄林(F1-2)、一代成熟林(F1-3)、二代幼龄林(F2-1)、二代中龄林(F2-1)、二代成熟林(F2-3)、三代幼龄林(F3-1)、三代中龄林(F3-2)、三代成熟林(F3-3)进行设置样地(表1),样地面积为20 m×20 m,每种林分设置3个重复样地,共计27块刺槐样地。对样地进行基本林分调查,包括海拔、坡度、胸径、树高、活枝下高、郁闭度、植被等。刺槐一代林是实生苗,二代林和三代林分别是一代林经过1次和2次皆伐后萌蘖形成的林分,幼龄林、中龄林、成熟林分别为6~7 a、12~15 a、15 a以上的林分。林下植被主要包括荆条Vitex negundo、夏至草Lagipsis supina、堇菜Viola verecunda、求米草Oplismenus undulatifolius、白屈菜Chelidonium majus、葎草Humulus scandens等。
表 1 样地基本情况
Table 1. Basic situation of the sample plots
林分 海拔/
m坡度/
(°)胸径/
cm树高/
m活枝
下高/m密度/
(株·hm−2)郁闭度 F1-1 611 24 6.55 8.17 5.24 2258 0.57 F1-2 665 18 9.71 10.11 5.59 1558 0.47 F1-3 712 15 20.50 11.13 6.44 625 0.33 F2-1 817 16 6.78 8.17 5.56 2517 0.53 F2-2 646 14 10.02 9.86 4.51 1267 0.37 F2-3 644 25 14.92 10.35 6.16 983 0.37 F3-1 656 22 4.84 6.46 3.87 4250 0.53 F3-2 671 15 6.80 8.47 5.93 3742 0.43 F3-3 677 22 7.25 8.61 4.65 3292 0.53 -
2020年11月在不同林分的刺槐样地中收集林下凋落物(当年新鲜凋落的叶片和小枝,外表轮廓完整,可以辨认出叶片和小枝的形态和质地),在每块样地随机设立3个1 m×1 m的小样方收集样品,放入密封袋带回实验室,去除杂质,自然风干。供试种子为当地刺槐种子。
-
刺槐林下凋落物浸提液质量浓度设置需考虑凋落物与降雨量比例[18]。根据调查,刺槐人工林凋落物的现存量为80~220 g·m−2,该地区年平均降水量为570 mm,换算得凋落物浸提液质量浓度为1.0∶2.5~1.0∶10.0。将自然风干的凋落物按质量浓度1.0∶2.5加入适量蒸馏水,在180 r·min−1回旋式震荡1 h,使用滤纸进行过滤,得原液。考虑野外在非雨季时,凋落物处于干燥未被浸提的状态[19],将原液稀释2、4、8、16倍,得0.400、0.200、0.100、0.050、0.025 kg·L−1的浸提液,分别标记为C1~C5,将浸提液放入4 ℃冰箱保存备用。
-
种子萌发实验采用培养皿滤纸法。选取大小均匀一致、颗粒饱满的刺槐种子,用质量浓度为0.5%的高锰酸钾溶液浸泡消毒2 h后,使用蒸馏水冲洗干净,再用75~80 ℃的热水至自然冷却浸泡24 h,以破除种子硬实。发芽床由直径9 cm的双层定性滤纸和培养皿构成。取5 mL不同处理的浸提液,加入培养皿中,每个培养皿整齐均匀放置50粒处理后的刺槐种子,每个处理设置3个重复,加入等量蒸馏水为对照(ck)。将培养皿放置于人工培养箱,设置光周期为16 h光/8 h暗,温度为25 ℃,相对湿度为80%。每天定量补充相应处理浸提液使滤纸保持湿润。
-
种子置床当天为第1天,之后每天同一时间观察记录发芽种子数,以胚根露出种皮1~2 mm为发芽标准,大部分处理连续3 d无种子萌发时,结束发芽试验,记录腐烂种子和硬实种子的数量。计算发芽率、发芽势、发芽速度指数、活力指数,并使用精度0.01 cm的游标卡尺测量胚根长和胚芽长,用精度0.0001 g的电子天平称量每皿胚根和胚芽的鲜质量和干质量。发芽率=(发芽种子数/供试种子总数)×100%;发芽势=(日发芽种子数达到最高峰/供试种子总数)×100%;发芽速度指数I=2×(6x1+5x2+4x3+3x4+2x5+x6)[20],x指每天发芽的种子数,解释化感物质对种子发芽的延缓作用,高于对照表示促进作用。活力指数=发芽指数×苗长,其中,发芽指数=
$ \displaystyle\sum \dfrac{\mathrm{每}\mathrm{天}\mathrm{的}\mathrm{发}\mathrm{芽}\mathrm{数}}{\mathrm{相}\mathrm{应}\mathrm{的}\mathrm{发}\mathrm{芽}\mathrm{天}\mathrm{数}} $ ,种子活力指数是衡量种子发芽期长短,胚是否健壮的重要指标,其值越大,表示胚越健壮,生长越好。化感综合效应指数反映化感效应的强弱,指同一处理下对同一受体各测试项目化感效应指数的算术平均值。种子萌发化感综合效应指数指发芽率、发芽势、发芽速度指数、活力指数等指标的化感效应指数的平均值。胚生长化感综合效应指数指胚根长、胚芽长、胚根鲜质量、胚芽鲜质量、胚根干质量、胚芽干质量等指标的化感效应指数的平均值。化感效应指数(IR)[21]:IR=1−Ick/ IT(IT≥Ick);IR= IT/Ick−1(IT<Ick)。其中,Ick为对照值,IT为凋落物浸提液的处理值。当IR>0时,表示促进作用;当IR<0时,表示抑制作用。IR绝对值越大,化感效应强度也越大。
-
用Excel 2019对数据进行基本汇总和处理,用SPSS 23软件进行分析,采用方差分析和多重比较分析不同处理之间的差异性,各林分之间的多重比较结果是同一质量浓度下多重比较的平均值。所有图使用Origin 2017进行绘制。数据均为平均值±标准误。
-
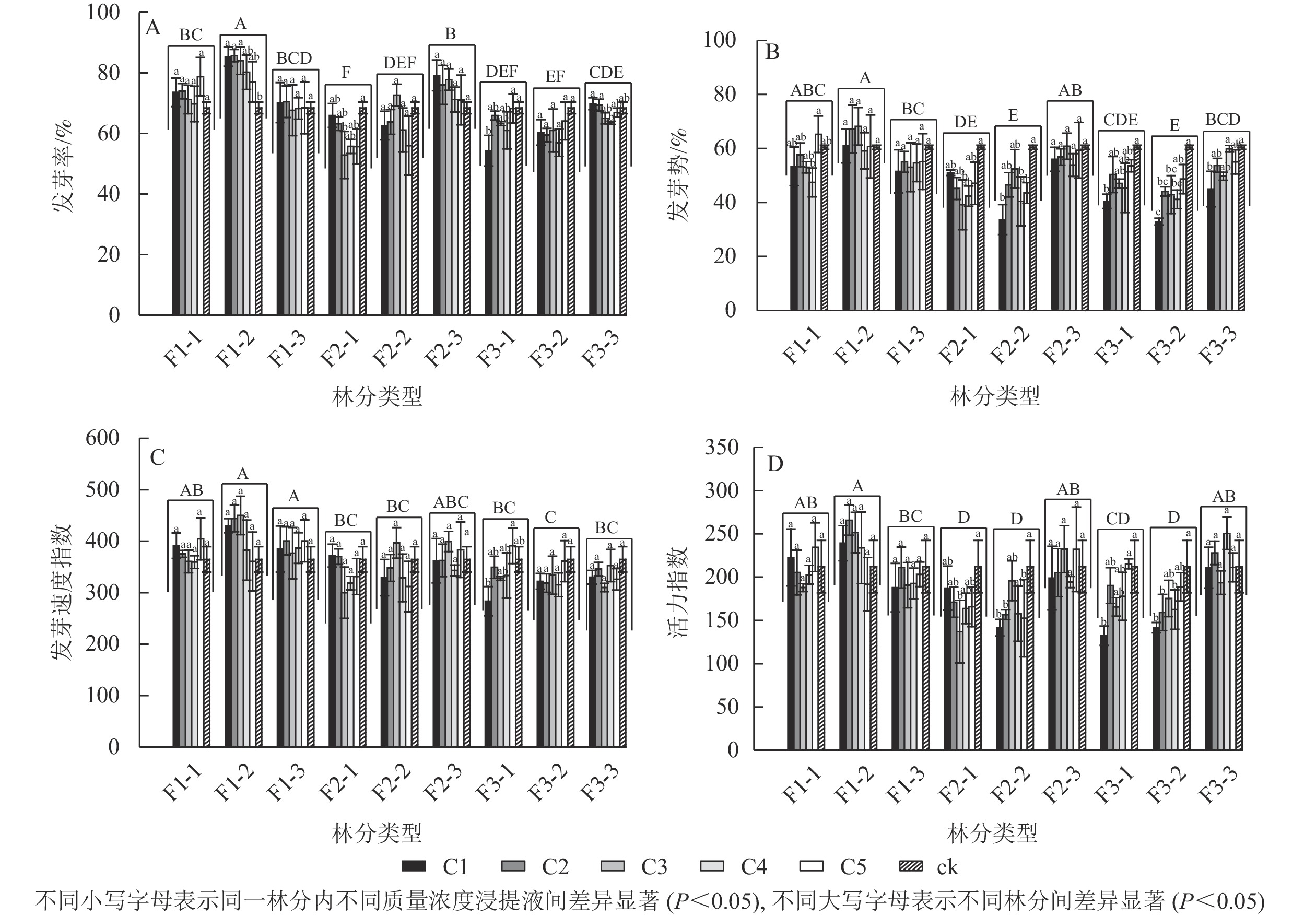
由图1A可见:不同林分凋落物浸提液处理下的刺槐种子发芽率具有显著差异(P<0.05),其中一代中龄林的凋落物浸提液处理下的刺槐种子发芽率最高,二代幼龄林发芽率最低。大多数林分不同质量浓度浸提液处理下的发芽率之间无显著差异。一代中龄林中,不同浸提液质量浓度之间的发芽率有显著差异(P<0.05),随着浸提液质量浓度的降低,其发芽率呈下降趋势,与对照相比,C1、C2、C3处理对发芽率具有显著促进作用(P<0.05);二代幼龄林中,发芽率随浸提液质量浓度的降低呈先下降后上升的趋势,C3对发芽率的抑制作用最强,发芽率与对照相比显著减少了22.74%(P<0.05);三代幼龄林中,随着浸提液质量浓度的降低,发芽率呈上升趋势,C1的发芽率与对照相比显著降低了20.66%(P<0.05);三代成熟林中,C4的发芽率比C1、C2分别显著下降9.95%、9.18%(P<0.05),随着浸提液质量浓度的下降,发芽率呈下降趋势。
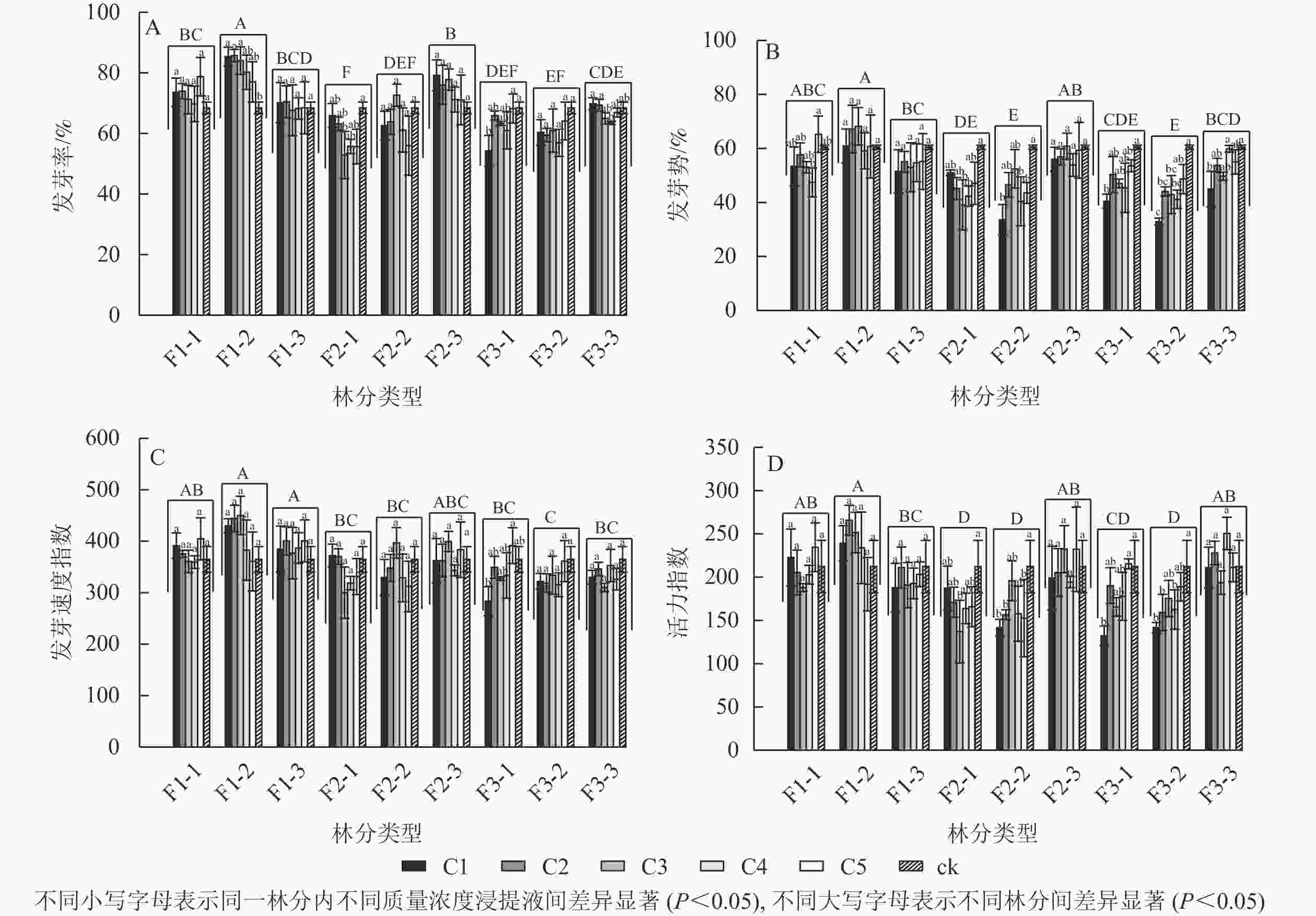
图 1 不同林分及不同质量浓度刺槐凋落物浸提液对刺槐种子萌发的影响
Figure 1. Effects of different forests and different concentrations of R. pseudoacacia litter extracts on their own seed germination
由图1B可见:不同林分凋落物浸提液处理下的刺槐种子发芽势具有显著差异(P<0.05),其中一代中龄林的凋落物浸提液处理下的刺槐种子发芽势最高,二代中龄林和三代中龄林其发芽势最低。随着凋落物质量浓度的变化,一代中龄林、一代成熟林、二代成熟林的凋落物浸提液对发芽势无显著差异。一代幼龄林中,与C5比较,C4处理的发芽势显著下降了27.30%(P<0.05)。二代幼龄林中,C3与对照组相比发芽势显著降低了35.27%(P<0.05),随着质量浓度的降低,其发芽势呈先下降后上升趋势。二代中龄林中,与对照组相比,C1、C4处理的发芽势分别下降了44.36%、33.17%(P<0.05)。三代幼龄林和三代中龄林下,其发芽势呈高质量浓度抑制作用,低质量浓度抑制作用减弱趋势,C1的发芽势与对照相比较均具有显著差异(P<0.05)。三代成熟林,与C4和对照相比,C1的发芽势分别显著下降了24.90%、25.64%(P<0.05),高质量浓度抑制其发芽势。
由图1C可见:不同林分凋落物浸提液处理下的刺槐种子发芽速度指数具有显著差异(P<0.05),其中一代中龄林和一代成熟林凋落物浸提液处理下的刺槐种子发芽速度指数最高,三代中龄林发芽速度指数最低。不同林分下的各质量浓度凋落物浸提液对刺槐种子发芽速度指数无显著差异,除了在三代幼龄林中的凋落物浸提液,与C5相比,C1的发芽速度指数显著下降了27.60%(P<0.05),呈高质量浓度抑制低质量浓度促进趋势。
由图1D可见:不同林分凋落物浸提液处理下的刺槐种子活力指数之间具有显著差异(P<0.05)。一代中龄林凋落物浸提液处理下的刺槐种子活力指数最高,二代幼龄林、二代中龄林、三代中龄林活力指数较低。部分林分下的各质量浓度凋落物浸提液对刺槐种子活力指数之间具有显著差异(P<0.05)。在二代幼龄林中,C3处理下的种子活力指数呈最低值,较对照组的活力指数显著下降了35.39%(P<0.05),随着质量浓度的降低,种子的活力指数呈先下降后上升趋势。在二代中龄林中,与对照组相比,C1、C2、C5处理下的活力指数分别显著下降了33.25%、26.18%、28.06%(P<0.05)。在三代幼龄林中,与对照和C5处理相比,C1处理下的种子活力指数分别下降37.60%、38.54%(P<0.05),高质量浓度抑制种子活力,低质量浓度促进种子活力。在三代中龄林中,与对照相比,C1、C2、C4处理下的种子活力分别显著下降了33.22%、24.96%、23.38%(P<0.05)。
-
由图2A可见:不同林分凋落物浸提液处理下的刺槐胚根长具有显著差异(P<0.05),三代成熟林凋落物浸提液处理下的刺槐胚根最长,二代中龄林胚根长达最低。除了三代成熟林,其他林分下各质量浓度凋落物浸提液的刺槐胚根长之间具有显著差异(P<0.05),对照胚根显著长于其他质量浓度处理下的胚根(P<0.05)。大部分林分下,高质量浓度对胚根长的抑制作用较强,低质量浓度对其抑制作用减弱。

图 2 不同林分及不同质量浓度刺槐凋落物浸提液对刺槐胚生长的影响
Figure 2. Effect of different forestands and different concentrations of R. pseudoacacia litter extract on the growth of its own embryos
由图2B可见:不同林分凋落物浸提液处理下的刺槐胚芽长具有显著差异(P<0.05),三代成熟林凋落物浸提液处理下刺槐胚芽长值最高,一代成熟林胚芽长达最低。在一代成熟林中不同质量浓度处理下的胚芽长呈显著差异(P<0.05),与对照相比,C2、C3、C4、C5处理下的胚芽长分别显著下降了19.88%、24.06%、14.51%、21.07%(P<0.05)。在三代成熟林中,各质量浓度凋落物浸提液处理下的胚芽长显著高于对照的胚芽长(P<0.05)。其他林分下不同质量浓度之间处理下的胚芽长没有显著差异。
由图2C可见:不同林分凋落物浸提液处理下的刺槐胚根鲜质量具有显著差异(P<0.05),三代中龄林和三代成熟林凋落物浸提液处理下的胚根鲜质量较高,一代成熟林和二代成熟林胚根鲜质量较低。在所有的林分中,对照处理下的胚根鲜质量显著大于其他质量浓度处理(P<0.05),大部分呈现高质量浓度浸提液处理下对胚根鲜质量的抑制作用较强,而低质量浓度处理下对其抑制作用减弱。
由图2D可见:不同林分凋落物浸提液处理下刺槐胚芽鲜质量之间具有显著差异(P<0.05),一代中龄林凋落物浸提液处理下的胚芽鲜质量最高,二代成熟林胚芽鲜质量值最低。二代中龄林中,与对照相比,C4、C5处理下的胚芽鲜质量分别显著下降28.21%、28.39%(P<0.05);二代成熟林中,与对照相比,C1、C3处理下的胚芽鲜质量分别显著降低32.50%、37.23%(P<0.05);三代幼龄林中,C1、C3、C4处理下显著抑制胚芽鲜质量,其分别较对照降低了40.27%、30.78%、28.96%(P<0.05)。三代中龄林中,与对照相比,C4处理下的胚芽鲜质量显著降低了24.46%(P<0.05)。
由图2E可见:不同林分凋落物浸提液处理下的刺槐胚根干质量之间具有显著差异(P<0.05),二代成熟林凋落物浸提液处理下的胚根干质量最大,二代幼龄林、三代中龄林、三代成熟林胚根干质量较小。绝大多数林分下凋落物浸提液处理下刺槐胚根干质量之间没有显著差异,除了一代中龄林和三代幼龄林。在一代中龄林中,与C1相比,C4和对照的胚根干质量分别显著下降了32.31%、30.86%(P<0.05),高质量浓度显著促进胚根干质量。在三代幼龄林中,与C5相比,C1、C3、对照的胚根干质量分别显著下降了42.10%、26.82%、31.64%(P<0.05),低质量浓度显著促进胚根干质量。
由图2F可见:不同林分凋落物浸提液处理下的刺槐胚芽干质量之间具有显著差异(P<0.05),一代中龄林凋落物浸提液处理下的胚芽干质量最大,三代中龄林胚芽干质量最小。大部分林分下不同质量浓度凋落物浸提液处理下刺槐胚芽干质量之间没有显著差异,除了三代幼龄林和三代中龄林。在三代幼龄林中,与C5相比,C1处理下的胚芽干质量显著下降了35.62%(P<0.05),高质量浓度抑制胚芽干质量,低质量浓度促进胚芽干质量。在三代中龄林中,与C5和对照相比,C4处理下的胚芽干质量显著下降了26.79%、28.98% (P<0.05)。
-
由图3A可见:从4个种子萌发指标的化感综合效应指数来看,大部分林分凋落物浸提液处理下的种子萌发受到抑制,只有在一代幼龄林C5,一代中龄林C1、C2、C3、C4,二代成熟林C3、C5处理下,表现出对种子萌发的促进作用。综合所有林分平均化感综合效应指数来看,各林分的抑制作用从大到小依次为三代中龄林、二代幼龄林、二代中龄林、三代幼龄林、三代成熟林、一代成熟林、一代幼龄林、二代成熟林、一代中龄林,其中一代中龄林凋落物浸提液对刺槐种子萌发表现为促进作用,化感综合效应指数为0.063,而三代中龄林化感综合效应指数为−0.211。在二代和三代林下,随着刺槐年龄的增加,其凋落物浸提液对刺槐种子萌发的抑制作用呈降低趋势。一代林中,中龄林凋落物浸提液促进种子萌发,幼龄林和成熟林其处理抑制种子萌发。在同一龄级下,随着刺槐经营世代的增加其凋落物浸提液对种子萌发的抑制作用呈上升趋势。
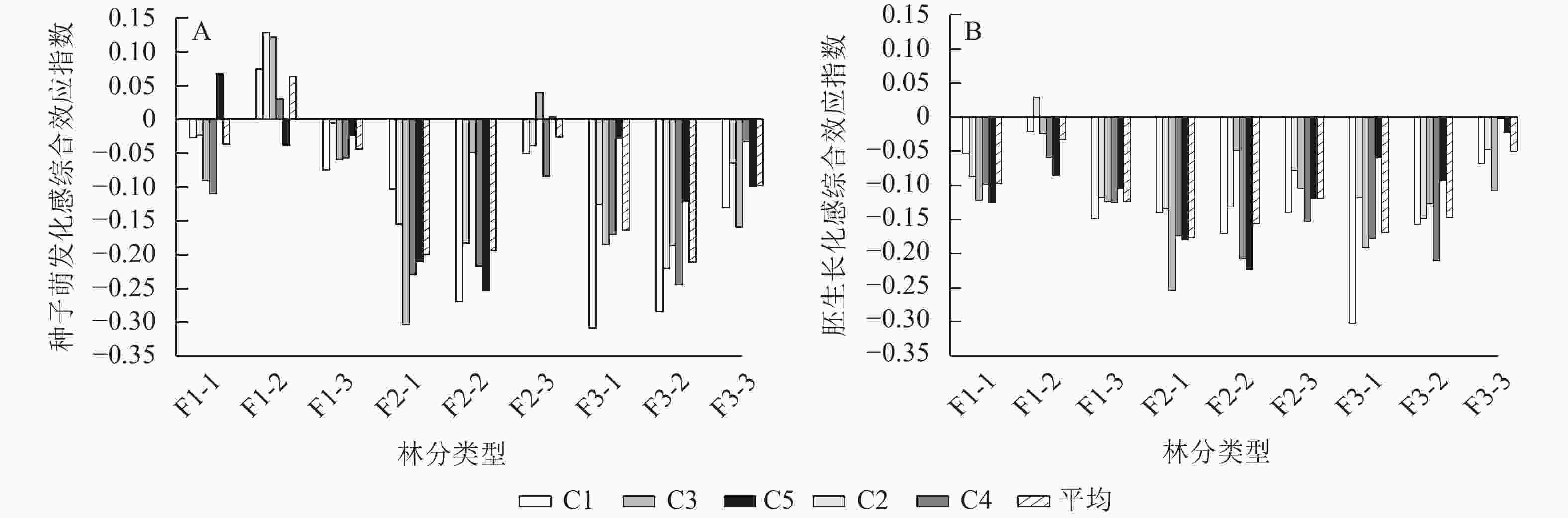
图 3 不同林分以及不同质量浓度刺槐凋落物浸提液对种子萌发和胚生长的化感综合效应
Figure 3. Allelopathy of different forest types and different concentrations of R. pseudoacacia litter extracts on seed germination and embryo growth
由图3B可见:从6个胚生长指标的化感综合效应指数来看,凋落物浸提液处理下的胚生长都被抑制生长。综合所有林分平均化感综合效应指数来看,各个林分的抑制作用从大到小依次为二代幼龄林、三代幼龄林、二代中龄林、三代中龄林、一代成熟林、二代成熟林、一代幼龄林、三代成熟林、一代中龄林,最强与最弱的抑制作用化感综合效应指数分别为−0.156和−0.032。在一代林下,凋落物浸提液的抑制作用从大到小依次为一代成熟林、一代幼龄林、一代中龄林。在二、三代林下,随着刺槐人工林年龄的增加,其林下凋落物浸提液对刺槐胚生长的抑制作用呈减弱趋势。在幼龄林和中龄林下,一代林刺槐凋落物浸提液处理下对胚生长的抑制作用最弱,二代林和三代林处理下对胚生长的抑制作用相同。在成熟林中,随着经营的增加,凋落物浸提液对刺槐胚生长的抑制作用呈现下降的趋势。
-
本研究发现:刺槐凋落物浸提液对刺槐自身种子萌发和胚生长表现出一定的抑制作用,与已有研究[15-16]结论一致。刺槐凋落物浸提液对种子萌发的抑制作用主要表现在降低种子发芽率、延长种子发芽时间、降低种子活力,刺槐凋落物浸提液对胚根的抑制作用强于对胚芽的抑制作用,胚根对浸提液的敏感性强于胚芽。这与前人的研究结果一致[22-23],这可能是胚根最先接触和吸收化感物质[24],而当胚根受到一定程度伤害时,水分和养分不能正常供给,胚芽才会表现出受害症状。已有研究[25-26]发现:化感物质对胚根生长的抑制作用导致植物根系表面积减小,吸水以及吸肥能力降低,因此导致胚根鲜质量较小。本研究也发现:对照的胚根鲜质量均大于刺槐凋落物浸提液处理的胚根鲜质量。刺槐凋落物浸提液对胚芽的抑制作用,也表现在鲜质量较小,这是由于根部受到损害,水分和养分不能正常供给时,地上部分表现出一定的症状[27]。刺槐凋落物浸提液对胚根和胚芽干质量的影响,可能由于影响叶绿素功能,造成胚的呼吸作用和光合作用的不平衡,导致生物量的积累或者消耗[28]。
同一物种在不同的生长时期会表现不同的化感潜力[29]。本研究表明:在二代林和三代林中,随着林龄的增加,刺槐凋落物浸提液对种子萌发和胚生长表现出自毒作用减弱趋势,对毛白杨Populus tomemtosa[26]、 对苜蓿Medicago sativa作用[30]的研究也得出一样的结论。陈淑芳[31]研究表明植物化感作用的强弱与植物自身的状况以及生存策略有关。刺槐为速生树种,当在幼龄林时期植物生长旺盛,其次植物种群之间的竞争也较为激烈,会分泌较多的化感物质,因而刺槐凋落物浸提液对刺槐自身化感抑制作用较强,而随着刺槐林龄的增加,个体生长趋于稳定,树木进入成熟期,为继续繁衍后代个体会产生较少的化感物质,其化感作用减弱。本研究发现:在一代林中,中龄林刺槐凋落物浸提液对种子萌发具有促进作用,对胚生长的抑制作用最小,这可能与环境因子有关[31-32]。环境因子会影响化感物质种类和数量的产生[33],在适宜的环境下,植物之间生存竞争小,向外界释放的化感物质较少,化感作用强度相对较弱[25]。本研究表明:在幼龄林和中龄林时,刺槐凋落物浸提液对自身种子萌发和胚生长的抑制作用随着经营世代的增加而增加;在成熟林时,随着经营世代的增加,刺槐凋落物浸提液对种子萌发的抑制作用呈上升趋势,对胚生长的抑制作用呈下降趋势,说明连栽刺槐会产生自毒作用。植物的化感物质浓度会随着种植密度的增加而增加[34]。前期调查发现随着刺槐林经营世代的增加,其密度呈增长趋势,因此刺槐的自毒作用增强。其次,随着经营世代增加,刺槐繁殖方式由实生繁殖转变为无性繁殖,刺槐产生的次生代谢物质的数量和种类发生一定的变化,并且部分代谢产物会通过各种方式累积下来。次生代谢产物不断增加,抑制作用也就加强[35]。此外,凋落物水淋溶的化感物质还受到微生物的作用,微生物影响化感物质的数量以及种类。有研究表明:二、三代刺槐人工林的微生物含量以及多样性大于一代林,微生物含量以及多样性增加会产生更多的化感物质[20],因此对植物生长的抑制作用增强。
本研究发现:刺槐人工林下凋落物浸提液的化感作用具有质量浓度效应,部分林分表现出随着质量浓度的增加,其抑制作用呈增加趋势,这种抑制作用的质量浓度效应与赵利等[36]的研究结果一致。这是由于化感物质影响植物自身对水分的吸收,质量浓度越高,植物水势就越低,水分胁迫就越严重,最终导致种子萌发延迟,胚生长也受到抑制[25]。其次,一些化感物质在高质量浓度会表现出强烈的抑制作用[27],高质量浓度下由于受到胁迫,植物细胞结构或者细胞功能遭到破坏[28],抑制种子萌发和胚生长。本研究发现:一些林分下种子萌发和胚生长的指标其抑制作用并没有随着浸提液稀释质量浓度的变化而变化,这可能是化感作用和资源限制之间相互抵消[18]。部分林分下种子萌发和胚生长指标在高质量浓度、中质量浓度表现促进作用,可能由于凋落物浸提液中含有植物生长需要的有机物质和营养元素[9],营养成分对植物生长的促进作用大于化感物质的抑制作用[37],也可能由于化感物质的复合效应[38],高质量浓度浸提液中同时含有对自身生长促进和抑制的化感物质,只是促进作用大于抑制作用。
Allelopathy of the litter extracts from Robinia pseudoacacia forest on its seed germination and embryo growth
-
摘要:
目的 探究不同世代和不同林龄刺槐Robinia pseudoacacia林下凋落物浸提液对自身种子萌发和胚生长的化感作用,旨在阐明刺槐林实生更新困难的原因。 方法 以刺槐人工林凋落物浸提液为化感物质来源,以刺槐种子为研究对象,采用培养皿滤纸法,分析不同经营世代及不同林龄的刺槐林下凋落物浸提液对刺槐种子发芽率、发芽势、发芽速度指数、活力指数以及胚生长的影响。 结果 刺槐林下凋落物浸提液抑制刺槐自身种子萌发和胚生长,且凋落物浸提液对胚根生长的抑制作用强于胚芽,不同林分以及不同质量浓度浸提液之间差异显著。在二代林和三代林中,随着林龄的增加,刺槐凋落物浸提液对种子萌发和胚生长的抑制作用呈减弱的趋势;在一代林中,中龄林凋落物浸提液对种子萌发具有促进作用,对胚生长的抑制作用较弱,化感综合效应指数分别为0.006和−0.032。随着经营世代的增加,幼龄林和中龄林下,刺槐凋落物浸提液对种子萌发和胚生长的抑制作用增强;成熟林下,随着经营世代的增加,其凋落物浸提液对种子萌发的抑制作用呈增加趋势,化感综合效应指数从0.044增加至0.097,对胚生长的抑制作用呈下降趋势,化感综合效应指数从0.124下降至0.050。部分林分下的凋落物浸提液具有质量浓度效应,对种子萌发和胚生长的抑制作用随着质量浓度的降低而减弱。 结论 不同林分刺槐林下凋落物浸提液对自身种子萌发和胚生长呈抑制作用;在二代和三代林下,凋落物浸提液随着林分年龄的增加,对刺槐种子萌发和胚生长的抑制作用呈减弱趋势;在幼龄林和中龄林下,凋落物浸提液随着经营世代的增加,对刺槐种子萌发和胚生长的抑制作用呈上升趋势。综上所述,连栽阻碍了刺槐实生苗的天然更新,但随着林龄的增加,对实生苗更新的阻碍作用会减弱。图3表1参38 Abstract:Objective This study, with an exploration of the allelopathic effects of understory litter extracts from different stand types of Robinia pseudoacacia on seed germination and embryo growth, is aimed to clarify causes of the difficulty in seedling regeneration under R. pseudoacacia forest. Method With the litter extracts of R. pseudoacacia plantation used as the source of allelochemicals and the seeds of R. pseudoacacia being the subjects of study, the Petri dish filter paper method was emoloyed to analyze the effects of the understory litter extracts of different management generations and different stand ages on the germination rate, germination potential, germination speed index, vigor index and embryo growth of R. pseudoacacia. Result (1) The litter extracts under the R. pseudoacacia forest inhibited the germination and embryo growth of R. seudoacacia and the inhibitory effect of the litter extract on the growth of the radicle was stronger than that of the embryo. (2) There were significant differences between different forest types and different concentrations in the second-generation forest and the third-generation forest, the inhibitory effect of R. pseudoacacia litter extract on seed germination and embryo growth decreased with the increase of forest age. (3) In the first-generation forest, the litter extracts of middle-aged forests could promote seed germination, but had a weak inhibitory effect on embryo growth with the allelopathic effect composite index being 0.006 and −0.032 respectively. (4) In middle-age forests, the inhibitory effect of R. pseudoacacia litter extract on seed germination and embryo growth increased with the increase of forest generations. (5) In mature forests, with the increase of forest generations, the inhibitory effect of the litter extract on seed germination showed an increasing trend with the allelopathy composite index increased from 0.044 to 0.097, whereas the inhibitory effect on embryo growth showed a decreasing trend, with the allelopathy composite index falling from 0.124 to 0.050. (6) The litter extract in some forest types had a concentration effect, and its inhibitory effect on seed germination and embryo growth weakened as the concentration decreased. Conclusion The litter extracts of different stand types of R. pseudoacacia undergrowth have an inhibitory effect on their own seed germination and embryo growth. In the second and third generation stands, the litter extract showed a weakening effect on the seed germination and embryo growth of R. pseudoacacia with the increase of stand age. In young-aged and middle-aged forests, the inhibitory effect of litter extract on seed germination and embryo growth of R. pseudoacacia increased with the increase of forest generation. In other words, continuous planting hinders the natural regeneration of seedlings of R. pseudoacacia, but as the forest age increases, the hindering effect on the regeneration of seedlings will be weakened. [Ch, 3 fig. 1 tab. 38 ref.] -
Key words:
- Robinia pseudoacacia /
- litter /
- seed germination /
- embryo growth /
- allelopathy
-
表 1 样地基本情况
Table 1. Basic situation of the sample plots
林分 海拔/
m坡度/
(°)胸径/
cm树高/
m活枝
下高/m密度/
(株·hm−2)郁闭度 F1-1 611 24 6.55 8.17 5.24 2258 0.57 F1-2 665 18 9.71 10.11 5.59 1558 0.47 F1-3 712 15 20.50 11.13 6.44 625 0.33 F2-1 817 16 6.78 8.17 5.56 2517 0.53 F2-2 646 14 10.02 9.86 4.51 1267 0.37 F2-3 644 25 14.92 10.35 6.16 983 0.37 F3-1 656 22 4.84 6.46 3.87 4250 0.53 F3-2 671 15 6.80 8.47 5.93 3742 0.43 F3-3 677 22 7.25 8.61 4.65 3292 0.53 -
[1] 孔垂华, 胡飞, 王朋. 植物化感(相生相克)作用[M]. 北京: 高等教育出版社, 2016. KONG Chuihua, HU Fei, WANG Peng. Plant Allelopathy[M]. Beijing: Higher Education Press, 2016. [2] KOCACE A, TERZ I. Allelopathic effects of walnut leaf extracts and juglone on seed germination and seedling growth [J]. The Journal of Horticultural Science and Biotechnology, 2001, 76(4): 436 − 440. [3] 陈一颚, 刘康, 李文华. 皆伐萌孽更新是改造刺槐林的有效途径[J]. 水土保持通报, 1995, 15(6): 64 − 68. CHEN Yi’e, LIU Kang, LI Wenhua. Clear-cutting and root-sprout regeneration is an efficient way for large-scale refoeming of locust forest [J]. Bulletion of Soil and Water Conservation, 1995, 15(6): 64 − 68. [4] 耿兵, 王华田, 王延平, 等. 刺槐萌生林与实生林的生长比较[J]. 中国水土保持科学, 2013, 11(2): 59 − 64. GENG Bing, WANG Huatian, WANG Yanping, et al. Comparative study of coppice and seeding forest of Robinia pseudoacacia L. [J]. Science of Soil and Water Conservation, 2013, 11(2): 59 − 64. [5] 王希才. 刺槐林的天然更新[J]. 山西林业科技, 1995, 3(1): 30 − 34. WANG Xicai. Natural regeneration of Robinia pseudoacacia forest [J]. Shanxi Forestry Science and Technology, 1995, 3(1): 30 − 34. [6] 康迪. 黄土高原人工刺槐林群落演化特征及稳定性综合评价[D]. 杨凌: 西北农林科技大学, 2017. KANG Di. Evolution Characteristics and Stability Evaluation of Artificial Robinia pseuoacacia Community in the Loess Plateau of China[D]. Yangling: Northwest A&F University, 2017. [7] 李强, 周道玮, 陈笑莹. 地上枯落物的累积、分解及其在陆地生态系统中的作用[J]. 生态学报, 2014, 34(14): 3807 − 3819. LI Qiang, ZHOU Daowei, CHEN Xiaoying. The accumulation, decomposition and ecological effects of above-ground litter in terrestrial ecosystem [J]. Acta Ecologica Sinica, 2014, 34(14): 3807 − 3819. [8] 陈莉莎, 张金池, 陆茜. 杨树根际土壤水浸提液对种农作物的化感效应[J]. 浙江农林大学学报., 2015, 32(2): 264 − 271. CHEN Lisha, ZHANG Jinchi, LU Qian. Allelopathy of aqueous extracts when intercropping in poplar rhizosphere soil [J]. Journal of Zhejiang A&F University, 2015, 32(2): 264 − 271. [9] 韦玮. 一二代马尾松人工林根际土壤浸提物的化学组成及其化感效应研究[D]. 贵阳: 贵州大学, 2017. WEI Wei. Study on the Chemical Constitutions and Allelopathy in Rhizosphere Soil Extracts of the 1st and 2nd Pinus massoniana Plantation[D]. Guiyang: Guizhou University, 2017. [10] 何斐, 崔鸣, 孙娅, 等. 刺槐凋落叶腐解液对3种作物的化感效应[J]. 西北林学院学报, 2021, 36(2): 116 − 122. HE Fei, CUI Ming, SUN Ya, et al. Allelopathic effect of decomposed liquid of Robinia pseudoacacia leaf litter on three crops [J]. Journal of Northwest Forestry University, 2021, 36(2): 116 − 122. [11] 何佩云, 丁贵杰. 刺槐、木荷水浸液对马尾松幼苗生理活性的化感效应[J]. 种子, 2007, 26(10): 4 − 6. HE Peiyun, DING Guijie. Effect of allelopathy of the aqueous extracts of Robina pseudoacaoa and Schima confertifloura on physiological activities of Pinus massoniana seedling [J]. Seed, 2007, 26(10): 4 − 6. [12] 何佩云. 刺槐·木荷水浸液对马尾松幼苗生长的化感效应[J]. 安徽农业科学, 2008, 36(2): 526 − 528. HE Peiyun. Allelopathic effects of aqueous infusion of Robinia pseudoacacia and Schima superba on the growth of Pinus massoniana seedling [J]. Journal of Anhui Agricultural Science, 2008, 36(2): 526 − 528. [13] 李轲, 杨柳. 刺槐根际土壤水浸提液对5种常见园林植物种子萌发及幼苗生长的化感作用[J]. 种子, 2019, 38(6): 115 − 120. LI Ke, YANG Liu. Allelopathic effects of aqueous extracts from rhizosphere soil of Robinia pseudoacacia Linn. on seed germination and seedling growth of five kinds of common garden plants [J]. Seed, 2019, 38(6): 115 − 120. [14] HABIB N, ZAHIDA I, SYUNTRO H, et al. Allelopathic potential of Robinia pseudo-acacia L. [J]. Journal of Chemical Ecology, 2005, 31(9): 2179 − 2192. [15] 王辉. 刺槐自毒作用及与主要伴生树种化感作用研究[D]. 保定: 河北农业大学, 2009. WANG Hui. Study of Robinia pseudoacacia Autointoxication and Interspecific Allelopathy between Robinia pseudoacacia and Its Associated Tree Species[D]. Baoding: Hebei Agricultural University, 2009. [16] 刘冬杰. 黄土高原主要人工林化感作用研究[D]. 杨凌: 西北农林科技大学, 2011. LIU Dongjie. Allelopathy of the Planted Forest in Loess Plateau[D]. Yangling: Northwest A&F University, 2011. [17] 王仙. 黄土丘陵区油松和刺槐根部化感效应研究[D]. 北京: 北京林业大学, 2015. WANG Xian. Allelopathic Effect of Pinus tabuliformis Root and Robinia pseudoacacia Root Research in Loess Hilly Area[D]. Beijing: Beijing Forestry University, 2015. [18] INDERJIT, ERIK T N. Bioassays and field studies for allelopathy in terrestrial plants: progress and problems [J]. Critical Reviews in Plant Sciences, 2003, 22(3): 221 − 238. [19] 晋梦然, 王哲, 李梦佳, 等. 格氏栲天然林凋落物浸提液对杉木种子萌发和胚根生长的影响[J]. 北京林业大学学报, 2020, 42(4): 51 − 59. JIN Mengran, WANG Zhe, LI Mengjia, et al. Effects of litter extracts from Castanopsis kawakamii natural forest on seed germination and radicle growth of Chinese fir [J]. Journal of Beijing Forestry University, 2020, 42(4): 51 − 59. [20] 曾任森. 化感作用研究中的生物测定方法综述[J]. 应用生态学报, 1999, 10(1): 125 − 128. ZENG Rensen. Review on bioassay methods for allelopathy research [J]. Chinese Journal of Applied Ecology, 1999, 10(1): 125 − 128. [21] WILLIAMSON G B, RICHARDSON D. Bioassays for allelopathy: measuring treatment responses with independent controls [J]. Journal of Chemical Ecology, 1988, 14(1): 181 − 187. [22] MUNIR A T, ABDEL M T. Inhibitory effects of aqueous extracts of black mustard on germination and growth of Lentil [J]. Journal of Agronomy, 2002, 1(1): 28 − 30. [23] CHUNG I M, MILLER D A. Effect of alfalfa plant and soil extracts on germination and growth of alfalfa [J]. Agronomy Journal, 1995, 87(4): 762 − 767. [24] CHON S U, COUTTS J H, NELSON C J. Effects of light, growth Media, and seedling orientation on bioassays of alfalfa autotoxicity [J]. Agronomy Journal, 2000, 92(4): 715 − 720. [25] 王小雪, 刘芸, 邵呈龙, 等. 5种经济植物对幼龄尾巨桉叶片提取液的化感敏感性[J]. 林业科学, 2011, 47(11): 188 − 193. WANG Xiaoxue, LIU Yun, SHAO Chenglong, et al. Allelopathic sensitivity of five economic species to aqueous leaf extract of Eucalyptus urophylla × E. grandis with different ages [J]. Scientia Silvae Sinicae, 2011, 47(11): 188 − 193. [26] 朱美秋. 毛白杨化感作用及其酚酸物质对其幼苗生长与生理影响研究[D]. 保定: 河北农业大学, 2009. ZHU Meiqui. The Study on Allelopathy of Populus tomemtosa and Effect on Growth and Physiology of Phenoilc Acids on Its Own Seedlings[D]. Baoding: Hebei Agricultural University, 2009. [27] 宋亮, 潘开文, 王进闯, 等. 酚酸类物质对苜蓿种子萌发及抗氧化物酶活性的影响[J]. 生态学报, 2006, 26(10): 3393 − 3403. SONG Liang, PAN Kaiwen, WANG Jinchuang, et al. Effects of phenolic acids on seed germination and seedling antioxidant enzyme activity of alfalfa [J]. Acta Ecologica Sinica, 2006, 26(10): 3393 − 3403. [28] 李羿桥. 巨桉凋落叶分解过程中养分和化感物质释放及其对三种草种的化感效应研究[D]. 雅安: 四川农业大学, 2013. LI Yiqiao. Release of Nutrient and Allelochemical from Decomposing Eucalyptus gradis Leaf Litter and Its Allelopathic Effect on Three Grasses[D]. Ya’an: Sichuan Agricultural University, 2013. [29] MORAL R D. The allelopathic effects of Eucalyptus camaldulensis [J]. American Midland Naturalist, 1970, 83(1): 254 − 282. [30] 王希, 沈禹颖, 高崇岳, 等. 异龄苜蓿水浸液对其种子萌发的自毒效应[J]. 草地学报, 2008, 16(6): 609 − 612. WANG Xi, SHEN Yuying, GAO Chongyue, et al. Autotoxicity effects of aqueous extracts of different aged alfalfa on seeds germination [J]. Acta Agrestia Sinica, 2008, 16(6): 609 − 612. [31] 陈淑芳. 植物化感作用影响因素的探讨[J]. 中国农学通报, 2009, 25(23): 258 − 261. CHEN Shufang. Discussion on influencing factors of plant allelopathy [J]. Chinese Agricultural Science Bulletin, 2009, 25(23): 258 − 261. [32] 孔垂华. 植物化感作用研究中应注意的问题[J]. 应用生态学报, 1998, 9(3): 109 − 113. KONG Chuihua. Problems needed attention on plant allelopathy research [J]. Chinese Journal of Applied Ecology, 1998, 9(3): 109 − 113. [33] 张晓珂, 姜勇, 梁文举, 等. 小麦化感作用研究进展[J]. 应用生态学报, 2004, 15(10): 1967 − 1972. ZHANG Xiaoke, JIANG Yong, LIAO Wenju, et al. Research advances in wheat (Triticum aestivum) allelopathy [J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1967 − 1972. [34] RIVOAL A, FERNANDEZ C, GREFF S, et al. Does competition stress decrease allelopathic potential? [J]. Biochemical Systematics and Ecology, 2011, 39(4): 401 − 407. [35] 王辉, 李玉灵, 朱美秋, 等. 侧柏落叶浸提液对自身种子发芽和幼苗生长的影响[J]. 东北林业大学学报, 2009, 37(3): 6 − 8. WANG Hui, LI Yuling, ZHU Meiqiu, et al. Aqueous extract from Platycladus orientalis fallen foliage and its effects on seed germination and seedling growth [J]. Journal of Northeast Forestry University, 2009, 37(3): 6 − 8. [36] 赵利, 牛俊义, 李长江, 等. 地肤水浸提液对胡麻化感效应的研究[J]. 草业学报, 2010, 19(2): 190 − 195. ZHAO Li, NIU Junyi, LI Changjiang, et al. Allelopathy of aqueous extracts of Kochia scoparia on flax seed [J]. Acta Agrestia Sinica, 2010, 19(2): 190 − 195. [37] 徐郑. 核桃凋落叶分解的化感作用研究[D]. 雅安: 四川农业大学, 2014. XU Zheng. Research on the Allelopathic Effect of Decomposing Walnut Leaf Litter[D]. Ya’an: Sichuan Agricultural University, 2014. [38] WYMAN C L, WALLER G R, JURZYSTA M, et al. Biological activity and chemical isolation of root saponins of six cultivars of alfalfa (Medicago sativa L. ) [J]. Plant and Soil, 1991, 135(1): 83 − 94. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220247






 下载:
下载: