-
森林群落中优势树种的种群结构及空间分布是当前森林生态学的研究热点。目前,关于种群结构和空间分布的研究大多基于样地初次调查结果,对其动态监测的研究尚不多见,由于缺少长期样地监测数据,其结果存在一定局限性[1]。生态系统的长期监测能够为研究生态系统的演替过程提供可靠的资料[2],为发展和验证现代生态学理论提供平台,对生态系统动态理论的发展具有重要意义[3]。近年来,利用永久监测样地已经成为森林动态研究的主要手段[4]。
细叶青冈Cyclobalanopsis gracilis为壳斗科Fagaceae青冈属Cyclobalanopsis常绿乔木,是中亚热带常绿落叶阔叶混交林主要建群种。木质坚韧,用途多样,具有较高的经济价值和生态效益,广泛分布于华东及湖北、湖南、广东、广西、贵州、四川、甘肃、陕西等省(自治区)。目前,关于细叶青冈的研究主要集中在生理特性、气候响应等方面[5−7],种群结构与空间分布格局的研究较少。本研究基于天目山国家级自然保护区典型常绿落叶阔叶混交林固定样地2012和2017年的调查数据,分析自然状态下常绿落叶阔叶混交林中细叶青冈种群结构和空间分布格局,探讨其动态规律及影响机制,旨在为该区域森林生态恢复、细叶青冈种群发展以及常绿落叶阔叶混交林的保护管理提供科学依据。
-
为监测中亚热带森林生态系统的动态变化,1996年在研究区选择典型常绿落叶阔叶混交林,建立了1块1 hm2(100 m×100 m)的固定监测样地。样地地理位置位为30°20′22″N ,119°25′47″E,海拔为1066.2 m。将样地划分为25个20 m×20 m的小样方,对样地内胸径(DBH)≥10.0 cm的木本植株挂牌编号,记录胸径、冠幅、树高、样方内坐标、生长状况等特征。考虑到小径级个体数量大且对生态过程较为敏感,因此在2012年对样地进行复查时将起测胸径调整为1.0 cm,对样地木本植株进行每木检尺,对新增树木(DBH≥1.0 cm)进行挂牌编号,对死亡个体的状态进行记录。
采用2012和2017年2期调查数据进行比较,分析细叶青冈种群结构与分布格局的动态特征。其中,2012年样地内共记录到木本植物4 369株,隶属44科71属121种,平均树高为3.96 m,平均胸径为5.65 cm;2017年样地内共记录到木本植物4 375株,隶属45科73属113种,平均树高为4.80 m,平均胸径为6.10 cm。样地中的主要树种有细叶青冈、交让木Daphniphyllum macropodum、大果山胡椒Lindera praecox、杉木Cunninghamia lanceolata、中国绣球Hydrangea chinensi、青钱柳Cyclocarya paliurus、短尾柯Lithocarpus brevicaudatus、缺萼枫香 Liquidambar acalycina、微毛柃Eurya hebeclados、宜昌荚蒾Viburnum erosum等。
-
采用径级结构代替年龄结构,根据样地调查数据的实际情况并参考相关文献[10],将细叶青冈胸径(DBH)划分为8个等级:Ⅰ级(1.0≤DBH<2.5 cm)、Ⅱ级(2.5≤DBH<7.5 cm)、Ⅲ级(7.5≤DBH<12.5 cm)、Ⅳ级(12.5≤DBH<17.5 cm)、Ⅴ级(17.5≤DBH<22.5 cm)、Ⅵ级(22.5≤DBH<27.5 cm)、Ⅶ级(27.5≤DBH<32.5 cm)、Ⅷ级(DBH≥32.5 cm)。根据划分的径级结构将细叶青冈种群分为幼苗(Ⅰ级)、幼树(Ⅱ级)、中树(Ⅲ~Ⅴ级)、大树(Ⅵ~Ⅷ级)4个生长阶段。
-
根据新增与死亡株数,分析细叶青冈种群的死亡率[M=(lnN0−lnSt)/T]、更新率[R=(lnNt−lnSt)/T]和种群年增长率(λ=R−M)。其中:N0为某种群在第1次调查时的个体数,Nt为该种群在第2次调查时的个体数,St为该种群在第2次调查时存活的个体数,T为2次调查时间间隔。死亡个体是指复查时死亡或无法找到的植株;新增个体是指2017年调查中新出现的胸径(DBH)≥1.0 cm的个体(将DBH≥5.0 cm的个体作为第1次调查时的漏测个体,因而不计入新增个体)。
-
空间分布格局采用Ripley提出的K(r)函数分析方法[11]:
$$ K(r)=\frac{A}{{{n}^{2}}}{\displaystyle \sum _{i=1}^{n}{\displaystyle \sum _{j=1}^{n}\frac{1}{{w}_{ij}}}}{I}_{r}({u}_{ij}),\;(i \ne {j}) 。$$ 其中:r为以目标树为圆点的取样圆半径;A为样地面积;n为样地树木株数;uij为点i和点j之间的距离,当uij≤r时,Ir(uij)=1;uij≥r时,Ir(uij)=0;wij为边界效应校正系数,是以点i为圆心,uij为半径的圆落在样地面积A中的比例,为一个点可以被观察到的概率。为了更直观地解释实际的空间格局,通常用Ripley’s L(r)函数表示:
$$ L(r) = \sqrt {\frac{{K(r)}}{\text{π} }} - r 。$$ 其中:当L(r)=0时,表示种群在空间尺度r内随机分布;当L(r)<0时,表示种群在空间尺度r内均匀分布;当L(r)>0时,表示种群在空间尺度r内聚集分布。
-
空间分布关联基础函数计算如下:
$$ {K}_{12}(r)=\frac{A}{{n}_{1}{n}_{2}}{\displaystyle \sum _{i=1}^{{n}_{1}}{\displaystyle \sum _{j=1}^{{n}_{2}}\frac{1}{{w}_{i,j}}}}I({u}_{i,j}),\;({i} \ne {j}) 。$$ 其中:K12(r)表示径级1 和径级2之间的K12(r)估计值,n1表示径级1的植物个体数;n2表示径级2的植物个体数。同样,用L12(r)取代K12(r),公式为:
$$ {L_{12}}(r) = \sqrt {\frac{{{K_{12}}(r)}}{\text{π} }} - r 。$$ 其中:当L12(r)= 0、L12(r)<0和L12(r)>0时,分别表示径级1与径级2在空间尺度r下无相关、负相关、正相关。
本研究使用完全空间随机模型。采用Monte-Carlo拟合检验,经过199次重复拟合得到置信度为99%的置信区间,进行结果偏离随机状态显著性检验。若L(r)和L12(r)值在置信区间之内,表示种群呈随机分布或2个径级之间无空间关联;在置信区间之上,表示种群呈聚集分布或2个径级之间呈空间正相关;若在置信区间之下,表示种群呈均匀分布或2个径级之间呈空间负相关。为减小边缘校正对数据的影响,将分析尺度限定在0~25 m,步长为1 m,数据分析过程通过生态学软件Programita[12]完成。
-
2012年样地内记录到细叶青冈共276株,2017年为291株,较2012年增加15株,种群年增长率为1.06%,种群个体总数变化不大。5 a间,样地内新增个体40株,占2012年细叶青冈种群总个体数的14.49%,死亡个体25株,占2012年细叶青冈种群总个体数的9.06%。细叶青冈种群平均胸径从10.65 cm增加到10.82 cm,胸高断面积从4.71 m2·hm−2增加到5.15 m2·hm−2(表1)。
表 1 细叶青冈种群数量特征
Table 1. Quantitative characteristics of C. gracilis population
调查年份 总个体
数/株死亡个
体数/株新增个
体数/株平均胸
径/cm胸高断面积/
(m2·hm−2)2012 276 10.65 4.71 2017 291 25 40 10.82 5.15 -
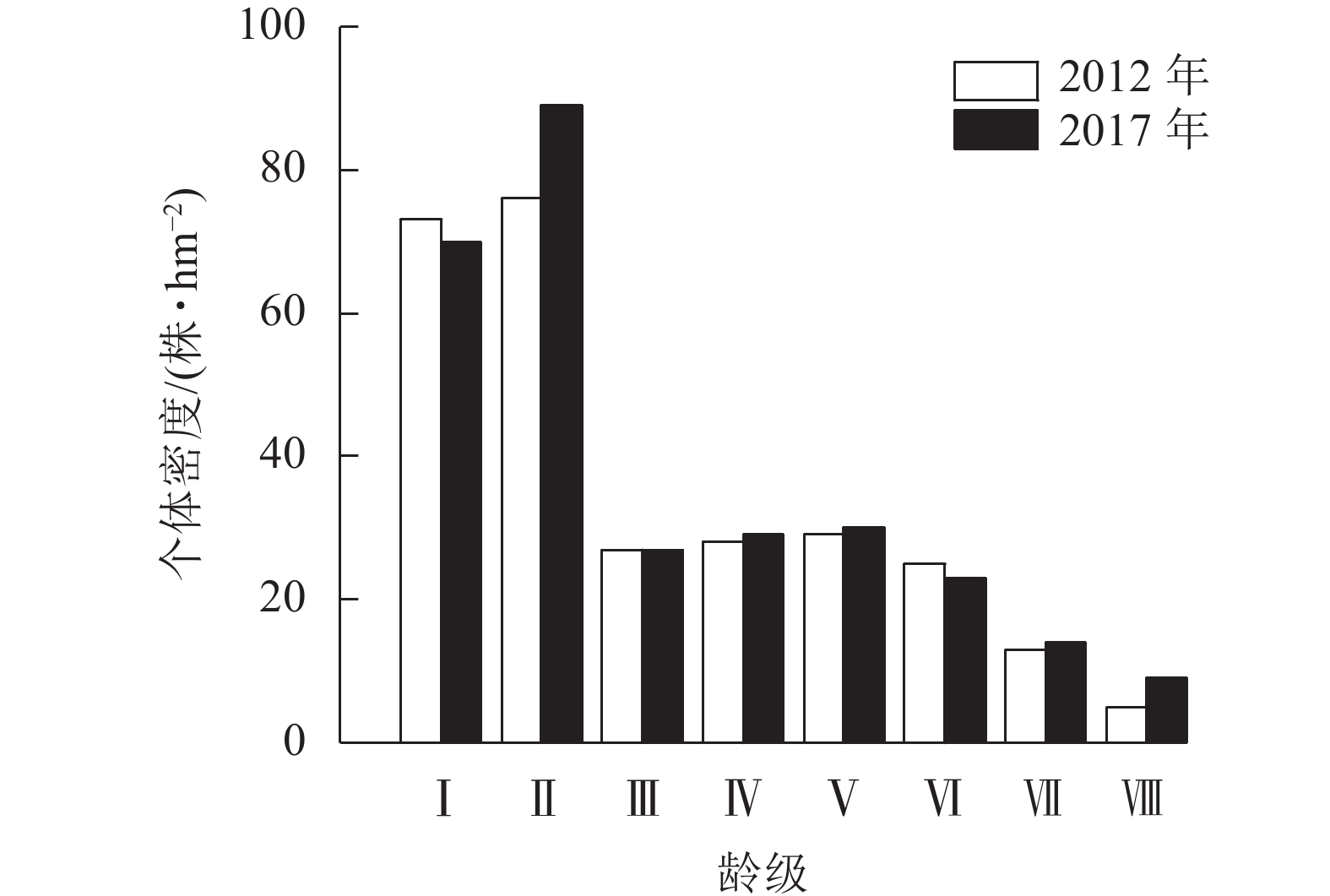
2次调查中细叶青冈种群龄级结构均呈倒“J”型(图1),低龄个体占比较高,2012和2017年细叶青冈种群幼苗、幼树(Ⅰ~Ⅱ龄级)个体数分别占总个体数的53.99%和54.64%,随着龄级的增加,个体数量逐渐减少,表明种群具有较高的更新苗木储备,属于增长型种群。2017年从Ⅰ龄级进入Ⅱ龄级的个体有20株·hm−2,从Ⅱ龄级进入Ⅲ龄级的个体有11株·hm−2,从Ⅲ龄级进入Ⅳ龄级的个体有8株·hm−2,从Ⅳ龄级进入Ⅴ龄级的个体有7株·hm−2,从Ⅴ龄级进入Ⅵ龄级的个体有6株·hm−2,从Ⅵ龄级进入Ⅶ龄级的个体有7株·hm−2,从Ⅶ龄级进入Ⅷ龄级的个体有4株·hm−2,除Ⅰ、Ⅳ龄级个体由于生长进入下一龄级的数量较多,而达到径阶的新增个体不足,导致个体数下降外,其余龄级个体数均有增加。5 a间,由于个体生长进阶补充,细叶青冈种群总个体数有一定变化,但龄级结构变化不显著,龄级结构保持随龄级升高,存活个体数减少的趋势,种群处于稳定增长的状态。
-
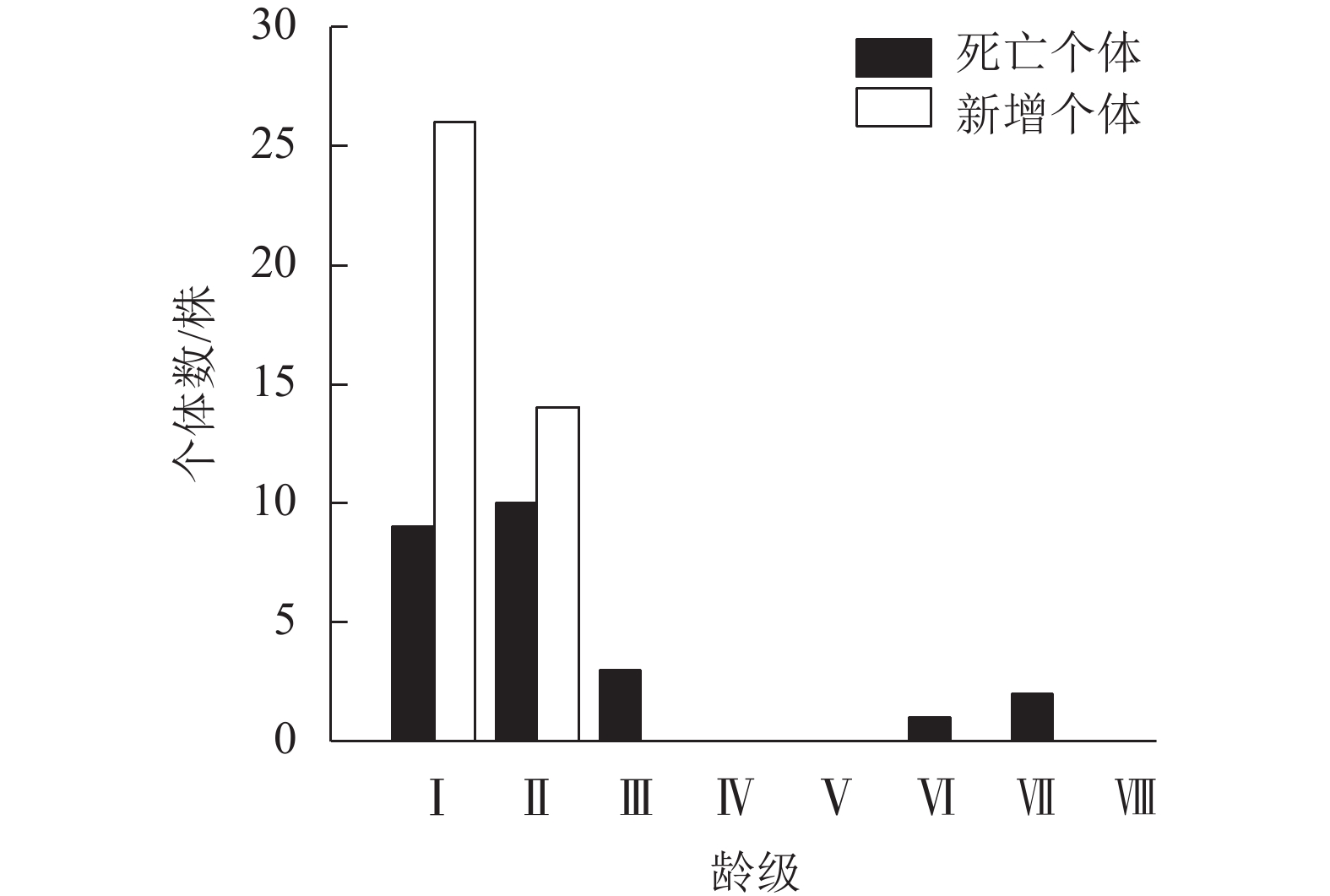
种群年死亡率为1.90%,年更新率为2.96%。从不同龄级死亡个体的情况看,死亡与新增个体的龄级分布均呈倒“J”型,不同龄级死亡与新增个体数差异较大(图2)。死亡个体平均胸径为6.68 cm,集中在幼苗、幼树阶段(Ⅰ~Ⅱ龄级),死亡个体数为19株,占死亡总个体数的76.00%,表明低龄级个体间竞争激烈,死亡率高;Ⅲ龄级死亡个体数为3株,占死亡总个体数的12.00%,Ⅳ、Ⅴ龄级无死亡个体,Ⅵ、Ⅶ龄级死亡个体数分别为1和2株,仅占死亡个体数的4.00%和8.00%,说明高龄级个体死亡相对较少。新增个体平均胸径2.34 cm。Ⅰ龄级的新增个体数最多,为26株,占新增个体总数的65.00%,Ⅱ龄级新增个体14株,占新增个体总数的35.00%,Ⅲ~Ⅷ龄级无新增个体。总体来看,死亡与新增个体均集中分布在低龄级,且随龄级增加总体呈下降趋势。
-
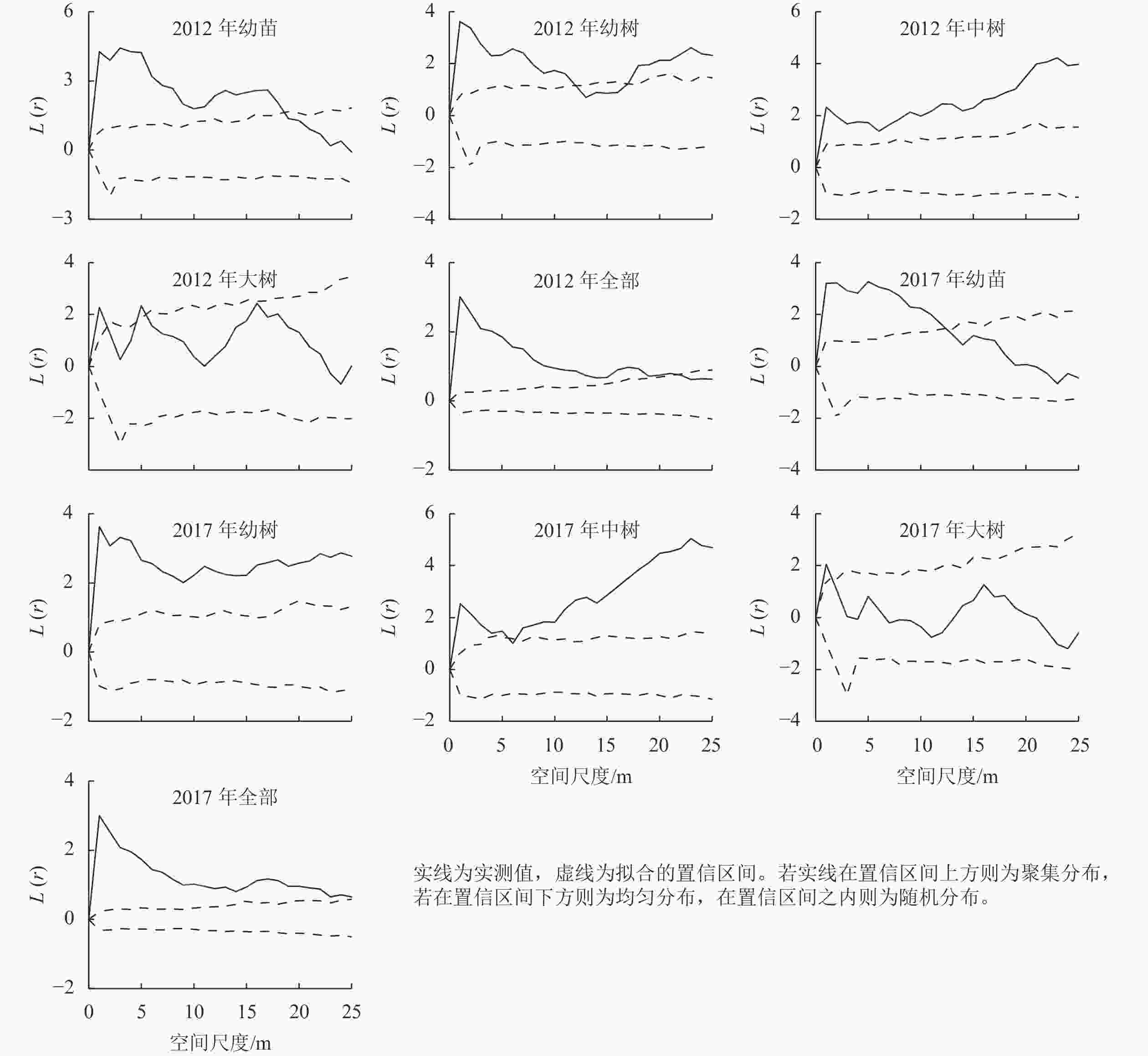
对天目山细叶青冈种群进行点格局分析发现(图3):不同生长阶段细叶青冈种群的空间分布格局有所差异。2012年,细叶青冈种群整体在0~21 m空间尺度内呈显著的聚集分布,在22~25 m空间尺度内呈随机分布,其最高聚集强度为3.013,对应空间尺度为1 m;幼苗在0~18 m空间尺度呈显著的聚集分布,在19~25 m空间尺度呈随机分布,其最高聚集强度为4.425,对应空间尺度为3 m;幼树在0~11 m空间尺度呈聚集分布,在12~16 m空间尺度呈随机分布,随着空间尺度的增加在17~25 m空间尺度又转为聚集分布,其最高聚集强度为3.621,对应空间尺度为1 m;中树在0~25 m空间尺度均呈显著聚集分布,其最高聚集强度为4.231,对应空间尺度为23 m;大树仅在0~1、4~5 m空间尺度呈聚集分布,2~25 m空间尺度呈随机分布,其最高聚集强度为2.327,对应空间尺度为5 m。2017年细叶青冈幼苗聚集程度较2012年有所降低,在0~12 m空间尺度呈聚集分布,在13~25 m空间尺度呈随机分布;幼树聚集程度有所提高,在0~25 m空间尺度均呈聚集分布;中树空间分布较2012年小尺度范围聚集强度减弱,大尺度范围聚集强度增强,具体表现为在0~5 m空间尺度呈聚集分布,在6 m空间尺度呈随机分布,13~25 m空间尺度呈聚集分布;大树随机分布强度较2012年有所增强。总体来看,细叶青冈种群整体呈聚集分布,且随着龄级的增加逐渐转为随机分布。
-
种群各生长阶段之间的空间关联能够直观体现种内关系的变化趋势,对了解不同林层之间的相互作用和种群稳定性变化具有重要意义[13−14]。对细叶青冈种群不同生长阶段的空间关联性进行分析发现(图4):2012年,幼苗与幼树在1~11 m空间尺度呈正相关,12~22 m空间尺度为无相关,23~25 m空间尺度为负相关;幼苗与中树在1~4 m空间尺度为正相关,5~25 m空间尺度为无相关;幼苗与大树在1~2、4~5 m空间尺度为正相关,3、6~25 m空间尺度为无相关;幼树与中树在1~10、21~25 m空间尺度为正相关,11~20 m空间尺度为无相关;幼树与大树在1~6 m空间尺度为正相关,7~25 m空间尺度为无相关;中树与大树在1~3 m空间尺度为正相关,4~21 m空间尺度为无相关,22~25 m空间尺度为负相关。2017年,细叶青冈种群各生长阶段两两空间关联趋势与2012年保持一致,幼苗与幼树、幼苗与大树、幼树与中树、中树与大树空间正相关较2012年有所增强。2017年,幼苗与幼树在0~11、13~18 m空间尺度呈显著正相关,幼苗与大树在0~8 m空间尺度呈显著正相关,幼树与中树除了11、14~15 m空间尺度外,在其他空间尺度均呈显著正相关。从整体来看,细叶青冈种群各生长阶段之间的空间关联均在小尺度呈正相关,随着尺度的增加过渡到无相关或负相关。
-
种群龄级结构能清晰地反映种群的生存状态,对预测种群动态具有重要意义[15]。由2次调查结果可知:2012—2017年细叶青冈种群总个体数上升,平均胸径增大。龄级结构无显著变化,均表现为倒“J”型。随着龄级的增大,个体数呈下降趋势,各径级无个体缺失,是典型的增长型种群。5 a间细叶青冈种群死亡个体共25株,年死亡率为1.90%,新增个体共40株,年更新率为2.96%,新增个体的平胸径均较小,说明群落更新状况良好。种群年更新率高于死亡率,种群年增长率为1.06%,表明细叶青冈种群目前处于稳定发展状态,在未来短时间内个体数量不会发生较大幅度的变化。
种群个体的更新和死亡是种群结构变化的重要方式,体现种群种内竞争及其对环境的适应。细叶青冈种群不同龄级死亡个体数量差异明显,死亡个体多以小径级为主,这可能与低龄个体的生存竞争及环境筛选有关。细叶青冈虽为耐阴树种,但随着幼苗、幼树对光照、养分的需求不断增加,除了低龄个体间的相互竞争,还要与大树及其他树种个体争夺空间和养分,一定程度上阻碍了幼苗、幼树顺利进入林冠层[16];中树阶段由于个体处于生长旺盛期,在竞争中处于优势地位,同时因为达到林冠层,光照需求不再受到抑制,死亡率相对较小[17];进入生长末期后,细叶青冈接近生理死亡年龄,种群死亡率随之升高。
-
种群分布格局既受自身生物学特性和外部环境影响,同时与空间尺度密切相关[18−19]。通常在小尺度范围种群的空间分布主要受到种群自身生物学特性的影响,而在较大尺度上则更多受到生境异质性的影响[20]。本研究对细叶青冈种群各龄级的空间分布格局进行分析表明:2次调查的空间分布格局类似,均在幼苗、幼树、中树阶段呈聚集分布,而在大树阶段呈随机分布,与蔡飞[21]对青冈Cyclobalanopsis glauca种群空间分布格局的研究结果一致,表明青冈属植物具有相似特性。这主要与细叶青冈自身的生物学特性及种群发育过程中因密度制约因素引起的种内种间竞争有关。一方面,由于根系萌蘖和种子的散布特点,细叶青冈幼苗基本聚集在母树周围,所以低龄阶段多呈聚集分布。另一方面,聚集分布能更好地改变微气候和小生境,有利于幼苗、幼树个体间的相互庇护,增强种群对不良环境的抗性[22],因此低龄个体常聚集分布。随着龄级的增大,密度制约引起种内竞争加剧,导致种群个体死亡增加,密度下降,故中树转变为大树后趋向随机分布。这种空间分布格局有利于将有限的环境资源的最大化利用,使植物个体满足自身的生存和发展,体现种群生长过程中对环境适应的生存策略及适应机制[23−24]。
-
同一物种不同生长阶段间的空间正关联来源于对环境的共同适应性,负关联来源于个体间的相互竞争排斥。细叶青冈种群各生长阶段均在小尺度范围内呈显著的正相关,随着尺度的增加过渡到无相关或负相关。种群空间格局与空间尺度的这种联系,可能与种内关系对空间尺度的依赖性有关[25]。同时,种群不同龄级间的空间关联性与龄级的差距有关。在小尺度范围内,种群个体间龄级差距越小,正关联性越强。细叶青冈幼苗与幼树的空间正相关大于幼苗与中树、大树,幼树与中树的空间正相关大于幼树与大树,说明幼苗与幼树对环境资源的选择具有一致性,所以在小尺度空间分布上表现为相互依存的关系。中树、大树可以为耐阴幼苗的生长提供较好的生存环境,因此幼苗与幼树、中树、大树在一定尺度范围内表现为空间正相关。然而这种空间关联可能会随着演替进程而发生变化,随着个体继续生长,细叶青冈个体抵御外界的胁迫能力增强,对空间资源及养分需求随之增加,导致竞争关系逐渐加强,使得中树与大树在大尺度表现为空间负相关。
-
本研究基于2012和2017年天目山常绿落叶阔叶混交林1 hm2固定监测样地2期调查资料,分析了细叶青冈种群结构和空间分布格局的动态变化。研究发现:天目山常绿落叶阔叶混交林中细叶青冈种群自然更新良好,处于稳定增长状态;2次调查种群的空间分布格局类似,整体呈聚集分布,随着龄级的增加,种群的空间格局由聚集分布转为随机分布。各生长阶段间的空间关联在小尺度空间呈正关联,且在小尺度一定范围内,龄级差越小,正关联性越强。这是细叶青冈种子散布特性、种内种间竞争及环境等多种因素共同作用的结果,体现细叶青冈种群生长过程中的一种生存策略和适应机制。种群在生长过程中对环境干扰较为敏感,低龄个体因聚集分布受密度制约而竞争激烈,幼苗幼树阶段死亡率较高。为维持种群的长期稳定,必要时可以分阶段进行人工调控。5 a间,种群中虽然有部分个体死亡与新增,但种群结构与空间分布格局没有发生显著变化,说明自然状态下细叶青冈种群结构与空间分布格局的变化是一个漫长的过程,研究其种群结构和空间分布格局动态需要更长的观测周期,对其进行持续性监测研究。同时,因为生态过程受多种因素影响,不仅与种群本身生物学特性有关,还可能与群落区域小生境、种间竞争、演替进程等因素有关,需要对这些方面进一步深入分析,以更好地掌握细叶青冈种群结构与空间分布的动态变化规律。
Population structure and spatial distribution pattern of Cyclobalanopsis gracilis in the evergreen and deciduous broad-leaved forest in Mount Tianmu
-
摘要:
目的 细叶青冈Cyclobalanopsis gracilis是中亚热带森林主要构成树种,也是天目山国家级自然保护区常绿落叶阔叶混交林的优势树种之一。研究自然状态下天目山常绿落叶阔叶混交森林群落中细叶青冈种群结构和空间分布格局,探讨其动态规律及其影响机制,对该区域森林生态恢复、细叶青冈种群发展以及常绿落叶阔叶混交林的保护管理等具有重要意义。 方法 基于天目山常绿落叶阔叶混交林1 hm2 (100 m×100 m)固定监测样地2012和2017年2期调查数据,从种群数量特征、龄级结构及空间分布等方面分析细叶青冈种群结构与分布格局的动态变化特征。 结果 ①2012—2017年细叶青冈种群个体从276株增加到291株,死亡个体共25株,新增个体共40株,种群年增长率为1.06%。种群平均胸径从10.65 cm增加到10.82 cm,胸高断面积从4.71 m2·hm−2增加到5.15 m2·hm−2。②细叶青冈种群年龄结构呈倒“J”型,种群自然更新良好,种群结构稳定。③细叶青冈种群新增与死亡个体集中分布在幼苗幼树阶段 (Ⅰ~Ⅱ龄级),且随龄级增加总体呈下降趋势。④细叶青冈整体呈聚集分布,随着龄级的增加转为随机分布。相比2012年,2017年幼苗聚集强度有所减弱,幼树、中树聚集强度稍有增强。⑤各生长阶段间的空间关联均在小尺度表现为正相关,随着尺度的增加过渡到无相关或负相关,2017年除幼树与中树、幼树与大树外,其余生长阶段间的空间正相关稍有增强。 结论 天目山常绿落叶阔叶混交林中细叶青冈种群属于稳定增长型种群,种群整体呈聚集分布,各生长阶段间的空间关联在小尺度空间呈正关联,体现细叶青冈生长发育过程中的一种生存策略和适应机制。5 a间种群结构及空间分布格局变化不显著,幼龄个体因聚集分布受密度制约而竞争激烈。为维持种群的长期稳定,必要时可分阶段进行人工调控。图4表1参25 Abstract:Objective Cyclobalanopsis gracilis is the main tree species in central subtropical forests and one of the dominant tree species in the evergreen deciduous broad-leaved mixed forest in National Nature Reserve of Mount Tianmu. The purpose is to investigate the population structure and spatial distribution pattern of C. gracilis in forest communities under natural conditions, as well as its dynamic law and impact mechanism, which is of great significance for forest ecological restoration, development of C. gracilis population, and conservation and management of the evergreen deciduous broad-leaved mixed forest in the study area. Method Based on the survey data in the fixed monitoring sample plots of 1 hm2(100 m×100 m) of the evergreen deciduous broad-leaved mixed forest in Mount Tianmu in 2012 and 2017, the dynamic variation characteristics of population structure and distribution pattern of C. gracilis were analyzed from the aspects of population quantity characteristics, age class structure and spatial distribution. Result (1) From 2012 to 2017, the individual population of C. gracilis increased from 276 to 291, with 25 dead individuals and 40 new individuals. The annual population growth rate was 1.06%. The average diameter at breast height (DBH) of the population increased from 10.65 cm to 10.82 cm, and the basal area increased from 4.71 m2·hm−2 to 5.15 m2·hm−2. (2) The age structure of C. gracilis population showed an inverted “J”shape, with a good natural regeneration and stable population structure. (3) The new and dead individuals of C. gracilis population were concentrated in the seedling and young stage (Ⅰ−Ⅱ age classes ), and showed a downward trend with the increase of age class. (4) The distribution of C. gracilis population was aggregated as a whole, and changed to random distribution with the increase of age class. The aggregation intensity of seedlings in 2017 decreased compared with 2012, while the aggregation intensity of young and middle trees was slightly enhanced. (5) The spatial correlation between each growth stage was positively correlated at a small scale, and transitioned to no correlation or negative correlation with the increase of scale. In 2017, the spatial positive correlation between the other growth stages was slightly enhanced except for seedlings and middle trees, young and big trees. Conclusion The population of C. gracilis in the evergreen and deciduous broad-leaved mixed forest of Mount Tianmu belongs to the stable growth type, and is clustered as a whole. The spatial correlation between different growth stages is positively correlated in small-scale space, reflecting a survival strategy and adaptive mechanism in the development of C. gracilis population. There is no significant change in population structure and spatial distribution pattern during the five years. The aggregation distribution of young individuals is restricted by density and the competition among young individuals is intense. To maintain long-term stability of the population, artificial control can be carried out in stages if necessary. [Ch, 4 fig. 1 tab. 25 ref.] -
表 1 细叶青冈种群数量特征
Table 1. Quantitative characteristics of C. gracilis population
调查年份 总个体
数/株死亡个
体数/株新增个
体数/株平均胸
径/cm胸高断面积/
(m2·hm−2)2012 276 10.65 4.71 2017 291 25 40 10.82 5.15 -
[1] 赵中华, 刘文桢, 石小龙, 等. 小陇山锐齿栎天然林结构动态分析[J]. 林业科学研究, 2015, 28(6): 759 − 766. ZHAO Zhonghua, LIU Wenzhen, SHI Xiaolong, et al. Structure dynamic of Quercus aliena var. acuteserrata natural forest on Xiaolongshan [J]. Forest Research, 2015, 28(6): 759 − 766. [2] 徐玮泽, 刘琪璟, 孟盛旺, 等. 长白山阔叶红松林树木种群动态的长期监测[J]. 应用生态学报, 2018, 29(10): 3159 − 3166. XU Weize, LIU Qijing, MENG Shengwang, et al. Long-term monitoring of tree population dynamics of broad-leaved Korean pine forest in Changbai Mountains, China [J]. Chinese Journal of Applied Ecology, 2018, 29(10): 3159 − 3166. [3] 祝燕, 赵谷风, 张俪文, 等. 古田山中亚热带常绿阔叶林动态监测样地——群落组成与结构[J]. 植物生态学报, 2008, 32(2): 262 − 273. ZHU Yan, ZHAO Gufeng, ZHANG Liwen, et al. Community composition and structure of Gutianshan forest dynamic plot inamid-subtropical evergreen broad-leaved forest, east China [J]. Chinese Journal of Plant Ecology, 2008, 32(2): 262 − 273. [4] 张毅锋, 汤孟平. 天目山常绿阔叶林空间结构动态变化特征[J]. 生态学报, 2021, 41(5): 1959 − 1969. ZHANG Yifeng, TANG Mengping. Analysis on spatial structure dynamic characteristics of evergreen broad-leaved forest in Tianmu Mountain [J]. Acta Ecologica Sinica, 2021, 41(5): 1959 − 1969. [5] 蔡永立, 达良俊. 亚热带东部壳斗科6种常绿植物叶的生态解剖[J]. 应用与环境生物学报, 2002, 8(5): 460 − 466. CAI Yongli, DA Liangjun. Ecological leaf anatomy of six evergreen species of Fagaceae in the eastern subtropical area of China [J]. Chinese Journal of Applied Environmental Biology, 2002, 8(5): 460 − 466. [6] 余小龙, 余树全, 伊力塔, 等. UV-B辐射胁迫对细叶青冈幼苗叶绿素荧光特性的影响[J]. 东北农业大学学报, 2011, 42(10): 114 − 119. YU Xiaolong, YU Shuquan, YI Lita, et al. UV-B radiative forcing on chlorophyll fluorescence characteristics of Cyclobalanopsis gracilis seedlings [J]. Journal of Northeast Agricultural University, 2011, 42(10): 114 − 119. [7] 蒋红宝, 伊力塔, 刘美华, 等. 模拟酸雨对细叶青冈幼苗叶片叶绿素荧光参数的影响[J]. 福建林学院学报, 2013, 33(4): 316 − 321. JIANG Hongbao, YI Lita, LIU Meihua, et al. Effects of simulated acid rain on chlorophyll fluorescence parameters of Cyclobalanopsis myrsinaefolia [J]. Journal of Fujian College of Forestry, 2013, 33(4): 316 − 321. [8] BAI Cheng, YOU Shixue, KU Weipeng, et al. Life form dynamics of the tree layer in evergreen and deciduous broad-leaved mixed forest during 1996−2017 in Tianmu Mountains, eastern China[J/OL]. Silva Fennica, 2020, 54(2)[2022-12-05]. doi: 10.14214/sf.10167. [9] 楼一恺, 范忆, 戴其林, 等. 天目山常绿落叶阔叶林群落垂直结构与群落整体物种多样性的关系[J]. 生态学报, 2021, 41(21): 8568 − 8577. LOU Yikai, FAN Yi, DAI Qilin, et al. Relationship between vertical structure and overall species diversity in an evergreen deciduous broad-leaved forest community of Tianmu Mountain Natural Reserve [J]. Acta Ecologica Sinica, 2021, 41(21): 8568 − 8577. [10] 汤孟平, 周国模, 施拥军, 等. 天目山常绿阔叶林优势种群及其空间分布格局[J]. 植物生态学报, 2006, 30(5): 743 − 752. TANG Mengping, ZHOU Guomo, SHI Yongjun, et al. Study of dominant plant populations and their spatial patterns in evergreen broadleaved forest in Tianmu Mountain, China [J]. Chinese Journal of Plant Ecology, 2006, 30(5): 743 − 752. [11] RIPLEY B D. Modelling spatial patterns [J]. Journal of the Royal Statistical Society, 1977, 39(2): 172 − 212. [12] WIEGAND T, MOLONEY K A. Rings, circles, and null-models for point pattern analysis in ecology [J]. Oikos, 2004, 104(2): 209 − 229. [13] 卢杰, 潘刚, 罗大庆, 等. 濒危植物急尖长苞冷杉种群结构及空间分布格局[J]. 林业资源管理, 2009, 8(4): 48 − 53. LU Jie, PAN Gang, LUO Daqing, et al. The population structure and spatial pattern of Abies georgei [J]. Forest Resources Management, 2009, 8(4): 48 − 53. [14] 杨晓惠, 林文树, 刘曦, 等. 小兴安岭典型阔叶红松林幼树的群落结构动态[J]. 中南林业科技大学学报, 2021, 41(12): 87 − 97. YANG Xiaohui, LIN Wenshu, LIU Xi, et al. The dynamics of sapling community structure of typical broad-leaved Korean pine forest in the Lesser Khingan mountains [J]. Journal of Central South University of Forestry &Technology, 2021, 41(12): 87 − 97. [15] 秦爱丽, 马凡强, 许格希, 等. 珍稀濒危树种峨眉含笑种群结构与动态特征[J]. 生态学报, 2020, 40(13): 4445 − 4454. QIN Aili, MA Fanqiang, XU Gexi, et al. Population structure and dynamic characteristics of a rare and endangered tree species Michelia wilsonii Finet et Gagn [J]. Acta Ecologica Sinica, 2020, 40(13): 4445 − 4454. [16] 宋萍, 洪伟, 吴承祯, 等. 珍稀濒危植物桫椤种群生命过程及谱分析[J]. 应用生态学报, 2008, 19(12): 2577 − 2582. SONG Ping, HONG Wei, WU Chengzhen, et al. Population life process and spectral analysis of rare and endangered plant Alsophila spinulosa [J]. Chinese Journal of Applied Ecology, 2008, 19(12): 2577 − 2582. [17] 张昭臣, 郝占庆, 叶吉, 等. 长白山次生杨桦林树木短期死亡动态[J]. 应用生态学报, 2013, 24(2): 303 − 310. ZHANG Zhaochen, HAO Zhanqing, YE Ji, et al. Short-term death dynamics of trees in natural secondary poplar-birch forest in Changbai Mountains of northeast China [J]. Chinese Journal of Applied Ecology, 2013, 24(2): 303 − 310. [18] 拓锋, 刘贤德, 刘润红, 等. 祁连山大野口流域青海云杉种群空间格局及其关联性[J]. 植物生态学报, 2020, 44(11): 1172 − 1183. TA Feng, LIU Xiande, LIU Runhong, et al. Spatial distribution patterns and association of Picea crassifolia population in Dayekou Basin of Qilian Mountains, northwestern China [J]. Chinese Journal of Plant Ecology, 2020, 44(11): 1172 − 1183. [19] 朱文婷, 刘海坤, 何睿, 等. 藏东南急尖长苞冷杉群落空间点格局分析及其时空动态[J]. 生态学报, 2022, 42(22): 8977 − 8984. ZHU Wenting, LIU Haikun, HE Rui, et al. Spatial point pattern analysis and spatio-temporal dynamics of Abies georgei var. smithii forests in southeast Tibet [J]. Acta Ecologica Sinica, 2022, 42(22): 8977 − 8984. [20] 黄明钗, 史艳财, 韦霄, 等. 珍稀濒危植物金花茶的点格局分析[J]. 生态学杂志, 2013, 32(5): 1127 − 1134. HUANG Mingchai, SHI Yancai, WEI Xiao, et al. Point pattern analysis of rare and endangered plant Camellia nitidissima Chi. [J]. Chinese Journal of Ecology, 2013, 32(5): 1127 − 1134. [21] 蔡飞. 杭州西湖山区青冈种群结构和动态的研究[J]. 林业科学, 2000, 36(3): 67 − 72. CAI Fei. A study on the structure and dynamics of Cyclobalanopsis glauca population at hills around West Lake in Hangzhou [J]. Scientia Silva Sinica, 2000, 36(3): 67 − 72. [22] 康华靖, 陈子林, 刘鹏, 等. 大盘山自然保护区香果树种群结构与分布格局[J]. 生态学报, 2007, 27(1): 389 − 396. KANG Huajing, CHEN Zilin, LIU Peng, et al. The population structure and distribution pattern of Emmenopterys henryi in Dapanshan Natural Reserve of Zhejiang Province [J]. Acta Ecologica Sinica, 2007, 27(1): 389 − 396. [23] 任毅华, 周尧治, 侯磊, 等. 色季拉山急尖长苞冷杉种群不同龄级立木的空间分布格局[J]. 生态学报, 2021, 41(13): 5417 − 5424. REN Yihua, ZHOU Yaozhi, HOU Lei, et al. Spatial distribution patterns of standing trees at different ages in Abies georgei var. smithii forests in Sejila Mountain [J]. Acta Ecologica Sinica, 2021, 41(13): 5417 − 5424. [24] 邱婧, 韩安霞, 何春梅, 等. 秦岭优势乔木锐齿槲栎的空间分布格局及种内关联[J]. 应用生态学报, 2022, 33(8): 2035 − 2042. QIU Jing, HAN Anxia, HE Chunmei, et al. Spatial distribution pattern and intraspecific association of dominant species Quercus aliena var. acu-tiserrata in Qinling Mountains, China [J]. Chinese Journal of Applied Ecology, 2022, 33(8): 2035 − 2042. [25] SCHURR F M, BOSSDORF O, MILTON S J, et al. Spatial pattern formation in semi-arid shrubland: apriori predicted versus observed pattern characteristics [J]. Plant Ecology, 2004, 173(2): 271 − 282. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220784






 下载:
下载: