-
第9次全国森林资源清查数据显示:全国森林覆盖率为22.96%,森林面积达到2.2亿hm2,森林蓄积量超过175.6亿m3[1]。大部分森林碳以活生物量和土壤有机质形式存在,约占生态系统碳密度的89%[2],因此,森林及其土壤碳库在调节全球碳平衡的过程中起着至关重要的作用。基于此,研究森林生物量和碳密度的分配特征及其主要影响因素成为了国内外学者关注的热点问题[3]。
造林年限是决定森林碳密度的重要因素[4]。随着造林年限的增加,森林植被组成和群落结构随之产生变化,进而通过改变林分密度、凋落物量、土壤养分等来影响森林碳库[5]。有研究表明:生物量碳密度随造林年限显著增加,但土壤有机碳(SOC)密度随造林年限的变化存在争议[6−8]。此外,造林年限与林分碳密度之间存在显著正相关性,在森林(包括乔木层、灌木层、草本层和土壤)碳分配中发挥着重要作用[9−11]。土壤有机碳库是陆地生态系统最大的碳库,其碳储量超过了大气和植被中碳储量的总和,对于维持碳平衡[12]至关重要。同时,土壤有机碳是土壤质量、土壤肥力、土壤持水能力和土壤生产力评价[13−14]的重要指标,可直接影响森林的生物量及其固碳潜力[9−11]。相反陆地生态系统的组成、结构和功能也会影响土壤碳库[15],其中造林年限通过改变林分结构,进一步影响土壤养分分配格局。土壤碳库的微小变化都会影响土壤性质、全球碳循环和气候变化[16−17],因此准确估算区域碳分配和碳密度有利于更好地理解森林碳库。
人工林在减缓温室效应和应对气候变化中发挥着重要作用[18]。在中国,马尾松Pinus massoniana因生长迅速且适应性强,常常作为先锋树种被广泛用于植树造林[19]。多时段、分批量地种植马尾松会产生不同龄级的人工林,对后续有效管理马尾松林造成阻碍,但同时也为研究不同造林年限马尾松林碳密度变化规律提供条件。量化马尾松人工林碳密度的变异性和分配模式可以更好地预测未来森林固碳能力[20]。目前还缺乏关于马尾松人工林在不同造林年限下土壤、凋落物和植被碳密度的差异研究。本研究选取造林年限为8、12、22、38 a的马尾松林地为研究对象,系统研究影响土壤和植被之间不同碳分配特征的因素,以期为马尾松人工林系统优化和森林碳汇潜力提供科学依据。
-
研究区位于浙江省杭州市淳安县千岛湖镇姥山林场(29°33′30″N,119°02′55″E)。该研究区属于亚热带季风气候区,总体呈现夏季高温多雨,冬季寒冷少雨的特征。年平均气温为17.1 ℃,≥10 ℃的年积温为5 410.0 ℃,年平均日照时数为1 951.0 h,年降水量为1 430.0 mm。平均海拔为150 m,坡度为20°~30°。土壤类型为黄红壤亚类。本研究选择姥山林场中,造林年限分别为8、12、22、38 a的马尾松林。这些样地最初种植密度相同,后续差异来源于马尾松在生长过程中的自然生长和死亡。样地基本概况见表1。
表 1 样地基本概况
Table 1. General situation of the sampling plots
样地代号 造林年限/a 海拔/m 坡度/(°) 坡向 平均胸径/cm 平均树高/m 密度/(株·hm−2) 2016-1 8 146 10.4 西北 13.3 12.6 1 800 2016-2 8 145 0.5 北坡 14.8 13.5 1 600 2016-3 8 141 16.5 北坡 14.3 13.6 1 700 2012-1 12 139 4.3 东南 14.5 14.8 2 400 2012-2 12 158 2.6 东南 12.0 15.6 2 500 2012-3 12 148 14.7 东南 13.5 9.8 2 200 2002-1 22 148 6.6 西南 19.2 30.9 2 300 2002-2 22 141 11.3 西北 25.2 23.9 2 000 2002-3 22 129 0.5 西北 29.9 25.4 1 900 1986-1 38 139 7.1 东南 33.9 29.0 1 800 1986-2 38 144 6.8 西北 26.5 28.6 1 900 1986-3 38 150 6.1 东北 26.1 23.8 1 800 -
采用“空间替代时间”的方法[21],选取该区域地形条件相似的4个马尾松人工林造林年限组:幼龄林(8 a)、中龄林(12 a)、近熟林(22 a)、成熟林(38 a)。每个造林年限设3个重复样地,大小为400 m2 (20 m×20 m),共计12个样地。对胸径≥3 cm的马尾松胸径、树高、冠幅等进行每木调查,统计样地内的马尾松株数用于计算植被密度。草本调查样方为2.5 m×2.5 m,记录样方的出现物种的物种名、高度、盖度等数据。选择各样地中胸径与平均胸径相同的马尾松作为标准木,采集标准木上、中、下部位的叶、枝等器官,混合后取500 g带回实验室分析。在样地中挖取土壤剖面,采集0~10和10~30 cm的土样,剔除其中的石块后取500 g带回实验室分析,并用环刀法测定容重。样地理化性质如表2。
表 2 不同造林年限马尾松林地土壤理化性质
Table 2. Basic physical and chemical properties of soil at different afforestation ages of P. massoniana
造林年限/a 容重/(g·cm−3) 含水率/% pH 碱解氮/(mg·kg−1) 有效磷/(mg·kg−1) 速效钾/(mg·kg−1) 8 1.07±0.16 bc 31.71±7.94 ab 4.96±0.08 b 74.42±25.67 a 53.00±5.07 a 72.17±28.56 ab 12 1.23±0.12 ab 28.67±1.02 c 5.11±0.09 a 65.75±13.28 a 49.53±6.23 a 92.83±21.93 a 22 1.25±0.10 a 30.00±3.76 ab 4.79±0.08 c 63.33±14.42 a 50.48±2.31 a 54.50±8.80 b 38 1.05±0.07 c 36.71±5.50 a 4.93±0.13 b 75.25±9.84 a 51.54±4.83 a 73.50±12.60 ab 说明:数据为平均值±标准差。根据GB/T 26424—2010 《森林资源规划设计调查技术规程》划分造林年限,马尾松1~10 a为幼龄林,11~20 a为中龄林,21~30 a为近熟林,31~50 a为成熟林,≥51 a为过熟林。不同小写字母表示相同理化性质不同造林年限间差异显著(P<0.05)。 -
采回的植物样品用去离子水洗净后,在烘箱内105 ℃杀青30 min,随后在烘箱内80 ℃烘干至恒量。将烘干后的马尾松样品粉碎,过100目筛后装入塑封袋备用。植物碳质量分数用重铬酸钾-外加热硫酸氧化法进行测定;植物氮、磷、钾采用H2SO4-H2O2消煮法提取,提取液用于进一步测定。氮质量分数用半微量凯氏定氮法测定;磷质量分数用钼锑抗比色法测定,钾质量分数用火焰光度计法测定。
采回的土壤样品置于常温下风干,风干后进一步磨碎,分别过10和100目筛后,用于pH、容重、碱解氮、速效磷、速效钾、全氮、全钾、全磷、有机质等土壤常规性质测定。土壤有机质用重铬酸钾-外加热硫酸氧化法测定;土壤pH用电位法测定,水土质量比为2.5∶1.0;土壤全氮、全磷、全钾采用H2SO4-H2O2、HClO4-H2SO4消煮提取并进一步测定。
-
采用收获法和建立各器官生物量模型的方法估测生物量[22]。根据马尾松胸径、树高实测结果,选择适合的马尾松生物量方程进行估算[23]。模型最终取值如表3所示。
表 3 马尾松生物量估测方程
Table 3. Estimation equation of P. massoniana biomass
组分 模型形式 a b r2 枝 W1=a(D2H)b 0.012 7 0.788 6 0.984 8 叶 W2= a(D2H)b 0.028 3 0.601 2 0.919 2 整树 W3= a(D2H)b 0.105 6 0.824 7 0.998 8 说明:W1、W2、W3分别为马尾松树枝、树叶、整株生物量(kg);D为马尾松胸径(cm);H为马尾松树高(m);a、b均为估测模型的参数。 草本层模型与马尾松模型不同,模型如下:
$$ {W}_{\mathrm{h}}=0.054 \;920{{H}^{0.803 \;0}G}^{1.087\; 7} 。 $$ (1) 式(1)中:Wh为单位面积总生物量(kg·m−2);H为草本层平均高(cm);G为草本层盖度。
-
植被层各组分(包括乔木、草本和凋落物)碳密度由各自碳质量分数与干生物量质量之积计算所得[24]。土壤碳密度根据式(2)计算[25]:
$$ {S}_{i}={10}^{-2}\times {D}_{\mathrm{S}\mathrm{B}i}{C}_{i}\times {H}_{i} 。 $$ (2) 式(2)中:Si为土壤某一层次内单位面积的土壤碳密度(t·hm−2); DSBi为第i层土壤的容重(g·cm−3);Ci为第i层土壤的含碳率(%);Hi为第i层土壤的土层厚度(cm)。马尾松林碳密度根据植被层各组分与土壤各层碳密度之和计算。
-
采用冗余分析(RDA)探究马尾松林碳密度与各类影响因子之间的相关关系,用结构方程模型(SEM)进一步判断各因子之间的关系强度,解释自变量对因变量的直接效应、间接效应和总效应。
-
使用Excel 2016和SPSS 21进行数据整理和统计分析;用Duncan新复极差法检验不同造林年限之间的差异显著性,显著性水平设定为0.05;用Pearson相关分析法对马尾松林的碳密度、生物量、基础理化性质进行相关分析;利用Origin 2021软件绘图,利用Canoco 5绘制冗余分析图。
-
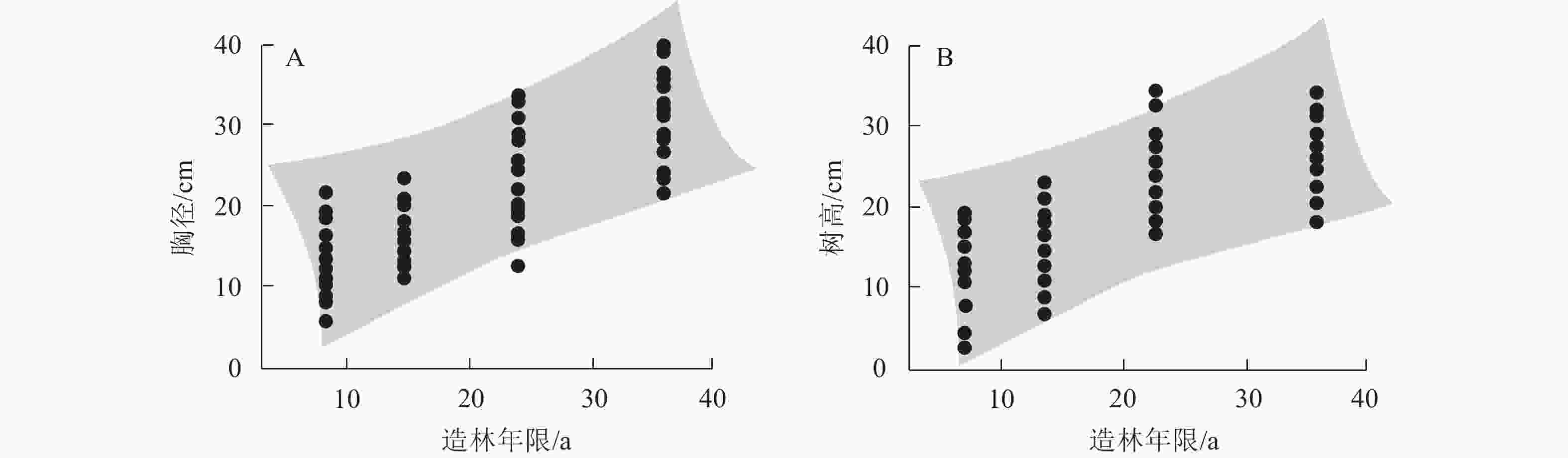
随着造林年限的增加,胸径(图1A)和树高(图1B)整体呈增加趋势,并在达到成熟阶段之后趋于稳定。造林年限与胸径和树高的决定系数(R2)分别为0.819和0.896。总体来看,造林年限作为影响马尾松林生长状况的主要因素,对提升马尾松林碳密度也至关重要。
-
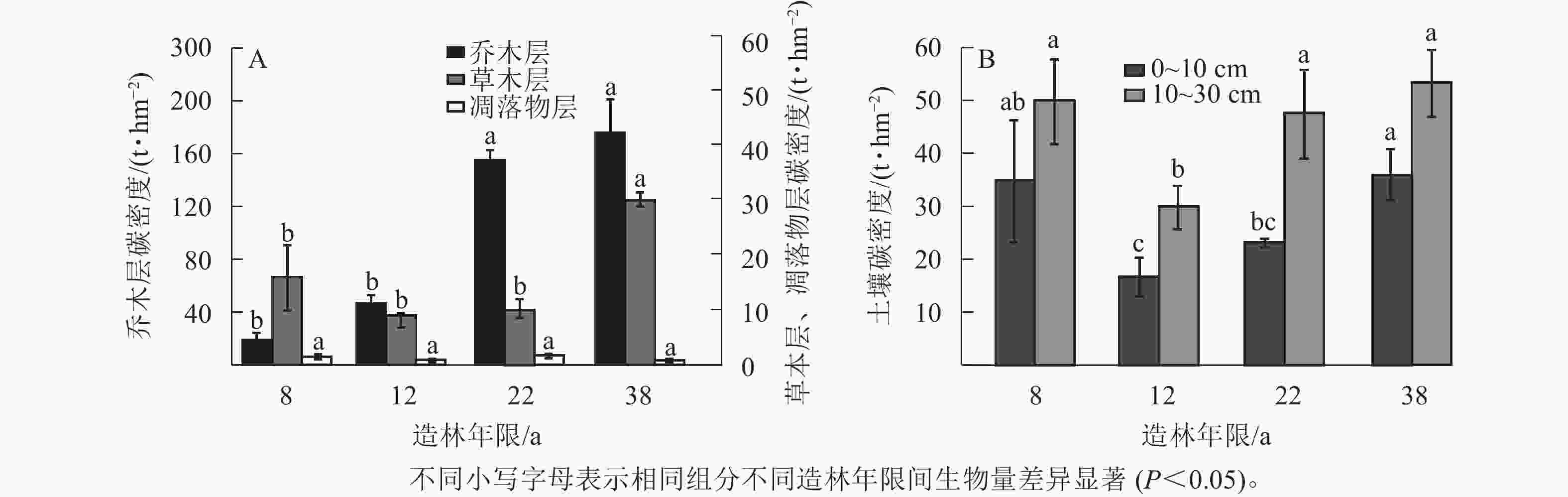
不同造林年限的马尾松林乔木层生物量呈现显著差异(P<0.05),乔木层生物量随着造林年限的增大而增大,在38 a (成熟林)时达到最大值,为352.02 t·hm−2 (表4)。枝和叶的生物量呈现先增加后减少的趋势,在造林年限为38 a (成熟林)时达到最大值,分别为64.57和49.79 t·hm−2。总生物量在22 a (近熟林)时达到最大值,显著大于中幼林的生物量(P<0.05),说明马尾松近熟林的生长状况最好。草本层和凋落物层生物量在造林年限为22 a时达到最大值,分别为13.74和5.24 t·hm−2。总体来看,乔木层生物量显著大于草本层、凋落物层的生物量。此外,不同组分和不同造林年限间的生物量差异揭示马尾松在近熟林时生长状态最好,具有较强的固碳能力。
表 4 不同造林年限马尾松林各组分生物量
Table 4. Biomass of each component of P. massoniana forests at different afforestation ages
造林年限/a 乔木层生物量/(t·hm−2) 草本层生物量/(t·hm−2) 凋落物层生物量/(t·hm−2) 总生物量/(t·hm−2) 枝 叶 整树 8 5.48±0.90 Cc 3.10±0.22 Cc 38.18±13.32 Bb 9.09±1.62 Cc 2.97±1.96 Cab 50.24±14.10 Ab 12 12.61±5.56 Cb 8.35±4.07 Cc 93.06±27.71 Bb 11.50±0.19 Cb 2.45±0.33 Cb 108.00±26.51 Ab 22 64.57±5.54 Ca 49.79±1.70 Ca 310.87±17.88 Ba 13.74±0.36 Da 5.24±2.11 Da 329.84±18.78 Aa 38 6.57±0.79 Bbc 35.55±8.04 Bb 352.02±100.13 Aa 12.74±1.12 Bab 3.74±0.90 Bab 368.51±99.85 Aa 说明:数据为平均值±标准差。不同小写字母表示相同组分不同造林年限间生物量差异显著(P<0.05);不同大写字母表示相同造林年限不同组分间生物量差异显著(P<0.05)。 -
由图2可知:乔木层碳密度随造林年限增加而增加,在38 a (成熟林)时达到最大值176.36 t·hm−2,近熟林碳密度显著高于幼龄林和中龄林碳密度(P<0.05)。草本层的碳密度在38 a (成熟林)时达到最大值,为30.10 t·hm−2,显著大于其他造林年限草本层的碳密度(P<0.05)。0~10 cm土层中,不同造林年限马尾松林的土壤碳密度存在显著差异(P<0.05),总体呈现为38 a (成熟林)时达到最大值,为38.60 t·hm−2。10~30 cm土层中,碳密度在38 a (成熟林)时达到最大值,为57.13 t·hm−2。总体上植被和土壤碳密度均在成熟林时达到最大值。这说明随着造林年限的增加,虽然马尾松的生长速度减慢,但是马尾松林的碳密度仍在积累。
-
表5显示:马尾松林植被和土壤的碳密度随造林年限的增加存在一定的起伏。随着造林年限的增加,植被和土壤碳密度总体呈现增加的趋势,在38 a (成熟林)中达到最大值。此外植被和土壤碳密度的比值逐渐增大,在22 a造林年限时达到最大值,在马尾松林到达成熟阶段之后,其植被和土壤碳密度达到稳定。由此说明马尾松成熟林阶段,其固碳能力最强。
表 5 马尾松林碳密度及其比值
Table 5. Carbon storage and its ratio of P. massoniana forests
造林年
限/a马尾松林碳密度/(t·hm−2) 碳密度占比/% 植被 土壤 植被 土壤 8 36.37±17.54 b 87.11±18.27 ab 20.12 79.88 12 57.23±11.89 b 47.84±5.72 d 50.28 49.72 22 167.67±12.87 a 72.98±8.16 bc 68.44 31.56 38 207.15±53.56 a 95.72±11.43 a 65.29 34.71 说明:数据为平均值±标准差。不同小写字母表示同一指标不同造林年限间差异显著(P<0.05)。 -
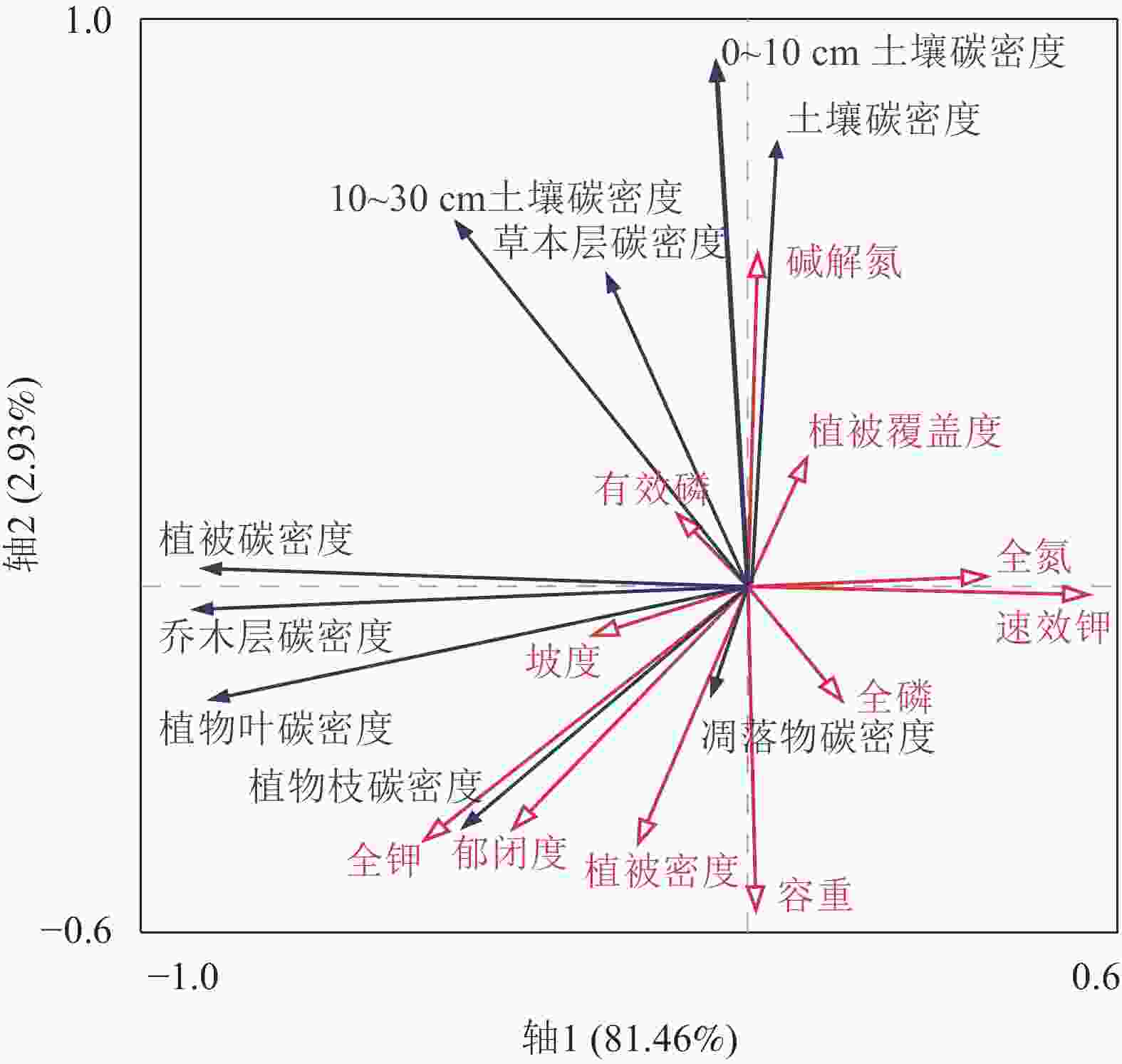
由冗余分析(图3)可知:轴1和轴2分别解释了总方差的81.46%和2.93%,总解释度为84.39%。土壤有效氮、土壤有效磷、土壤全氮与土壤碳密度呈正相关;土壤容重、坡度、植被密度、土壤全钾、植被覆盖度等与土壤碳密度呈负相关。分析数据显示:土壤全钾、土壤速效钾、坡向为主要贡献因子,分别解释了土壤碳密度的28.70%、27.00%、9.90%。0~10 cm土壤碳密度与土壤容重、植被密度和郁闭度呈显著负相关(P<0.05);0~10 cm土壤碳密度和10~30 cm土壤碳密度与土壤有机碳呈极显著正相关(P<0.001)。植被碳密度总体上与土壤总氮、土壤总磷和土壤速效钾呈负相关;土壤碳密度与植被覆盖度、土壤速效氮成正相关,与土壤全磷、土壤容重、植被密度等呈负相关。从以上分析可知:马尾松林环境因子和土壤氮、土壤钾质量分数对土壤和植被碳密度具有重要影响。
-
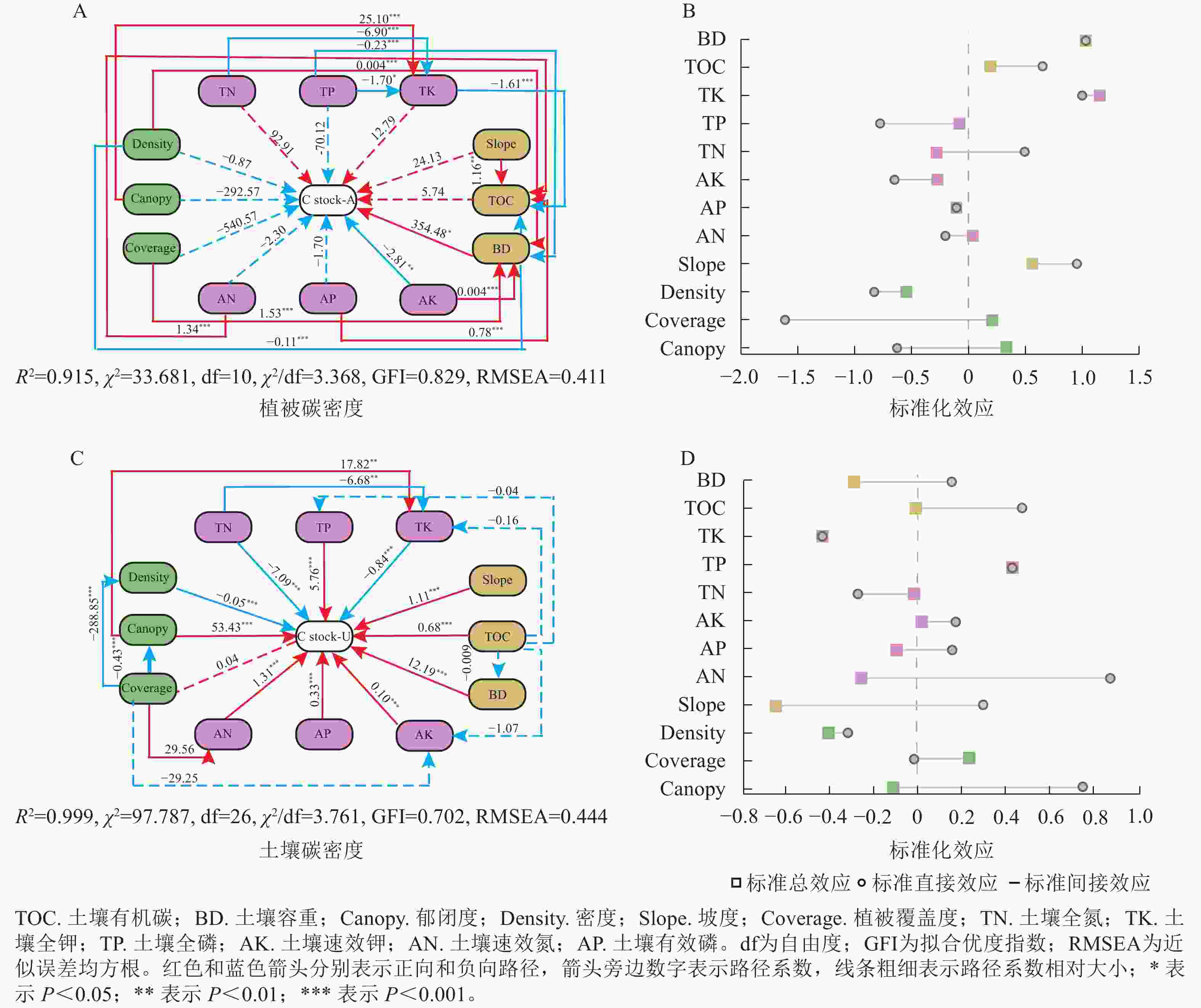
马尾松植被碳密度模型的适配度检验结果显示(图4A):R2为0.915,χ2为33.681,自由度(df)为10,拟合优度指数(GFI)为0.829,近似误差均方根(RMSEA)为0.411,表明本研究模型和数据的适配度较高,拟合情况理想,可以满足研究和分析的要求。马尾松植被碳密度与影响因素的结构方程模型路径图如图4A所示。马尾松植被碳密度影响因素中土壤容重和土壤速效钾对碳密度有极显著的影响,其中土壤容重对植被碳密度有显著正影响(P<0.05);土壤速效钾对植被碳密度有极显著负影响(P<0.05)。由图4B可知:容重和全钾的标准化总效应高于其他因子,标准化总效应对植被碳密度的影响大于直接效应。马尾松林土壤碳密度模型的适配度检验结果显示(图4C):R2为0.999,χ2为97.787,df为26,GFI为0.702,RMSEA为0.444,表明本研究中模型和数据的适配度较高、拟合情况理想,可以满足研究和分析的要求。土壤碳密度与影响因素的结构方程模型路径图如图4C所示。植被覆盖率对土壤碳密度均有极显著的正向影响(P<0.05),冠幅、土壤全磷、土壤有机碳、容重等对土壤碳密度有极显著正影响(P<0.01),植被密度、土壤全氮、土壤全钾对土壤碳密度有极显著负影响(P<0.001)。由图4D可知:土壤碱解氮和郁闭度对土壤碳密度的直接效应高于其他因子,标准直接效应对土壤碳密度的影响大于标准总效应。该模型进一步表明,土壤有机碳以及速效养分对土壤碳密度的直接影响大于植被碳密度,植被碳密度的标准间接效应高于直接效应。
-
生物量是马尾松林生长的重要属性,受胸径、树高、树种组成等林分特征,坡度、海拔等环境因素以及造林年限等人为因素的影响[26]。已有研究表明,系统掌握树木胸径、树高的生长过程,是评价马尾松林生长状况最直接有效的方法[27]。本研究发现:随着造林年限的增加,马尾松的胸径和树高呈现增长趋势,且生物量在成熟林阶段最高。这与谢伊等[28]的研究结果相同,不同造林年限下林木的生长具有显著差异,造林年限越长,径级越大,生长量越大。究其原因可能是林木的生长多取决于自身个体的大小,随着造林年限的增加,林木个体逐渐增大,导致胸径和树高随之增加,进而提升马尾松生物量。这说明造林年限作为影响马尾松生长状况的关键因素,对提升马尾松林碳密度至关重要。
-
本研究结果表明:马尾松林碳密度随造林年限增长而显著增加,马尾松林碳密度从大到小依次为成熟林(302.88 t·hm−2)、近熟林(240.66 t·hm−2)、幼龄林(123.49 t·hm−2)、中龄林(105.08 t·hm−2)。中龄林的碳密度比幼龄林小的可能原因有多个:一方面幼龄林生长迅速,新陈代谢旺盛,对养分的需求量大,通过吸收土壤养分来增加其生物量,进而提高植被部分的碳密度[29];另一方面,幼龄林林冠稀疏,光照充足,光合作用效率较高,且生长竞争较小,有利于植被层碳密度的积累[30]。成熟林阶段碳密度最高主要是因为在森林演替过程中,乔木生物量持续增加,最终导致植被碳密度大幅提升,这与郭丽玲等[31]的研究结果一致。
本研究中,马尾松幼龄林的植被碳密度和土壤碳密度分别占马尾松林碳密度的29.45%和70.55%,随造林年限增长植被碳密度的占比逐渐增加,说明植被碳密度对马尾松林碳密度的影响逐渐增加。这与前人研究结果相似,随着造林年限的增加植被碳密度也呈现增加趋势,出现植被碳密度占比更大的可能原因为:植被大量吸收有机质矿化产生的养分导致土壤碳密度降低[32]。此外本研究结果表明:乔木层碳密度在所有地上部分碳库中所占比例最高,其次是草本层,凋落物层碳密度最低。这与前人的研究结果不同,HE等[33]认为:植被生长过程中不断产生的凋落物成为地表重要的碳库,凋落物层的碳密度比草本层的碳密度更大[34]。产生不同的结果可能是由多个因素共同作用导致的:目前对凋落物的组成成分研究较多的是凋落叶,很少有关枝、球果、树皮等的研究[35−37],这可能会导致结果差异;此外气象条件(大风、雪)、林分密度、造林年限等都是影响凋落物碳密度的因素[38]。本研究所处季节并非枝叶脱落季节,且林分密度适度,故出现凋落物碳密度较小的结果。
本研究发现土壤碳密度主要集中于0~10 cm的表层中,且随着造林年限增加土壤碳密度逐渐增加,并在成熟林阶段达到最大值。这与大部分研究结果相似,植物群落会通过各种形式,如凋落物分解,促进土壤碳的积累[39]。随造林年限的增加,凋落物的分解作用和植物呼吸作用等相应增强,植被覆盖度等环境因子随之改变,导致土壤碳密度逐渐增加[40]。
-
探讨植被和土壤碳密度的主要影响因素,有助于确定影响马尾松林固碳的主控因子,进一步提高马尾松林固碳能力。本研究发现土壤容重和土壤速效钾对地上植被碳密度有直接影响;所选择的环境因子对土壤碳密度均有显著影响,其中植被覆盖率有最显著的直接正向影响。这与已有的研究结果相似:土壤理化因子(氮、钾等元素)可以通过影响土壤结构和植被生长进而影响林木碳密度[41]。出现该结果的主要原因可能是土壤养分状况好的条件下,凋落物分解快,而土壤养分状况作为森林碳密度的主要影响因素,进一步促进马尾松林碳积累[42]。此外本研究冗余分析和结构方程模型结果表明:植被碳密度与土壤碳密度呈负相关,可能是因为植被通过根系生长等途径从土壤中获取生长所需养分,并分泌特殊物质加速有机质分解[43]。此外,植被也会向土壤输送碳,包括植物残体和根系分泌物,进而促进土壤有机质的分解[44]。
-
不同造林年限马尾松林植被碳密度和土壤碳密度具有明显的动态变化特征,总体上植被碳密度和土壤碳密度随造林年限增加呈现逐渐增加的趋势,其中成熟阶段马尾松林的固碳能力最强,马尾松林生物量和碳密度在成熟林阶段达到峰值。土壤容重、植被密度、土壤全磷、土壤全钾质量分数及坡度通过植物和土壤系统碳密度之间的平衡来调节生态系统碳密度,其中植被密度和全钾质量分数对马尾松林碳密度影响最大。为提升马尾松林固碳能力以及维持最大生产力,可进行未成熟林补植或过熟林砍伐合理控制马尾松生长状况,通过对中龄林阶段合理施肥提升土壤碳密度、控制马尾松林植被密度等手段促进林木生长,提升马尾松林质量。
Characteristics and influencing factors of carbon density structure in Pinus massoniana forests with different afforestation years
-
摘要:
目的 解译典型亚热带马尾松Pinus massoniana人工林生长过程中碳的积累特征,探明马尾松林的固碳机制和固碳潜力。 方法 在浙江淳安县千岛湖镇姥山林场内,选取坡度、海拔基本一致的4个不同造林年限(分别为8、12、22、38 a)的马尾松人工林样地,采用多元统计方法结合冗余分析、结构方程模型,揭示不同造林年限的马尾松林碳密度特征以及影响马尾松林碳密度的主要因素。 结果 马尾松林总生物量在38 a(成熟林)时达到最大值,显著大于中幼林的生物量(P<0.05);草本层和凋落物层生物量在造林年限为22 a时达到最大值,分别为13.74和5.24 t·hm−2。不同造林年限的乔木层碳密度随造林年限增加而增加,在38 a (成熟林)时达到最大值,为176.36 t·hm−2。不同造林年限马尾松林的土壤碳密度存在显著差异(P<0.05),0~10和10~30 cm土层均在38 a (成熟林)时达到最大值,分别为38.60和57.13 t·hm−2。冗余分析显示:全钾和速效钾质量分数、坡向为马尾松林碳密度的主要贡献因子,分别解释了各组分碳密度的28.70%、27.00%、9.90%,对整体土壤和植被碳的固定至关重要。结构方程模型显示:容重、植被密度、全钾质量分数对马尾松林碳密度具有重要影响。 结论 马尾松林碳密度在很大程度上与造林年限有关,其中成熟阶段的马尾松林固碳能力最强。此外,环境因子和土壤养分状况对马尾松林固碳潜力的提升至关重要。图4表5参44 Abstract:Objective The objective of this study is to interpret the carbon accumulation characteristics during the growth process of typical Pinus massoniana forests, and investigate the mechanism and potential of carbon sequestration in P. massoniana forests. Method Four different afforestation years (8, 12, 22, 38 years) of P. massoniana plantations with similar slopes and altitudes were selected in Laoshan Forest Farm, Qiandaohu Town, Chun’an County, Zhejiang Province. Multiple statistical methods combined with redundancy analysis and structural equation modeling were employed to analyze the carbon density characteristics of P. massoniana forests with different afforestation years and the main factors affecting their carbon density. Result The total biomass reached its maximum value at 38 years (mature forest), which was significantly higher than that of young and middle-aged forests (P<0.05). The biomass of the herb layer and litter layer reached their maximum values at 22 years of afforestation, with values of 13.74 and 5.24 t·hm−2, respectively. Carbon density of the tree layer increased with the increase of afforestation years, reaching a maximum value of 176.36 t·hm−2 at 38 years (mature forest). There were significant differences in soil carbon density among different ages of P. massoniana forests (P<0.05). The carbon density in the soil layers of 0−10 and 10−30 cm reached their maximum values at 38 years (mature forest), which were 38.60 and 57.13 t·hm−2, respectively. Redundancy analysis revealed that total potassium, available potassium, and slope direction were the main contributing factors to carbon density of P. massoniana forests, accounting for approximately 28.70%, 27.00%, and 9.90% of the carbon density of each component, respectively, and were crucial to overall carbon sequestration of soil and vegetation. The structural equation model demonstrated that bulk density, vegetation density, and total potassium content had significant effects on carbon density in P. massoniana forests. Conclusion The carbon density of P. massoniana forests is closely related to the years of afforestation, with mature P. massoniana forests exhibiting the highest capacity for carbon sequestration. Environmental factors and soil nutrient status are crucial for enhancing the carbon sequestration potential of P. massoniana forests. [Ch, 4 fig. 5 tab. 44 ref.] -
表 1 样地基本概况
Table 1. General situation of the sampling plots
样地代号 造林年限/a 海拔/m 坡度/(°) 坡向 平均胸径/cm 平均树高/m 密度/(株·hm−2) 2016-1 8 146 10.4 西北 13.3 12.6 1 800 2016-2 8 145 0.5 北坡 14.8 13.5 1 600 2016-3 8 141 16.5 北坡 14.3 13.6 1 700 2012-1 12 139 4.3 东南 14.5 14.8 2 400 2012-2 12 158 2.6 东南 12.0 15.6 2 500 2012-3 12 148 14.7 东南 13.5 9.8 2 200 2002-1 22 148 6.6 西南 19.2 30.9 2 300 2002-2 22 141 11.3 西北 25.2 23.9 2 000 2002-3 22 129 0.5 西北 29.9 25.4 1 900 1986-1 38 139 7.1 东南 33.9 29.0 1 800 1986-2 38 144 6.8 西北 26.5 28.6 1 900 1986-3 38 150 6.1 东北 26.1 23.8 1 800 表 2 不同造林年限马尾松林地土壤理化性质
Table 2. Basic physical and chemical properties of soil at different afforestation ages of P. massoniana
造林年限/a 容重/(g·cm−3) 含水率/% pH 碱解氮/(mg·kg−1) 有效磷/(mg·kg−1) 速效钾/(mg·kg−1) 8 1.07±0.16 bc 31.71±7.94 ab 4.96±0.08 b 74.42±25.67 a 53.00±5.07 a 72.17±28.56 ab 12 1.23±0.12 ab 28.67±1.02 c 5.11±0.09 a 65.75±13.28 a 49.53±6.23 a 92.83±21.93 a 22 1.25±0.10 a 30.00±3.76 ab 4.79±0.08 c 63.33±14.42 a 50.48±2.31 a 54.50±8.80 b 38 1.05±0.07 c 36.71±5.50 a 4.93±0.13 b 75.25±9.84 a 51.54±4.83 a 73.50±12.60 ab 说明:数据为平均值±标准差。根据GB/T 26424—2010 《森林资源规划设计调查技术规程》划分造林年限,马尾松1~10 a为幼龄林,11~20 a为中龄林,21~30 a为近熟林,31~50 a为成熟林,≥51 a为过熟林。不同小写字母表示相同理化性质不同造林年限间差异显著(P<0.05)。 表 3 马尾松生物量估测方程
Table 3. Estimation equation of P. massoniana biomass
组分 模型形式 a b r2 枝 W1=a(D2H)b 0.012 7 0.788 6 0.984 8 叶 W2= a(D2H)b 0.028 3 0.601 2 0.919 2 整树 W3= a(D2H)b 0.105 6 0.824 7 0.998 8 说明:W1、W2、W3分别为马尾松树枝、树叶、整株生物量(kg);D为马尾松胸径(cm);H为马尾松树高(m);a、b均为估测模型的参数。 表 4 不同造林年限马尾松林各组分生物量
Table 4. Biomass of each component of P. massoniana forests at different afforestation ages
造林年限/a 乔木层生物量/(t·hm−2) 草本层生物量/(t·hm−2) 凋落物层生物量/(t·hm−2) 总生物量/(t·hm−2) 枝 叶 整树 8 5.48±0.90 Cc 3.10±0.22 Cc 38.18±13.32 Bb 9.09±1.62 Cc 2.97±1.96 Cab 50.24±14.10 Ab 12 12.61±5.56 Cb 8.35±4.07 Cc 93.06±27.71 Bb 11.50±0.19 Cb 2.45±0.33 Cb 108.00±26.51 Ab 22 64.57±5.54 Ca 49.79±1.70 Ca 310.87±17.88 Ba 13.74±0.36 Da 5.24±2.11 Da 329.84±18.78 Aa 38 6.57±0.79 Bbc 35.55±8.04 Bb 352.02±100.13 Aa 12.74±1.12 Bab 3.74±0.90 Bab 368.51±99.85 Aa 说明:数据为平均值±标准差。不同小写字母表示相同组分不同造林年限间生物量差异显著(P<0.05);不同大写字母表示相同造林年限不同组分间生物量差异显著(P<0.05)。 表 5 马尾松林碳密度及其比值
Table 5. Carbon storage and its ratio of P. massoniana forests
造林年
限/a马尾松林碳密度/(t·hm−2) 碳密度占比/% 植被 土壤 植被 土壤 8 36.37±17.54 b 87.11±18.27 ab 20.12 79.88 12 57.23±11.89 b 47.84±5.72 d 50.28 49.72 22 167.67±12.87 a 72.98±8.16 bc 68.44 31.56 38 207.15±53.56 a 95.72±11.43 a 65.29 34.71 说明:数据为平均值±标准差。不同小写字母表示同一指标不同造林年限间差异显著(P<0.05)。 -
[1] 段学军, 邹辉, 王磊. 长江经济带建设与发展的体制机制探索[J]. 地理科学进展, 2015, 34(11): 1377−1387. DUAN Xuejun, ZOU Hui, WANG Lei. Institutions and mechanisms for developing the Yangtze River Economic Belt [J]. Progress in Geography, 2015, 34(11): 1377−1387. [2] YUAN Zaixiang, JIN Xuemei, XIAO Wenya, et al. Comparing soil organic carbon stock and fractions under natural secondary forest and Pinus massoniana plantation in subtropical China [J/OL]. Catena, 2022, 212 : 106092[2024-05-12]. DOI: 10.1016/j.catena.2022.106092. [3] 张煜林, 刘玲娟, 刘胜龙, 等. 不同密度杉木萌生林自然恢复初期群落结构对林分碳密度的影响[J]. 应用生态学报, 2024, 35(2): 289−297. ZHANG Yulin, LIU Lingjuan, LIU Shenglong, et al. Effects of community structure of Cunninghamia lanceolata sprouting forests with different densities on ecosystem carbon density at the early stage of succession [J]. Chinese Journal of Applied Ecology, 2024, 35(2): 289−297. [4] YU Zhen, ZHAO Hongrun, LIU Shirong, et al. Mapping forest type and age in China’s plantations [J/OL]. Science of the Total Environment, 2020, 744 : 140790[2024-05-12]. DOI: 10.1016/j.scitotenv.2020.140790. [5] NA Meng, SUN Xiaoyang, ZHANG Yandong, et al. Higher stand densities can promote soil carbon storage after conversion of temperate mixed natural forests to larch plantations [J]. European Journal of Forest Research, 2021, 140(2): 373−386. [6] TAMANG M, CHETTRI R, VINEETA, et al. Stand structure, biomass and carbon storage in Gmelina arborea plantation at agricultural landscape in Goothills of Eastern Himalayas [J/OL]. Land, 2021, 10 (4): 387[2024-05-12]. DOI: 10.3390/land10040387. [7] GONZÁLEZ M E, LARA A, URRUTIA-JALABERT R, et al. Carbon stocks across different environments, disturbance regimes, and stand age in Fitzroya cupressoides forests, the longest-lived species of the southern hemisphere [J/OL]. Frontiers in Forests and Global Change, 2022, 5 [2024-05-12]. DOI: 10.3389/ffgc.2022.960429. [8] MA Quanlin, WANG Xinyou, CHEN Fang, et al. Carbon sequestration of sand-fixing plantation of Haloxylon ammodendron in Shiyang River Basin: storage, rate and potential [J/OL]. Global Ecology and Conservation, 2021, 28 : e01607 [2024-05-12]. DOI: 10.1016/j. gecco. 2021. e01607. [9] LEVAN C, HUNG B M, BOLANLE-OJO O T, et al. Biomass and carbon storage in an age-sequence of Acacia mangium plantation forests in Southeastern Region, Vietnam [J/OL]. Forest Systems, 2020, 29 (2): e009[2024-05-12]. DOI: 10.5424/fs/2020292-16685. [10] GOGOI A, AHIRWAL J, SAHOO U K. Plant biodiversity and carbon sequestration potential of the planted forest in Brahmaputra flood plains [J/OL]. Journal of Environmental Management, 2021, 280 : 111671[2024-05-12]. DOI: 10.1016/j.jenvman.2020.111671. [11] SAHOO U K, TRIPATHI O P, NATH A J, et al. Quantifying tree diversity, carbon stocks, and sequestration potential for diverse land uses in northeast India [J/OL]. Frontiers in Environmental Science, 2021, 9 [2024-05-12]. DOI: 10.3389/fenvs.2021.724950. [12] LUO Zhongkui, VISCARRA-ROSSEL R A, QIAN Tian. Similar importance of edaphic and climatic factors for controlling soil organic carbon stocks of the world [J]. Biogeosciences, 2021, 18(6): 2063−2073. [13] WEI Liang, GE Tida, ZHU Zhenke, et al. Comparing carbon and nitrogen stocks in paddy and upland soils: accumulation, stabilization mechanisms, and environmental drivers [J/OL]. Geoderma, 2021, 398 : 115121[2024-05-12]. DOI: 10.1016/j.geoderma.2021.115121. [14] TOMAR U, BAISHYA R. Moisture regime influence on soil carbon stock and carbon sequestration rates in semi-arid forests of the National Capital Region, India [J]. Journal of Forestry Research, 2020, 31(6): 2323−2332. [15] BHATTACHARYA S S, KIM K H, DAS S, et al. A review on the role of organic inputs in maintaining the soil carbon pool of the terrestrial ecosystem [J]. Journal of Environmental Management, 2016, 167: 214−227. [16] CONFORTI M, LUCÀ F, SCARCIGLIA F, et al. Soil carbon stock in relation to soil properties and landscape position in a forest ecosystem of southern Italy (Calabria region) [J]. Catena, 2016, 144: 23−33. [17] WANG Gang, YU Chenxi, SINGH M, et al. Community structure and ecosystem carbon stock dynamics along a chronosequence of mangrove plantations in China [J]. Plant and Soil, 2021, 464(1): 605−620. [18] GAO Yang, CHENG Jimin, MA Zhengrui, et al. Carbon storage in biomass, litter, and soil of different plantations in a semiarid temperate region of northwest China [J]. Annals of Forest Science, 2014, 71(4): 427−435. [19] ZHANG Xue, ZHAO Zeyao, CHEN Tong, et al. Fertilization and clear-cutting effects on greenhouse gas emissions of pinewood nematode damaged masson pine plantation [J/OL]. Ecosystem Health and Sustainability, 2021, 7 (1): 1868271[2024-05-12]. DOI: 10.1080/20964129.2020.1868271. [20] GE Jielin, XU Wenting, LIU Qing, et al. Patterns and environmental controls of soil organic carbon density in Chinese shrublands [J/OL]. Geoderma, 2020, 363 : 114161[2024-05-12]. DOI: 10.1016/j.geoderma.2019.114161. [21] 胡建文, 刘常富, 勾蒙蒙, 等. 林龄对马尾松人工林微生物残体碳积累的影响机制[J]. 应用生态学报, 2024, 35(1): 153−160. HU Jianwen, LIU Changfu, GOU Mengmeng, et al. Influencing mechanism of stand age to the accumulation of microbial residue carbon in the Pinus massoniana plantations [J]. Chinese Journal of Applied Ecology, 2024, 35(1): 153−160. [22] 秦佳双, 李玉凤, 马姜明, 等. 广西不同气候条件下马尾松人工林生物量模型构建及分配格局[J]. 广西科学, 2020, 27(2): 165−174. QIN Jiashuang, LI Yufeng, MA Jiangming, et al. Biomass model construction and distribution pattern of Pinus massonniana plantations under different climatic conditions in Guangxi [J]. Guangxi Sciences, 2020, 27(2): 165−174. [23] 袁位高, 江波, 葛永金, 等. 浙江省重点公益林生物量模型研究[J]. 浙江林业科技, 2009, 29(2): 1−5. YUAN Weigao, JIANG Bo, GE Yongjin, et al. Study on biomass model of key ecological forest in Zhejiang Province [J]. Journal of Zhejiang Forestry Science and Technology, 2009, 29(2): 1−5. [24] 温远光, 张祖峰, 周晓果, 等. 珍贵乡土树种与桉树混交对生态系统生物量和碳储量的影响[J]. 广西科学, 2020, 27(2): 111−119. WEN Yuanguang, ZHANG Zufeng, ZHOU Xiaoguo, et al. Effects of mixing precious indigenous tree species and Eucalyptus on ecosystem biomass and carbon stocks [J]. Guangxi Sciences, 2020, 27(2): 111−119. [25] NEUMANN-COSEL L, ZIMMERMANN B, HALL J S, et al. Soil carbon dynamics under young tropical secondary forests on former pastures: a case study from Panama [J]. Forest Ecology and Management, 2011, 261(10): 1625−1633. [26] 曹磊. 基于多期保留木实测胸径估计吉林省蒙古栎天然林年龄[D]. 北京: 中国林业科学研究院, 2022. CAO Lei. Estimating Stand Age of Quercus mongolica Natural Forests in Jilin Based on Diameter Data of Periodical Measurements [D]. Beijing: Chinese Academy of Forestry, 2022. [27] 陈长启, 和璐璐, 段劼. 北京油松人工林生长对密度和立地的响应[J]. 西南林业大学学报, 2024, 44(6): 8−20. CHEN Changqi, HE Lulu, DUAN Jie. Growth pattern to density and Site condition of Pinus tabuliformis plantation in the Beijing mountainous area [J]. Journal of Southwest Forestry University, 2024, 44(6): 8−20. [28] 谢伊, 杨华. 长白山天然云冷杉针阔混交林主要树种胸径生长与林分空间结构的关系[J]. 北京林业大学学报, 2022, 44(9): 1−11. XIE Yi, YANG Hua. Relationship between stand spatial structure and DBH increment of principal species in natural spruce-fir mixed forest in Changbai Mountains of northeastern China [J]. Journal of Beijing Forestry University, 2022, 44(9): 1−11. [29] GONZALEZ-BENECKE C A, CANNON C F, VON BLON E C. Nutrient content of vegetation and soil of four conifer species growing under different site and competing vegetation management conditions [J/OL]. Forest Ecology and Management, 2024, 555 : 121735[2024-05-12]. DOI: 10.1016/j.foreco.2024.121735. [30] 王文杰, 王凯, 王媛媛, 等. 东北针叶林与阔叶林乔灌草组成特征及碳汇功能对比研究[J]. 北京林业大学学报, 2022, 44(10): 52−67. WANG Wenjie, WANG Kai, WANG Yuanyuan, et al. Comparative study on tree, shrub and herb composition and carbon sink function between coniferous and broadleaved forests in Northeast China [J]. Journal of Beijing Forestry University, 2022, 44(10): 52−67. [31] 郭丽玲, 潘萍, 欧阳勋志, 等. 赣南马尾松天然林不同生长阶段碳密度分布特征[J]. 北京林业大学学报, 2018, 40(1): 37−45. GUO Liling, PAN Ping, OUYANG Xunzhi, et al. Distribution characteristics of carbon density of natural Pinus massoniana forest at different stand growing stages in southern Jiangxi Province, eastern China [J]. Journal of Beijing Forestry University, 2018, 40(1): 37−45. [32] WELLOCK M, RAFIQUE R, LAPERLE C, et al. Changes in ecosystem carbon stocks in a grassland ash (Fraxinus excelsior) afforestation chronosequence in Ireland [J]. Journal of Plant Ecology, 2014, 7(5): 429−438. [33] HE Jie, DAI Quanhou, XU Fengwei, et al. Variability in carbon stocks across a chronosequence of masson pine plantations and the trade-off between plant and soil systems [J/OL]. Forests, 2021, 12 (10): 1342[2024-05-12]. DOI: 10.3390/f12101342. [34] MAKITA N, FUJII S. Tree species effects on microbial respiration from decomposing leaf and fine root litter [J]. Soil Biology and Biochemistry, 2015, 88: 39−47. [35] OSIPOV A F, KUTJAVIN I N, BOBKOVA K S. Ratios between aboveground net primary production, litterfall and carbon stocks in scots pine stands (Russia) [J/OL]. Cerne, 2021, 27 : e-102567[2024-05-12]. DOI: 10.1590/01047760202127012567. [36] ZHOU Lili, LI Shubin, LIU Bo, et al. Tissue-specific carbon concentration, carbon stock, and distribution in Cunninghamia lanceolata (Lamb. ) Hook plantations at various developmental stages in subtropical China [J/OL]. Annals of Forest Science, 2019, 76 (3): 70[2024-05-12]. DOI: 10.1007/s13595-019-0851-x. [37] ANDIVIA E, ROLO V, JONARD M, et al. Tree species identity mediates mechanisms of top soil carbon sequestration in a Norway spruce and European beech mixed forest [J]. Annals of Forest Science, 2016, 73(2): 437−447. [38] 李鹏, 刘晓君, 刘苑秋, 等. 红壤侵蚀区不同植被恢复模式土壤碳储量特征及其影响因素[J]. 浙江农林大学学报, 2024, 41(1): 12−21. LI Peng, LIU Xiaojun, LIU Yuanqiu, et al. Characteristics and influencing factors of soil carbon stocks in different vegetation restoration models in red soil erosion areas [J]. Journal of Zhejiang A&F University, 2024, 41(1): 12−21. [39] 鲁艺, 牟长城, 高旭, 等. 林型和林龄对嫩江沙地人工林生态系统碳储量影响规律研究[J]. 北京林业大学学报, 2023, 45(10): 16−27. LU Yi, MOU Changcheng, GAO Xu, et al. Effects of forest type and stand age on ecosystem carbon storage of plantations in Nenjiang Sandy Land of northeastern China [J]. Journal of Beijing Forestry University, 2023, 45(10): 16−27. [40] 潘嘉琛, 刘超, 董智, 等. 黄泛沙地不同林龄杨树人工林土壤团聚体及有机碳特征[J]. 水土保持研究, 2022, 29(3): 25−30, 37. PAN Jiachen , LIU Chao, DONG Zhi, et al. Distribution characteristics of soil aggregates and soil organic carbon in Populus artificial forest with different forest ages in Yellow River Flood Plain [J]. Research of Soil and Water Conservation, 2022, 29(3): 25−30, 37. [41] 童根平, 姜霓雯, 傅伟军, 等. 清凉峰自然保护区土壤阳离子交换量的剖面分布特征及其影响因素[J]. 东北林业大学学报, 2023, 51(2): 111−115, 122. TONG Genping, JIANG Niwen, FU Weijun, et al. Profile distribution characteristics and influencing factors of soil cation exchange capacity in low mountain natural forest land in south China [J]. Journal of Northeast Forestry University, 2023, 51(2): 111−115, 122. [42] 王卫霞, 史作民, 罗达, 等. 我国南亚热带几种人工林生态系统碳氮储量[J]. 生态学报, 2013, 33(3): 925−933. WANG Weixia, SHI Zuomin, LUO Da, et al. Carbon and nitrogen storage under different plantations in subtropical south China [J]. Acta Ecologica Sinica, 2013, 33(3): 925−933. [43] 彭健健, 徐坚, 王晓晓, 等. 杨梅主产区土壤肥力空间异质性及其影响因素——以浙江仙居和临海为例[J]. 果树学报, 2023, 40(7): 1421−1433. PENG Jianjian, XU Jian, WANG Xiaoxiao, et al. Spatial variation of soil fertility and its influencing factors in Myrica rubra region: a case study in Xianju County and Linhai City [J]. Journal of Fruit Science, 2023, 40(7): 1421−1433. [44] HENRY R J, FURTADO A, RANGAN P. Pathways of photosynthesis in non-eafl tissues [J/OL]. Biology, 2020, 9 (12): 438[2024-05-12]. DOI: 10.3390/biology9120438. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20240401






 下载:
下载: