-
梨Pyrus是世界范围栽培的主要果树树种之一。2012年中国梨的栽种面积为108.55万hm2,梨产量达到了1 579万t[1],为世界上梨产量最高、面积最大的国家。梨为落叶乔木,树体较大,而且结果周期较长,因此,梨的新品种选育不仅需要的时间长,而且土地及劳动力投入耗费大。目前,中国梨品种选育方式主要包括杂交育种、芽变选种、实生选种、辐射育种等[2]。以上梨品种培育方法中除了辐射育种,其他育种方式的效率都较低,难以满足育种和生产实践的需求。此外,由于梨自身产生突变的效率比较低,难以获得类似模式植物的突变体材料用于重要性状的内在机制研究,因此,开展梨突变体的创制具有重要的实践和科学意义,是十分重要的研究工作。甲基磺酸乙酯(EMS)是目前应用最为广泛,效果最佳的化学诱变剂之一,其诱变后代的突变频率高,EMS处理玉米Zea mays花粉,突变频率高达78%[3],且多为显性突变[4],易于突变体的筛选。EMS已成功应用于水稻Oryza sativa,油菜Brassica napus等10多种植物诱导突变体[5-15],但在梨上的应用还未见报道。为了探索适宜梨的突变体诱导技术体系,本研究采用不同体积分数的EMS溶液处理杜梨Pyrus betulaefolia种子,通过对种子萌发、遗传位点变异率鉴定,以及幼苗生长发育状态等检测,筛选最适宜的EMS诱变处理体积分数,以期获得梨的突变体,为梨新品种的选育以及特异性状分子基础研究提供资源和种质材料。
-
供试材料为杜梨种子,采集于南京农业大学国家梨工程研究中心江浦实验基地。EMS药剂由美国Sigma公司生产。
-
使用砂藏法层积2 000粒杜梨种子,温度为4 ℃,湿度为60%,层积时间为40 d,在发现种子有80%左右尖端露白时即可使用EMS药剂进行处理。处理前先用蒸馏水将河沙洗净,再用蒸馏水浸泡24 h。
-
将杜梨种子随机分成10组,200粒·组-1,放入锥形瓶中。使用0.1 mol· L-1,pH 7.0的磷酸缓冲液配置EMS溶液,各组EMS的体积分数依次为0(ck),0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%,0.8%和0.9%。将配置好的EMS溶液分别加入各组,将锥形瓶口封住,摇匀,处理24 h后使用硫代硫酸钠清洗种子15 min,再用双蒸水清洗15 min,将种子晾干后,播种,种子出芽时统计出芽率。
-
随机选取梨苗20株·组-1,于春季采集幼嫩叶片,液氮速冻后保存于-70 ℃。使用改良的十六烷基三甲基溴化铵(CTAB)法提取DNA[16],在10.0 g·kg-1琼脂糖凝胶上进行电泳检测DNA质量,使用Nanodrop超微量分光光度计调整质量浓度至50 mg· L-1,DNA样品保存于-20 ℃。
-
从通用的相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)引物中筛选出多态性较好,条带较为清晰的10对引物[16],并对它们进行编号(表 1),检测EMS处理后杜梨幼苗的遗传变异频率,并进行重复验证。聚合酶链式反应(PCR)体系(25.0 μL):10×PCR缓冲液(Mg2+)2.0 μL,2.5 mmol· L-1 dNTP 1.6 μL,各引物0.6 μL,50~100 ng DNA模板,Taq酶1.0×16.67 nkat(药剂购于TakaRa公司)。PCR扩增所用程序:94 ℃预变性4 min,94 ℃,1 min,35 ℃,1 min,72 ℃,1 min,5个循环,94 ℃变性1 min,55 ℃退火1 min,72 ℃ 1 min,34个循环后72 ℃延伸8 min,应用Sensoquest Labcycle PCR仪器进行扩增。
表 1 检测样品间遗传差异的SRAP标记及引物序列
Table 1. SRAP markers and primer sequence used for identification of genetic variation
正向引物 反向引物 em1: 5′-GACTGCGTACGAATTAAT-3′ me1: 5′-TGAGTCCAAACCGGATA-3′ em4: 5′-GACTGCGTACGAATTTGA-3′ me3: 5′-TGAGTCCAAACCGGAAT-3′ em5: 5′-GACTGCGTACGAATTAAC-3′ me5: 5′-TGAGTCCAAACCGGAAG-3′ em9: 5′-GACTGCGTACGAATTCGA-3′ me6: 5′-TGAGTCCAAACCGGTAA-3′ em10: 5′-GACTGCGTACGAATTCAG-3′ me8: 5′-TGAGTCCAAACCGGTGC-3′ em11: 5′-GACTGCGTACGAATTCCA-3′ em12: 5′-GACTGCGTACGAATTATT-3′ 说明:引物组合1: em1,me1;2: em4,me3;3: em4,me8;4: em10,me5;5: em5,me5;6: em9,me6;7: em11,me5;8: em12,me 3;9: em15,me1;10: em15,me6。 取PCR产物1.5 uL点样于质量浓度为0.8%的非变性聚丙烯酰胺凝胶中电泳分离,以恒定功率80 W,电泳2.5 h,染色液染色15 min,显色液显色15 min后拍照记录。观察电泳图谱,将各对引物变异位点处有条带的记为“0”,无条带的记为“1”,将数据录入Excel表格中,计算变异条带总数和变异平均值。
-
幼苗定植田间后,定期管理幼苗,分别于2012年12月和2013年12月,测量所有梨苗的植株高度和节间长度,计算各组植株高度均值和平均节间长度,并进行差异显著性分析。
-
统计各组EMS处理后杜梨幼苗发芽率,结果显示:不同体积分数EMS处理降低了梨苗的发芽率。各组中,发芽率最高的组为对照组,其发芽率为90.5%;发芽率最低的组为第10组(体积分数为0.9%EMS),发芽率仅为15.5%。从表 2中可以看出:在EMS体积分数为0.1%~0.6%时,随着体积分数升高,发芽率逐渐降低;而在EMS体积分数为0.7%和0.8%时,发芽率趋于平稳;半致死剂量出现在EMS体积分数为0.3%处理组样品,该组出芽率为47.0%;临界致死剂量出现在EMS体积分数为0.4%处理组样品,该组出芽率为38.0%。
表 2 EMS诱变后杜梨苗发芽率和变异频率
Table 2. Germination percentage of seeds and mutant rate of seedlings after EMS treatment
组号 EMS体积分数/% 发芽数量 发芽率/% 变异频率/% 1 0(对照) 181 90.5 11.0 2 0.1 128 64.0 34.0 3 0.2 117 58.5 32.0 4 0.3 94 47.0 33.7 5 0.4 76 38.0 37.3 6 0.5 66 33.0 31.3 7 0.6 41 20.5 33.7 8 0.7 42 21.0 32.7 9 0.8 41 20.5 29.3 10 0.9 31 15.5 35.3 -
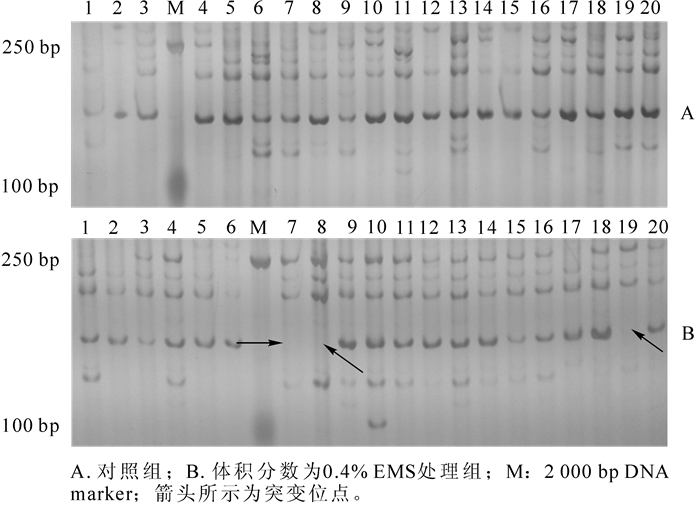
利用筛选的10对SRAP标记通用引物对不同处理组的样本DNA进行鉴定,统计各组幼苗的变异频率。结果表明:10对引物总共检测到15个变异位点,平均每对1.5个,变异位点多出现在100~500 bp扩增大小区间。数据统计结果显示,EMS的体积分数为0.4%时,变异频率最高,为37.3%(表 2)。可见,EMS处理梨种子使其产生了可鉴定的序列位点突变。如图 1所示:为引物em10-me5检测对照组与0.4% EMS处理组随机选取的20株幼苗的遗传突变扩增图谱,可见0.4%EMS处理组在100~250 bp间产生了突变位点。通过引物扩增的重复试验,可以确定检测到的变异位点是稳定可靠的。
-
不同体积分数EMS处理后的幼苗定植田间后,定期管理幼苗,测量杜梨苗第1年和第2年停止生长时的植株高度和节间长度,并计算各组植株高度均值的差异显著性以及平均节间长度(表 3)。统计结果显示:杜梨苗第1年和第2年停止生长时,植物高度均值最高的组都为对照组,其高度分别为81.9 cm和175.5 cm;植物高度均值最低组则发生了变化,第1年停止生长时最低组为第4组,EMS体积分数为0.3%,其高度为44.5 cm,而第2年时,最低组为第8组,EMS体积分数为0.7%,其高度为92.0 cm;杜梨苗第1年和第2年停止生长时,各组株高均与对照组差异极显著(P<0.01),可见EMS处理梨种子后都在一定程度上影响了梨苗的生长。平均节间长度数据的统计结果显示:杜梨连续2 a停止生长时,对照组的节间长度都是最长的,分别为1.97 cm和3.10 cm。第1年停止生长时最短组为第6组,EMS体积分数为0.5%,其长度为1.68 cm。第2年时,最短组为第5组,EMS体积分数为0.4%,其长度为2.56 cm;第1年停止生长时,EMS处理各组的梨苗节间长度差异不显著;第2年停止生长时,对照组与第2,4,5,7,8,9组差异极显著(P<0.01)。
表 3 EMS诱变后杜梨苗连续2 a生长情况的表型统计
Table 3. Phenotypic evaluation of seedlings after EMS treatment in 2012-2013
组号 EMS体积分数/% 株高平均值/cm 平均节间长度/cm 2012 2013 2012 2013 1(对照组) 0 81.85±4.83 A 175.50±7.83 A 1.97±0.098 A 3.10±0.062 A 2 0.1 52.28±2.63 B 98.68±5.49 B 1.78±0.069 A 2.62±0.081 B 3 0.2 60.50±4.32 B 109.63±7.11 B 1.81±0.076 A 2.82±0.070 AB 4 0.3 44.53±2.79 B 93.89±5.65 B 1.71±0.056 A 2.59±0.066 B 5 0.4 53.68±3.34 B 111.50±5.55 B 1.74±0.058 A 2.56±0.059 B 6 0.5 55.54±4.73 B 119.14±8.21 B 1.68±0.048 A 2.69±0.011 AB 7 0.6 56.64±5.19 B 104.76±6.53 B 1.86±0.070 A 2.60±0.082 B 8 0.7 58.80±6.52 B 92.00±6.44 B 1.78±0.17 A 2.63±0.014 B 9 0.8 49.07±4.75 B 102.57±9.30 B 1.84±0.058 A 2.61±0.012 B 10 0.9 52.09±5.83 B 118.27±10.19 B 1.89±0.077 A 2.88±0.013 AB 说明:差异显著性水平,大写字母表示P<0.01。 -
诱变育种中一般采用植株半致死剂量或临界剂量作为诱变的最佳体积分数[17]。杜梨苗的半致死剂量出现在第4组,EMS处理体积分数为0.3%;临界剂量出现在第5组,EMS体积分数为0.4%。经过SRAP分子标记检测,变异频率最高的组为第5组,EMS处理体积分数正好为临界剂量。在表型数据上,虽然第4组的梨苗高度低于第5组,但2组之间的差异并不显著;而在节间长度方面,2组的长度较为接近。因此,综合以上数据分析,确定EMS处理促进杜梨种子突变的最佳体积分数为0.4%。
-
EMS是一种良好的化学诱变剂,Klmark于1953年最早报告了EMS对突变诱导的有效性。其后EMS被广泛应用于植物中,其产生的突变类型较多。例如抗逆类型突变,Zhou等[5]使用EMS诱变水稻,获得了抗盐性的突变植株;品质和产量类型突变,Fang等[8]使用EMS诱变花生Arachis hypogaea,获得高油酸突变体;形态特征类型的突变,这类突变是EMS诱变后突变最多的类型,而且大致上都是以矮化为主,EMS在许多植物[6-14]上都产生了不同程度的矮化突变体。本实验中,使用不同体积分数的EMS诱变杜梨种子后,不仅产生了可检测的遗传变异,各处理组在株高上显著低于对照组,形态上发生了变化,但要确定这些变异是否为可遗传的稳定变异,还有待于进一步试验研究。
-
不同体积分数EMS诱变植物产生突变体效率不同。Fang等[8]使用10.0 g·kg-1的EMS处理原本油酸含量44.2%的花生品种,得到了油酸含量超过60%的突变体。而Zhou等[5]使用体积分数为0.5%的EMS处理水稻种子,获得了抗盐性较好的突变体。我们使用不同体积分数的EMS处理杜梨种子,结合分子和生理指标的鉴定,获得了促进杜梨突变的最适宜EMS体积分数为0.4%。由此可见,EMS处理在不同物种的最佳使用体积分数是有差异的,需要针对不同物种进行优化和筛选。
-
EMS是一种烷化剂,能够诱发基因突变,多为点突变[4],使用DNA分子标记的方法可以快速有效地鉴定出突变位点。胡建斌等[18]使用SRAP分子标记技术检测到了EMS诱变黄瓜Cucumis sativus的变异位点。殷冬梅等[19]使用随机扩增多态性DNA(RAPD)分子标记技术检测到了EMS诱变花生的突变位点。相比于其他分子标记,SRAP分子标记的特点:操作较为简单,只涉及到PCR扩增;引物片段较长,重复性较好;使用通用引物,正反向引物可以随机组合;检测结果中共显性标记占标记位点的比例较高[20-21],在基因组中分布较为均匀,更适用于检测农艺性状的差异[22]。本试验中,使用的10对通用SRAP引物共检测到了15个突变位点,检测效率较高,可对筛选适宜的EMS体积分数提供可靠的数据支持。
-
EMS在农作物与蔬菜花卉中的应用较广,已构建了很多突变体库。由于木本植物生长周期较长,获得稳定遗传的时间较长,所以在果树上的应用研究还比较少。本研究中,我们首次使用不同体积分数的EMS药剂诱变杜梨种子,通过分子和生理数据的鉴定与分析,得到了最佳的诱变处理体积分数,其种子繁殖当代植株在形态上表现出了一定的变异特征,相比于传统的杂交育种和自然突变体筛选,化学诱变的效率更高。本研究结果将为今后快速获得梨突变体提供可靠的理论基础和依据。
Identification and analysis of EMS-induced seed mutants in Pyrus betulifolia
-
摘要: 为了获得杜梨Pyrus betulifolia突变体, 以杜梨种子为试材, 分别使用不同体积分数甲基磺酸乙酯(EMS)[0(ck), 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%, 0.8%, 0.9%]对层积后的种子进行诱变处理。然后, 统计了种子发芽率, 使用相关序列扩增多态性(SRAP)标记鉴定遗传变异位点, 测量幼苗田间株高和节间长度。试验结果表明:杜梨种子发芽的半致死剂量为0.3% EMS处理。结合SRAP标记鉴定和表型数据分析, 筛选出最适宜的EMS处理体积分数为0.4%, 变异率为37.3%;同时, 使用SPSS软件对表型数据分析显示, 处理组的杜梨苗株高极显著低于对照组(P=0.01)。研究结果为快速获得杜梨突变体提供了理论基础和依据。
-
关键词:
- 园艺学 /
- 杜梨 /
- 甲基磺酸乙酯(EMS) /
- 种子 /
- 相关序列扩增多态性(SRAP)标记 /
- 突变
Abstract: To obtaining the mutants of Pyrus betulifolia, different concentrations (0, 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%, 0.8%, 0.9%) of ethyl methane sulphonate (EMS) were used to induce seeds after stratification. Then, seed germination percentage was determined, sequence-related amplified polymorphism (SRAP) markers were used to identify mutant loci, and phenotypic measurements of plant height and internode length of the seedlings were made. Results showed that the half lethal dose of EMS concentration was 0.3%. Combined with SRAP markers detection and phenotypic data analysis, the optimum concentration of EMS treatment was 0.4%, and the mutation rate was 37.3%. Meanwhile, the phenotypic data analysis which used SPSS revealed that plant height with different EMS treatments was significantly lower (P=0.01) than the ck group. These results should provide a valuable theoretical basis for effectively obtaining pear mutants. -
表 1 检测样品间遗传差异的SRAP标记及引物序列
Table 1. SRAP markers and primer sequence used for identification of genetic variation
正向引物 反向引物 em1: 5′-GACTGCGTACGAATTAAT-3′ me1: 5′-TGAGTCCAAACCGGATA-3′ em4: 5′-GACTGCGTACGAATTTGA-3′ me3: 5′-TGAGTCCAAACCGGAAT-3′ em5: 5′-GACTGCGTACGAATTAAC-3′ me5: 5′-TGAGTCCAAACCGGAAG-3′ em9: 5′-GACTGCGTACGAATTCGA-3′ me6: 5′-TGAGTCCAAACCGGTAA-3′ em10: 5′-GACTGCGTACGAATTCAG-3′ me8: 5′-TGAGTCCAAACCGGTGC-3′ em11: 5′-GACTGCGTACGAATTCCA-3′ em12: 5′-GACTGCGTACGAATTATT-3′ 说明:引物组合1: em1,me1;2: em4,me3;3: em4,me8;4: em10,me5;5: em5,me5;6: em9,me6;7: em11,me5;8: em12,me 3;9: em15,me1;10: em15,me6。 表 2 EMS诱变后杜梨苗发芽率和变异频率
Table 2. Germination percentage of seeds and mutant rate of seedlings after EMS treatment
组号 EMS体积分数/% 发芽数量 发芽率/% 变异频率/% 1 0(对照) 181 90.5 11.0 2 0.1 128 64.0 34.0 3 0.2 117 58.5 32.0 4 0.3 94 47.0 33.7 5 0.4 76 38.0 37.3 6 0.5 66 33.0 31.3 7 0.6 41 20.5 33.7 8 0.7 42 21.0 32.7 9 0.8 41 20.5 29.3 10 0.9 31 15.5 35.3 表 3 EMS诱变后杜梨苗连续2 a生长情况的表型统计
Table 3. Phenotypic evaluation of seedlings after EMS treatment in 2012-2013
组号 EMS体积分数/% 株高平均值/cm 平均节间长度/cm 2012 2013 2012 2013 1(对照组) 0 81.85±4.83 A 175.50±7.83 A 1.97±0.098 A 3.10±0.062 A 2 0.1 52.28±2.63 B 98.68±5.49 B 1.78±0.069 A 2.62±0.081 B 3 0.2 60.50±4.32 B 109.63±7.11 B 1.81±0.076 A 2.82±0.070 AB 4 0.3 44.53±2.79 B 93.89±5.65 B 1.71±0.056 A 2.59±0.066 B 5 0.4 53.68±3.34 B 111.50±5.55 B 1.74±0.058 A 2.56±0.059 B 6 0.5 55.54±4.73 B 119.14±8.21 B 1.68±0.048 A 2.69±0.011 AB 7 0.6 56.64±5.19 B 104.76±6.53 B 1.86±0.070 A 2.60±0.082 B 8 0.7 58.80±6.52 B 92.00±6.44 B 1.78±0.17 A 2.63±0.014 B 9 0.8 49.07±4.75 B 102.57±9.30 B 1.84±0.058 A 2.61±0.012 B 10 0.9 52.09±5.83 B 118.27±10.19 B 1.89±0.077 A 2.88±0.013 AB 说明:差异显著性水平,大写字母表示P<0.01。 -
[1] 中华人民共和国农业部.中国农业年鉴2012[M].沈阳:辽宁教育出版社, 2012:214-215. [2] 柴明良, 沈德绪.中国梨育种的回顾和展望[J].果树学报, 2003, 20(5):379-383. CHAI Mingliang, SHEN Dexu. Status and prospects of pear breeding in China[J]. J Fruit Sci, 2003, 20(5):379-383. [3] BIRD R M K, NEUFFER M G. Induced mutations in maize[J]. Plant Breed Rev, 1987, 5:139-180. [4] GREENE E A, CODOMO C A, TAYLOR N E, et al. Spectrum of chemically induced mutations from a large-scale reverse-genetic screen in Arabidopsis[J]. Genetics, 2003, 164(2):731-740. [5] ZHOU Jingwei, WANG Fuzheng, DENG Ping, et al. Characterization and mapping of a salt-sensitive mutant in rice (Oryza sativa L.)[J]. J Integr Plant Biol, 2013, 55(6):504-513. [6] EMRANI S N, ARZANI A, SAEIDI G. Seed viability, germination and seedling growth of canola (Brassica napus L.) as influenced by chemical mutagens[J]. Afr J Biotechnol, 2013, 10(59):12602-12613. [7] LAXANI S, DESAI S A, LOHITHASWA H C, et al. The utility of chemical and radiation induced mutations in tetraploid wheat[J]. Indian J Genet Plant Breed, 2013, 73(3):252-258. [8] FANG Chaoqi, WANG Chuantang, WANG Piwu, et al. Identification of a novel mutation in FAD2B from a peanut EMS mutant with elevated oleate content[J]. J Oleo Sci, 2012, 61(3):143-148. [9] DAS A, BATTA A K, BHATTACHARYA A, et al. EMS induced mutagenesis in Poshita and Jawahar 22 of Withania somnifera (L.) Dunal (Solanaceae)[J]. Cytol Int J Cytol, 2010, 75(3):305-311. [10] SIKDER S, BISWAS P, HAZRA P, et al. Induction of mutation in tomato (Solanum lycopersicum L.) by gamma irradiation and EMS[J]. Indian J Genet Plant Breed, 2013, 73(4):392-399. [11] TOUSI M S, BAHRAMI A R, ZOLALA J, et al. Ethyl methanesulfonate treatment of celery plants affects the expression pattern of CEL I endonuclease[J]. Acta Physiol Plant, 2011, 33(2):469-472. [12] KUMAR A, PARMHANSH P, PRASAD R. Induced chlorophyll and morphological mutations in mungbean (Vigna radiata L. Wilczek)[J]. Legume Res J, 2009, 32(1):41-45. [13] SINGH S V, SINGH D B, YADAV M, et al. Effect of EMS on germination, growth and sensitivity of papaya (Carica papaya L.) cv. Farm Selection-1[J]. Acta Hort, 2008, 851(II International Symposium on Papaya):113-116. [14] CHEN Yaosheng, CHEN Wen, HUANG Xia, et al. Fusarium wilt-resistant lines of Brazil banana (Musa spp., AAA) obtained by EMS-induced mutation in a micro-cross-section cultural system[J]. Plant Pathol, 2013, 62(1):112-119. [15] KUMAR G, NASEEM S. EMS Induced intercellular chromatin transmigration in Papaver somniferum L.[J]. Czech J Genet Plant Breed, 2013, 49(2):86-89. [16] 路娟.利用DNA分子标记研究梨、樱桃种质资源遗传多样性[D].南京:南京农业大学, 2010. [17] 蔡春菊, 高健, 牟少华. 60Coγ辐射对毛竹种子活力及早期幼苗生长的影响[J].核农学报, 2007, 21(5):436-440 CAI Chunju, GAO Jian, MU Shaohua. Effects of 60Coγrays radiation on seed vigor and young seedling growth of Phyllostachys edulis[J]. J Nucl Agric Sci, 2007, 21(5):436-440. [18] 胡建斌, 刘丹华, 王建丽, 等. EMS诱导黄瓜离体变异及分子标记检测[J].江西农业学报, 2011, 23(4):36-38. HU Jianbin, LIU Danhua, WANG Jianli, et al. EMS-induced mutagenesis of isolated cucumber and its detection by molecular markers[J]. Acta Agric Jiangxi, 2011, 23(4):36-38. [19] 殷冬梅, 杨秋云, 杨海棠, 等.花生突变体的EMS诱变及分子检测[J].中国农学通报, 2009, 25(5):53-56. YIN Dongmei, YANG Qiuyun, YANG Haitang, et al. EMS mutagenesis and molecular identification of peanut mutant[J]. Chin Agric Sci Bull, 2009, 25(5):53-56. [20] LI G, QUIROS C F. Sequence-related amplified polymorphism(SRAP), a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J]. Theor Appl Genet, 2001, 103(2/3):455-461. [21] 李莉, 彭建营, 白瑞霞, 等. SRAP与TRAP标记及其在园艺植物研究中的应用[J].西北植物学报, 2006, 26(8):1749-1752. LI Li, PENG Jianying, BAI Ruixia, et al. SRAP and TRAP markers and their application toresearch about horticultural plants[J]. Acta Bot Boreal-Occident Sin, 2006, 26(8):1749-1752. [22] FERRIOL M, PICO B, NUEZ F. Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLP markers[J]. Theor Appl Genet, 2003, 107(2):271-282. 期刊类型引用(1)
1. 王眉樾,张兰珍,翟禄新,刘芸瑜,黎婵,欧晓华,廖伟婷,迟晋浙. 毛竹与桉树蒸散估算公式修正及对比分析. 水土保持研究. 2020(06): 353-361 .  百度学术
百度学术其他类型引用(5)
-

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2014.06.010




 下载:
下载:

