-
三叶青Tetrastigma hemsleyanum为葡萄科Vitaceae崖爬藤属Tetrastigma的药用植物,主要以地下块根入药。在临床中,三叶青内服可治疗咽喉炎、肝炎、肺炎、小儿高热惊厥及病毒性脑膜炎等炎症,外用可治毒蛇咬伤、跌打损伤、痈疽等疾病,被誉为“植物抗生素”,是中国独有的珍贵药材,主要分布于浙江、湖南、广东、广西、四川等地[1]。由于三叶青具有良好的抗肿瘤功效且无毒副作用[2],导致三叶青需求量大量增加,人工栽培面积不断扩大。人工种植三叶青多采取遮光大棚雾喷管理,藤叶生长茂盛,但块根品质却远不如生长环境苛刻的野生三叶青[3-5]。逆境胁迫虽抑制植物的生长发育,特别是营养生长,但同时也会促进或者抑制植物中黄酮等一些次生代谢产物的累积[6-9]。三叶青喜阴湿环境,野生三叶青多生长于山坡或山沟、溪谷两旁的针阔混交林或杂木林林下背阴处[10-11],可见水分条件对三叶青的生长影响较大。目前,温度[12-13]、光照[14-15]、土壤肥料[16-17]等环境因子对三叶青生长的影响已有研究,但关于水分胁迫对三叶青特别是三叶青黄酮含量的影响还未见报道。因此,本研究分析了水分胁迫对三叶青生长、黄酮含量及其合成途径中关键酶的影响,为人工种植高品质三叶青提供理论依据。
-
三叶青由浙江五养堂药业有限公司遂昌县金竹药王谷三叶青基地提供。为了保持试验材料的一致性,以专用袋标准化繁育的2年生三叶青植株作为供试材料。
-
实验地位于浙江农林大学东湖校区(30°15′28″N,119°43′35″E),该区全年降水量1 628.6 mm,全年平均气温16.4 ℃,年日照时数1 847.3 h,无霜期237.0 d。取长势良好的2年生的三叶青植株,种植在上口径20 cm、下口径15 cm、高20 cm的塑料花盆中,栽培基质为过筛土∶营养基质=2∶1(质量比),每盆1株,缓苗5周,缓苗期间定时定量浇水。5周后,选取长势基本一致的2年生植株57株,随机分为3组,每组19盆,设置3个处理组,分别为干旱、水涝和对照。干旱组在试验期间一直不浇水,水涝组保证地下部分在试验期间一直处于淹水状态,对照组在试验期间正常浇水。
-
干旱组在胁迫处理的第1、8、16、24、32、40天,于相同叶位随机取样3盆(预试验发现三叶青在不浇水40 d左右出现死亡现象),水涝组在胁迫处理的第1、4、8、12、16、20天,于相同叶位随机取样3盆(预试验发现三叶青在水淹20 d左右出现死亡现象),对照组在胁迫处理的第1、4、8、12、16、20、24、32、40天,于相同叶位处随机取样3盆。每个试验组设置3个重复,所有样品取样后立即用清水洗净擦干后再立即用液氮预冷,于−80 ℃冰箱保存待测。
电镜样品取样,在胁迫处理最后1 d,取植株的中部成熟叶片,中间靠近大叶脉处部位切成长0.1 cm、宽0.2 cm左右的小片(避开大叶脉)后迅速放入体积分数为2.5%的戊二醛溶液中,抽真空至材料沉入固定液底部,4 ℃固定过夜,每个试验组重复3次。
-
随机取实验三叶青进行叶片表型拍摄,再取块根,洗净后擦干进行块根表型拍摄。
-
倒掉固定液,用0.1 mol·L−1 pH 7.0的磷酸缓冲液漂洗样品3次,每次15 min;用质量分数为1%的锇酸固定样品1~2 h后漂洗3次。然后用不同体积分数的乙醇溶液(30%、50%、70%、80%、90%和95%)对样品进行脱水处理,每种体积分数处理15 min,再用纯乙醇处理20 min,最后用纯丙酮处理20 min。接着用Spurr包埋剂与丙酮的混合液(V/V=1/1)处理样品1 h;再用Spurr包埋剂与丙酮的混合液(V/V=3/1)处理样品3 h;最后用纯包埋剂处理样品过夜。将经过渗透处理的样品包埋起来,70 ℃加热过夜,即得到包埋好的样品;样品在LEICA EM UC7型超薄切片机中切片,获得70~90 nm的切片;切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液(体积分数)各染色5~10 min。最后在Hitachi H-7650型透射电镜中观察叶肉细胞中的叶绿体。
-
黄酮质量分数的测定方法参照文献[18-19]。以芦丁不同质量分数(mg)为纵坐标(y),以波长500 nm下的吸光度D(500)为横坐标(x)绘制标准曲线,得到回归方程y=0.245 9x+0.001 6(R2=0.999 9)。测定样品在500 nm波长下的吸光度D(500),计算三叶青总黄酮质量分数,每个样品3个重复。
-
酶液制备及苯丙氨酸解氨酶(PAL)活性的测定参照徐琳煜[20]的方法,以每克鲜质量叶片每分钟波长290 nm下的吸光度D(290)变化0.01为1个酶活力单位(16.67 nkat·g−1·min−1)。查尔酮合成酶(CHS)活性测定参照试剂盒法(上海晶抗生物工程):以标准物的浓度(×16.67 nkat·L−1)为纵坐标(y),波长450 nm下的吸光度D(450)为横坐标(x),得到标准曲线直线回归方程y=92.238x+1.193 8(R2=0.999),然后根据样品的D(450)计算样品相应的浓度。查尔酮异构酶(CHI)活性测定参照试剂盒法(上海晶抗生物工程):以标准物的浓度(×16.67 nkat·L−1)为纵坐标(y),波长450 nm下的吸光度D(450)为横坐标(x),得到标准曲线直线回归方程y=1 165.3x+50.552(R2=0.999),然后根据样品的D(450)计算出样品相应的浓度。
-
用Excel进行数据处理与制图;运用单因素方差分析和最小显著极差法LSR进行方差分析和多重比较(α=0.05);采用Pearson’s进行相关性分析。
-
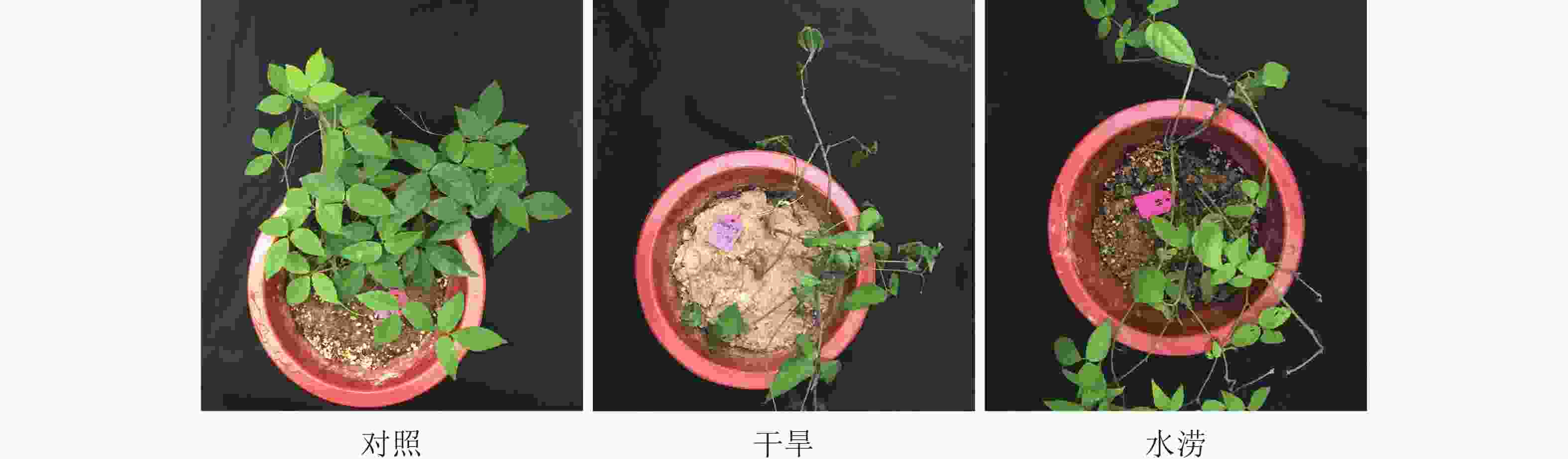
水分胁迫严重影响三叶青的营养生长。从叶片表型来看,未遭受水分胁迫的三叶青(对照)叶片饱满,色泽鲜艳,叶脉清晰;干旱胁迫40 d后,三叶青叶片失水,萎蔫,逐渐发黄枯萎;水涝胁迫20 d后,三叶青叶片失绿变黄(图1)。从块根的表观形态上来看,对照组的块根饱满,形状完好,而干旱组的块根失水皱缩,表皮布满沟壑,水涝组的块根绵软,表皮极易脱落,块根几乎腐烂(图2)。
-
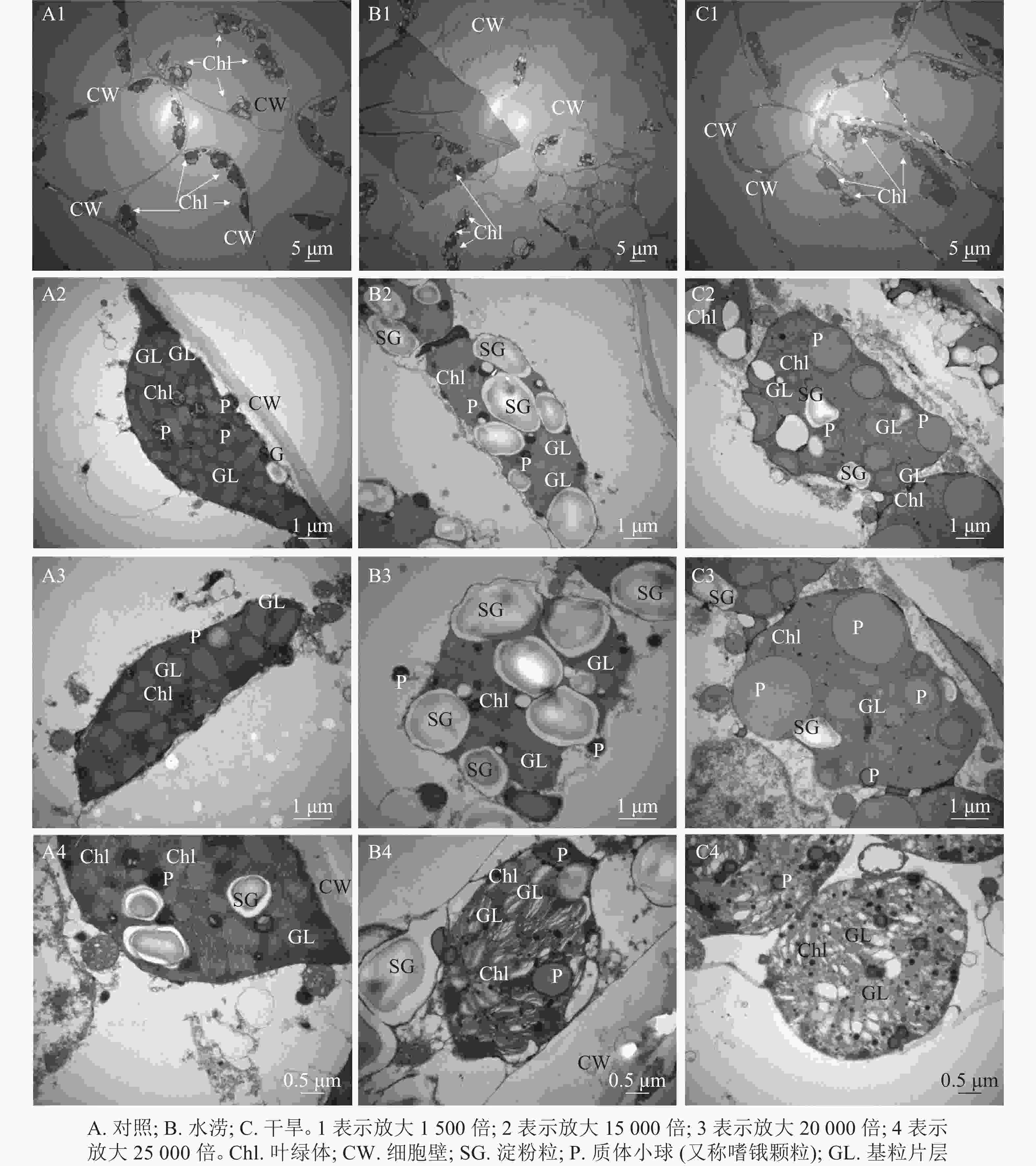
叶绿体结构的完整性及其内部结构的有序性对光合作用的光能吸收和传递有着重要作用。与对照相比,水涝和干旱处理下叶绿体数目明显减少(图3A1,图3B1,图3C1)。水分胁迫下,三叶青叶片中的叶绿体在细胞内的排列方式发生变化,与对照的紧贴细胞壁并且整齐分布相比,水涝和干旱处理后,叶肉细胞中的叶绿体与细胞壁分离,挤向液泡,在细胞中呈现拥挤混乱的现象,叶绿体向细胞中间靠拢,完全随机分布在细胞中(图3A1,图3B1,图3C1)。水涝和干旱处理后,叶肉细胞叶绿体膨胀,失去原本形态,叶绿体中淀粉粒数量增多,可能是代谢不正常导致淀粉粒无法运出造成的(图3A2,图3B2,图3B3)。与对照相比,水涝和干旱处理后,叶绿体基质颜色变浅,叶绿体膨大,质体小球颜色变浅,数量增多,体积变大(图3A3,图3B3,图3C3)。对照基粒片层结构整齐,紧密排列,而干旱和水涝处理后,基粒片层失去整齐紧密结构,与细胞质之间不再有完整界限,结构被破坏(图3A4,图3B4,图3C4)。
-
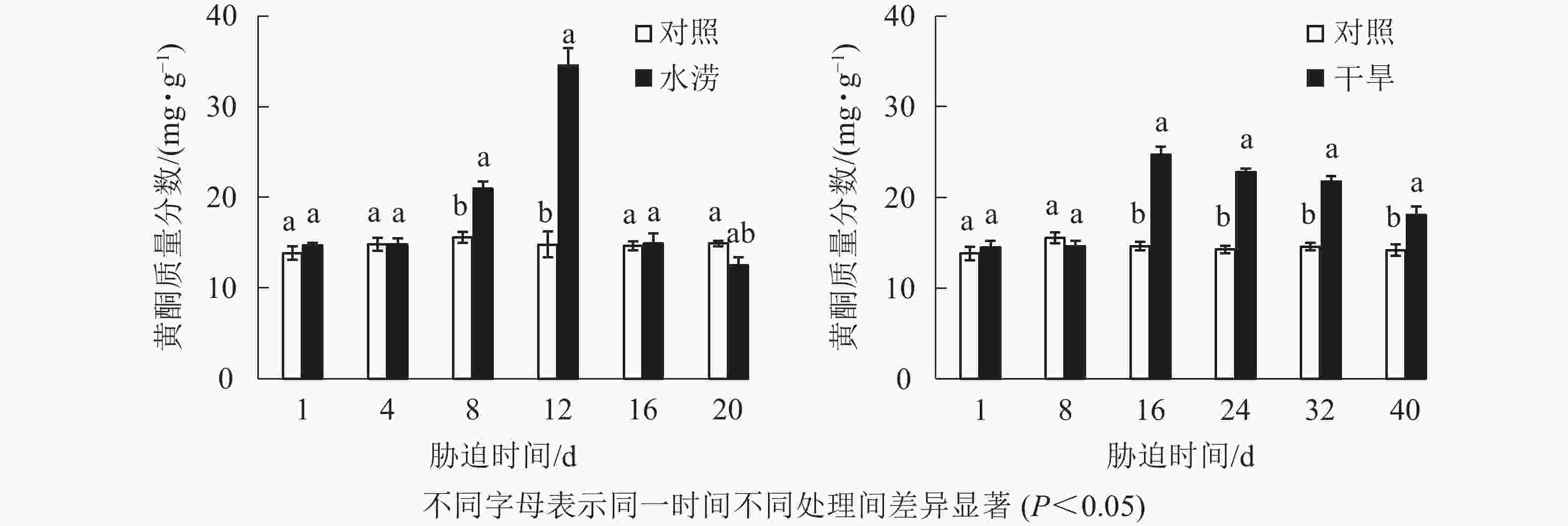
水分胁迫影响三叶青块根的黄酮质量分数。水涝胁迫8 d后,总黄酮质量分数显著高于对照(P<0.05),在胁迫12 d时达到最大值。干旱胁迫16 d后,总黄酮质量分数显著高于对照(P<0.05),在胁迫16 d时达到峰值(图4)。对照总黄酮质量分数保持在比较稳定的范围内,而水涝和干旱处理后,总黄酮质量分数呈先低后高再回落的变化趋势。
-
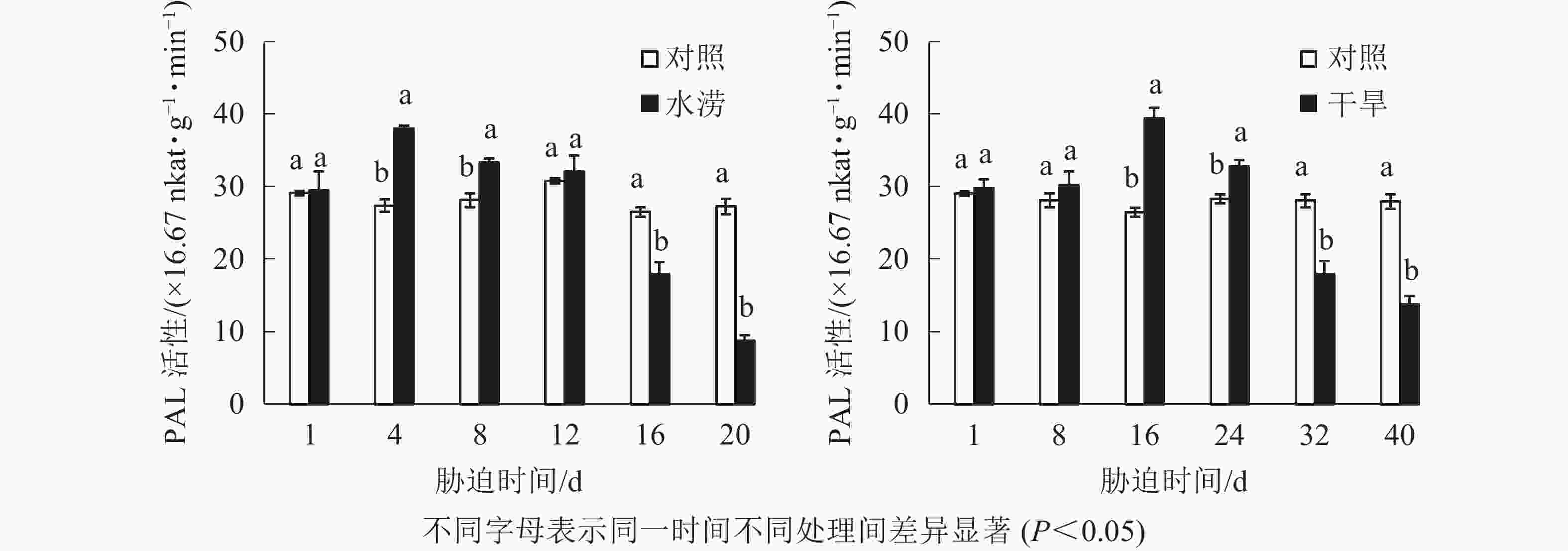
水分胁迫对三叶青块根黄酮合成关键酶活性的影响较大。水涝胁迫4 d后,PAL活性显著提高(P<0.05),并且在胁迫4 d时达到峰值,之后下降且在胁迫16 d时显著低于对照(P<0.05)。干旱胁迫16 d后,PAL活性显著高于对照(P<0.05),并且在胁迫16 d时达到峰值,之后下降且在胁迫32 d时显著低于对照(P<0.05)。即PAL活性呈先上升后下降的趋势,胁迫处理前期大于对照,胁迫后期则低于对照(图5)。
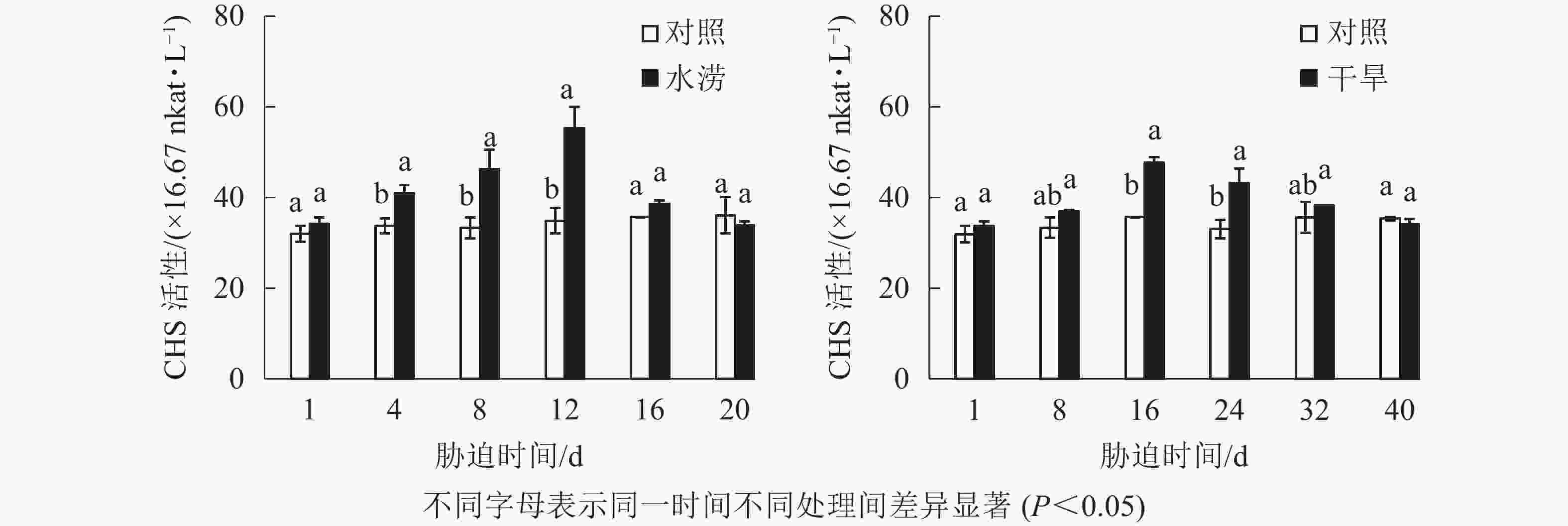
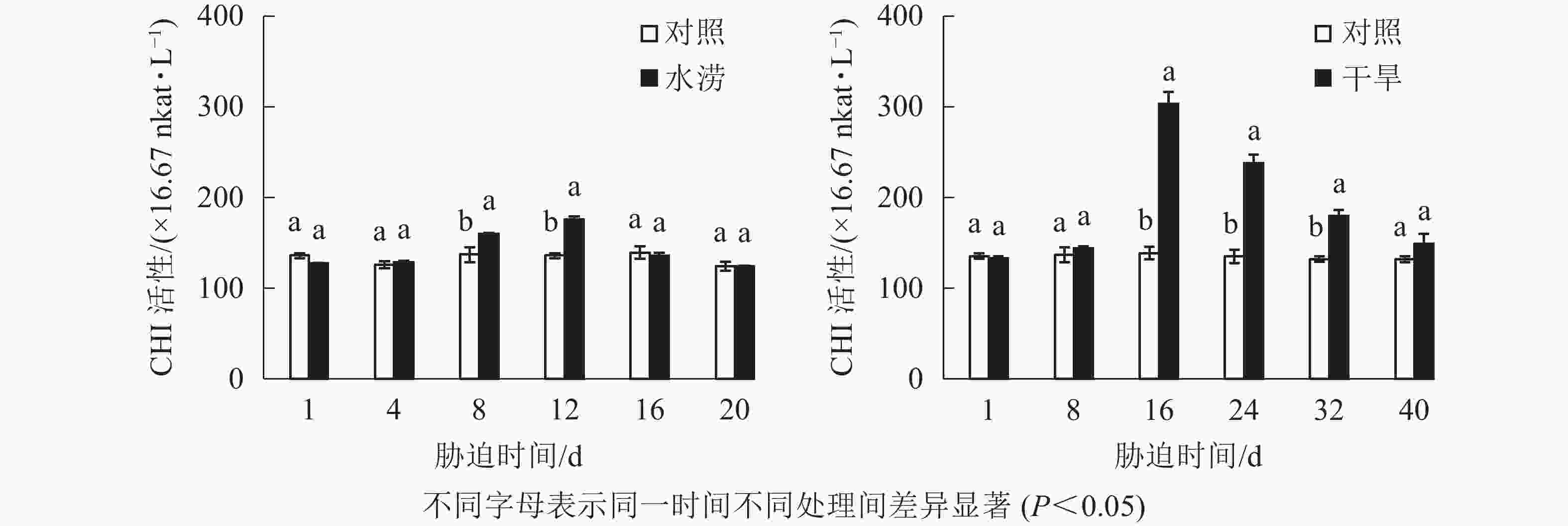
水分胁迫影响三叶青CHS活性。水涝胁迫4 d后,CHS活性显著高于对照(P<0.05),且在胁迫处理的12 d达到最大值,之后回落到与对照近似水平。干旱胁迫16 d后,干旱处理的CHS活性显著增强(P<0.05),并且在胁迫16 d达到峰值,之后下降至与对照近似水平。整个研究过程中,水涝和干旱处理的CHS活性呈先上升后下降的趋势,且酶活性大于对照组,对照组基本不变(图6)。
与对照相比,水涝胁迫12 d后,CHI活性显著增强(P<0.05),并且在胁迫处理的12 d达到峰值,之后开始下降。干旱胁迫下,CHI活性在8~16 d迅速增加,且在胁迫16 d显著高于对照(P<0.05),之后开始下降(图7)。总体来说,水涝和干旱的CHS活性呈先上升后下降的趋势,且酶活性大于对照组,而对照组的CHI活性一直比较稳定。此外,相比于CHS活性,CHI对胁迫的响应略有延缓,说明CHI可能在CHS之后起作用。
-
从表1可以看出:干旱和水涝胁迫下,三叶青黄酮质量分数、PAL、CHS、CHI活性之间均表现为正相关关系,个别呈显著相关(P<0.05),表明黄酮质量分数受酶活性的调控。胁迫处理组的PAL与CHS、CHI之间呈正相关,但相关不显著(P>0.05);CHS和CHI之间呈极显著相关(P<0.01),表明CHS和CHI共同促进黄酮质量分数增加。
表 1 水分胁迫下黄酮质量分数、PAL、CHS、CHI之间的相关性分析
Table 1. Correlation analysis between flavonoid content, PAL, CHS and CHI under water stress
处理 黄酮 PAL CHS CHI 水涝 黄酮 1 PAL 0.143 1 CHS 0.830* 0.614 1 CHI 0.854* 0.413 0.950** 1 干旱 黄酮 1 PAL 0.256 1 CHS 0.846* 0.699 1 CHI 0.895* 0.625 0.980** 1 对照 黄酮 1 PAL 0.565 1 CHS −0.014 0.464 1 CHI 0.336 0.553 0.920** 1 说明:*表示显著相关(P<0.05);**表示极显著相关(P< 0.01) -
水分影响三叶青的光合作用,而叶绿体作为光合作用的反应场所,其结构的完整性是影响光合作用正常运行的关键。本研究在三叶青叶绿体超微结构中发现:胁迫使三叶青叶绿体数量减少且不断向细胞中央靠拢,可能是三叶青叶片发黄的原因。王顺才等[21]在研究干旱胁迫对3种苹果属Malus植物的叶绿体超微结构的影响时也证实了这一点。本研究发现:干旱和水涝下,叶绿体形态结构发生改变,叶绿体膨大变圆,淀粉粒大量积累无法运出,质体小球的数量增多、体积变大、颜色变浅。杨凤军等[22]研究了干旱胁迫对番茄Lycopersicon esculentum叶面叶绿体超微结构后表明:逆境导致质体小球数量增加;因为质体小球是类囊体降解脂类聚集的结果,其数量的变化可作为叶细胞受损的标志[23]。本研究还观察到水涝和干旱的三叶青叶绿体基粒片层失去整齐紧密排列结构,变得松散模糊,没有界限,这与李冬林等[24]的研究结果一致;表明水涝和干旱使三叶青叶片叶绿体膜结构严重受损,失去生理活性,从而影响三叶青的光合作用和营养生长。
次生代谢过程是连接生态环境与药效成分含量的中间环节,产生的次生代谢产物在植物自我保护、生理调节等生命活动方面起着重要作用[25],并且是药用植物的主要药效成分。环境影响次生代谢产物的形成和积累[26]。目前,关于非生物因子影响药用植物次生代谢产物的研究已有很多,ZHU等[27]研究认为:柴胡Bupleurum chinense在水分胁迫下通过增加次生代谢产物的含量来提高抗氧化能力,进而抵制因水分胁迫产生的自由基;有研究发现:低温培养的黄豆Glycine max,其大豆黄素和染料木苷的代谢水平显著增高[28];LI等[29]在研究拟南芥Arabidopsis thaliana应对盐胁迫的响应时发现:黄酮类化合物含量上升。三叶青作为中药材,其药用活性成分主要有黄酮类化合物、酚酸类化合物、萜类化合物等次生代谢产物,本研究发现:水分胁迫促进了三叶青黄酮的积累,导致总黄酮质量分数高于对照,说明水涝和干旱使三叶青黄酮代谢增强,增加了三叶青块根单位干质量的黄酮质量分数。小麦Triticum aestivum、丹参Salvia miltiorrhiza等在水分胁迫下同样出现了黄酮类化合物质量分数上升的情况[30-31]。
PAL是连接初级代谢和苯丙烷类代谢途径中的关键酶和限速酶,可催化苯丙氨酸生成香豆酸、肉桂酸等中间产物,并且可以进一步转化为绿原酸、香豆素,也能够形成酯,再经历多条途径,进一步转化为木质素、类黄酮等物质。研究发现:药用植物在遭遇逆境胁迫时,PAL活性提高,当胁迫过严重时,PAL活性变弱[32],本研究也验证了这一点。胁迫前期,PAL活性增强,催化苯丙氨酸代谢,促进黄酮代谢的进行;随着胁迫时间加长,PAL活性降低。CHS和CHI分别是黄酮类化合物合成途径中的第1个和第2个关键酶,胁迫会上调CHS、CHI活性[33]。本研究中,CHS和CHI活性在PAL之后增强,而黄酮质量分数也在这时达到峰值,这与酶作用途径中的顺序一致;而在胁迫后期,PAL、CHS、CHI活性不断下降,三叶青黄酮质量分数也有所回落,这可能是由于胁迫使三叶青生长受到威胁,严重抑制各种生命活动,各种酶的活性也不断下降。
郭肖等[34]对水芹Oenanthe javanica黄酮质量分数和PAL活性的相关性分析发现:黄酮含量与PAL活性的变化趋势一致。本研究发现:三叶青块根中PAL、CHS、CHI活性与黄酮质量分数呈正相关,且部分指标显著相关(P<0.05),表明三叶青黄酮质量分数与关键酶活性相关,关键酶活性增强可能是引起三叶青黄酮高积累的关键因素。许多研究也证明了这一点,如LI等[35]研究发现:转基因烟草Nicotiana tabacum的总黄酮质量分数与CHI活性呈正相关;在温度与水分胁迫下,参与银杏Ginkgo biloba黄酮类代谢的PAL、CHS基因表达量的变化趋势与类黄酮质量分数变化趋势基本一致[36]。
水分胁迫影响三叶青的生长,表现为叶片块根受损、叶绿体超微结构损伤、黄酮质量分数以及黄酮合成途径相关酶活性变化等。三叶青通过产生一系列应激反应以应对水分胁迫,适度的水分胁迫可通过增强黄酮合成途径中的关键酶活性以增强抗逆性,同时增加黄酮的产量,提高三叶青的药材品质。
Effects of water stress on chloroplast ultrastructure and key enzymes of flavonoid synthesis in Tetrastigma hemsleyanum
-
摘要:
目的 探究水分胁迫对三叶青Tetrastigma hemsleyanum叶绿体超微结构及黄酮合成关键酶活性的影响,有利于提升三叶青的品质。 方法 以2年生三叶青实生苗为材料,通过控水盆栽试验(设置水涝、干旱和对照),分析水分胁迫对三叶青叶绿体超微结构、块根总黄酮质量分数以及黄酮合成途径中的3个关键酶[苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)和查尔酮异构酶(CHI)]活性的影响。 结果 干旱和水涝均引起三叶青叶片叶绿体数量减少,叶绿体质体小球的数量增多、体积变大、颜色变浅,叶绿体基粒片层结构不再整齐紧密;干旱时,三叶青总黄酮质量分数在胁迫12 d达到峰值,水涝时则在胁迫16 d达到峰值,而PAL、CHS和CHI等3个关键酶则在黄酮质量分数达到峰值前期或者是同期表现出较高的活性;随着胁迫时间的延长,黄酮质量分数和关键酶活性都有不同程度的下降,黄酮质量分数与PAL、CHS、CHI活性均显著相关(P<0.05)。 结论 适度的水分胁迫可提高三叶青块根中黄酮类化合物的质量分数以及相关酶的活性。图7表1参36 Abstract:Objective This study aims to investigate the effects of water stress on the ultrastructure of chloroplast and the activity and content of key enzymes in the flavonoid synthesis pathway of Tetrastigma hemsleyanum, so as to improve the quality of T. hemsleyanum. Method With two-year-old seedlings of T. hemsleyanum as materials, and through water control pot experiments (setting waterlogging, drought, and the control), the effects of water stress on chloroplast ultrastructure, root flavonoid content and the activities of three key enzymes [phenylalanine ammonia lyase(PAL), chalcone synthase(CHS) and chalcone isomerase(CHI)] in flavonoid synthesis pathway were analyzed. Result Drought and waterlogging both caused the decrease of chloroplast number in the leaves, and they moved toward the center of the cell instead of clinging to the cell wall. Besides, the number of plastid globules in the chloroplast increased and the volume became larger, the color became lighter, and the lamella structure of chloroplast was no longer neat and compact. The total flavonoid content of T. hemsleyanum reached the peak on the 12th day under drought stress, and reached the peak on the 16th day under waterlogging stress. Analysis of key enzyme activities in the biosynthetic pathway of flavonoids showed that the activities of PAL, CHS and CHI increased successively in the early stage of the maximum flavonoid content or during the same period, but with the extension of stress time, the total flavonoid content and key enzyme activities decreased in varying degrees. There was a significant correlation between the content of flavonoids and the activities of PAL, CHS, and CHI (P<0.05). Conclusion Moderate water stress can increase the content of flavonoids in the roots of T. hemsleyanum and enhance the activity of related enzymes. [Ch, 7 fig. 1 tab. 36 ref.] -
Key words:
- water stress /
- Tetrastigma hemsleyanum /
- ultrastructure /
- flavonoid /
- key enzyme
-
表 1 水分胁迫下黄酮质量分数、PAL、CHS、CHI之间的相关性分析
Table 1. Correlation analysis between flavonoid content, PAL, CHS and CHI under water stress
处理 黄酮 PAL CHS CHI 水涝 黄酮 1 PAL 0.143 1 CHS 0.830* 0.614 1 CHI 0.854* 0.413 0.950** 1 干旱 黄酮 1 PAL 0.256 1 CHS 0.846* 0.699 1 CHI 0.895* 0.625 0.980** 1 对照 黄酮 1 PAL 0.565 1 CHS −0.014 0.464 1 CHI 0.336 0.553 0.920** 1 说明:*表示显著相关(P<0.05);**表示极显著相关(P< 0.01) -
[1] 邱模昌, 周争道, 杨章坚. 三叶青总黄酮通过MAPK途径诱导乳腺癌细胞凋亡[J]. 中国临床药理学杂志, 2019, 35(23): 3059 − 3063. QIU Mochang, ZHOU Zhengdao, YANG Zhangjian. Total flavonoids from Tetrastigma hemsleyanum Diels et Gilg induce apoptosis of breast cancer cells through MAPK pathway [J]. Chin J Clin Pharmacol, 2019, 35(23): 3059 − 3063. [2] 卢爱芳, 祁明君, 李宗亮, 等. 三叶青愈伤组织培养及其总黄酮含量的研究[J]. 中药材, 2010, 33(7): 1042 − 1045. LU Aifang, QI Mingjun, LI Zongliang, et al. Callus cultivation and determination of flavonoids from Tetrastigma hemsleyanum [J]. Chin Med Mater, 2010, 33(7): 1042 − 1045. [3] 马方芳, 张善华, 甘林叶, 等. 遂昌县三叶青产业发展现状与发展对策[J]. 浙江农业科学, 2020, 61(2): 296 − 298. MA Fangfang, ZHANG Shanhua, GAN Linye, et al. Status and countermeasures of Tetrastigma hemsleyanum Diels et Gilg industry development in Suichang [J]. Zhejiang Agric Sci, 2020, 61(2): 296 − 298. [4] 蹇京蓉. 中药三叶青资源状况及其对策研究[J]. 中国药物经济学, 2012(2): 228 − 230. JIAN Jingrong. Research on the resource status and countermeasures of the traditional chinese medicine Sanyeqing [J]. Chin Pharm Econ, 2012(2): 228 − 230. [5] 倪川, 袁雪艳, 丁卉, 等. 不同栽培模式三叶青叶绿素荧光特征[J]. 江苏农业科学, 2019, 47(14): 161 − 164. NI Chuan, YUAN Xueyan, DING Hui, et al. Effect of different cultivation modes on chlorophyll fluorescence characteristics of Tetrastigma hemsleyanum [J]. Jiangsu Agric Sci, 2019, 47(14): 161 − 164. [6] 张润华, 赵昕刚, 马尔妮. 栓皮槠软木微观构造和化学成分的研究[J]. 林产工业, 2019, 46(1): 48 − 52. ZHANG Runhua, ZHAO Xingang, MA Erni. Study on microstructure and chemical composition of cork from Quercus suber [J]. China For Prod Ind, 2019, 46(1): 48 − 52. [7] 蔡娜, 淡荣, 陈鹏. 水分胁迫对苦荞幼苗黄酮类物质含量的影响[J]. 西北农业学报, 2008, 17(4): 91 − 93. CAI Na, DAN Rong, CHEN Peng. Effects of water stress on flavonoids content of tartary buckwheat seedlings[J]. Acta Agric Boreali-Occident Sin, 2008, 17(4): 91 − 93. [8] 李丹丹, 梁宗锁, 杨宗岐, 等. 外源-5氨基乙酰丙酸对干旱胁迫下紫花苜蓿生理特性及次生代谢物含量的影响[J]. 西北植物学报, 2019, 39(10): 1827 − 1834. LI Dandan, LIANG Zongsuo, YANG Zongqi, et al. Effect of exogenous 5-aminolevulinic acid on physiological characteristics and secondary metabolite contents of Alfalfa seedling under drought stress [J]. Acta Bot Boreali-Occident Sin, 2019, 39(10): 1827 − 1834. [9] 刘晓玲. 不同色系大叶榉类黄酮物质变化规律及对干旱胁迫的响应[D]. 长沙: 中南林业科技大学, 2019. LIU Xiaoling. Changes of Flavonoids in Zelkova schneiana of Different Autumn Leaf Colors and Their Response to Drought Stress[D]. Changsha: Central South University of Forestry and Technology, 2019. [10] 徐庆华, 杨进良, 黄练忠, 等. 次生常绿阔叶林群落冠结构对林下植被的影响[J]. 浙江农林大学学报, 2019, 36(6): 1151 − 1157. XU Qinghua, YANG Jinliang, HUANG Lianzhong, et al. Influence of canopy strcture on understory vegetation of secondary evergreen broadleaf forest communities [J]. J Zhejiang A&F Univ, 2019, 36(6): 1151 − 1157. [11] 孙健, 沈晓霞, 陈加红, 等. 药用植物三叶青种质多样性与栽培管理的研究进展[J]. 科技通报, 2018, 34(1): 13 − 17. SUN Jian, SHEN Xiaoxia, CHEN Jiahong, et al. Research progress on the germplasm diversity and cultivation management of the medicinal plant Trifolium repens [J]. Bull Sci Technol, 2018, 34(1): 13 − 17. [12] 钱丽华, 阮松林, 戴丹丽, 等. 温度对三叶青组培苗SOD、MDA等指标的影响[J]. 浙江农业科学, 2010, 51(5): 972 − 974. QIAN Lihua, RUAN Songlin, DAI Danli, et al. The influence of temperature on the SOD, MDA and other indicators of Tetrastigma hemsleyanum tissue culture seedlings [J]. Zhejiang Agric Sci, 2010, 51(5): 972 − 974. [13] 钱丽华, 毛碧增. 光温条件对三叶青愈伤生长及黄酮积累的影响[J]. 浙江农业科学, 2013, 54(9): 1098 − 1100. QIAN Lihua, MAO Bizeng. The effect of light and temperature conditions on the callus growth and flavonoid accumulation of Tetrastigma hemsleyanum [J]. Zhejiang Agric Sci, 2013, 54(9): 1098 − 1100. [14] 徐琳煜, 刘守赞, 白岩, 等. 不同光强处理对三叶青光合特性的影响[J]. 浙江农林大学学报, 2018, 35(3): 467 − 475. XU Linyu, LIU Shouzan, BAI Yan, et al. Effects of light intensity treatments on photosynthetic characteristics in Tetrastigma hemsleyanum [J]. J Zhejiang A&F Univ, 2018, 35(3): 467 − 475. [15] 胡晓甜, 刘守赞, 白岩, 等. 遮阴对浙江三叶青生理生化及总黄酮的影响[J]. 广西植物, 2019, 39(7): 925 − 932. HU Xiaotian, LIU Shouzan, BAI Yan, et al. Effects of different shading treatments on physiology, biochemistry and total flavonoids of Tetrastigma hemsleyanum in Zhejiang Province [J]. Guihaia, 2019, 39(7): 925 − 932. [16] 吴志庄, 高贵宾, 欧建德, 等. 生物炭肥对毛竹林下三叶青叶绿素含量、光合与荧光特性的影响[J]. 西北林学院学报, 2017, 32(5): 59 − 63. WU Zhizhuang, GAO Guibin, OU Jiande, et al. Effects of the application of biochar-based fertilizer on chlorophyll contents and photosynthesis & fluorescence characteristics of Tetrastigma hemsleyanum under moso bamboo forest [J]. J Northwest For Univ, 2017, 32(5): 59 − 63. [17] 周武, 张善华. 不同有机肥对药用植物三叶青化感物质的影响[J]. 丽水学院学报, 2017, 39(2): 66 − 71. ZHOU Wu, ZHANG Shanhua. The effect of different organic fertilizers on the secretion of allelochemicals of medicinal plant Tetrastigma hemsleyanum Diels et Gilg [J]. J Lishui Univ, 2017, 39(2): 66 − 71. [18] 郑军献, 胡轶娟, 梁卫青, 等. 紫外可见分光光度法测定三叶青中总黄酮的含量[J]. 中国中医药科技, 2009, 16(5): 386 − 387. ZHENG Junxian, HU Yijuan, LIANG Weiqing, et al. Determination of total flavonoids in Sanyeqing by ultraviolet-visible spectrophotometry [J]. China Tradit Chin Med Sci Technol, 2009, 16(5): 386 − 387. [19] 熊科辉, 吴学谦, 许海顺, 等. 不同干燥方法对三叶青活性成分含量的影响[J]. 中国药业, 2015(8): 48 − 50. XIONG Kehui, WU Xueqian, XU Haishun, et al. Influence of different drying methods on contents of active ingredients in Tetrastigma Hemsleyanum [J]. China Pharm, 2015(8): 48 − 50. [20] 徐琳煜. 光质对三叶青生长及黄酮类化合物合成的影响研究[D]. 杭州: 浙江农林大学, 2018. XU Linyu. Effect of Light Quality on the Growth and Synthesis of Flavonoids Synthesis of Tetrastigma hemsleyanum Diels et Gilg[D]. Hangzhou: Zhejiang A&F University, 2018. [21] 王顺才, 邹养军, 马锋旺. 干旱胁迫对3种苹果属植物叶片解剖结构、微形态特征及叶绿体超微结构的影响[J]. 干旱地区农业研究, 2014, 32(3): 15 − 23. WANG Shuncai, ZOU Yangjun, MA Fengwang. Influence of drought stress on leaf anatomical structure and micro-morphology traits and chloroplast ultrastructure of three Malus species [J]. Agric Res Arid Areas, 2014, 32(3): 15 − 23. [22] 杨凤军, 李天来, 臧忠婧, 等. 等渗NaCl、干旱胁迫对番茄幼苗光合特性及叶绿体超微结构的影响[J]. 应用生态学报, 2017, 28(8): 2588 − 2596. YANG Fengjun, LI Tianlai, ZANG Zhongjing, et al. Effects of isotonic NaCl and drought stress on photosynthetic characteristics and chloroplast ultrastructure of tomato seedlings [J]. Chin J Appl Ecol, 2017, 28(8): 2588 − 2596. [23] 朱素英. 不同条件下三七叶绿体超微结构的比较[J]. 西南农业学报, 2014, 27(6): 2554 − 2558. ZHU Suying. Comparative study on chloroplast ultrastructure of Panax notoginseng (Burk) F. H. Chen under different conditions [J]. Southwest China J Agric Sci, 2014, 27(6): 2554 − 2558. [24] 李冬林, 金雅琴, 崔梦凡, 等. 夏季遮光对连香树幼苗形态、光合作用及叶肉细胞超微结构的影响[J]. 浙江农林大学学报, 2020, 37(3): 103 − 112. LI Donglin, JIN Yaqin, CUI Mengfan, et al. Growth, photosynthesis and ultrastructure of mesophyll cells for Cercidiphyllum japonicum seedlings with shading in summer [J]. J Zhejiang A&F Univ, 2020, 37(3): 103 − 112. [25] 鲁守平, 隋新霞, 孙群, 等. 药用植物次生代谢的生物学作用及生态环境因子的影响[J]. 天然产物研究与开发, 2006, 18(6): 1027 − 1032. LU Shouping, SUI Xinxia, SUN Qun, et al. Biological functions of secondary metabolism of medicinal plants and influences of ecological environment [J]. Nat Prod Res Dev, 2006, 18(6): 1027 − 1032. [26] 孟书亦. SA和MeJA对黄芩愈伤组织黄酮类化合物含量及其合成酶的影响[D]. 长春: 吉林农业大学, 2017. MENG Shuyi. The Effect of SA and MeJA on the Content of Flavonoids and Synthase in the Callus of Scutellaria baicalensis Georgi[D]. Changchun: Jilin Agricultural University, 2017. [27] ZHU Zaibiao, LIANG Zongsuo, HAN Ruilian. Saikosaponin accumulation and antioxidative protection in drought-stressed Bupleurum chinense DC. plants [J]. Environ Exp Bot, 2009, 66(2): 326 − 333. [28] JANAS K M, CVIKROVÁ M, PAŁAGIEWICZ A, et al. Constitutive elevated accumulation of phenylpropanoids in soybean roots at low temperature [J]. Plant Sci, 2002, 163(2): 369 − 373. [29] LI Baozhu, FAN Ruonan, GUO Siyi, et al. The Arabidopsis MYB transcription factor, MYB111 modulates salt responses by regulating flavonoid biosynthesis[J]. Environ Exp Bot, 2019, 166(10): 103807. doi: 10.1016/j.envexpbot.2019.103807. [30] ALI Q, ALI S, LQBAL N, et al. Alpha-tocopherol fertigation confers growth physio-biochemical and qualitative yield enhancement in field grown water deficit wheat (Triticum aestivum L.)[J]. Sci Rep, 2019, 9(1): 12924. doi: 10.1038/s41598-019-49481-7. [31] BAYAT H, MOGHADAM A N. Drought effects on growth, water status, proline content and antioxidant system in three Salvia nemorosa L. cultivars [J]. Acta Physiol Plant, 2019, 41(9): 149 − 156. [32] ZHOU Y J, CHE Q M, XU S X, et al. Metabolites of baicalein in human urine [J]. Die Pharm, 2000, 55(8): 626 − 627. [33] YUN Y B, JUNG H G, RAHIM M A, et al. Molecular analysis of genes related to phenylpropanoid and ascorbate biosynthesis in salt and UV-B treated pak choi grown under LEDs [J]. Botany, 2019, 97(9): 513 − 519. [34] 郭肖, 孔德章, 曹玉洪, 等. 不同产地水芹黄酮含量及PAL酶活性的差异研究[J]. 长江蔬菜, 2014(2): 32 − 34. GUO Xiao, KONG Dezhang, CAO Yuhong, et al. Difference about flavonoid content and PAL activity of water dropwort from different areas [J]. Yangtze River Veg, 2014(2): 32 − 34. [35] LI F, JIN Z, QU W, et al. Cloning of a cDNA encoding the Saussurea medusa chalcone isomerase and its expression in transgenic tobacco [J]. Plant Physiol Biochem, 2006, 44(7/9): 455 − 461. [36] 汪贵斌, 郭旭琴, 常丽, 等. 温度和土壤水分对银杏叶黄酮类化合物积累的影响[J]. 应用生态学报, 2013, 24(11): 3077 − 3083. WANG Guibin, GUO Xuqin, CHANG Li, et al. Effects of air temperature and soil moisture on flavonoids accumulation in Ginkgo biloba leaves [J]. Chin J Appl Ecol, 2013, 24(11): 3077 − 3083. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200358






 下载:
下载: