-
闽楠Phoebe bournei是樟科Lauraceae楠属Phoebe常绿大乔木,广泛分布于中国长江以南地区[1]。闽楠木材纹理美观,气味清雅,是珍贵用材树种,具有很高的经济价值与生态价值,现已成为中国亚热带地区人工栽培面积最大的树种之一[2]。目前关于闽楠的研究多集中在育苗、栽培和生理特性方面[3]。闽楠染色体级别高质量全基因组测序已完成,这为开展基因功能研究提供了重要基础[4]。近期XU等[5]以未成熟胚胎为原始材料,成功建立了闽楠体细胞胚胎发生技术体系并进行遗传转化研究,最高转化率为11.24%。利用该体细胞胚转基因体系,张苗等[6]深入探究了PbWOX基因在闽楠体胚发育过程中的分子调控机制。此外,利用发根农杆菌Agrobacterium rhizogenes介导的闽楠毛状根转基因体系也已成功构建,为闽楠重要基因的功能验证以及分子辅助育种提供了技术支撑[7]。然而,闽楠现有转化体系效率低、育种周期长,优良性状难以稳定遗传等问题,严重阻碍了闽楠基因功能的快速解析及分子育种进程。
原生质体是除去细胞壁后由质膜包裹的裸露的植物细胞[8-9],作为细胞的基本单位,携全套遗传信息,具有全能性[10]。由于原生质体没有细胞壁,使得外源遗传物质容易通过理化方式进入原生质体。原生质体瞬时表达体系快速、高效,已被广泛应用于亚细胞定位、蛋白质互作、基因沉默等功能研究[11−13]。近年来许多非模式植物的原生质体瞬时表达体系已经成功建立,如杨树Populus × xiaohei[14]、茶树Camellia sinensis[15]、茉莉Jasminum sambac[16]及柑橘 Citrus grandis[17]等,原生质体已成为开展基因功能研究的有力工具。
为了使目标基因的表达产物正确折叠,修饰并精准定位于相应的亚细胞结构,选择同源植物细胞瞬时表达分析可增加研究的准确性。本研究以闽楠实生苗幼叶为原材料,分离得到原生质体,并采用聚乙二醇(PEG)介导的遗传转化方法,成功建立了原生质体瞬时表达体系,并通过目标蛋白的亚细胞定位分析进行了验证,可为将来闽楠基因的同源表达、功能分析及单细胞转录组测序等研究奠定基础。
-
6~8周的闽楠实生苗栽培于透气透水性高的河沙中,人工气候室培养条件为温度26 ℃/22 ℃ (昼/夜),光照16 h/黑暗8 h,光照强度为100 µmol·m−2·s−1。
-
所用质粒载体为pAN580-GFP,带有35S启动子及绿色荧光蛋白(green fluorescent protein, GFP)标记基因。质粒载体转化至大肠埃希菌Eschericha coli DH5α (上海唯地生物技术有限公司)菌株中。pAN580-PbTPSa25-GFP载体:参考闽楠基因组设计PbTPSa25克隆引物,以闽楠叶片cDNA为模板克隆并测序验证,利用同源重组试剂盒(南京诺唯赞生物科技股份有限公司)将PbTPSa25基因质粒构建在pAN580-GFP载体上并转入大肠埃希菌DH5α菌株。同源重组选择BamHI (NEB)进行酶切,上下游引物分别为:PbTPSa25F(AGGACCGGTCCCGGGGGATCCATGGCTCTTGTTTCTGGTTCTG),PbTPSa25R(GCCCTTGCTCACCATGGATCCAATTGGGATAGGATTAACAAGC)。pAN580-PbTPSa25-GFP质粒提取纯化后DNA质量浓度为2 g·L−1,−20 ℃保存备用。
-
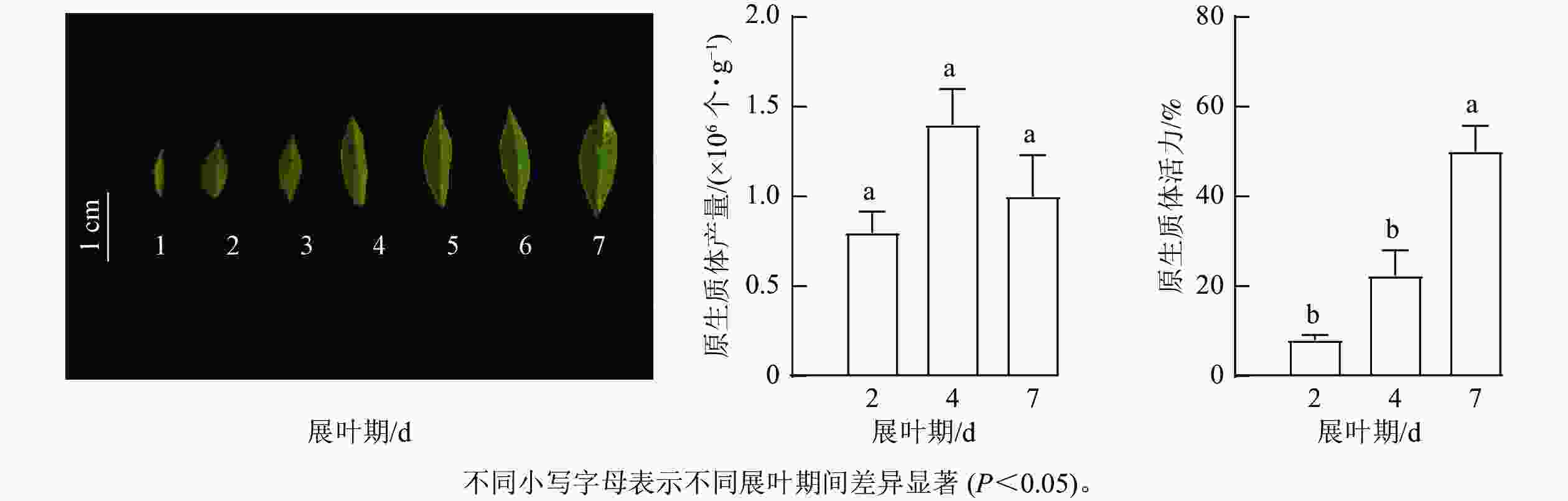
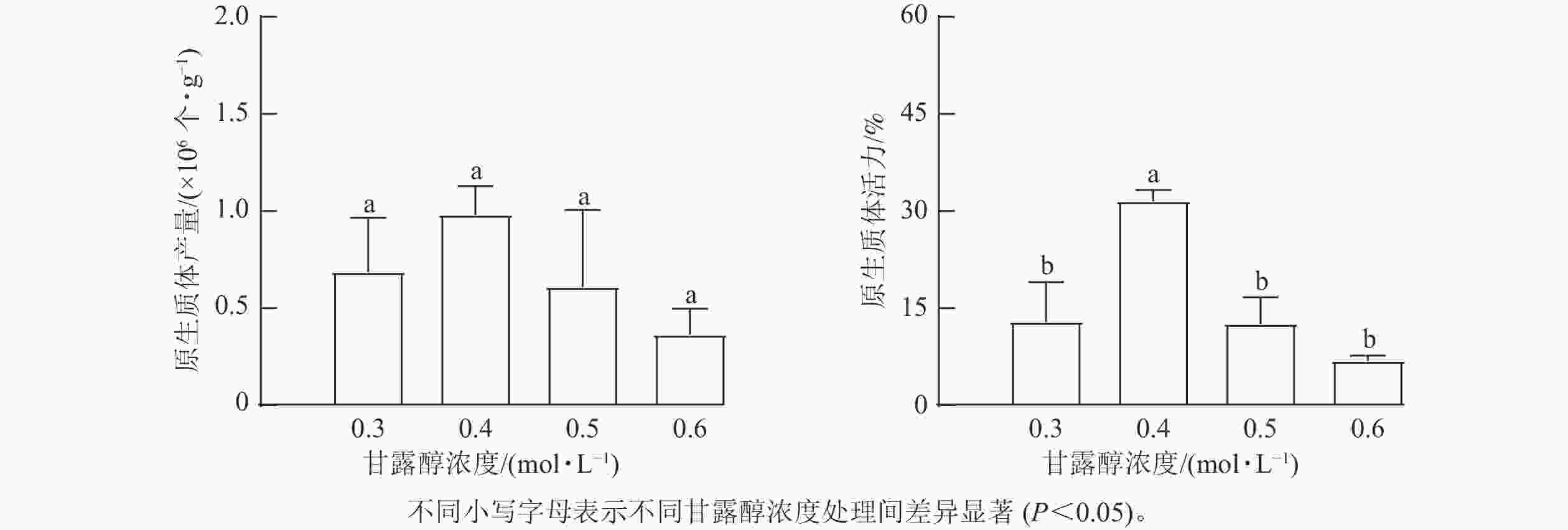
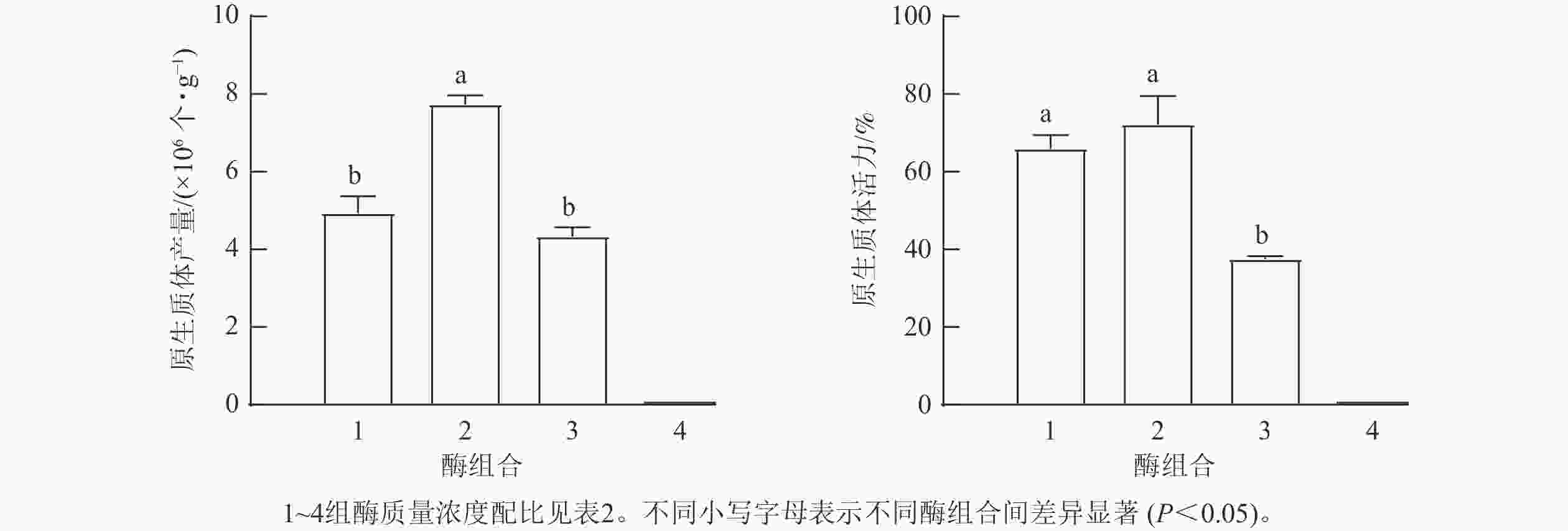
选用展叶期为1~7 d的叶片进行混合采样,开展闽楠叶片原生质体分离实验。针对影响原生质体分离的主要因素进行单因素筛选实验。①酶组合。根据新疆杨Populus alba var. pyramidalis[18]和茶树 [19]等木本植物叶片原生质体分离的最适酶质量浓度,设计了6种酶组合(表1)。②不同展叶期的叶片材料。将尚未展叶的叶片定义为展叶期1 d,本研究选择展叶期2、4、7 d的叶片为材料,利用E组酶解液进行原生质体分离实验。③渗透压。选择展叶期7 d的叶片,使用甘露醇溶液预处理浸泡叶片20 min,分别设置不同浓度甘露醇(0.3、0.4、0.5、0.6 mol·L−1),调节酶解液的渗透压,溶解E组酶组合后酶解3 h,进行优化实验。由于后续瞬时转化实验对大量且完整原生质体的需求,参考前人研究[20−21],在原有酶液配比体系的基础上进一步增加半纤维素酶、蜗牛酶和崩溃酶等4组酶组合(表2),使用展叶期7 d的叶片,探究更适合闽楠叶片的酶组合(表2)。先将不同的酶溶解于酶解缓冲液[0.3~0.6 mol·L−1甘露醇、20 mmol·L−1 KCl、20 mmol·L−1 2-吗啉乙磺酸( MES,pH 5.7)],55 ℃水浴10 min,冷却至室温后再加入10 mmol·L−1 CaCl2和质量分数为0.1%的牛血清白蛋白(bovine serum albumin, BSA)。在前期预实验分别对甘露醇预处理时间(0、20和40 min)和酶解时间(3、4和5 h)筛选出合适处理,将0.5 g闽楠叶片切成宽度小于1 mm的细丝,在0.4 mol·L−1甘露醇溶液中黑暗下预处理20 min,随后转移至10 mL酶液中,60 r·min−1摇床,25 ℃避光酶解3 h。
酶液组合 质量浓度/(mg·L−1) 纤维素酶R-1 离析酶R-1 果胶酶Y-23 A 15 4 4 B 15 4 6 C 20 4 4 D 20 4 6 E 25 4 4 F 25 4 6 Table 1. Enzyme concentrations
酶液
组合质量浓度/(mg·L−1) 纤维素酶
R-10纤维素酶
RS离析酶
R-10果胶酶
Y-23半纤维
素酶蜗牛
酶崩溃
酶1 15 10 10 4 0 0 0 2 15 10 10 4 10 0 0 3 15 10 10 4 0 5 0 4 15 10 10 4 0 0 5 Table 2. New enzyme concentrations
-
将酶解后混合液用40 μm细胞筛过滤,100 g离心10 min,弃上清液。加入预冷的等体积W5溶液[154 mmol·L−1 NaCl、125 mmol·L−1 CaCl2、5 mmol·L−1 MES (pH 5.7)、2 mmol·L−1 KCl、5 mmol·L−1无水葡萄糖]轻弹底部重悬,100 g离心10 min,弃上清液。加入200~500 μL预冷MMG溶液[0.4 mol·L−1甘露醇、4 mmol·L−1 MES (pH 5.7)、15 mmol·L−1 MgCl2]重悬。将离心管置于冰上30 min,并避光保存。
-
使用0.1 mm血球计数板统计原生质体数量,用质量浓度为0.01%二乙酸荧光素(FDA)测定原生质体活力。详细计数方法及计算公式参考前人研究[22]。
-
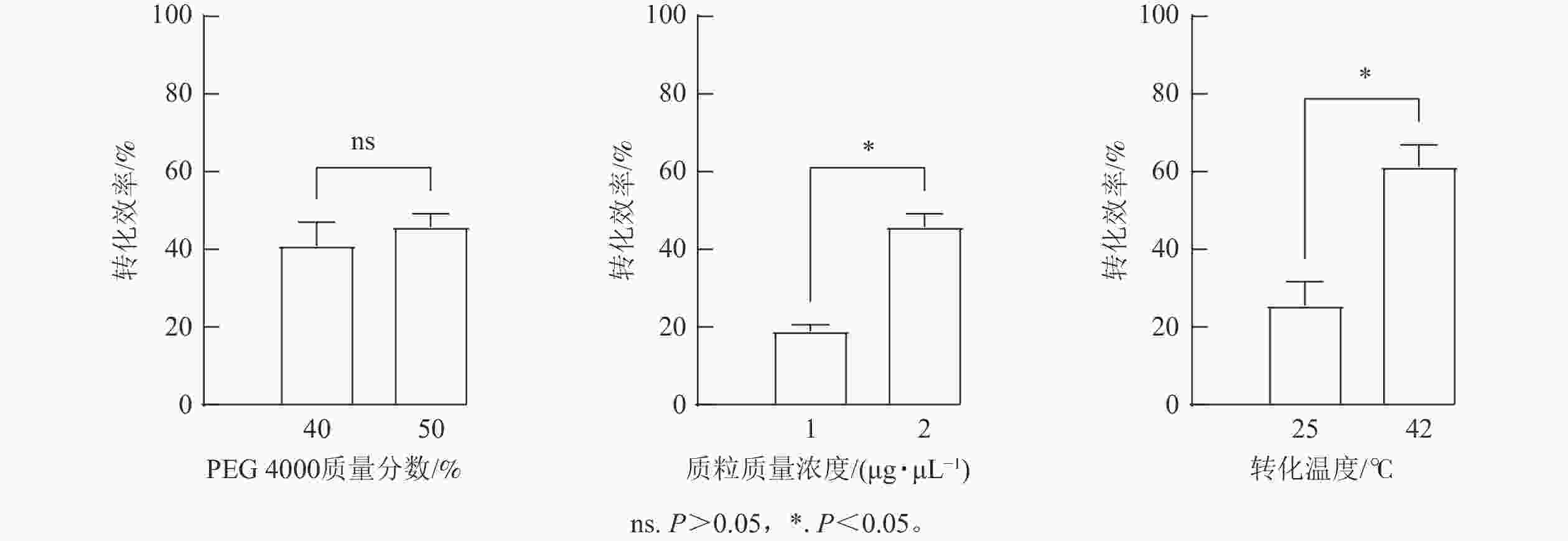
针对影响原生质体瞬时转化的主要因素,对PEG
4000 质量分数(40%、50%)、质粒质量浓度(1、2 μg·μL−1)和转化温度(25、42 ℃)等进行了比较。原生质体转化时,取100 μL高活性的原生质体悬液与10 μL质粒以及110 μL PEG4000 溶液[质量分数分别为40%和50% 的PEG4000 、0.2 mol·L−1甘露醇、100 mmol·L−1 MgCl2]充分混匀后置于黑暗下孵育15 min,加入440 μL W5溶液终止反应,100 g离心3 min弃上清。加入1 mL W5溶液,轻弹混匀,在室温黑暗下孵育16 h。原生质体转化率=发绿色荧光原生质体数目/同视野下原生质体总数×100%。每个重复的原生质体转化率均统计10个及以上视野的数据。利用建立的闽楠原生质体瞬时转化体系对编码萜类合酶蛋白的PbTPSa25基因的亚细胞定位,检测瞬时表达体系中外源基因是否转化成功。 -
从管底吸取10 μL原生质体溶液置于载玻片上,激光共聚焦显微镜(LSM880,Zeiss)观察目标蛋白表达情况。用于观察GFP信号的荧光激发光波长为488 nm,发射波长为505~535 nm;观察叶绿体自发荧光的激发光波长为633 nm,发射波长为647~685 nm。
-
用Office 2016对数据进行统计,用SPSS 27.0进行单因素方差分析(One-way ANOVA),用Tukey法进行多重比较,并用Graphpad Prism 9.0进行独立样本t检验和作图以及Adobe Illustrator 2018进行图表绘制。不同小写字母代表在P<0.05水平上差异显著,相同字母表示差异不显著。P>0.05标为ns,P<0.05标为*。
-
图1显示:原生质体产量随着纤维素酶浓度提高而上升,E组和F组的原生质体产量与其他组相比显著增加 (P<0.05),但两组之间的产量无显著差异。然而,D组的原生质体活力最高,达到30%,但该组的产量明显低于E、F组。因此综合考虑原生质体产量与活力两方面因素,选择E组(2.5%纤维素酶+0.4%离析酶+0.4%果胶酶)作为后续实验的酶解液配比。
-
由图2可见:不同展叶期叶片分离的原生质体产量无显著差异,但是其活力存在显著差异(P<0.05)。当叶片处于展叶期4 d时,原生质体产量最高,达1.4×106 个·g−1。随着叶片叶龄增加,原生质体活力随之增加,叶片展叶期为2 d时,原生质体活力仅为8%,但叶片展叶期为7 d时,原生质体活力最高,达50%。因此,选择展叶期为7 d的闽楠叶片最佳,能够分离出较高活力的原生质体。
-
原生质体产量与活力随着甘露醇浓度的增加呈先上升后下降趋势(图3)。不同甘露醇浓度下原生质体产量差异不显著,其中甘露醇浓度为0.4 mol·L−1时原生质体产量最高。此外,0.4 mol·L−1甘露醇浓度下原生质体活力最高,达32%,显著高于其他组(P<0.05)。因此,在闽楠叶片原生质体分离时,选择0.4 mol·L−1的甘露醇浓度配置酶解液最为适宜。
-
与其他3组酶组合相比,第2组酶解液的分离效果最佳,获得的原生质体产量和活力最高,分别达到7.7×106 个·g−1和72%(图4)。相较于之前E组酶解液,使用第2组酶解液分离的原生质体产量实现了一定程度的提升,同时原生质体活力提升2.4倍(图1)。而添加了崩溃酶的组合4酶解效果较差,且抑制原生质体细胞壁解离的作用。综上,第2组酶解液(15 mg·L−1纤维素酶R-10+10 mg·L−1纤维素酶RS+10 mg·L−1离析酶R-10+4 mg·L−1果胶酶Y-23+10 mg·L−1半纤维素酶)适合于闽楠叶片原生质体分离。
-
图5表明:质量分数为50%PEG
4000 的转化效率略高于40%PEG4000 ,但差异不显著。同时,使用质粒质量浓度为2 μg·μL−1的瞬时转化效率明显高于1 μg·μL−1的质粒质量浓度,可达46%。此外,还比较了使用室温(25 ℃)和热激法(42 ℃)下孵育15 min对闽楠叶片原生质体瞬时转化效果的影响,发现42 ℃转化效率可达60%,显著高于25 ℃室温孵育(P<0.05)。综上,闽楠叶片原生质体瞬时转化使用2 μg·μL−1的质粒和质量分数为50%的PEG4000 在42 ℃下热激15 min转化效率最佳。 -
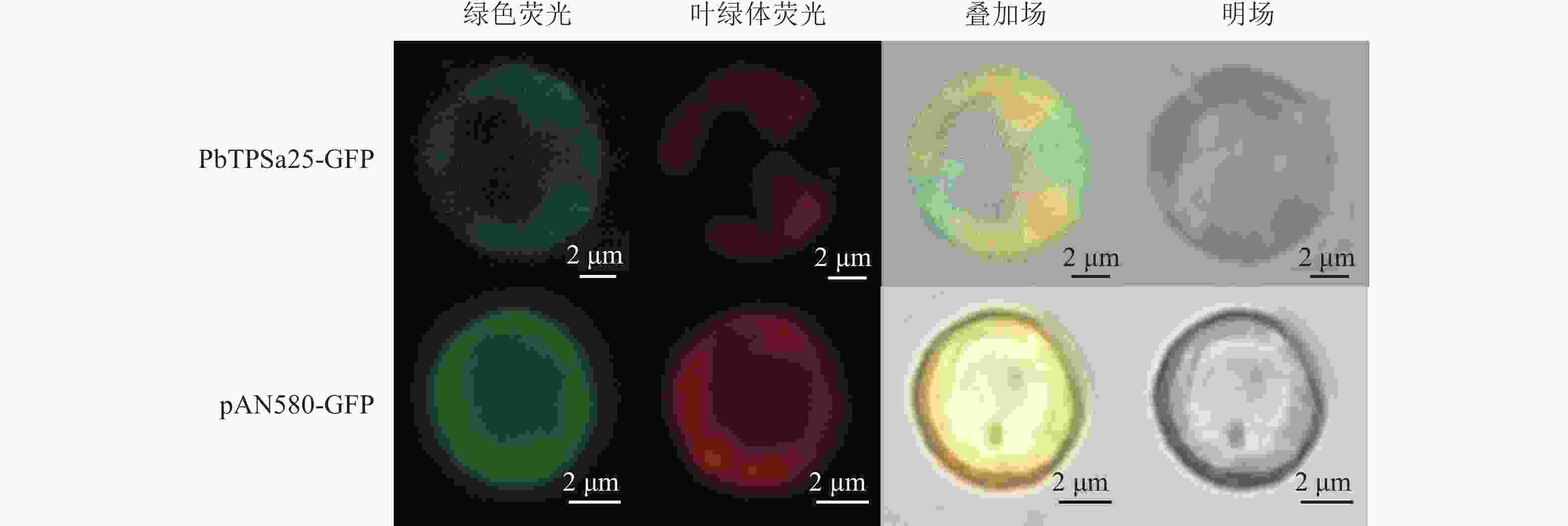
将重组载体PbTPSa25-GFP和空对照载体pAN580-GFP分别转化到闽楠原生质体中,16 h后,转染的闽楠原生质体细胞内可见绿色荧光(图6)。结果表明:pAN580-GFP的绿色荧光分布在整个原生质体细胞中。PbTPSa25-GFP融合蛋白的荧光信号仅部分与叶绿体自发荧光重叠,预示PbTPSa25蛋白主要定位于闽楠细胞质内。
-
原生质体转化技术广泛应用于亚细胞定位[23]、蛋白质互作[24]、基因功能和基因表达调控分析[25]等领域。此外,原生质体分离及培养技术在组培快繁、作物性状改良和作物育种中发挥重要作用[26]。如樟树Cinnamomum camphora已成功实现胚性愈伤组织的原生质体分离与再生植株[27]。然而同属于樟科的闽楠作为经济价值极高的国家二级珍稀渐危树种,其遗传转化研究长期以来因转基因技术的限制而进展缓慢。本研究建立并优化了闽楠叶片原生质体分离及瞬时表达体系,能够在短时间内实现目的基因在同源体系中的高效表达,避免使用异源瞬时转化体系可能引起的表达或定位紊乱,为闽楠基因工程研究提供了高效稳定的技术体系。然而,由于原生质体细胞壁再生植株的过程艰难,难以直接观察到其表型特征,因此,后续研究将继续深入探索。
叶片因易获取性及包含有叶绿体等多种细胞器而成为原生质体分离及瞬时转化的优选材料。杨树 [14]及油棕Elaeis guineensis [28]等木本植物仅需幼嫩叶片就能分离出高质量原生质体。但闽楠叶片为革质,表面覆盖较厚角质层和蜡质层,原生质体释放难度大。本研究结果表明:展叶期7 d的闽楠叶片能够有效提升原生质体分离质量。在酶液中加入适量的甘露醇,可确保原生质体的活性,其添加的浓度范围为0.3~1.0 mol·L−1 [19]。国槐Sophora japonica叶肉细胞的原生质体在甘露醇浓度为0.5 mol·L−1时表现最佳[29],新疆杨叶肉细胞的原生质体则在0.6 mol·L−1的甘露醇浓度下达到最优状态 [21]。相比之下,闽楠叶肉细胞的原生质体所需的甘露醇浓度较低,本研究结果表明,0.4 mol·L−1的甘露醇浓度最为适宜。
在分离植物原生质体时,酶的选择至关重要。常见方案采用纤维素酶和果胶酶,前者分解初生细胞壁中的纤维素和半纤维素,后者则针对胞间层的果胶。在分离新疆杨叶肉细胞原生质体过程中,除了纤维素酶和离析酶外,还添加了果胶酶及半纤维素酶[21]。闽楠和新疆杨叶肉细胞原生质体在分离时所需的最佳酶质量浓度相近。本研究结果显示:闽楠叶肉细胞原生质体分离的最佳酶组合质量浓度为:15 mg·L−1纤维素酶R-10+10 mg·L−1纤维素酶RS+10 mg·L−1离析酶R-10+4 mg·L−1果胶酶Y-23+10 mg·L−1半纤维素酶。适量增加酶解液质量浓度能够提高原生质体的产量,但是过高的酶质量浓度会降低原生质体活性。在闽楠原生质体分离过程中,半纤维素酶及果胶酶Y-23靶向协同作用于细胞壁中的半纤维素组分及胞间层的果胶物质,从而促进了这些高分子结构的有效分解,对实现原生质体的高效、高产量及高生物活性分离具有重要作用。
原生质体的转化效率受到质粒质量浓度、PEG质量分数及转化温度等多重因素的影响[30−31]。通常使用1 μg·μL−1的质粒进行瞬时转化,如拟南芥Arabidopsis thaliana、烟草Nicontiana benthamiana、大豆Glycine max[32]。然而,闽楠则表现出对更高质粒质量浓度的需求,本研究表明:使用2 μg·μL−1的质粒转化效率提升显著。此外,PEG质量分数也是影响原生质体转化的关键因素。在高粱Sorghum bicolor中使用30%的PEG 4000可获得最高原生质体融合率[33];而棉花Gossypium hirsutum则需要40%的PEG 4000 [34]。闽楠最适PEG 4000质量分数更高,需达50%。温度也是影响原生质体转化效率的重要因素。菊花Chrysanthemum morifolium花瓣原生质体经28 ℃热激处理60 s后有效促进了转化效率[35];柑橘叶片原生质体在47 ℃下热激7 min时转化效率最高[17]。本研究结果显示:闽楠在42 ℃条件下进行15 min热激处理,可高效地将外源质粒导入原生质体内。值得注意的是,尽管闽楠和柑橘的材料均为叶片,且转化温度相近,但闽楠的热激处理时间却高于柑橘和菊花。
-
针对闽楠叶片原生质体难释放的问题,本研究建立了高效分离高活力闽楠原生质体的体系,即先以0.4 mol·L−1甘露醇预处理展叶期7 d的闽楠叶片20 min,随后在15 mg·L−1纤维素酶R-10+10 mg·L−1纤维素酶RS+10 mg·L−1离析酶R-10+4 mg·L−1果胶酶Y-23+10 mg·L−1半纤维素酶的混合酶液中酶解3 h。在此基础上,通过PEG介导法,采用2 μg·μL−1质粒与质量分数为50%的PEG
4000 ,在42 ℃条件下进行15 min热激处理,可高效地将外源质粒导入原生质体内。本研究验证了PbTPSa25-GFP融合蛋白定位于细胞质中,建立了闽楠叶片原生质体瞬时转化体系,为深入探索闽楠的基因功能与种质创新提供技术支撑。
Establishment of protoplast isolation and transient expression system in Phoebe bournei leaves
doi: 10.11833/j.issn.2095-0756.20240584
- Received Date: 2024-10-22
- Accepted Date: 2025-02-26
- Rev Recd Date: 2025-02-20
- Available Online: 2025-05-30
- Publish Date: 2025-05-30
-
Key words:
- Phoebe bournei /
- protoplast /
- leaf /
- transient transformation /
- subcellular localization
Abstract:
| Citation: | YE Rumei, WANG Changtian, HAN Xiao, et al. Establishment of protoplast isolation and transient expression system in Phoebe bournei leaves[J]. Journal of Zhejiang A&F University, 2025, 42(3): 592−600 doi: 10.11833/j.issn.2095-0756.20240584 |











 DownLoad:
DownLoad:




