-
叶绿素是植物体中参与光合作用的重要色素,它能够捕捉光能转变成化学能用于植物生长和代谢过程。在植物生长发育过程中,其光合色素含量和叶绿素荧光参数均上升,光合效率增加。随叶片发育,板栗Castanea millissima[1]和紫丁香Syringa oblate[2]的叶绿素含量逐渐增加;在银杏Ginkgo biloba叶片展开过程中,叶绿素含量和净光合速率均增加[3];在绿豆Vigna radiata幼苗脱黄化初期,叶片叶绿素a和叶绿素b含量随光照时间增加而逐渐上升,而叶绿素a/b比值逐渐降低[4]。玉米Zea mays叶片展开过程中从叶基到叶尖光化学活性逐渐完善[5];杨树Populus叶片在春季发育过程中,光系统Ⅱ(PSⅡ)最大光化学效率、光能吸收、传递效率和反应中心数目均趋于稳定,且光系统也渐渐发育完善[6];与针叶相比,挪威云杉Picea abies营养芽的性能指标(PIABS)显著下降,PSⅡ最大光化学效率和光合效率也略有下降[7]。毛竹Phyllostachys edulis作为中国森林资源重要的组成部分,分布面积大,开发利用程度高,是集经济、生态和社会效益于一体的笋材两用竹种。目前,对毛竹的研究主要集中在毛竹林生态系统生物量及其碳通量的变化特征[8-9],毛竹叶片叶绿素含量的年动态变化[10],毛竹叶片的光合途径[11],毛竹发育过程中叶片的光合生理、茎秆的光合色素、光合酶活性的变化[12-13]等方面。但对毛竹快速生长期茎秆叶绿素荧光参数的研究较为匮乏。鉴于此,本研究以毛竹出笋后快速生长期高度为6 m的茎秆为研究对象,分析了毛竹生长发育过程中,不同节间的光合色素质量分数和叶绿素荧光参数的变化,为进一步研究毛竹快速生长机制提供理论依据。
-
试验地位于浙江省杭州市临安区(29°56′~30°27′N,118°51′~119°52′E)现代毛竹示范园内,毛竹林为纯林。该区属中亚热带季风气候,温暖湿润,四季分明。年平均气温15.8 ℃,7月气温最高,平均为28.1 ℃,1月气温最低,平均为3.4 ℃。极端最高气温为41.9 ℃,极端最低气温-13.3 ℃。年平均降水量为1 628.6 mm,年平均日照时数为1 939.0 h,无霜期为234.0 d,森林覆盖率达76.5%。毛竹林土壤属山地红壤,土层深度60 cm以上。每年3,7和11月施肥,来年从毛竹密度大的区域收获竹笋。
-
试验材料为2017年当年生毛竹笋竹,2017年4月末,选取生境条件一致,生长状况良好,株高6 m左右,基径约15 cm的自然状态下的毛竹笋竹,从茎秆地上部分的基部将其伐倒,将节间按照从基部至顶部的顺序编号,每间隔2个节间选取测定点,从基部至顶部依次选取编号为1,4,7,10,13,16,19,22的节间,测定时间为10:00-12:00。选取5株笋竹,每株作为1个独立实验,共5次重复。
-
称取0.5 g茎秆外层绿色组织,取样厚度为2 mm,将其迅速剪成碎块后放入具塞的试管中,加入体积分数为80%的丙酮5 mL,室温下遮光萃取48 h,至茎秆外层绿色组织完全变白,取上清液分别在波长为663,646和470 nm处测定其光密度值(D)。参照LICHTENTHALER[14]的公式分别计算光合色素的质量分数。
-
采用非调制式叶绿素荧光仪(YZQ-500,中国)进行快速叶绿素荧光诱导曲线的测定。测定前暗适应20 min,然后暴露在饱和脉冲光(3 000 μmol·m-2·s-1蓝光)下1 s,以10 μs(2 ms之前)和1 ms(2 ms之后)的间隔记录荧光信号,测得快速叶绿素荧光诱导动力学曲线(OJIP)。
-
依照STRASSER等[15-16]提出的能量流动模型,天线色素吸收的能量(ABS)其中一小部分主要以热能和荧光的形式耗散掉,大部分则被反应中心(RC)所捕获,在反应中心激发能被转化为还原能,将初级醌受体(QA)还原为QA-,QA-又可以被重新氧化,从而产生电子传递(ET)用于固定二氧化碳或其他途径,以此为基础发展起来的数据处理就被称为JIP-test。根据JIP-test[15-16]计算得到的部分参数见表 1。
表 1 快速叶绿素荧光诱导动力学曲线(OJIP)的参数
Table 1. Formulae and glossary of terms for the analysis of the fluorescence transient OJIP
参数缩写 描述 Fo 在暗适应后的最小荧光强度 Fp 在暗适应后的最大荧光强度 φpo 最大光化学效率 ψo 捕获激子将电子传递到电子传递链QA-下游其他电子受体的概率 φEo PSⅡ反应中心吸收光能用于电子传递的量子产额 φDo 用于热耗散的量子比率 ABS/CSo 单位面积吸收的光能 TRo/CSo 单位面积捕获的光能 ETo/CSo 单位面积电子传递的量子产额 DIo/CSo 单位面积的热耗散 ABS/RC 单位反应中心吸收的光能 TRo/RC 单位反应中心捕获的用于还原QA的能量 ETo/RC 单位反应中心捕获的用于电子传递的能量 DIo/RC 单位反应中心耗散掉的能量 RC/CSo 单位面积内反应中心的数量 PIABS 以吸收光能为基础的性能指数 -
所有数据均为5次重复的平均值±标准差,利用Origin 9.0统计分析和作图。采用one-way ANOVA,进行Turkey多重比较(P<0.05)。
-
从表 2可看出:随着毛竹茎秆节间升高,叶绿素a,叶绿素b和类胡萝卜素质量分数整体呈逐渐下降的趋势。在第1~7节中3种光合色素质量分数均基本保持不变;从第7节往上不断下降,第16节与第7节相比,叶绿素a,叶绿素b和类胡萝卜素质量分数分别降低了58.9%,67.4%和56.6%(P<00.05),叶绿素总量降低了61.0%(P<00.05);叶绿素a/b比值整体呈上升趋势,第22节比第7节比值升高了59.1%(P<00.05)。
表 2 毛竹茎秆不同节间光合色素质量分数的差异
Table 2. Differences of pigment contents in the Phyllostachys edulis stems of different internodes
节间 光合色素质量分数/(μg·g-1) 叶绿素a/b 叶绿素a 叶绿素b 总叶绿素 类胡萝卜素 1 15.19 ± 0.28 a 5.07 ± 0.04 a 20.26 ± 0.29 a 6.37 ± 0.27 a 3.00 ± 0.24 c 4 16.22 ± 0.27 a 5.27 ± 0.40 a 21.49 ± 0.39 a 7.00 ± 0.28 a 3.10 ± 0.27 c 7 15.80 ± 1.09 a 5.21 ± 0.20 a 21.01 ± 1.28 a 6.66 ± 0.48 a 3.03 ± 0.10 c 10 13.98 ± 0.42 b 3.91 ± 0.11 b 17.89 ± 0.53 b 6.27 ± 0.32 a 3.58 ± 0.02 c 13 10.01 ± 0.63 c 2.71 ± 0.03 c 12.22 ± 0.61 c 4.27 ± 0.19 b 3.69 ± 0.25 c 16 6.49 ± 0.29 d 1.70 ± 0.09 d 8.19 ± 0.23 d 2.89 ± 0.17 c 3.83 ± 0.35 bc 19 2.43 ± 0.07 e 0.53 ± 0.02 e 2.96 ± 0.09e 1.23 ± 0.09 d 4.59 ± 0.1 ab 22 1.83 ± 0.15 e 0.38 ± 0.03 e 2.22 ± 0.16e 0.97 ± 0.05 d 4.82 ± 0.55 a 说明:数值为平均值±标准差。同列不同字母表示差异显著(P<0.05),同列相同字母表示差异不显著(P>0.05) -
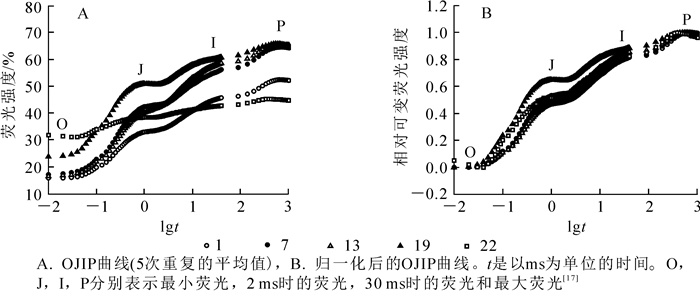
毛竹茎秆在暗适应后的最小荧光O点,PSⅡ处于“完全开放”状态。O点荧光强度随着茎秆节间的升高而上升(图 1A),且随着节间的升高上升越明显。P点表示PSⅡ反应中心完全关闭,不接受光量子,此时荧光产量最高。中下部节间的P点荧光强度变化不显著,从第22节开始下降(图 1A)。在O~P点变化过程中,还存在2个拐点(J点和I点)。J点和I点相对可变荧光强度均随节间升高而上升,从22节开始下降(图 1B)。由上可知,毛竹茎中下部的O相,J相和I相均高于上部,而P相变化不明显。
-
从表 3可以看出:从16节Fo逐渐上升,第16节比第10节上升了22.6%(P<00.05)。FP随着节间的升高而下降,第16节比第10节下降了6.7%(P<00.05)。RC/CSo呈先上升后下降的趋势,第16节比第10节上升了12.0%、第22节比第16节下降了44.7%(P<00.05)。1~13节PIABS变化不显著,从第16节往上逐渐下降,比第10节下降了81.9%(P<00.05)。
表 3 毛竹茎秆不同节间的叶绿素荧光参数
Table 3. Chlorophyll fluorescence parameters in the Phyllostachys edulis stems of different internodes
节间 Fo FP RC/CSo PIABS 1 15.83 ± 0.85 c 52.50 ± 1.00 c 4.40 ± 0.10 bc 0.69 ± 0.17 a 4 16.47 ± 0.75 c 60.97 ± 0.81 b 5.21 ± 0.57 ab 0.68 ± 0.20 a 7 17.43 ± 2.27 c 64.60 ± 1.15 ab 5.12 ± 0.16 ab 0.69 ± 0.20 a 10 17.67 ± 0.23 c 69.00 ± 2.15 a 5.07 ± 0.27 ab 0.72 ± 0.15 a 13 17.80 ± 0.72 c 65.90 ± 2.51 ab 5.86 ± 0.46 a 0.88 ± 0.16 a 16 21.67 ± 2.15 b 64.37 ± 0.95 ab 5.68 ± 0.24 ab 0.13 ± 0.03 b 19 24.10 ± 0.72 b 64.30 ± 1.51 b 4.71 ± 0.12 b 0.17 ± 0.04 b 22 31.40 ± 0.56 a 43.77 ± 3.81 d 3.14 ± 0.96 c 0.07 ± 0.04 b 说明:数值为平均值±标准差。同列不同字母表示差异显著(P<00.05),同列相同字母表示差异不显著(P>0.05) -
从表 4可以看出:1~13节φPo,φEo,ψo和φDo变化不显著,从16节φPo,φEo和ψo逐渐下降,分别比第13节下降了9.6%,36.1%和22.0%(P<00.05);φDo比13节上升了36.0%(P<00.05)。
表 4 毛竹茎秆不同节间量子产额的变化
Table 4. Changes of quantum yield in the Phyllostachys edulis stems of different internodes
节间 φPo φEo ψo φDo 1 0.70 ± 0.02 a 0.36 ± 0.03 a 0.51 ± 0.04 a 0.30 ± 0.02 bc 4 0.73 ± 0.01 a 0.32 ± 0.04 a 0.44 ± 0.05 a 0.27 ± 0.01 c 7 0.73 ± 0.03 a 0.33 ± 0.02 a 0.45 ± 0.03 a 0.27 ± 0.03 c 10 0.74 ± 0.01 a 0.34 ± 0.03 a 0.46 ± 0.04 a 0.26 ± 0.01 e 13 0.73 ± 0.02 a 0.36 ± 0.03 a 0.50 ± 0.05 a 0.25 ± 0.01 c 16 0.66 ± 0.03 a 0.23 ± 0.01 b 0.39 ± 0.01 b 0.34 ± 0.03 bc 19 0.63 ± 0.01 b 0.21 ± 0.03 b 0.34 ± 0.04 b 0.37 ± 0.01 b 22 0.28 ± 0.07 c 0.15 ± 0.01 c 0.26 ± 0.16 c 0.72 ± 0.07 a 说明:数值为平均值±标准差。同列不同字母表示差异显著(P<00.05),同列相同字母表示差异不显著(P>0.05) -
从表 5可以看出:ABS/CSo和DIo/CSo从第16节逐渐上升,分别比第13节上升了21.7%和52.1%(P<00.05)。TRo/CSo和ETo/CSo从第16节逐渐下降,分别比第13节降低了20.4%和18.4%(P<00.05)。
表 5 毛竹茎秆不同节间单位面积比活性的变化
Table 5. Changes of specific activity per internode area in the Phyllostachys edulis stems of different internodes
节间 ABS/CSo TRo/CSo ETo/CSo DIo/CSo 1 15.83 ± 0.85 c 11.05 ± 0.33 ab 5.63 ± 0.27 ab 4.79 ± 0.54 c 4 16.47 ± 0.75 c 12.01 ± 0.38 ab 5.26 ± 0.77 ab 4.45 ± 0.38 c 7 17.43 ± 2.27 c 12.96 ± 1.15 ab 5.75 ± 0.56 ab 4.75 ± 1.13 c 10 17.67 ± 0.23 c 13.14 ± 0.25 a 6.04 ± 0.64 ab 4.52 ± 0.06 c 13 17.80 ± 0.72 c 12.98 ± 0.24 a 6.42 ± 0.63 a 4.82 ± 0.54 c 16 21.67 ± 2.15 b 10.33 ± 0.31 c 5.24 ± 0.04 ab 7.33 ± 1.42 bc 19 24.10 ± 0.72 b 10.07 ± 0.05 c 5.01 ± 0.05 b 9.03 ± 0.40 b 22 31.40 ± 0.56 a 8.75 ± 1.98 d 4.73 ± 0.43 b 22.65 ± 2.52 a 说明(数值为平均值±标准差。同列不同字母表示差异显著(P < 0.05),同列相同字母表示差异不显著(P>0.05) -
从表 6可以看出:ABS/RC和DIo/RC从第16节逐渐上升,分别比第10节上升了9.2%和44.9%(P<00.05)。随着节间的升高,ETo/RC和TRo/RC变化不显著。
表 6 毛竹茎秆不同节间反应中心比活性的变化
Table 6. Change of specific activity of reflecting center in the Phyllostachys edulis stems of different internodes
节间 ABS/RC TRo/RC ETo/RC DIo/RC 1 3.60 ± 0.16 bc 2.51 ± 0.08 a 1.28 ± 0.07 a 1.09 ± 0.11 bc 4 3.18 ± 0.23 c 2.32 ± 0.19 a 1.01 ± 0.04 a 0.86 ± 0.06 c 7 3.40 ± 0.35 bc 2.48 ± 0.16 a 1.12 ± 0.10 a 0.92 ± 0.20 c 10 3.49 ± 0.14 bc 2.60 ± 0.10 a 1.19 ± 0.07 a 0.89 ± 0.05 c 13 3.04 ± 0.16 c 2.22 ± 0.16 a 1.09 ± 0.05 a 0.82 ± 0.04 c 16 3.81 ± 0.21 bc 2.52 ± 0.03 a 0.48 ± 0.03 a 1.29 ± 0.19 bc 19 5.11 ± 0.13 b 3.20 ± 0.04 a 1.08 ± 0.12 a 1.92 ± 0.09 b 22 8.72 ± 1.84 a 2.52 ± 1.03 a 1.32 ± 0.33 a 6.20 ± 0.81 a 说明(数值为平均值±标准差。同列不同字母表示差异显著(P < 0.05),同列相同字母表示差异不显著(P>0.05) -
叶绿素含量的变化对植物光合作用具有一定影响,可作为植物表现光合生理状态的良好指示剂[18]。在毛竹出笋后的快速生长期,不同部位叶绿素a,叶绿素b,类胡萝卜素和总叶绿素质量分数均增加,60 d时最高[19]。随着毛竹年龄的增加,茎秆和叶片中的叶绿素a,叶绿素b和类胡萝卜素质量分数均增加[20]。本研究中,毛竹茎秆中部及下部发育较为成熟,其表面包被的笋箨已逐渐脱落,茎秆外层由下至上接受的光照面积和光照时间逐渐减少,进而导致茎秆皮层绿色组织中光合色素质量分数逐渐减小,叶绿素a/b逐渐增加(表 2)。在毛竹快速生长期,茎秆中下部较高的叶绿素质量分数及其较强的吸收光能和同化二氧化碳能力可能是维持毛竹笋竹快速生长的原因之一。
植物光合原初反应和叶绿素荧光存在着密切的关系,快速叶绿素荧光诱导动力学曲线(OJIP)能够提供关于PSⅡ供体侧、受体侧及PSⅡ反应中心电子氧化还原状态等光化学信息[21-22]。在毛竹快速生长期,上部节间的ψO和φPo均减小,故而φEo下降,且归一化处理后上部节间的J相和I相荧光强度仍下降,表明上部节间PSⅡ反应中心吸收的光能用于电子传递较少,受体侧的传递电子能力较弱,电子在PSⅡ反应中心受体侧QA-处大量积累,QA到QB的电子传递链过程受到了抑制[23],同时其QA和QB被还原的能力相对较弱。PIABS性能指数可以准确地反映植物光合机构的整体状态[5]。上部节间ABS/RC较高,TRo/RC和ETo/RC变化不明显(表 6),同样表明上部节间单位反应中心所吸收的能量并没有更多地用于还原QA和电子传递。PIABS和φPo整体均减小,但PIABS的变化幅度比φPo大,表明这与PSⅡ有活性反应中心的数目和在PSⅡ和PSⅠ之间的传递电子数量有着极大关系。
快速叶绿素荧光诱导动力学曲线(OJIP)还可反映植物光合器官对光能的吸收、转化和耗散等状况[17]。OJIP曲线上的O点(Fo)可理解为植物PSⅠ的活性[24],毛竹茎秆上部节间的ABS/CSo和Fo均高于中下部,表明上部单位面积吸收的光能更多地分配给了PSⅠ,使PSⅠ活性增强,而PSⅡ获得的激发能较少。上部的TRo/CSo和ETo/CSo低于中下部,表明上部节间单位面积吸收的光能较多,但单位面积光合利用率较低,PSⅡ反应中心活性和光合能力也相对较弱。上部节间FP低于中下部,表明上部节间有活性的反应中心数量较少,这与RC/CSO的变化相一致。中下部节间RC/CSo和φPo均高于上部,表明中下部PSⅡ反映中心活性较强,色素所吸收和捕获的能量用于光化学部分的比例较高,优先推动了PSⅡ电子传递(ETo/RC)[25],通过光化学反应转化成与光合作用有关的化学能,有效地发挥了光合机构的功能,提高了茎秆中PSⅡ反应中心内原初的转化效率,这与温星等[12]对毛竹叶片的研究结果一致。在光合机构捕获光能发生电子传递的同时,其中一部分以热能和荧光的形式耗散掉,而光能利用和耗散方式之间存在着相互竞争的关系[26]。上部节间φDo,DIo/CSo和DIo/RC均比中、下部高,这是因为茎秆发育过程中,上部节间的光合系统还未发育成熟,实际用于光合作用的能量较少,PSⅡ和PSⅠ之间电子传递较慢,光合效率较低,通过耗散更多的能量来维持整个能量的合理分配,避免过剩的激发能对光合系统的破坏,这与孙山等[1]对板栗的研究结果一致。
综上所述,在毛竹快速生长期,茎秆不同节间的叶绿素荧光参数存在明显差异,中下部PSⅡ的结构已经基本发育完整,此时PSⅡ反应中心活性较强,电子传递速率较快,能量耗散较少,光能利用效率较高,生长较快;上部节间则与中下部相反,生长比较缓慢。研究成果对明确毛竹快速生长机制具有参考价值。
Changes of chlorophyll fluorescence in different internodes during Phyllostachys edulis stem development
-
摘要: 为了揭示毛竹Phyllostachys edulis快速生长期茎秆不同节间叶绿素荧光特征,以毛竹笋竹茎秆为材料,用YZQ-500型非调制式叶绿素荧光仪和JIP-test数据分析方法,研究了茎秆不同节间光合色素质量分数和叶绿素荧光参数的变化特征。结果显示:随着节间的升高,毛竹笋竹茎秆中叶绿素a,叶绿素b和类胡萝卜素质量分数显著下降(P < 0.05);单位面积捕获的光能(TRo/CSo),单位面积电子传递的量子产额(ETo/CSo),PSⅡ反应中心吸收光能用于电子传递的量子产额(φEo),PSⅡ最大光化学效率(φPo),光合性能指数(PIABS)和反应中心数量(RC/CSo)显著下降(P < 0.05);用于热耗散的量子比率(φDo),单位面积热耗散(DIo/CSo)和单位反应中心耗散掉的能量(DIo/RC)显著上升(P < 0.05),表明茎秆上下部节间的生长发育存在明显差异,中下部节间PSⅡ反应中心活性较强,光能转换效率较高,能量耗散较少,生长较快;上部节间光合功能相对较弱,生长比较缓慢。研究成果对明确毛竹快速生长机制具有参考价值。Abstract: To reveal the chlorophyll fluorescence characteristics of different internodes in the rapid growth period of Phyllostachys edulis, P. edulis shoots and stems were used as materials. The changes of the photosynthetic pigment content and chlorophyll fluorescence parameters for different internodes were studied by using a non-modulated chlorophyll fluorescence (YZQ-500) and the JIP-test data analysis method. Results showed that the content of chlorophyll a, chlorophyll b, and carotenoid in P. edulis stems significantly decreased (P < 0.05) with an increase of internodes. Light energy captured per unit area (TRo/CSo), quantum yield of electron transport per unit area (ETo/CSo), quantum yield of PS Ⅱ reaction center absorbing light energy for electron transfer (φEo), photosynthetic performance index (PIABS), and number of reaction centers (RC/CSo) significantly decreased (P < 0.05). Quantum for heat dissipation ratio (φDo), heat dissipation per unit area (DIo/CSo), and unit reaction center of wasted energy (DIo/RC) significantly decreased (P < 0.05). Since growth and development of the top and bottom internodes of P. edulis revealed activity in the middle and lower internodes having a stronger PS Ⅱ reaction center, a higher light energy conversion efficiency, and less energy dissipation enabling faster growth rates, and since photosynthetic functions of upper internodes were relatively weak meaning growth was slower, this study could be used as a reference value for clarifying the growth mechanism of P. edulis.
-
Key words:
- botany /
- Phyllostachys edulis /
- stem /
- internode /
- chlorophyll /
- chlorophyll fluorescence
-
表 1 快速叶绿素荧光诱导动力学曲线(OJIP)的参数
Table 1. Formulae and glossary of terms for the analysis of the fluorescence transient OJIP
参数缩写 描述 Fo 在暗适应后的最小荧光强度 Fp 在暗适应后的最大荧光强度 φpo 最大光化学效率 ψo 捕获激子将电子传递到电子传递链QA-下游其他电子受体的概率 φEo PSⅡ反应中心吸收光能用于电子传递的量子产额 φDo 用于热耗散的量子比率 ABS/CSo 单位面积吸收的光能 TRo/CSo 单位面积捕获的光能 ETo/CSo 单位面积电子传递的量子产额 DIo/CSo 单位面积的热耗散 ABS/RC 单位反应中心吸收的光能 TRo/RC 单位反应中心捕获的用于还原QA的能量 ETo/RC 单位反应中心捕获的用于电子传递的能量 DIo/RC 单位反应中心耗散掉的能量 RC/CSo 单位面积内反应中心的数量 PIABS 以吸收光能为基础的性能指数 表 2 毛竹茎秆不同节间光合色素质量分数的差异
Table 2. Differences of pigment contents in the Phyllostachys edulis stems of different internodes
节间 光合色素质量分数/(μg·g-1) 叶绿素a/b 叶绿素a 叶绿素b 总叶绿素 类胡萝卜素 1 15.19 ± 0.28 a 5.07 ± 0.04 a 20.26 ± 0.29 a 6.37 ± 0.27 a 3.00 ± 0.24 c 4 16.22 ± 0.27 a 5.27 ± 0.40 a 21.49 ± 0.39 a 7.00 ± 0.28 a 3.10 ± 0.27 c 7 15.80 ± 1.09 a 5.21 ± 0.20 a 21.01 ± 1.28 a 6.66 ± 0.48 a 3.03 ± 0.10 c 10 13.98 ± 0.42 b 3.91 ± 0.11 b 17.89 ± 0.53 b 6.27 ± 0.32 a 3.58 ± 0.02 c 13 10.01 ± 0.63 c 2.71 ± 0.03 c 12.22 ± 0.61 c 4.27 ± 0.19 b 3.69 ± 0.25 c 16 6.49 ± 0.29 d 1.70 ± 0.09 d 8.19 ± 0.23 d 2.89 ± 0.17 c 3.83 ± 0.35 bc 19 2.43 ± 0.07 e 0.53 ± 0.02 e 2.96 ± 0.09e 1.23 ± 0.09 d 4.59 ± 0.1 ab 22 1.83 ± 0.15 e 0.38 ± 0.03 e 2.22 ± 0.16e 0.97 ± 0.05 d 4.82 ± 0.55 a 说明:数值为平均值±标准差。同列不同字母表示差异显著(P<0.05),同列相同字母表示差异不显著(P>0.05) 表 3 毛竹茎秆不同节间的叶绿素荧光参数
Table 3. Chlorophyll fluorescence parameters in the Phyllostachys edulis stems of different internodes
节间 Fo FP RC/CSo PIABS 1 15.83 ± 0.85 c 52.50 ± 1.00 c 4.40 ± 0.10 bc 0.69 ± 0.17 a 4 16.47 ± 0.75 c 60.97 ± 0.81 b 5.21 ± 0.57 ab 0.68 ± 0.20 a 7 17.43 ± 2.27 c 64.60 ± 1.15 ab 5.12 ± 0.16 ab 0.69 ± 0.20 a 10 17.67 ± 0.23 c 69.00 ± 2.15 a 5.07 ± 0.27 ab 0.72 ± 0.15 a 13 17.80 ± 0.72 c 65.90 ± 2.51 ab 5.86 ± 0.46 a 0.88 ± 0.16 a 16 21.67 ± 2.15 b 64.37 ± 0.95 ab 5.68 ± 0.24 ab 0.13 ± 0.03 b 19 24.10 ± 0.72 b 64.30 ± 1.51 b 4.71 ± 0.12 b 0.17 ± 0.04 b 22 31.40 ± 0.56 a 43.77 ± 3.81 d 3.14 ± 0.96 c 0.07 ± 0.04 b 说明:数值为平均值±标准差。同列不同字母表示差异显著(P<00.05),同列相同字母表示差异不显著(P>0.05) 表 4 毛竹茎秆不同节间量子产额的变化
Table 4. Changes of quantum yield in the Phyllostachys edulis stems of different internodes
节间 φPo φEo ψo φDo 1 0.70 ± 0.02 a 0.36 ± 0.03 a 0.51 ± 0.04 a 0.30 ± 0.02 bc 4 0.73 ± 0.01 a 0.32 ± 0.04 a 0.44 ± 0.05 a 0.27 ± 0.01 c 7 0.73 ± 0.03 a 0.33 ± 0.02 a 0.45 ± 0.03 a 0.27 ± 0.03 c 10 0.74 ± 0.01 a 0.34 ± 0.03 a 0.46 ± 0.04 a 0.26 ± 0.01 e 13 0.73 ± 0.02 a 0.36 ± 0.03 a 0.50 ± 0.05 a 0.25 ± 0.01 c 16 0.66 ± 0.03 a 0.23 ± 0.01 b 0.39 ± 0.01 b 0.34 ± 0.03 bc 19 0.63 ± 0.01 b 0.21 ± 0.03 b 0.34 ± 0.04 b 0.37 ± 0.01 b 22 0.28 ± 0.07 c 0.15 ± 0.01 c 0.26 ± 0.16 c 0.72 ± 0.07 a 说明:数值为平均值±标准差。同列不同字母表示差异显著(P<00.05),同列相同字母表示差异不显著(P>0.05) 表 5 毛竹茎秆不同节间单位面积比活性的变化
Table 5. Changes of specific activity per internode area in the Phyllostachys edulis stems of different internodes
节间 ABS/CSo TRo/CSo ETo/CSo DIo/CSo 1 15.83 ± 0.85 c 11.05 ± 0.33 ab 5.63 ± 0.27 ab 4.79 ± 0.54 c 4 16.47 ± 0.75 c 12.01 ± 0.38 ab 5.26 ± 0.77 ab 4.45 ± 0.38 c 7 17.43 ± 2.27 c 12.96 ± 1.15 ab 5.75 ± 0.56 ab 4.75 ± 1.13 c 10 17.67 ± 0.23 c 13.14 ± 0.25 a 6.04 ± 0.64 ab 4.52 ± 0.06 c 13 17.80 ± 0.72 c 12.98 ± 0.24 a 6.42 ± 0.63 a 4.82 ± 0.54 c 16 21.67 ± 2.15 b 10.33 ± 0.31 c 5.24 ± 0.04 ab 7.33 ± 1.42 bc 19 24.10 ± 0.72 b 10.07 ± 0.05 c 5.01 ± 0.05 b 9.03 ± 0.40 b 22 31.40 ± 0.56 a 8.75 ± 1.98 d 4.73 ± 0.43 b 22.65 ± 2.52 a 说明(数值为平均值±标准差。同列不同字母表示差异显著(P < 0.05),同列相同字母表示差异不显著(P>0.05) 表 6 毛竹茎秆不同节间反应中心比活性的变化
Table 6. Change of specific activity of reflecting center in the Phyllostachys edulis stems of different internodes
节间 ABS/RC TRo/RC ETo/RC DIo/RC 1 3.60 ± 0.16 bc 2.51 ± 0.08 a 1.28 ± 0.07 a 1.09 ± 0.11 bc 4 3.18 ± 0.23 c 2.32 ± 0.19 a 1.01 ± 0.04 a 0.86 ± 0.06 c 7 3.40 ± 0.35 bc 2.48 ± 0.16 a 1.12 ± 0.10 a 0.92 ± 0.20 c 10 3.49 ± 0.14 bc 2.60 ± 0.10 a 1.19 ± 0.07 a 0.89 ± 0.05 c 13 3.04 ± 0.16 c 2.22 ± 0.16 a 1.09 ± 0.05 a 0.82 ± 0.04 c 16 3.81 ± 0.21 bc 2.52 ± 0.03 a 0.48 ± 0.03 a 1.29 ± 0.19 bc 19 5.11 ± 0.13 b 3.20 ± 0.04 a 1.08 ± 0.12 a 1.92 ± 0.09 b 22 8.72 ± 1.84 a 2.52 ± 1.03 a 1.32 ± 0.33 a 6.20 ± 0.81 a 说明(数值为平均值±标准差。同列不同字母表示差异显著(P < 0.05),同列相同字母表示差异不显著(P>0.05) -
[1] 孙山, 张立涛, 杨兴华, 等.板栗幼叶展叶过程的反射光谱和叶绿素荧光动力学[J].林业科学, 2009, 45(4):162-166. SUN Shan, ZHANG Litao, YANG Xinghua, et al. Spectral reflectance and chlorophyll fluorescemce kinetics of young leaves at the various stages of leaf expansion in field-grown chestnut plants[J]. Sci Silv Sin, 2009, 45(4):162-166. [2] 田野, 张会慧, 张秀丽, 等.紫丁香叶片发育过程中花色素苷含量与叶绿素荧光和激发能分配的关系[J].南京林业大学学报(自然科学版), 2014, 38(1):59-64. TIAN Ye, ZHANG Huihui, ZHANG Xiuli, et al. The relationship between leaf anthocyanin content and chlorophyll fluorescence as well as excited energy distribution during leaf expansion of Syringa oblate Lindl.[J]. J Nanjing For Univ Nat Sci Ed, 2014, 38(1):59-64. [3] 杨贤松.银杏叶片生长和衰老过程中叶绿体光合能力的变化及其叶绿素荧光动力学研究[D].南京: 南京师范大学, 2010. YANG Xiansong. Changes of Chloroplast Photosynthetic Capacity and Chlorophyll Fluorescence Kinetics During Growth and Senescence of Ginkgo biloba Leaves[D]. Nanjing: Nanjing Normal University, 2010. [4] 张汝民.绿豆幼苗脱黄化初期质体发育生理生化机制的研究[D].北京: 北京林业大学, 2005. ZHANG Rumin. Study on Physiological and Biochemical Mechanism of Plastids During Early Stage of Seedling Deetiolation of Phaseolus radiates L.[D]. Beijing: Beijing Forestry University, 2005. [5] 朱延姝, 于丽姣, 樊金娟, 等.玉米幼苗叶片叶绿素荧光参数变化规律研究[J].河南农业科学, 2011, 40(6):36-38. ZHU Yanshu, YU Lijiao, FAN Jinjuan, et al. Characteristics of chlorophyll fluorescence parameters of leaves during leaf elongation of maize seedling[J]. J Henan Agric Sci, 2011, 40(6):36-38. [6] 宋玉光, 马宗琪, 董蔚, 等.春季杨树叶片发育过程的研究[J].林业科技, 2016, 41(3):20-23. SONG Yuguang, MA Zongqi, DONG Wei, et al. Study on the development process of Populus tomentosa leaf in spring[J]. For Sci Technol, 2016, 41(3):20-23. [7] KATANI Z, ATIC L, FERHATOVIC D, et al. PSⅡ photochemistry in vegetative buds and needles of norway spruce (Picea abies L. Karst.) probed by OJIP chlorophyll a fluorescence measurement[J]. Acta Biol Hung, 2012, 63(2):218-230. [8] 周国模, 刘恩斌, 施拥军, 等.基于最小尺度的浙江省毛竹生物量精确估算[J].林业科学, 2011, 47(1):1-5. ZHOU Guomo, LIU Enbin, SHI Yongjun, et al. Accurate estimation for Phyllostachys edulis biomass in Zhejiang Province based on the lowest scale technique[J]. Sci Silv Sin, 2011, 47(1):1-5. [9] 徐超, 温国胜, 王海湘, 等.毛竹快速生长期的高生长与碳通量的变化规律[J].东北林业大学学报, 2016, 44(11):1-4. XU Chao, WEN Guosheng, WANG Haixiang, et al. Change rule of carbon flux and shoots high growth of Phyllostachys edulis during its fastgrowth stage[J]. J Northeast For Univ, 2016, 44(11):1-4. [10] 施建敏, 郭起荣, 杨光耀.毛竹光合动态研究[J].林业科学研究, 2005, 18(5):551-555. SHI Jianmin, GUO Qirong, YANG Guangyao. Study on the photosynthetic dynamic variation of Phyllostachys edulis[J]. For Res, 2005, 18(5):551-555. [11] 杨丽, 娄永峰, 彭镇华, 等.毛竹、麻竹光合途径类型分析[J].南京林业大学学报(自然科学版), 2015, 39(5):169-173. YANG Li, LOU Yongfeng, PENG Zhenhua, et al. A preliminary study on the type of photosynthetic pathway in Phyllostachys edulis and Dendrocalamus latiflorus[J]. J Nanjing For Univ Nat Sci Ed, 2015, 39(5):169-173. [12] 温星, 程路芸, 李丹丹, 等.毛竹叶片发育过程中光合生理特性的变化特征[J].浙江农林大学学报, 2017, 34(3):437-442. WEN Xing, CHENG Luyun, LI Dandan, et al. Photosynthetic characteristics in the development process of Phyllostachys edulis[J]. J Zhejiang A&F Univ, 2017, 34(3):437-442. [13] 王星星, 刘琳, 张洁, 等.毛竹出笋后快速生长期内茎秆中光合色素和光合酶活性的变化[J].植物生态学报, 2012, 36(5):456-462. WANG Xingxing, LIU Lin, ZHANG Jie, et al. Photosynthetic characteristics in the development process of Phyllostachys edulis[J]. Chin J Plant Ecol, 2012, 36(5):456-462. [14] LICHTENTHALER H K. Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J]. Methods Enzymol, 1987, 148(1):350-382. [15] STRASSERF R J, SRIVASTAVA A. Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J]. Photochem Photobiol, 1995, 61(1):32-42. [16] STRASSER R J, SRIVASTAVA A, TSIMILLI-MICHAEL M. The fluorescence transient as a tool to characterize and screen photosynthetic samples[C]//YUNUS M, PATHRE U, MOHANTY P, et al. Probing Photosynthesis: Mechanism, Regulation and Adaptation. London: Taylor and Francis Press, 2000: 445-483. [17] 李鹏民, 高辉远, STRASSER R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报, 2005, 31(6):559-566. LI Pengmin, GAO Huiyuan, STRASSER R J. Application of the chlorophyll fluorescence induction dynamics in photosynthesis study[J]. J Plant Physiol Mol Biol, 2005, 31(6):559-566. [18] RICHARDSON A D, DUIGAN S P, BERLYN G P. An evaluation of noninvasive methods to estimate foliar chlorophyll content[J]. New Phytol, 2010, 153(1):185-194. [19] 刘琳, 王玉魁, 王星星, 等.毛竹出笋后快速生长期茎秆色素含量与反射光谱的相关性[J].生态学报, 2013, 33(9):2703-2711. LIU Lin, WANG Yukui, WANG Xingxing, et al. Correlation between pigment content and reflectance spectrum of Phyllostachys edulis stems during its rapid growth stage[J]. Acta Ecol Sin, 2013, 33(9):2703-2711. [20] 陈登举, 高培军, 吴兴波, 等.毛竹茎秆叶绿体超微结构及其发射荧光光谱特征[J].植物学报, 2013, 48(6):635-642. CHEN Dengju, GAO Peijun, WU Xingbo, et al. Ultrastructure of chloroplast and its emission fluorescence spectrum of Phyllostachys edulis stems[J]. Bull Bot, 2013, 48(6):635-642. [21] STRASSER B J, STRASSER R J. Measuring fast fluorescence transients to address environmental questions, The JIP test//MATHIS P. Photosynthesis: From Light to Biosphere. Dordrecht: Kluwer Academy Publishers, 1995: 977-980. [22] KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis:the basics[J]. Annu Rev Plant Physiol Plant Mol Biol, 1991, 42:313-349. [23] STRASSER R J, TSIMILLI-MICHAEL M, SRIVASTAVA A. Analysis of the fluorescence transient[C]//PAPAGEORGIOU G G. Chlorophyll A Fluorescence: A Signature of Photosynthesis, Advances in Photosynthesis and Respiration: vol 19. Dordrecht: Springer, 2004: 321-362. [24] 张谧, 王慧娟, 于长青.超旱生植物沙冬青高温胁迫下的快速叶绿素荧光动力学特征[J].生态环境学报, 2009, 18(6):2272-2277. ZHANG Mi, WANG Huijuan, YU Changqing. Rapid chlorophyll fluorescence kinetics under high temperature stress of the ultraxerophyte Ammopiptanthus mongolicus[J]. Ecol Environ Sci, 2009, 18(6):2272-2277. [25] KALAJI H M, OUKARROUM A, ALEXANDROV V, et al. Identification of nutrient deficiency in maize and tomato plants by invivo chlorophyll a fluorescence measurements[J]. Plant Physiol Biochem, 2014, 81:16-25. [26] 武海, 许大全.依赖叶黄素循环的非辐射能量耗散在防御珊瑚树叶片光抑制破坏中的作用[J].植物生理学报, 1993, 19(2):181-187. WU Hai, XU Daquan. The role of nonradiative energy dissipation relying on the xanthophyll cycle in defending the photoinhibition damage of Viburnum odoratissinum leaves[J]. Plant Physiol J, 1993, 19(2):181-187. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2019.04.009







 下载:
下载: