-
森林植被退化改变了森林结构,导致林地土壤质量下降,引发林地水土流失[1−2]。南方红壤区由于降水丰沛且季节分明,产流率高,退化林地土壤侵蚀严重[3],森林生态系统功能被严重削弱。在森林生态系统中,土壤作为植物生长的基质和环境,其质量是影响森林可持续发展的重要因素。酶作为土壤中最活跃的成分之一,可活化各种养分[4−5],其高低可衡量土壤肥力水平[6],同时对土壤养分的循环过程也有敏感的响应。因此,监测植被恢复中的土壤养分及酶活性,可以更深入地了解土壤退化和恢复程度[7]。
目前,针对退化林地修复过程中土壤养分与酶活性关系的研究集中于人工林恢复措施,普遍认为植被恢复可提高土壤养分含量和酶活性。如张国微等[8]对比了喀斯特山地滇柏Cupressus duclouxiana纯林、刺槐Robinia pseudoacacia纯林和滇柏-刺槐混交林3种人工林与未造林地的差异,发现人工林土壤有机质、全氮、碱解氮、有效磷含量及酶活性均显著高于未造林地,土壤全氮、全磷能解释酶活性变异的60.7%;李欢等[9]对元谋干热河谷沟蚀区域植被恢复前后土壤理化性质与酶活性的关系进行研究,发现植被恢复后土壤酶活性化学计量显著提高,且与土壤碳含量显著正相关;梁燕芳等[10]研究发现:间伐均能提高杂交松人工林土壤养分含量及酶活性,中等强度的间伐对土壤质量的改善效果最明显。
等高反坡阶整地属于人工微地形带状整地措施,能有效拦蓄径流及表土携带的养分[11],提高水分入渗[12]等,进而维持土壤原有组分和理化状态,已成为坡耕地水土保持的重要措施。等高反坡阶整地因工程量小、扰动小、实施简单等特点,也可用作坡面植被恢复的辅助措施[13],可优化林地生长环境,加快植被恢复过程中林木的生长速率,并丰富植物群落结构[14]。此外,在云南松Pinus yunnanensis坡林地生态系统碳储量及分配格局的研究中发现:等高反坡阶整地显著提高云南松林生态系统生物量55.56%,碳增量达29.68%[15]。目前,关于坡林地等高反坡阶整地多围绕植被恢复效果[16]、乔木层及林下碳储量及碳增量[17]等方面开展研究,而就其如何影响植被恢复过程中土壤养分和酶活性的研究鲜有报道。因此,本研究以昆明市松华坝水源区迤者小流域的退化云南松坡林地为对象,研究等高反坡阶整地对土壤养分质量分数和酶活性的影响,揭示该措施退化林地土壤修复机制,为滇中地区红壤坡面退化林地修复提供理论依据。
-
研究区位于云南省昆明市松华坝水源区迤者小流域(24°14′~25°12′N,102°44′~102°48′E),平均海拔为2 220 m,属于典型低纬度高原山地季风气候,年均气温≥10 ℃,年均降水量为785 mm。地带性植被是以云南松为优势种的暖温性针叶林,灌草为云南杨梅Myrica nana、扭黄茅Heteropogon contortus、金丝草Pogonatherum crinitum等。流域受河流迂回切割影响,形成丘陵剥蚀地貌及土壤中轻度流失区,原坡地云南松林因过度砍伐、放牧等人为因素被毁严重,在1985年区域森林覆盖率降至27%[18]。
-
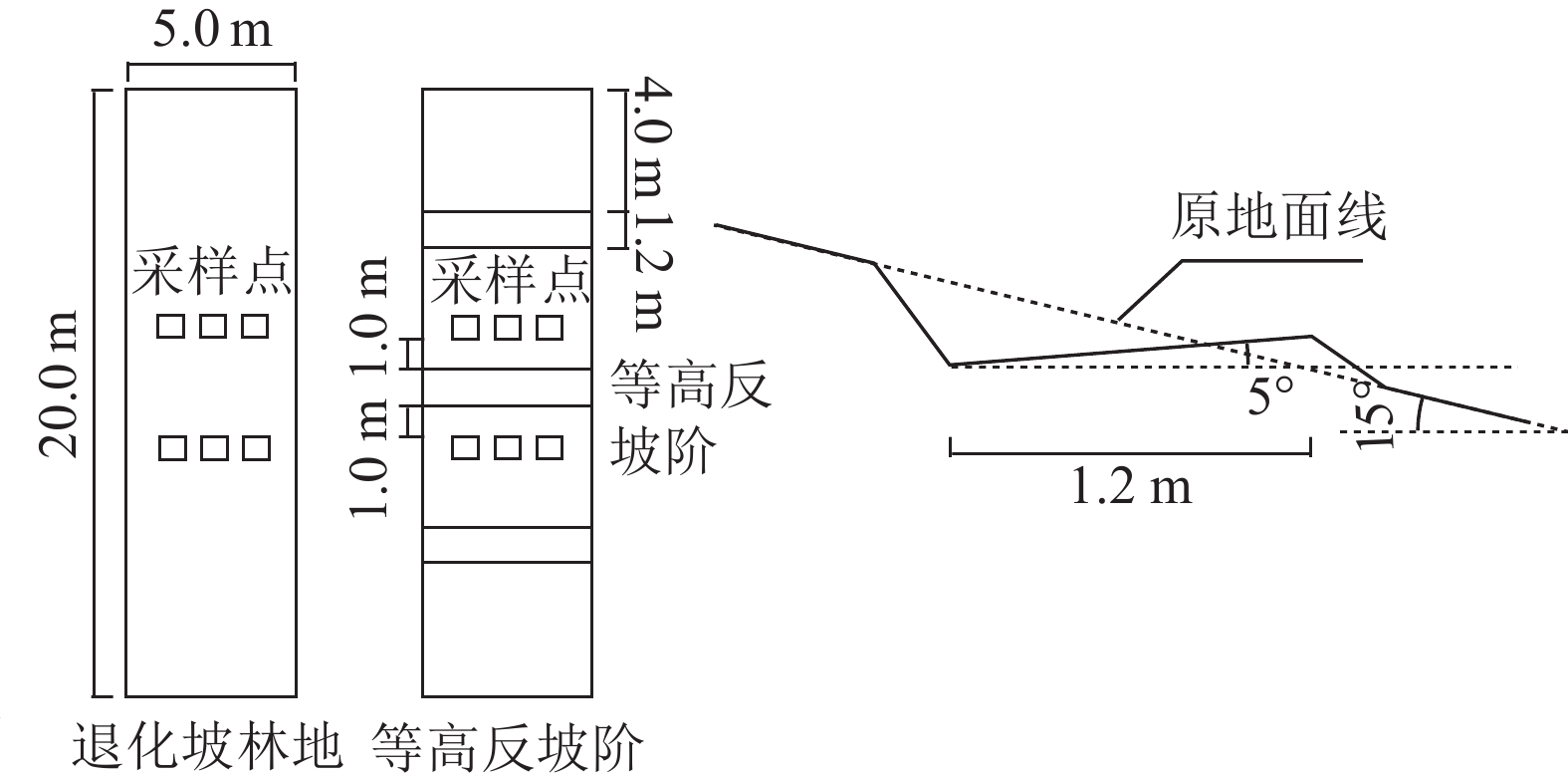
选取林分、林龄、植被密度、立地条件(海拔为2 100 m,坡度为15°,坡向为东北向)、土壤类型(红壤)等条件一致的云南松次生林,设置5 m×20 m样地,样地仅实施等高反坡阶整地,未采取人工造林措施。2022年5月中旬开展研究,设置等高反坡阶整地10 a样地(2009年6月开展研究)和等高反坡阶整地1 a样地(2021年6月开展研究),以相应原状坡面为对照(ck),每类样地均设置3块。2009年布设样地时,云南松林龄为11 a,植被密度为(3 891±49) 株·hm−2。等高反坡阶即沿等高方向从上向下里切外垫,修成一反坡台面,宽为1.2 m,反坡角为5°,以蓄水保土为目的。每个样地共布设3条等高反坡阶,每2个反坡阶之间的坡面水平距离为4 m,反坡阶面积约占样地总面积的18.0%,如图1所示。
-
于2022年5月中旬,用土壤剖面法采集各样地不同土层(0~10、10~20、20~30和30~40 cm)样品,其中0~10 cm定义为表层。为反映反坡阶的作用,在样地内中间反坡阶的阶上1.0 m和阶下1.0 m位置采样,同时采集ck样地的相应位置,每个位置布设3个采样点(图1),分别将同一位置3个采样点同一土层样品混匀后,装入无菌自封袋中;取部分样品用冰袋迅速运回实验室,放入4 ℃冰箱保存,用于土壤酶活性测定,其余土样运回后在室内阴凉处自然干燥,磨碎并过筛用于土壤养分测定。
-
土壤养分测定主要参照《土壤农化分析》[19]。土壤有机质采用重铬酸钾容量法-外加热测定;全氮采用浓硫酸-过氧化氢消煮、凯氏定氮仪测定;全磷采用浓硫酸-过氧化氢消煮、ICP-OES测定;碱解氮采用扩散吸收法;速效磷采用盐酸-氟化铵浸提、紫外可见分光光度计比色法测定;速效钾采用1 mol·L−1中性醋酸铵浸提、火焰光度计测定;pH采用电位法测定。
土壤酶活性测定主要参照《土壤酶及其研究法》[20]。脲酶活性、蔗糖酶活性和酸性磷酸酶活性分别采用苯酚-次氯酸钠、3,5-二硝基水杨酸、磷酸苯二钠紫外可见分光光度计比色法测定;过氧化氢酶活性采用高锰酸钾滴定法测定。
-
运用SPSS 26进行单因素方差分析(one-way ANOVA),显著性水平为0.05;采用Origin 2021进行Pearson相关性分析;采用Canoco 5进行冗余分析(RDA)。
-
如表1所示:研究区土壤pH为4.4~5.2,呈酸性。等高反坡阶整地实施后,阶上和阶下的土壤全氮、全磷、碱解氮、有机质和速效钾质量分数均显著高于ck相应位置(P<0.05),且10 a>1 a>ck。1和10 a表层土壤养分质量分数阶下均显著高于阶上(P<0.05),而ck阶上和阶下的相应位置土壤养分质量分数差异不显著(P>0.05)。随着土层深度的增加,1和10 a阶上和阶下土壤养分质量分数呈先增大后减小的趋势,ck变化不显著(P>0.05)。可见,等高反坡阶整地实施后显著提高了坡林地阶上和阶下的土壤养分质量分数,改变了原状坡面养分分布规律。
表 1 等高反坡阶整地下土壤养分空间分布
Table 1. Spatial distribution of soil nutrients under contour reverse-slope terrace measures
取样
位置土层/
cm实施
措施pH 有机质/
(g·kg−1)全氮/
(g·kg−1)碱解氮/
(mg·kg−1)全磷/
(g·kg−1)速效磷/
(mg·kg−1)速效钾/
(mg·kg−1)阶上 0~10 ck 4.5±0.0 Ca 23.3±0.3 Ca 5.7±0.0 Ca 78.1±1.0 Ba 0.3±0.0 Ba 16.8±0.4 Ba 45.4±0.4 Ba 1 a 4.7±0.0 Ba 34.2±1.5 Ba 8.9±0.1 Ba 104.7±2.5 Aa 0.3±0.0 Ba 16.8±0.4 Ba 53.8±2.2 Aa 10 a 4.9±0.0 Aa 55.6±0.3 Aa 11.9±0.1 Aa 109.2±2.4 Aa 0.7±0.1 Aa 18.7±0.3 Aa 62.2±1.7 Aa 10~20 ck 4.3±0.0 Ca 18.3±0.8 Bb 4.7±0.1 Bab 41.4±0.7 Bb 0.3±0.0 Ba 14.8±0.6 ABb 43.2±0.4 Bb 1 a 4.6±0.1 Bab 18.4±1.5 Bb 5.7±0.2 Bb − 0.3±0.0 Bb 12.8±0.5 Bb 46.4±1.7 ABab 10 a 4.8±0.0 Aa 47.9±0.7 Ab 8.1±0.1 Ab 89.0±0.8 Ab 0.4±0.1 Ab 17.6±1.4 Aa 52.2±0.4 Ab 20~30 ck 4.4±0.0 Ba 13.4±0.8 Bc 3.4±0.2 Cb − 0.3±0.0 Ba 12.1±0.4 Ac 40.6±0.4 Cc 1 a 4.5±0.1 Bb 15.3±1.4 Bbc 5.2±0.2 Bb − 0.3±0.0 Bb 10.9±0.6 Abc 44.2±1.2 Bab 10 a 4.7±0.0 Aa 34.0±0.5 Ac 6.5±0.4 Ac 64.7±2.0 Ac 0.3±0.0 Ab 12.4±0.1 Ab 51.7±0.1 Ab 30~40 ck 4.4±0.1 Aa 8.0±1.3 Bd 2.9±0.1 Bb − 0.2±0.0 Ab 9.9±0.2 Ad 39.6±0.5 Bc 1 a 4.5±0.1 Ab 11.7±0.7 Bc 3.3±0.2 Bc − 0.2±0.0 Ab 10.5±0.7 Ac 43.6±0.8 Bb 10 a 4.9±0.2 Aa 26.0±1.4 Ad 4.4±0.2 Ad 59.6±2.8 Ac 0.3±0.0 Ab 11.2±0.1 Ab 49.7±1.8 Ab 阶下 0~10 ck 4.5±0.0 Ca 20.9±2.1 Ca 6.1±0.2 Ba 84.6±1.8 Ba 0.3±0.0 Ca 17.1±0.2 Ba 45.8±0.2 Ba 1 a 5.1±0.0 Ba 39.4±0.7 Ba 11.8±0.1 Aa 138.9±2.4 Ba 0.5±0.0 Ba 16.0±1.0 Ba 60.6±0.5 Aa 10 a 4.8±0.0 Aa 63.0±0.2 Aa 13.2±0.3 Aa 155.8±4.2 Aa 1.3±0.1 Aa 30.6±0.7 Aa 67.5±0.4 Aa 10~20 ck 4.5±0.0 Ca 16.7±0.6 Cab 5.3±0.2 Ca 56.2±5.0 Bb 0.3±0.0 Ca 15.5±0.3 Bb 44.6±0.5 Ba 1 a 4.9±0.0 Bab 25.8±0.9 Bb 9.2±0.1 Bb 79.0±16.0 Bb 0.4±0.0 Ba 14.8±0.8 Bb 51.6±0.8 Ab 10 a 4.7±0.0Aab 53.0±1.4 Ab 11.5±0.0 Ab 142.0±12.3 Aa 1.0±0.0 Ab 25.9±0.5 Ab 56.8±0.6 Ab 20~30 ck 4.4±0.1 Ba 15.0±0.8 Cb 3.8±0.1 Bb 38.6±5.8 Bc 0.3±0.0 Bab 12.9±0.2 Bc 44.5±0.6 Ba 1 a 4.8±0.1 Abc 21.9±0.8 Bc 6.4±0.5 Ac 50.2±10.4 Bbc 0.3±0.0 Bb 12.0±0.6 Bbc 44.3±0.7 Bb 10 a 4.6±0.0 Ab 39.4±0.9 AC 7.7±0.2 Ac 86.5±0.4 Ab 0.7±0.0 Ac 17.6±0.1 Ac 51.3±0.8 Ac 30~40 ck 4.5±0.0 Aa 10.6±0.7 Bc 3.1±0.3 Bb − 0.2±0.0 Bb 11.7±0.4 Bd 41.7±0.2 Ba 1 a 4.7±0.1 Ac 12.0±1.1 Bd 4.1±0.4 Ad 28.6±4.4 Bc 0.3±0.0 Bb 10.5±0.9 Bc 41.9±0.7 Bb 10 a 4.6±0.1 Ab 26.4±1.3 Ad 5.0±0.0 Ad 63.8±6.3 Ab 0.6±0.0 Ac 16.4±0.8 Ac 50.2±0.3 Ac 说明:ck表示无整地措施;1 a表示实施1 a的等高反坡阶整地;10 a表示实施10 a的等高反坡阶整地;−表示未检出。不同大写字母表示同一土层不同整地措施间差异显著(P<0.05);不同小写字母表示同一整地措施不同土层间差异显著(P<0.05)。 -
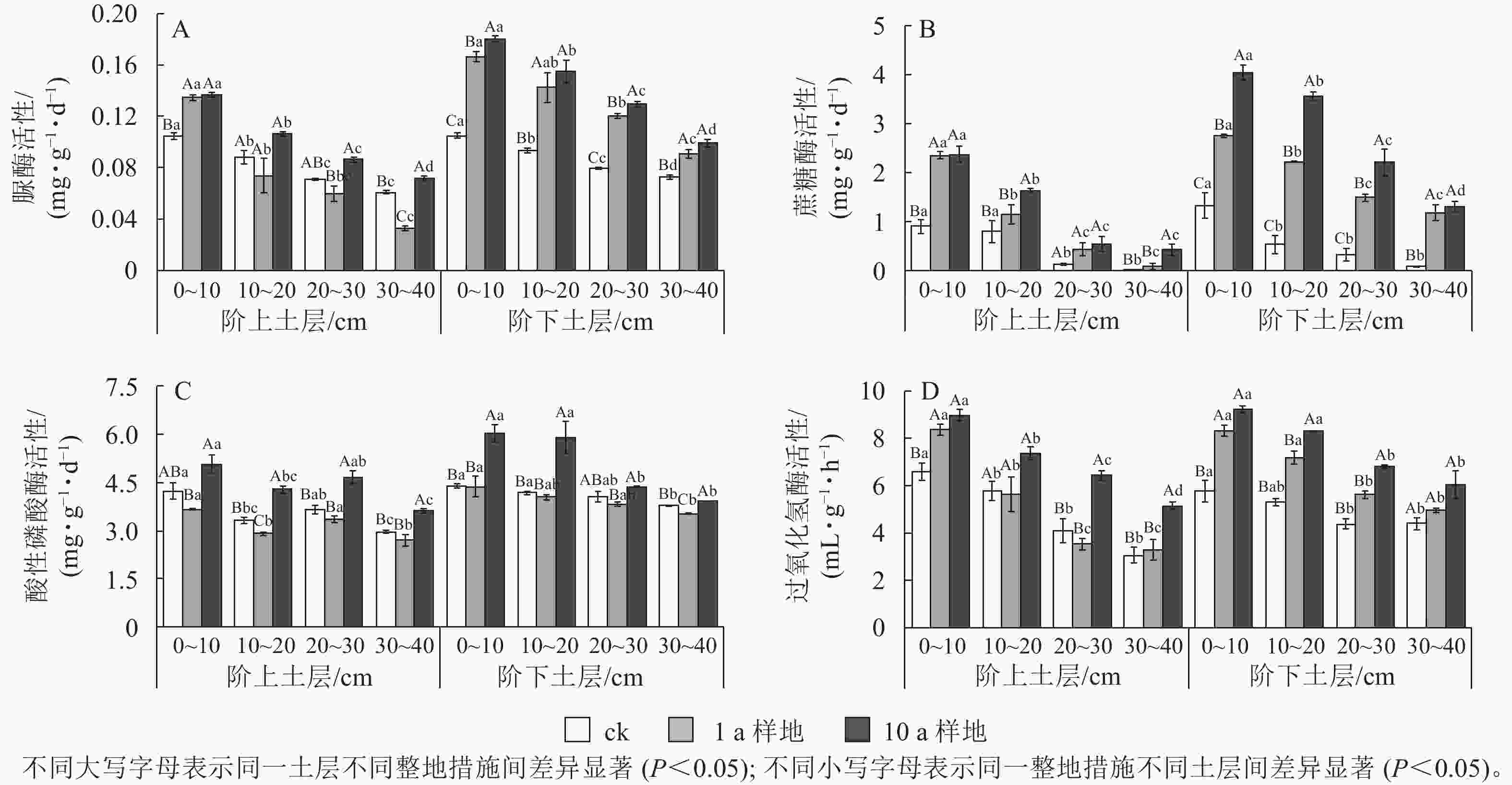
如图2所示:等高反坡阶整地阶上和阶下的土壤脲酶、蔗糖酶、酸性磷酸酶和过氧化氢酶的活性比ck相应位置均显著提高(P<0.05),且10 a>1 a>ck,10 a等高反坡阶样地的土壤脲酶、蔗糖酶、酸性磷酸酶和过氧化氢酶活性阶下比阶上分别高出24.2%、41.2%、16.9%和2.9%,1 a等高反坡阶样地分别高出19.2%、14.4%、16.1%和4.0%,ck阶上阶下差异不显著(P>0.05)。随着土层深度的增加,阶上与阶下的土壤脲酶、蔗糖酶和过氧化氢酶活性的差异程度明显增加,而酸性磷酸酶活性则呈先增加后降低的趋势。
-
从图3可以看出:ck、1 和10 a样地土壤养分对酶活性的解释率分别为68.0%、88.0%和92.7%。ck和1 a样地的速效磷和全氮对土壤酶活性的解释率达显著水平(P<0.05),解释率分别为65.9%和88.0%;10 a样地的碱解氮、全氮和全磷对土壤酶活性的解释率达显著水平(P<0.05),解释率分别为88.7%、4.9%和2.5%。表明等高反坡阶整地提高了土壤养分指标对酶活性的解释程度,10 a样地的解释率达显著水平的指标最多。
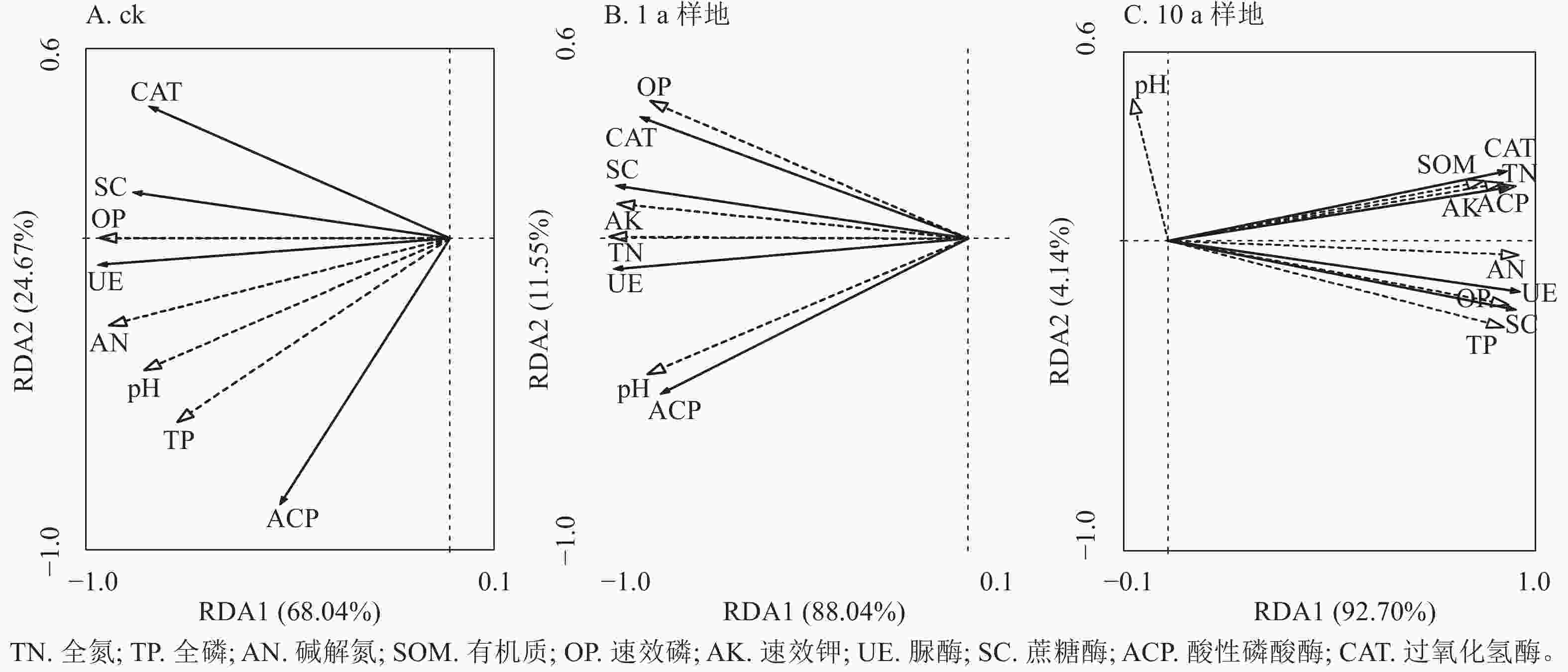
图 3 等高反坡阶整地下土壤养分与酶活性冗余分析
Figure 3. Redundancy analysis of soil nutrients and soil enzyme activities under contour reverse-slope terrace measures
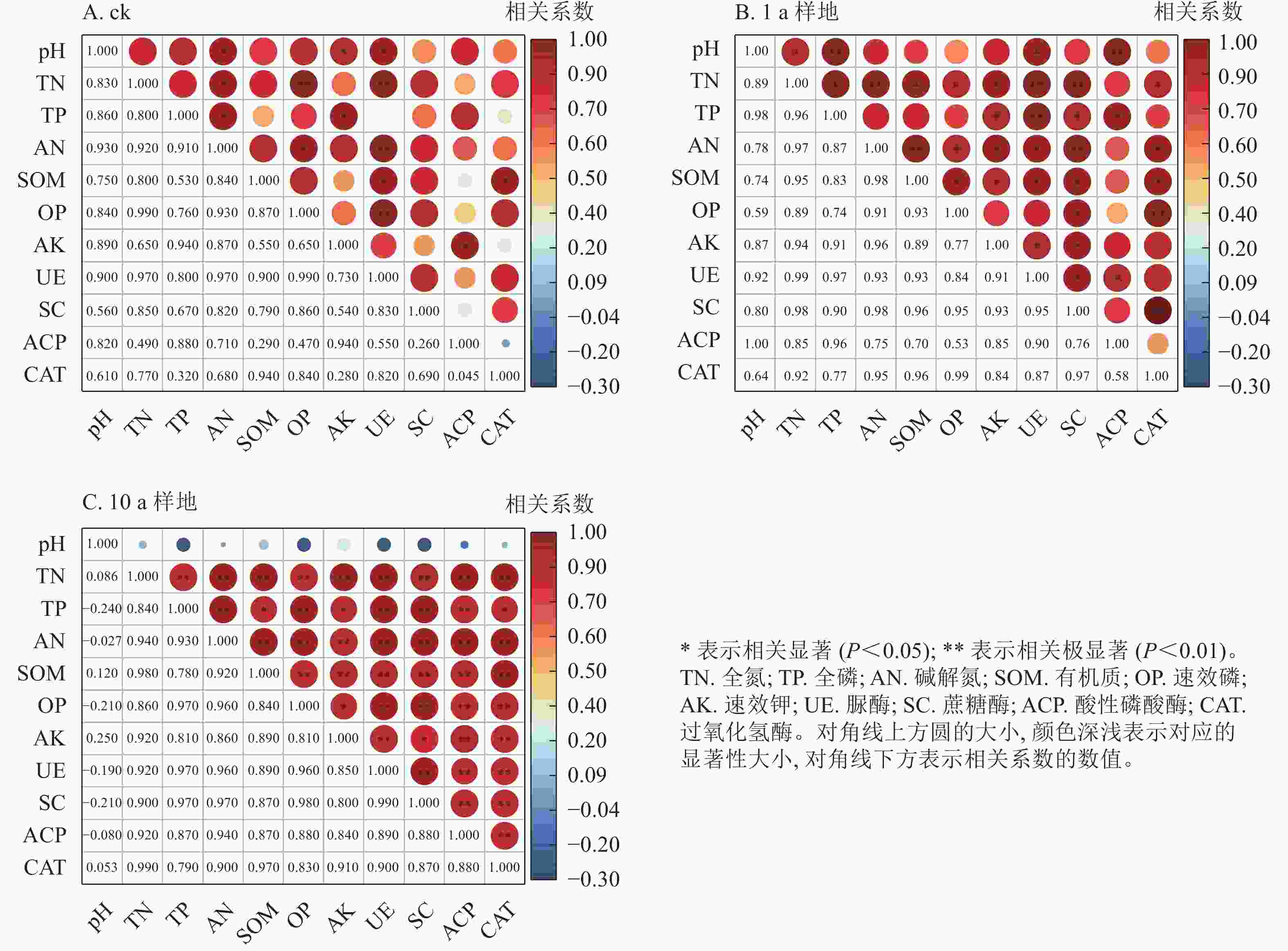
如图4所示:土壤养分与酶活性形成的两两组合中,ck和1 a样地达到显著水平的正相关关系分别有14组和34组(P<0.05),其中均有1组达到极显著水平(P<0.01),相关系数变化范围分别为0.26~0.99和0.53~0.99。10 a样地中,除pH外,其余养分与对应转化功能酶的活性均为正相关,相关系数为0.78~1.00,达极显著水平的组合有15组。等高反坡阶整地提高了土壤养分与具有对应转化功能土壤酶活性间的正相关关系,却降低了pH对土壤养分与酶活性的影响。
-
土壤养分可直接衡量土壤质量和林木生长所需土壤养分元素的潜在供应能力[21−22]。本研究表明:相较于ck,1和10 a样地的土壤养分质量分数在同一土层深度显著提高,说明等高反坡阶整地可促进土壤养分积累。同时,等高反坡阶措施可促进云南松凋落物的蓄积[13],增加土壤储水能力,提高凋落物的分解转化,提高土壤养分质量分数[17]。本研究还发现:土壤养分质量分数阶下显著高于阶上,这与等高反坡阶措施拦截径流、阻拦泥沙、增加养分入渗的作用有关。有研究表明:等高反坡阶对坡耕地径流和泥沙的削减率分别可达65.3%和80.7%[11−14],导致土壤养分质量分数显著提高,其中全氮质量分数增加达1.09倍[23]。与原状坡面相比,等高反坡阶有效阻断了坡面径流的形成,且样地中坡位的土壤同时受到上部阶面截流保护及下部阶面营养富集效应的影响,出现土壤养分阶下高于阶上的结果,且10 a样地的提升效果高于1 a[13]。并且,阶下与阶上土壤养分的差异随着土层深度的增加而减小,即等高反坡阶整地对表层养分质量分数的提升效果更好,这与人工林植被恢复的研究现象相似[24−25]。表明土壤养分具有表聚性[24],林地凋落物分布于土壤表层,通过分解转化可为土壤有机质等养分提供补充[25],随着土层深度的增加,该补充作用逐渐减弱,再加上等高反坡阶整地表层土壤中植物根系的生长更集中,进而呈现出表层提升效果更明显的状况[26]。
-
酶作为土壤生态系统中生化反应的重要催化剂,对土壤质量有指示作用,土壤质量越好,脲酶、蔗糖酶和酸性磷酸酶活性越高。本研究10 a的样地中,土壤中蔗糖酶、脲酶、酸性磷酸酶和过氧化氢酶活性显著提高,这与相关的研究结果相似[27]。有研究表明:等高反坡阶整地对坡耕地根际土壤酶活性有显著提高作用,脲酶、蔗糖酶、过氧化氢酶和酸性磷酸酶活性比对照提高9.58%~92.92%[27]。等高反坡阶整地阻止了土壤养分和水分流失,这类似于植被恢复中的凋落物积累,植被恢复中,水分和土壤温度等环境因子得以改善,土壤动物、微生物的种类和数量、含氧量均为表层土壤高于深层[28−29],本研究的等高反坡阶整地使阶下和表层土壤养分表聚和转化,促进了土壤微生物多样性形成,丰富的碳源及其他养分为酶促反应提供底物,利于胞外酶的产生,进而利于酶的催化反应,酶活性显著提高[30]。同时,本研究土壤酶活性表现出与养分相似的空间分布规律,进一步证明养分积累促进了土壤酶活性。
-
在造林植被恢复、人工藻结皮覆盖相关研究中,养分和酶参与土壤物质能量转化过程时并非独立作用,而是彼此配合[31−32]。土壤养分质量分数与酶活性间存在相互促进的作用机制,酶促反应中,养分作为底物可激发酶活性,酶活性的提高反过来促进养分循环[33]。人工藻结皮覆盖通过提高盐碱地土壤养分质量分数及酶活性有效改善盐碱地土壤质量[31],不同林龄杉木Cunninghamia lanceolata -红豆杉Taxus chinensis混交林改变了土壤养分状态,间接提高了土壤酶活性[32]。本研究的等高反坡阶整地具有提高退化坡林地土壤养分与酶活性正相关关系的作用,10 a样地的效果更明显。其原因在于等高反坡阶整地一方面通过阻断径流,增加入渗,为养分蓄积提供条件,在反应底物逐渐充足的过程中,土壤养分转化的相关酶活性被激活[14];另一方面,养分蓄积刺激植物生长,其根系向土壤分泌更多的酶,可进一步提升土壤养分的转化和循环速率。在参与土壤生理生化反应过程中,土壤养分与酶的配合程度提升[34],最终形成了土壤-植物-养分-酶的稳定复合体系,全面改善土壤质量。土壤养分质量分数和酶活性与pH的相关关系,由ck和1 a样地的正相关变为10 a样地的负相关,说明等高反坡阶整地实施一定时间后,改变了云南松坡林地酸性土壤对养分和酶活性的限制作用,在其他类型林地中也发现了类似的现象[35]。
-
实施等高反坡阶整地后,云南松坡林地的土壤养分质量分数与酶活性显著增加,反坡阶的阶下提高程度高于阶上,且对表层土壤养分和酶活性的提高程度高于下层土壤。等高反坡阶整地显著提高了土壤养分与酶活性的正相关关系,同时改变了土壤pH对养分与酶活性的限制作用,整地10 a的效果尤为明显。因此,等高反坡阶整地可作为退化坡林地恢复的辅助措施,通过提升土壤养分与酶活性间的关联性,改善土壤质量并加快退化林地的恢复进程。
Response of soil nutrients and enzyme activities to contour reverse-slope land preparation in slope forest land of central Yunnan Province
-
摘要:
目的 通过分析等高反坡阶整地对退化坡林地恢复过程中土壤养分与酶活性的影响,揭示该措施生态修复的作用机制。 方法 以昆明市松华坝水源区迤者小流域的退化云南松Pinus yunnanensis坡林地为对象,设置等高反坡阶整地1 a样地(1 a)和10 a样地(10 a),以原状坡面(ck)为对照,比较土壤养分质量分数和酶活性在反坡阶的阶上和阶下及不同土层深度(0~10、10~20、20~30和30~40 cm)的分布差异。 结果 ①等高反坡阶整地显著提高土壤养分质量分数(P<0.05),碳、氮、磷等养分提升达15.3%~236.2%,阶下高于阶上,表层土壤(0~10 cm)增加最明显。②土壤脲酶、蔗糖酶、酸性磷酸酶和过氧化氢酶活性均表现为10 a样地显著高于ck (P<0.05),4种酶活性提升范围在3.7%~587.5%,阶下仍高于阶上,表层土壤酶活性提升显著(P<0.05)。③冗余分析显示:等高反坡阶整地后土壤养分对酶活性的累积解释贡献率升高,ck、1和10 a样地分别为68.0%、88.0%和92.7%;反坡阶整地后土壤养分与酶活性的正相关关系提高,相关系数范围和达极显著性组数(P<0.01)由ck的0.26~0.99和1组,增至10 a样地的0.78~1.00和15组。 结论 退化坡林地实施等高反坡阶整地后,可促进土壤养分蓄积,激发土壤酶活性,增加两者在土壤生理生化反应过程中的配合度,最终改善土壤质量。图4表1参35 Abstract:Objective The aim is to reveal the mechanism of ecological restoration by analyzing the effects of contour reverse-slope terrace on soil nutrients and enzyme activities during the restoration of degraded slope forest . Method The degraded Pinus yunnanensis slope forest land in Yizhe minor watershed of Songhuaba water source area in Kunming City was taken as the research object. 1-year and 10-year contour reverse-slope terrace preparation trials were set up, with the original slope as a control (ck). Soil nutrients contents and enzyme activities above and below the terrace, as well as those at different soil depths (0 − 10, 10 − 20, 20 − 30, and 30 − 40 cm) were systematically compared. Result (1) Contour reverse-slope terraces displayed a significant increase in soil nutrient contents (P<0.05), and the nutrients such as carbon, nitrogen, and phosphorus increased by 15.3% − 236.2%. The nutrient levels below the terrace were higher than those above the terrace, and the increase in surface soil (0 − 10 cm) was the most significant. (2) The activities of soil urease, sucrase, acid phosphatase, and catalase in 10-year plots were significantly higher than those in ck (P<0.05), and the 4 enzyme activities increased by 3.7% − 587.5%. Soil enzyme activities below the terrace were still higher than those above the terrace. The increase in enzyme activity in the surface soil was significant (P<0.05). (3) Redundancy analysis showed that soil enzyme activities were better interpreted by soil nutrient indicators after soil preparation of contour reverse-slope terrace measures, with ck, 1-year plots, and 10-year plots accounting for 68.0%, 88.0%, and 92.7%, respectively. The positive correlation between soil nutrients contents and enzyme activities increased after soil preparation of contour reverse-slope terrace measures, and the range of correlation coefficients and the number of highly significant groups (P<0.01) increased from 0.26 − 0.99 and 1 group in ck to 0.78 − 1.00 and 15 groups in 10-year plots, respectively. Conclusion The implementation of contour reverse-slope terrace soil preparation in degraded slope forest can increase the accumulation of soil nutrient, stimulate soil enzyme activity, increase the coordination between the two in soil physiological and biochemical reaction, and ultimately improve soil quality. [Ch, 4 fig. 1 tab. 35 ref.] -
表 1 等高反坡阶整地下土壤养分空间分布
Table 1. Spatial distribution of soil nutrients under contour reverse-slope terrace measures
取样
位置土层/
cm实施
措施pH 有机质/
(g·kg−1)全氮/
(g·kg−1)碱解氮/
(mg·kg−1)全磷/
(g·kg−1)速效磷/
(mg·kg−1)速效钾/
(mg·kg−1)阶上 0~10 ck 4.5±0.0 Ca 23.3±0.3 Ca 5.7±0.0 Ca 78.1±1.0 Ba 0.3±0.0 Ba 16.8±0.4 Ba 45.4±0.4 Ba 1 a 4.7±0.0 Ba 34.2±1.5 Ba 8.9±0.1 Ba 104.7±2.5 Aa 0.3±0.0 Ba 16.8±0.4 Ba 53.8±2.2 Aa 10 a 4.9±0.0 Aa 55.6±0.3 Aa 11.9±0.1 Aa 109.2±2.4 Aa 0.7±0.1 Aa 18.7±0.3 Aa 62.2±1.7 Aa 10~20 ck 4.3±0.0 Ca 18.3±0.8 Bb 4.7±0.1 Bab 41.4±0.7 Bb 0.3±0.0 Ba 14.8±0.6 ABb 43.2±0.4 Bb 1 a 4.6±0.1 Bab 18.4±1.5 Bb 5.7±0.2 Bb − 0.3±0.0 Bb 12.8±0.5 Bb 46.4±1.7 ABab 10 a 4.8±0.0 Aa 47.9±0.7 Ab 8.1±0.1 Ab 89.0±0.8 Ab 0.4±0.1 Ab 17.6±1.4 Aa 52.2±0.4 Ab 20~30 ck 4.4±0.0 Ba 13.4±0.8 Bc 3.4±0.2 Cb − 0.3±0.0 Ba 12.1±0.4 Ac 40.6±0.4 Cc 1 a 4.5±0.1 Bb 15.3±1.4 Bbc 5.2±0.2 Bb − 0.3±0.0 Bb 10.9±0.6 Abc 44.2±1.2 Bab 10 a 4.7±0.0 Aa 34.0±0.5 Ac 6.5±0.4 Ac 64.7±2.0 Ac 0.3±0.0 Ab 12.4±0.1 Ab 51.7±0.1 Ab 30~40 ck 4.4±0.1 Aa 8.0±1.3 Bd 2.9±0.1 Bb − 0.2±0.0 Ab 9.9±0.2 Ad 39.6±0.5 Bc 1 a 4.5±0.1 Ab 11.7±0.7 Bc 3.3±0.2 Bc − 0.2±0.0 Ab 10.5±0.7 Ac 43.6±0.8 Bb 10 a 4.9±0.2 Aa 26.0±1.4 Ad 4.4±0.2 Ad 59.6±2.8 Ac 0.3±0.0 Ab 11.2±0.1 Ab 49.7±1.8 Ab 阶下 0~10 ck 4.5±0.0 Ca 20.9±2.1 Ca 6.1±0.2 Ba 84.6±1.8 Ba 0.3±0.0 Ca 17.1±0.2 Ba 45.8±0.2 Ba 1 a 5.1±0.0 Ba 39.4±0.7 Ba 11.8±0.1 Aa 138.9±2.4 Ba 0.5±0.0 Ba 16.0±1.0 Ba 60.6±0.5 Aa 10 a 4.8±0.0 Aa 63.0±0.2 Aa 13.2±0.3 Aa 155.8±4.2 Aa 1.3±0.1 Aa 30.6±0.7 Aa 67.5±0.4 Aa 10~20 ck 4.5±0.0 Ca 16.7±0.6 Cab 5.3±0.2 Ca 56.2±5.0 Bb 0.3±0.0 Ca 15.5±0.3 Bb 44.6±0.5 Ba 1 a 4.9±0.0 Bab 25.8±0.9 Bb 9.2±0.1 Bb 79.0±16.0 Bb 0.4±0.0 Ba 14.8±0.8 Bb 51.6±0.8 Ab 10 a 4.7±0.0Aab 53.0±1.4 Ab 11.5±0.0 Ab 142.0±12.3 Aa 1.0±0.0 Ab 25.9±0.5 Ab 56.8±0.6 Ab 20~30 ck 4.4±0.1 Ba 15.0±0.8 Cb 3.8±0.1 Bb 38.6±5.8 Bc 0.3±0.0 Bab 12.9±0.2 Bc 44.5±0.6 Ba 1 a 4.8±0.1 Abc 21.9±0.8 Bc 6.4±0.5 Ac 50.2±10.4 Bbc 0.3±0.0 Bb 12.0±0.6 Bbc 44.3±0.7 Bb 10 a 4.6±0.0 Ab 39.4±0.9 AC 7.7±0.2 Ac 86.5±0.4 Ab 0.7±0.0 Ac 17.6±0.1 Ac 51.3±0.8 Ac 30~40 ck 4.5±0.0 Aa 10.6±0.7 Bc 3.1±0.3 Bb − 0.2±0.0 Bb 11.7±0.4 Bd 41.7±0.2 Ba 1 a 4.7±0.1 Ac 12.0±1.1 Bd 4.1±0.4 Ad 28.6±4.4 Bc 0.3±0.0 Bb 10.5±0.9 Bc 41.9±0.7 Bb 10 a 4.6±0.1 Ab 26.4±1.3 Ad 5.0±0.0 Ad 63.8±6.3 Ab 0.6±0.0 Ac 16.4±0.8 Ac 50.2±0.3 Ac 说明:ck表示无整地措施;1 a表示实施1 a的等高反坡阶整地;10 a表示实施10 a的等高反坡阶整地;−表示未检出。不同大写字母表示同一土层不同整地措施间差异显著(P<0.05);不同小写字母表示同一整地措施不同土层间差异显著(P<0.05)。 -
[1] 汤景明, 翟明普, 付林胜. 森林植被恢复研究进展[J]. 湖北林业科技, 2012(3): 35 − 39. TANG Jingming, ZHAI Mingpu, FU Linsheng. Research progress on forest vegetation restoration [J]. Hubei Forestry Science and Technology, 2012(3): 35 − 39. [2] DENG Lei, SHANGGUAN Zhouping. Afforestation drivers soil carbon and nitrogen changes in China [J]. Land Degradation &Development, 2017, 28(1): 151 − 165. [3] 梁楚欣, 范弢, 陈培云. 滇东石漠化坡地不同恢复模式下云南松林土壤碳氮磷化学计量特征及其影响因子[J]. 浙江农林大学学报, 2023, 40(3): 511 − 519. LIANG Chuxin, FAN Tao, CHEN Peiyun. Stoichiometric characteristics and influencing factors of soil C, N and P in Pinus yunnanensis forests under different restoration modes on rocky desertification slope land in eastern Yunnan [J]. Journal of Zhejiang A&F University, 2023, 40(3): 511 − 519. [4] 陈小花, 陈宗铸, 雷金睿, 等. 清澜港红树林湿地土壤酶活性与理化性质的关系[J]. 林业科学研究, 2022, 35(2): 171 − 179. CHEN Xiaohua, CHEN Zongzhu, LEI Jinrui, et al. Relationship between soil enzyme activities and physicochemical properties in mangrove wetland of Qinglan Port [J]. Forest Research, 2022, 35(2): 171 − 179. [5] SAMUEL A D, BUNGAU S G, TIT D M, et al. Effects of long term application of organic and mineral fertilizers on soil enzymes [J]. Revista de Chimie, 2018, 69(10): 2608 − 2612. [6] GONG Shiwei, ZHANG Tao, GUO Rui, et al. Response of soil enzyme activity to warming and nitrogen addition in a meadow steppe [J]. Soil Research, 2015, 53(3): 242 − 252. [7] 张童, 刘宇飞, 隋心, 等. 土地利用方式对黑龙江西部地区土壤理化性质和酶活性的影响[J]. 农学学报, 2021, 11(5): 33 − 41. ZHANG Tong, LIU Yufei, SUI Xin, et al. Land use patterns: effects on soil physical and chemical properties and enzyme activities in the western Heilongjiang [J]. Journal of Agriculture, 2021, 11(5): 33 − 41. [8] 张国微, 薛建辉, 马洁, 等. 喀斯特退化山地不同类型人工林土壤养分与酶活性[J]. 生态学杂志, 2024, 43(3): 616 − 622. ZHANG Guowei, XUE Jianhui, MA Jie, et al. Soil nutrients and enzyme activities in different types of plantations in karst degraded mountainous sites [J]. Chinese Journal of Ecology, 2024, 43(3): 616 − 622. [9] 李欢, 魏雅丽, 闫帮国, 等. 元谋干热河谷沟蚀地区植被恢复对土壤养分和酶活性的影响[J]. 土壤通报, 2020, 51(5): 1118 − 1126. LI Huan, WEI Yali, YAN Bangguo, et al. Effect of vegetation restoration on soil nutrients and enzyme activities in the gully eroded areas of Yuanmou dry-hot valley [J]. Chinese Journal of Soil Science, 2020, 51(5): 1118 − 1126. [10] 梁燕芳, 罗华龙, 蒋林, 等. 不同间伐强度对杂交松人工林土壤理化性质及酶活性的影响[J]. 北华大学学报(自然科学版), 2022, 23(4): 521 − 529. LIANG Yanfang, LUO Hualong, JIANG Lin, et al. Effects of different thinning intensities on soil physicochemical properties and enzyme activities in hybrid pine plantation [J]. Journal of Beihua University (Natural Science), 2022, 23(4): 521 − 529. [11] 唐佐芯, 王克勤, 李秋芳, 等. 等高反坡阶对坡耕地产流产沙和氮磷迁移的作用研究[J]. 水土保持研究, 2013, 20(1): 1 − 8. TANG Zuoxin, WANG Keqin, LI Qiufang, et al. Study on contour reverse-slope terrace controlling soil and water loss and nitrogen and phosphorus transfer in the sloping farmland [J]. Research of Soil and Water Conservation, 2013, 20(1): 1 − 8. [12] 陈雪, 宋娅丽, 王克勤, 等. 基于Van Genuchten模型的等高反坡阶下土壤水分特征[J]. 水土保持研究, 2019, 26(5): 45 − 52. CHEN Xue, SONG Yali, WANG Keqin, et al. Moisture characteristics under contour reverse-slope terrace based on Van Genuchten model [J]. Research of Soil and Water Conservation, 2019, 26(5): 45 − 52. [13] 王帅兵, 王克勤, 宋娅丽, 等. 等高反坡阶对昆明市松华坝水源区坡耕地氮、磷流失的影响[J]. 水土保持学报, 2017, 31(6): 39 − 45. WANG Shuaibing, WANG Keqin, SONG Yali, et al. Effects of contour reverse-slope terrace on nitrogen and phosphorus loss in sloping farmland in the water resource area of Songhua Dam in Kunming City [J]. Journal of Soil and Water Conservation, 2017, 31(6): 39 − 45. [14] 王震, 王克勤, 赵洋毅, 等. 山坡退化林地林木生长对微地形人工干预的响应[J]. 应用生态学报, 2019, 30(8): 2583 − 2590. WANG Zhen, WANG Keqin, ZHAO Yangyi, et al. Responses of tree growth to artificial intervention on micro-topography in degraded woodland on hillslope [J]. Chinese Journal of Applied Ecology, 2019, 30(8): 2583 − 2590. [15] 李学峰, 王克勤, 宋娅丽, 等. 等高反坡阶对滇中云南松林生态系统碳储量及增量分配格局的影响[J]. 水土保持研究, 2019, 26(5): 21 − 27. LI Xuefeng, WANG Keqin, SONG Yali, et al. Effects of contour reverse-slope terrace on carbon storage and incremental distribution of Pinus yunnanensis forest ecosystem in middle of Yunnan Province [J]. Research of Soil and Water Conservation, 2019, 26(5): 21 − 27. [16] 华锦欣, 王克勤, 张香群, 等. 等高反坡阶对松华坝水源区弃荒坡地植被恢复的初期影响[J]. 西南林业大学学报, 2016, 36(3): 116 − 120. HUA Jinxin, WANG Keqin, ZHANG Xiangqun, et al. Initial influence on vegetation restoration of sloping wasteland under the reverse-slope level terrace in the water resource area of Songhua Dam [J]. Journal of Southwest Forestry University, 2016, 36(3): 116 − 120. [17] 李学峰, 宋娅丽, 王克勤, 等. 等高反坡阶对滇中云南松林下碳储量及增量分配格局的影响[J]. 水土保持研究, 2019, 26(4): 19 − 25. LI Xuefeng, SONG Yali, WANG Keqin, et al. Effects of contour reverse-slope terrace on carbon storage and incremental distribution in understory layer of Pinus yunnanensis forest in middle Yunnan Province [J]. Research of Soil and Water Conservation, 2019, 26(4): 19 − 25. [18] 赵语. 松华坝水源区保护研究[D]. 昆明: 云南大学, 2015. ZHAO Yu. Research on the Protection of the Water Source Area of Songhua Dam [D]. Kunming: Yunnan University, 2015. [19] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO Shidan. Soil Agrochemical Analysis [M]. Beijing: China Agricultural Publishing House, 2000. [20] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. GUAN Songyin. Soil Enzyme and Its Research Methods [M]. Beijing: Agricultural Publishing House, 1986. [21] SEONGJUN K, CHOONSIG K, SEUNG H H, et al. A multi-site approach toward assessing the effect of thinning on soil carboncontents across temperate pine, oak, and larch forests [J]. Forest Ecology and Management, 2018, 424: 62 − 70. [22] SCHJOERRING J K, CAKMAK I, WHITE P J. Plant nutrition and soil fertility: synergies for acquiring global green growth and sustainable development [J]. Plant and Soil, 2019, 434(1): 1 − 6. [23] 刘晓微, 赵洋毅, 王克勤, 等. 坡耕地等高反坡阶整地年限对土壤改良和玉米产量的影响[J]. 水土保持学报, 2022, 36(1): 307 − 315. LIU Xiaowei, ZHAO Yangyi, WANG Keqin, et al. Effects of site preparation years of contour reverse-slope terrace on soil improvement and corn yield in sloping farmland [J]. Journal of Soil and Water Conservation, 2022, 36(1): 307 − 315. [24] 窦沛彤, 贺思腾, 高成杰, 等. 干热河谷不同恢复群落对林下物种多样性和土壤理化性质的影响[J]. 浙江农林大学学报, 2022, 39(3): 616 − 624. DOU Peitong, HE Siteng, GAO Chengjie, et al. Effects of different restoration communities on understory species diversity and soil physical and chemical properties in dry-hot valley [J]. Journal of Zhejiang A&F University, 2022, 39(3): 616 − 624. [25] GOLUBTSOV V A, VANTEEVA Y V, VOROPAY N N. Effect of humidity on the stable carbon isotopic composition of soil organic matter in the Baikal region [J]. Eurasian Soil Science, 2021, 54(10): 1463 − 1474. [26] 杜娟, 黄海霞, 姚志勇, 等. 不同恢复年限对柠条林地土壤养分含量和酶活性的影响[J]. 草原与草坪, 2023, 43(1): 100 − 107. DU Juan, HUANG Haixia, YAO Zhiyong, et al. Effects of restoration years on soil nutrients and enzyme activities in Caragana korshinskiis forest land soils [J]. Grassland and Turf, 2023, 43(1): 100 − 107. [27] 刘晓微, 王克勤, 赵洋毅, 等. 等高反坡阶措施下玉米苗期根系分泌物特征及其对根际土壤酶活性的响应[J]. 四川农业大学学报, 2021, 39(4): 477 − 485. LIU Xiaowei, WANG Keqin, ZHAO Yangyi, et al. Characteristics of maize root exudates at seedling stage and their response to rhizosphere soil enzyme activities under contour reverse-slope terrace [J]. Journal of Sichuan Agricultural University, 2021, 39(4): 477 − 485. [28] 李晗, 吕刚, 李叶鑫, 等. 露天煤矿排土场不同植被恢复模式土壤养分和酶活性的差异性[J]. 生态学杂志, 2022, 41(5): 919 − 924. LI Han, LÜ Gang, LI Yexin, et al. The differences of soil nutrients and enzyme activities of different vegetation restoration models in open cast coal mine dump [J]. Chinese Journal of Ecology, 2022, 41(5): 919 − 924. [29] 隋夕然, 吴丽芳, 王妍, 等. 滇中岩溶高原不同石漠化程度土壤团聚体养分及酶活性特征[J]. 浙江农林大学学报, 2022, 39(1): 115 − 126. SUI Xiran, WU Lifang, WANG Yan, et al. Characteristics of nutrient and enzyme activity in soil aggregates of different rocky desertification levels in central Yunnan Plateau [J]. Journal of Zhejiang A&F University, 2022, 39(1): 115 − 126. [30] 宋思意, 吕思扬, 邱岭军, 等. 华西雨屏区常绿阔叶林不同深度土壤氮矿化及酶活性对模拟氮沉降的响应[J]. 生态学报, 2022, 42(22): 9045 − 9056. SONG Siyi, LÜ Siyang, QIU Lingjun, et al. Responses of soil nitrogen mineralization and enzyme activities at different depths to nitrogen additions in an evergreen broad-leaved forest [J]. Acta Ecologica Sinica, 2022, 42(22): 9045 − 9056. [31] 刘太坤, 高班, 谢作明, 等. 人工藻结皮对河套平原盐碱土理化性质和酶活性的影响[J]. 水土保持研究, 2022, 29(4): 133 − 139. LIU Taikun, GAO Ban, XIE Zuoming, et al. Effects of artificial algal crusts on physicochemical properties and enzyme activities of saline-alkali soil in Hetao plain [J]. Research of Soil and Water Conservation, 2022, 29(4): 133 − 139. [32] 赵洋, 余雯静, 何易蔓, 等. 套种南方红豆杉对杉木人工林土壤肥力的影响[J]. 应用与环境生物学报, 2024, 30(2): 344 − 352. ZHAO Yang, YU Wenjing, HE Yiman, et al. Effects of understory Taxus chinensis var. mairei planting on soil fertility of Chinese fir plantations [J]. Chinese Journal of Applied and Environmental Biology, 2024, 30(2): 344 − 352. [33] 黄瑞灵, 王西文, 马国虎, 等. 模拟氮沉降对高寒湿地土壤理化性质和酶活性的影响[J]. 草地学报, 2022, 30(6): 1343 − 1349. HUANG Ruiling, WANG Xiwen, MA Guohu, et al. Effects of simulated nitrogen deposition on soil physicochemical properties and enzyme activities in alpine wetland [J]. Acta Agrestia Sinica, 2022, 30(6): 1343 − 1349. [34] 赵娜, 沈爱红, 石云, 等. 贺兰山东麓冲积扇区不同微地形土壤理化性质及酶活性特征研究[J]. 西南农业学报, 2023, 36(11): 2451 − 2463. ZHAO Na, SHEN Aihong, SHI Yun, et al. Characterization of physicochemical properties and enzymatic activities of different micro-topographical soils in alluvial fan area at eastern foot of the Helan Mountain [J]. Southwest China Journal of Agricultural Sciences, 2023, 36(11): 2451 − 2463. [35] 陈佳, 姚成硕, 林勇明, 等. 武夷山林地土壤酶活性差异及土壤肥力质量评价[J]. 山地学报, 2021, 39(2): 194 − 206. CHEN Jia, YAO Chengshuo, LIN Yongming, et al. Soil enzyme activity difference in woodlands, and soil fertility quality evaluation in Mount Wuyi, China [J]. Mountain Research, 2021, 39(2): 194 − 206. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230545







 下载:
下载: