-
香榧Torreya grandis ‘Merrilii’是红豆杉科Taxaceae榧树属Torreya裸子植物榧树Torreya grandis经无性繁殖形成的优良栽培品种,也是中国南方特有的集果用、药用、材用、油用和观赏于一体的珍贵经济树种,具有极高的经济和生态价值[1]。香榧种实风味香酥,余味浓郁,营养丰富,具有很强的健康功效,深受消费者的喜爱,且丰产期产值在30万元·hm−2以上[2]。与其他坚果不同,香榧种实需经过一段后熟过程以积累糖分、不饱和脂肪酸和氨基酸等营养成分[3],此过程对于香榧坚果采后品质的形成与提升极为关键[4]。
氨基酸是构建蛋白质的基本组成单元,不仅是人体生命活动的重要物质基础,也是决定食物风味与营养价值的关键成分[5−6]。在坚果中,游离氨基酸的含量及组成直接影响其营养品质和感官特性,尤其是呈味氨基酸的分布对坚果的风味特征具有重要贡献,如鲜味氨基酸赋予食物鲜味[7],甜味氨基酸增强甜感[8],而芳香味氨基酸则带来复杂味觉层次[9]。ZHANG等[10]研究表明:香榧种仁中含有17种游离氨基酸,其中,鲜味氨基酸占比最高,赋予其浓郁的鲜香风味,甜味和苦味氨基酸次之,形成独特的味觉平衡。长柄扁桃仁Amygdalus pedunculatus中,游离氨基酸质量分数较高,达21.74~32.35 mg·g−1,其必需氨基酸占总氨基酸比例为24.86%~28.22%,以鲜味氨基酸为主,甜味氨基酸次之[11]。鲜核桃Juglans regia中谷氨酸和天冬氨酸占比显著高于干核桃,其必需氨基酸占比高于扁桃仁,达30%~41%,营养价值更高[12]。花生Arachis hypogaea[13]和榛子Corylus heterophylla[14]等其他坚果,虽然氨基酸占比有差异,但游离氨基酸占比均少于扁桃仁。香榧受异花授粉、自然杂交、生态环境等方面因素影响,产生了许多变异,形成了不同品种(品系)。目前已研究发现:不同香榧品种的种实在形态和营养物质方面存在显著差异,如核形指数[15]、油脂[16]和蛋白质等[17]。氨基酸作为蛋白质的分解产物,它的组成和质量分数是衡量香榧品质优劣的重要指标[18]。
本研究选取当前主要栽培品种‘细榧’T. grandis‘Xi Fei’和主要推广品种‘象牙榧’T. grandis‘Xiangya Fei’,分析2个品种种实氨基酸积累的规律和差异,为香榧的品质评估和品种推广提供科学参考,以进一步提升香榧坚果的核心竞争力以及推动香榧产业的发展。
-
种实采集于浙江省湖州市安吉县上墅乡刘家塘村(30°38′N,119°41′E),选取突破种鳞后525 d的‘细榧’ 和‘象牙榧’种实。样品采摘后于4 h内运回实验室,人工去除假种皮后清洗干净,放置一晚去除田间热。选取大小、颜色、形状一致的香榧种实,将其分为3个生物学重复,每个重复20 kg,置于温度25 ℃和湿度90%的室内进行后熟处理。每天进行1次翻堆,保证种实处于均匀的后熟环境。分别于后熟的第0、5、10、15和20天进行采样,人工去除香榧种壳,并将2个品种香榧种仁切碎分装于50 mL离心管,立即置于液氮中冷却速冻,放置于−80 ℃冰箱中保存,用于后续研究。
-
茚三酮、乙酸、乙酸钠、盐酸、氢氧化钠、乙醇等分析纯试剂购自国药集团化学试剂有限公司,柠檬酸、柠檬酸钠等优级纯试剂购自日本和光公司,氨基酸混标购自Sigma公司。L-8900全自动氨基酸分析仪购自日本日立公司,天平为波兰RADWAG-AS 220.R2专业分析天平。
-
准确吸取Type B、Type AN-Ⅱ氨基酸混标(日本和光)各0.20、0.40、0.60、0.80、1.00 mL于25 mL容量瓶中,用0.02 mol·L−1盐酸溶液定容,4 ℃冷藏保存。取配制好的17种氨基酸混标,进样20 µL,以氨基酸浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
-
取5 g液氮研磨好的香榧种实粉末鲜样,溶于10 mL去离子水,混匀成匀浆。再将该匀浆移至100 mL的容量瓶中,并添加60 mL的去离子水,摇匀后沸水浴1 h,期间每15 min涡旋1次。待冷却到室温后,定容到100 mL。从中取5 mL的定容液置于15 mL的离心管中,再加入等体积质量浓度为10%的磺酸水杨酸溶液混匀后,在4 ℃、10 000 r·min−1的条件下离心15 min。离心后用注射器吸取上清液,取上清液过0.22 μm水膜,待测。采用L-
8900 全自动氨基酸分析仪测定香榧种实游离氨基酸。 -
色谱柱为Na+型阳离子交换柱;离子交换树脂2622,检测器为紫外可见光检测器;显色剂为茚三酮;缓冲液系统为柠檬酸钠缓冲液B1 (pH 3.2),B2 (pH 3.0),B3 (pH 4.0),B4 (pH 4.9);缓冲液流速为0.40 mL·min−1,茚三酮流速为0.35 mL·min−1;柱温为57 ℃,室温为135 ℃。进样体积为20 μL。用外标法测定样品溶液中的游离氨基酸,其中脯氨酸检测波长为440 nm,其他氨基酸检测波长为570 nm。
-
数据通过Excel进行计算并绘图,方差分析采用SPSS 26.0。对数据进行标准化处理,进一步计算特征值和特征向量,基于累积方差贡献率进行主成分分析(PCA);数据分析过程在Origin 2022平台完成,采用内置的PCA分析模块进行处理,并绘制相应的得分图(Score Plot),以直观展示各类氨基酸在主成分空间中的分布特征及其相互关系。
-
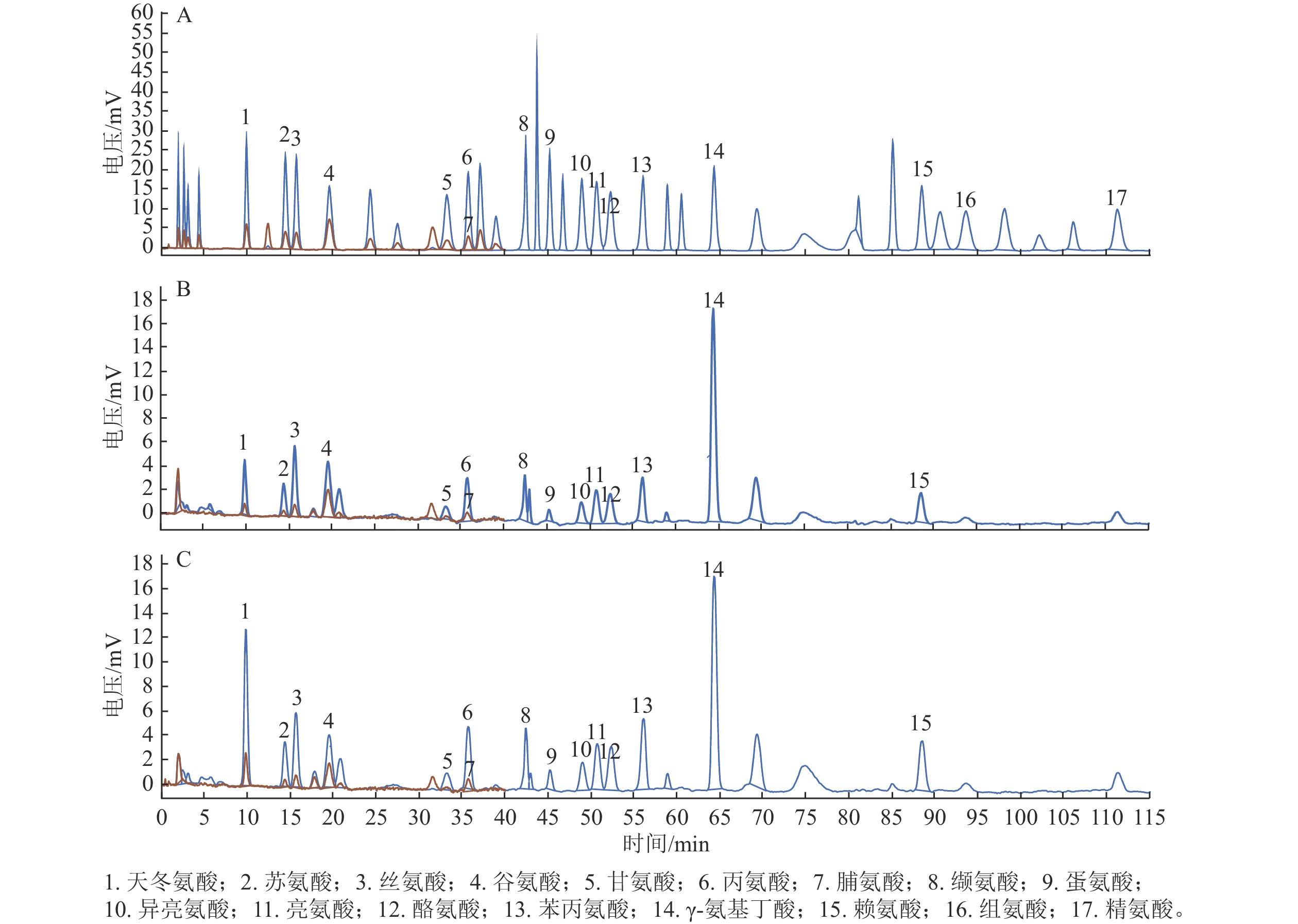
以17种游离氨基酸为对照,分别检测后熟过程中‘细榧’和‘象牙榧’种实的氨基酸组分。如图1所示:在‘细榧’和‘象牙榧’种实中氨基酸种类无差异,均检测到了包含天冬氨酸、苏氨酸等14种蛋白质氨基酸以及γ-氨基丁酸,但组氨酸和精氨酸未检出(表1和表2)。
图 1 17种氨基酸混标(A)、‘细榧’(B)与‘象牙榧’(C)种实后熟第0天氨基酸色谱图
Figure 1. 17 amino acid mixed standards (A), amino acid chromatograms of ‘Xi Fei’ (B) and ‘Xiangya Fei’ (C) on day 0 during post-ripening process
表 1 在后熟过程中‘细榧’和‘象牙榧’种实非必需氨基酸质量分数的变化
Table 1. Non-essential amino acid content of ‘Xi Fei’ and ‘Xiangya Fei’ seeds during post-ripening process
品种 时间/d 非必需氨基酸质量分数/(µg·g−1) 天冬氨酸 丝氨酸 谷氨酸 脯氨酸 甘氨酸 丙氨酸 酪氨酸 γ-氨基丁酸 总计 ‘细榧’ 0 40.90±1.15 c 46.37±2.56 b 72.80±5.89 de 44.01±7.91 a 9.43±0.65 b 29.90±1.43 cd 52.87±2.78 f 156.33±8.06 d 433.67±23.61 f 5 42.77±8.77 c 38.90±0.80 cd 89.63±2.79 bc 23.82±3.82 bc 30.20±6.22 a 28.87±2.21 d 114.67±4.99 d 320.00±24.91 a 665.03±36.97 cd 10 42.77±8.77 c 41.60±0.36 bcd 84.83±8.86 cde 14.03±4.24 c 32.73±5.89 a 35.13±0.69 bc 139.67±8.99 abc 331.67±21.70 a 731.30±28.72 abc 15 78.97±3.76 b 40.37±2.74 cd 72.47±5.42 de 15.23±0.97 c 32.07±5.53 a 34.93±3.46 bc 149.33±18.57 a 358.67±33.81 a 766.80±76.40 ab 20 79.27±6.31 b 36.57±1.03 d 81.20±2.97 cde 37.17±9.61 ab 33.47±4.18 a 30.80±0.59 cd 146.00±8.64 ab 353.67±14.50 a 798.13±19.70 a ‘象牙榧’ 0 106.23±8.32 a 51.53±1.67 a 71.97±5.15 e 40.77±8.34 a 12.63±1.24 b 40.53±1.10 a 72.30±5.46 ef 166.67±5.79 d 562.63±13.31 e 5 83.83±4.25 b 38.87±1.95 cd 87.70±13.71 bcd 42.77±7.89 a 26.40±0.45 a 34.60±2.32 bc 79.27±5.78 e 225.33±3.86 c 618.77±39.21 de 10 102.37±4.88 a 42.53±1.46 bc 92.63±5.24 bc 36.37±7.33 ab 29.43±1.00 a 33.27±1.09 cd 104.57±7.73 d 263.67±9.74 bc 704.83±27.31 bc 15 121.67±2.05 a 38.17±5.45 cd 100.20±2.29 b 42.47±7.98 a 26.33±4.22 a 39.03±4.71 ab 117.67±7.32 cd 270.33±16.74 b 755.86±21.37 abc 20 121.00±11.43 a 36.80±2.55 cd 119.33±6.13 a 22.40±12.01 bc 34.30±6.64 a 30.10±0.08 cd 124.67±19.62 bcd 255.67±30.71 bc 744.27±75.48 abc 说明:数值为平均值±标准差。不同小写字母表示‘细榧’和‘象牙榧’在同一物质不同后熟时间间差异显著(P<0.05)。 表 2 在后熟过程中‘细榧’和‘象牙榧’种实必需氨基酸质量分数的变化
Table 2. Essential amino acid content of ‘Xi Fei’ and ‘Xiangya Fei’ seeds during post-ripening process
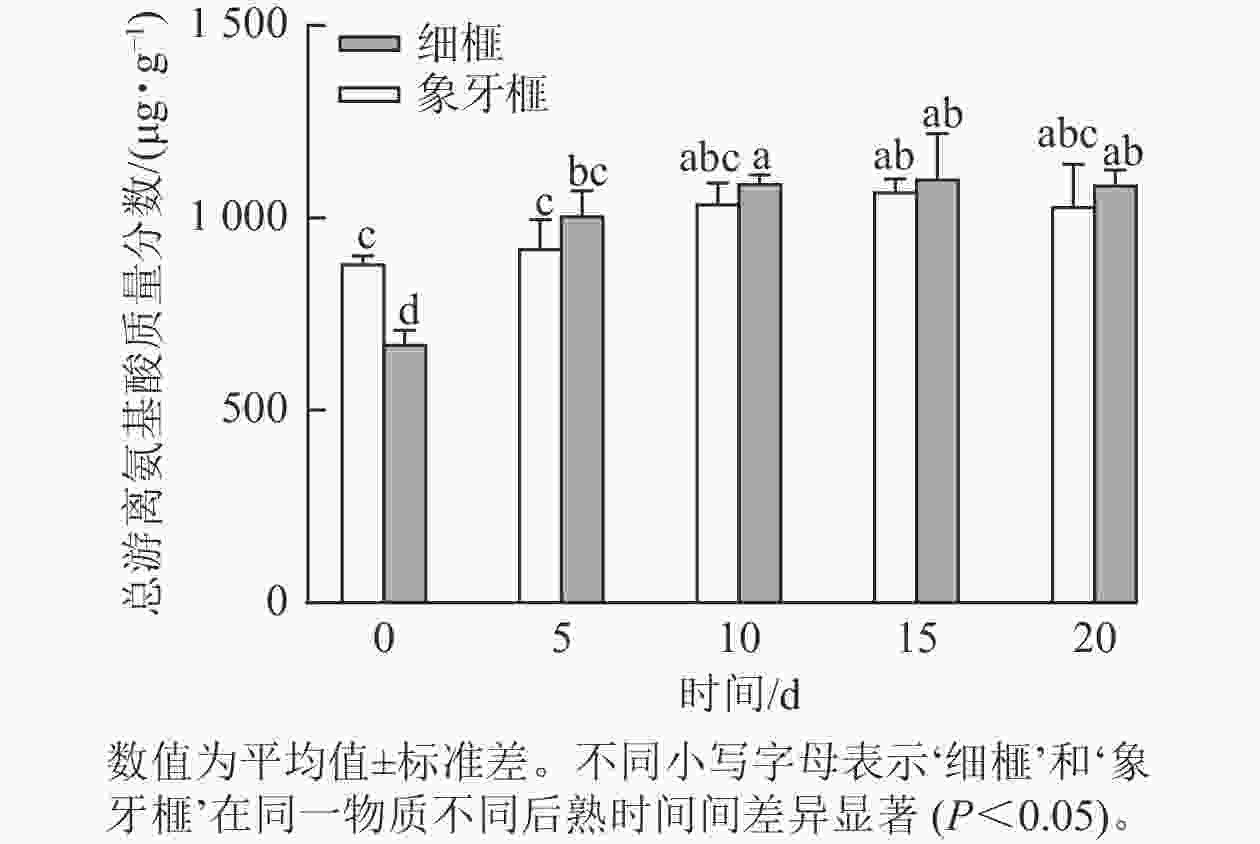
品种 时间/d 必需氨基酸质量分数/(µg·g−1) 苏氨酸 缬氨酸 蛋氨酸 异亮氨酸 亮氨酸 苯丙氨酸 赖氨酸 总计 ‘细榧’ 0 23.37±1.34 b 28.63±2.43 c 10.07±1.11 cd 24.13±0.17 d 37.97±0.87 cd 57.80±2.38 d 38.53±3.82 b 220.50±14.06 c 5 35.63±2.47 a 44.23±4.76 ab 10.23±0.45 cd 31.70±2.49 abc 44.57±5.82 abcd 89.60±6.73 a 62.33±2.36 a 318.30±27.81 ab 10 38.83±2.25 a 48.60±2.29 a 11.97±0.88 bc 34.73±2.41 ab 48.87±5.57 ab 89.53±1.30 a 72.23±2.15 a 344.77±19.50 a 15 37.43±3.60 a 47.43±4.92 a 9.63±0.74 cd 34.60±3.60 ab 41.73±6.21 abcd 82.07±7.93 ab 67.43±7.71 a 320.33±40.59 ab 20 34.47±2.13 a 44.73±4.72 a 8.20±0.00 de 29.03±1.80 c 36.67±2.32 d 73.00±2.44 bc 63.07±5.31 a 289.17±18.78 b ‘象牙榧’ 0 33.93±0.85 a 37.13±1.90 b 16.00±0.67 a 29.97±0.54 bc 48.67±2.38 abc 87.93±5.41 a 65.50±2.09 a 319.13±8.33 ab 5 34.40±1.24 a 41.60±1.55 ab 11.37±2.38 bc 32.30±2.34 abc 45.63±2.00 abcd 77.33±10.14 abc 59.87±10.17 a 302.50±35.60 ab 10 37.17±1.23 a 47.63±1.28 a 12.70±1.39 b 36.30±2.48 a 51.63±3.41 a 80.73±3.80 ab 67.57±7.62 a 333.73±24.24 ab 15 38.30±1.44 a 48.00±1.14 a 10.30±0.49 cd 35.80±0.41 a 43.07±8.13 abcd 71.00±2.62 bc 66.60±2.87 a 313.07±16.31 ab 20 34.20±3.47 a 43.43±3.52 ab 7.03±0.40 e 32.67±3.18 abc 38.50±3.24 bcd 65.10±7.86 cd 65.17±7.85 a 286.10±33.01 b 说明:数值为平均值±标准差。不同小写字母表示‘细榧’和‘象牙榧’在同一物质不同后熟时间间差异显著(P<0.05)。 根据标准曲线计算得到每种氨基酸的质量分数,结果显示:2个品种种实在后熟过程中的总游离氨基酸质量分数均显著(P<0.05)增加,‘细榧’种实的总游离氨基酸质量分数为673.11~1 102.36 µg·g−1,‘象牙榧’种实为881.77~1 068.93 µg·g−1(图2)。后熟过程开始后,‘细榧’和‘象牙榧’种实总非必需氨基酸质量分数显均呈现上升趋势,‘细榧’在第20天积累达到最多,而‘象牙榧’种实则在第15天达时达到最大值后下降(表1)。‘细榧’种实总必需氨基酸质量分数显著高于‘象牙榧’(P<0.05,表2),然而,‘细榧’种实总必需氨基酸占比(26.59%~32.76%)却小于‘象牙榧’的占比(27.77%~36.19%)。在这2个品种中,γ-氨基丁酸质量分数最高,其次是谷氨酸和酪氨酸。γ-氨基丁酸在后熟过程中显著积累,且在第20天‘细榧’种实中γ-氨基丁酸质量分数为‘象牙榧’的1.38倍。
-
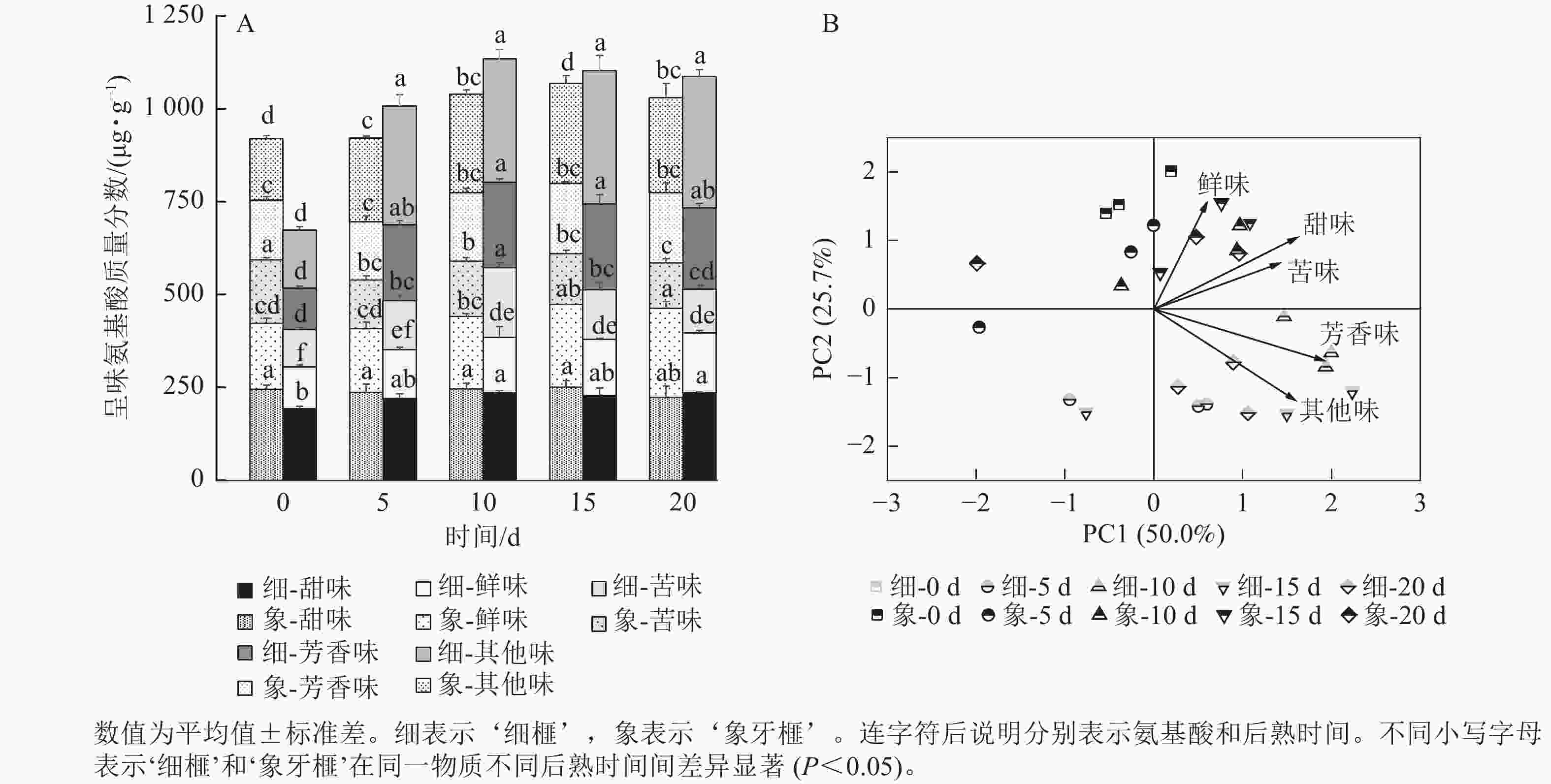
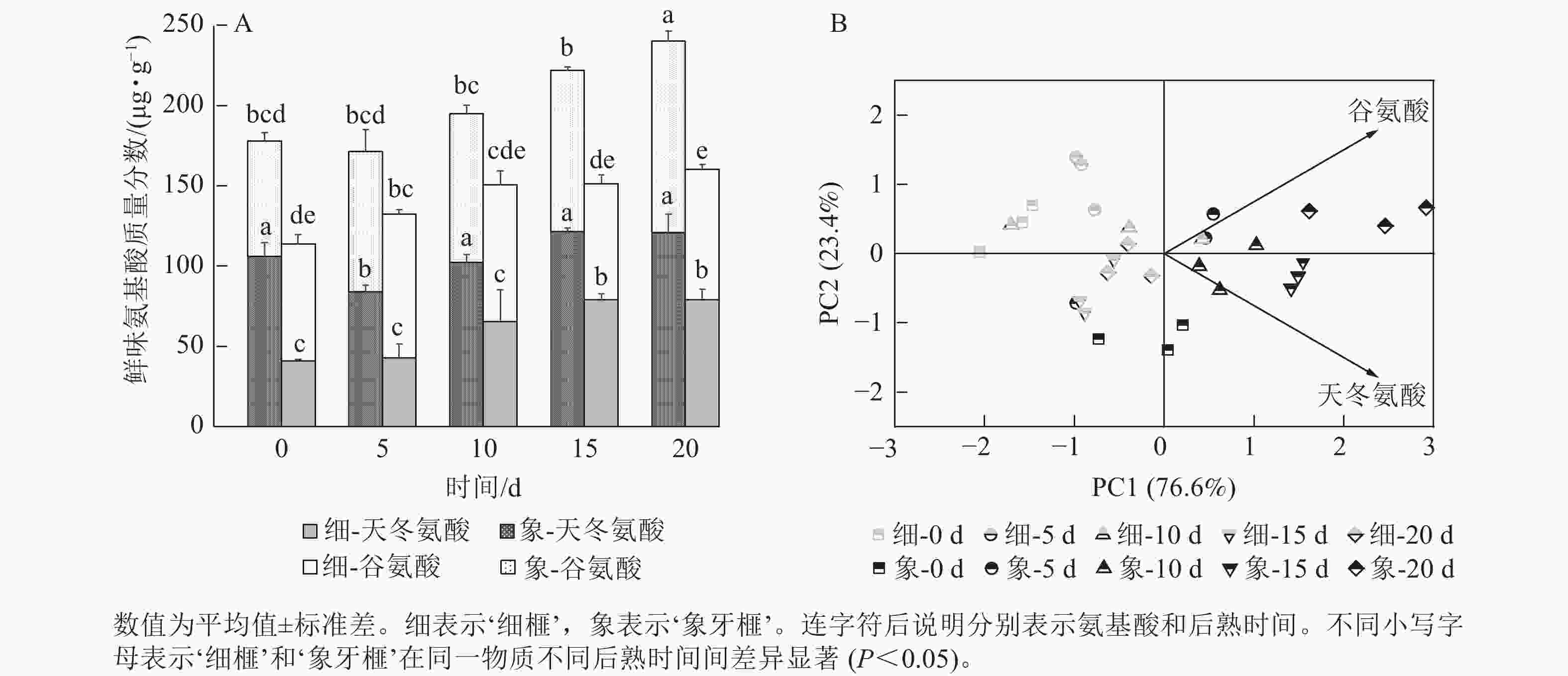
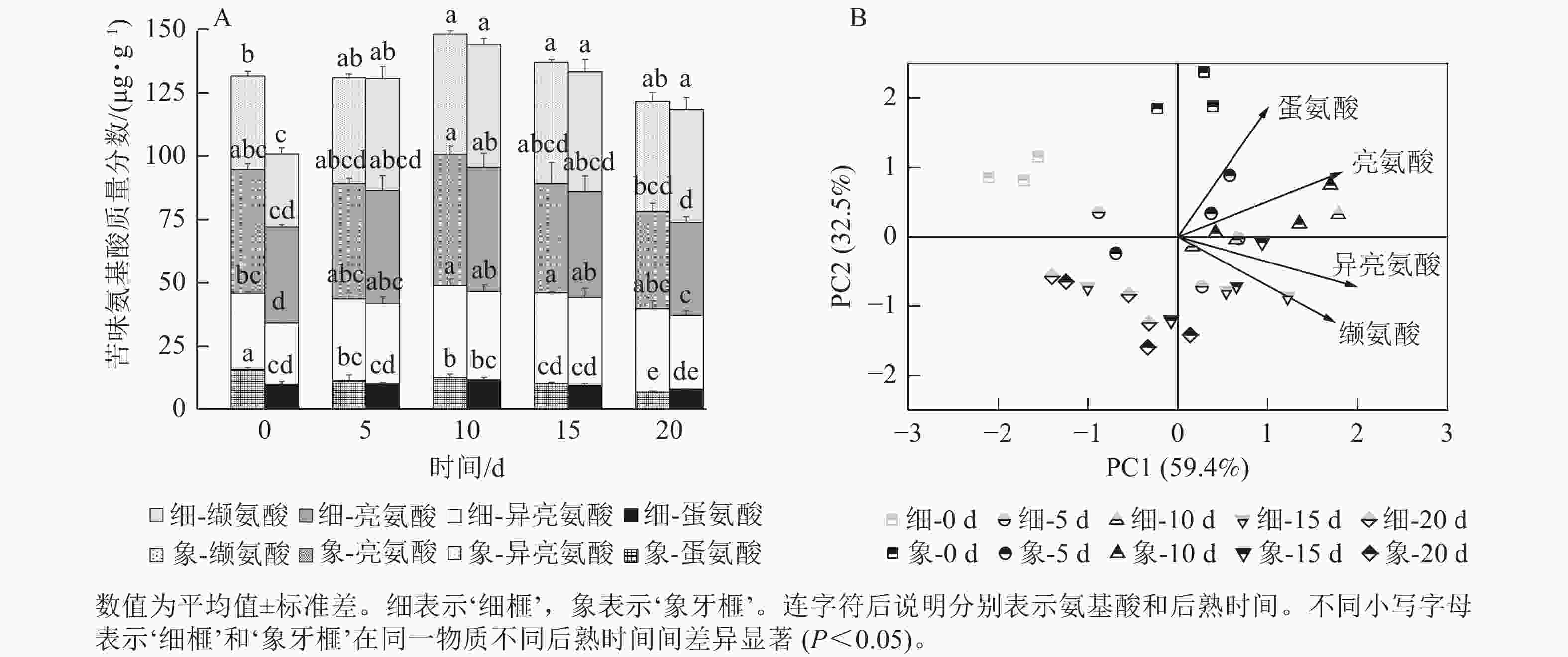
甜味氨基酸包括脯氨酸、赖氨酸、丙氨酸、甘氨酸、丝氨酸和苏氨酸;芳香味氨基酸包括酪氨酸和苯丙氨酸;鲜味氨基酸包括谷氨酸和天冬氨酸;苦味氨基酸包括蛋氨酸、亮氨酸、异亮氨酸和缬氨酸。在‘细榧’和‘象牙榧’种实中,总呈味氨基酸的质量分数从大到小排序为甜味氨基酸>芳香族氨基酸>鲜味氨基酸>苦味氨基酸。鲜味氨基酸在‘象牙榧’种实中的占比高于‘细榧’,而芳香族氨基酸占比则相反,即在‘细榧’种实中的占比高于‘象牙榧’(图3A)。PCA结果(图3B)显示:鲜味、甜味、苦味和芳香族氨基酸在这2个品种中显示出明显的分离,且‘细榧’种实具有较高的芳香族氨基酸,而‘象牙榧’种实具有较高的鲜味氨基酸和甜味氨基酸。
-
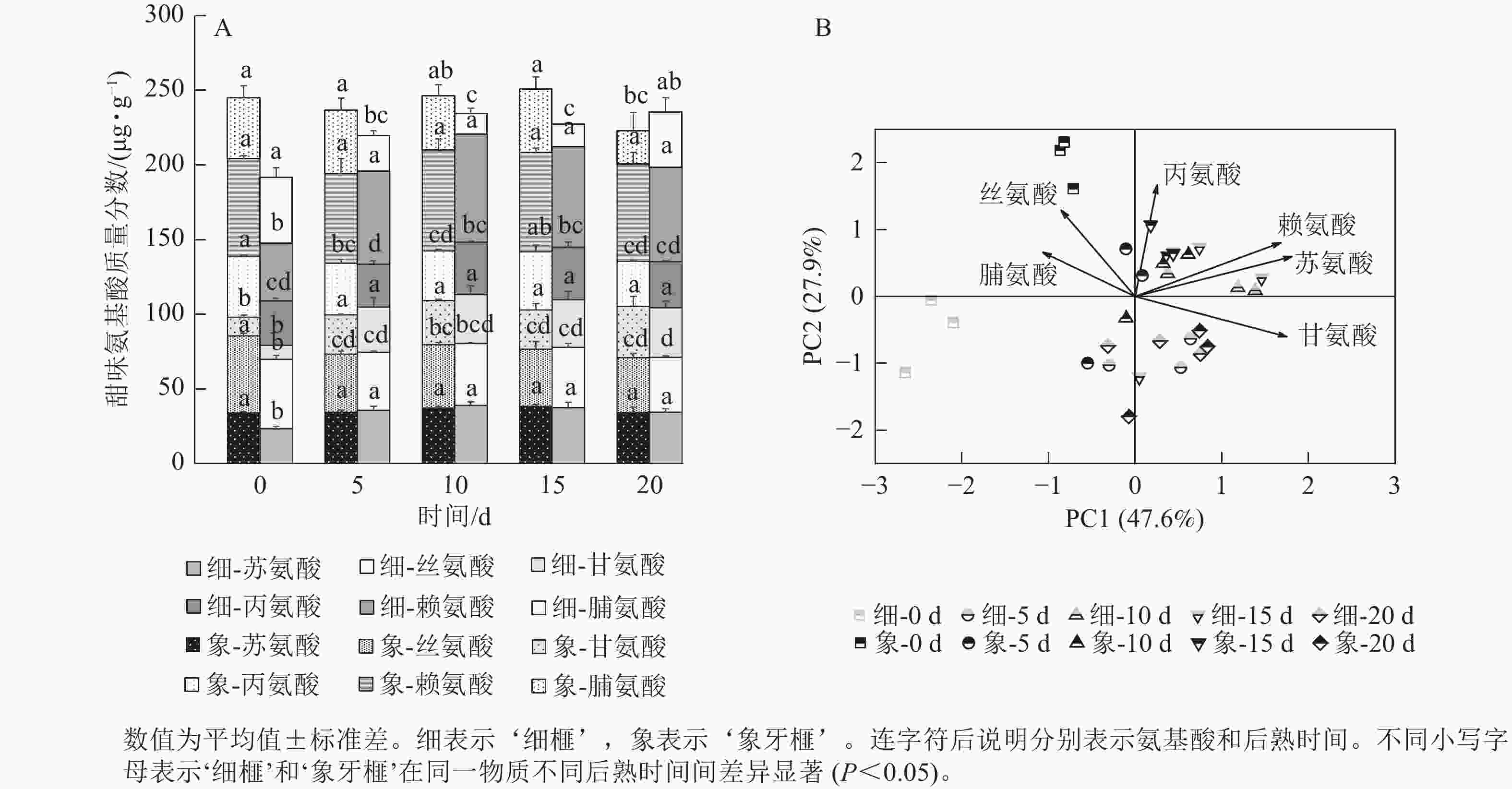
在后熟过程中,‘细榧’种实的总甜味氨基酸质量分数无显著变化,在第20天时最高,为235.53 µg·g−1;‘象牙榧’种实的总甜味氨基酸逐渐积累,在第15天时达到最大值,为250.89 µg·g−1(图4A)。在‘象牙榧’种实中,赖氨酸的质量分数最高,在‘细榧’中,赖氨酸逐渐积累且在第15天达到最高。PCA结果(图4B)显示:2个品种种实的甜味氨基酸在第0天差异明显,其中丝氨酸在‘象牙榧’中的贡献较大。随着后熟时间的推移,2个品种的甜味氨基酸质量分数差异不明显。
-
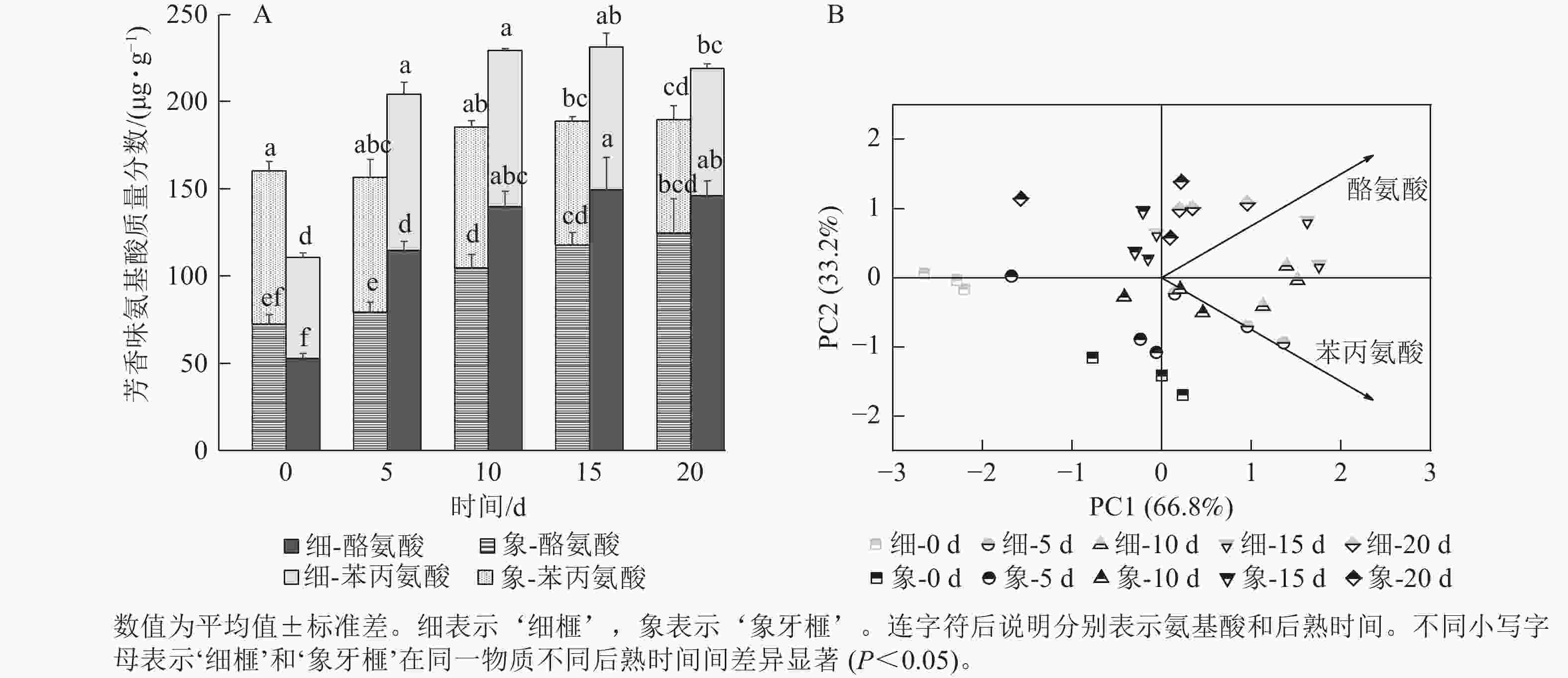
如图5A所示:后熟第0天时,‘细榧’种实的芳香族氨基酸质量分数低于‘象牙榧’。在后熟过程中,2个品种种实的芳香族氨基酸质量分数均呈上升趋势,但‘象牙榧’到第10天后趋于稳定,不再增加,而‘细榧’仍不断增加,在第15天达到最大值,且高于‘象牙榧’。‘细榧’种实的芳香族氨基酸质量分数介于110.67~231.40 µg·g−1,‘象牙榧’则介于156.60~189.77 µg·g−1。苯丙氨酸和酪氨酸是构成香榧芳香族氨基酸的重要成分,其中酪氨酸在后熟过程中质量分数增加更为显著,这2种氨基酸都对‘细榧’种实后熟过程中芳香味的形成有较大贡献(图5B)。
-
在后熟过程中,2个品种种实总鲜味氨基酸质量分数的变化趋势与芳香族氨基酸相似,均呈上升的趋势。然而,‘象牙榧’种实的鲜味氨基酸质量分数在整个后熟期间始终高于‘细榧’,特别是在后熟的第20天时,‘象牙榧’种实的鲜味氨基酸质量分数比‘细榧’高79.86 µg·g−1(图6A)。谷氨酸和天冬氨酸是构成香榧鲜味氨基酸的关键成分,均在后熟过程中逐渐积累。相比而言,‘细榧’种实的谷氨酸变化较小,这说明天冬氨酸可能是影响‘细榧’鲜味变化的主要因素。而在‘象牙榧’种实中,天冬氨酸和谷氨酸的质量分数则相对接近。PCA结果(图6B)进一步显示:谷氨酸和天冬氨酸均对‘象牙榧’种实在后熟过程中的鲜味有着较大的贡献。
-
如图7A所示:‘细榧’和‘象牙榧’的苦味氨基酸质量分数接近,在后熟过程中的变化趋势也相似,均在后熟第10天达到最高值,后逐渐降低。亮氨酸、异亮氨酸和缬氨酸占‘细榧’和‘象牙榧’苦味氨基酸的90%。2个品种在PCA分析(图7B)中呈现一定的分离,说明2个品种在后熟过程中苦味氨基酸组成的变化模式存在差异,其中亮氨酸和蛋氨酸对‘象牙榧’种实苦味贡献较大。
-
近年来,香榧坚果因其高营养价值和独特风味,深受消费者青睐[19]。本研究发现:香榧种实中总游离氨基酸质量分数为673.11~
1102.36 µg·g−1,均值为991.06 µg·g−1,低于核桃,但高于山核桃Carya cathayensis和巴西松子Araucaria angustifolia [12]。香榧中的氨基酸组成与联合国粮食及农业组织/世界卫生组织(FAO/WHO)推荐的理想模式非常接近,易被人体吸收利用[2]。本研究检测到15种游离氨基酸,与ZHANG等[10]的研究相比,相差2种,可能是由于香榧品种及产地的不同,造成氨基酸组成成分和质量分数的差异。在后熟过程中,2个品种种实的游离氨基酸质量分数均显著提高,‘细榧’种实的整体游离氨基酸质量分数高于‘象牙榧’。其中,质量分数较高的氨基酸从高到低依次为γ-氨基丁酸、酪氨酸、天冬氨酸和谷氨酸。这些氨基酸不仅对香榧的营养价值有重要贡献,还通过参与美拉德反应等化学反应,生成多种风味化合物[20],能显著提升香榧的风味品质。已有研究表明:天冬氨酸能改善心肌收缩功能、促进能量代谢、保护线粒体功能以及降低缺血性心脏病风险[21−22]。谷氨酸作为中枢神经系统中主要的兴奋性神经递质[23],参与神经信号传递,调节学习和记忆功能[24]。酪氨酸作为芳香族氨基酸,与降低血压相关,尤其是在高血压患者中,其水平与心血管健康指标之间存在关联[25]。质量分数最高的γ-氨基丁酸能通过调节自主神经系统[26],降低血压[27]。这说明后熟过程不仅能提升香榧的氨基酸质量分数,还能优化其营养成分。
氨基酸的多样性和组成差异是香榧独特口感的重要基础[28]。呈味氨基酸在食物的风味调节中发挥重要作用,它们赋予食品甜味、鲜味和苦味等多种风味特征,显著影响食品的整体风味和决定食品的可接受性[29]。在种实后熟过程中香榧的游离氨基酸,特别是鲜味和芳香族氨基酸的积累,显著提升了香榧的风味品质。本研究发现:香榧中各类呈味氨基酸的质量分数从高到低排序为:甜味>芳香族>鲜味>苦味。‘细榧’种实中γ-氨基丁酸与酪氨酸质量分数较高,芳香风味更突出。有研究表明:在柑橘Citrus中,酪氨酸和苯丙氨酸也是重要的芳香味氨基酸,是柑橘风味多样性的重要来源[30]。酪氨酸和苯丙氨酸会通过参与挥发性化合物的合成,影响果实的香气特征[31]。‘象牙榧’种实因天冬氨酸与谷氨酸质量分数高,鲜味更足。谷氨酸具有明显的鲜味,是发酵食物和调味品中最丰富的氨基酸,也是其中最重要的风味成分物质[32],间接影响蔬菜的风味形成[33]。番茄Solanum lycopersicum中的谷氨酸和天冬氨酸为它提供了特有的鲜味,其含量随着果实成熟逐渐增加,有助于番茄果实风味的形成[34]。综上,后熟过程使香榧种实具有了不同于其他坚果的独特呈味。
-
本研究结果显示:香榧不同品种种实的氨基酸组成和质量分数存在较大差异,在香榧种实的后熟过程中,游离氨基酸质量分数逐渐增加,‘细榧’和‘象牙榧’种实氨基酸差异主要体现在芳香族氨基酸和鲜味氨基酸上。未来可进一步优化检测方法,深入研究不同香榧品种种实游离氨基酸差异的形成机制,并结合转录组分析不同香榧品种后熟过程中氨基酸合成代谢机制。
Differences in free amino acids during post-ripening process of Torreya grandis ‘Xi Fei’ and ‘Xiangya Fei’ seeds
-
摘要:
目的 旨在探究不同香榧Torreya grandis ‘Merrilii’品种在后熟过程中游离氨基酸质量分数的变化及其品种间差异,为香榧品种的品质评估和种质创新提供科学参考。 方法 采用全自动氨基酸分析仪,对后熟过程中 ‘细榧’T. grandis ‘Xi Fei’和‘象牙榧’T. grandis ‘Xiangya Fei’种实的游离氨基酸质量分数进行测定,并结合主成分分析法,揭示了2种香榧在后熟过程中总游离氨基酸、必需氨基酸和呈味氨基酸的具体差异。 结果 在后熟过程中,‘细榧’和‘象牙榧’种实均检测到了15种常见游离氨基酸。其中,‘细榧’种实总游离氨基酸质量分数为673.11~ 1102.36 µg·g−1,‘象牙榧’种实总游离氨基酸质量分数为881.7 ~1 068.93 µg·g−1,且‘细榧’种实中必需氨基酸和非必需氨基酸的质量分数均显著高于‘象牙榧’。主成分分析进一步揭示了香榧2个品种在主要呈味氨基酸的差异,‘细榧’芳香族氨基酸质量分数更高,更具香气;而‘象牙榧’鲜味氨基酸质量分数较高,其口感鲜美。结论 不同香榧品种的氨基酸质量分数和组成存在较大差异。后熟过程不仅提升了香榧的游离氨基酸质量分数,还提升了‘细榧’和‘象牙榧’种实的风味,使2个品种更具自身特色。图7表2参34 Abstract:Objective This study aims to investigate the changes in free amino acid content during post-ripening process of different Torreya grandis ‘Merrilii’ cultivars and the differences among cultivars, providing a scientific reference for quality assessment and germplasm innovation of T. grandis ‘Merrilii’ cultivars. Method The automatic amino acid analyzer was used to measure the free amino acid content in the seeds of ‘Xi Fei’ and ‘Xiangya Fei’ during post-ripening process. Combined with principal component analysis (PCA), the specific differences in total free amino acids, essential amino acids and flavor amino acids between the two cultivars during post-ripening process were systematically revealed. Result Fifteen common free amino acids were detected in both ‘Xi Fei’ and ‘Xiangya Fei’ seeds throughout the ripening process. Specifically, the total free amino acid content ranged from 673.11 to 1 102.36 µg·g−1 in ‘Xi Fei’ and from 881.77 to 1 068.93 µg·g−1 in ‘Xiangya Fei’. Notably, the contents of both essential and non-essential amino acids were significantly higher in ‘Xi Fei’ seeds compared to ‘Xiangya Fei’. PCA further highlighted the differences in major flavor amino acids between the two cultivars, with ‘Xi Fei’ exhibiting prominent aromatic amino acids, contributing to its aromatic character, while ‘Xiangya Fei’ showed significant umami amino acids, enhancing its delicious taste. Conclusion Considerable variations exist in the amino acid content and composition among different T. grandis ‘Merrilii’ cultivars. The ripening process not only increases the amino acid content and nutritional value of the seeds but also enhances the flavor characteristics of both cultivars, making them more distinctive in their own right. [Ch, 7 fig. 2 tab. 34 ref.] -
表 1 在后熟过程中‘细榧’和‘象牙榧’种实非必需氨基酸质量分数的变化
Table 1. Non-essential amino acid content of ‘Xi Fei’ and ‘Xiangya Fei’ seeds during post-ripening process
品种 时间/d 非必需氨基酸质量分数/(µg·g−1) 天冬氨酸 丝氨酸 谷氨酸 脯氨酸 甘氨酸 丙氨酸 酪氨酸 γ-氨基丁酸 总计 ‘细榧’ 0 40.90±1.15 c 46.37±2.56 b 72.80±5.89 de 44.01±7.91 a 9.43±0.65 b 29.90±1.43 cd 52.87±2.78 f 156.33±8.06 d 433.67±23.61 f 5 42.77±8.77 c 38.90±0.80 cd 89.63±2.79 bc 23.82±3.82 bc 30.20±6.22 a 28.87±2.21 d 114.67±4.99 d 320.00±24.91 a 665.03±36.97 cd 10 42.77±8.77 c 41.60±0.36 bcd 84.83±8.86 cde 14.03±4.24 c 32.73±5.89 a 35.13±0.69 bc 139.67±8.99 abc 331.67±21.70 a 731.30±28.72 abc 15 78.97±3.76 b 40.37±2.74 cd 72.47±5.42 de 15.23±0.97 c 32.07±5.53 a 34.93±3.46 bc 149.33±18.57 a 358.67±33.81 a 766.80±76.40 ab 20 79.27±6.31 b 36.57±1.03 d 81.20±2.97 cde 37.17±9.61 ab 33.47±4.18 a 30.80±0.59 cd 146.00±8.64 ab 353.67±14.50 a 798.13±19.70 a ‘象牙榧’ 0 106.23±8.32 a 51.53±1.67 a 71.97±5.15 e 40.77±8.34 a 12.63±1.24 b 40.53±1.10 a 72.30±5.46 ef 166.67±5.79 d 562.63±13.31 e 5 83.83±4.25 b 38.87±1.95 cd 87.70±13.71 bcd 42.77±7.89 a 26.40±0.45 a 34.60±2.32 bc 79.27±5.78 e 225.33±3.86 c 618.77±39.21 de 10 102.37±4.88 a 42.53±1.46 bc 92.63±5.24 bc 36.37±7.33 ab 29.43±1.00 a 33.27±1.09 cd 104.57±7.73 d 263.67±9.74 bc 704.83±27.31 bc 15 121.67±2.05 a 38.17±5.45 cd 100.20±2.29 b 42.47±7.98 a 26.33±4.22 a 39.03±4.71 ab 117.67±7.32 cd 270.33±16.74 b 755.86±21.37 abc 20 121.00±11.43 a 36.80±2.55 cd 119.33±6.13 a 22.40±12.01 bc 34.30±6.64 a 30.10±0.08 cd 124.67±19.62 bcd 255.67±30.71 bc 744.27±75.48 abc 说明:数值为平均值±标准差。不同小写字母表示‘细榧’和‘象牙榧’在同一物质不同后熟时间间差异显著(P<0.05)。 表 2 在后熟过程中‘细榧’和‘象牙榧’种实必需氨基酸质量分数的变化
Table 2. Essential amino acid content of ‘Xi Fei’ and ‘Xiangya Fei’ seeds during post-ripening process
品种 时间/d 必需氨基酸质量分数/(µg·g−1) 苏氨酸 缬氨酸 蛋氨酸 异亮氨酸 亮氨酸 苯丙氨酸 赖氨酸 总计 ‘细榧’ 0 23.37±1.34 b 28.63±2.43 c 10.07±1.11 cd 24.13±0.17 d 37.97±0.87 cd 57.80±2.38 d 38.53±3.82 b 220.50±14.06 c 5 35.63±2.47 a 44.23±4.76 ab 10.23±0.45 cd 31.70±2.49 abc 44.57±5.82 abcd 89.60±6.73 a 62.33±2.36 a 318.30±27.81 ab 10 38.83±2.25 a 48.60±2.29 a 11.97±0.88 bc 34.73±2.41 ab 48.87±5.57 ab 89.53±1.30 a 72.23±2.15 a 344.77±19.50 a 15 37.43±3.60 a 47.43±4.92 a 9.63±0.74 cd 34.60±3.60 ab 41.73±6.21 abcd 82.07±7.93 ab 67.43±7.71 a 320.33±40.59 ab 20 34.47±2.13 a 44.73±4.72 a 8.20±0.00 de 29.03±1.80 c 36.67±2.32 d 73.00±2.44 bc 63.07±5.31 a 289.17±18.78 b ‘象牙榧’ 0 33.93±0.85 a 37.13±1.90 b 16.00±0.67 a 29.97±0.54 bc 48.67±2.38 abc 87.93±5.41 a 65.50±2.09 a 319.13±8.33 ab 5 34.40±1.24 a 41.60±1.55 ab 11.37±2.38 bc 32.30±2.34 abc 45.63±2.00 abcd 77.33±10.14 abc 59.87±10.17 a 302.50±35.60 ab 10 37.17±1.23 a 47.63±1.28 a 12.70±1.39 b 36.30±2.48 a 51.63±3.41 a 80.73±3.80 ab 67.57±7.62 a 333.73±24.24 ab 15 38.30±1.44 a 48.00±1.14 a 10.30±0.49 cd 35.80±0.41 a 43.07±8.13 abcd 71.00±2.62 bc 66.60±2.87 a 313.07±16.31 ab 20 34.20±3.47 a 43.43±3.52 ab 7.03±0.40 e 32.67±3.18 abc 38.50±3.24 bcd 65.10±7.86 cd 65.17±7.85 a 286.10±33.01 b 说明:数值为平均值±标准差。不同小写字母表示‘细榧’和‘象牙榧’在同一物质不同后熟时间间差异显著(P<0.05)。 -
[1] 黎章矩, 戴文圣. 中国香榧[M]. 北京: 科学出版社, 2007. LI Zhangju, DAI Wensheng. Torreya grandis in China[M]. Beijing: Science Press, 2007. [2] 徐立伟, 马佳慧, 于淼. 香榧的营养和功能成分研究进展[J]. 食品工业, 2020, 41(8): 210−214. XU Liwei, MA Jiahui, YU Miao. Advances in the nutritional and functional ingredients of Torreya grandis [J]. The Food Industry, 2020, 41(8): 210−214. [3] 叶珊, 王为宇, 周敏樱, 等. 不同采收成熟度和堆沤方式对香榧种子堆沤后熟品质的影响[J]. 林业科学, 2017, 53(11): 43−51. YE Shan, WANG Weiyu, ZHOU Minying, et al. Effects of different harvest maturity and after-ripening ways on the harvested quality of Torreya grandis ‘Merrillii’ seeds [J]. Scientia Silvae Sinicae, 2017, 53(11): 43−51. [4] SONG Lili, MENG Xuecheng, SONG Hanbing, et al. A comprehensive metabolomics analysis of Torreya grandis nuts with the effective de-astringent treatment during the postharvest ripening stage[J/OL]. Food Chemistry, 2023, 398 : 133859[2025-03-01]. DOI: 10.1016/j.foodchem.2022.133859. [5] LING Zhenan, JIANG Yifan, RU Junnan, et al. Amino acid metabolism in health and disease[J/OL]. Signal Transduction and Targeted Therapy, 2023, 8 : 345[2025-01-01]. DOI: 10.1038/s41392-023-01569-3. [6] HU Songhe, LI Kaifeng, ZHANG Xing, et al. The impact of the foliar application of amino acid aqueous fertilizer on the flavor of potato tubers[J/OL]. Foods, 2023, 12 (21): 3951[2025-01-01]. DOI: 10.3390/foods12213951. [7] GABRIEL A, NINOMIYA K, UNEYAMA H. The role of the Japanese traditional diet in healthy and sustainable dietary patterns around the world[J/OL]. Nutrients, 2018, 10 (2): 173[2025-01-01]. DOI: 10.3390/nu10020173. [8] 卢柏山, 董会, 赵久然, 等. 不同鲜食玉米品种适采期氨基酸含量分析[J]. 中国农业科技导报, 2023, 25(11): 132−142. LU BaiShan, DONG Hui, ZHAO Jiuran, et al. Amino acid content analysis of different fresh corn varieties at suitable harvest time [J]. Journal of Agricultural Science and Technology, 2023, 25(11): 132−142. [9] 魏光强, 李子怡, 黄艾祥, 等. 基于游离氨基酸、挥发性组分和感官评价的2种酸化技术加工乳饼的滋味特征差异分析[J]. 食品科学, 2021, 42(22): 263−269. WEI Guangqiang, LI Ziyi, HUANG Aixiang, et al. Differential taste characteristics of milk cakes processed by two acidification methods revealed by free amino acids, volatile compounds and sensory evaluation [J]. Food Science, 2021, 42(22): 263−269. [10] ZHANG Zuying, CHEN Wenchao, TAO Liu, et al. Ethylene treatment promotes umami taste-active amino acids accumulation of Torreya grandis nuts post-harvest by comparative chemical and transcript analyses[J/OL]. Food Chemistry, 2023, 408 : 135214[2025-01-01]. DOI: 10.1016/j.foodchem.2022.135214. [11] 姜仲茂, 乌云塔娜, 王森, 等. 不同产地野生长柄扁桃仁氨基酸组成及营养价值评价[J]. 食品科学, 2016, 37(4): 77−82. JIANG Zhongmao, WU Yuntana, WANG Sen, et al. Amino acid composition and nutritional quality evaluation of wild Amygdalus pedunculatus pall. kernels from different growing regions [J]. Food Science, 2016, 37(4): 77−82. [12] 高桂琴, 赵雪娇, 仲昭欣, 等. 15种坚果果仁氨基酸组成及含量差异分析[J]. 食品安全质量检测学报, 2020, 11(4): 1173−1179. GAO Guiqin, ZHAO Xuejiao, ZHONG Zhaoxin, et al. Analysis onthe difference of amino acid composition and concentrations in 15 kinds of nut [J]. Journal of Food Safety & Quality, 2020, 11(4): 1173−1179. [13] 刘华, 王倩, 秦利, 等. 花生野生种核型与氨基酸组分分析 [J/OL]. 中国油料作物学报, 2024-12-16[2025-01-01]. DOI: 10.19802/j. issn. 1007-9084.2024269. LIU Hua, WANG Qian, QIN Li, et al. Karyotypes and amino acid component analysis of Arachis species [J/OL]. Chinese Journal of Oil Crops, 2024-12-16[2025-01-01]. DOI: 10.19802/j.issn.1007-9084.2024269. [14] 魏雅静. 平欧榛子蛋白及其组分的氨基酸组成分析及营养评价[J]. 食品工业, 2022, 43(2): 334−338. WEI Yajing. Analysis of amino acid composition and nutritional evaluation of flat-European hybrid hazelnut protein and its components [J]. The Food Industry, 2022, 43(2): 334−338. [15] 胡芳名, 丁之恩. 黄山不同类型香榧品质研究[J]. 中南林学院学报, 2003, 23(4): 1−4. HU Fangming, DING Zhien. Quality studies of three types of Huangshan Chinese Torreya [J]. Journal of Central South Forestry University, 2003, 23(4): 1−4. [16] HUANG Zicheng, DU Meijun, QIAN Xueqin, et al. Oxidative stability, shelf-life and stir-frying application of Torreya grandis seed oil [J]. International Journal of Food Science & Technology, 2022, 57(3): 1836−1845. [17] 于美, 张川, 曾茂茂, 等. 香榧坚果中油脂和蛋白质的研究进展[J]. 食品科学, 2016, 37(17): 252−256. YU Mei, ZHANG Chuan, ZENG Maomao, et al. Recent advances in research on oils and proteins from Torreya grandis nuts [J]. Food Science, 2016, 37(17): 252−256. [18] 张涛, 宋海云, 贺鹏, 等. 不同澳洲坚果种质果仁氨基酸组成分析与评价[J]. 中国农业科技导报, 2022, 24(1): 119−127. ZHANG Tao, SONG Haiyun, HE Peng, et al. Analysis and evaluation of amino acid composition in different Macadamia ternifolia germplasm [J]. Journal of Agricultural Science and Technology, 2022, 24(1): 119−127. [19] 刘惠红, 马晓芸, 刘书涵, 等. 浙江省诸暨市香榧产业发展研究[J]. 农村经济与科技, 2024, 35(11): 90−93. LIU Huihong, MA Xiaoyun, LIU Shuhan, et al. Study on the development of Torreya grandis industry in Zhuji City, Zhejiang Province [J]. Rural Economy and Science-Technology, 2024, 35(11): 90−93. [20] 邢通, 王成赞, 张林, 等. 鸡肉风味物质的影响因素及其营养调控研究进展[J]. 动物营养学报, 2021, 33(6): 3028−3035. XING Tong, WANG Chengzan, ZHANG Lin, et al. Research advance of factors affecting chicken meat flavor and its nutritional regulation [J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3028−3035. [21] WENG S F, KAI J, GUHA I N, et al. The value of aspartate aminotransferase and alanine aminotransferase in cardiovascular disease risk assessment[J/OL]. Open Heart, 2015, 2 (1): e000272[2025-01-01]. DOI: 10.1136/openhrt-2015-000272. [22] ZHAO J V, KWOK M K, SCHOOLING C M. Effect of glutamate and aspartate on ischaemic heart disease, blood pressure, and diabetes: a Mendelian randomisation study [J]. American Journal of Clinical Nutrition, 2019, 109(4): 1197−1206. [23] PLATT S R. The role of glutamate in central nervous system health and disease–a review [J]. The Veterinary Journal, 2007, 173(2): 278−286. [24] CHEN T J, KUKLEY M. Glutamate receptors and glutamatergic signalling in the peripheral nerves [J]. Neural Regeneration Research, 2020, 15(3): 438−447. [25] FRANKLIN L F D. Structural characterization of tyrosinases and an update on human enzymes [M]// SUPURAN C T, The Enzymes: Vol. 56. Amsterdam: Elsevier, 2024: 55−83. [26] ALMUTAIRI S, SIVADAS A, KWAKOWSKY A. The effect of oral GABA on the nervous system: potential for therapeutic intervention [J]. Nutraceuticals, 2024, 4(2): 241−259. [27] XIE Mengqing, QIN Hao, LIU Li, et al. GABA regulates metabolic reprogramming to mediate the development of brain metastasis in non-small cell lung cancer[J/OL]. Journal of Experimental & Clinical Cancer Research, 2025, 44 (1): 61[2025-01-01]. DOI: 10.1186/s13046-025-03315-9. [28] 杨春霞, 开建荣, 马桂娟, 等. 枸杞鲜果呈味氨基酸含量组成、呈味特征及主成分分析[J]. 中国食品添加剂, 2024, 35(9): 197−205. YANG Chunxia, KAI Jianrong, MA Guijuan, et al. Composition, flavor characteristics and principal component analysis of flavor amino acids in fresh wolfberry fruits [J]. China Food Additives, 2024, 35(9): 197−205. [29] 耿瑞蝶, 王金水. 呈味氨基酸和肽对发酵食品中风味的作用[J]. 中国调味品, 2019, 44(7): 176−178, 183. GENG Ruidie, WANG Jinshui. Effect of flavored amino acids and peptides on the flavor of fermented foods [J]. China Condiment, 2019, 44(7): 176−178, 183. [30] 林媚, 张伟清, 王天玉, 等. 15个杂交柑橘品种的果实游离氨基酸组成及其对风味品质的影响[J]. 果树学报, 2022, 39(3): 352−365. LIN Mei, ZHANG Weiqing, WANG Tianyu, et al. Study on the composition of free amino acid and the effects on fruit flavor quality in 15 hybrid Citrus varieties [J]. Journal of Fruit Science, 2022, 39(3): 352−365. [31] TANG Qian, HUANG Yuxin, SHEN Zhuanglin, et al. 6-Phosphogluconate dehydrogenase 2 bridges the OPP and shikimate pathways to enhance aromatic amino acid production in plants [J]. Science China Life Sciences, 2024, 67(11): 2488−2498. [32] KURIHARA K. Glutamate: from discovery as a food flavor to role as a basic taste (umami) [J]. The American Journal of Clinical Nutrition, 2009, 90(3): 719S−722S. [33] 刘鑫, 王家旺, 隋雨萌, 等. 中国传统发酵蔬菜中微生物多样性及其对品质形成影响研究进展[J]. 食品科学, 2024, 45(10): 290−297. LIU Xin, WANG Jiawang, SUI Yumeng, et al. Microbial diversity and its influence on quality development in Chinese traditional fermented vegetables: a review [J]. Food Science, 2024, 45(10): 290−297. [34] 郭精桐, 赵圆, 孙玉敬. 番茄果实风味及其影响因素的研究进展[J]. 食品科学, 2023, 44(17): 169−177. GUO Jingtong, ZHAO Yuan, SUN Yujing. Recent advances in research on flavor substances in tomato fruit and their influential factors [J]. Food Science, 2023, 44(17): 169−177. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250169






 下载:
下载: