-
黄薇Heimia myrtifolia为千屈菜科Lythraceae黄薇属Heimia的落叶灌木[1],原产南美洲和非洲的热带、亚热带地区,人类的迁移致使南亚、东亚地区有零星分布[2],为中国引种植物。其花色金黄,夏季开花,花量丰富,花期较长,观赏价值极高。此外,黄薇植株可塑性强,繁殖简便,生长迅速,具有耐高温、耐水湿和耐轻微干旱的特性,抗逆能力强,生态适应性广,是一种待开发的优良观赏植物。迄今为止,关于黄薇生态适应性的研究国内外未见报道。黄薇原生环境夏季高温多雨,冬季少雨。目前,中国引种地区夏季易出现高温天气并伴随干旱发生,在两者的共同作用下,植物的生长和发育会受到较大的影响,甚至无法恢复导致植株死亡[3]。研究表明:植物遭受胁迫后体内的活性氧含量会不断积累,过量的活性氧一方面会导致生物膜脂过氧化,形成有害物质;另一方面会破坏植株叶绿体结构,削弱光合作用能力,对植物造成伤害[4]。植物会依靠植株体内的酶促和非酶促两大类保护系统对过量的活性氧进行清除,以维持正常代谢和减轻受到的损伤[5-6]。酶促清除系统主要包括超氧化物歧化酶(SOD),过氧化氢酶(CAT),抗坏血酸过氧化物酶(APX)及作用范围较广的过氧化物酶(POD),还包括保持抗氧化物质还原性所必须的酶如抗坏血酸—谷胱甘肽循环酶类等;非酶促清除系统主要包括抗坏血酸(AsA),类胡萝卜素及一些含巯基的低分子化合物(如还原型谷胱甘肽GSH)等物质[6]。本研究通过研究高温干旱胁迫对黄薇抗氧化酶活性和抗坏血酸-谷胱甘肽(AsA-GSH)循环的影响,探究高温干旱胁迫下黄薇抗氧化系统的响应机制,以期揭示黄薇在高温干旱胁迫下的耐胁迫能力,进而为黄薇的推广和栽培提供理论依据。
-
实验材料为1年生黄薇扦插苗,于2017年4月选择健壮枝条扦插于浙江农林大学风景园林与建筑学院温室中,当年7月移栽入塑料花盆(12.0 cm × 8.8 cm × 10.8 cm)中,栽培基质为m(泥炭土):m(蛭石):m(珍珠岩)=2:1:1的混合基质。2018年4月,选择健壮、长势基本一致的苗采用相同基质定植于塑料花盆(16.0 cm × 11.0 cm × 14.0 cm)中,当年6-7月放入人工气候箱(宁波莱福,中国)进行处理,处理前在人工气候箱中适应性培养7-10 d。
模拟自然高温干旱条件下土壤水分不断流失并无法补充的过程对实验材料的影响。实验时采用人工气候箱精确控制温度,分为3个温度梯度进行处理:T1(30 ℃/22 ℃),T2(36 ℃/26 ℃)和T3(42 ℃/30 ℃),15盆·组-1,光周期为12 h光照/12 h黑暗,光合有效辐射为240 μmol·m-2·s-1。每日早中晚使用便携式土壤水分测定仪(Spectrum公司,美国)对每盆苗进行土壤含水量测定,水分分为4个梯度:正常状态(对照,70%~80%田间持水量),轻度干旱(LD,55%~65%田间持水量),中度干旱(MD,35%~45%田间持水量),重度干旱(HD,10%~30%田间持水量)。根据测定,当每个温度梯度到达相应田间持水量时选取中上部完整的功能叶进行抗氧化系统相关指标测定。
-
超氧化物歧化酶(SOD)采用氮蓝四唑法[7]、过氧化物酶(POD)采用愈创木酚法[7]、丙二醛(MDA)采用硫代巴比妥酸(TBA)法[7]、过氧化氢酶(CAT)采用紫外吸收法[7]。
-
抗坏血酸(AsA)和脱氢抗坏血酸(DHA)质量摩尔浓度测定采用二联吡啶法[8],氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH)质量摩尔浓度测定参考NAGALAKSHMI等[9]的DTNB循环检测法。抗坏血酸过氧化物酶(APX)活性测定参考NAKANO等[10]的方法,单脱氢抗坏血酸还原酶(MDHAR)活性测定采用KRIVOSHEEVA等[11]的方法,谷胱甘肽还原酶(GR)活性和脱氢抗坏血酸还原酶(DHAR)活性采用试剂盒(苏州科铭,中国)进行测定。
-
将数据分为高温胁迫、干旱胁迫和高温干旱胁迫3组,使用SPSS Stastics 18(IBM,美国)进行方差分析。
-
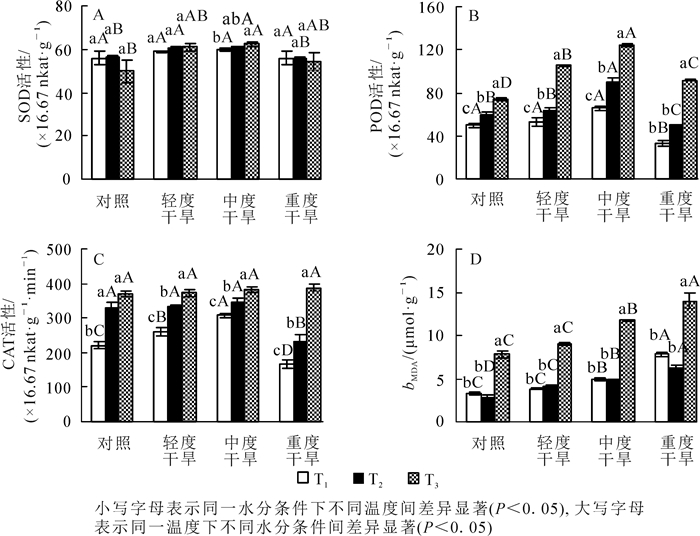
高温胁迫下黄薇叶片SOD活性,在轻度干旱和中度干旱下呈上升趋势,在重度干旱和对照组中呈现下降趋势,但变化不显著(P>0.05);干旱胁迫下黄薇叶片SOD活性随着干旱程度的增加,呈先上升后下降的趋势,且于中度干旱下达到最大;协同胁迫下在中度干旱时达到峰值,为对照的125.0%(P<0.05)(图 1A)。

图 1 高温干旱胁迫对黄薇SOD,POD,CAT活性及MDA质量摩尔浓度的影响
Figure 1. Effects of heat and drought stress on SOD activity, POD activity, CAT activity and MDA contents of Heimia myrtifolia
高温胁迫下黄薇叶片POD活性随着温度的增加而呈现上升趋势,且变化显著,42与30 ℃相比较,对照、轻度干旱、中度干旱、重度干旱4个水分组分别增加了49.1%(P<0.05),99.0%(P<0.05),89.1%(P<0.05)和173.5%(P<0.05);干旱胁迫下,POD活性随着胁迫程度呈先上升后下降的趋势,且变化显著,在中度干旱时值达到最大,与对照相比分别增加31.7%(P<0.05),53.0%(P<0.05)和67.1%(P<0.05);协同胁迫下在中度胁迫时达到峰值,为42 ℃干旱对照组的167.1%(P<0.05)(图 1B)。
高温胁迫下黄薇叶片CAT活性随着温度的增加而呈现上升趋势,且变化显著,42与30 ℃相比较,对照、轻度干旱、中度干旱、重度干旱分别增加了68.1%(P<0.05),42.5%(P<0.05),23.7%(P<0.05)和131.3%(P<0.05);干旱胁迫下,CAT活性在30和36 ℃时随着胁迫程度呈先上升后下降的趋势,在中度干旱时值达到最大,分别为增加了40.1%(P<0.05)和4.1%(P>0.05),42 ℃呈现上升趋势但变化不显著;协同胁迫下在重度干旱时达到峰值,为42 ℃干旱对照组的104.6%(P>0.05)(图 1C)。
高温胁迫下黄薇叶片MDA质量摩尔浓度随着温度的增加而呈现先下降后上升的趋势,在重度胁迫时达到峰值,且变化显著(P<0.05);干旱胁迫下MDA都呈现上升趋势,于重度胁迫下达到峰值,与对照相比分别增加了133.4%(P<0.05),117.5%(P<0.05)和79.6%(P<0.05)(图 1D)。
-
高温胁迫下黄薇叶片AsA质量摩尔浓度随着温度的增加呈现不同的趋势,均无显著变化(P>0.05);干旱胁迫下,AsA质量摩尔浓度在30和36 ℃时随着胁迫程度呈先上升后下降的趋势,在轻度干旱时值达到最大,重度干旱时值最小,重度干旱胁迫比对照组分别减少19.3%(P>0.05)和37.4%(P<0.05);协同胁迫下AsA质量摩尔浓度随胁迫程度逐渐下降,重度干旱胁迫时与42 ℃干旱对照组相比减少了38.2%(P<0.05)(图 2A)。

图 2 高温干旱胁迫对黄薇AsA和DHA质量摩尔浓度及AsA/DHA比值的影响
Figure 2. Effects of heat and drought stress on AsA contents, DHA contents and AsA/DHA of Heimia myrtifolia
高温胁迫下黄薇叶片DHA质量摩尔浓度随着温度的增加而呈现不同的趋势,对照、轻度干旱、中度干旱3组呈现先上升后下降趋势,重度干旱组呈现上升趋势;干旱胁迫下,DHA质量摩尔浓度在30和36 ℃时随着胁迫程度呈先上升后下降的趋势,在中度干旱时达最大值,分别增加了162.5%(P<0.05)和115.4%(P<0.05);协同胁迫下DHA质量摩尔浓度随胁迫程度逐渐上升,重度干旱胁迫时与42 ℃干旱对照组相比增加了115.8%(P<0.05)(图 2B)。
AsA/DHA比值在高温胁迫下随着温度的增加呈不同趋势,均无明显差异性;干旱胁迫下,AsA/DHA比值随着胁迫程度均呈下降趋势,在重度干旱分别减少了68.8%(P<0.05),65.3%(P<0.05)和72.6%(P<0.05)(图 2C)。
-
高温胁迫下黄薇叶片GSH质量摩尔浓度随着温度的增加而呈不同趋势,对照、中度干旱、重度干旱3组呈现先上升后下降趋势,各组内差异显著(P<0.05),轻度干旱组呈现上升趋势,差异不显著;干旱胁迫下,GSH质量摩尔浓度随着胁迫程度呈现先上升后下降的趋势,在30和36 ℃时在中度干旱时达最大值;协同胁迫下GSH质量摩尔浓度随胁迫程度先上升后下降,重度干旱胁迫时与42 ℃干旱对照组相比减少了58.8%(P<0.05)(图 3A)。

图 3 高温干旱胁迫对黄薇GSH和GSSG质量摩尔浓度及GSH/GSSG比值的影响
Figure 3. Effects of heat and drought stress on GSH contents, GSSG contents and GSH/GSSG of Heimia myrtifolia
高温胁迫下黄薇叶片GSSG质量摩尔浓度随着温度的增加而呈现不同的趋势,对照组和轻度干旱组呈现先下降后上升趋势,中度干旱组和重度干旱组呈现下降趋势;干旱胁迫下,在30和36 ℃时GSSG质量摩尔浓度随着胁迫程度上升而上升,在重度干旱时达最大值,分别增加了46.0%(P<0.05)和52.4%(P<0.05);协同胁迫下GSSG质量摩尔浓度随胁迫程度先上升后下降,中度干旱胁迫时达最大值,与42 ℃干旱对照组相比增加了26.4%(P<0.05)(图 3B)。
GSH/GSSG比值在高温胁迫下随着温度升高呈现先上升后下降的趋势,于36 ℃达最大值,42 ℃达最小值,两者相比各组分别减少了27.8%(P<0.05),21.3%(P<0.05),33.3%(P<0.05)和40.1%(P<0.05);干旱胁迫下,GSH/GSSG比值随着胁迫程度均呈现下降的趋势,在重度干旱分别减少了28.8%(P<0.05),37.5%(P<0.05)和48.1%(P<0.05)(图 3C)。
-
高温胁迫下黄薇叶片APX活性随着温度的增加而呈现不同的趋势,对照组和轻度干旱组呈上升趋势,中度干旱组和重度干旱组呈先上升后下降趋势,各组差异性均较显著;干旱胁迫下,APX活性均呈先上升后下降的趋势,在30和36 ℃时在中度干旱时达最大值,分别增加了60.0%(P<0.05)和208.3%(P<0.05);协同胁迫下APX活性于轻度干旱胁迫时达到最大值,与42 ℃干旱对照组相比增加了8.7%(P>0.05)(图 4A)。

图 4 高温干旱胁迫对黄薇APX,GR,DHAR和MDHAR活性的影响
Figure 4. Effects of heat and drought stress on APX activity, GR activity, DHAR activity and MDHAR activity of Heimia myrtifolia
高温胁迫下黄薇叶片GR活性随着温度的增加而呈现不同的趋势,对照组、轻度干旱组呈上升趋势,中度干旱组呈下降趋势,重度干旱组呈先下降后上升趋势,各组差异性均显著;干旱胁迫下,GR活性均呈先上升后下降的趋势,在30和36 ℃时,中度干旱下达最大值,分别增加了128.3%(P<0.05)和71.8%(P<0.05);协同胁迫下GR活性于轻度干旱胁迫时达到最大值,与42 ℃干旱对照组相比增加了28.7%(P<0.05)(图 4B)。
高温胁迫下黄薇叶片DHAR活性随着温度的增加而呈不同趋势,对照组呈先上升后下降趋势,轻度干旱组、中度干旱组、重度干旱组呈现先下降后上升趋势,除重度干旱组外各组差异性均较显著;干旱胁迫下,DHAR活性均呈先上升后下降的趋势,在30和36 ℃时,中度干旱下达最大值,分别增加了69.4%(P<0.05)和47.2%(P<0.05);协同胁迫下DHAR活性于轻度干旱胁迫时达到最大值,与42 ℃干旱对照组相比增加了145.0%(P<0.05)(图 4C)。
高温胁迫下黄薇叶片MDHAR活性随着温度的增加而呈不同趋势,中度干旱组呈先上升后下降趋势,对照、轻度干旱、重度干旱3组呈先下降后上升趋势,中度干旱组和重度干旱组差异较显著;干旱胁迫下,MDHAR活性均呈现先上升后下降的趋势,在30和36 ℃时,中度干旱下达最大值,分别增加了150.0%(P<0.05)和561.5%(P<0.05);协同胁迫下MDHAR活性于轻度干旱胁迫时达到最大值,与42 ℃干旱对照组相比增加了100.0%(P<0.05)(图 4D)。
-
植物体内活性氧的产生与清除始终处于一种动态平衡,植物在遭受逆境时会产生并积累大量的活性氧导致动态平衡被打破,造成活性氧代谢失调[12]。植物刚遭受到逆境胁迫时,会通过增加体内抗氧化酶的活性来减轻活性氧造成的伤害,但随着胁迫加深活性氧的增加和积累,抗氧化酶活性下降,多余的活性氧无法被清除而导致植物体受到不可逆的伤害[13]。高温胁迫往往伴随干旱胁迫同时发生,多重胁迫对植物的伤害明显大于单一胁迫[14]。本研究中,单一胁迫下SOD,POD和CAT活性总体上呈增加趋势,高温胁迫下的增幅高于干旱胁迫,说明黄薇对高温胁迫更加敏感;高温干旱协同胁迫下,3种酶活性总体高于单一胁迫,POD活性的变化明显较SOD和CAT活性显著,说明POD是黄薇对抗高温干旱胁迫的主要氧化酶;MDA质量摩尔浓度随着胁迫程度增加而显著增加且明显高于单一胁迫,表明协同胁迫下活性氧对植物细胞膜产生的伤害较大。裴斌等[15]对沙棘Hippophae rhamnoides的干旱胁迫研究表明:SOD,POD和CAT活性随着胁迫程度呈现先升后降的趋势,其中SOD活性明显高于POD和CAT活性,MDA质量摩尔浓度则是随着胁迫程度而逐渐增加。干旱胁迫下,黄薇叶片中MDA质量摩尔浓度随着胁迫程度增加而增加,3种酶活性虽都呈现先增强后下降趋势,但SOD和CAT活性增强不明显,POD的活性增强显著,这与裴斌等[15]的研究结果不一致,可能是由于POD在活性氧的清除中效果较好。高温胁迫下,SOD,POD和CAT活性总体上呈现上升趋势,POD和CAT活性增幅显著,SOD活性增幅较小,这与周广等[16]对井冈山杜鹃Rhododendron jinggangshanicum高温胁迫的研究结果相似;MDA质量摩尔浓度总体呈先降后升趋势,这与周广等[16]的研究结果不同,可能是黄薇在高温环境下具有一定的适应性,减缓了细胞膜脂质过氧化的速度。
AsA-GSH循环是植物体内清除活性氧自由基的重要途径[17],植物通过增加抗氧化剂含量和相关酶活性提高AsA-GSH循环的效率以适应环境胁迫[18]。高温干旱协同胁迫下,中度胁迫时黄薇叶片内APX活性相对平稳随胁迫加重而下降,GR和MDHAR活性虽有增强但远不如单一胁迫,而DHAR活性远强于单一胁迫,黄薇叶片内DHA,GSH和GSSG质量摩尔浓度不断显著增加,AsA质量摩尔浓度不断显著下降,DHAR活性增强与DHA增加,AsA减少,这与韩一林等[18]和SILVA等[19]的研究结果不一致,可能因为DHAR活性虽然增加但循环仍以APX的清除优先,不能及时补充为AsA,故AsA质量摩尔浓度被大量消耗,无法及时得到补充从而不断下降。重度协同胁迫下,植物细胞已经遭到破坏,各物质的量和酶的活性均下降,部分达到最低值,这与许馨露等[20]的研究结果相似。此外AsA/DHA比值和GSH/GSSG比值随着胁迫呈下降趋势,表明胁迫造成AsA还原力不断增强。单一干旱胁迫下,APX,GR,MDHAR和DHAR活性均呈先升高后下降的趋势,这与董守坤等[21]的研究结果一致。AsA,GSH和DHA质量摩尔浓度总体上呈现先增加后下降趋势,GSSG质量摩尔浓度总体呈上升趋势,实验表明:面对干旱胁迫时黄薇叶内的AsA-GSH循环能够及时进行活性氧的清除,减轻其细胞的损伤。高温胁迫下,APX,GR活性和AsA质量摩尔浓度呈上升趋势,DHAR活性和DHA质量摩尔浓度先上升后下降,MDHAR活性和GSSG质量摩尔浓度先下降后上升,表明高温胁迫下循环内以APX清除为主,其余的酶则维持着循环内的平衡,保证对活性氧的清除能力;比较各水分组发现各酶活性总体上都在中度干旱组内达到最大值,表明黄薇对高温胁迫下的干旱也具备一定的抵抗能力。
综上所述,单一高温或干旱胁迫下,黄薇内的抗氧化防御系统可及时进行响应,维持着植物体的正常生长发育。但在两者共同胁迫下,受到轻度胁迫的黄薇仍具有有效的防御能力,而中度和重度胁迫下,活性氧的积累逐渐超出黄薇的承受能力,较单一胁迫造成更大的伤害。研究也发现,在30和36 ℃时黄薇对环境变化的承受力仍较强,在42 ℃时如不能及时补充水分则会造成较大的伤害。黄薇在轻度和中度干旱下适应性相对较强,可以适应由高温情况下短暂缺水情况,在长江以南地区的景观规划或生态修复中可扩大其栽培及应用。
Heat and drought stress with an antioxidant defense system in Heimia myrtifolia
-
摘要: 黄薇Heimia myrtifolia是具有较高价值的引种植物,但对其引种后的适应性研究仍较缺乏。为了探究黄薇对高温干旱及协同胁迫的响应,采用人工模拟自然状态下干旱(对照、轻度干旱、中度干旱和重度干旱),高温(30,36和42℃)及高温干旱协同胁迫对黄薇叶片抗氧化防御系统的影响。结果显示:干旱胁迫下,过氧化物酶(POD)活性和丙二醛(MDA)质量摩尔浓度显著增加(P < 0.05),脂膜过氧化程度加深,抗坏血酸-谷胱甘肽(AsA-GSH)循环相关酶活性和相关还原物质均呈先上升后下降趋势,在中度胁迫下达到顶峰,与对照相比均显著增加(P < 0.05)。高温胁迫下,抗氧化酶效率和AsA-GSH循环效率均有提高。高温干旱协同胁迫下,黄薇受到的伤害明显大于单一胁迫,超氧化物歧化酶(SOD)和POD显著上升(P < 0.05)并于中度胁迫时达到顶峰,MDA质量摩尔浓度显著增加(P < 0.05),AsA-GSH循环效率均有提高但在中度胁迫下开始下降,脂膜过氧化随着胁迫加深显著加剧,重度胁迫下已无法维持正常生长。黄薇在高温干旱胁迫下可以通过调节抗氧化酶系统和AsA-GSH循环共同清除氧化物质,提高抗胁迫能力,维持正常生长发育。Abstract: To determine the effects of drought stress and heat stress both individually and combined on the antioxidant defense system of Heimia myrtifolia, an introduced plant with high value but poor distribution. Soil moisture loss with natural high temperature and drought conditions without replenishment were artificially simulated using drought stress of a control (no stress), light, moderate, and heavy stresses and heat stress of 30℃ (control), 36℃, and 42℃. The upper complete functional leaf was carried out when the moisture gradient reaches the sampling requirement under heat treatment. Experimental results showed that, firstly, with drought treatments, peroxidase (POD) activity and malondialdehyde (MDA) molar concentration increased significantly (P < 0.05), lipid membrane peroxidation deepened, ascorbic Acid-glutathione (AsA-GSH) cyclerelated enzyme activity and related reductants increased first and then decreased, peaking with moderate stress and significantly increased compared with the control (P < 0.05). Secondly, with high temperature stress, the efficiency of antioxidant enzymes and ASA-GSH cycle increased but not dramatic. Finally, with the synergistic stress of heat and drought, the damage of H. myrtifolia was significantly greater than that with single stress. The superoxide dismutase (SOD) and POD activities increased significantly (P < 0.05) and reached the peak with moderate stress. The molar concentration of MDA increased significantly (P < 0.05). The circulation efficiency of AsA-GSH increased, but began to decrease with moderate stress. Lipid membrane peroxidation increased significantly with the deepening of stress and the normal growth could not be maintained with severe stress. Thus, with heat and drought stress, the plant could remove excessive reactive oxygen by regulating the antioxidant enzyme system and AsA-GSH cycle, and improve resistance to stress so as to maintain normal growth and development.
-
Key words:
- botany /
- Heimia myrtifolia /
- heat /
- drought /
- antioxidant enzyme /
- ascorbate glutathione cycle
-
-
[1] 方文培.中国植物志:第52(2)卷[M].北京:科学出版社, 2004. [2] RAWAT G S, CHANDOLA S, NAITHANI H B. A note on the occurrence of Heimia myrtifolia (Lythraceae) in India[J]. Indian For, 2007, 133(5):398-409. [3] 简令成, 王红.逆境植物细胞生物学[M].北京:科学出版社, 2009. [4] LEI Peng, XU Zongqi, DING Yan, et al. Effect of ploy(γ-glutamic acid) on the physiological responses and calcium signaling of rape seeding (Brassica napus L.) under cold stress[J]. J Agric Food Chem, 2015, 63(48):10399-10406. [5] 潘瑞炽.植物生理学[M].北京:高等教育出版社, 2012. [6] 尹永强, 胡建斌, 邓明军.植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J].中国农学通报, 2007, 23(1):105-110. YIN Yongqiang, HU Jianbin, DENG Mingjun. Latest development of antioxidant system and responses to stress in plant leaves[J]. Chin Agri Sci Bull, 2007, 23(1):105-110. [7] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社, 2004. [8] JIANG Mingyi, ZHANG Jianhua. Effect of abscisic acid on active oxygen species, antioxidative defence system and oxidative damage in leaves of maize seedlings[J]. Plant Cell Physiol, 2001, 42(11):1265-1273. [9] NAGALAKSHMI N, PRASAD M N V. Responses of glutathione cycle enzymes and glutathione metabolism to copper stress in Scenedesmus bijugatus[J]. Plant Sci, 2001, 160(2):291-299. [10] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1981, 22(5):867-880. [11] KRIVOSHEEVA A, TAO Dali, OTTANDER C, et al. Cold acclimation and photoinhibition of photosynthesis in Scotspine[J]. Planta, 1996, 200(3):296-305. [12] 马旭俊, 朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传, 2003, 25(2):225-231. MA Xujun, ZHU Dahai. Functional roles of the plant superoxide dismutase[J]. Hereditas, 2003, 25(2):225-231. [13] 陈培琴, 郁松林, 詹妍妮, 等.植物在高温胁迫下的生理研究进展[J].中国农学通报, 2006, 22(5):223-227. CHEN Peiqin, YU Songlin, ZHAN Yanni, et al. A review on plant heat stress physiology[J]. Chin Agric Sci Bull, 2006, 22(5):223-227. [14] ROOT T L, PRICE J T, HALL K R, et al. Fingerprints of global warming on wild animals and plants[J]. Nature, 2003, 421:57-60. [15] 裴斌, 张光灿, 张淑勇, 等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报, 2013, 33(5):1386-1396. PEI Bin, ZHANG Guangcan, ZHANG Shuyong, et al. Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities in Hippophae rhamnoides Linn. seedings[J]. Acta Ecol Sin, 2013, 33(5):1386-1396. [16] 周广, 孙宝腾, 张乐华, 等.井冈山杜鹃叶片抗氧化系统对高温胁迫的响应[J].西北植物学报, 2010, 30(6):1149-1156. ZHOU Guang, SUN Baoteng, ZHANG Lehua, et al. Responses of antioxidant system in leaves of Rhododendron jinggangshanicum to high temperature stress[J]. Acta Bot Boreal-Occident Sin, 2010, 30(6):1149-1156. [17] 孙军利, 赵宝龙, 郁松林. SA对高温胁迫下葡萄幼苗AsA-GSH循环的影响[J].核农学报, 2015, 29(4):799-804. SUN Junli, ZHAO Baolong, YU Songlin. Effects of exogenous salicylic acid (SA) on ascorbate glutathione cycle(AsA-GSH)circulation metabolism in grape seedlings under high temperature stress[J]. J Nucl Agric Sci, 2015, 29(4):799-804. [18] 韩一林, 王鑫朝, 许馨露, 等.毛竹幼苗抗氧化酶和AsA-GSH循环对高温干旱及协同胁迫的响应[J].浙江农林大学学报, 2018, 35(2):268-276. HAN Yilin, WANG Xinzhao, XU Xinlu, et al. Responses of anti-oxidant enzymes and the ascorbate-glutathione cycle to heat, drought, and synergistic stress in Phyllostachys edulis seedlings[J]. J Zhejiang A&F Univ, 2018, 35(2):268-276. [19] SILVA E N, FERREIRA-SLIVA S L, FONTENELE A, et al. Photosynthetic changesand protective mechanisms against oxidative damage subjected to isolated and combined drought and heat stresses in Jatropha curcas plants[J]. J Plant Physiol, 2010, 167:1157-1164. [20] 许馨露, 李丹丹, 马元丹, 等.四季桂抗氧化防御系统对干旱、高温及协同胁迫的响应[J].植物学报, 2018, 53(1):72-81. XU Xinlu, LI Dandan, MA Yuandan, et al. Responses of the antioxidant defense system of Osmanthus fragrans cv. 'Tian Xiang TaiGe' to drought, heat and the synergistic stress[J]. Chin Bull Bot, 2018, 53(1):72-81. [21] 董守坤, 马玉玲, 李爽, 等.干旱胁迫及复水对大豆抗坏血酸-谷胱甘肽循环的影响[J].东北农业大学学报, 2018, 49(1):10-18. DONG Shoukun, MA Yuling, LI Shuang, et al. Effect of drought stress and re-watering on ascorbate-glutathione cycle of soybean[J]. J Northeast Agric Univ, 2018, 49(1):10-18. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2019.05.007






 下载:
下载: