-
土壤是陆地生态系统中的有机碳库,0~100 cm土层土壤的碳储量就占陆地植被碳库的2/3[1]。土壤有机碳既是碳源,也可作碳汇,其含量和动态变化影响着全球碳循环[2]。中国2/3的国土光照充沛,太阳能资源丰富;太阳能发电不产生任何排放和噪音,所以光伏产业被人们认为是清洁、安全和可靠的能源。然而在大型太阳能电站建造的起始阶段,移除原始植被、翻动土层、加入压实填料等施工行为均会损害土壤结构[3],进而改变土壤的养分和水分动态循环及生化特征[4],最终可能降低电站内土壤碳形成的速度[5]。所以,土壤有机碳也被看作衡量光伏电站土壤修复程度的主要指标之一。研究植被恢复中光伏电站土壤有机碳储量的变化过程对探究土壤质地及其恢复效果有重大意义。长期以来,植被恢复因其与全球气候变化、碳氮循环、土壤质量改善和促进区域经济发展相关而被广泛关注[6-7]。目前,有关植被修复影响有机碳含量的研究颇为丰富。研究表明:植被恢复可显著提高有机碳含量[8],且到达一定恢复年限后有机碳含量会和恢复年限成正比[9-10]。还有研究指出:植被恢复类型极易影响土壤碳、氮和磷的储量变化[11],但关于光伏电站植被恢复对土壤有机碳储量的影响研究较少。因此,研究光伏电站内植被恢复后能否产生与未受干扰的参考样地相似的土壤有机碳,分析土壤主要理化性质与土壤有机碳的相关性,进一步探究光伏电站内土壤质地和土壤肥力状况,为光伏电站内土壤修复措施提供科学依据。
-
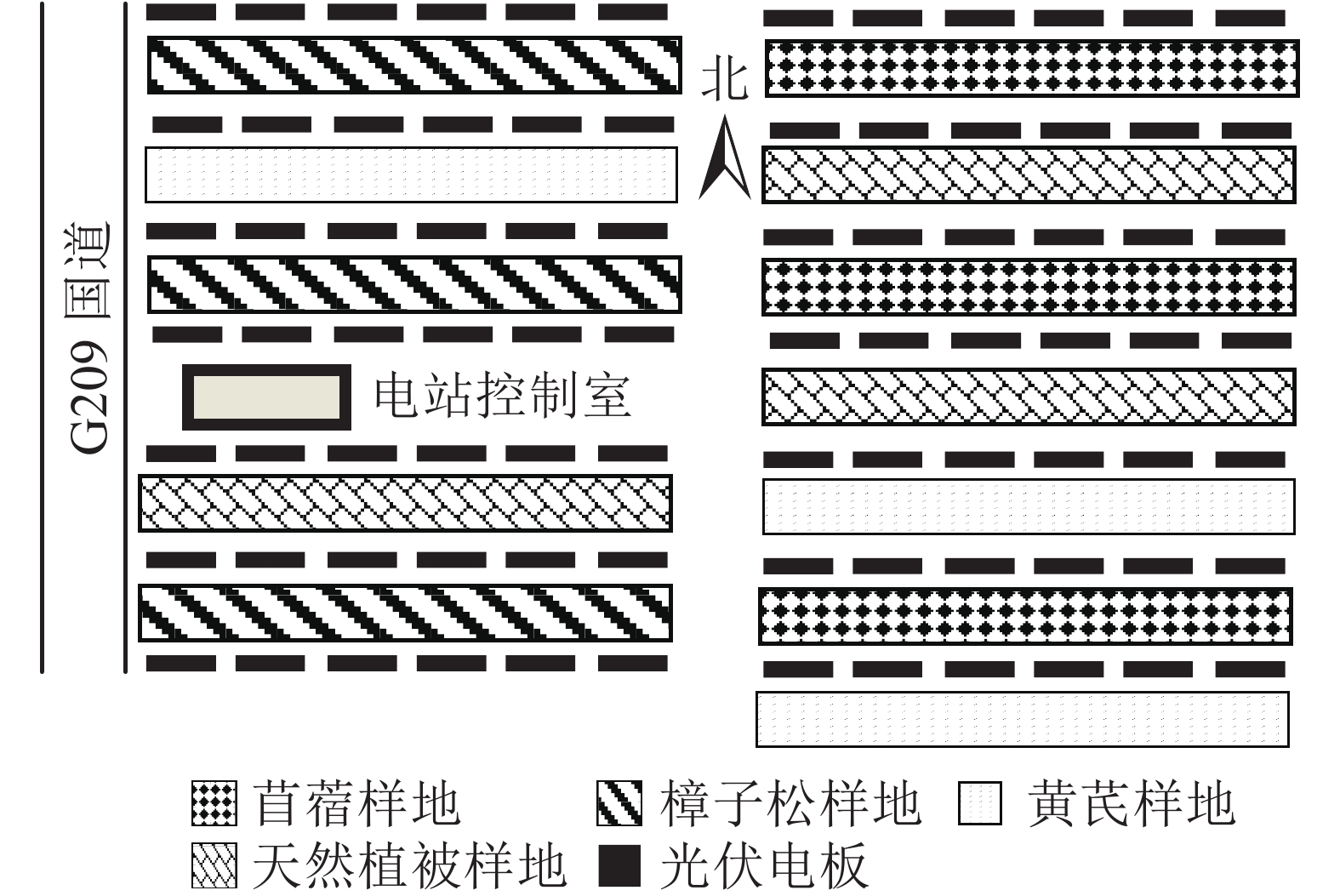
研究区域位于内蒙古自治区呼和浩特市土默特左旗沙尔沁乡的大有光能源光伏农林牧示范基地(40°36′N,110°47′E)。该区域属于温带大陆性季风气候,常年日照充足,气候干燥。年均蒸发量为1870.0 mm,年均降水量为399.0 mm。无霜期为187.0 d,灾害性天气常发生于春旱到春寒期间。该光伏电站于2012年投产使用。因开发为农林牧示范基地,该光伏电站在2013年开展了整地工作,并在电板间人工种植了樟子松Pinus sylvestris var. mongolica、苜蓿Medicago sativa和黄芪Astragalus membranaceus var. mongholicus等。光伏板阵列行间距为10 m,每年秋季为防火会修剪电板间的植被,并且在前檐下方设置2.5 m的防火隔离带。
-
2019年6月中旬,在太阳能光伏电板间采集土壤样本,并进行实地调查(图1)。试验地中随机设置人工种植樟子松、黄芪和苜蓿的固定样地3块(30 m×10 m)以及未被扰动的天然草地(对照),样地间距大于30 m,并确保样地地形、植被及土壤等立地条件基本一致。以“S”型取样法在每个样地内随机多点采样,人工挖土壤剖面,分别在0~20、20~40 cm深度取环刀土及混合土样(将每个样地取样点土样同层混合后采用“四分法”缩减),用于测定土壤容重及室内化学分析,每个样地重复取3个平行样。将样品带回实验室,自然风干后剔除植物根系及砾石等杂物并过筛,同时测定粒径>2 mm的石砾含量。由于几乎所有的土壤粒径均小于2 mm,所以本研究中石砾含量不计入碳储量分析部分。
-
土壤含水量采用直接烘干法测定;土壤容重用环刀法测定;pH采用电极法测定(水土质量比2.5∶1.0);电导率采用电导率仪测定(水土质量比2.5∶1.0);土壤有机碳(SOC)质量分数采用重铬酸钾外加热法测定[12]。
-
土壤有机碳储量计算公式如下[13]:RSOC =0.1ρSOCnBDnDn。其中:RSOC为第n层土壤有机碳储量(t·hm−2);ρSOCn为第n层土壤有机碳质量分数(g·kg−1);BDn为第n层土壤容重(g·cm−3);Dn为第n层土壤厚度(cm),0.1是单位转换系数。
不同修复模式土壤养分变异性被分作3级:变异系数(VC)≤0.1为弱变异;0.1<VC≤1.0为中等变异;VC>1.0为强度变异[14]。
用Excel 2007处理数据,制作图表。用SAS 9.2进行单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVAs),用Pearson法进行相关性分析。
-
0~20 cm土层内有机碳质量分数从大到小表现为天然植被样地、樟子松地、黄芪地、苜蓿地,且四者差异显著(P<0.05,表1)。同时,只有苜蓿样地土壤有机碳变异系数为中等变异(0.16),其他3种植被类型均属于弱变异。随着土层深度的加深(20~40 cm),各植被类型土壤有机碳质量分数均呈下降趋势,即表层土壤有机碳质量分数显著高于底土层。20~40 cm土壤中有机碳质量分数分布规律与0~20 cm土层一致,且4种植被类型间存在显著差异(P<0.05),其中樟子松和天然植被样地土壤有机碳变异系数为弱变异,黄芪和苜蓿样地为中等变异。
表 1 不同植被类型下不同土层土壤有机碳
Table 1. Soil organic carbon contents in different soil layers under different vegetation types
植被 不同土层有机碳/(g·kg−1) 变异系数 0~20 cm 20~40 cm 0~20 cm 20~40 cm 樟子松 7.93±0.38 Ab 4.70±0.37 Bb 0.05 0.08 黄芪 4.89±0.46 Ac 2.75±0.63 Bc 0.09 0.23 苜蓿 3.71±0.58 Ad 2.12±0.44 Bd 0.16 0.21 天然植被 9.72±0.34 Aa 6.76±0.30 Ba 0.03 0.04 说明:数据为平均值±标准差。不同大写字母表示相同植被不同土层间差异显著(P<0.05),不同小写字母表示同一土层不同植被间 差异显著(P<0.05) -
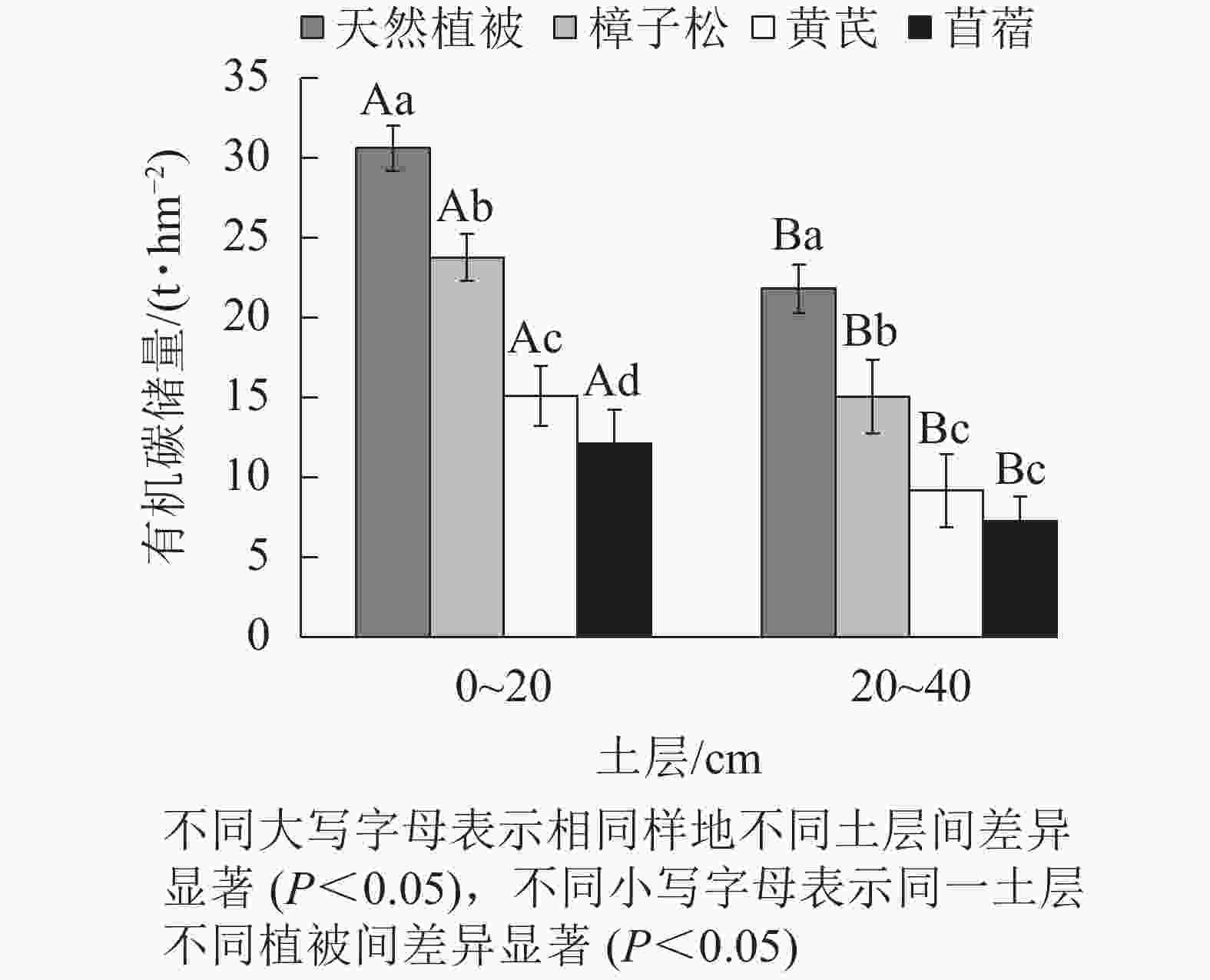
在0~20 cm土层中,4种植被类型的土壤有机碳储量均有显著差异(P<0.05,图2)。土壤有机碳储量从大到小顺序为天然植被地(30.62 t·hm−2)、樟子松地(23.77 t·hm−2)、黄芪地(15.11 t·hm−2)、苜蓿地(12.15 t·hm−2)。20~40 cm土层4种植被类型的碳储量与表土层的规律一致。天然植被样地有机碳储量(21.81 t·hm−2)显著高于其他3种样地(P<0.05),其中黄芪样地和苜蓿样地碳储量差异不显著。同时,在0~40 cm土层内,有机碳储量表现出随土壤深度加深而下降的趋势,表土层显著高于底土层(P<0.05)。
-
分析植被类型和土壤深度的交互作用发现(表2):植被类型和土壤深度对土壤容重、土壤有机碳质量分数以及土壤碳储量有极显著的影响(P<0.01),植被类型对pH有极显著影响(P<0.01)。两者之间的交互作用显著影响土壤有机碳质量分数(P<0.05)。
表 2 植被类型、土壤深度、土壤理化性质和有机碳储量的双因素方差分析
Table 2. Two-way ANOVAs on the effects of vegetation types and soil depeth on soil phsico-chemical properties and organic carbon storage
因素 F 含水量 电导率 容重 pH 有机碳质量分数 有机碳储量 植被类型 0.81 0.54 11.20*** 6.94** 161.87*** 111.17*** 土壤深度 0.58 1.20 26.34*** 1.31 182.33*** 101.16*** 植被类型×土壤深度 0.39 1.63 0.80 1.84 3.53* 1.18 说明:*表示P<0.05,**表示P<0.01,***表示P<0.001 不同植被类型土壤有机碳质量分数和储量与土壤理化性质的相关性见表3。可以看出:土壤有机碳质量分数与土壤pH呈极显著负相关(P<0.01),与容重呈显著负相关(P<0.05),与含水量和电导率均呈显著正相关(P<0.05)。有机碳储量与pH也呈极显著负相关(P<0.01),还与电导率呈显著正相关(P<0.05)。
表 3 土壤有机碳质量分数、有机碳储量与土壤主要理化性质的相关性
Table 3. Correlation between organic carbon storage and major soil physical and chemical properties
组分 容重 含水量 pH 电导率 有机碳质量分数 −0.37* 0.24* −0.57** 0.28* 有机碳储量 −0.22 0.19 −0.58** 0.25* 说明:* 表示P<0.05,** 表示P<0.01 -
本研究发现:樟子松、苜蓿和黄芪等3种人工植被土壤有机碳质量分数显著低于天然植被样地。这是由于天然植被样地并未受到建造电站时土方工程的影响,而光伏阵列建造过程中对表土以及原有植被进行了移除,破坏了土壤结构,会影响土壤有机碳质量分数。这与CHOI等[15]和LARNEY等[16]等的研究结果一致。说明研究区经过多年的植被恢复工作,养分循环尚未完全恢复到和原生土壤一致的水平。这3种人工植被样地在0~20和20~40 cm土层中有机碳质量分数从大到小均表现为樟子松地、黄芪地、苜蓿地。这可能是由于不同的植被类型会产生不同的凋落物,并且植物根系生物量及分布情况存在较大差异,均会造成土壤中有机碳质量分数的差异[17]。同时,植被类型与土壤pH呈极显著相关。张青青等[18]的研究中提到:不同植被类型土壤pH有所不同。本研究还发现:土壤有机碳质量分数与土壤容重、土壤含水量和土壤电导率呈显著相关。大量的研究也表明:土壤容重、土壤含水量和土壤电导率通过影响土壤通气性、植被根系生长、枯枝落叶的分解速率以及土壤营养元素吸收和转化,来影响有机碳的分解速率[19-21]。
垂直方向上,3种植被类型有机碳质量分数均随着土层的加深而显著降低,说明表层土壤有机碳质量分数富集现象较为明显。这与王玉婷等[22]和李若南等[23]的研究结论一致。一方面可能是人工建植促进了植被覆盖度和表层凋落物增多,增加外源有机质输入的同时,也促进了土壤中微生物的分解转化作用,帮助土壤积累有机碳[24]。另一方面,根系多盘踞在浅土层,分泌的碳水化合物、有机酸类等物质[17]以及植物死根会促进土壤固持有机碳。深层土壤中有机碳主要源于雨水淋溶和利用拥有较长根系的灌木或乔木等来固定碳[25],这也是20~40 cm土层内樟子松样地有机碳质量分数显著高于黄芪和苜蓿样地的原因。本研究中,植被类型和土壤深度及其交互作用均对土壤有机碳质量分数有极显著的影响,表明植被类型和土壤深度是决定土壤有机碳分布的关键因素。
-
本研究发现:天然植被的土壤有机碳储量最高。3种植被恢复模式下的土壤固碳能力远没有达到和原生土壤一致的水平,但是樟子松样地的土壤碳储量最高,说明乔木的碳汇能力远高于草地。韩鲁艳等[26]的研究也证明:乔木能产生远高于草地的凋落物归还量,提高土壤固碳能力。草地根系相对较浅,其生物量和凋落物归还量较少[27]。同时,樟子松作为一种常绿乔木,可以起到长期有效的遮阴作用,降低林下温度,减缓有机碳的矿化速率[28]。有研究显示:常绿树种较为发达的细根系统可以帮助其将更多光合产物固定到根部,达到有效固持土壤有机碳的效果[29]。
有机碳储量随土壤深度的加深而显著降低,这与多数研究结果一致[30-31]。另外,土壤通气状况也会影响深层土壤中有机碳分解能力[32],深层土壤空隙水分含量较低,通气状况适中,有机碳更易被分解[33],不利于深层土壤储存有机碳。整体上,植被类型和土壤深度均对有机碳储量有极显著的影响。GAO等[34]的研究表明:植被主要利用自身归还凋落物、根系分泌物以及土壤微生物分解能力来影响土壤碳含量和储量。许多研究[35-38]也证明了土壤深度是影响土壤碳含量和储量的主要因素之一。土壤有机碳质量分数和储量与土壤pH呈极显著负相关。原因是土壤中pH呈弱碱性时,会降低土壤微生物的活性[39],从而降低有机质的分解速率,不利于土壤有机碳的储存。
本研究分析表明:该电站内,即使樟子松样地是3种植被恢复类型中有机碳质量分数和储量最高的,但仍然远低于原生土壤的天然植被样地,所以植被恢复作为一项持续任务,需要看更长久的结果。后期要加大对该区域的研究力度,提高光伏电站生态修复科技支撑水平,促进该区域生态可持续发展。
-
研究区内的樟子松、黄芪和苜蓿样地有机碳质量分数和储量经过8 a的恢复,仍然低于天然植被样地。但在这3种植被类型中,樟子松样地的有机碳质量分数和储量要显著高于黄芪和苜蓿样地。有机碳质量分数和储量均随土层深度的加深而显著降低。植被类型和土壤深度及其交互作用显著影响土壤有机碳质量分数。此外,土壤pH和电导率也是影响土壤有机碳质量分数和储量的重要指标。
Distribution characteristics of soil organic carbon storage in photovoltaic power station under different vegetation restoration modes
-
摘要:
目的 探究光伏电站环境内不同植被恢复措施下0~40 cm土壤有机碳质量分数和储量的变化特征,为干旱区光伏电站生态治理模式优化配置提供理论依据。 方法 在光伏电站内选取3种人工建植植被样地:樟子松 Pinus sylvestris var. mongolica、黄芪Astragalus membranaceus var. mongholicus、苜蓿Medicago sativa,以未受电站建设干扰的天然植被样地作为对照。 结果 重新建植植被后,樟子松、黄芪和苜蓿样地的土壤有机碳质量分数和储量仍然显著低于对照(P<0.05),但在这3种植被中,樟子松样地的土壤有机碳质量分数相对于另外2种样地显著增加了4.99和6.80 g·kg−1,而有机碳储量则显著提高了14.52和19.37 t·hm−2 (P<0.05)。研究区土壤有机碳质量分数和储量整体上随土壤深度增加而显著降低(P<0.05)。植被类型和土壤深度及其交互作用显著影响研究区的土壤有机碳质量分数。此外,土壤pH和电导率也是影响土壤有机碳质量分数和储量的重要指标。 结论 随着电站内环境治理工作的推进,相比于草本植被,光伏电站内可以通过人工种植樟子松来提高土壤固碳作用,并尽量减少后期的人为干扰。图2表3参39 Abstract:Objective This study aims to explore the change characteristics of soil organic carbon mass fraction and storage at 0−40 cm under different vegetation restoration measures in the environment of photovoltaic power station, so as to provide theoretical basis for the optimal allocation of ecological management mode of photovoltaic power station in arid area. Method Three artificial vegetation plots(Pinus sylvestris var. mongolica, Astragalus membranaceus var. mongholicus, Medicago sativa) in the photovoltaic power station were selected as the research objects, and the natural vegetation plots undisturbed by power station construction were used as the control. Result After replanting, the soil organic carbon mass fraction and storage of P. sylvestris var. mongolica, A. membranaceus var. mongholicus and M. sativa were still significantly lower than those of the control (P<0.05). However, compared with the other two plots, the soil organic carbon mass fraction of P. sylvestris var. mongolica sample plot increased significantly by 4.99 and 6.80 g·kg−1, while the organic carbon storage increased significantly by 14.52 and 19.37 t·hm−2 (P<0.05). The mass fraction and storage of soil organic carbon in the study area decreased significantly with the increase of soil depth (P<0.05). Vegetation type, soil depth and their interaction significantly affected the organic carbon mass fraction in the study area. In addition, soil pH and electrical conductivity were also important indicators affecting the mass fraction and storage of organic carbon. Conclusion With the advancement of environmental governance in the power station, compared with herbages, P. sylvestris var. mongolicacan can be artificially planted in the photovoltaic power station to improve soil carbon sequestration and minimize human interference in the later stage, which is of great significance to improve regional ecological benefits. [Ch, 2 fig. 3 tab. 39 ref.] -
表 1 不同植被类型下不同土层土壤有机碳
Table 1. Soil organic carbon contents in different soil layers under different vegetation types
植被 不同土层有机碳/(g·kg−1) 变异系数 0~20 cm 20~40 cm 0~20 cm 20~40 cm 樟子松 7.93±0.38 Ab 4.70±0.37 Bb 0.05 0.08 黄芪 4.89±0.46 Ac 2.75±0.63 Bc 0.09 0.23 苜蓿 3.71±0.58 Ad 2.12±0.44 Bd 0.16 0.21 天然植被 9.72±0.34 Aa 6.76±0.30 Ba 0.03 0.04 说明:数据为平均值±标准差。不同大写字母表示相同植被不同土层间差异显著(P<0.05),不同小写字母表示同一土层不同植被间 差异显著(P<0.05) 表 2 植被类型、土壤深度、土壤理化性质和有机碳储量的双因素方差分析
Table 2. Two-way ANOVAs on the effects of vegetation types and soil depeth on soil phsico-chemical properties and organic carbon storage
因素 F 含水量 电导率 容重 pH 有机碳质量分数 有机碳储量 植被类型 0.81 0.54 11.20*** 6.94** 161.87*** 111.17*** 土壤深度 0.58 1.20 26.34*** 1.31 182.33*** 101.16*** 植被类型×土壤深度 0.39 1.63 0.80 1.84 3.53* 1.18 说明:*表示P<0.05,**表示P<0.01,***表示P<0.001 表 3 土壤有机碳质量分数、有机碳储量与土壤主要理化性质的相关性
Table 3. Correlation between organic carbon storage and major soil physical and chemical properties
组分 容重 含水量 pH 电导率 有机碳质量分数 −0.37* 0.24* −0.57** 0.28* 有机碳储量 −0.22 0.19 −0.58** 0.25* 说明:* 表示P<0.05,** 表示P<0.01 -
[1] SCHLESINGER W H. Evidence from chronosequences studies for a low carbon-storage potential of soils [J]. Nature, 1990, 348(6298): 232 − 234. [2] 黎鹏, 张勇, 李夏浩祺, 等. 黄土丘陵区不同退耕还林措施的土壤碳汇效应[J]. 水土保持研究, 2021, 28(4): 29 − 33. LI PENG, ZHANG Yong, LI Xiahaoqi, et al. Effect of soil carbon sink in the hilly region of the Loess Plateau Under Grain for Green Project [J]. Res Soil Water Conserv, 2021, 28(4): 29 − 33. [3] HERNANDEZ R R, EASTER S B, MURPHY-MARISCALM L, et al. Environmental impacts of utility-scale solarenergy [J]. Renewable Sustainable Energy Rev, 2014, 29: 766 − 779. [4] ULDRIJAN D, KOVÁČIKOVÁ M, JAKIMIUK A, et al. Ecological effects of preferential vegetation composition developed on sites with photovoltaic power plants [J]. Ecol Eng, 2021, 168: 125 − 133. [5] 赵川, 和丽萍, 李贵祥, 等. 植被恢复对昆阳磷矿土壤有机碳储量的影响[J]. 水土保持研究, 2017, 24(5): 168 − 171, 177. ZHAO Chuan, HE Liping, LI Guixiang, et al. Impacts of vegetation restoration on the soil organic carbonstorage in Kunyang Phosphorite Mine [J]. Res Soil Water Conserv, 2017, 24(5): 168 − 171, 177. [6] RUDEL T K, COOMES O T, MORAN E, et al. Forest transitions: towards a global understanding of land use change [J]. Global Environ Change, 2005, 15(1): 23 − 31. [7] BASTIN J F, FINEGOLD Y, CARCIA C, et al. The global tree restoration potentia [J]. Science, 2019, 365(6448): 76 − 79. [8] 董云中, 王永亮, 张建杰, 等. 晋西北黄土高原丘陵区不同土地利用方式下土壤碳氮储量[J]. 应用生态学报, 2014, 25(4): 955 − 960. DONG Yunzhong, WANG Yongliang, ZHANG Jianjie, et al. Soil carbon and nitrogen storage of different land use types in northwestern Shanxi Loess Plateau [J]. Chin J Appl Ecol, 2014, 25(4): 955 − 960. [9] 程彩芳, 陆爱云, 李正才, 等. 不同林龄木荷-青冈栎混交林幼林碳储量[J]. 生态学杂志, 2015, 34(10): 2705 − 2710. CHENG Caifang, LU Aiyun, LI Zhengcai, et al. Carbon storage in mixed Schima superba Gardn. et Champ. -Cyclobalanpsis glauca (Thunb.) Oerst. young plantations at different stand ages [J]. Chin J Ecol, 2015, 34(10): 2705 − 2710. [10] 刘政, 许文斌, 田地, 等. 南方红壤严重侵蚀地不同恢复年限马尾松人工林生态系统碳储量特征[J]. 水土保持通报, 2019, 39(1): 37 − 42. LIU Zheng, XU Wenbin, TIAN Di, et al. Characteristics of ecosystem carbon stocks in Pinus massoniana plantations with differen trestoration age on severely erodedred soils in Southern China [J]. Bull Soil Water Conserv, 2019, 39(1): 37 − 42. [11] 何高迅, 王越, 彭淑娴, 等. 滇中退化山地不同植被恢复下土壤碳氮磷储量与生态化学计量特征[J]. 生态学报, 2020, 40(13): 4425 − 4435. HE Gaoxun, WANG Yue, PENG Shuxian, et al. Soil carbon, nitrogen and phosphorus stocks and ecological stoichiometry characteristics of different vegetation restorations in degraded mountainous area of central Yunnan, China [J]. Acta Ecol Sin, 2020, 40(13): 4425 − 4435. [12] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. [13] 任玉连, 陆梅, 曹乾斌, 等. 南滚河国家级自然保护区典型植被类型土壤有机碳及全氮储量的空间分布特征[J]. 北京林业大学学报, 2019, 41(11): 104 − 115. REN Yulian, LU Mei, CAO Qianbin, et al. Spatial distribution characteristics of soil organic carbon and total nitrogen stocks across the different typical vegetation types in Nangunhe National Nature Reserve, southwestern China [J]. J Beijing For Univ, 2019, 41(11): 104 − 115. [14] 郑纪勇, 邵明安, 张兴昌. 黄土区坡面表层土壤容重和饱和导水率空间变异特征[J]. 水土保持学报, 2004, 18(3): 53 − 56. ZHENG Jiyong, SHAO Ming’ an, ZHANG Xingchang. Spatial variation of surface soils bulk density and saturated hydraulic conductivity on slope in Loess Region [J]. J Soil Water Conserv, 2004, 18(3): 53 − 56. [15] CHOI C S, CAGLE A, MACKNICK J, et al. Effects of revegetationon soil physical and chemical properties in solar photovoltaic infrastructure [J]. Front Environ Sci, 2020, 4(5): 236 − 243. [16] LARNEY F J, LI Lingling, JANZEN H H, et al. Soil quality attributes, soil resilience, and legacy effects following topsoil removal andone-timeamendments [J]. Can J Soil Sci, 2016, 96(2): 177 − 190. [17] JOBBÁGY E, JACKSON R B. The vertical distribution of soil organic carbon and it’s relation to climate and vegetation [J]. Ecol Appl, 2000, 10(2): 423 − 436. [18] 张青青, 张桂莲, 伍海兵, 等. 上海市林地土壤有机碳分布特征及其与土壤理化性质的关系[J]. 浙江农林大学学报, 2019, 36(6): 1087 − 1095. ZHANG Qingqing, ZHANG Guilian, WU Haibing, et al. Soil organic carbon distribution and its relationship with soil physicochemical properties in different forest types of Shanghai City [J]. J Zhejiang A&F Univ, 2019, 36(6): 1087 − 1095. [19] 赵栋, 权丽, 屠彩芸, 等. 拱坝河流域5种森林类型土壤有机碳的分布特征[J]. 水土保持通报, 2018, 38(6): 54 − 60. ZHAO Dong, QUAN Li, TU Caiyun, et al. Distribution characteristics of soil organic carbon in typical forestlands in drainage basin of Gongba River [J]. Bull Soil Water Conserv, 2018, 38(6): 54 − 60. [20] ROUSK J, BROOKES P, BÅÅTH E. Investigate the mechanisms for the opposing pH relationships of fungal and bacterial growth in soil [J]. Soil Biol Biochem, 2010, 42(6): 926 − 934. [21] KEMMITT S J, WRIGHT D, GOULDING K W, et al. pH regulation of carbon and nitrogen dynamics in two agricultural soils [J]. Soil Biol Biochem, 2006, 38(5): 898 − 911. [22] 王玉婷, 查轩, 陈世发, 等. 红壤侵蚀退化马尾松林下不同治理模式土壤化学计量特征[J]. 应用生态学报, 2020, 31(1): 17 − 24. WANG Yuting, ZHA Xuan, CHEN Shifa, et al. Soil stoichiometry of Pinus massoniana forest in red soil erosion area under different management patterns [J]. Chin J Appl Ecol, 2020, 31(1): 17 − 24. [23] 李若南, 楚海燕, 李一清, 等. 森林转换对不同土层土壤碳氮含量及储量的影响[J]. 亚热带资源与环境学报, 2019, 14(1): 23 − 29. LI Ruonan, CHU Haiyan, LI Yiqing, et al. Effects of forest conversion on soil carbon and nitrogen storage in different soil layers [J]. J Subtrop Resour Environ, 2019, 14(1): 23 − 29. [24] ZENG Quanchao, DARBOUX F, MAN Cheng, et al. Soil aggregate stability under different rain conditions for three vegetation types on the Loess Plateau (China) [J]. Catena, 2018, 167: 276 − 283. [25] 张磊, 贾淑娴, 李啸灵, 等. 凋落物和根系输入对亚热带米槠天然林土壤有机碳组分的影响[J]. 水土保持学报, 2021, 35(3): 244 − 251. ZHANG Lei, JIA Shuxian, LI Xiaoling, et al. Effects of litter and root inputs on soil organic carbon fractions in a subtropical natural forest of Castanopsis carlesii [J]. J Soil Water Conserv, 2021, 35(3): 244 − 251. [26] 韩鲁艳, 郝乾坤, 焦菊英. 黄土丘陵沟壑区人工林地的土壤抗蚀性评价[J]. 水土保持通报, 2009, 29(3): 159 − 164. HAN Luyan, HAO Qiankun, JIAO Juying. Soil anti-erodibility of artificial woodlands in the hilly-gullied region of the Loess Plateau [J]. Bull Soil Water Conserv, 2009, 29(3): 159 − 164. [27] 许明祥. 黄土丘陵区生态恢复过程中土壤质量演变及调控[D]. 杨凌: 西北农林科技大学, 2003. XU Mingxiang. Soil Quality Evolvement Mechanism in the Process of Ecosystem Restoration and Its Management in Loess Hilly-gully Region[D]. Yangling: Northwest A&F University, 2003. [28] VOGT K A, GRIER C C, VOGT D J. Production, turn-over, and nutrient dynamics of above and below ground detritus of world forests [J]. Adv Ecol Res, 1986, 15: 303 − 377. [29] GAO Han, HUANG Yimei. Impacts of the three-north shelter forest program on the main soil nutrients in Northern Shaanxi China: ameta analysis[J]. For Ecol Manage, 2020, 458(2). doi: 10.1016/j.foreco.2019.117808. [30] 张帅, 许明祥, 张亚峰, 等. 黄土丘陵区土地利用变化对深层土壤有机碳储量的影响[J]. 环境科学学报, 2014, 34(12): 3094 − 3101. ZHANG Shuai, XU Mingxiang, ZHANG Yafeng, et al. Effects of land use change on storage of soil organic carbon in deep soil layers in the hilly Loess Plateau Region, China [J]. Acta Sci Circumstantiae, 2014, 34(12): 3094 − 3101. [31] 涂夏明, 周家茂, 曹军骥, 等. 黄土高原不同土地利用类型有机碳和黑碳的储量及意义[J]. 地球环境学报, 2017, 8(1): 65 − 71. TU Xiaming, ZHOU Jiamao, CAO Junji, et al. Implication and storage of soil organic carbon and black carbon in different land use types in the topsoil of Loess Plateau [J]. J Earth Environ, 2017, 8(1): 65 − 71. [32] LI Chenhua, LI Yan, TANG Lisong. Soil organic carbon stock and carbon efflux in deep soils of desert and oasi [J]. Environ Earth Sci, 2010, 60(3): 549 − 557. [33] 张金, 许明祥, 王征, 等. 黄土丘陵区植被恢复对深层土壤有机碳储量的影响[J]. 应用生态学报, 2012, 23(10): 2721 − 2727. ZHANG Jin, XU Mingxiang, WANG Zheng, et al. Effects of revegetation on organic carbon storage in deep soils in hilly Loess Plateau Region of Northwest China [J]. Chin J Appl Ecol, 2012, 23(10): 2721 − 2727. [34] GAO Yang, HE Nianpeng, YU Guirui, et al. Long-term effects of different land use types on C, N, and P stoichiometry andstorage in subtropical ecosystems: a case study in China [J]. Ecol Eng, 2014, 67: 171 − 181. [35] OUYANG Shuai, XIANG Wenhua, GOU Mengmeng, et al. Variation in soil carbon, nitrogen, phosphorus and stoichiometry along for forest succession in southern China [J]. Biogesciencs Discuss, 2017, 10. doi:10.5194/bg-2017-408. [36] YU Zaipeng, WANG Minhuang, HUANG Zhiqun, et al. Temporal changes in soil C-N-P stoichiometry over the past 60 years across sbtropicalChina [J]. Global Change Biol, 2018, 24(3): 1308 − 1320. [37] 戴万宏, 黄耀, 武丽, 等. 中国地带性土壤有机质含量与酸碱度的关系[J]. 土壤学报, 2009, 46(5): 851 − 860. DAI Wanhong, HUANG Yao, WU Li, et al. Relationships between soil organic matter content (SOM) and pH in topsoil of zonal soils in China [J]. Acta Pedol Sin, 2009, 46(5): 851 − 860. [38] 郭志华, 张莉, 郭彦茹, 等. 海南清澜港红树林湿地土壤有机碳分布及其与pH 的关系[J]. 林业科学, 2014, 50(10): 8 − 15. GUO Zhihua, ZHANG Li, GUO Yanru, et al. Soil carbon sequestration and its relationship with soil pH in Qinglangang Mangrove Wetlands in Hainan Island [J]. Sci Silv Sin, 2014, 50(10): 8 − 15. [39] 吕秀华. 东北羊草草原不同生境土壤微生物与土壤理化性质关系研究[D]. 长春: 东北师范大学, 2003. LÜ Xiuhua. Study on the Relationship Between Soil Microorganisms and Soil Physicochemical Properties in Different Habitats of Leymus chinensis Grassland in Northeast China[D]. Changchun: Northeast Normal University, 2003. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210500






 下载:
下载: