-
黄精属 Polygonatum 是百合科Liliaceae的多年生草本植物,广布于北温带。《中国植物志》记载全世界约有黄精属植物40种,中国有31种[1]。中药材黄精来源于黄精 Polygonatum sibiricum,多花黄精 P. cyrtonema 或滇黄精 P. kingianum 的干燥根茎,具有补气养阴、健脾、润肺、益肾等传统功效[2]。黄精药食同源,用途非常广泛,可作为临床配方、中成药生产、保健食品配伍及药膳原料使用。由于市场需求量的增加、资源蕴藏量的减少等原因,黄精价格逐渐上涨,但其引种驯化、丰产栽培技术的研究与应用尚处于初级阶段,市场上药材仍主要来源于野生[3]。近年来,黄精属植物在分子生物学方面的研究主要围绕属下物种的鉴定,周晔等[4]采用简单重复序列区间分子标记(inter-simple sequence repeat,ISSR)鉴定黄精与卷叶黄精 Polygonatum cirrhifolium,周晔等[5-6]、朱艳等[7]采用随机扩增多态性DNA分子标记(random amplified polymorphic DNA,RADP)鉴定黄精属部分药用植物。目标起始密码子多态性分子标记(start codon targeted polymorphism,SCoT)是一种基于单引物扩增反应的新型DNA分子标记,具有引物通用性高、实验操作方便、重复性好、多态性高、可获丰富的遗传信息、能产生与性状联系的标记等优点,有效补充了ISSR和RAPD的不足[8]。SCoT分子标记已经被成功应用于多种农作物、花卉等遗传多样性研究,如水稻 Oryza sativa,花生 Arachis hypogaea,柑橘 Citrus reticulata,龙眼 Dimocarpus longan,甘蔗 Saccharum officinarum,牡丹 Paeonia suffruticosa,石蒜 Lycoris radiate,菊花 Chrysanthemum morifolium 等[8-15],近几年,药用植物玄参 Scrophularia ningpoensis,桃儿七 Sinopodophyllum emodi,铁皮石斛 Dendrobium officinale 等也开展了相关研究[16-18],但在中药黄精基原植物的遗传多样性以及种质鉴定等方面未见报道。本研究通过种质资源收集与评价,为黄精的种源筛选、品种选育及中药材生产质量管理规范(GAP)栽培提供研究基础,为黄精资源的可持续利用提供科学依据。
-
不同种源的黄精供试品来自浙江、安徽、湖北、辽宁、云南等地(表 1),于浙江省丽水市莲塘区林业科学院种质资源圃栽植1.5 a,2014年7月采集正常生长的嫩叶,于-20 ℃冰箱保存。经浙江农林大学斯金平教授鉴定,1~8,10~18号为多花黄精,9号为黄精,19号为滇黄精。
表 1 供试的19份黄精种源
Table 1. List of the 19 Polygonatum provenances
编号 种源地 纬度(N)/(°) 经度(E)/(°) 1 浙江丽水莲都 28.45 119.92 2 浙江丽水松阳 28.45 119.49 3 浙江丽水庆元 27.62 119.07 4 浙江丽水龙泉 28.08 119.15 5 浙江金华磐安盘峰 28.94 120.55 6 浙江丽水遂昌桂洋林场 28.52 119.09 7 浙江丽水缙云壶镇 28.82 120.26 8 浙江丽水景宁东坑 27.80 119.72 9 辽宁北票市上园镇 41.62 120.98 10 湖北赤壁 29.73 113.91 11 浙江丽水云和雾溪 28.06 119.56 12 浙江衢州江山 28.74 118.62 13 浙江台州天台石梁 29.24 121.06 14 浙江温州文成石祥林场 27.87 119.84 15 安徽青阳 30.64 117.85 16 浙江杭州淳安 29.61 119.05 17 浙江湖州安吉山川 30.47 119.69 18 浙江绍兴新昌小将林场 29.39 121.10 19 云南漾濞 25.68 99.96 -
移液枪(Eppendorf公司);冷冻离心机(Hitachi公司);聚合酶链式反应(PCR)仪(Biometra公司);紫外分光光度计(NanoDrop 1000);水平电泳槽(北京市六一仪器厂);琼脂糖凝胶成像系统(BIO RAD公司)。Taq DNA聚合酶、三磷酸碱基脱氧核苷酸(dNTPs)等基因组DNA提取相关试剂和DNA marker DL 5 000均购自宝生物工程(大连)有限公司,SCoT引物根据Collard和Mackill[8, 19]公布的引物,由南京金斯瑞生物科技有限公司合成。
-
采用改进的十六烷基三甲基溴化胺(cetyl triethyl ammonium bromide,CTAB)法提取供试材料的基因组DNA。具体如下:黄精叶片经蒸馏水洗净后用吸水纸吸干,剪碎,在加有一定量聚乙烯吡咯烷酮(pvp)的研钵内用液氮冷却碾碎成细粉后,取适量粉样迅速置于2.0 mL的离心管内,加入65 ℃预热的CTAB缓冲液1.0 mL,摇匀后置于65 ℃水浴90 min,期间轻柔搅动5~6次,冷却至室温,16 000 r·min-1离心10 min,吸取上清液至另一2.0 mL的离心管中,加入等体积的氯仿-异戊醇(24:1)萃取液,轻轻颠倒混匀室温,10 000 r·min-1离心10 min,小心吸取上清液至另一离心管中,重复上述步骤2~3次,直至两相间的蛋白质除尽,吸取上清液至另一新的1.5 mL离心管中,加入2/3倍体积预冷的异丙醇,-20 ℃放置30 min,12 000 r·min-1离心10 min,弃去上清液,沉淀用体积分数为70%乙醇1.0 mL漂洗2次,室温风干,用30 μL TE缓冲液(含核糖核酸酶RnaseA)溶解DNA。用质量分数为1.5%的琼脂糖凝胶电泳检测DNA质量,经紫外分光光度计测定浓度后,加双蒸水稀释至10.0 mg·L-1,-20 ℃储存备用。
-
SCoT引物采用COLLARD等[12]开发的引物,共37条,由南京金斯瑞生物科技有限公司合成。选取地理距离较远的6个DNA模版进行引物筛选,根据电泳图谱初步筛选出29条条带多且易于区分的引物。用19个供试材料的DNA样品从初选的引物中经过PCR进行复选,最终挑选出易于区分、重复性高的15条引物来统计多态性。筛选出的引物及退火温度见表 2。SCoT-PCR反应体系:总体积20 μL,内含1×聚合酶链式反应(PCR)缓冲液,2.00 mmol·L-1镁离子(Mg2+),0.15 mmol·L-1脱氧核糖核苷三磷酸(dNTP),0.40 μmol·L-1引物,10.00 ng模板,1×16.67 nkat TaqDNA聚合酶(1 U=16.67 nkat)。扩增程序为预变性94 ℃,3 min;变性94 ℃,50 s,退火50 s,延伸72 ℃,100 s,共40个循环;再延伸72 ℃,5 min;最后4 ℃保存。各取PCR扩增产物5 μL,加1 μL 6 × DNA上样缓冲液混匀后,在质量分数为1.5%的琼脂糖凝胶上电泳分离,缓冲系统为1 × TAE,电压150 V当溴酚蓝指示剂距离琼脂糖凝胶前沿约2~3 cm时停止电泳,在凝胶成像系统上观察、照相并记录。
表 2 筛选出的SCOT引物序列及退火温度
Table 2. Sequence of reliable SCoT primers and the annealing temperature
引物名 序列(5'→3') 退火温度/℃ SP3 CAACAATGGCTACCACCG 59 SP11 AAGCAATGGCTACCACCA 59 SP12 ACGACATGGCGACCAACG 59 SP13 ACGACATGGCGACCATCG 58 SP14 ACGACATGGCGACCACGC 58 SP15 ACGACATGGCGACCGCGA 58 SP18 ACCATGGCTACCACCGCC 56 SP23 CACCATGGCTACCACCAG 59 SP29 CCATGGCTACCACCGGCC 59 SP30 CCATGGCTACCACCGGCG 51 SP31 CCATGGCTACCACCGCCT 50 SP38 ACGACATGGCGACCACCG 58 SP42 AACCATGGCTACCACCGT 59 SP45 GCAACAATGGCTACCACA 59 SP58 ACAATGGCTACCACCACC 59 -
根据PCR扩增产物的电泳结果,对清晰且易于辨认的条带根据其迁移率及有无,统计所有的二元数据,有带(显性)记为1,无带(隐性)记为0,从而形成SCoT标记的0,1二维数字矩阵。利用POPGENE 32软件计算19份黄精种质的遗传相似性系数和遗传距离,利用NTsys-pc 2.1计算各黄精种源间Nei’s遗传相似性系数,按非加权配对算术平均法(unweighted pair group method using arithmetic average,UPGMA)建立各样品间亲缘关系的聚类图。用NTsys-pc 2.1软件将遗传相似系数进行Dcenter数据转化,求其特征量和特征向量,生成主坐标三维图,进行主坐标分析。
-
采集黄精新鲜叶片结合改良的CTAB法提取的基因组DNA纯度较好,在电泳图上看出:没有蛋白质和核糖核酸(RNA)的污染,没有拖尾和降解的现象,紫外分光光度法检测的DNA质量浓度为100.00~900.00 mg·L-1,D(260)/D(280)的比值为1.8~2.0,符合后续PCR的要求。
-
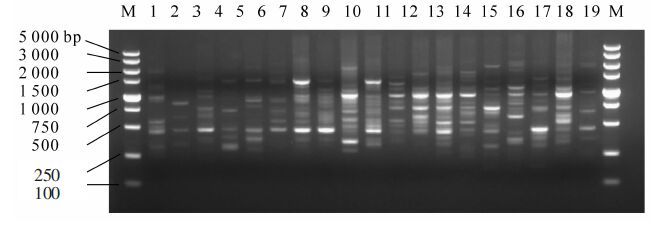
15个SCoT引物进行19个黄精样品扩增总共得到500个条带,平均每个引物产生33.3个条带,其中多态性条带498个,多态性比率为99.6%。条带大小为250~3 000 bp不等(图 1)。
-
扩增结果用NTsys-pc 2.1软件进行聚类分析得图 2。在遗传系数为0.6的水平上,供试样品被分成两大类(Ⅰ和Ⅱ),其中Ⅰ类又分为5组:①组包含6份材料,除5号来源于浙江金华,其他都来源于浙江丽水,这些黄精亲缘性最近;②组均来源于浙江丽水;来自湖北赤壁的10号、来自安徽青阳的15号、来自浙江杭州的16号和来自浙江湖州的17号聚为③组,其中16号和17号相似性系数最高,达到了0.73,位于整个聚类图的最基部;来自浙江绍兴的18号和来自云南漾濞的19号(滇黄精)聚为④组;⑤组包括4个种源地的黄精,11号与12号比较接近,13号与14号比较接近。Ⅱ类仅包括1组,采集于辽宁的9号(黄精)单独聚为一类,与其他供试样品的亲缘关系最远。
-
遗传距离是显性基因频率的函数,能判断种源间遗传关系的远近。通过种源间的遗传相似度和遗传距离(表 3),可以定量分析种源之间的相似性。从SCoT的分析结果来看,19个黄精种质的遗传相似性范围为0.554 0~0.734 0,遗传距离范围为0.309 2~0.590 6;其中16号浙江杭州的多花黄精与17号浙江湖州的多花黄精遗传距离最近,相似度最高;9号辽宁的黄精与18号浙江绍兴的多花黄精遗传距离最远,相似度最低。
表 3 19份黄精种质的遗传相似度与遗传距离
Table 3. Genetic similarity and distance of 19 Polygonatum germplasms
种源编号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 1 0.7200 0.6480 0.6900 0.6340 0.6660 0.6000 0.6360 0.5940 0.5620 0.6100 0.6040 0.5840 0.6140 0.6080 0.6520 0.6300 0.6320 0.6380 2 0.3285 0.6960 0.6940 0.6220 0.7140 0.6560 0.6480 0.5860 0.6460 0.6300 0.6320 0.6280 0.6540 0.6520 0.6560 0.6900 0.6360 0.6900 3 0.4339 0.3624 0.6700 0.6340 0.6580 0.6640 0.6520 0.5900 0.6460 0.6140 0.6120 0.5840 0.6260 0.5960 0.6280 0.6500 0.6120 0.6300 4 0.3711 0.3653 0.4005 0.7000 0.7000 0.6380 0.6500 0.5840 0.6400 0.6280 0.6100 0.6180 0.6200 0.6460 0.6500 0.6600 0.6500 0.6640 5 0.4557 0.4748 0.4557 0.3567 0.6880 0.6260 0.6700 0.5920 0.5960 0.6000 0.5900 0.5940 0.6440 0.6060 0.6020 0.6400 0.6220 0.6360 6 0.4065 0.3369 0.4186 0.3567 0.3740 0.6700 0.6980 0.6000 0.6240 0.6320 0.6620 0.6140 0.6640 0.6380 0.6580 0.6720 0.6420 0.6280 7 0.5108 0.4216 0.4095 0.4494 0.4684 0.4005 0.7160 0.6100 0.6620 0.6380 0.6200 0.6280 0.6100 0.6400 0.6240 0.6380 0.6200 0.6220 8 0.4526 0.4339 0.4277 0.4308 0.4005 0.3595 0.3341 0.6100 0.6380 0.6260 0.6400 0.6520 0.6340 0.6160 0.6400 0.6660 0.6000 0.6220 9 0.5209 0.5344 0.5276 0.5379 0.5242 0.5108 0.4943 0.4943 0.6040 0.5760 0.6180 0.6260 0.6000 0.5980 0.5980 0.5800 0.5540 0.6040 10 0.5763 0.4370 0.4370 0.4463 0.5175 0.4716 0.4125 0.4494 0.5042 0.6600 0.6380 0.6220 0.6160 0.6460 0.6100 0.6760 0.6460 0.6080 11 0.4943 0.4620 0.4878 0.4652 0.5108 0.4589 0.4494 0.4684 0.5516 0.4155 0.7020 0.6620 0.6560 0.6060 0.6260 0.6360 0.6380 0.6120 12 0.5042 0.4589 0.4910 0.4943 0.5276 0.4125 0.4780 0.4463 0.4813 0.4494 0.3538 0.6960 0.6580 0.6040 0.6440 0.6300 0.6480 0.6180 13 0.5379 0.4652 0.5379 0.4813 0.5209 0.4878 0.4652 0.4277 0.4684 0.4748 0.4125 0.3624 0.6900 0.6040 0.6640 0.6620 0.6520 0.6220 14 0.4878 0.4246 0.4684 0.4780 0.4401 0.4095 0.4943 0.4557 0.5108 0.4845 0.4216 0.4186 0.3711 0.6180 0.6500 0.6440 0.6500 0.6240 15 0.4976 0.4277 0.5175 0.4370 0.5009 0.4494 0.4463 0.4845 0.5142 0.4370 0.5009 0.5042 0.5042 0.4813 0.6760 0.6740 0.6120 0.6100 16 0.4277 0.4216 0.4652 0.4308 0.5075 0.4186 0.4716 0.4463 0.5142 0.4943 0.4684 0.4401 0.4095 0.4308 0.3916 0.7340 0.6600 0.6420 17 0.4620 0.3711 0.4308 0.4155 0.4463 0.3975 0.4494 0.4065 0.5447 0.3916 0.4526 0.4620 0.4125 0.4401 0.3945 0.3092 0.6380 0.6560 18 0.4589 0.4526 0.4910 0.4308 0.4748 0.4432 0.4780 0.5108 0.5906 0.4370 0.4494 0.4339 0.4277 0.4308 0.4910 0.4155 0.4494 0.6500 19 0.4494 0.3711 0.4620 0.4095 0.4526 0.4652 0.4748 0.4748 0.5042 0.4976 0.4910 0.4813 0.4748 0.4716 0.4943 0.4432 0.4216 0.4308 说明:对角线以上为遗传相似度,对角线以下为遗传距离。 -
利用19份黄精种质的遗传相似性系数进行主坐标分析,绘制三维散点图(图 3)。位置近表示亲缘关系比较接近,位置远表示亲缘关系比较远。从主坐标图可以看出:19份种质被分为6组,第1组为1号、2号、3号、4号、5号、6号,来源于浙江丽水与浙江金华的黄精种质,位于主坐标轴的最右侧。第2组为7号、8号,分别来源于浙江丽水缙云和浙江丽水景宁的黄精种质;第3组为10号、15号、16号、17号,分别来源于湖北赤壁、安徽青阳、浙江杭州、浙江湖州的黄精种质;第4组为18号和19号,分别来源于浙江绍兴和云南漾濞;第5组为11号、12号、13号、14号,分别来源于浙江丽水、浙江衢州、浙江台州、浙江温州;第6组为9号,来源于辽宁的黄精种质。其中第6组与第1组、第5组距离相对较远,与第5组相对来说最近。比较主坐标分析结果与系统聚类分析结果可以看出2种方法反映出的遗传关系基本一致,但主坐标分析可以从不同方向不同层面更加直观地显示各种质间的关系。
-
黄精为多基原药用植物,由于各类群间性状交叉,地理分布区重叠,黄精属的分类一直存在争议,种间分类仍不明确。BAKER[1]根据叶序将黄精属分为互生叶类(Alternifolia),轮生叶类(Verticillata)和对生叶类(Oppositifolia),但从中国的大量资料来看,叶序这个性状并不十分稳定,在同一个种内就有变化。研究结果表明:9号来自辽宁的黄精为轮生叶,叶片呈线性,根茎形态也与其他黄精有明显的区别,单独聚为一类,与其他的药用黄精的相似性仅为0.6;这也可能与地理距离较远有一定的关系。19号来自云南的滇黄精为轮生叶序,亲缘关系与互生叶序的多花黄精无明显差异;聚类分析显示与18号来自浙江绍兴的多花黄精相似性较高,聚为一类,这也印证了吴世安等[20]认为黄精属仍处在比较活跃的分化期的观点,需要用其他的方法进一步的研究。在分子水平对黄精开展的相关研究很少,仅有ISSR,RAPD,RFLP分子标记研究黄精的系统位置和鉴定的报道[4-5, 20]。著者建立SCoT分子标记方法并应用于黄精的遗传多样性研究,为黄精的种源鉴定提供一定的科学依据。
对多态性条带分析表明:15个SCoT引物进行19个黄精样品扩增总共得到500个条带,平均每个引物产生33.3个条带,其中多态性条带498个,多态性比率为99.6%,从中可以看出:黄精种质的遗传多样性丰富。样品间UPGMA聚类分析的相似系数范围为0.600 0~0.730 0,也可以得出黄精种质存在较丰富的遗传多样性,亲缘关系较远。来自湖北赤壁的10号、来自安徽青阳的15号与浙江杭州的16号、浙江湖州的17号,这些地理距离较远的黄精聚为一类,表明基于SCoT标记的黄精聚类分析没有地理相关性,其原因可能与黄精的适宜栽植地区广泛,遗传变异较大有关系。
要全面了解黄精类群的分类及变异规律,还需要进一步收集种源,建立更为有效的分子标记或新方法对黄精遗传多样性的变异大小、时空分布等从遗传学基础上进行系统的剖析,才能真正揭示该类群的遗传多样性,为合理地制订引种驯化及良种遗传改良策略提供理论支持,为黄精药材的规范化栽培提供佐证,为保护资源并可持续应用提供科学依据。
Genetic diversity of Polygonatum germplasm
-
摘要: 为揭示中药材黄精种质资源的遗传多样性及种源间亲缘关系,建立了目标起始密码子多态性分子标记(SCoT)方法,采用非加权平均距离法(UPGMA)和主坐标分析(PCoA)等方法对19份不同种源的黄精Polygonatum材料进行分析。从待选的29个引物中筛选出15个SCoT引物用于扩增基因组DNA,总共得到500个条带,平均每个引物产生33.3个条带,其中多态性条带498个,多态性比率为99.6%,19个黄精种质间的遗传相似系数范围为0.554 0~0.734 0。结果表明:不同种源的黄精种质有较丰富的遗传多样性,SCoT分子标记可以为黄精的分类及鉴别提供一定的依据,为中药黄精优良品种的培育及资源可持续利用提供研究基础。图3表3参20Abstract: To explore the genetic diversity and relationship of germplasm resources of polygonati rhizoma (derived from Polygonatum cyrtonema and P. sibiricum), the Start Codon Targeted (SCoT) molecular marker technique was established, and the unweighted pair-group method with arithmetic means (UPGMA) and principal coordinates analysis (PCoA) were used to study the genetic diversity of 19 Polygonatum provenances followed by a cluster analysis. Fifteen SCoT primers were eventually screened from 29 primers and then used to amplify the genome DNAs. Results showed a total of 500 SCoT loci were produced with 33.3 SCoT loci per primer including 498 polymorphic loci having a polymorphism rate of 99.6%. The genetic similarity coefficients were between 0.554 0-0.734 0, and the cluster analysis showed that Polygonatum germplasm from different sources had abundant genetic diversity. Thus, SCoT molecular markers could provide some basis for classification and identification of Polygonatum with this research laying a foundation for quicker breeding of varieties and sustainable use of Polygonatum resources.[Ch, 3 fig. 3 tab. 20 ref.]
-
Key words:
- Chinese herbology /
- Polygonatum /
- ScoT /
- germplasm resources /
- cluster analysis /
- genetic diversity
-
表 1 供试的19份黄精种源
Table 1. List of the 19 Polygonatum provenances
编号 种源地 纬度(N)/(°) 经度(E)/(°) 1 浙江丽水莲都 28.45 119.92 2 浙江丽水松阳 28.45 119.49 3 浙江丽水庆元 27.62 119.07 4 浙江丽水龙泉 28.08 119.15 5 浙江金华磐安盘峰 28.94 120.55 6 浙江丽水遂昌桂洋林场 28.52 119.09 7 浙江丽水缙云壶镇 28.82 120.26 8 浙江丽水景宁东坑 27.80 119.72 9 辽宁北票市上园镇 41.62 120.98 10 湖北赤壁 29.73 113.91 11 浙江丽水云和雾溪 28.06 119.56 12 浙江衢州江山 28.74 118.62 13 浙江台州天台石梁 29.24 121.06 14 浙江温州文成石祥林场 27.87 119.84 15 安徽青阳 30.64 117.85 16 浙江杭州淳安 29.61 119.05 17 浙江湖州安吉山川 30.47 119.69 18 浙江绍兴新昌小将林场 29.39 121.10 19 云南漾濞 25.68 99.96 表 2 筛选出的SCOT引物序列及退火温度
Table 2. Sequence of reliable SCoT primers and the annealing temperature
引物名 序列(5'→3') 退火温度/℃ SP3 CAACAATGGCTACCACCG 59 SP11 AAGCAATGGCTACCACCA 59 SP12 ACGACATGGCGACCAACG 59 SP13 ACGACATGGCGACCATCG 58 SP14 ACGACATGGCGACCACGC 58 SP15 ACGACATGGCGACCGCGA 58 SP18 ACCATGGCTACCACCGCC 56 SP23 CACCATGGCTACCACCAG 59 SP29 CCATGGCTACCACCGGCC 59 SP30 CCATGGCTACCACCGGCG 51 SP31 CCATGGCTACCACCGCCT 50 SP38 ACGACATGGCGACCACCG 58 SP42 AACCATGGCTACCACCGT 59 SP45 GCAACAATGGCTACCACA 59 SP58 ACAATGGCTACCACCACC 59 表 3 19份黄精种质的遗传相似度与遗传距离
Table 3. Genetic similarity and distance of 19 Polygonatum germplasms
种源编号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 1 0.7200 0.6480 0.6900 0.6340 0.6660 0.6000 0.6360 0.5940 0.5620 0.6100 0.6040 0.5840 0.6140 0.6080 0.6520 0.6300 0.6320 0.6380 2 0.3285 0.6960 0.6940 0.6220 0.7140 0.6560 0.6480 0.5860 0.6460 0.6300 0.6320 0.6280 0.6540 0.6520 0.6560 0.6900 0.6360 0.6900 3 0.4339 0.3624 0.6700 0.6340 0.6580 0.6640 0.6520 0.5900 0.6460 0.6140 0.6120 0.5840 0.6260 0.5960 0.6280 0.6500 0.6120 0.6300 4 0.3711 0.3653 0.4005 0.7000 0.7000 0.6380 0.6500 0.5840 0.6400 0.6280 0.6100 0.6180 0.6200 0.6460 0.6500 0.6600 0.6500 0.6640 5 0.4557 0.4748 0.4557 0.3567 0.6880 0.6260 0.6700 0.5920 0.5960 0.6000 0.5900 0.5940 0.6440 0.6060 0.6020 0.6400 0.6220 0.6360 6 0.4065 0.3369 0.4186 0.3567 0.3740 0.6700 0.6980 0.6000 0.6240 0.6320 0.6620 0.6140 0.6640 0.6380 0.6580 0.6720 0.6420 0.6280 7 0.5108 0.4216 0.4095 0.4494 0.4684 0.4005 0.7160 0.6100 0.6620 0.6380 0.6200 0.6280 0.6100 0.6400 0.6240 0.6380 0.6200 0.6220 8 0.4526 0.4339 0.4277 0.4308 0.4005 0.3595 0.3341 0.6100 0.6380 0.6260 0.6400 0.6520 0.6340 0.6160 0.6400 0.6660 0.6000 0.6220 9 0.5209 0.5344 0.5276 0.5379 0.5242 0.5108 0.4943 0.4943 0.6040 0.5760 0.6180 0.6260 0.6000 0.5980 0.5980 0.5800 0.5540 0.6040 10 0.5763 0.4370 0.4370 0.4463 0.5175 0.4716 0.4125 0.4494 0.5042 0.6600 0.6380 0.6220 0.6160 0.6460 0.6100 0.6760 0.6460 0.6080 11 0.4943 0.4620 0.4878 0.4652 0.5108 0.4589 0.4494 0.4684 0.5516 0.4155 0.7020 0.6620 0.6560 0.6060 0.6260 0.6360 0.6380 0.6120 12 0.5042 0.4589 0.4910 0.4943 0.5276 0.4125 0.4780 0.4463 0.4813 0.4494 0.3538 0.6960 0.6580 0.6040 0.6440 0.6300 0.6480 0.6180 13 0.5379 0.4652 0.5379 0.4813 0.5209 0.4878 0.4652 0.4277 0.4684 0.4748 0.4125 0.3624 0.6900 0.6040 0.6640 0.6620 0.6520 0.6220 14 0.4878 0.4246 0.4684 0.4780 0.4401 0.4095 0.4943 0.4557 0.5108 0.4845 0.4216 0.4186 0.3711 0.6180 0.6500 0.6440 0.6500 0.6240 15 0.4976 0.4277 0.5175 0.4370 0.5009 0.4494 0.4463 0.4845 0.5142 0.4370 0.5009 0.5042 0.5042 0.4813 0.6760 0.6740 0.6120 0.6100 16 0.4277 0.4216 0.4652 0.4308 0.5075 0.4186 0.4716 0.4463 0.5142 0.4943 0.4684 0.4401 0.4095 0.4308 0.3916 0.7340 0.6600 0.6420 17 0.4620 0.3711 0.4308 0.4155 0.4463 0.3975 0.4494 0.4065 0.5447 0.3916 0.4526 0.4620 0.4125 0.4401 0.3945 0.3092 0.6380 0.6560 18 0.4589 0.4526 0.4910 0.4308 0.4748 0.4432 0.4780 0.5108 0.5906 0.4370 0.4494 0.4339 0.4277 0.4308 0.4910 0.4155 0.4494 0.6500 19 0.4494 0.3711 0.4620 0.4095 0.4526 0.4652 0.4748 0.4748 0.5042 0.4976 0.4910 0.4813 0.4748 0.4716 0.4943 0.4432 0.4216 0.4308 说明:对角线以上为遗传相似度,对角线以下为遗传距离。 -
[1] 汪发缵,唐进. 中国植物志:第15卷被子植物门单子叶植物纲百合(二)[M]. 北京:科学出版社,1978:52-80. [2] 国家药典委员会. 中华人民共和国药典:2010年版一部[S]. 北京:中国医药科技出版社,2010:288. [3] 李莺,赵兵,陈克克,等. 黄精的研究进展[J]. 中国野生植物资源,2012,31(1):9-13. LI Ying,ZHAO Bing,CHEN Keke,et al. Progress of research on Polygonatum sibiricum[J]. Chin Wild Plant Resour,2012,31(1):9-13. [4] 周晔,王润玲,唐铖,等. ISSR法鉴定中药黄精与卷叶黄精[J]. 天津医科大学学报,2006,12(2):178-181. ZHOU Ye,WANG Runling,TANG Cheng,et al. Identification of Polygonatum sibiricum and P. cirrhifolium by ISSR[J]. J Tianjin Med Univ,2006,12(2):178-181. [5] 周晔,王润玲,唐铖,等. RAPD标记法鉴定中药黄精及长梗黄精的研究[J]. 时珍国医国药,2007,18(9):2149-2150. [6] 周晔,唐铖,张攻,等. 随机扩增多态性DMA技术与简单序列重复标记法探讨部分黄精属药用植物亲缘关系的研究[J]. 时珍国医国药,2008,19(7):1646-1647. ZHOU Ye,TANG Cheng,ZHANG Gong,et al. Studies on the relationship of some species of Polygonatum by RAPD and ISSR[J]. Lishizhen Med Mater Med Res,2008,19(7):1646-1647. [7] 朱艳,孙伟,秦民坚,等. 基于RAPD技术探讨黄精属部分药用植物系统位置[J]. 中国野生植物资源,2011,30(6):34-37. ZHU Yan,SUN Wei,QIN Minjian,et al. Systematic position of some medicinal plants from Polygonatum based on RAPD[J]. Chin Wild Plant Resour,2011,30(6):34-37. [8] COLLARD B C Y,MACKILL D J. Start codon targeted(SCoT) polymorphism:a simple,novel DNA marker technique for generating gene-targeted markers in plants[J]. Plant Mol Biol Rep,2009,27(1):86-93. [9] 熊发前,蒋菁,钟瑞春,等. 目标起始密码子多态性(SCoT)分子标记技术在花生属中的应用[J]. 作物学报,2010,36(12):2055-2061. XIONG Faqian,JIANG Jing,ZHONG Ruichun,et al. Application of SCoT molecular marker in genus Arachis[J]. Acta Agron Sin,2010,36(12):2055-2061. [10] 韩国辉,向素琼,汪卫星,等. 柑橘SCoT分子标记技术体系的建立及其在遗传分析中的应用[J]. 园艺学报,2011,38(7):1243-1250. HAN Guohui,XIANG Suqiong,WANG Weixing,et al. Establishment and application of SCoT molecular marker system for Citrus[J]. Acta Horict Sin,2011,38(7):1243-1250. [11] 陈虎,何新华,罗聪,等. 龙眼24个品种的SCoT遗传多样性分析[J]. 园艺学报,2010,37(10):1651-1654. CHEN Hu,HE Xinhua,LUO Cong,et al. Analysis on the genetic diversity of 24 Longan (Dimocarpus longan) accessions by SCoT markers[J]. Acta Hortic Sin,2010,37(10):1651-1654. [12] 杨翠. 基于SCoT标记分析甘蔗种质资源遗传多样性[D]. 福州:福建农林大学,2010. YANG Cui. Analysis of Genetic Diversity Based on SCOT Markers in Sugarcane Germplasms[D]. Fuzhou:Fujian Agriculture and Forestry University,2010. [13] 侯小改,王娟,贾甜,等. 牡丹SCoT分子标记正交优化及引物筛选[J]. 华北农学报,2011,26(5):92-96. HOU Xiaogai,WANG Juan,JIA Tian,et al. Orthogonal optimization of SCoT-PCR system and primer screening of tree peony[J]. Acta Agric Boreal-Sin,2011,26(5):92-96. [14] 姜小凤,高燕会,童再康,等. 石蒜属植物SCoT-PCR反应体系构建及优化[J]. 浙江农林大学学报,2013,30(3):444-452. JIANG Xiaofeng,GAO Yanhui,TONG Zaikang,et al. Establishing and optimizing a SCoT-PCR system for Lycoris[J]. J Zhejiang A & F Univ,2013,30(3):444-452. [15] 李丕睿,蒋甲福,陈素梅,等. 菊属植物SCoT分子标记技术在遗传多样性分析中的应用[J]. 园艺学报,2013,40(10):2015-2025. LI Pirui,JIANG Jiafu,CHEN Sumei,et al. Establishment and optimization of SCoT molecular marker system in Chrysanthemum and its application of analysis on genetic diversity[J]. Acta Horict Sin, 2013, 40(10):2015-2025. [16] 陈大霞,张雪,王钰,等. 应用SCoT标记分析玄参种质资源的遗传多样性[J]. 中国中药杂志,2012,37(16):2368-2372. CHEN Daxia,ZHANG Xue,WANG Yu,et al. Genetic diversity of Scrophularia ningpoensis based on SCoT analysis[J]. China J Chin Mater Med,2012,37(16):2368-2372. [17] 陈大霞,赵纪峰,刘翔,等. 濒危药用植物桃儿七野生居群遗传多样性与遗传结构的SCoT分析[J]. 中国中药杂志,2013,38(2):278-283. CHEN Daxia,ZHAO Jifeng,LIU Xiang,et al. Genetic diversity and genetic structure of endangered wild Sinopodophyllum emodi by start codon targeted polymorphism[J]. China J Chin Mater Med, 2013, 38(2):278-283. [18] 赵瑞强,高燕会,章晓玲,等. 铁皮石斛SCoT-PCR反应体系构建及优化[J]. 核农学报,2012,26(4):648-655. ZHAO Ruiqiang,GAO Yanhui,ZHANG Xiaoling,et al. Establishment and optimization of SCoT-PCR reaction system for Dendrobium officinale[J]. Acta Agric Nucl Sin,2012,26(4):648-655. [19] 熊发前,唐荣华,陈忠良,等. 目标起始密码子多态性(SCoT):一种基于翻译起始位点的目的基因标记新技术[J]. 分子植物育种,2009,7(3):635-638. XIONG Faqian,TANG Ronghua,CHEN Zhongliang,et al. SCoT:a novel gene targeted marker technique based on the translation start codon[J]. Mol Plant Breed,2009,7(3):635-638. [20] 吴世安,吕海亮,杨继,等. 叶绿体DNA片段的RFLP分析在黄精族系统学研究中的应用[J]. 植物分类学报,2000,38(2):97-110. WU Shian,LÜ Hailiang,YANG Ji,et al. Molecular systematic studies on the tribe Polygonateae (s. l.) in China based on RFLPs data of PCR-amplified chloroplast DNA fragments[J]. Acta Phytotaxon Sin,2000,38(2): 97-110. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2016.06.023







 下载:
下载: