-
高异黄酮是类黄酮化合物中结构特殊的一类,其母体结构(C6-C3-C1-C6)比异黄酮(C6-C3-C6)多1个碳原子,具有独特的9号碳骨架。这种特殊的结构使高异黄酮表现出显著的抗氧化[1]和抗糖尿病活性[2−4],在医药和功能性食品领域具有重要应用潜力[5]。然而,高异黄酮在植物中的分布较为有限,主要在天门冬科Asparagaceae和豆科Fabaceae植物中被发现,在蓼科Polygonaceae、马齿苋科Portulacaceae等植物中仅有少量存在[6−8]。目前,已从植物中分离鉴定出300多种高异黄酮,其中从豆科植物中分离出92种,尤以苏木属Caesalpinia植物最为丰富,已经分离出近30种高异黄酮;从天门冬科植物中分离出200多种,其中麦冬Ophiopogon japonicus是高异黄酮的重要天然来源[9],已鉴定出近60种高异黄酮;从黄精属Polygonatum植物中分离出39种高异黄酮,其中以多花黄精Polygonatum cyrtonema最多,已鉴定出17种高异黄酮[10−11]。
尽管高异黄酮的分离鉴定研究已取得一定进展,但其生物合成途径的研究仍较为匮乏。现有研究表明,查尔酮可能是高异黄酮生物合成的前体物质[12−13]。紫花苜蓿Medicago sativa 的ChOMT(Chalcone O-methyltransferase)基因在大肠埃希菌Escherichia coli外源表达系统中能够催化2′,4′,4-三羟基查尔酮的2′-OH甲基化,生成4,4′-二羟基-2′-甲氧基查尔酮[14]。这一发现为ChOMT基因的功能研究奠定了基础,同时也为利用合成生物学手段高效异源合成高异黄酮提供了可能。
在植物合成生物学研究中,选择合适的宿主生物(即“底盘”)是设计阶段的关键之一[15]。目前,已开发的底盘植物包括烟草Nicotiana tabacum[16]、水稻Oryza sativa[17]、番茄Solanum lycopersicum[18]、拟南芥Arabidopsis thaliana等多种植物。其中,番茄因其丰富的遗传资源、成熟的遗传转化体系以及完善的基因组数据库[19−21],成为合成生物学研究的理想底盘植物。此外,番茄在商业化种植中具有广泛的应用基础,因此,本研究选择番茄作为高异黄酮的合成底盘,旨在构建高异黄酮营养强化的番茄植株,为高异黄酮的高效生产和应用提供新的途径。
-
番茄品种‘Micro Tom’于2023年种植于植物生长发育培养室,种子由浙江农林大学森林药材课题组扩繁保存,大肠埃希菌Escherichia coli DH5α和农杆菌Agrobacterium tumefaciens GV3101购自上海唯地生物技术有限公司,MS来自于phytotech公司的M519系列。LB培养基:质量分数为1.0%胰蛋白胨,质量分数为0.5%酵母提取物,质量分数为1.0%氯化钠;酵母膏肉汤培养基(YEP):质量分数为1.0%胰蛋白胨,质量分数为1.0%酵母提取物,质量分数为0.5%氯化钠;1/2MS0培养基: MS 2.21g,琼脂7.2g,水1 000 mL,pH 5.8~6.0;MS0-AS溶液:MS 4.43 g,蔗糖30 g,水1 000 mL,pH 5.8~6.0,高温灭菌后,加1 mL乙酰丁香酮(AS)。MS0培养基:MS 4.43 g,蔗糖30 g,琼脂7.2 g,水1 000 mL,pH 5.8~6.0。
-
植物表达载体为改造过的pCAMBIA1380质粒,由森林食物资源挖掘与利用全国重点实验室保存。紫花苜蓿ChOMT基因目的序列来自美国国家生物技术信息中心(NCBI)网站(登录号 L10211),以紫花苜蓿cDNA 为模板,设计在 5′端引入酶切位点及保护碱基的特异引物 ChOMT-F-XbaI:5′- TCAGATCTGAGAGAACACGGGGGACTGTCGAC-3′,ChOMT-R-SalI:5′-TCGTCGACGTTTGTGCCGCTGCCCTTGTCATC-3′进行扩增,得到的目的片段经双酶切法装入pCAMBIA1380,并测序验证。构建的表达载体如图1。
-
将重组质粒 pCAMBIA1380-ChOMT 采用热击法转到农杆菌菌株 GV3101 中。具体转化步骤如下:取 2 μL重组质粒加入到 GV3101 感受态细胞中;迅速放入液氮中冷冻 5 min,37 ℃热击 5 min,冰浴 5 min;加入600 μL LB 培养基,28 ℃振荡培养 3~4 h;吸取上述菌液100 μL 涂布于 YEP+25 μg·mL−1利福平+100 μg·mL−1卡那霉素的固体培养基上,30 ℃培养 2~3 d。挑取单克隆,用基因特异性检测引物进行 聚合酶链式反应(PCR)鉴定,得到的阳性克隆用于番茄转化。
-
①种子灭菌。在超净工作台中,将称量好的番茄种子倒入灭过菌的100 mL锥形瓶中,加体积分数为75%的乙醇,摇晃30 s,用无菌水洗2遍,质量分数为2.0%次氯酸钠溶液浸泡,在摇床上摇1 h,用无菌水洗5遍,放4 ℃冰箱过夜。②外植体的获取。将灭菌后的种子在超净工作台上播到1/2MS0培养基中,播种5 d后,番茄2片子叶完全展开且没有真叶长出,即可剪下子叶,置于MS0-AS溶液的玻璃皿中,待所有子叶剪完后,转移到铺有滤纸的A1共培养培养基[(MS0 + 2.0 mg·L−1ZT + 0.1 mg·L−1吲哚乙酸(IAA)]上,叶面朝上,锡纸包裹后置于黑暗条件下预培养2 d。③农杆菌侵染。将携带目的基因的农杆菌GV3101(pCAMBIA1380-ChOMT)震荡培养过夜,4 000 r·min−1离心10 min,收集菌体,用MS0-AS溶液重悬至D(600)=0.3,与上述预培养的外植体共孵育15 min,叶背朝上转接到A1共培养培养基上,黑暗过夜共培养。④脱分化与再分化。将A1中的叶片转接到A2愈伤诱导培养基[MS0 +2.0 mg·L−1玉米素(ZT) + 0.1 mg·L−1IAA + 100.0 mg·L−1卡那霉素 +300.0 mg·L−1 替门汀(Timentin)]中,叶面朝上培养50 d,待愈伤长出后,转移至A3芽诱导培养基(MS0+1.0 mg·L−1ZT + 0.1 mg·L−1IAA + 50.0 mg·L−1卡那霉素+ 50.0 mg·L−1替门汀)中,在A3培养基中培养30 d左右,待小苗长到5 cm,转移到A4根诱导培养基(1/2MS0 + 0.3 mg·L−1IAA + 30.0 mg·L−1卡那霉素 + 150.0 mg·L−1替门汀)中进行生根培养,10 d左右即可生根,进行土壤移栽。
-
分析叶片和果实品质时,每个样品的果肉各用5 mL冻存管取样,装好样品后,将其快速放入液氨中,然后移至−80 ℃超低温箱保存。代谢组学分析样品的提取流程参照王莎等[22]的方法,将提取好的样品保存于进样瓶中,利用超高效液相色谱(UPLC,Shim-pack UFLC SHIMADZU CBM30A)和串联质谱 (MS/MS,Applied Biosystems
4500 QTRAP)对样本进行物质分离和鉴定。 -
质控样本(QC)为3组分析样品提取物的等量混合物。检测分析时,每10个分析样本中插入1个质控样本。代谢组数据分析基于京都基因和基因组数据库(KEGG)化合物数据库和MetWare数据库,以及多反应监测(MRM)开展样品代谢物的定性和定量质谱分析,代谢物鉴定MS容差和MS2容差设置为20 mg·kg−1,代谢物的定量利用三重四极杆质谱的多反应监测模式分析完成。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正.。利用Analyst 1.6.3软件处理质谱数据,每个色谱峰的峰面积代表对应物质的相对含量。采用多元统计分析,对3组样品进行主成分分析和聚类分析,根据正交偏最小二乘法判别分析法(OPLS-DA)预测模型的可靠性。采取将变化倍数和OPLS-DA模型的变量重要性投影(VIP)相结合的方法筛选差异代谢物,变化倍数为2倍以上或0.5倍以下,OPLS-DA的VIPz1则认为差异显著。
-
将构建好的重组质粒 pCAM1380-ChOMT活化后,利用农杆菌介导的叶盘转化法转化MicroTom番茄叶片。经农杆菌侵染的番茄叶片在MS培养基上暗培养2~3 d后,转到筛选培养基上(图2A)。经历2~4周培养后番茄叶缘开始分化出愈伤组织(图2B),期间通过更换新的培养基确保愈伤组织不断分化长大(图2C),培养7~8周开始产生抗性丛苗(图2D)。切下完整抗性丛苗接种到生根培养基,经过2~3周的培养丛苗开始生根并正常生长(图2E)。当番茄生根2周后可进行移栽(图2F)。共得到6株转化番茄。
-
以转化的6株番茄DNA为模板,未转化番茄DNA为阴性对照,对目的基因进行PCR检测,发现转化番茄扩增出的条带略大于1 000 bp,与目的基因1 119 bp大小一致(图3A)。
-
转化的质粒中携带有GFP报告基因,所以转化的番茄在450~490 nm蓝光波长下会发出绿色的荧光,将转化长大的番茄放在析浦手持式单波长荧光手电筒GFPfinder-
2101 照射下,发出绿色荧光,野生型番茄无绿色荧光(图3B)。因此,荧光检测进一步证明ChOMT转基因番茄构建成功。 -
图4为混样质控(QC) 样本的总离子流图(TIC)及多反应监测模式(MRM)代谢物检测多峰图(XIC),横坐标为代谢物检测的保留时间(RT),纵坐标为离子检测的离子流强度(单位为 cps,count per second)。MRM代谢物检测多峰图展示了样本中能够检测到的物质,每个不同颜色的色谱峰代表检测到的1个代谢物。通过三重四极杆筛选出每个物质的特征离子,在检测器中获得特征离子的信号强度,用MultiQuant软件打开样本下机质谱文件,进行色谱峰的积分和校正工作,每个色谱峰的峰面积代表对应物质的相对含量,最后导出所有色谱峰面积积分。
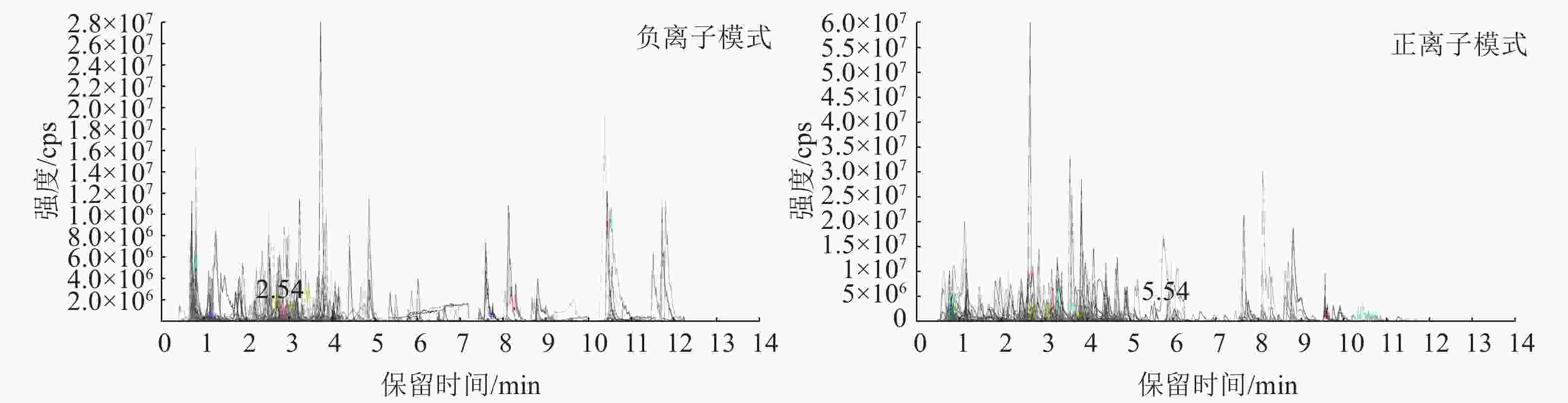
图 4 MRM 代谢物检测正负离子多峰图
Figure 4. Multi-peak diagrams of positive and negative ions for MRMg metabolite detection
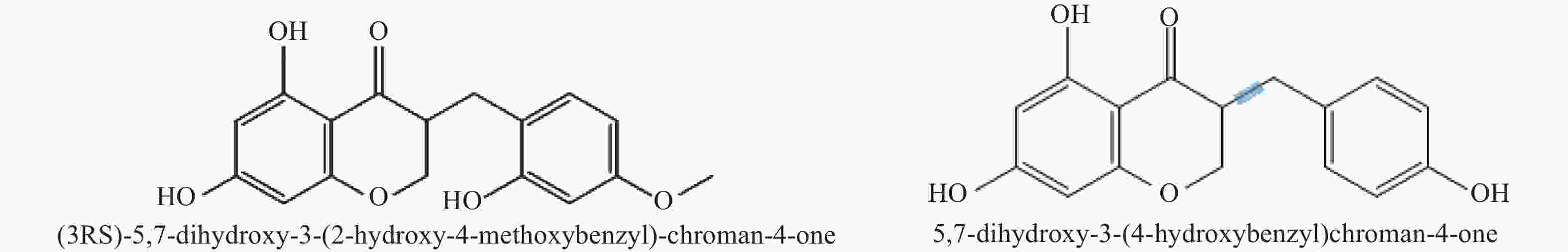
基于本地高异黄酮代谢数据库,通过三重四极杆筛选出高异黄酮的特征离子,根据代谢物二级质谱信息,鉴定出ChOMT转基因番茄苗中新产生的2种高异黄酮 (3RS)-5,7-dihydroxy-3-(2-hydroxy-4-methoxybenzyl)-chroman-4-one (HIF1)和 5,7-dihydroxy-3-(4-hydroxybenzyl)-chroman-4-one (HIF2)。结构如图5所示。
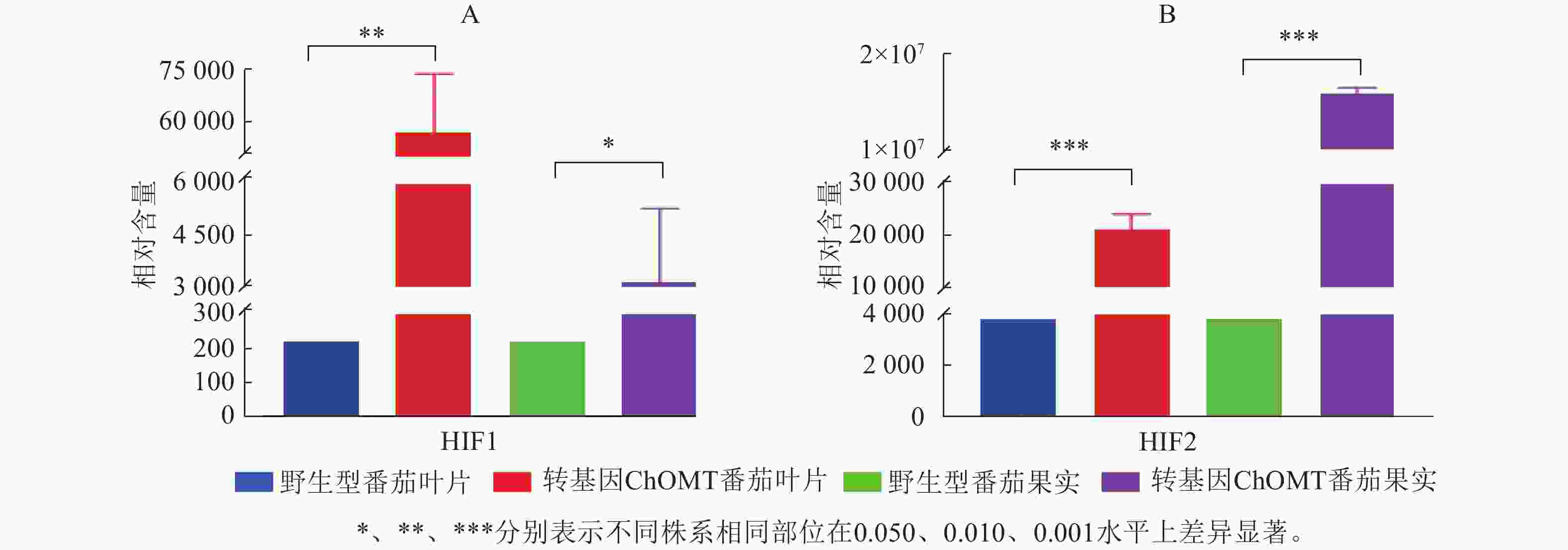
根据代谢物保留时间与峰型的信息,并对高异黄酮HIF1和HIF2检测到的色谱峰进行校正,进行相对含量测定。高异黄酮HIF1和HIF2在番茄野生株系中相对含量极低,在ChOMT转基因植株中相对含量均显著升高。其中,HIF1在转基因番茄叶片中的相对含量为57 019,比野生型叶片中的相对含量(220)增加了260倍,转基因番茄叶片与果实中的HIF1都显著高于野生型(P<0.05,图6A)。HIF2在转基因番茄果实中的相对含量为15 849 985,对比野生型的相对含量(3 849)更是提高了4 000余倍,转基因番茄叶片与果实中的HIF2都极显著高于野生型(P<0.001,图6B)。上述研究结果充分证实了紫花苜蓿ChOMT基因的导入,成功构建了高异黄酮营养强化番茄。
-
随着“健康中国”战略的深入推进,“药补不如食补”“食物即药物”的理念已深入人心,通过日常饮食改善健康状况、预防甚至治疗疾病已成为社会与市场的关注热点。已有研究发现:天然高异黄酮是一种结构特殊的黄酮类化合物,其碳骨架比常见黄酮多1个碳原子,具有显著的降血糖[2−4]、调节免疫、抗氧化[1]、抗肿瘤[23–24]、抗病毒等多种生物活性。然而,天然高异黄酮在植物中含量较低且提取成本高昂,严重制约了其营养价值开发和综合利用。近年来,番茄因其丰富的遗传资源和高效的遗传转化体系,已成为合成生物学研究的重要底盘植物,已被成功用于生产辣椒素、甜菜碱、迷迭香酸等多种天然产物[25]。如通过异源转入CYP76AD6基因,在番茄中合成了帕金森药物L-DOPA[18];通过启动BCAT、CS基因及多个辣椒素生物合成关键基因(如C4H、COMT、Kas和AMT),实现了辣椒素的高效、低成本生产[25]。在医学应用领域,番茄也展现出巨大潜力。如利用转基因番茄作为生物反应器,成功表达并正确折叠具有活性的人胰岛素分子,为口服胰岛素预防I型糖尿病提供了新途径[26]。从葡萄‘雷司令’ Vitis vinifera ‘Riesling’中克隆到芪合酶基因,利用农杆菌介导法成功转化出富含白藜芦醇的番茄,其果实白藜芦醇含量显著提高,可用于抗癌、抗炎症等[27]。此外,在改善番茄果实品质方面也取得了显著进展。如在番茄中过表达番茄SlMYB75基因使鲜果花青素质量分数达到1.86 mg·g−1,同时显著提高了酚类物质、类黄酮和可溶性固形物,分别为野生型的2.6、4.0和1.2倍[28],为提升番茄的感官和营养品质提供了快速改良方案。由此可见,通过引入外源或内源基因定向遗传改良番茄品质或作为底盘合成关键功效物质展现出广泛的应用前景。高异黄酮作为一种具有重要生物活性的成分,仅在豆科和天门冬科等少数植物中特异存在,本研究通过利用紫花苜蓿高异黄酮合成通路基因ChOMT,成功培育出高异黄酮营养强化的转基因番茄。与野生型相比,转基因番茄中高异黄酮的相对含量显著提升,为番茄及其他粮食作物的高异黄酮遗传改良提供了重要范例。
-
本研究通过转化外源高异黄酮合成关键基因提高其在番茄中的含量来改善果实品质,不仅能够满足消费者对高营养价值食品的需求,还能为人类健康带来积极影响。同时,研究结果也进一步验证了ChOMT在高异黄酮生物合成中的关键角色,为未来高异黄酮的高效生产和综合利用提供了理论支撑。
本文已在中国知网网络首发,可在知网搜索、下载并阅读全文。
过表达紫花苜蓿ChOMT基因创制高异黄酮营养强化番茄
DOI: 10.11833/j.issn.2095-0756.20250186
Overexpression of Medicago sativa ChOMT gene in constructing homoisoflavone-enriched tomatoes
-
摘要:
目的 基于紫花苜蓿Medicago sativa高异黄酮合成酶基因ChOMT,构建转基因高异黄酮番茄Solanum lycopersicum植株,从而实现番茄的营养强化。 方法 利用农杆菌Agrobacterium tumefaciens介导法将ChOMT转入番茄,通过聚合酶链式反应(PCR)和荧光检测进行转基因鉴定,进一步采用植物广泛靶向代谢组学技术和多元统计分析方法,对高异黄酮相对含量进行精准定量分析。 结果 经PCR和荧光检测获得ChOMT转基因阳性植株,与野生型相比,高异黄酮相对含量显著提升,其中(3RS)-5,7-dihydroxy-3-(2-hydroxy-4-methoxybenzyl)-chroman-4-one(HIF1)在转基因番茄叶片中的相对含量为57 019,对比野生型叶片中的相对含量(220)增加了260倍,5,7-dihydroxy-3-(4-hydroxybenzyl)-chroman-4-one(HIF2)在转基因番茄果实中的相对含量为15 849 985,对比野生型的相对含量(3 849)更是提高了4 000余倍。 结论 成功获得了ChOMT转基因番茄,不仅为解析ChOMT在植物体内的催化功能提供了理论依据,同时也为培育高异黄酮遗传改良番茄品种奠定了重要的种质资源基础。图7参28 Abstract:Objective This study aims to construct transgenic homoisoflavones tomato (Solanum lycopersicum) plants based on the homoisoflavones synthase gene ChOMT from alfalfa (Medicago sativa), thereby achieving nutritional fortification of tomatoes. Method ChOMT gene was introduced into tomatoes using Agrobacterium-mediated transformation. Transgenic identification was carried out through PCR and fluorescence detection. Furthermore, plant-wide targeted metabolomics technology and multivariate statistical analysis methods were employed for precise quantitative analysis of homoisoflavones content. Result Through PCR and fluorescence detection, positive transgenic plants of ChOMT were obtained. Compared with the wild type, the content of homoisoflavonoids significantly increased. Among them, the relative content of (3RS)-5,7-dihydroxy-3-(2-hydroxy-4-methoxybenzyl)-chroman-4-one (HIF1) in the leaves of transgenic tomatoes was 57019 , which was 260 times higher than the relative content of 220 in the leaves of the wild type. The relative content of 5,7-dihydroxy-3-(4-hydroxybenzyl)-chroman-4-one (HIF2) in the fruits of transgenic tomatoes was 15 849 985, which was over 4 000 times higher than the relative content of3849 in the wild type.Conclusion ChOMT transgenic tomatoes are obtained, which not only provides a theoretical basis for analyzing the catalytic function of ChOMT in plants, but also lays an important foundation of germplasm resources for breeding genetically improved tomato varieties with high homoisoflavonoid content. [Ch, 7 fig. 28 ref.] -
Key words:
- homoisoflavones /
- tomato /
- Agrobacterium-mediated method /
- ChOMT /
- metabolome /
- molecular farm
-
-
[1] CALVO M I. Three new homoisoflavanones from the bulbs of Ledebouria floribunda [J]. Fitoterapia, 2009, 80(7): 394−398. DOI: 10.1016/j.fitote.2009.05.010. [2] KHIL L Y, HAN S S, KIM S G, et al. Effects of brazilin on GLUT4 recruitment in isolated rat epididymal adipocytes [J]. Biochemical Pharmacology, 1999, 58(11): 1705−1712. DOI: 10.1016/S0006-2952(99)00275-0. [3] YOU E J, KHIL L Y, KWAK W J, et al. Effects of brazilin on the production of fructose-2, 6-bisphosphate in rat hepatocytes [J]. Journal of Ethnopharmacology, 2005, 102(1): 53−57. DOI: 10.1016/j.jep.2005.05.020. [4] WANG Huijun, FOWLER M I, MESSENGER D J, et al. Homoisoflavonoids are potent glucose transporter 2 (GLUT2) inhibitors: a potential mechanism for the glucose-lowering properties of Polygonatum odoratum [J]. Journal of Agricultural and Food Chemistry, 2018, 66(12): 3137−3145. DOI: 10.1021/acs.jafc.8b00107. [5] LIN Ligen, LIU Qianyu, YE Yang. Naturally occurring homoisoflavonoids and their pharmacological activities [J]. Planta Medica, 2014, 80(13): 1053−1066. DOI: 10.1055/s-0034-1383026. [6] MOTTAGHIPISHEH J, STUPPNER H. A comprehensive review on chemotaxonomic and phytochemical aspects of homoisoflavonoids, as rare flavonoid derivatives[J]. International Journal of Molecular Sciences, 2021, 22(5): 2735. DOI: 10.3390/ijms22052735. [7] PECIO Ł, PECIO S, MROCZEK T, et al. Spiro-flavonoids in nature: a critical review of structural diversity and bioactivity[J]. Molecules, 2023, 28(14): 5420. DOI: 10.3390/molecules28145420. [8] LIU Jianbo, WANG Hongqing, SHAO Hongjie, et al. Isolation and characterization of dihydrohomoisoflavonoids from Portulaca oleracea L.[J]. Phytochemistry, 2024, 222: 114071. DOI: 10.1016/j.phytochem.2024.114071. [9] PU Hangyi, CAO Yu, JIANG Xilang, et al. Steroidal saponins and homoisoflavonoids from the fibrous roots of ophiopogon japonicus and their anti-pulmonary fibrosis activities [J]. Natural Product Research, 2025, 39(14): 4055−4065. DOI: 10.1080/14786419.2024.2331044. [10] SHI Yan, SI Dun, CHEN Donghong, et al. Bioactive compounds from Polygonatum genus as anti-diabetic agents with future perspectives[J]. Food Chemistry, 2023, 408: 135183. DOI: 10.1016/j.foodchem.2022.135183. [11] 任洪民, 邓亚羚, 张金莲, 等. 药用黄精炮制的历史沿革、化学成分及药理作用研究进展[J]. 中国中药杂志, 2020, 45(17): 4163−4182. REN Hongmin, DENG Yaling, ZHANG Jinlian, et al. Research processing history evolution, chemical components and pharmacological effects of polygonati rhizome [J]. China Journal of Chinese Materia Medica, 2020, 45(17): 4163−4182. DOI: 10.19540/j.cnki.cjcmm.20200522.601. REN Hongmin, DENG Yaling, ZHANG Jinlian, et al. Research processing history evolution, chemical components and pharmacological effects of polygonati rhizome [J]. China Journal of Chinese Materia Medica, 2020, 45(17): 4163−4182. [12] SAITOH T, SAKASHITA S, NAKATA H, et al. 3-Benzylchroman derivatives related to brazilin from Sappan Lignum [J]. Chemical and Pharmaceutical Bulletin, 1986, 34(6): 2506−2511. DOI: 10.1248/cpb.34.2506. [13] LIN Ligen, XIE Hua, LI Honglin, et al. Naturally occurring homoisoflavonoids function as potent protein tyrosine kinase inhibitors by c-Src-based high-throughput screening [J]. Journal of Medicinal Chemistry, 2008, 51(15): 4419−4429. DOI: 10.1021/jm701501x. [14] MAXWELL C A, HARRISON M J, DIXON R A. Molecular characterization and expression of alfalfa isoliquiritigenin 2'-O-methyltransferase, an enzyme specifically involved in the biosynthesis of an inducer of Rhizobium meliloti nodulation genes [J]. Plant Journal, 1993, 4(6): 971−981. DOI: 10.1046/j.1365-313X.1993.04060971.x. [15] MOLINA-HIDALGO F J, VAZQUEZ-VILAR M, D’ANDREA L, et al. Engineering metabolism in Nicotiana species: a promising future [J]. Trends in Biotechnology, 2021, 39(9): 901−913. DOI: 10.1016/j.tibtech.2020.11.012. [16] LI Jianhua, MUTANDA I, WANG Kaibo, et al. Chloroplastic metabolic engineering coupled with isoprenoid pool enhancement for committed taxanes biosynthesis in Nicotiana benthamiana[J]. Nature Communications, 2019, 10(1): 4850. DOI: 10.1038/s41467-019-12879-y. [17] ZHU Qinlong, ZENG Dongchang, YU Suize, et al. From golden rice to aSTARice: bioengineering astaxanthin biosynthesis in rice endosperm [J]. Molecular Plant, 2018, 11(12): 1440−1448. DOI: 10.1016/j.molp.2018.09.007. [18] BREITEL D, BRETT P, ALSEEKH S, et al. Metabolic engineering of tomato fruit enriched in L-DOPA [J]. Metabolic Engineering, 2021, 65: 185−196. DOI: 10.1016/j.ymben.2020.11.011. [19] ZHU Guangtao, WANG Shouchuang, HUANG Zejun, et al. Rewiring of the fruit metabolome in tomato breeding [J]. Cell, 2018, 172(1/2): 249−261. DOI: 10.1016/j.cell.2017.12.019. [20] TIEMAN D, ZHU Guangtao, RESENDE M F R Jr, et al. A chemical genetic roadmap to improved tomato flavor [J]. Science, 2017, 355(6323): 391−394. DOI: 10.1126/science.aal1556. [21] 张博, 马永硕, 尚轶, 等. 植物合成生物学研究进展[J]. 合成生物学, 2020(2): 121−140. ZHANG Bo, MA Yongshuo, SHANG Yi, et al. Recent advances in plant synthetic biology [J]. Synthetic Biology Journal, 2020(2): 121−140. DOI: 10.12211/2096-8280.2020-016. ZHANG Bo, MA Yongshuo, SHANG Yi, et al. Recent advances in plant synthetic biology [J]. Synthetic Biology Journal, 2020(2): 121−140. [22] 王莎, 杜致辉, 陈之林. 基于GC-MS代谢组学技术2种香型美花石斛代谢物的对比分析[J]. 分子植物育种, 2021, 19(9): 3081−3089. WANG Sha, DU Zhihui, CHEN Zhilin, et al. Comparison of metabolites of two aromatic Dendrobium loddigesii species based on GC-MS metabonomics [J]. Molecular Plant Breeding, 2021, 19(9): 3081−3089. DOI: 10.13271/j.mpb.019.003081. WANG Sha, DU Zhihui, CHEN Zhilin, et al. Comparison of metabolites of two aromatic Dendrobium loddigesii species based on GC-MS metabonomics [J]. Molecular Plant Breeding, 2021, 19(9): 3081−3089. [23] CONSTANTINESCU T, MIHIS A G. Two important anticancer mechanisms of natural and synthetic chalcones[J]. International Journal of Molecular Sciences, 2022, 23(19): 11595. DOI: 10.3390/ijms231911595. [24] ZHOU Changxin, ZOU Li, MO Jianxia, et al. Homoisoflavonoids from Ophiopogon japonicus [J]. Helvetica Chimica Acta, 2013, 96(7): 1397−1405. DOI: 10.1002/hlca.201200493. [25] NAVES E R, de ÁVILA SILVA L, SULPICE R, et al. Capsaicinoids: pungency beyond Capsicum [J]. Trends in Plant Science, 2019, 24(2): 109−120. DOI: 10.1016/j.tplants.2018.11.001. [26] SOLTANMOHAMMADI B, JALALI-JAVARAN M, RAJABI-MEMARI H, et al. Cloning, transformation and expression of proinsulin gene in Tomato (Lycopersicum esculentum Mill.) [J]. Jundishapur Journal of Natural Pharmaceutical Products, 2014, 9(1): 9−15. DOI: 10.17795/jjnpp-7779. [27] 谭琳, 康由发, 马兵刚, 等. 芪合酶基因转化番茄产生白藜芦醇的研究[J]. 生命科学研究, 2003, 7(3): 262−266. TAN Lin, KANG Youfa, MA Binggang, et al. Resveratrol production of tomato transformed with a Vitis stilbene synthase gene [J]. Life Science Research, 2003, 7(3): 262−266. DOI: 10.16605/j.cnki.1007-7847.2003.03.015. TAN Lin, KANG Youfa, MA Binggang, et al. Resveratrol production of tomato transformed with a Vitis stilbene synthase gene [J]. Life Science Research, 2003, 7(3): 262−266. [28] JIAN Wei, CAO Haohao, YUAN Shu, et al. SlMYB75, an MYB-type transcription factor, promotes anthocyanin accumulation and enhances volatile aroma production in toma to fruits[J]. Horticulture Research, 2019, 6: 22. DOI: 10.1038/s41438-018-0098-y. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250186







 下载:
下载: