-
土壤酸化是中国耕地面临的主要障碍之一,近30 a来,中国耕地土壤pH平均降低了0.5[1]。南方红壤地区高温多雨,集约化经营程度高,化肥施用量大,土壤酸化状况尤为突出。土壤酸化不仅降低土壤养分有效性、抑制作物根系生长和养分吸收,而且对土壤生物多样性和农业生态环境造成负面影响[2]。阻控土壤酸化、改良酸性土壤肥力、提高土壤生物学活性对促进区域农业绿色可持续发展具有重要意义。
土壤微生物及其胞外酶是土壤有机质分解和养分转化的直接驱动者,两者对土壤环境变化极为灵敏,是衡量土壤肥力和健康状况的重要指标[3-4]。近年来,土壤酶生态化学计量特征被广泛应用于衡量土壤微生物能量和养分资源限制状况,表征土壤微生物代谢需求与土壤养分供应之间的生物化学平衡[5]。土壤酶生态化学计量主要以参与碳循环相关的β-葡萄糖苷酶(BG)、纤维二糖水解酶(CB),参与氮循环相关的亮氨酸氨基肽酶(LAP)和β-1,4-N-乙酰氨基葡萄糖苷酶(NAG)以及参与磷循环相关的酸性磷酸酶(PHOS)的比值为研究对象。土壤酶碳∶氮∶磷(C∶N∶P)在全球尺度上相对稳定,当比值偏离时表明微生物受到C、N或者P的限制[6]。酶化学计量的向量长度(vector length)和向量角度(vector angle)可以较好地表征微生物的能量和养分限制状况[3]。土壤酸碱性影响土壤酶活性,当土壤pH过低时,土壤微生物与胞外酶活性受到抑制,进而影响土壤酶生态化学计量特征[7]。探明不同改良措施引起的土壤酸碱度、养分变化与土壤微生物养分限制状况之间的关系对促进土壤肥力和作物生长具有重要意义。
天目小香薯Ipomoea batatas是浙江省杭州市临安区的特色农产品[8]。随着天目小香薯市场需求日益扩大,一些丘陵山地被开垦用于番薯种植。然而,丘陵红壤往往立地条件差,水分养分蓄纳功能弱,土壤酸化程度高,需要进行合理的土壤质量管理。施用土壤调理剂是改善红壤结构、酸碱性和养分有效性的重要手段之一。其中,矿物型土壤调理剂在均衡土壤肥力、提高作物抗逆性及优化土壤生态环境质量等方面均发挥着积极作用[9]。研究表明:利用石灰石、钾长石等制成的矿物调理剂可有效调节土壤pH、改善土壤酸化、提高土壤微生物和酶活性[10-11]。尽管丘陵红壤施用石灰等矿物型土壤调理剂已有较多研究[9],然而目前研究集中在改善农田土壤酸化、增加土壤养分和提升产量等方面,其如何影响土壤酶活性及微生物养分限制状况尚缺乏报道。并且,矿物调理剂类型多样,不同调理剂效果差异大,亟待开发适合不同土壤和作物的土壤调理剂产品。为此,本研究通过田间试验研究矿物调理剂施用对天目小香薯产量、土壤养分、微生物生物量、土壤酶活性及生态化学计量特征的短期影响,探明影响土壤酶活性和微生物代谢限制的主要因素,从土壤酶生态化学计量角度评估矿物调理剂的施用效果,旨在为改善丘陵红壤质量提供理论依据。
-
研究区位于浙江省杭州市临安区潜川镇(30°12′N,119°42′E)。该区属亚热带季风气候,温暖湿润,四季分明,年降水量为1 420 mm,年均气温为15.9 ℃,年日照时数为1 774 h,无霜期为 236 d。供试土壤为粉砂发育的红壤为主,土壤pH 5.36,有机碳为 6.75 g·kg−1,全氮为0.75 g·kg−1,全磷为0.60 g·kg−1,全钾为2.17 g·kg−1, 碱解氮为100.88 mg·kg−1,速效钾为145.52 mg·kg−1,有效磷为2.5 mg·kg−1。
-
小区试验设置3个处理:不施矿物调理剂(对照ck)、施用矿物调理剂3 t·hm−2 (W1)和矿物调理剂6 t·hm−2 (W2)。矿物调理剂是由白云石、钾长石为主要原料经煅烧制成的一种粉末状物质,其基本性质为pH 8.22,氧化钾质量分数为35.20%,氧化锰质量分数为 21.42%,氧化硅质量分数为8.54%,全钾质量分数为0.05%,全磷质量分数为0.38%,全氮质量分数为2.80%,速效钾质量分数为283 mg·kg−1。每处理设置3个重复,随机区组设计,小区面积为49 m2 (7 m×7 m),每个小区之间设置1 m宽的保护行。试验于2021年4月下旬布置,将矿物调理剂表面撒施后翻入0~25 cm土壤,混合均匀。翻耕后起垄,垄长7.0 m、宽0.5 m、高0.2 m,垄距0.2 m。各试验小区施肥及田间日常管理措施均完全一致。各小区施肥量为120 kg·hm−2尿素(氮质量分数为46.2%),225 kg·hm−2钙镁磷肥(五氧化二磷、氧化钾和氧化镁质量分数分别为12%、42%、10%),225 kg·hm−2氯化钾(氧化钾质量分数为62.7%)。天目小香薯秧苗扦插定植于垄上,每垄株距为0.3 m。
-
于2021年8月底采收天目小香薯,测定藤长、地上部生物量及其产量。同时,在各小区内按照五点法采集0~15 cm土壤,剔除其中的植物根系、残体和石子等杂物,充分混匀后置于无菌塑封袋低温带回实验室。每份混合样品过2 mm筛子,挑去石粒、根系以及植物残体,并分成3份:1份室温自然风干,用于基本理化性质的测定;1份存于4 ℃冰箱,用于土壤酶活性和微生物量的测定;剩余样品经冷冻干燥后存放于−70 ℃冰箱。
-
土壤化学性质分析参考鲁如坤[12]的方法。土壤水分含量采用烘干法测定;土壤pH值按1.0∶2.5土水质量体积比测定;土壤有机碳(SOC)采用重铬酸钾氧化,浓硫酸外加热法测定;全氮(TN)采用凯氏定氮法测定;土壤全磷(TP)采用高氯酸-硫酸消煮,钼锑抗比色法测定;土壤速效钾(AK)用醋酸铵提取,火焰光度法测定;土壤有效磷(AP)采用盐酸氟化铵浸提,分光光度法测定;土壤碱解氮(AN)采用碱解扩散法测定;土壤交换性酸、氢和铝采用氯化钾交换,中和滴定法测定。土壤微生物生物量碳(MBC)、微生物生物量氮(MBN)和微生物生物量磷(MBP)采用氯仿熏蒸提取法分析[13-14]。
-
土壤酶活性测定参照SAIYA-CORK等[15]的方法。本研究测定了5种土壤酶活性,包括β-葡萄糖苷酶(BG)、纤维二糖水解酶(CB)、β-1,4-N-乙酰基氨基葡萄糖苷酶(NAG)、亮氨酸氨基酞酶(LAP)、酸性磷酸酶(PHOS)。称取相当于2 g干质量的鲜土于100 mL离心管中,用50 mmol·L−1醋酸铵缓冲液(pH 5.0)浸提,取200 μL土壤悬液于96孔板中,并立即加入50 μL反应底物。微孔板放入25 ℃培养箱中避光培养3 h,加入10 μL 0.5 mol·L−1的氢氧化钠结束反应。用多功能酶标仪(Synergy™ H1,Biotek)检测荧光裂解产物4-甲基伞形酮或4-甲基香豆素的产量,检测时以365 nm为激发波长,450 nm为检测波长。酶活性单位为nmol·g−1·h−1。
-
采用土壤酶生态化学计量特征向量分析,即向量长度和向量角度,表征土壤微生物代谢受碳、氮和磷的限制状况[3]。向量长度越大,表示碳限制越大;向量角度<45°和>45°分别表示氮限制或磷限制的相对程度,偏离程度越大,限制越强。
-
采用 SPSS 26.0 进行数据处理和分析。单因素方差分析(one-way ANOVA) Duncan法多重比较检验不同处理间的差异显著性,显著性水平为0.05;利用CANOCO 4.5进行冗余分析(RDA),确定影响土壤酶活性与计量比的关键因子。
-
由表1可知:相比ck,W2处理显著提高了土壤pH、AN和AP,提高幅度分别为17.7%、48.3%和 40.7%(P<0.05)。 W1和W2处理显著降低了土壤交换性酸(57.0%和67.1%)、交换性H+ (57.7%和69.2%)和交换性Al3+(57.1%和60.7%,P<0.05)。W1和W2处理对SOC、TP、DOC、DN、AK、C/N、C/P、N/P均无显著影响。由表2可知:与ck相比,W1和W2处理显著提高了天目小香薯藤长38.5%和39.7%(P<0.05),但对天目小香薯产量、地上生物量、地上部与产量的比值均无显著影响。
处理 pH SOC/
(g·kg−1)TP/
(g·kg−1)TN/
(g·kg−1)DOC/
(mg·kg−1)DN/
(mg·kg−1)AK/
(mg·kg−1)AP
(mg·kg−1)ck 5.42±0.06 b 6.90±1.34 a 0.60±0.07 a 0.77±0.01 ab 201.07±8.74 a 93.53±5.85 a 105.26±22.54 a 2.53±0.44 b W1 6.10±0.22 ab 8.86±1.92 a 0.63±0.11 a 0.84±0.03 a 216.33±15.28 a 91.53±5.05 a 79.49±12.94 a 2.92±0.10 ab W2 6.38±0.46 a 8.07±1.03 a 0.57±0.07 a 0.76±0.04 b 202.67±27.78 a 93.20±4.91 a 81.45±16.41 a 3.56±0.42 a 处理 AN /
(mg·kg−1)C/N C/P N/P 交换性酸/
(cmol·kg−1)交换性H+/
(cmol·kg−1)交换性Al3+/
(cmol·kg−1)ck 162.45±26.22 b 9.14±1.72 a 11.85±2.39 a 1.30±0.15 a 0.79±0.19 a 0.52±0.16 a 0.28±0.05 a W1 202.10±12.25 ab 9.97±2.08 a 13.04±0.74 a 1.36±0.24 a 0.34±0.15 b 0.22±0.08 b 0.12±0.07 b W2 240.86±20.28 a 10.80±1.02 a 14.97±3.41 a 1.37±0.21 a 0.26±0.06 b 0.16±0.01 b 0.11±0.07 b 说明:SOC为土壤有机碳;TP为全磷;TN为全氮;DOC为可溶性有机碳;DN为可溶性氮;AK为速效钾;AP为有效磷;AN为碱解氮; C/N表示SOC/TN;C/P表示SOC/TP;N/P表示TN/TP;同列不同小写字母表示不同处理间差异显著(P<0.05)。 Table 1. Soil chemical properties under different treatments
处理 产量/(t·hm−2) 地上部生物量/(t·hm−2) 藤长/m 地上部/产量 ck 25.77±1.78 a 2.94±1.15 a 1.56±0.06 b 0.12±0.05 a W1 28.67±0.96 a 3.19±0.11 a 2.16±0.31 a 0.11±0.01 a W2 28.46±2.21 a 2.55±0.89 a 2.18±0.17 a 0.09±0.04 a 说明:同列不同小写字母表示不同处理间差异显著(P<0.05)。 Table 2. Sweet potato yield and aboveground biomass under different treatments
-
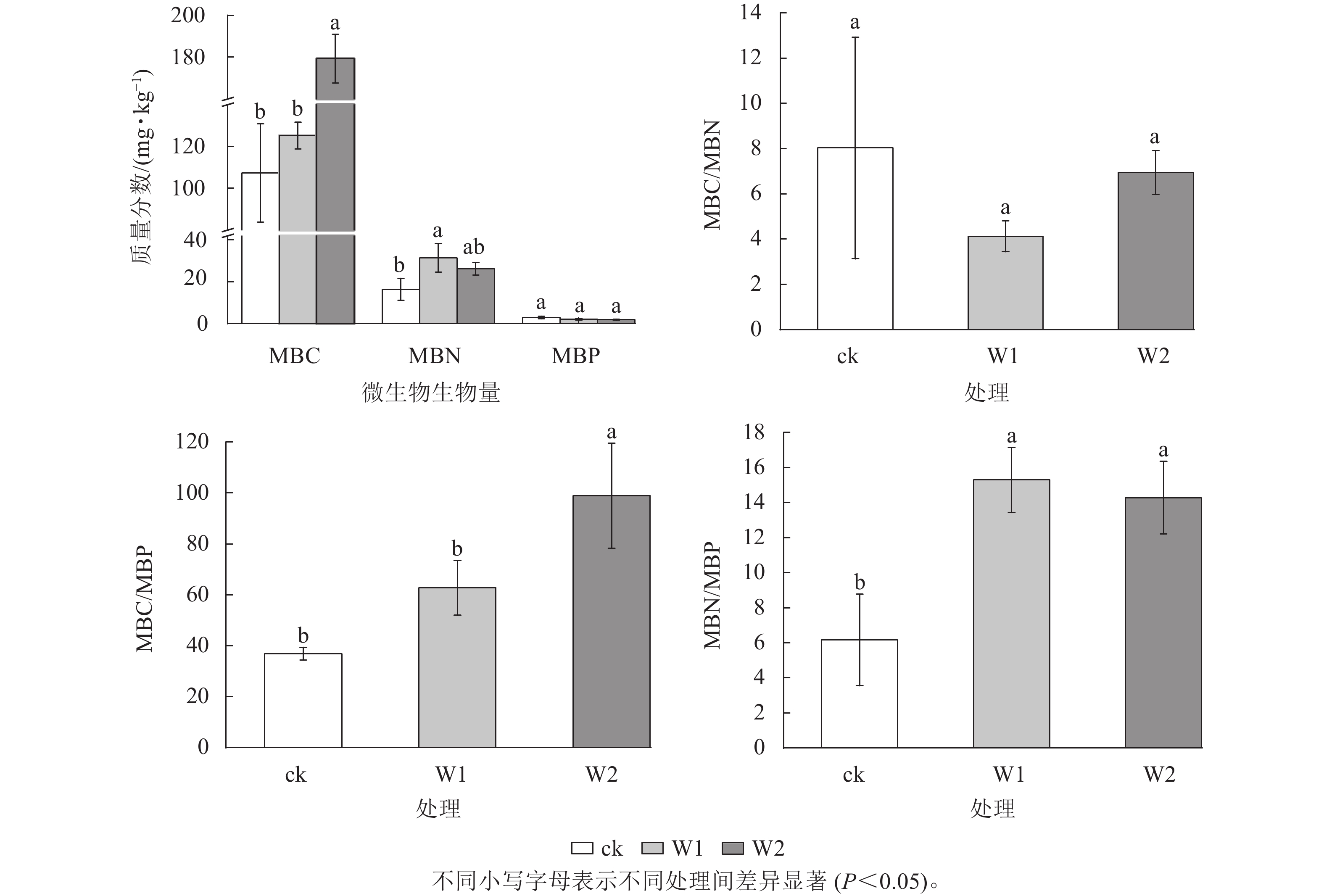
由图1可知:与ck相比,W1处理显著提高了MBN (91.1%)、MBN/MBP (148.2%) (P<0.05)。 W2处理显著提高了MBC (67.1%)、 MBC/MBP (168.2%)和MBN/MBP (131.8%) (P<0.05)。 W1和W2处理对MBP和MBC/MBN均无显著影响。
-
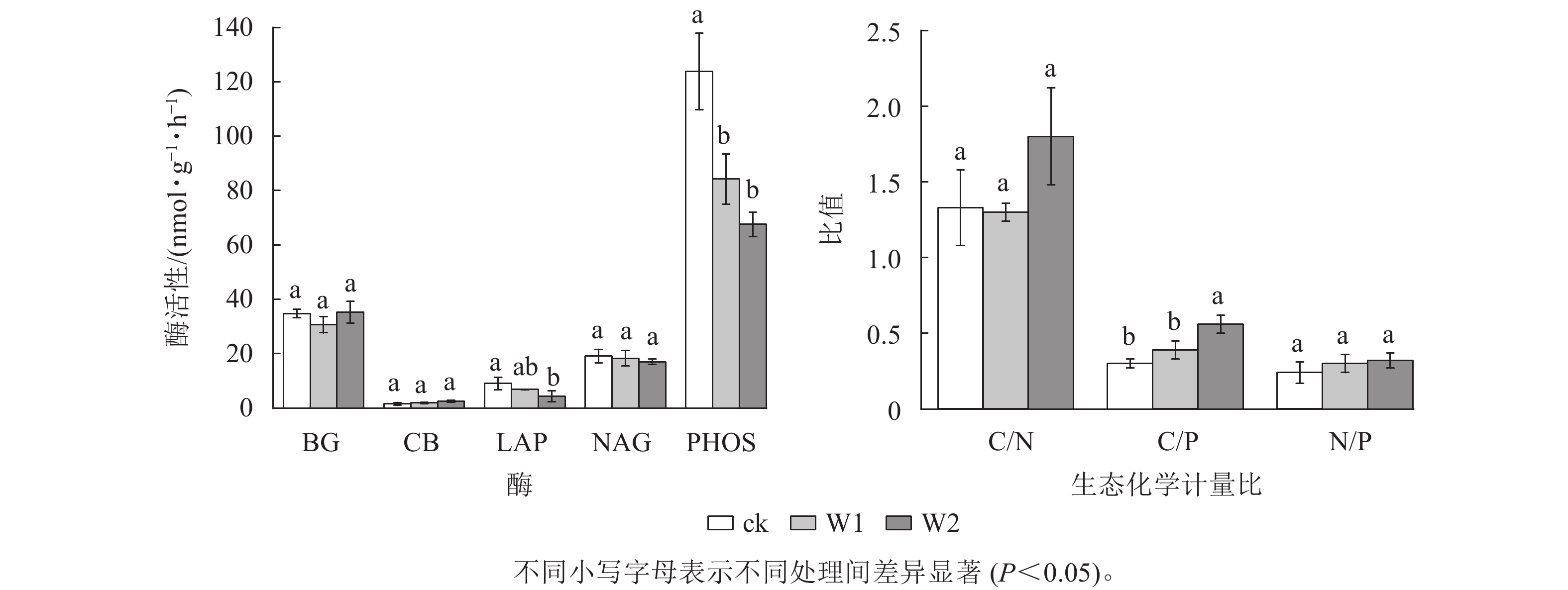
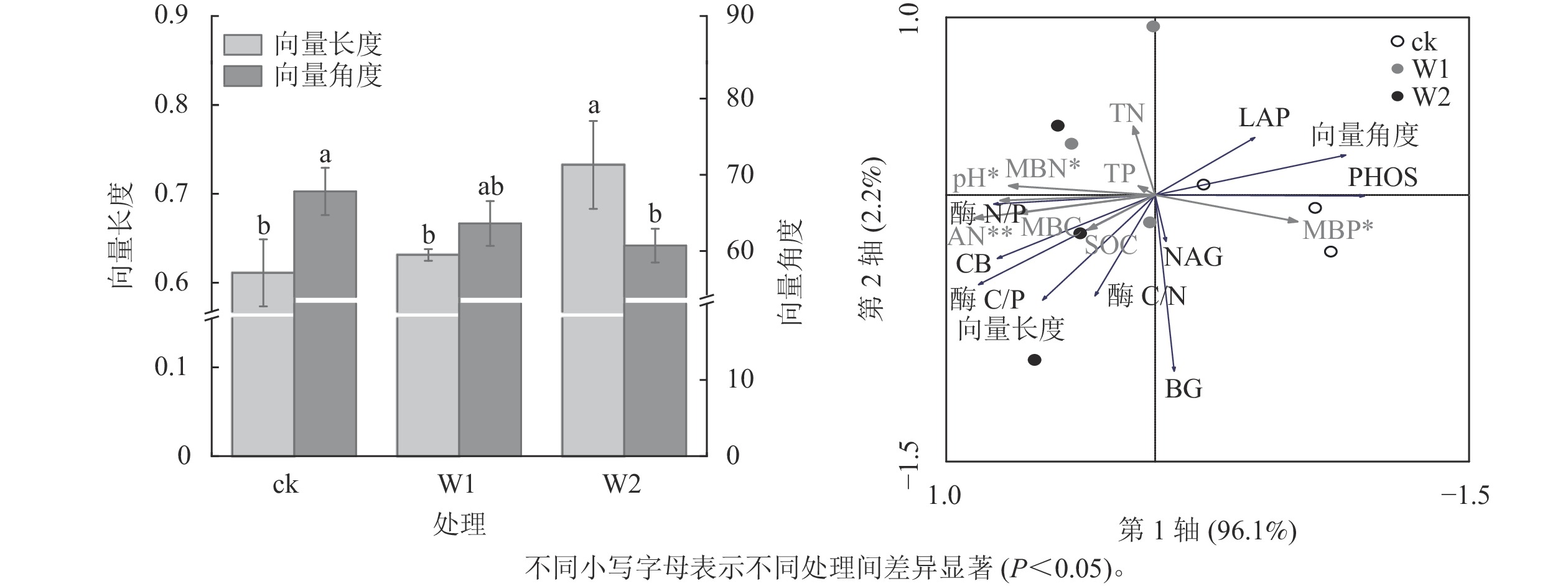
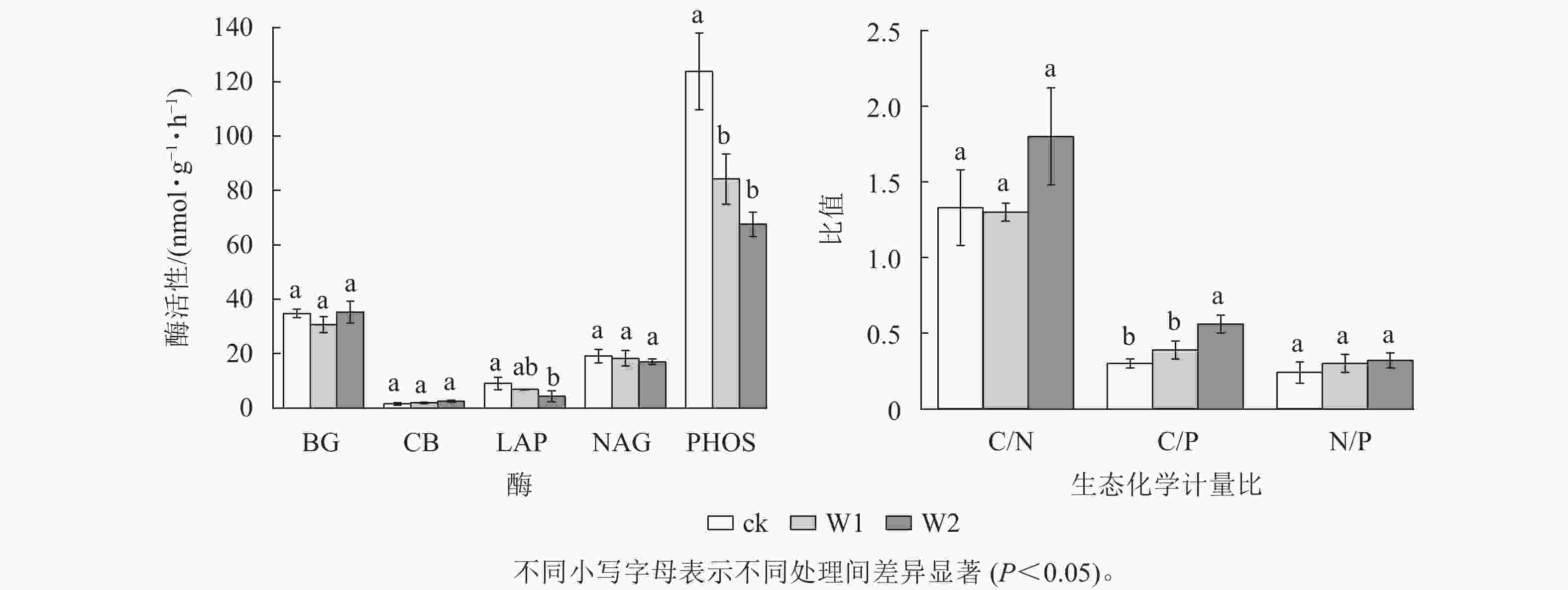
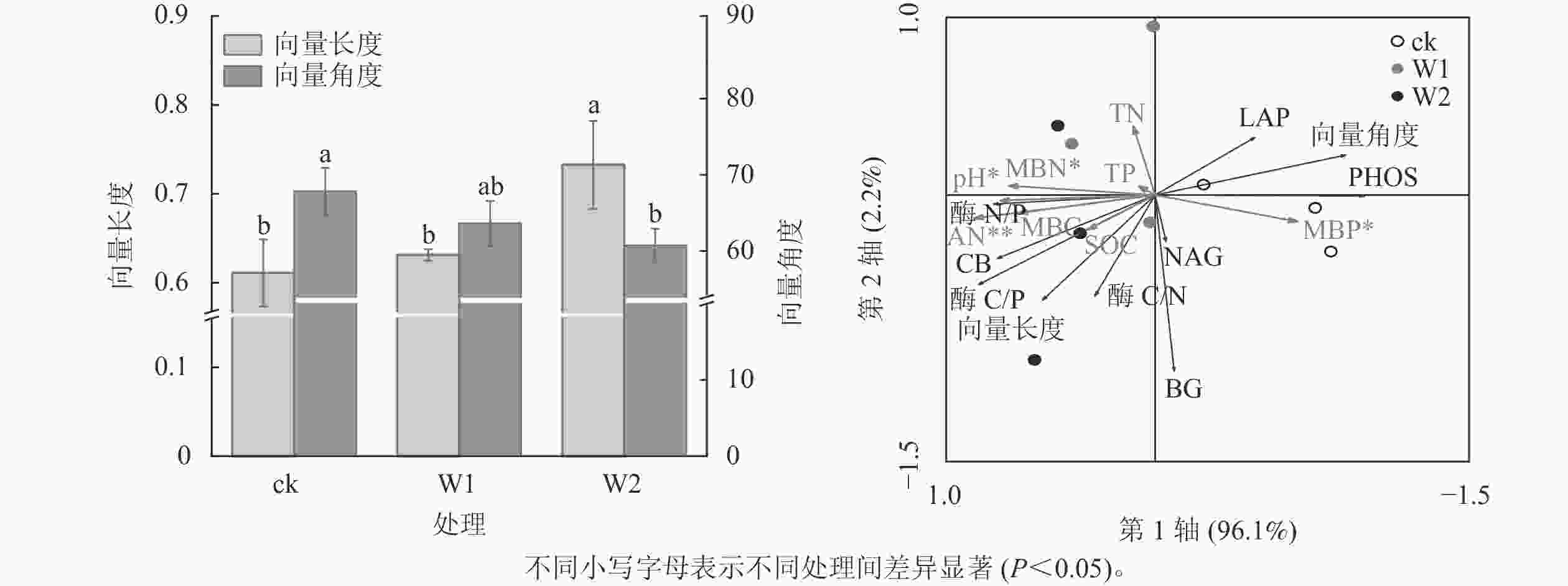
由图2可知:W1处理显著降低了PHOS活性(31.9%,P<0.05),而对BG、CB、 NAG、LAP活性、酶C/N、酶C/P、酶N/P、向量长度、向量角度均无显著影响。 W2处理显著降低了PHOS活性(45.4%)、 LAP活性(52.4%),提高了酶C/P(96.7%)、向量长度(19.7%)、向量角度(10.5%)(P<0.05),而对其他指标无影响,表明高量矿物调理剂施用提高了微生物碳限制,而缓解了微生物磷限制。
冗余分析(图3)表明:土壤化学性质对土壤酶活性及生态化学计量比的总解释率为98.3%,其中第1轴解释了变量的96.1%,第2轴解释了变量的2.2%。 AN(F=18.05,P=0.002), pH (F=7.87,P=0.016), MBN (F=6.211,P=0.048),MBP (F=5.61,P=0.044)是显著影响土壤酶活性及化学计量比的主要因子,解释率分别为72.0%、53.0%、47.0%、45.0%。
-
本研究中,施用6 t·hm−2的矿物调理剂可显著提高土壤pH,这与矿物调理剂富含的氧化钾和氧化镁可中和土壤中的H+有关[16]。李昂等[17]发现:红壤中施用白云石、钾长石、牡蛎壳和麦饭石等4种矿物调理剂可使pH提高3.2%~28.0%,其中白云石提高幅度最明显,但低用量的矿物调理剂对土壤pH无显著影响。可能是因为本研究所用调理剂的pH较低,低用量的矿物调理剂难以有效中和土壤酸度。2种矿物调理剂均可显著降低土壤交换性酸、氢和铝质量分数,可能是因为调理剂自身含有丰富的交换性阳离子,如钙离子和镁离子会与土壤交换性氢和铝发生作用,从而降低土壤中交换性酸质量摩尔浓度[2, 18]。本研究供试土壤全磷和有效磷质量分数均相对较低,这与亚热带红壤中铁、铝质量分数较高且酸性较强,使得磷易于被铁铝离子固定成磷酸铁和磷酸铝[19]有关。施用高用量矿物调理剂后土壤有效磷质量分数显著高于对照,说明本研究制备的矿物调理剂有利于提高土壤有效磷水平。这与矿物调理剂含有一定量的磷元素[10]、以及矿物调理剂中的硅迁移到黏土颗粒表面取代了土壤中的磷酸根离子,进而增加土壤磷有效性有关[20]。此外,施用矿物调理剂也显著提高了土壤碱解氮质量分数。龚玲婷等[9]研究表明:矿物质调理剂可有效改善土壤酸性、提高土壤有效氮质量分数,促进作物氮素吸收。施用矿物调理剂后土壤有机碳质量分数并无显著变化,这是因为矿物调理剂中几乎不含有机质成分,短时间内难以直接提高土壤有机碳质量分数[21]。
2种用量矿物调理剂分别显著提高了土壤微生物生物量氮和碳质量分数,说明施用矿物调理剂有利于丘陵红壤微生物生长。相关研究表明:施用矿物调理剂可以改变土壤结构,提高土壤pH和养分含量,在一定程度上改善了微生物生存环境,进而提高微生物的活性[9]。李致博[22]研究发现:土壤pH升高可显著提高土壤戴氏菌属Taifanglania、产黄杆菌属Rhodanobacter、链霉菌属Streptomyces等的丰度。同时,矿物调理剂的施用增加了土壤有效氮质量分数,刺激了微生物生长[23-24]。相反,施用矿物调理剂后微生物量磷未显著变化,可能是因为土壤有效磷质量分数较低,微生物生长受磷限制。有研究表明:MBC/MBN在作物生长季节的变化不大,即土壤微生物生物量碳和土壤微生物生物量氮能维持相对稳定的比例[25],这与本研究结果相似。土壤有效磷和碱解氮的输入缓解了土壤微生物的养分限制,而较低的有机碳输入促进了微生物的能量限制[26],促使MBC/MBP显著提高。2种水平矿物调理剂施用均未显著改变天目小香薯的产量与地上部生物量,说明矿物调理剂对天目小香薯生长无显著影响。有研究表明:块茎类植物,如马铃薯Solanum tuberosum对钾的需求较大,其次是氮磷[27]。本研究调理剂施用并未改变天目小香薯产量,可能与所制备的矿物调理剂中总养分质量分数,特别是钾质量分数较低有关。
-
高用量的矿物调理剂显著降低了土壤LAP活性,这主要是由于矿物调理剂施用增加了土壤碱解氮质量分数,为微生物生长提供了氮源,满足了微生物生长的氮素需求,从而降低了氮获取相关酶的分泌和活性。许淼平等[7]研究表明:土壤微生物可通过调节自身胞外酶的分泌来缓解养分限制,当土壤中氮的有效性增加后,与氮转化相关的酶活性呈下降趋势。与此相似,矿物调理剂施用显著提高了土壤有效磷质量分数,降低了PHOS活性,这进一步印证了微生物影响胞外酶分泌的生态化学计量学调控作用。SPEIR等[28]发现:无机磷添加可抑制土壤微生物或植物根系分泌磷酸酶作用,降低土壤微生物对磷素的需求,进而抑制磷酸酶的活性。本研究土壤pH与酸性磷酸酶活性呈显著负相关,这可能因为亚热带红壤pH普遍呈酸性(pH<6.5),低pH条件下土壤微生物将分泌更多的酸性磷酸酶矿化有机磷,以满足微生物和植物对磷的需求[29]。
酶生态化学计量比反映了微生物获取碳、氮与磷的相对需求,酶 C/N 和酶 C/P 越高,表明土壤微生物对碳获取酶的投资高于对氮和磷获取酶的投资,即微生物受碳源限制高于受氮、磷限制[30]。本研究发现:2种水平矿物调理剂施用对酶C/N无显著影响,但高用量调理剂显著提高了酶C/P,说明高用量矿物调理剂使微生物对碳获取酶的投资相对高于磷获取酶。这可能与矿物调理剂本身未能直接提供有机质而提高了土壤有效磷质量分数有关,暗示高用量矿物调理剂的施用微生物更易受碳限制,而缓解了磷限制[20, 31]。全球尺度酶C/N、C/P 和N/P 平均值分别为 1.41、0.62 和0.44[26]。本研究中,对照土壤的酶C/P远低于全球平均值,说明相较于磷,土壤存在较强的碳限制。高用量矿物调理剂显著提高了向量长度,而降低了向量角度,且所有处理的向量角度均大于45°,这进一步印证了高用量的矿物调理剂提高了微生物生物量碳限制而缓解了微生物生物量磷限制。冗余分析结果进一步证明:碱解氮、pH、土壤微生物生物量氮和土壤微生物生物量磷显著影响土壤酶活性及化学计量比,说明土壤速效养分和微生物生物量变化可潜在影响丘陵红壤酶化学计量学特征。ZHANG等[29]对黄土高原撂荒地和人工刺槐林Robinia pseudoacacia研究发现:土壤生态酶活性和化学计量学的变化与土壤中的可溶碳氮呈显著正相关。曾泉鑫等[32]研究表明:长期氮添加加剧了毛竹Phyllostachys edulis土壤微生物生物量碳、微生物生物量磷限制,认为氮添加会降低土壤有效磷和可溶性碳,从而造成土壤碳和土壤磷限制。本研究表明:矿物调理剂施用使土壤有效磷质量分数增加,缓解了土壤微生物生物量磷限制,而进一步加剧了碳限制。
-
矿物调理剂短期内可显著提高土壤pH和速效养分质量分数,降低土壤交换性酸质量摩尔浓度,但对天目小香薯生长和产量影响不显著。2种用量矿物调理剂均显著提高了土壤微生物生物量,降低了酸性磷酸酶活性,缓解了土壤微生物的磷限制,加剧碳限制。冗余分析表明:土壤pH、碱解氮、微生物生物量碳氮是影响土壤酶活性及其化学计量特征的主要因子。因此,施用矿物调理剂短期内可有效降低土壤酸度,增加速效养分质量分数,缓解土壤微生物生物量磷限制,有助于降低南方丘陵红壤磷限制对作物生长的影响。在丘陵红壤施用矿物调理剂时应注意配合其他管理措施,如秸秆还田或增施有机肥,减弱微生物生物量碳限制,促进微生物的碳源和养分平衡。
Effects of mineral conditioner on the yield of sweet potato and ecoenzymatic stoichiometry in a hilly red soil
doi: 10.11833/j.issn.2095-0756.20220487
- Received Date: 2022-07-31
- Accepted Date: 2022-12-12
- Rev Recd Date: 2022-11-28
- Available Online: 2023-05-22
- Publish Date: 2023-05-20
-
Key words:
- mineral conditioner /
- red soil /
- soil microorganisms /
- soil enzymes /
- Ipomoea batatas
Abstract:
| Citation: | YU Jinzhu, WU Chenchen, JI Haonan, et al. Effects of mineral conditioner on the yield of sweet potato and ecoenzymatic stoichiometry in a hilly red soil[J]. Journal of Zhejiang A&F University, 2023, 40(3): 531-539. DOI: 10.11833/j.issn.2095-0756.20220487 |









 DownLoad:
DownLoad: