-
三叶青Tetrastigma hemsleyanum为葡萄科Vitaceae崖爬藤属Tetrastigma植物,学名为三叶崖爬藤,是中国特有药材,也是新“浙八味”之一[1]。三叶青全株均可药用,具有清热解毒、消肿止痛、祛风化痰等功效,常用于治疗发烧、小儿热惊厥、哮喘、肝炎、风湿等疾病[2],还可用于饲料绿色添加剂,改善动物健康,预防疾病[3],被称为“植物抗生素”[4]。研究表明:三叶青的主要化学成分为黄酮类物质,如二氢黄酮、黄酮和黄酮醇,包括柚皮素、芦丁、山奈酚、异槲皮素和原花青素等[5]。这些成分具有良好的药理活性,是三叶青药材品质的物质基础。
黄酮类成分作为药用植物的次生代谢产物,生物合成过程受到诸多转录因子的调控,如MYB、bHLH、WRKY等。有研究发现:参与调控黄酮生物合成途径的MYB转录因子多为R2R3-MYB的第4、5、6、7亚家族成员[6]。其中,第4亚家族的R2R3-MYB转录因子是公认的苯丙烷途径及木质素生物合成途径的转录抑制因子,如蓝莓Vaccinium corymbosum中的VcMYB4a作为R2R3-MYB第4亚家族的转录因子,抑制蓝莓木质素的生物合成,起到负调控作用[7]。第5亚家族或第6亚家族的R2R3-MYB基因成员作为MYB-bHLH-WDR (MBW)转录复合物的一个组成部分,参与花青素或原花青素的合成[8],如胡萝卜Daucus carota中的DcMYB6可诱导花青素的生物合成[9];拟南芥Arabidopsis thaliana中第5亚家族的AtMYB123/TT2可以与TT8和TTG1蛋白形成复合物,激活DFR、ANS和ANR基因表达,共同促进种皮中原花青素的合成[10];葡萄Vitis vinifera中的转录因子VvMYBPA1、VvMYBPA2和VvMYB5a等均参与原花青素调控[11]。第7亚家族的R2R3-MYB因子则一般具有调控黄酮醇的功能[12],如拟南芥中的AtMYB11、AtMYB12和AtMYB111转录因子被归类为第7亚家族,通过调节AtFLS1基因表达冗余调节黄酮醇的生物合成[13]。
BAI等[14]研究发现:三叶青地上和地下部分的品质有所差异,特别是黄酮类成分含量有明显变化。但关于三叶青地上和地下部分黄酮类成分差异的形成机制却鲜有报道。因此,本研究通过对前期转录组分析发现的MYBPAR基因进行克隆,从ThMYBPAR的基因结构、蛋白定位、系统发育关系、表达量等方面,探究ThMYBPAR基因对三叶青块根和叶片中黄酮类成分的合成调控作用,以期为三叶青药材品质调控提供科学依据。
-
在浙江省丽水市遂昌县种植基地,选取生长健壮、无病虫害、苗高大小近似的近3年生三叶青苗,种植于浙江省中药资源保护与创新重点实验室试验基地(30°15′30.39″N,119°43′26.92″E)。于2024年5月取三叶青块根及叶片放入密封袋,立即液氮冷冻并放置在超低温冰箱保存(−80 ℃)备用。
-
总黄酮的测定选用芦丁作为标准品。分别称取三叶青块根及叶片样品各0.1 g,置于锥形瓶中,加入体积分数为70%的甲醇3.0 mL,在60 ℃水温超声30 min,离心10 min取上清,即为供试样品溶液。吸取三叶青块根及叶片供试样品溶液1.0 mL于10.0 mL量瓶中,用体积分数为70%的甲醇定容至刻度,分别吸取2.0 mL于10.0 mL试管中,加质量分数为5%的亚硝酸钠溶液0.3 mL,振荡摇匀,黑暗放置6 min,加质量分数为10%的硝酸铝0.3 mL,振荡摇匀,黑暗放置6 min,再加质量分数为4%的氢氧化钠4.0 mL,振荡摇匀,用体积分数为70%的甲醇定容至刻度,振荡摇匀,黑暗放置15 min后置比色皿中,测定波长510 nm处的吸光度。以体积分数为70%的甲醇溶液作为空白对照。
-
提取方法同1.2.1。采用香草醛-盐酸法测定提取液中的原花青素含量。将4.0 g香兰素溶于100.0 mL甲醇中,得质量分数为4%的香草醛-甲醇溶液。取1.0 mL三叶青块根及叶片样品于试管中,加入质量分数为4%的香草醛-甲醇溶液,混合后再加入1.5 mL浓盐酸,立即摇匀。室温避光30 min,测定波长500 nm处的吸光度,以质量分数为4%的香草醛-甲醇溶液作为空白对照。
-
称取3.785 g过硫酸钾于100 mL容量瓶中,加水超声溶解后定容,配制成140 mmol·L−1的过硫酸钾溶液;称取0.384 g ABTS于100 mL棕色容量瓶中,加水定容,配制成7 mmol·L−1的ABTS溶液。量取88 μL过硫酸钾与5 mL的ABTS混合,摇匀避光12 h。12 h后用无水乙醇稀释,使其在波长734 nm处的吸光度为0.7±0.2。在96孔板中加入100 μL反应液和100 μL三叶青块根及叶片样品,室温避光震荡反应6 min后,测量734 nm处的吸光度,以抗坏血酸作为阳性对照,将测量值代入,计算ABTS自由基清除率(A):A=(1−Ai/A0)×100%。其中:A0为混合液的吸光度,Ai为样品i的吸光度。
-
取三叶青的块根、叶片,分别在液氮中研磨后,用FastPure Universal Plant Total RNA Isolation Kit提取总RNA,经凝胶电泳和超微量核酸分析仪检测,获得高质量的RNA,用于后续研究。
-
使用PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit试剂盒将RNA反转录成cDNA。根据转录组数据库中MYBPAR基因的CDS序列,设计基因克隆引物(表1),根据PrimeSTAR® Max DNA Polymerase使用说明书对ThMYBPAR基因进行PCR扩增。经电泳检测后,目的片段被纯化回收,经载体连接及大肠埃希菌Escherichia coli DH5α转化测序后获得阳性单菌落,并在−80 ℃条件下保存。
引物名称 序列(5′→3′) ThMYBPAR-F ATGGGGAGAAGCCCTTGTTGT ThMYBPAR-R TTATTCTCCAAACCAGTCACCGC MDH-F TGTTGCTACGACTGATGT MDH-R CCTGAGACTTGTAGATGGAA qThMYBPAR-F GCTGGCCGGAGCAAGAACAA qThMYBPAR-R GTGGTGTTTCCGTCGGTCGT qThLAR-F CGACAGCCGACGCTGGTATT qThLAR-R TCAAGCGCAGGTTGCAGTGA ThMYBPAR-GFP-F gctcggtacccggggatccATGGGGAGAAGCCCTTGTTGT ThMYBPAR-GFP-R gcccttgctcaccatgtcgacTTATTCTCCAAACCAGTCACCGC Table 1. Primer sequences
-
根据植物表达载体pCAMBIA
1300 -GFP及ThMYBPAR基因序列,设计含有限制性酶切位点的引物(表1),PCR扩增得到的产物经纯化回收后与GFP表达载体连接,转化农杆菌Agrobacterium tumefaciens GV3101 (pSoup),注射接种本氏烟草Nicotiana benthamiana的幼嫩叶片,2 d后用激光共聚焦显微镜观察荧光信号。 -
使用PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒对样品的RNA进行反转录,设计荧光定量PCR引物(表1),后用ChamQ Universal SYBR qPCR Master Mix试剂盒进行荧光定量PCR试验。基因的相对表达量用2−ΔΔCt方法表示。
-
采用Excel整理数据,通过SPSS进行Pearson相关性分析,显著性水平为0.05。每个实验重复3次。
-
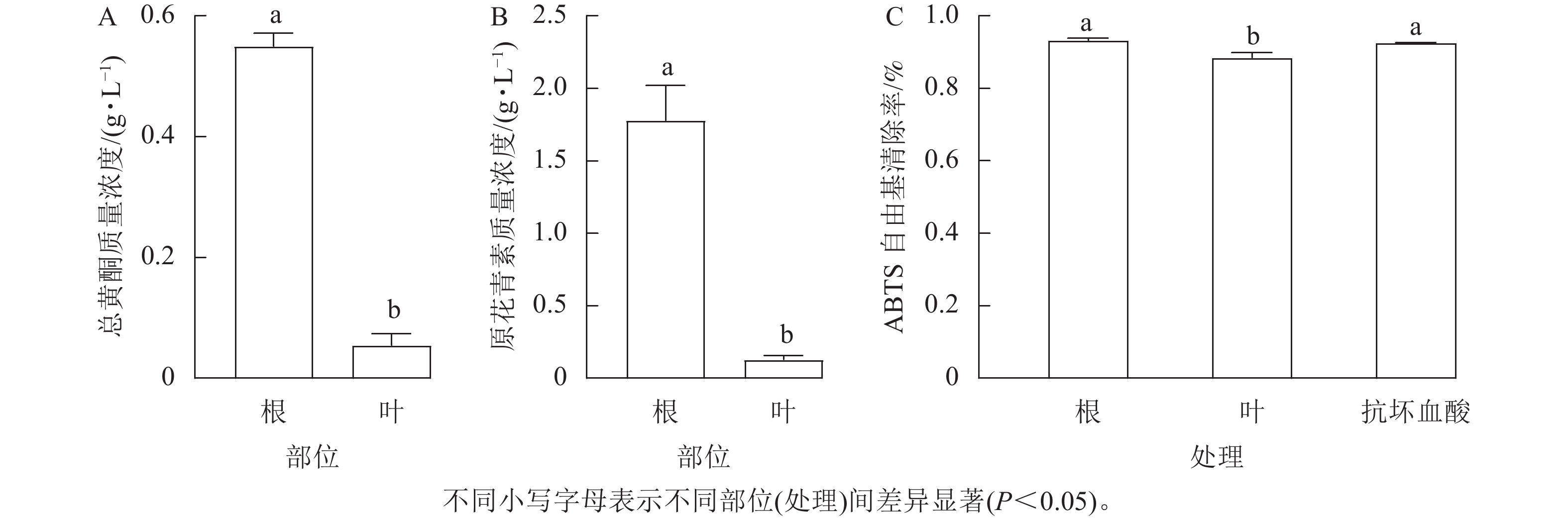
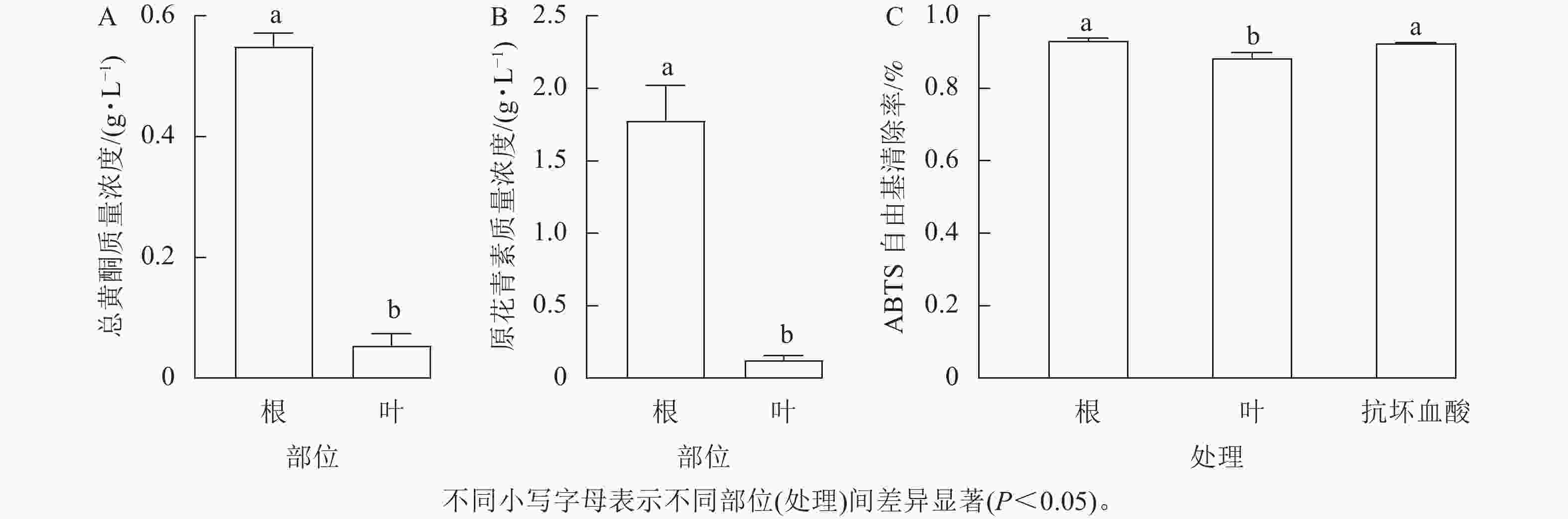
从图1A和图1B可见:三叶青块根及叶片中的总黄酮质量浓度分别为0.55和0.05 g·L−1,原花青素质量浓度分别为1.77和0.13 g·L−1,三叶青块根中总黄酮的质量浓度是叶片的11倍,块根中原花青素的质量浓度是叶片中的13倍。可以看出三叶青块根中的总黄酮和原花青素质量浓度均显著高于叶片(P<0.05)。
-
由图1C可以看出:三叶青块根及叶片对ABTS均具备清除能力,且块根的清除能力高于叶片,块根的ABTS自由基清除率高达90%。
-
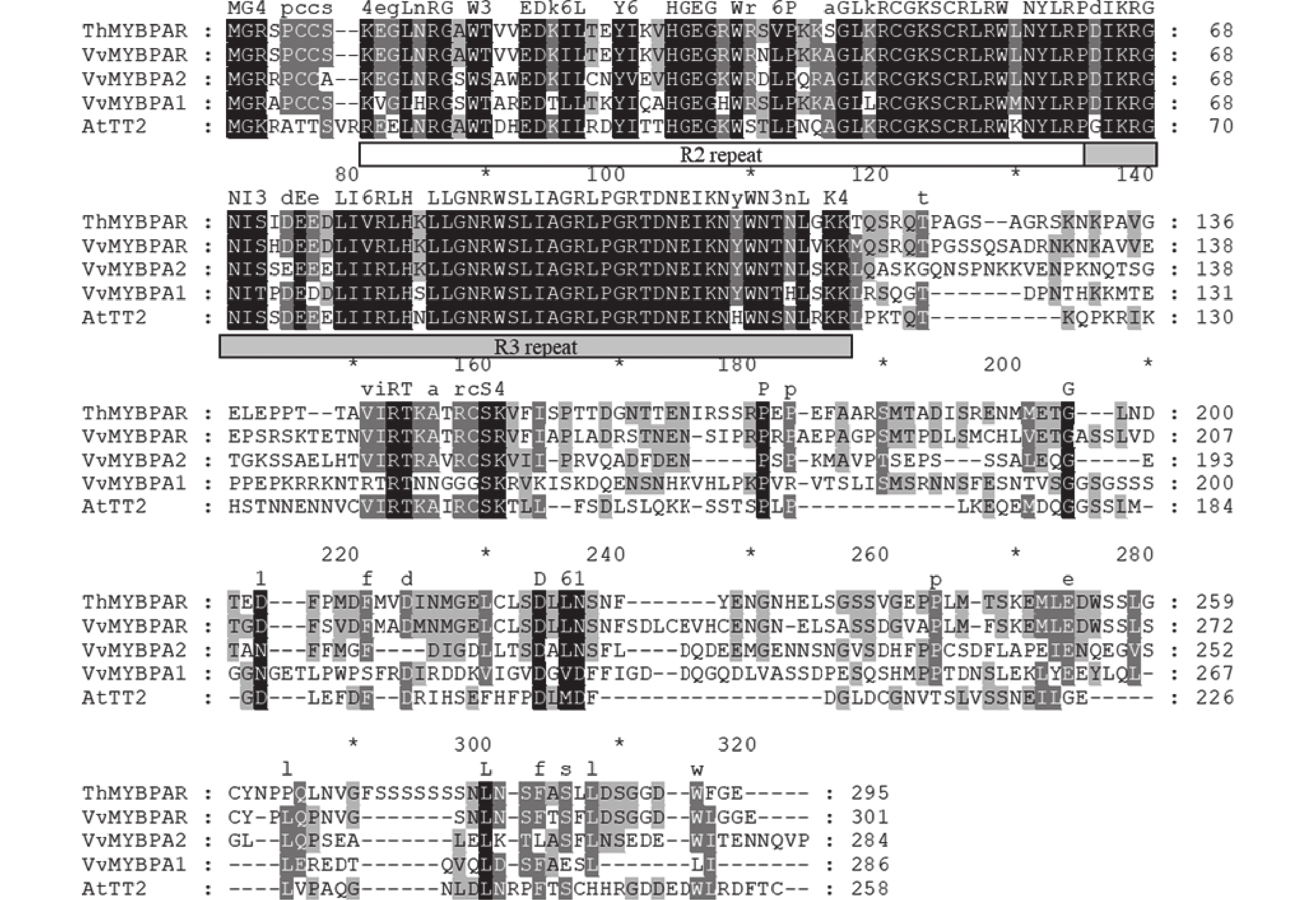
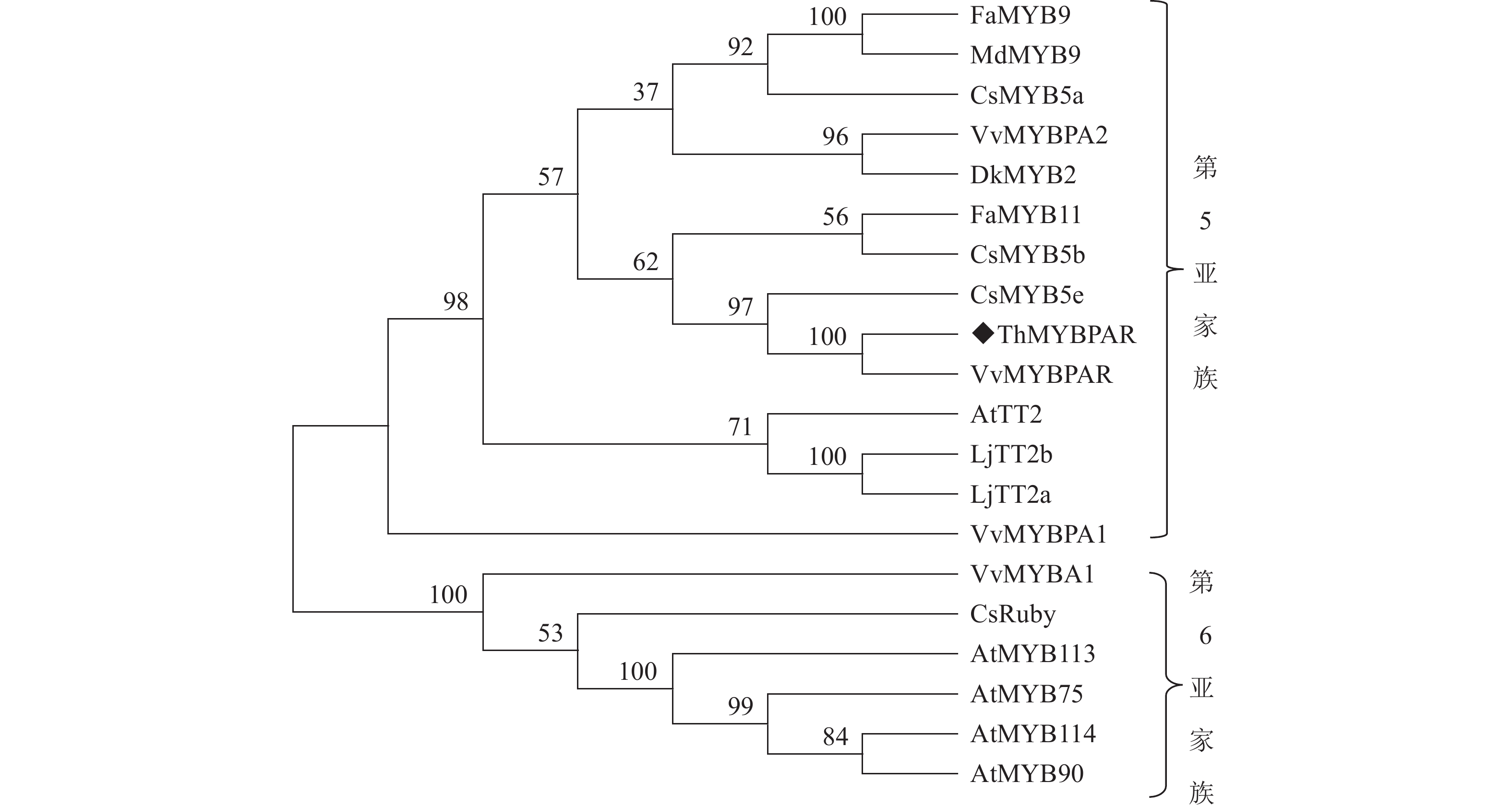
本研究发现了1个属于R2R3-MYB第5亚家族的MYB转录因子,命名为ThMYBPAR。ThMYBPAR基因的序列长度为888 bp,预测编码产生310个氨基酸组成的蛋白。将ThMYBPAR蛋白与美国国家生物技术信息中心(NCBI)数据库中收录的VvMYBPAR、VvMYBPA1、VvMMYBPA2和AtTT2进行序列比对(图2),结果发现ThMYBPAR具有典型的R2和R3 DNA结合功能结构域,说明ThMYBPAR为R2R3-MYB家族。且本研究进一步分析了ThMYBPAR与数据库中的VvMYBPAR、VvMYBPA1、VvMMYBPA2和AtTT2序列上的差异。从系统进化分析结果(图3)可以明显看出:ThMYBPAR可以与VvMYBPAR、CsMYB5e、CsMYB5b等R2R3-MYB第5亚家族的成员聚为一类,且ThMYBPAR与VvMYBPAR更相近。
-
蛋白质在细胞中的定位一定程度上能够反映其潜在的功能,为了探究ThMYBPAR编码蛋白在细胞中的定位,构建基因ThMYBPAR与GFP融合表达载体,与植物细胞核定位Marker在烟草叶片中共定位。如图4所示:ThMYBPAR蛋白的荧光信号仅出现在烟草的细胞核中,呈现出明显的绿色荧光信号,与植物细胞核定位Marker定位一致,说明ThMYBPAR属于核定位。
-
对ThMYBPAR及ThLAR基因进行RT-qPCR验证(图5)显示:块根中ThMYBPAR及ThLAR表达量显著高于叶片(P<0.05)。其中三叶青块根中ThLAR的表达量是叶片中的4倍,而块根中ThMYBPAR的表达量是叶片的20倍。
-
由表2可知:三叶青中总黄酮与原花青素呈极显著正相关(P<0.01),与ThMYBPAR、ThLAR基因表达量也均呈极显著正相关(P<0.01);原花青素与ThMYBPAR、ThLAR基因表达量也呈极显著正相关(P<0.01)。
活动成分 总黄酮 原花青素 ThMYBPAR ThLAR 总黄酮 1.000 原花青素 1.000** 1.000 ThMYBPAR 0.983** 0.983** 1.000 ThLAR 0.989** 0.989** 0.994** 1.000 说明:**表示极显著相关(P<0.01)。 Table 2. Correlation between active ingredients and gene expression of T. hemsleyanum
-
MYB转录因子是一类DNA结合蛋白,由高度保守的MYB结构域构成,每个结构域由一系列高度保守的氨基酸序列及间隔序列拼接而成。这些氨基酸可以使MYB蛋白折叠成螺旋—螺旋—转角—螺旋(HHTH)结构[15]。作为植物中最大的转录因子家族,MYB结构域由1~4个重复序列构成。根据MYB结构域的数量和位置,可以分为4类:1R(R1/2,R3-MYB)、2R(R2R3-MYB)、3R(R1R2R3-MYB)和4R(R1R2R2R1/2MYB)[16]。其中与类黄酮代谢相关的MYB通常为R2R3-MYB,并且在原花青素合成调控模式中起着重要作用[17]。本研究从三叶青中克隆得到1个MYBPAR基因,从基因编码的氨基酸序列结构上来看,ThMYBPAR的N端具有高度保守的R2R3结构域,并对其进行生物信息学分析,得出ThMYBPAR蛋白序列具有2个典型的MYB转录因子结构域,表明ThMYBPAR属于R2R3-MYB转录因子,且在三叶青块根中的表达量高于叶片。
系统进化树分析显示:ThMYBPAR、AtTT2、VvMYBPA1和VvMYBPA2等参与原花青素调控的转录因子共聚到SG5-MYB亚组,因此推测ThMYBPAR基因可能也参与原花青素的生物合成。花青素还原酶(ANR)及无色花青素还原酶(LAR)是原花青素单体生物合成过程中2个关键限速酶,对原花青素的生物合成及积累具有重要作用[18]。有研究发现:葡萄VvLAR基因还可通过时空特异性表达影响原花青素的种类和积累[19];如VvMYBPAR通过激活原花青素(PA)特异性分支基因,以及与PA单体前体修饰和运输相关的候选基因的启动子,参与调控原花青素的合成途径[20];VvMYBPA1、ANR和LAR基因的高表达促进了葡萄中原花青素的合成[21−22]。因此,推测三叶青块根中ThLAR与ThMYBPAR的高表达,可能促进三叶青中原花青素的合成,从而导致三叶青块根中的原花青素质量浓度显著高于叶片。
三叶青具有广阔的药用价值和经济价值,而原花青素作为植物重要的次生代谢产物之一,不仅是植物应对生物和非生物胁迫的一种重要防御手段,还能影响植物发育和品质。虽然原花青素生物合成途径在模式植物中已有研究,但在三叶青中的调控机制研究相对较少。基于以上研究结果,可以进一步探究三叶青中黄酮类物质的生物合成途径及其调控机制,为药用植物资源的利用和品质调控提供新的思路和方法。
-
本研究从三叶青中克隆了1个ThMYBPAR基因,基因的序列长度为888 bp,编码310个氨基酸,ThMYBAPR属于R2R3-MYB转录因子家族,定位于细胞核,与葡萄、拟南芥等R2R3-MYB转录因子有较高的同源性。系统进化分析表明:ThMYBPAR转录因子与葡萄中的VvMYBPAR、拟南芥中的AtTT2等参与调控原花青素的转录因子聚为一类,且与原花青素调控相关的基因ThLAR在三叶青块根中显著上调,ThMYBPAR与ThLAR呈显著正相关。因此推测ThMYBPAR转录因子参与了三叶青中原花青素的合成,且主要通过ThLAR来调控。
Cloning and analysis of tissue-specific expression patterns of ThMYBPAR gene in Tetrastigma hemsleyanum
doi: 10.11833/j.issn.2095-0756.20240459
- Received Date: 2024-07-22
- Accepted Date: 2025-01-09
- Rev Recd Date: 2024-12-20
- Available Online: 2025-04-01
- Publish Date: 2025-04-01
-
Key words:
- Tetrastigma hemsleyanum /
- gene clone /
- ThMYBPAR gene /
- proanthocyanidins
Abstract:
| Citation: | WANG Ziyue, YANG Feng, WANG Hongyan, et al. Cloning and analysis of tissue-specific expression patterns of ThMYBPAR gene in Tetrastigma hemsleyanum[J]. Journal of Zhejiang A&F University, 2025, 42(2): 273−280 doi: 10.11833/j.issn.2095-0756.20240459 |













 DownLoad:
DownLoad: