-
元宝枫Acer truncatum是无患子科Sapindaceae槭树属Acer落叶乔木树种。近年来四川、甘肃、云南、贵州等地区在荒山造林和退耕还林中大量种植元宝枫[1]。元宝枫具有较高的生态、经济价值,侧根发达,具有较强的耐旱、抗寒、抗风害能力,是绿化、景观和水土保持的理想树种[2],同时作为“食药两用”树种,已成为保健品和药品的重要原料[3]。2011年元宝枫籽油被批准为新资源食品;2015年元宝枫被列为全国重点发展的木本油料树种,2019年被列入国家储备林建设树种目录。但现阶段元宝枫存在种源不清、幼苗品质不一、缺乏科学规范的种植繁育技术和管理方法等问题[4],因此,培育优质、高产、抗性强的优良苗木,对获得优质元宝枫籽油原料和促进元宝枫产业良好发展尤为重要。
生物质炭是生物质材料在高温缺氧条件下热裂解得到的富碳物质[5]。近年来,生物质炭作为一类新型环境功能材料引起广泛关注,因其具有成本低、可持续性、来源全面、环境友好以及较高碳含量、疏松多孔结构、丰富的官能团和较强的吸附能力等特点[6−7],在土壤改良、植物生长、温室气体减排以及污染环境修复等方面都展现出应用潜力,已成为当前的研究热点[8]。育苗基质是植物育苗的重要物质基础和关键因素,良好的育苗基质能为植物提供丰富的养分和相对稳定的生长环境[9]。育苗基质中添加生物质炭不仅可以提高幼苗的株高、茎粗、叶面积、鲜质量、干质量,还能增加叶绿素含量,促进光合作用[10−11]。但生物质炭对幼苗生长的影响因生物质炭种类、添加量和植物种类不同而有所差别,在大范围推广生物质炭育苗基质之前,需根据生物质炭种类、不同植物进行深入研究,以筛选出最佳添加量[12−13]。通过椰壳生物质炭与菌肥配施对元宝枫幼苗生长影响研究发现:添加生物质炭后显著提高了元宝枫幼苗生长量、生物量及叶绿素含量[14],但未针对不同种类生物质炭进行对比试验。因此,为探明不同种类和施用量的生物质炭对元宝枫幼苗生长及养分的影响,本研究以元宝枫幼苗为材料,进行育苗盆栽试验,筛选最优的生物质炭种类及施用量,为培育优质元宝枫苗木提供理论参考和技术指导。
-
元宝枫种子采自云南省昆明市石林大道上发育健壮、树形丰满、生长良好和无病虫害的元宝枫母树。调配育苗基质所用红壤采自云南省昆明市呼马山,其理化性质为:pH 6.6、有机碳质量分数1.03 g·kg−1、全氮0.30 g·kg−1、全磷1.10 g·kg−1、全钾2.45 g·kg−1、碱解氮22.37 mg·kg−1、有效磷2.44 mg·kg−1、速效钾109.27 mg·kg−1。
选取竹类、木本类、壳类生物质炭中较为常见的竹炭、橡胶木炭、稻壳炭,购买于福建优选炭业有限责任公司。3种生物质炭基本特性见表1。
表 1 生物质炭基本特性
Table 1. Basic properties of biochars
种类 比表面积/(m2·g−1) 平均孔径/nm 总孔容积/(×10−2 m3·g−1) 碳质量分数/(g·kg−1) 氮质量分数/(g·kg−1) 竹炭 82.59 2.65 5.48 860.00 10.00 橡胶木炭 265.01 1.94 12.85 614.20 11.00 稻壳炭 62.47 3.37 5.27 270.00 10.00 -
试验地位于云南省昆明市西南林业大学树木园实验基地。试验花盆直径为17.0 cm,高为12.0 cm,对照组1 (ck0)仅有红壤,不加椰糠和生物质炭;对照组2 (ck1)为常规轻基质[V(椰糠)∶V(红壤)=3∶7],不加生物质炭。其余处理组均为常规轻基质,每盆装入0.8 kg育苗基质,分别设置30.0、50.0、70.0 g·kg−1的橡胶木炭(T1、T2、T3)、稻壳炭(T4、T5、T6)和竹炭(T7、T8、T9)的添加量,将生物质炭与育苗基质拌匀待用。共11个处理,每个处理设置10个重复。
元宝枫种子于2022年4月5日播种,播深为2.0~3.0 cm。播后定期浇水和除草,分别于7月底和8月底追施氮磷钾复合肥[m(N)∶m(P)∶m(K)=15∶15∶15],每盆施肥8.0 g。
-
元宝枫幼苗生长后期为8—9月,因此于2022年9月25日取样,每个处理选取3株长势一致的幼苗测定。幼苗株高用直尺测定;茎粗用游标卡尺测定;采集植株根、茎、叶样品带回实验室,清洗干净后测定鲜质量,放入烘箱在105 ℃杀青30 min,65 ℃烘干至恒量测定干质量;单株叶面积用叶面积仪(LI-300A)测定;叶绿素质量分数用无水乙醇法测定;光合指标[光合速率、胞间二氧化碳(CO2)摩尔分数、气孔导度、蒸腾速率]用便携式光合系统分析仪(LI-6400)测定;根系指标(总根长、总根表面积、总根系体积、根平均直径)采用根系分析系统(WinRhizo Pro LA2400)测定[14];将植株干样粉碎后过80目筛测定全氮、全磷、全钾质量分数,全氮用凯氏定氮法测定,全磷用高氯酸消解-钼锑抗比色法测定,全钾用氢氧化钠熔融-火焰光度计法[2]。
-
采用Excel 2019处理数据;采用Origin 2023绘制图表;采用SPSS 24通过单因素方差分析确定不同处理之间的差异显著性。对所有指标进行主成分分析,得出主成分各处理的指标测定值,应用隶属函数法,计算出各主成分的隶属函数值,以主成分贡献率为权重,单项得分乘以相应的贡献率后相加,得出各处理的苗木综合指数(CEI)。具体方法参考文献[15]。
-
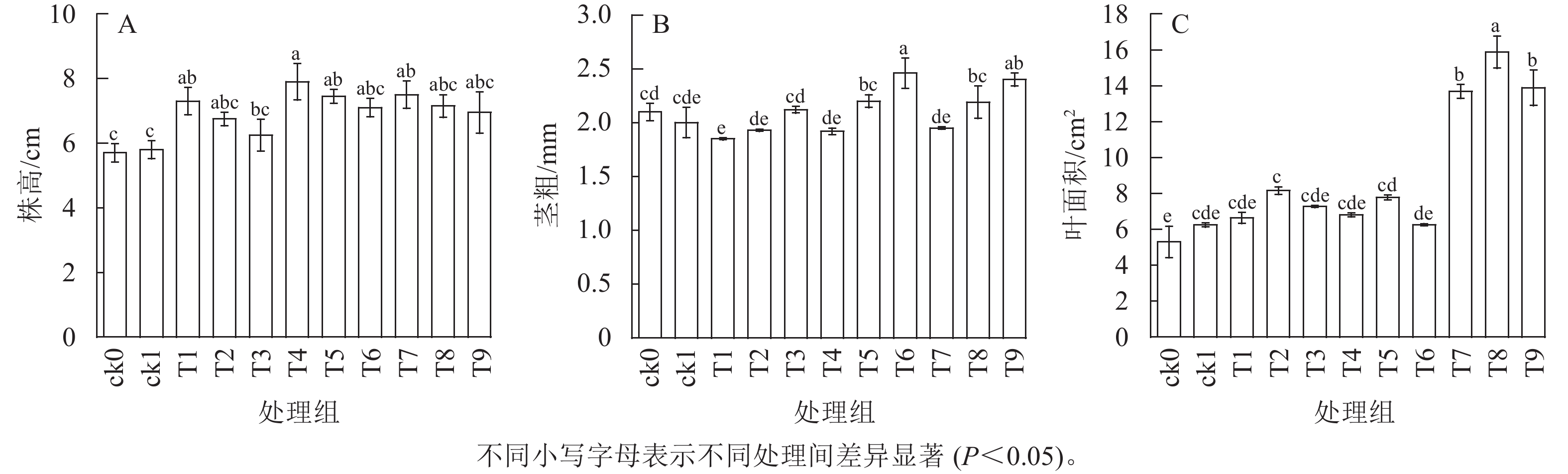
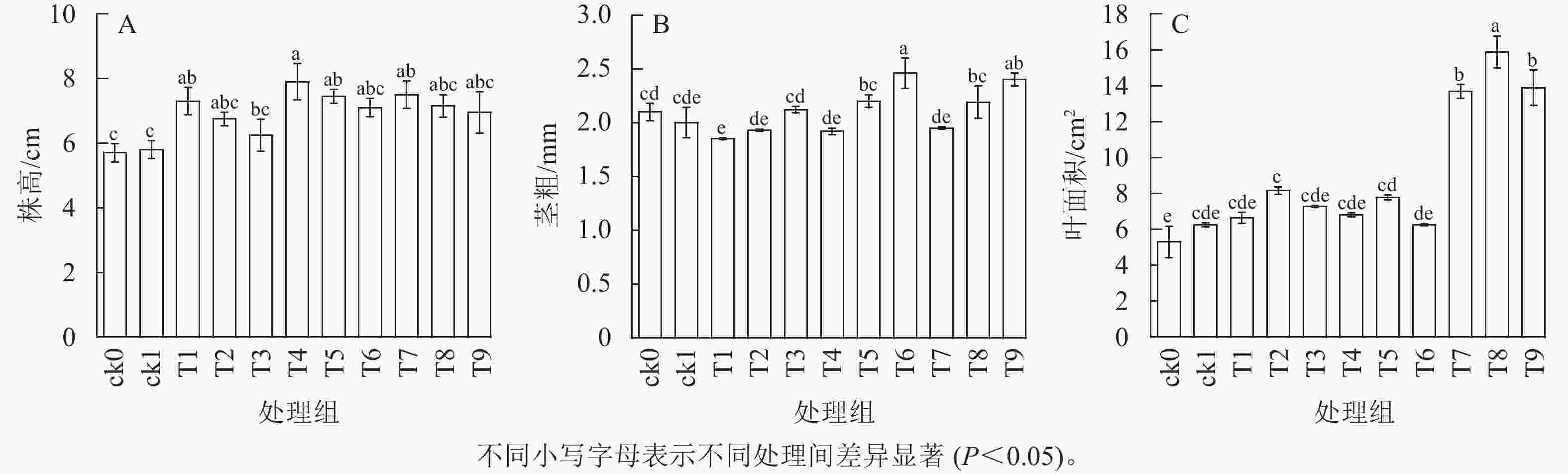
由图1可知:ck1株高和叶面积优于ck0,施用稻壳炭对幼苗株高和茎粗的提高效果优于橡胶木炭和竹炭,施用竹炭对幼苗叶面积的提高效果优于橡胶木炭和稻壳炭(P<0.05)。施用30.0 g·kg−1生物质炭后各处理株高优于不加生物质炭处理(P<0.05)。3种生物质炭处理组株高均呈现出随施炭量增加而降低的趋势;T4处理株高最大,与ck1相比平均提高了36.21%。在30.0 g·kg−1施炭量下,3种生物质炭处理组茎粗均小于对照,与ck1相比,T1、T4、T7分别降低了7.50%、4.00%、2.50%;3种生物质炭处理组茎粗均呈现出随施炭量增加而升高的趋势,对茎粗增加最优为T6处理,与ck1相比提高了23.00%,差异显著(P<0.05)。除T6处理外,其他处理叶面积均大于对照,叶面积随施炭量增加呈现先增加后降低的趋势;叶面积最大的处理为T8处理,与ck1相比提高了154.49%,差异显著(P<0.05)。
-
由图2可知:ck1元宝枫幼苗鲜质量和干质量均优于ck0。幼苗根、茎、叶的鲜质量和干质量均在T8处理时达最大,与ck1相比,鲜质量分别提高了112.33%、76.19%、218.18%,干质量分别提高了137.93%、70.00%、169.23%,差异显著(P<0.05)。各处理下元宝枫幼苗根系鲜质量和干质量均高于茎和叶。施炭处理除T7外,其他处理根系鲜质量和干质量均高于不加生物质炭处理。ck1与T6、T8、T9处理叶鲜质量差异显著(P<0.05),与其他处理差异不显著。随生物质炭施用量增加,施用不同生物质炭根系干质量均呈现先升高后降低的趋势。
-
由表2可知:添加不同种类、不同施用量生物质炭处理的元宝枫幼苗根系形态发育存在差异。ck1元宝枫幼苗根系形态均优于ck0。除T2处理外,其余施炭处理对幼苗总根长、总根表面积、总根体积和根平均直径均有促进作用。施用稻壳炭幼苗总根长、总根表面积、总根体积和根平均直径优于施用竹炭和橡胶木炭,且随施炭量增加呈现先增加后降低的趋势,T5处理对幼苗根系生长最佳,与ck1相比各形态分别提高了98.79%、110.22%、175.00%、37.50%,差异显著(P<0.05)。施用橡胶木炭处理,随施炭量增加幼苗各根系形态均呈现先降低后升高的趋势,低施炭量优于高施炭量。施用竹炭处理,不同施炭量之间除总根长外各根系形态差异不显著,低施炭量下总根长和总根表面积高于高施炭量。
表 2 不同生物质炭处理对元宝枫幼苗根系生长的影响
Table 2. Effects of different biochar treatments on root growth of A. truncatum seedlings
处理 总根长/cm 总根表面积/cm2 总根体积/cm3 根平均直径/mm ck0 142.99±14.38 de 22.94±1.97 de 0.22±0.01 c 0.38±0.05 b ck1 180.12±7.21 cd 23.88±1.29 de 0.24±0.02 c 0.40±0.01 b T1 263.91±2.95 b 45.47±4.63 ab 0.63±0.13 a 0.55±0.06 a T2 118.92±15.65 e 18.08±3.27 e 0.22±0.12 c 0.38±0.06 ab T3 206.08±14.96 c 27.17±0.39 d 0.29±0.03 c 0.42±0.05 b T4 290.93±15.50 b 35.35±3.90 c 0.34±0.03 c 0.44±0.07 b T5 358.12±13.26 a 50.20±2.25 a 0.66±0.05 ab 0.55±0.03 ab T6 296.51±0.57 b 42.24±0.90 b 0.48±0.02 b 0.45±0.01 ab T7 264.42±13.16 b 28.41±3.60 d 0.25±0.03 c 0.44±0.01 ab T8 207.79±16.55 c 26.17±3.71 d 0.26±0.03 c 0.42±0.04 b T9 198.28±4.88 c 26.98±0.65 d 0.31±0.05 c 0.46±0.06 ab 说明:不同小写字母表示同一指标不同处理间差异显著(P<0.05)。 -
由表3可知:施炭后元宝枫幼苗各项光合指标存在差异。稻壳炭对各光合指标的影响大于橡胶木炭和竹炭,且各指标呈现随稻壳炭施炭量增加而增加的趋势。与ck1相比,幼苗叶绿素、净光合速率、气孔导度、蒸腾速率在T3和T4处理下均降低,在其他施炭处理下均有所提高。施炭后幼苗胞间CO2摩尔分数均大于ck1。T6处理对叶绿素、净光合速率、气孔导度、蒸腾速率影响显著(P<0.05),分别比ck1提高50.00%、221.76%、200.00%、146.91%。T7处理胞间CO2摩尔分数最大,比ck1提高85.95%。
表 3 不同生物质炭处理对元宝枫幼苗光合作用的影响
Table 3. Effects of different biochar treatments on photosynthesis of A. truncatum seedlings
处理 叶绿素/(mg·g−1) 净光合速率/(μmol·m−2·s−1) 气孔导度/(mol·m−2·s−1) 胞间CO2摩尔分数/(μmol·mol−1) 蒸腾速率/(mmol·m−2·s−1) ck0 1.31±0.05 cd 1.78±0.13 g 0.02±0.01 c 144.50±16.26 e 0.67±0.35 de ck1 1.48±0.05 bcd 2.16±0.40 efg 0.03±0.01 bc 153.00±9.90 e 1.13±0.01 bcd T1 1.66±0.22 b 2.71±0.24 def 0.03±0.01 bc 198.50±10.61 cd 1.17±0.02 cde T2 2.20±0.14 a 5.38±0.33 b 0.06±0.01 abc 189.00±1.41 d 1.92±0.08 b T3 0.96±0.01 e 1.70±0.37 g 0.02±0.01 bc 221.50±6.36 bc 0.73±0.11 de T4 1.22±0.17 de 1.89±0.69 fg 0.02±0.01 c 217.50±7.78 bcd 0.53±0.05 e T5 1.55±0.08 bcd 3.54±0.53 cd 0.03±0.01 bc 202.50±12.02 cd 1.17±0.02 cde T6 2.22±0.15 a 6.95±0.49 a 0.09±0.03 a 247.50±9.19 b 2.79±0.28 a T7 1.64±0.22 bc 2.68±0.19 def 0.07±0.05 ab 284.50±7.78 a 1.72±0.81 bc T8 1.57±0.10 bc 3.01±0.06 cde 0.03±0.01 bc 220.50±3.54 bc 1.29±0.01 bcd T9 1.53±0.15 bcd 3.69±0.12 c 0.04±0.01 abc 229.50±3.54 bc 1.64±0.01 bc 说明:不同小写字母表示同一指标不同处理间差异显著(P<0.05)。 -
由图3可知:ck1地上部分和地下部分全氮质量分数高于ck0。除T3处理外,施用生物质炭对幼苗地上部分全氮质量分数均有促进作用,地上部分全氮质量分数最高为T8处理,与ck1相比提高了47.05%。地下部分全氮质量分数最高为T9处理,与ck1相比提高了49.87%。元宝枫幼苗全磷全钾质量分数表现为:轻基质土壤ck1处理优于纯土ck0处理,施用生物质炭处理优于不加生物质炭处理,地上、地下部分全磷和全钾质量分数最高均为T9处理,相比ck1,全磷分别提高了178.89%和203.39%,全钾分别提高了179.67%和138.28%,差异显著(P<0.05)。
-
通过主成分分析提取5个主成分,贡献率分别为35.675%、22.391%、16.477%、10.291%、6.081%,累计贡献率为90.915%,表明5个主成分可以反映生物质炭处理效果90.915%的信息。从主成分贡献率来看,第1主成分全氮载荷最大;第2主成分总根表面积的载荷最大;第3主成分全磷的载荷最大;第4主成分胞间CO2摩尔分数的载荷量最大;第5主成分茎粗的载荷量最大。根据主成分分析和隶属函数法得出各处理的苗木综合指数(CEI)。CEI代表了各处理的综合效果,分值越高对元宝枫幼苗生长的影响效果最好。由表4可知:11种处理效果从大到小依次为T5、T9、T8、T6、T1、T4、T7、T3、T2、ck1、ck0。
表 4 不同生物质炭处理苗木综合评价
Table 4. Comprehensive evaluation of seedlings under different biochar treatments
处理 指标测定值 CEI 1 2 3 4 5 ck0 −1.565 −0.510 −0.144 −0.837 −0.066 0.191 ck1 −1.155 −0.450 −0.382 −0.699 −0.185 0.235 T1 0.124 1.444 0.172 −0.320 −1.442 0.557 T2 0.161 −1.419 −1.027 −0.113 −1.413 0.274 T3 −1.086 0.105 0.541 0.061 1.156 0.394 T4 −0.467 0.897 0.458 0.652 0.161 0.525 T5 0.643 1.676 0.243 −0.757 0.065 0.665 T6 1.616 −0.088 −1.617 −0.989 1.116 0.558 T7 −0.047 0.221 −1.141 2.556 0.233 0.496 T8 0.590 −0.944 1.262 0.021 1.442 0.563 T9 1.186 −0.931 1.636 0.424 −1.068 0.613 -
生物质炭能为植物生长提供营养物质,对植物生长发育具有促进作用,不仅可以提高幼苗的株高、茎粗、叶面积、生物量,还能增加叶绿素质量分数,增强根系活力,促进光合作用[10−11]。本研究发现:与不加生物质炭处理相比,施用生物质炭后,元宝枫幼苗株高、茎粗、叶面积、生物量均有所提高,叶面积提高效果最显著,提高了6.41%~154.49%,这与黄娴等[16]和GUO等[17]对油用牡丹Paeonia和番茄Solanum lycopersicum的研究结果一致。可能是因为生物质炭具有疏松多孔的特性,施入基质后提高了基质孔隙度,使基质的抗张强度降低,改善基质团聚体特性,提高基质持水、透气性,进而促进植物的生长[18],因此施用生物质炭后对不同植物地上部分生长的表型具有促进作用。生物质炭的种类和添加量都会影响元宝枫幼苗生长。本研究中稻壳炭对元宝枫幼苗株高和茎粗的提升效果优于竹炭和橡胶木炭,茎粗随施炭量的增加而增加,但株高随施炭量的增加而降低;对叶面积和生物量提升最高的是竹炭,最优施炭量均为50.0 g·kg−1竹炭施用量。这与王高飞等[19]研究结果一致。可能是因为生物质炭原材料和施用量的不同,使得生物质炭在结构、挥发成分质量分数、总孔容积、比表面积、平均孔径等理化性质上表现出差异性,产生不同的环境效益[20],导致不同生物质炭对植物生长的影响不同。
根系是直接与基质接触的营养器官,基质的理化性质等因素直接影响根系的生长、分布及功能,进而影响植株的生长发育和作物产量[21−22]。本研究发现:除50.0 g·kg−1橡胶木炭施用量外,其余施炭处理幼苗总根长、总根表面积、总根体积和根平均直径均高于不加生物质炭处理,分别提高了10.08%~98.82%、9.59%~110.22%、4.17%~175.00%、5.00%~37.50%。这与成功等[23]研究结果一致。一方面基质的物理性状是限制植物根系生长的重要环境因素,生物质炭的高表面积和孔隙度有效改善了基质物理性质;另一方面生物质炭在水土交融作用下可能会释放或吸收植物生长的化学信号等,对根系分泌物产生影响,从而刺激和干扰根系生理进程,影响根系生长[24]。因此,施用生物质炭对元宝枫幼苗根系生长具有促进作用。
光合作用是植物生长代谢最基本的物质和能量来源[25]。本研究中,与不加生物质炭对比,施用生物质炭后幼苗胞间CO2摩尔分数均有所提高,除T3和T4处理外,其余施炭处理下幼苗叶绿素、净光合速率、气孔导度、蒸腾速率均提高;稻壳炭对各光合指标的影响大于橡胶木炭和竹炭,且各指标随稻壳炭施炭量增加而增加。李彩斌等[26]研究结果与本研究一致。研究发现:施加生物质炭促进了植物根系生长,根系能够为叶片输送充足的水分和矿质营养,保证叶片中叶绿素的活性,从而促进植物光合作用[27]。也有研究认为:生物质炭的添加提高了植物氮素吸收和利用效率,使植物氮素质量分数上升,进而提高植物的光合作用强度[26],但具体机制有待进一步研究。
幼苗的养分直接反映元宝枫后期生长发育情况,施加生物质炭可以提高元宝枫幼苗对氮、磷、钾养分的吸收[28]。本研究表明:生物质炭促进了元宝枫幼苗对氮、磷、钾的吸收,除T3处理外,其余处理地上部分全氮质量分数均大于对照;地下部分全氮质量分数除T3、T7、T8处理外均大于对照。与不加生物质炭相比,施炭后幼苗地上、地下部分全磷和全钾质量分数均有所提高。施用竹炭幼苗全磷和全钾质量分数高于橡胶木炭和稻壳炭。这与周加顺等[29]的研究结果一致。生物质炭本身含有一定对元宝枫幼苗有益的元素,施入基质后能显著提高基质中氮、磷、钾的质量分数,为元宝枫幼苗的生长提供良好的元素供应源,且不同种类的生物质炭本身孔隙度、表面官能团分布、pH和所含的养分质量分数不同,同时对基质中养分的吸附效果也不同,所以对元宝枫幼苗养分影响也不同[30−31]。
育苗基质添加生物质炭后,可以改变元宝枫幼苗的营养、光合等生理生化特性,从而引起根系、生物量等表型的改变,最终影响整个生长过程。然而植物生长过程中,不同的生长环境使幼苗各部位生长发育及养分吸收情况均有差异,无法直观评价苗木生长的好坏[25]。本研究对元宝枫幼苗生长量、生物量、根系形态指标、光合指标、养分质量分数进行主成分分析,提取5个主成分,累计贡献率达90.915%,用隶属函数法计算苗木综合指数,结果显示:T5处理苗木综合指数最大,为0.665。说明施用生物质炭能够提高苗木综合质量。本研究中50.0 g·kg−1稻壳炭可作为元宝枫幼苗育苗基质推荐使用。
-
育苗基质中添加生物质炭对元宝枫幼苗生长量、生物量、根系形态、光合指标、养分质量分数均有一定的提升效果,可将生物质炭用于育苗基质中,培育优质元宝枫幼苗。不同种类生物质炭及不同施用量对元宝枫幼苗生长效果影响不同。本研究通过隶属函数法进行苗木质量综合评价得出最佳施炭量,建议在元宝枫育苗基质中优先选择添加50.0 g·kg−1稻壳炭。
Growth of Acer truncatum seedlings in response to the seedling substrate with different kinds of biochar
-
摘要:
目的 探讨不同种类和不同用量生物质炭基质对元宝枫Acer truncatum幼苗生长与幼苗养分的影响,筛选较优生物质炭及施炭量,以期为元宝枫育苗基质科学施用生物质炭提供理论参考。 方法 以元宝枫幼苗为试验对象,采用盆栽试验,对照组(ck1)为常规轻基质不加生物质炭。选取橡胶木炭、稻壳炭和竹炭3种生物质炭,分别设置30.0、50.0、70.0 g·kg−1的添加量,测定不同处理下元宝枫幼苗生长量、生物量、光合指标、根系形态、养分等指标,通过主成分与隶属函数分析对元宝枫幼苗各指标进行综合评价,探讨最佳生物质炭及添加量。 结果 育苗基质中添加生物质炭对元宝枫幼苗生长量、生物量、根系形态、光合指标、养分质量分数均有一定促进作用,施用稻壳炭对幼苗株高、茎粗、光合指标、根系形态提升效果优于竹炭和橡胶木炭。50.0 g·kg−1稻壳炭对幼苗根系生长最佳,总根长、总根表面积、总根体积和根平均直径较ck1分别提高了98.79%、110.22%、175.00%和37.50%;70.0 g·kg−1稻壳炭对叶绿素、净光合速率、气孔导度和蒸腾速率产生显著影响(P<0.05),较ck1分别提高了50.00%、221.76%、200.00%和146.91%。添加50.0 g·kg−1稻壳炭的苗木评价指数最大(0.665),为最佳施炭量。 结论 育苗基质中添加生物质炭对元宝枫幼苗生长发育和养分吸收利用有一定的促进效果。建议在育苗时优先选择添加50.0 g·kg−1的稻壳炭基质。图3表4参31 Abstract:Objective In order to study the effects of different kinds and amount of biochar on the growth and nutrition of Acer truncatum seedlings, the better biochar and its application amount are selected to provide a theoretical reference for the scientific application of biochar in A. truncatum seedlings. Method The seedlings were used as experimental objects, and pot experiments were carried out. Conventional light substrate without biochar was taken as the control (ck1). 3 types of biochar (rubber biochar, rice husk biochar and bamboo biochar) with addition of 30.0, 50.0 and 70.0 g·kg−1 were set up. The growth, biomass, photosynthetic index, root morphology and nutrition of the seedlings under different treatments were determined. The principal component analysis and membership function analysis of the seedlings were used to comprehensively evaluate the indicators and explore the best biochar and addition proportion. Result The growth, biomass, root morphological index, photosynthetic index and nutrient content of the seedlings were all promoted by adding biochar to the substrate, the effect of rice husk biochar on seedling height, stem diameter, photosynthetic index and root morphology was better than that of bamboo biochar and rubber biochar. 50.0 g·kg−1 rice husk biochar addition proportion was the best for root growth of seedlings, compared with ck1, the total root length, total root surface area, total root volume and average root diameter increased by 98.79%, 110.22%, 175.00% and 37.50%, respectively. 70.0 g·kg−1 rice husk biochar addition proportion had significant effects on chlorophyll, net photosynthetic rate, stomatal conductance, and transpiration rate, compared with ck1, which increased by 50.00%, 221.76%, 200.00% and 146.91%, respectively. The evaluation index of seedlings with 50.0 g·kg−1 rice husk biochar was the highest (0.665), which was the best amount of biochar. Conclusion The addition of biochar to the the substrate could promote the absorption and utilization of nutrients in A. truncatum seedlings. It is suggested that 50.0 g·kg−1 rice husk biochar should be preferentially selected when adding biochar to A. truncatum seedling substrate. [Ch, 3 fig. 4 tab. 31 ref.] -
Key words:
- biochar /
- Acer truncatum /
- seedling growth /
- seedling nutrient /
- grow seedlings
-
表 1 生物质炭基本特性
Table 1. Basic properties of biochars
种类 比表面积/(m2·g−1) 平均孔径/nm 总孔容积/(×10−2 m3·g−1) 碳质量分数/(g·kg−1) 氮质量分数/(g·kg−1) 竹炭 82.59 2.65 5.48 860.00 10.00 橡胶木炭 265.01 1.94 12.85 614.20 11.00 稻壳炭 62.47 3.37 5.27 270.00 10.00 表 2 不同生物质炭处理对元宝枫幼苗根系生长的影响
Table 2. Effects of different biochar treatments on root growth of A. truncatum seedlings
处理 总根长/cm 总根表面积/cm2 总根体积/cm3 根平均直径/mm ck0 142.99±14.38 de 22.94±1.97 de 0.22±0.01 c 0.38±0.05 b ck1 180.12±7.21 cd 23.88±1.29 de 0.24±0.02 c 0.40±0.01 b T1 263.91±2.95 b 45.47±4.63 ab 0.63±0.13 a 0.55±0.06 a T2 118.92±15.65 e 18.08±3.27 e 0.22±0.12 c 0.38±0.06 ab T3 206.08±14.96 c 27.17±0.39 d 0.29±0.03 c 0.42±0.05 b T4 290.93±15.50 b 35.35±3.90 c 0.34±0.03 c 0.44±0.07 b T5 358.12±13.26 a 50.20±2.25 a 0.66±0.05 ab 0.55±0.03 ab T6 296.51±0.57 b 42.24±0.90 b 0.48±0.02 b 0.45±0.01 ab T7 264.42±13.16 b 28.41±3.60 d 0.25±0.03 c 0.44±0.01 ab T8 207.79±16.55 c 26.17±3.71 d 0.26±0.03 c 0.42±0.04 b T9 198.28±4.88 c 26.98±0.65 d 0.31±0.05 c 0.46±0.06 ab 说明:不同小写字母表示同一指标不同处理间差异显著(P<0.05)。 表 3 不同生物质炭处理对元宝枫幼苗光合作用的影响
Table 3. Effects of different biochar treatments on photosynthesis of A. truncatum seedlings
处理 叶绿素/(mg·g−1) 净光合速率/(μmol·m−2·s−1) 气孔导度/(mol·m−2·s−1) 胞间CO2摩尔分数/(μmol·mol−1) 蒸腾速率/(mmol·m−2·s−1) ck0 1.31±0.05 cd 1.78±0.13 g 0.02±0.01 c 144.50±16.26 e 0.67±0.35 de ck1 1.48±0.05 bcd 2.16±0.40 efg 0.03±0.01 bc 153.00±9.90 e 1.13±0.01 bcd T1 1.66±0.22 b 2.71±0.24 def 0.03±0.01 bc 198.50±10.61 cd 1.17±0.02 cde T2 2.20±0.14 a 5.38±0.33 b 0.06±0.01 abc 189.00±1.41 d 1.92±0.08 b T3 0.96±0.01 e 1.70±0.37 g 0.02±0.01 bc 221.50±6.36 bc 0.73±0.11 de T4 1.22±0.17 de 1.89±0.69 fg 0.02±0.01 c 217.50±7.78 bcd 0.53±0.05 e T5 1.55±0.08 bcd 3.54±0.53 cd 0.03±0.01 bc 202.50±12.02 cd 1.17±0.02 cde T6 2.22±0.15 a 6.95±0.49 a 0.09±0.03 a 247.50±9.19 b 2.79±0.28 a T7 1.64±0.22 bc 2.68±0.19 def 0.07±0.05 ab 284.50±7.78 a 1.72±0.81 bc T8 1.57±0.10 bc 3.01±0.06 cde 0.03±0.01 bc 220.50±3.54 bc 1.29±0.01 bcd T9 1.53±0.15 bcd 3.69±0.12 c 0.04±0.01 abc 229.50±3.54 bc 1.64±0.01 bc 说明:不同小写字母表示同一指标不同处理间差异显著(P<0.05)。 表 4 不同生物质炭处理苗木综合评价
Table 4. Comprehensive evaluation of seedlings under different biochar treatments
处理 指标测定值 CEI 1 2 3 4 5 ck0 −1.565 −0.510 −0.144 −0.837 −0.066 0.191 ck1 −1.155 −0.450 −0.382 −0.699 −0.185 0.235 T1 0.124 1.444 0.172 −0.320 −1.442 0.557 T2 0.161 −1.419 −1.027 −0.113 −1.413 0.274 T3 −1.086 0.105 0.541 0.061 1.156 0.394 T4 −0.467 0.897 0.458 0.652 0.161 0.525 T5 0.643 1.676 0.243 −0.757 0.065 0.665 T6 1.616 −0.088 −1.617 −0.989 1.116 0.558 T7 −0.047 0.221 −1.141 2.556 0.233 0.496 T8 0.590 −0.944 1.262 0.021 1.442 0.563 T9 1.186 −0.931 1.636 0.424 −1.068 0.613 -
[1] 乔谦, 丰震, 任红剑, 等. 元宝枫天然种群种实表型多样性[J]. 生态学杂志, 2017, 36(10): 2707 − 2715. QIAO Qian, FENG Zhen, REN Hongjian, et al. Phenotypic diversity of natural populations of Acer truncatum [J]. Chinese Journal of Ecology, 2017, 36(10): 2707 − 2715. [2] 陈梦婕, 李小英, 苏小娟, 等. 不同种类生物炭对元宝枫育苗基质养分及酶活性的影响[J]. 西部林业科学, 2024, 53(1): 99 − 107, 118. CHEN Mengjie, LI Xiaoying, SU Xiaojuan, et al. Effects of different types of biochar on substrate nutrients and enzyme activities of Acer truncatum seedlings [J]. Journal of West China Forestry Science, 2024, 53(1): 99 − 107, 118. [3] 佟祎鑫, 许佳敏, 陈芳, 等. 元宝枫化学成分及产品应用现状研究进展[J]. 中国油脂, 2022, 47(2): 118 − 123. TONG Yixin, XU Jiamin, CHEN Fang, et al. Advance in chemical components and products application status of Acer truncatum Bunge [J]. China Oils and Fats, 2022, 47(2): 118 − 123. [4] LEHMANN J. A handful of carbon [J]. Nature, 2007, 447(7141): 143 − 144. [5] JIANG Fan, ZHU Yahong, LIU Zheng, et al. Novel synthesis route for the preparation of mesoporous nitrogen-doped carbons from forestry wastes for supercapacitors [J/OL]. Surfaces and Interfaces, 2021, 24: 101132[2024-01-04]. doi: 10.1016/j.surfin.2021.101132. [6] CHEW J, ZHU Longlong, NIELSEN S, et al. Biochar-based fertilizer: supercharging root membrane potential and biomass yield of rice [J/OL]. Science of the Total Environment, 2020, 713: 136431[2024-01-04]. doi: 10.1016/j.scitotenv.2019.136431. [7] 卜晓莉, 薛建辉. 生物炭对土壤生境及植物生长影响的研究进展[J]. 生态环境学报, 2014, 23(3): 535 − 540. BU Xiaoli, XUE Jianhui. Biochar effects on soil habitat and plant growth: a review [J]. Ecology and Environmental Sciences, 2014, 23(3): 535 − 540. [8] 陈丽美, 李小英, 李俊龙, 等. 竹炭与有机肥配施对土壤肥力及紫甘蓝生长的影响[J]. 浙江农林大学学报, 2021, 38(4): 774 − 783. CHEN Limei, LI Xiaoying, LI Junlong, et al. Effects of combined application of bamboo charcoal and organic fertilizer on soil fertility and growth of Brassica oleracea var. capitata f. rubra [J]. Journal of Zhejiang A&F University, 2021, 38(4): 774 − 783. [9] 姜新, 欧智涛, 李一伟, 等. 不同栽培基质对‘甜查理’草莓生长及果实品质的影响[J]. 中国农学通报, 2019, 35(33): 71 − 75. JIANG Xin, OU Zhitao, LI Yiwei, et al. Substrates affect the growth and fruit quality of ‘Sweet Charlie’ strawberry [J]. Chinese Agricultural Science Bulletin, 2019, 35(33): 71 − 75. [10] 吴星慧, 苏宝玲, 齐麟, 等. 生物炭对白桦种子出苗率与幼苗生长的影响[J]. 林业资源管理, 2020(6): 128 − 134. WU Xinghui, SU Baoling, QI Lin, et al. Effects of biochar on seed germination and seedling growth of Betula platyphylla [J]. Forest and Grassland Resources Research, 2020(6): 128 − 134. [11] 夏亚真, 田利英, 李胜利, 等. 生物炭对番茄幼苗生长及养分吸收的影响[J]. 中国蔬菜, 2018(5): 32 − 35. XIA Yazhen, TIAN Liying, LI Shengli, et al. Creation method and identification technology for sweet-waxy maize of double recessive genotype [J]. China Vegetables, 2018(5): 32 − 35. [12] CHRYSARGYRIS A, PRASAD M, KAVANAGH A, et al. Biochar type and ratio as a peat additive/partial peat replace-ment in growing media for cabbage seedling production [J/OL]. Agronomy, 2019, 9(11): 693[2024-01-04]. doi: 10.3390/ agronomy9110693. [13] SOLAIMAN Z M, MURPHY D Y, ABBOTT L K. Biochars influence seed germination and early growth of seedlings [J]. Plant and Soil, 2012, 353(1): 273 − 287. [14] 白雪, 李小英, 邱宗海. 添加生物炭与菌肥的复合基质对元宝枫幼苗生长的影响[J]. 西南林业大学学报(自然科学), 2020, 40(4): 14 − 22. BAI Xue, LI Xiaoying, QIU Zonghai. Effects of adding compound substrates with biochar and bacterial fertilizer on the growth of Acer truncatum seedlings [J]. Journal of Southwest Forestry University (Natural Sciences), 2020, 40(4): 14 − 22. [15] 刘士玲, 贾宏炎, 陈琳, 等. 容器规格和添加生物炭的基质配方对西南桦幼苗生长的影响[J]. 生态学杂志, 2019, 38(9): 2875 − 2882. LIU Shiling, JIA Hongyan, CHEN Lin, et al. Effects of container size and medium formula with biochar addition on the growth of Betula alnoides seedlings [J]. Chinese Journal of Ecology, 2019, 38(9): 2875 − 2882. [16] 黄娴, 张兴伟, 王震洪. 添加生物炭对黄壤种植油用牡丹生长的影响[J]. 山地农业生物学报, 2018, 37(2): 74 − 79. HUANG Xian, ZHANG Xingwei, WANG Zhenhong. Effect of adding biochar on the growth of oil peonies in yellow soil [J]. Journal of Mountain Agriculture and Biology, 2018, 37(2): 74 − 79. [17] GUO Lili, BORN M L, NIU Wenquan, et al. Biochar amendment improves shoot biomass of tomato seedlings and sustains water relations and leaf gas exchange rates under different irrigation and nitrogen regimes [J/OL]. Agricultural Water Management, 2021, 245: 106580[2024-01-04]. doi: 10.1016/j.agwat.2020.106580. [18] LEHMANN J, RILLIG M C, THIES J, et al. Biochar effects on soil biota: a review [J]. Soil Biology and Biochemistry, 2011, 43(9): 1812 − 1836. [19] 王高飞, 刘鸿雁, 邢丹, 等. 育苗基质添加辣椒秆生物炭对辣椒幼苗生长与养分的影响[J]. 西南农业学报, 2022, 35(3): 543 − 549. WANG Gaofei, LIU Hongyan, XING Dan, et al. Effects of pepper straw biochar added in seedling substrate on growth and nutrient of pepper seedlings [J]. Southwest China Journal of Agricultural Sciences, 2022, 35(3): 543 − 549. [20] 刘朝霞, 牛文娟, 楚合营, 等. 秸秆热解工艺优化与生物炭理化特性分析[J]. 农业工程学报, 2018, 34(5): 196 − 203. LIU Zhaoxia, NIU Wenjuan, CHU Heying, et al. Process optimization for straws pyrolysis and analysis of biochar physiochemical properties [J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(5): 196 − 203. [21] BENGOUGH A G, MCKENZIE B M, HALLETT P D, et al. Root elongation, water stress, and mechanical impedance: a review of limiting stresses and beneficial root tip traits [J]. Journal of Experimental Botany, 2011, 62(1): 59 − 68. [22] 宋久洋, 刘领, 陈明灿, 等. 生物质炭施用对烤烟生长及光合特性的影响[J]. 河南科技大学学报(自然科学版), 2014, 35(4): 68 − 72. SONG Jiuyang, LIU Ling, CHEN Mingcan, et al. Effects of biochar addition on growth and photosynthetic characteristics of flue-cured tobacco [J]. Journal of Henan University of Science and Technology (Natural Science), 2014, 35(4): 68 − 72. [23] 成功, 康健, 张育林, 等. 生物质炭施用对烟草漂浮育苗中出苗及幼苗生长的影响[J]. 陕西农业科学, 2017, 63(3): 6 − 10. CHENG Gong, KANG Jian, ZHANG Yulin, et al. Effect of biomass charcoal application on emergence and seedling growth in tobacco floating nurseries [J]. Shaanxi Journal of Agricultural Sciences, 2017, 63(3): 6 − 10. [24] 梁晓艳, 衣葵花, 李萌, 等. 生物炭对盐碱地藜麦根系生长及生理特性的影响[J]. 山东农业科学, 2020, 52(12): 24 − 29, 38. LIANG Xiaoyan, YI Kuihua, LI Meng, et al. Effects of biochar on root growth and physiological characteristics of Quinoa in saline-alkali soil [J]. Shandong Agricultural Sciences, 2020, 52(12): 24 − 29, 38. [25] 白雪, 李小英, 李俊龙, 等. 生物炭与菌肥配施对元宝枫育苗基质性质及幼苗生长的影响[J]. 江苏农业科学, 2020, 48(9): 148 − 154. BAI Xue, LI Xiaoying, LI Junlong, et al. Effects of biochar and fungal fertilizer on the nature of the seedling substrate and seedling growth of Acer truncatum [J]. Jiangsu Agricultural Sciences, 2020, 48(9): 148 − 154. [26] 李彩斌, 符德龙, 曹廷茂, 等. 炭基复混肥配方对土壤酶和烤烟生理、养分积累及产量的影响[J]. 湖南农业科学, 2019(7): 48 − 50, 54. LI Caibin, FU Delong, CAO Tingmao, et al. Effects of carbon-based compound fertilizer formula on soil enzyme activity and characteristic of physiology, nutrient accumulation and yield of flue-cured tobacco [J]. Hunan Agricultural Sciences, 2019(7): 48 − 50, 54. [27] 王欢欢, 任天宝, 张志浩, 等. 生物质炭对烤烟旺长期根系发育及光合特性的影响[J]. 水土保持学报, 2017, 31(2): 287 − 292. WANG Huanhuan, REN Tianbao, ZHANG Zhihao, et al. Effects of biochar on root development and leaf photosynthetic characteristics of flue-cured tobacco in the vigorous growing period [J]. Journal of Soil and Water Conservation, 2017, 31(2): 287 − 292. [28] 蒋志慧, 王文慧, 张有利, 等. 生物炭用量对鲜食糯玉米产量及品质的影响[J]. 江苏农业科学, 2023, 51(14): 109 − 115. JIANG Zhihui, WANG Wenhui, ZHANG Youli, et al. Effect of biochar dosage on yield and quality of fresh glutinous maize [J]. Jiangsu Agricultural Sciences, 2023, 51(14): 109 − 115. [29] 周加顺, 郑金伟, 池忠志, 等. 施用生物质炭对作物产量和氮、磷、钾养分吸收的影响[J]. 南京农业大学学报, 2016, 39(5): 791 − 799. ZHOU Jiashun, ZHENG Jinwei, CHI Zhongzhi, et al. Effects of biochar amendment on crop yield and the uptake of nitrogen, phosphorus and potassium [J]. Journal of Nanjing Agricultural University, 2016, 39(5): 791 − 799. [30] 彭启超, 刘小华, 罗培宇, 等. 不同原料生物炭对氮、磷、钾的吸附和解吸特性[J]. 植物营养与肥料学报, 2019, 25(10): 1763 − 1772. PENG Qichao, LIU Xiaohua, LUO Peiyu, et al. Adsorption and desorption characteristics of nitrogen, phosphorus and potassium by biochars from different raw materials [J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(10): 1763 − 1772. [31] 孟康, 李小英, 李新宇, 等. 元宝枫籽壳生物质炭性质及对NH4 +-N吸附性能研究[J]. 南方农业, 2019, 13(5): 129 − 131, 138. MENG Kang, LI Xiaoying, LI Xinyu, et al. Study on the properties and NH4 +-N adsorption performance of biomass charcoal from Acer truncatum seed husk [J]. South China Agriculture, 2019, 13(5): 129 − 131, 138. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20240109






 下载:
下载: