-
硅对生物地球化学循环、生物过程以及调节全球碳平衡和缓解气候变化具有重要的意义[1]。比如,硅能减缓土壤酸化,通过硅酸盐矿物的风化封存二氧化碳[2−3],提高植物生物量[4−5],并以植硅体碳的形式长期封存有机碳[6],还可以通过缓解生物和非生物胁迫促进作物健康生长,提高作物产量[7]。
土壤中全硅质量分数为450 g·kg−1[8]。土壤硅的组分可分为难溶和易溶2个部分,前者包括原生结晶硅酸盐和次生硅酸盐等晶质硅,后者包括水溶性硅、吸附态硅和无定形二氧化硅(生物成因和成土成因)等活性硅[9]。土壤中活性硅组成通常表现出较高的异质性,并且会经历连续的相互转化(比如溶解、沉淀和吸附-解吸过程)。土壤有效硅和水溶性硅主要来源于无定形硅的转化[10],水溶性硅被植物吸收并以植硅体形式返回到土壤中[11]。外源硅改良剂能直接和间接调整水溶性硅,反之,缺少外源硅投入,长期移除作物残体可能会降低土壤水溶性硅的质量分数。有关硅肥和生物质炭对硅输入与输出影响的研究集中在植物硅吸收、转运和沉积以及土壤水溶性硅和可利用硅方面,但是,硅肥和生物质炭对土壤水溶性硅的影响机制尚不明确,尤其是外源性硅如何影响活性硅各组分对水溶性硅的贡献。生物质炭和硅肥被认为是影响土壤硅供给和可利用能力、植物硅吸收和沉积以及植硅体形成的2种外源性硅[12−13]。富含植硅体的生物质炭是低有效硅的土壤中潜在的硅来源[14],生物质炭施用可能提高土壤无定形硅库(生物硅库)和土壤pH,调节土壤活性硅组分的相互转化。硅肥可能通过输入水溶性硅,提高土壤可利用硅供应,改变土壤活性硅的组成。这意味着硅肥和生物质炭通过不同途径影响土壤活性硅的组成。
生物和非生物因素,如土壤pH、母岩类型、土壤质地、有机质和铁锰氧化物,强烈影响土壤活性硅库的质量分数。土壤pH 是驱动硅酸岩矿物溶解的重要因素[15],pH上升加速矿物≡Si—O—表面位点的去质子化[16],促进矿物硅的溶解;pH 可通过提高水的亲核特性或偏振,削弱矿物表面的Si—O—Si 键[17−18]。相比来自花岗岩和石英斑岩形成的土壤,玄武岩和火山灰形成的土壤拥有较多的有效硅[19]。土壤有效硅质量分数与土壤黏粒质量分数呈显著正相关[20],与土壤砂粒呈显著负相关[21]。土壤中水溶性硅质量分数受反应性土壤物质(有机质和铁锰氧化物)硅的吸附和解吸的影响[22−23],这主要是由于它们不同的表面积和化学组成所致[1]。以上生物和非生物因素对土壤活性硅组分的影响并不是简单的加和效应,它们之间的相互作用对土壤活性硅组分影响难以预测。生物质炭和硅肥添加可能会影响生物和非生物因素,从而影响土壤活性硅组分。
全球有毛竹Phyllostachys edulis林面积在为6 Mhm2 [24],并且以每年3%的增长速率不断扩张[25]。毛竹为喜硅型植物,毛竹林要从土壤中带走大量的硅素养分,且毛竹林土壤pH低、土壤风化和脱硅富铝化程度高,导致硅素供应不平衡问题日趋凸显[26]。毛竹林施用硅肥和生物质炭有缓解硅元素供需矛盾的现实需求。本研究通过析因试验设计研究生物质炭和硅肥添加对毛竹人工林土壤水溶性硅、生物可利用硅、有机结合态硅、铁锰氧化物结合态硅、无定形硅(生物成因和成土成因)、总硅质量分数的影响。
-
研究区位于浙江省杭州市临安区青山镇(30°19′N,119°22′E)。该地年平均气温为16.0 ℃,年平均降水量为1 420.0 mm。该地土壤类型为红壤土类黄红壤亚类。研究区毛竹林管理年限为26 a,平均胸径为9.9 cm,平均密度为2 900 株·hm−2。撒施尿素(以氮计) 200 kg·hm−2·a−1,氯化钾(以氧化钾计) 70 kg·hm−2·a−1 和过磷酸钙(以五氧化二磷计) 60 kg·hm−2·a−1,并且每年手工移除林下植被[27]。
-
遵循析因试验设计。生物质炭施用量分别为0和10 t·hm−2,代号分别为B0和B1;硅肥施用量分别为0和450 kg·hm−2,代号分别为S0和S1。本研究共设4个处理组合:S0B0、S1B0、S0B1和S1B1。每个处理3次重复,随机区组排列,每个试验小区面积为100 m2,小区和小区间有4 m 的缓冲带。试验前先将生物质炭进行干燥,再研磨过<2 mm筛。
将硅肥和生物质炭翻耕20 cm入土。试验用生物质炭原材料为竹材(浙江景宇木炭公司生产)。生物质炭热解步骤为:升温速率为10 ℃·min−1,氮气通量为3 L·min−1,恒温500 ℃维持5 h。该生物质炭的总氮、总氢、总碳和总硫质量分数分别为9.6、12.7、440.4和8.5 g·kg−1,生物可利用硅质量分数为 83.7 mg·kg−1,pH 为10.4。硅肥由Osco工业集团股份公司生产。硅肥的总碳和总硅质量分数分别为7.2和337.4 g·kg−1。
-
对每个小区多点采样。分别采集0~10和10~30 cm 土层土样,并将相同小区相同土层土样充分混合。不锈钢容重圈收集土壤容重样品。采集的土样风干,去除肉眼可见的根,并过2.00 mm 筛,用于测定土壤pH、土壤水溶性硅、生物可利用硅、有机结合态硅、铁锰氧化物结合态硅和无定形硅。再从过2.00 mm 筛土样挑根研磨后过0.15 mm 筛,用于测定土壤有机碳、土壤有机氮、土壤植硅体、土壤总硅、土壤总铝和土壤总铁。
-
生物质炭和土样的pH用利用pH 计(土水质量比为1.00∶2.50,FE20)测定;生物质炭的总氮、总氢、总碳、总硫和土壤有机碳、土壤有机氮采用元素分析仪(model CHNS-O-rapid)测定;土壤总铁采用氢氟酸-高氯酸-硝酸消解-邻菲罗啉分光光度法测定;土壤总铝采用氟化钾取代-EDTA容量法测定。土壤总硅采用偏硼酸锂熔融和稀硝酸溶解法提取[28]。土壤水溶性硅、生物可利用硅、有机结合态硅、铁锰氧化物结合态硅和无定形硅采用硅逐级提取法[29],硅钼蓝法比色测定。采用微波消解和重液浮选法从土壤中分离植硅体。所有土壤样品分析均做3次重复。
-
硅各组分的计算:wb-a=0.4wp;wp-a=wa−wb-a;wn=wa+ws+wo+wd+wb;wc=wt−wn。其中:wb-a为土壤中生物成因无定形硅的质量分数;wp为土壤中植硅体的质量分数;wp-a为土壤中成土成因无定形硅的质量分数;wa为土壤中无定形硅的质量分数;wn为土壤中活性硅(非晶质硅)的质量分数;ws为土壤中铁锰氧化物结合态硅的质量分数;wo为土壤中有机结合态硅的质量分数;wd为土壤中水溶性硅的质量分数;wb为土壤中生物可利用硅的质量分数;wc为土壤中生物晶质硅的质量分数;wt为土壤中总硅的质量分数;0.4为生物成因无定形硅和植硅体之间的转换系数[22, 30−32]。无定形硅包含生物成因无定形硅和成土成因无定形硅。一般来说,生物成因硅组分包括植物成因硅(<5 μm)、≥5 μm植硅体中的硅、动物成因硅和微生物成因硅(如细菌和真菌中的硅)。植硅体对陆地土壤生物成因无定形硅的贡献最大,因此,在本研究中,假设植硅体硅代表主要的生物成因无定形硅。
采用析因设计方差分析来测试处理效果。Duncan 新复极差法用于比较组均值之间的差异,其中“S×B”表示硅肥和生物质炭的交互作用。冗余分析和主成分分析利用Canoco 4.5 进行。所有统计分析均使用SPSS 26.0进行。结构方程模型使用AMOS 18.0 运行。
-
不论生物质炭添加与否,S1处理的表层土壤有机碳(24.38 g·kg−1)和总铝(66.69 g·kg−1)高于S0处理(有机碳为22.32 g·kg−1、总铝为63.23 g·kg−1,P<0.05,表1和表2)。生物质炭的施用显著影响0~10和10~30 cm土层土壤有机碳质量分数和土壤pH(P<0.05,表1和表2)。
表 1 硅肥和生物质炭对毛竹林土壤化学性质的方差分析
Table 1. Analysis of variance results of silicon fertilizer and biochar on soil chemical properties in P. edulis forests
土层深度/cm 处理 pH 有机碳 有机氮 总铝 总铁 0~10 硅肥(S) 0.02 6.04* 0.27 11.06* 0.25 生物质炭(B) 24.71** 56.69** 3.92 1.33 2.69 S×B 0.00 3.47 0.10 1.06 0.12 10~30 硅肥(S) 0.30 2.05 1.58 3.72 0.01 生物质炭(B) 10.14* 6.34* 1.58 0.30 0.54 S×B 0.04 0.42 0.81 0.65 3.94 说明:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 2 硅肥和生物质炭对毛竹林土壤化学性质的影响
Table 2. Effects of silicon fertilizer and biochar on soil chemical properties in P. edulis forests
土层深度/cm 处理 pH 有机碳/(g·kg−1) 有机氮/(g·kg−1) 总铝/(g·kg−1) 总铁/(g·kg−1) 0~10 S0 5.64(0.50) A 22.32(4.50) B 1.73(0.34) A 63.23(1.70) B 30.24(2.35) A S1 5.66(0.58) A 24.38(2.94) A 1.82(0.26) A 66.69(1.97) A 30.85(1.94) A B0 5.22(0.09) b 20.18(2.50) b 1.62(0.23) a 64.36(3.02) a 31.53(1.99) a B1 6.08(0.37) a 26.52(1.09) a 1.93(0.27) a 65.56(1.99) a 29.56(1.81) a 10~30 S0 5.32(0.52) A 17.93(3.20) A 1.30(0.24) A 66.54(2.35) A 29.30(3.95) A S1 5.46(0.65) A 21.40(6.46) A 1.53(0.39) A 63.71(2.45) A 29.10(2.53) A B0 4.98(0.24) b 16.62(2.22) b 1.30(0.21) a 64.73(3.33) a 29.83(3.12) a B1 5.79(0.51) a 22.72(5.65) a 1.53(0.41) a 65.52(2.21) a 28.57(3.37) a 说明:同列不同小写字母和大写字母分别表示生物质炭(基于硅肥处理的平均值)和硅肥处理(基于生物质炭处理的平均值)差异显著(P<0.05);括号中数值表示标准误。 硅肥施用显著影响了0~10和10~30 cm土层土壤活性硅库和0~10 cm土层土壤成土成因无定形硅质量分数。S1处理毛竹林地0~10和10~30 cm 土层中的活性硅(非晶质硅)质量分数分别是S0 处理的113.6%和113.3%,而成土成因无定形硅质量分数则分别为S0 处理的175.0%和107.1%。与B0处理相比,S1毛竹林地0~10和10~30 cm 土层中的活性硅(非晶质硅)质量分数分别增加了28.0%和15.5%,而成土成因无定形硅质量分数则分别增加了97.9%和23.5% (表3和表4)。
表 3 硅肥和生物质炭对土壤晶态硅和非晶态硅质量分数的方差分析
Table 3. Analysis of variance results of silicon fertilizer and biochar on soil crystalline and non-crystalline silicon in P. edulis forests
处理 0~10 cm 10~30 cm 总硅 活性硅库 晶质硅 成土成因无定形硅 总硅 活性硅库 晶质硅 成土成因无定形硅 硅肥(S) 2.52 21.20** 3.19 6.81* 0.10 5.89* 0.36 0.60 生物质炭(B) 0.77 79.19** 0.15 9.94* 2.76 7.84* 2.20 6.05* S×B 0.77 0.12 0.76 0.61 6.34* 0.33 7.67* 0.60 说明:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 4 硅肥和生物质炭对土壤晶态硅和非晶态硅质量分数的影响
Table 4. Effects of silicon fertilizer and biochar on soil crystalline and non-crystalline silicon in P. edulis forests
处理 不同土层晶态硅和非晶态硅质量分数/(g·kg−1) 0~10 cm 10~30 cm 总硅 活性硅库 晶质硅 成土成因无定形硅 总硅 活性硅库 晶质硅 成土成因无定形硅 S0 296.5(6.2) A 6.09(0.89) B 290.4(5.9) A 0.52(0.30) B 295.1(7.7) A 5.66(0.46) B 289.4(7.3) A 3.4(0.58) A S1 291.2(4.9) A 6.92(0.95) A 284.3(5.2) A 0.91(0.39) A 294.1(6.2) A 6.41(0.84) A 287.7(5.9) A 3.64(0.67) A B0 292.4(4.3) a 5.71(0.48) b 286.7(4.5) a 0.48(0.29) b 292.1(4.4) a 5.60(0.52) b 286.5(4.1) a 3.15(0.53) b B1 295.3(7.4) a 7.31(0.58) a 288.0(7.9) a 0.95(0.34) a 297.2(7.9) a 6.47(0.74) a 290.7(7.9) a 3.89(0.44) a 说明:同列不同小写字母和大写字母分别表示生物质炭(基于硅肥处理的平均值)和硅肥处理(基于生物质炭处理的平均值)差异显著(P<0.05)。 -
硅肥和生物质炭的施用及其相互作用显著影响了0~10 cm 土层中土壤水溶性硅(表5)。S0B1、S1B0和S1B1处理的0~10 cm土层中水溶性硅质量分数分别比S0B0处理提高了48.2%、96.7%和255.6%(图1A),说明硅肥和生物质炭配施存在协同作用。
表 5 硅肥和生物质炭对土壤活性硅库各组分的方差分析结果
Table 5. Analysis of variance results of silicon fertilizer and biochar on silicon fractions of soil active silicon pool in P. edulis forests
处理 0~10 cm 10~30 cm 水溶性硅 生物可
利用硅有机结
合态硅铁锰氧化物
结合态硅无定形硅 生物成因
无定形硅水溶性硅 生物可
利用硅有机结
合态硅铁锰氧化物
结合态硅无定形硅
生物成因无定形硅 硅肥(S) 44.21** 14.73** 0.44 21.79** 11.23* 1.02 52.09** 30.03** 18.01** 7.36* 4.43 3.86 生物质炭(B) 20.51** 0.49 18.16** 0.30 67.58** 20.07** 18.16** 15.81** 8.15* 1.93 7.36* 0.04 S×B 5.86* 0.36 3.34 0.22 0.37 0 5.11 0.35 0.01 0.67 0.53 0.51 说明: *表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 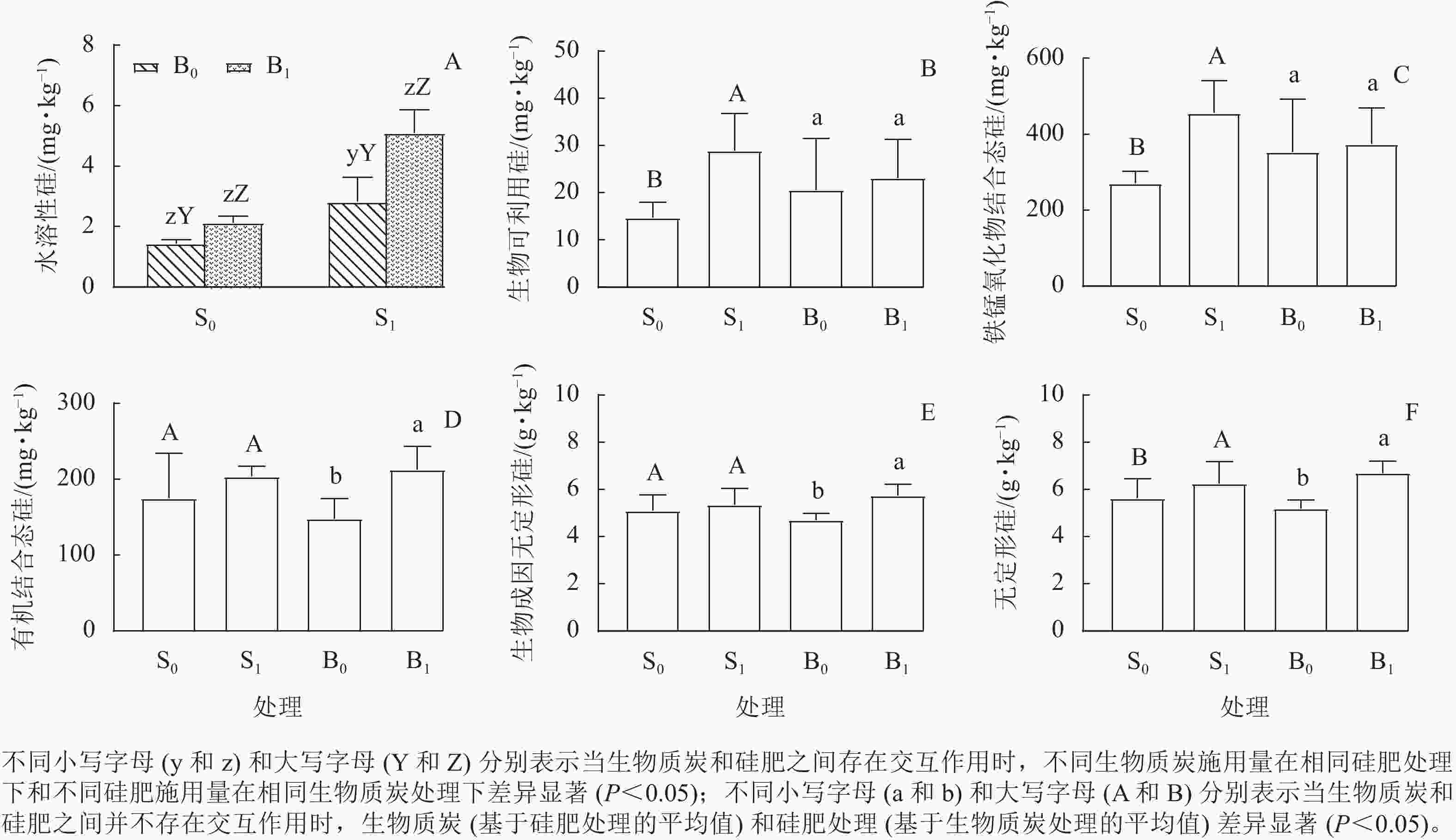
图 1 硅肥和生物质炭对毛竹林0~10 cm 土层土壤硅组分质量分数的影响
Figure 1. Effect of silicon fertilizer and biochar addition on soil silicon component in 0-10 cm soil of P. edulis forests
S1 处理的0~10 cm 土层中生物可利用硅和铁锰氧化物结合态硅质量分数分别比S0 处理提高了95.4%和68.4%(主效应)(图1B和图1C)。与B0 处理相比,在0~10 cm 土层中,B1 处理使土壤有机结合态硅和生物成因无定形硅质量分数显著增加(P<0.05)(图1D和图1E)。施用硅肥和生物质炭均可增加0~10 cm 土层的土壤无定形硅质量分数(图1F)。
硅肥和生物质炭两者施用对10~30 cm土层水溶性硅、生物可利用硅和有机结合态硅质量分数的影响仅为加和性效应(图2A、图2B和图2C)。硅肥增加了10~30 cm土层的铁锰氧化物结合态硅质量分数(图2D)。生物质炭增加了10~30 cm土层的无定形硅质量分数(图2E)。与B0 处理相比,B1 处理土壤生物成因无定形硅质量分数在10~30 cm 土层中没有增加(P>0.05,图2F)。
-
主成分中的2 个轴解释了植硅体参数中观察到的总变异的83.2%。因子1 解释了57.97%的变异。0~10和10~30 cm土层土壤中同一处理的土壤活性硅组分趋向于聚集。将土壤活性硅组分分为2 组,硅肥和生物质炭添加能改变土壤活性硅的组成(图3A)。冗余分析表明:土壤有机碳(F=7.1,P=0.002)的质量分数与土壤活性硅组分存在显著正相关(图3B)。
-
生物质炭的添加通过影响0~10 cm土层土壤生物成因无定形硅和成土成因无定形硅质量分数,进而影响活性硅组分,最终影响表层土壤水溶性硅。0~10 cm土层土壤水溶性硅主要由成土成因无定形硅驱动,其次是生物成因无定形硅(图4A)。

图 4 生物质炭和硅肥施用对土壤水溶性硅的直接和间接影响
Figure 4. The direct and indirect effects of silicon fertilizer and biochar addition on the soil dissolved silicon in the 0−10 and 10−30 cm soil layers of P. edulis forests
生物质炭的添加通过影响10~30 cm土层土壤pH,进而影响成土成因无定形硅和活性硅组分,最终影响亚层土壤水溶性硅。亚层土壤水溶性硅主要由土壤活性硅组分驱动,其次是成土成因无定形硅和pH(图4B)。
硅肥的施用增加了0~10 cm层土壤活性硅组分和活性硅库(图4C)。0~10 cm层土壤水溶性硅主要由硅肥驱动,其次是活性硅库(图4C)。而硅肥的施用增加了10~30 cm层土壤活性硅组分,进而增加了活性硅库(图4D)。10~30 cm层土壤水溶性硅主要由硅肥驱动,其次是活性硅组分(图4D)。
-
以往研究更多关注硅肥和生物质炭施用对植物硅吸收和土壤有效硅供应的影响效应,对土壤硅库转化及其与水溶性硅的关系尚未被量化。本研究发现:硅肥的施用提高了0~10和10~30 cm土层土壤水溶性硅、生物可利用性硅、铁锰氧化结合态硅,并提高了0~10 cm土层土壤成土成因无定形硅,说明硅肥的施用不仅仅提高了土壤的水溶性硅,并促进了土壤硅不同形态的转化。相似的结果在对水稻Oryza sativa、苜蓿Medicago sativa的研究中均有报道。水稻土壤中施硅肥可使土壤水溶性硅提高31%[33];高产苜蓿品种施用硅肥可使土壤有效硅提高38%,同时也能使高抗品种土壤有效硅提高34%[34],说明施用硅肥可提高土壤硅的可利用性,但提高幅度因植物种类不同存在差别。对于长期种植水稻但不施用硅肥的土壤,其无定形硅库随种植年限的增加而减少,表明无定形硅(生物成因)转化为生物可利用硅和水溶性硅被作物吸收利用。本研究表明:硅肥施用存在反向过程,即水溶性硅会被土壤氧化物吸附以及以成土成因无定形硅形式保存在土壤中。另外,硅肥施用介导活性硅组分的转换,提高活性硅库,进而提高土壤水溶性硅。说明硅肥施用提高水溶性硅的关键是通过维持活性硅库各组分的动态平衡,并提高活性硅总库容量来实现的。
生物质炭施入提高了0~10 和10~30 cm土层土壤水溶性硅、有机结合态硅、成土成因无定形硅,以及0~10 cm土层生物成因无定型硅。与硅肥施用相比,生物质炭改变土壤活性硅库,提高土壤有机结合态硅和生物成因无定形硅,依赖于生物质炭硅形态以生物成因无定形硅形式输入,并提高土壤有机碳,从而为以有机物质吸附硅提供可能。生物质炭的添加可以显著提高水稻、黑麦草Lolium perenne、棉花Gossypium hirsutum等作物土壤的可利用硅[35−37]。也有研究表明:施用秸秆生物质炭可以增加土壤有效硅,但无硅生物质炭对土壤中的有效硅几乎没有影响[38],意味着生物质炭改变土壤硅库需要考虑生物质炭本身硅的数量和形态。
不同土层生物质炭对土壤水溶性硅的影响过程存在不同。0~10 cm土层生物质炭通过3条路径来提高水溶性硅:提高生物成因无定形硅(标准化路径系数为0.35);改变活性硅组分转化,包括直接影响(标准化路径系数为−0.58)和介导成土成因无定形硅(标准化路径系数为0.57),从而影响水溶性硅。涉及可能机制:①生物质炭投入会为土壤带入植硅体,植硅体溶解提高了土壤水溶性;②生物质炭本身疏松多孔和较大比表面积会与土壤氧化物影响硅的吸附;③生物质炭的有些纳米颗粒成分可能沉淀为成土成因无定形硅。10~30 cm土层生物质炭主要通过提高土壤pH,改变成土成因无定型硅和活性硅库各组分硅的动态平衡来提高水溶性硅[39−41]。
本研究还表明:硅肥和生物质炭对0~10 cm土层水溶性硅存在协同效应,正如前面提到硅肥和生物质炭提高水溶性硅实现路径的不同,硅肥和生物质炭耦合会使部分硅组分吸附和沉积达到饱和。进一步冗余分析结果表明:土壤有机碳对活性硅库有很好的指示作用,土壤有机碳很可能作为限制因子决定活性硅库吸附过程最大容量。
-
硅肥和生物质炭施用均能改变毛竹林土壤硅组分在不同土层的分布,同时也促进土壤活性硅的积累。除0~10 cm土层土壤水溶性硅外,硅肥和生物质炭施用对各层土壤硅组分的影响均为加和性正效应。硅肥添加提高土壤水溶性硅积累的关键是自身投入大量可溶性硅,影响土壤硅组分转化,提高土壤活性硅供给能力。生物质炭添加提高0~10 cm土层土壤水溶性硅积累的关键在于提高了土壤生物成因和成土成因的无定形硅;对于10~30 cm土层土壤水溶性硅的影响主要由于生物质炭提高土壤pH,促进成土成因无定形硅的积累,改变了土壤活性硅组分分布。
Effects of silicon fertilizer and biochar on active silicon components in Phyllostachys edulis forest soil
-
摘要:
目的 探究施用硅肥和生物质炭对毛竹Phyllostachys edulis人工林土壤水溶性硅、生物可利用硅、有机结合态硅、铁锰氧化物结合态硅、无定形硅(生物成因和成土成因)、总硅质量分数的影响;分析土壤水溶性硅与土壤活性硅组分和土壤特性之间的关系。 方法 遵循析因试验设计,共4个处理,分别为对照(S0B0)、施用硅肥450 kg·hm−2 (S1B0)、施用生物质炭10 t·hm−2 (S0B1)、硅肥和生物质炭配施(S1B1)。 结果 硅肥提高毛竹林土壤中生物可利用硅和铁锰氧化物结合态硅。生物质炭增加无定形硅库(主效应)。硅肥和生物质炭配施提高了土壤水溶性硅。硅肥、生物质炭添加和土层深度均改变土壤活性硅组成,促进它们之间的相互转化。土壤有机碳质量分数与土壤活性硅组分存在极显著正相关(P=0.002)。此外,硅肥添加可直接和间接提高土壤水溶性硅,介导土壤硅组分之间转化,并提高土壤活性硅库容。生物质炭添加提高土壤水溶性硅积累,一方面增加植物源硅,另一方面提高土壤pH,提高成土成因无定形硅质量分数,调控土壤硅在各组分分布。 结论 施用硅肥和生物质炭促进了毛竹人工林土壤活性硅的积累,并改变了其相互转化,但其转化路径存在不同。图4表5参41 Abstract:Objective This study aims to investigate the impact of applying silicon fertilizer and biochar on water-soluble silicon, bioavailable silicon, organically bound silicon, iron-manganese oxide bound silicon, amorphous silicon (biogenic and pedogenic), and total silicon mass fraction in Phyllostachys edulis forest soil, and analyze the relationship between soil water-soluble silicon, soil active silicon components and soil characteristics. Method Based on the factorial design, 4 treatments were used, including control (S0B0), application of silicon fertilizer at 450 kg·hm−2 (S1B0), application of biochar at 10 t·hm−2 (S0B1), and combination of silicon fertilizer and biochar (S1B1). Result Silicon fertilizer increased bioavailable silicon and iron-manganese oxide bound silicon. The addition of biochar increased the amorphous silicon reservoir (main effect). The combined application of silicon fertilizer and biochar increased the water-soluble silicon in soil. The addition of silicon fertilizer, biochar, and soil depth all changed the composition of soil active silicon and promoted their mutual transformation. There was a highly significant positive correlation between soil organic carbon mass fraction and soil active silicon component (P=0.002). In addition, the addition of silicon fertilizer could directly and indirectly improve soil water-soluble silicon, mediate the conversion of soil silicon components, and improve the solubility of soil active silicon pools. The addition of biochar improved the accumulation of water-soluble silicon in soil. On the one hand, it increased botanical silicon. On the other hand, it increased soil pH and the mass fraction of amorphous silicon in soil formation, and regulated the distribution of soil silicon in each component. Conclusion The application of silicon fertilizer and biochar promotes the accumulation of active silicon in soil and changes their mutual conversion in P. edulis forest, but the transformation pathways are different. [Ch, 4 fig. 5 tab. 41 ref.] -
Key words:
- silicon fertilizer /
- biochar /
- Phyllostachys edulis /
- soil silicon component
-
表 1 硅肥和生物质炭对毛竹林土壤化学性质的方差分析
Table 1. Analysis of variance results of silicon fertilizer and biochar on soil chemical properties in P. edulis forests
土层深度/cm 处理 pH 有机碳 有机氮 总铝 总铁 0~10 硅肥(S) 0.02 6.04* 0.27 11.06* 0.25 生物质炭(B) 24.71** 56.69** 3.92 1.33 2.69 S×B 0.00 3.47 0.10 1.06 0.12 10~30 硅肥(S) 0.30 2.05 1.58 3.72 0.01 生物质炭(B) 10.14* 6.34* 1.58 0.30 0.54 S×B 0.04 0.42 0.81 0.65 3.94 说明:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 2 硅肥和生物质炭对毛竹林土壤化学性质的影响
Table 2. Effects of silicon fertilizer and biochar on soil chemical properties in P. edulis forests
土层深度/cm 处理 pH 有机碳/(g·kg−1) 有机氮/(g·kg−1) 总铝/(g·kg−1) 总铁/(g·kg−1) 0~10 S0 5.64(0.50) A 22.32(4.50) B 1.73(0.34) A 63.23(1.70) B 30.24(2.35) A S1 5.66(0.58) A 24.38(2.94) A 1.82(0.26) A 66.69(1.97) A 30.85(1.94) A B0 5.22(0.09) b 20.18(2.50) b 1.62(0.23) a 64.36(3.02) a 31.53(1.99) a B1 6.08(0.37) a 26.52(1.09) a 1.93(0.27) a 65.56(1.99) a 29.56(1.81) a 10~30 S0 5.32(0.52) A 17.93(3.20) A 1.30(0.24) A 66.54(2.35) A 29.30(3.95) A S1 5.46(0.65) A 21.40(6.46) A 1.53(0.39) A 63.71(2.45) A 29.10(2.53) A B0 4.98(0.24) b 16.62(2.22) b 1.30(0.21) a 64.73(3.33) a 29.83(3.12) a B1 5.79(0.51) a 22.72(5.65) a 1.53(0.41) a 65.52(2.21) a 28.57(3.37) a 说明:同列不同小写字母和大写字母分别表示生物质炭(基于硅肥处理的平均值)和硅肥处理(基于生物质炭处理的平均值)差异显著(P<0.05);括号中数值表示标准误。 表 3 硅肥和生物质炭对土壤晶态硅和非晶态硅质量分数的方差分析
Table 3. Analysis of variance results of silicon fertilizer and biochar on soil crystalline and non-crystalline silicon in P. edulis forests
处理 0~10 cm 10~30 cm 总硅 活性硅库 晶质硅 成土成因无定形硅 总硅 活性硅库 晶质硅 成土成因无定形硅 硅肥(S) 2.52 21.20** 3.19 6.81* 0.10 5.89* 0.36 0.60 生物质炭(B) 0.77 79.19** 0.15 9.94* 2.76 7.84* 2.20 6.05* S×B 0.77 0.12 0.76 0.61 6.34* 0.33 7.67* 0.60 说明:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 4 硅肥和生物质炭对土壤晶态硅和非晶态硅质量分数的影响
Table 4. Effects of silicon fertilizer and biochar on soil crystalline and non-crystalline silicon in P. edulis forests
处理 不同土层晶态硅和非晶态硅质量分数/(g·kg−1) 0~10 cm 10~30 cm 总硅 活性硅库 晶质硅 成土成因无定形硅 总硅 活性硅库 晶质硅 成土成因无定形硅 S0 296.5(6.2) A 6.09(0.89) B 290.4(5.9) A 0.52(0.30) B 295.1(7.7) A 5.66(0.46) B 289.4(7.3) A 3.4(0.58) A S1 291.2(4.9) A 6.92(0.95) A 284.3(5.2) A 0.91(0.39) A 294.1(6.2) A 6.41(0.84) A 287.7(5.9) A 3.64(0.67) A B0 292.4(4.3) a 5.71(0.48) b 286.7(4.5) a 0.48(0.29) b 292.1(4.4) a 5.60(0.52) b 286.5(4.1) a 3.15(0.53) b B1 295.3(7.4) a 7.31(0.58) a 288.0(7.9) a 0.95(0.34) a 297.2(7.9) a 6.47(0.74) a 290.7(7.9) a 3.89(0.44) a 说明:同列不同小写字母和大写字母分别表示生物质炭(基于硅肥处理的平均值)和硅肥处理(基于生物质炭处理的平均值)差异显著(P<0.05)。 表 5 硅肥和生物质炭对土壤活性硅库各组分的方差分析结果
Table 5. Analysis of variance results of silicon fertilizer and biochar on silicon fractions of soil active silicon pool in P. edulis forests
处理 0~10 cm 10~30 cm 水溶性硅 生物可
利用硅有机结
合态硅铁锰氧化物
结合态硅无定形硅 生物成因
无定形硅水溶性硅 生物可
利用硅有机结
合态硅铁锰氧化物
结合态硅无定形硅
生物成因无定形硅 硅肥(S) 44.21** 14.73** 0.44 21.79** 11.23* 1.02 52.09** 30.03** 18.01** 7.36* 4.43 3.86 生物质炭(B) 20.51** 0.49 18.16** 0.30 67.58** 20.07** 18.16** 15.81** 8.15* 1.93 7.36* 0.04 S×B 5.86* 0.36 3.34 0.22 0.37 0 5.11 0.35 0.01 0.67 0.53 0.51 说明: *表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 -
[1] SONG Zhaoliang, LIU Congqiang, MÜLLER K, et al. Silicon regulation of soil organic carbon stabilization and its potential to mitigate climate change [J]. Earth-Science Reviews, 2018, 185: 463 − 475. [2] CONLEY D J, LIKENS G E, BUSO D C, et al. Deforestation causes increased dissolved silicate losses in the Hubbard Brook Experimental Forest [J]. Global Change Biology, 2018, 14(11): 2548 − 2554. [3] SOMMER M, KACZOREK D, KUZYAKOV Y, et al. Silicon pools and fluxes in soils and landscapes: a review [J]. Journal of Plant Nutrition and Soil Science, 2006, 169(3): 310 − 329. [4] SONG Zhaoliang, WANG Hailong, STRONG P J, et al. Increase of available soil silicon by Si-rich manure for sustainable rice production [J]. Agronomy for Sustainable Development, 2014, 34(4): 813 − 819. [5] WANG Liying, ASHRAF U, CHANG Chunrong, et al. Effects of silicon and phosphatic fertilization on rice yield and soil fertility [J]. Journal of Soil Science and Plant Nutrition, 2019, 20(2): 557 − 565. [6] HUANG Chengpeng, LI Yongchun, JIN Lin, et al. Effects of long-term planting on PhytOC storage and its distribution in soil physical fractions in moso bamboo forests in subtropical China [J]. Journal of Soils and Sediments, 2020, 20: 2317 − 2329. [7] NAWAZ M A, ZAKHARENKO A M, ZEMCHENKO I V, et al. Phytolith formation in plants: from soil to cell [J/OL]. Plants, 2019, 8(8): 249[2023-05-13]. doi: 10.3390/plants8080249. [8] HÖHN A, SOMMER M, KACZOREK D, et al. Silicon fractions in Histosols and Gleysols of a temperate grassland site [J]. Journal of Plant Nutrition and Soil Science, 2008, 171(3): 409 − 418. [9] DERRY A, KURTZ C, ZIEGLER K, et al. Biological control of terrestrial silica cycling and export fluxes to watersheds [J]. Nature, 2005, 433(7027): 728 − 731. [10] 蔡彦彬, 宋照亮, 姜培坤. 岩性对毛竹林土壤硅形态的影响[J]. 浙江农林大学学报, 2013, 30(6): 799 − 804. CAI Yanbin, SONG Zhaoliang, JIANG Peikun. Silicon fractions in Phyllostachys edulis soils derived from different parent materials [J]. Journal of Zhejiang A&F University, 2013, 30(6): 799 − 804. [11] 李蓓蕾, 宋照亮, 姜培坤, 等. 毛竹林生态系统植硅体的分布及其影响因素[J]. 浙江农林大学学报, 2014, 31(4): 547 − 553. LI Beilei, SONG Zhaoliang, JIANG Peikun, et al. Phytolith distribution and carbon sequestration in China with Phyllostachys edulis [J]. Journal of Zhejiang A&F University, 2014, 31(4): 547 − 553. [12] HOUBEN D, SONNET P, CORNELIS J T. Biochar from Miscanthus: a potential silicon fertilizer [J]. Plant and Soil, 2014, 374(1/2): 871 − 882. [13] SUN Xing, LIU Qing, TANG Tong, et al. Silicon fertilizer application promotes phytolith accumulation in rice plants [J]. Frontiers in Plant Science, 2019, 10: 1 − 7. [14] LI Zimin, DELVAUX B. Phytolith-rich biochar: a potential Si fertilizer in desilicated soils [J]. GCB Bioenergy, 2019, 11(11): 1264 − 1282. [15] FRAYSSE F, CANTAIS F, POKROVSKY O S, et al. Aqueous reactivity of phytoliths and plant litter: physico-chemical constraints on terrestrial biogeochemical cycle of silicon [J]. Journal of Geochemical Exploration, 2006, 88(1/3): 202 − 205. [16] BRADY P V, WALTHER J V. Kinetics of quartz dissolution at low temperatures [J]. Chemical Geology, 1990, 82: 253 − 264. [17] HAYNES R J. A contemporary overview of silicon availability in agricultural soils [J]. Journal of Plant Nutrition and Soil Science, 2014, 177(6): 831 − 844. [18] MINH N N, DULTZ S, GUGGENBERGER G. Effects of pretreatment and solution chemistry on solubility of rice-straw phytoliths [J]. Journal of Plant Nutrition and Soil Science, 2014, 177(3): 349 − 359. [19] LIANG Yongchao, NIKOLIC M, BÉLANGER R, et al. Silicon in Agriculture: From Theory to Practice[M]. Dordrecht: Springer Dordrecht, 2015: 45−68. [20] CORNELIS J T, DELVAUX B. Soil processes drive the biological silicon feedback loop [J]. Functional Ecology, 2016, 30(8): 1298 − 1310. [21] QUIGLEY K M, DONATI G L, ANDERSON T M. Variation in the soil 'silicon landscape' explains plant silica accumulation across environmental gradients in Serengeti [J]. Plant and Soil, 2017, 410(1/2): 217 − 229. [22] YANG Xiaomin, SONG Zhaoliang, van ZWIETEN L, et al. Spatial distribution of plant-available silicon and its controlling factors in paddy fields of China [J/OL]. Geoderma, 2021, 401: 115215[2023-05-13]. doi: 10.1016/j.geoderma.2021.115215. [23] YANG Xiaomin, SONG Zhaoliang, YU Changxun, et al. Quantification of different silicon fractions in broadleaf and conifer forests of northern China and consequent implications for biogeochemical Si cycling [J/OL]. Geoderma, 2020, 361: 114036[2023-05-13]. doi: 10.1016/j.geoderma.2019.114036. [24] LI Yongfu, ZHANG Jiaojiao, CHANG S X, et al. Long-term intensive management effects on soil organic carbon pools and chemical composition in moso bamboo (Phyllostachys pubescens) forests in subtropical China [J]. Forest Ecology and Management, 2013, 303: 121 − 130. [25] ZHOU Guomo, MENG Cifu, JIANG Peikun, et al. Review of carbon fixation in bamboo forests in China [J]. The Botanical Review, 2011, 77(3): 262 − 270. [26] 赵送来, 宋照亮, 姜培坤, 等. 西天目集约经营雷竹林土壤硅存在形态与植物有效性研究[J]. 土壤学报, 2012, 49(2): 331 − 338. ZHAO Songlai, SONG Zhaoliang, JIANG Peikun, et al. Fractions of silicon in soils of intensively managed Phyllostachys pracecox stands and their plant-availability [J]. Acta Pedologica Sinica, 2012, 49(2): 331 − 338. [27] HUANG Chengpeng, WANG Li, GONG Xiaoqiang, et al. Silicon fertilizer and biochar effects on plant and soil PhytOC concentration and soil PhytOC stability and fractionation in subtropical bamboo plantations [J/OL]. Science of the Total Environment, 2020, 715: 136846[2023-05-13]. doi: 10.1016/j.scitotenv.2020.136846. [28] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 107 − 240. LU Rukun. Analytical Methods of Soil and Agricultural Chemistry[M]. Beijing: China Agricultural Science and Technology Press, 1999: 107 − 240. [29] GEORGIADIS A, SAUER D, HERRMANN L, et al. Development of a method for sequential Si extraction from soils [J]. Geoderma, 2013, 209/210: 251 − 261. [30] ALBERT R M, BAMFORD M K, CABANES D. Taphonomy of phytoliths and macroplants in different soils from Olduvai Gorge (Tanzania) and the application to Plio-Pleistocene palaeoanthropological samples [J]. Quaternary International, 2006, 148(1): 78 − 94. [31] SONG Zhaoliang, LIU Hongyan, LI Beilei, et al. The production of phytolith-occluded carbon in China’ s forests: implications to biogeochemical carbon sequestration [J]. Global Change Biology, 2013, 19(9): 2907 − 2915. [32] SONG Zhaoliang, LIU Hongyan, STRÖMBERG C A, et al. Phytolith carbon sequestration in global terrestrial biomes [J]. Science of the Total Environment, 2017, 603/604: 502 − 509. [33] 宁东峰, 刘战东, 肖俊夫, 等. 水稻土施用钢渣硅钙肥对土壤硅素形态和水稻生长的影响[J]. 灌溉排水学报, 2016, 35(8): 42 − 46. NING Dongfeng, LIU Zhandong, XIAO Junfu, et al. Effects of application of steel slag-based silicon fertilizer on chemical forms of soil silicon and rice growth [J]. Journal of Irrigation and Drainage, 2016, 35(8): 42 − 46. [34] 李沐霖, 卢树昌. 施硅对2个品种苜蓿生长及硅吸收利用影响研究[J]. 天津农业科学, 2022, 28(增刊1): 7 − 10. LI Mulin, LU Shuchang. Study on the effects of two alfalfa varieties growth and silicon uptake under silicon application [J]. Tianjin Agricultural Sciences, 2022, 28(suppl 1): 7 − 10. [35] WANG Yaofeng, XIAO Xin, ZHANG Kun, et al. Effects of biochar amendment on the soil silicon cycle in a soil-rice ecosystem [J]. Environmental Pollution, 2019, 248: 823 − 833. [36] WANG Meng, WANG J J, WANG Xudong. Effect of KOH-enhanced biochar on increasing soil plant-available silicon [J]. Geoderma, 2018, 321: 22 − 31. [37] LI Zimin, DELVAUX B, YANS J, et al. Phytolith-rich biochar increases cotton biomass and silicon-mineralomass in a highly weathered soil [J]. Journal of Plant Nutrition and Soil Science, 2018, 181(4): 537 − 546. [38] 费颖恒, 邓海燕, 李敏烯, 等. 富硅生物炭对重金属污染土壤的改良修复作用[J]. 环境科学与技术, 2021, 44(12): 177 − 184. FEI Yingheng, DENG Haiyan, LI Minxi, et al. Modification and remediation of heavy metals contaminated soil by silicon-rich biochar [J]. Environmental Science &Technology, 2021, 44(12): 177 − 184. [39] WIJAYA K A. Effects of Si-fertilizer application through the leaves on yield and sugar content of sugarcane grown in soil containing abundant N [J]. Agriculture and Agricultural Science Procedia, 2016, 9: 158 − 162. [40] CUONG T X, ULLAH H, DATTA A, et al. Effects of silicon-based fertilizer on growth, yield and nutrient uptake of rice in tropical zone of Vietnam [J]. Rice Science, 2017, 24(5): 283 − 290. [41] ZAHOOR, SUN Dan, LI Ying, et al. Biomass saccharification is largely enhanced by altering wall polymer features and reducing silicon accumulation in rice cultivars harvested from nitrogen fertilizer supply [J]. Bioresource Technology, 2017, 243: 957 − 965. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230366






 下载:
下载:




