-
繁育系统指所有影响后代遗传组成有性特征的总和[1],主要包括花部形态特征、花各部位的寿命、花的开放式样、传粉者种类和访问频率、自交亲和程度和交配系统。植物的上述有性特征与传粉者以及传粉行为共同影响繁殖后代遗传组成和适应性。因此,繁育系统是影响植物居群遗传多样性及地理分布最关键的生物学性状之一[2],繁育系统研究在花的适应性、物种形成机制和濒危植物保育方面具有重要价值[3]。玉铃花Styrax obassia属于安息香科Styracaceae安息香属Styrax落叶小乔木或灌木,花朵清香,树姿优美,果实、木材和虫瘿均具有重要的经济价值,是非常珍贵具有潜力的园林绿化观赏与经济树种。玉铃花在中国的分布区北至辽宁东南部,向南可见于河南、山东、安徽和浙江等地[4],多处于野生状态,尚未开展有效人工扩繁并合理利用。受人类活动干扰、自然生境破坏和传粉者行为影响,加之种子萌发困难等原因,玉铃花野生植株稀少,种群零星分布[5],天然更新过程受阻。对安息香科另一物种黄梅秤锤树Sinojackia huangmeiensis有性繁殖的研究发现:其繁育类型以异交为主,部分自交亲和且需要传粉者;单株较大的开花量可维持居群的自然更新,部分自交亲和也为其提供一定生殖保障[6]。玉铃花繁育系统与黄梅秤锤树可能存在一定共性,推测植株数量可能受到所分布群落结构的影响,繁育系统和访花者的行为受气候条件影响。目前,有关玉铃花的研究集中于育苗技术和组织培养[7]、种子休眠破解[8-9]、遗传多样性AFLP分析[10]和药用价值[11]等方面,尚无繁育系统的观察研究报道。本研究通过定点观察(测)玉铃花引种植株,从花部结构、开花动态和繁育系统角度,揭示其生物学特性,探讨其天然更新困难可能存在的障碍,以期为玉铃花杂交育种、生境保护提供理论依据,同时为城市园林绿化应用推广提供技术支持。
-
试验于2021年3—6月进行。试验材料为引种至浙江农林大学东湖校区(30°15′54″N,119°43′19″E,海拔101.3 m)露地栽培的处于半自然状态的玉铃花。栽植地为平坦沟谷,亚热带季风气候,全年平均气温为17.8 ℃,年均降水量为1 613.9 mm,无霜期为237 d,年日照时数为1 765.6 h。地带性植被为亚热带常绿阔叶林。
-
选定5株样株,每日观察开花进程并拍照记录。按照DAFNI [12]的标准,确定始花期、盛花期和末花期。盛花期随机选择尚待开放的花序30个,挂牌标记,测量记录花序长度(mm)和花蕾数(个),每日观察花序发育情况,直至花瓣脱落,确定单花序和单花开放时间;随机选取单花30朵,挂牌标记后定点观察,用游标卡尺测定花冠直径(mm)、花柱长度(mm)、花丝长度(mm)等指标。在Stemi 508体式显微镜下,对花朵进行实体解剖,观察子房和胚珠等构造。
-
以玉铃花单花开放前1 d为检测起点,收集开放前1 d、开放第1、2、3、4和5天的不同个体混合花粉。选用2,3,5-氯化三苯基四氮唑(TTC)染色法[12]评定花粉活力,选用联苯胺-过氧化氢法[13]检测柱头可授性。
-
随机采集花药尚未开裂的花蕾,剥离雌蕊与雄蕊。在体式显微镜下用解剖针轻轻划开子房,统计单花胚珠数(个);采集对应单花的全部花药,用光学显微镜统计花粉粒数量(个)。重复3次,取平均值。平均单花花粉粒总数=平均花粉粒数量×1000;P/O=平均单花花粉粒总数/平均胚珠数。依据CRUDEN [14]标准,确定玉铃花繁育系统类型。
-
随机选取30朵花,测定单花直径(mm)、雌雄蕊空间高度差(mm)及雌雄蕊成熟时间间隔。依据DAFNI标准[12],确定OCI 值,评判玉铃花的繁育系统类型。
-
盛花期,晴朗天气下连续1周每天观察样树的昆虫访花情况,拍照记录各种访花昆虫种类、访花行为、访问时间、单花停留时间、单次连续访花朵数等。
-
借助Excel 2019处理原始数据,计算平均值与标准误;利用Origin 2019制图。使用佳能M6观察拍摄玉铃花开花植株和花部结构照片。
-
玉铃花为腋生或顶生总状花序,花序长(13.29±0.66) cm,含(25.3±1.8)朵花;生长初期花序梗和花序轴密被短绒毛,但随着其生长,下部毛渐渐退化,直至无毛;花梗长(5.61±0.20) mm,稍向下弯;花萼杯状,长(5.68±0.12) mm,宽(4.28±0.05) mm,上端有5~6个三角形萼齿;花梗至花萼筒均密被灰黄色星状短绒毛;花冠直径为(17.37±0.50) mm,花瓣白色,4~6瓣,常见5,椭圆形,长(16.51±0.19) mm,宽(6.47±0.13) mm,花蕾期花瓣呈覆瓦状排列;雄蕊7~11,常见9,基部贴生于花冠,花丝扁平,上下几乎等宽,长(10.17±0.15) mm,花药2室,以其背部贴生花丝,椭圆型,花药长(4.01±0.10) mm,宽(0.97±0.02) mm;花柱与略膨大子房连接,子房3室,半下位或下位,胚珠(12.8±0.7)枚(表1)。
表 1 玉铃花花部器官数量特征统计
Table 1. Statistics on the quantitative characteristics of floral organs of Styrax obassia
参数 花瓣长度/mm 花瓣宽度/mm 花冠直径/mm 花药长度/mm 花药宽度/mm 花丝长度/mm 花柱长度/mm 测定值 16.51±0.19 6.47±0.13 17.37±0.50 4.01±0.10 0.97±0.02 10.17±0.15 17.24±0.22 参数 雄蕊数量/个 子房长度/mm 子房宽度/mm 花筒长度/mm 花柄长度/mm 雄蕊雌蕊高度差/mm 测定值 9.2±0.2 2.79±0.04 1.96±0.05 5.68±0.12 5.61±0.20 2.50±0.16 -
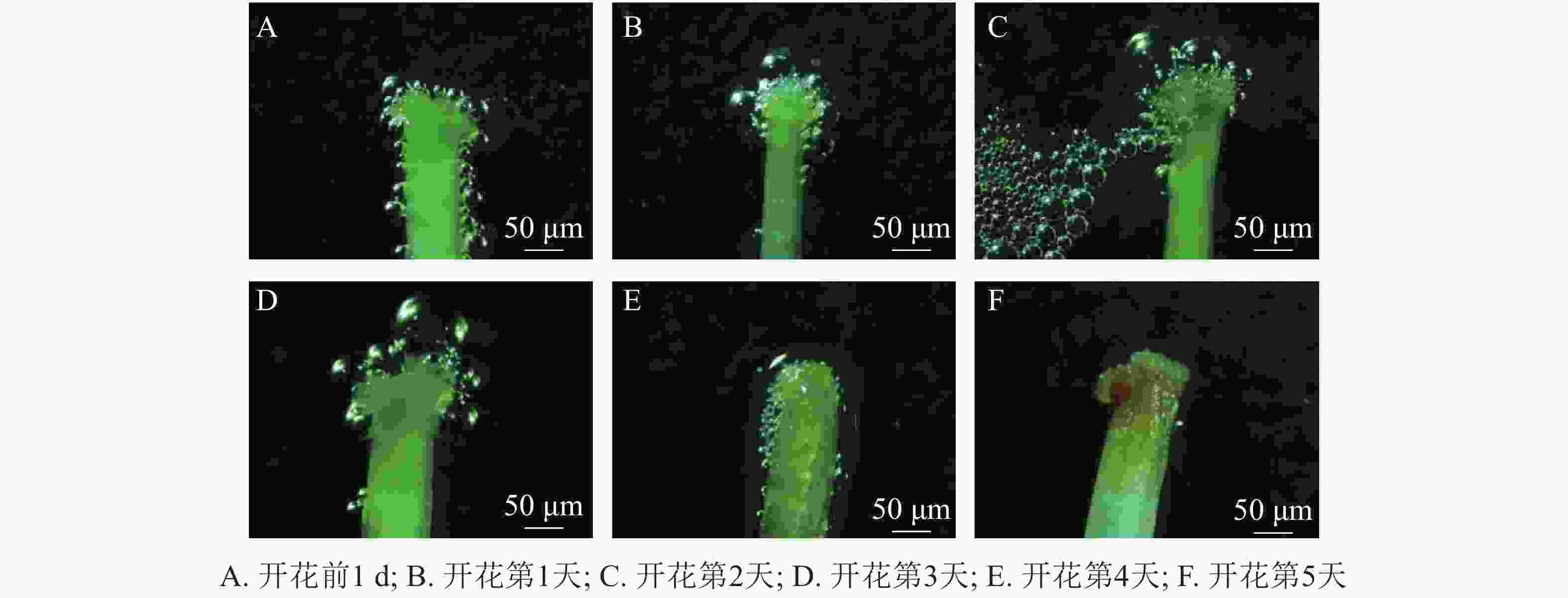
玉铃花花芽膨大期始于3月15—20日,花芽叶芽同期,显蕾期为3月21日—4月15日,花序逐渐伸长,花蕾逐渐膨大(图1A~F),始花期为4月15-18日,盛花期为4月19—26日,末花期为4月27日—5月2日,花冠凋落,随后成功授粉的子房逐渐膨大,雌蕊干枯败落进入幼果期(图1J~L)。花期持续约15 d,单花花期3~5 d。
玉铃花开花过程大致分为5个时期(图1M)。①包裹期:花萼包裹着花蕾,上端分5个小型三角形萼裂齿;②退化期:花蕾逐渐膨大,花瓣慢慢伸长,花萼退化成杯状托住花冠,此时雄蕊藏于花冠中;③微绽期:花瓣微微绽开,可见黄色的花药和嫩绿色柱头,花粉囊微纵裂,少量花粉散出;④展开期:花瓣张开角度加大,花药柱头全部露出,柱头高于雄蕊,花粉囊开裂变大,散出花粉增多;⑤完全展开期:花瓣完全展开,花粉囊纵列增大,散出花粉量逐渐变少到散尽,花药颜色变淡。
玉铃花花序开花的顺序由内至外(图1G~I),整个开花过程受天气和温度影响较大,晴天和气温较高时,花瓣展开速度和散粉速度快,整个开花持续时间较短;阴天、雨天或气温稍低,花瓣开放速度趋慢,开花持续时间较长。
-
统计花粉粒染色率发现:开花前1 d,玉铃花花粉活力达74.00%,开花第1天降至50.80%,第2天更低,仅为37.60%,随后持续降低,直到花瓣脱落,花粉殆尽,花粉活力为0。用联苯胺-过氧化氢法检测柱头可授性,结合图2可知:开花前1 d,柱头部分具有可授性,此后可授性呈增强趋势,至开花第2天,达到最强,随后逐渐下降,开花第5天,柱头已无可授性。
-
对花蕾中花药花粉粒和子房胚珠的统计可知:玉铃花单花花粉量为(8 080.0±739.8)粒,胚珠数量为(12.8±0.7)粒,P/O为(646.30±64.35)。依据CRUDEN的标准,玉铃花有性繁育系统为兼性异交。
-
玉铃花成熟花朵直径为(17.37±0.49) mm,>6 mm,OCI记为3;花朵开放前1 d花粉粒活性最强,柱头部分可授,花药开裂时间和柱头可授性具有高度同步性,OCI记为0;所观察的30朵成熟花的柱头位置均高于雄蕊花药,雄蕊花药与柱头间空间分离明显,雄蕊雌蕊高度差为(2.50±0.16) mm,OCI记为1。由此判定玉铃花开放花朵OCI值为4,其有性繁育系统为异交且部分自交亲和,需要传粉者,属于兼性异交,估算结果与P/O一致。
-
盛花期观察到的访花昆虫主要有蜜蜂科Apidae的中华蜜蜂Apis cerana、蚁科Formicidae的日本弓背蚁Camponotus japonicus、蝽科Pentatomidae的稻棘缘蝽Cletus punctiger和花蓟马Frankliniella intonsa等。其中,日本弓背蚁、中华蜜蜂出现频率最高,稻棘缘蝽除了盛花期第1天出现外,之后未观察到。
观察发现:8:00—12:00,中华蜜蜂数量和访花次数都处在较高水平,随后减少,至17:00,没有中华蜜蜂采蜜。访花时,中华蜜蜂头部朝下,足部抓住花瓣边沿,头部和胸部的绒毛可粘取花粉,伸长口器吸食花蜜,采完1朵花后携带花粉采食另1朵,触及柱头完成授粉(图3 A~C)。中华蜜蜂收集花粉时,后足绒毛沾满花粉,好似“花粉筐”,有利于传粉(图3 D)。统计发现:中华蜜蜂的单花停留时间为7.5 s,单次连续访花数9朵,单序停留时间约1.4 min。日本弓背蚁(图3 E)出现频率也较高,其单花停留时间为27.5 s,单序停留时间约3.0 min,但是由于日本弓背蚁体型很小,有研究认为其腹腺分泌物含抗生素可降低花粉活力,并且其作为无翅访问者,具有重复访花、花序行为,易促进自花授粉的发生[15],因此蚂蚁传粉作用较小。甲虫等其他种类昆虫,仅吸取子房上部花被管内的花蜜,稻棘缘蝽刺吸植物茎叶(图3 F),喜好中午时趴在花筒上吸食汁液,而花蓟马多集于花内取食,两者对玉铃花传粉无太大作用,甚至会造成花朵萎蔫,阻碍传粉。
-
植物的花部特征、传粉特性和繁育系统是相互适应的[16],此种适应性大多体现在2个方面,其一为花部结构、形态的适应,其二为传粉者行为的适应。玉铃花花朵洁白,花冠直径>6 mm,花药黄色耀眼,具清香气味,具有较强的吸引昆虫特性, 与江南牡丹草Gymnospermium kiangnanense[17]花部表现出的泛化传粉类型特征相似。玉铃花为总状花序,花朵数量较多,自下而上开花,与1年生水生植物冠果草Sagittaria guyanensis的开花顺序一致[18];单花花期约5 d,整个花序寿命长达15 d,这种花序开花不同步,且花朵耀眼、数量大的特性,有助于延长传粉昆虫的访花时间和增加植物完成异花授粉的成功率,是植物长期适应不稳定传粉环境的表现,与ZHAO等[19]发现的花形态、大小对传粉者多样性和选择性有显著影响,且花展示和数量越多、选择性越强的研究结论一致。
玉铃花在浙江境内的野生居群零星状分布,天然更新受阻,主要原因可能是传粉昆虫数量和种类较少。本研究发现:中华蜜蜂是玉铃花的主要传粉昆虫,体型与其单花大小相适宜,两者存在供食与授粉的互惠关系;中华蜜蜂访花次数和时间与花粉活力、柱头可授性最强的时间一致。可见,玉铃花有性繁育主要依赖中华蜜蜂传粉的异交。观察还发现:大量的日本弓背蚁和花蓟马在玉铃花花朵上出现,但这些昆虫体型小,易出现重复访花行为,增加自花授粉可能性,很难形成有效传粉[20]。此外,外界干扰会影响传粉者的行为,其中天气的干扰影响程度较为突出,特别是阴雨天气,使得昆虫传粉行为受到一定抑制。如在花期遭遇连续数天阴雨的山地生境,玉铃花花期会延长,符合RATHCKE [21]的研究结论,即在传粉者稀少或者不稳定生境时,植物会通过延长花期来提高生殖成功率。本研究中,玉铃花花药不同步开裂,将花粉活力从5 d延长至6~7 d,可视为对传粉者行为受限时的适应。
-
花粉/胚珠比和杂交指数被广泛用于植物繁育系统的研究[22-23]。根据DAFNI杂交指数标准,玉铃花繁育系统为异交、部分自交亲和,属于需要传粉者类型;依据GRUDEN花粉/胚珠比测定结果,玉铃花繁育系统属于兼性异交,与安息香科另一植物黄梅秤锤树的研究结论一致[6]。在玉铃花开花过程中,单花尺度的雄蕊和雌蕊始终处于空间分离,柱头高于花药,不利于自花授粉,有利于柱头接受异花授粉;同时,花粉活力和柱头可授性的强弱具有一定的时间间隔,因此避免了同花自交现象的发生。但是花朵开放花药散粉时,柱头已经具有可授性,其花粉活力与柱头可授性存在一段时间重叠,使得玉铃花在时间上又具备自交的可能性。从单株水平看,玉铃花整株同时开放的花朵数量多,且单序分2~3段开放,花朵发育期又不同,在受到外界昆虫访花者及风力的作用下,也会出现同株同花和同株异花授粉,即植物自交。植物自交是被子植物进化的普遍趋势,是植物在恶劣环境中保证繁育成功的一种适应机制[24]。如花期降雨导致传粉受阻时,玉铃花选择自花授粉。因此,自花授粉为适应不断变化的生境提供了一定生殖保障,但是自交是否会对后代适合度造成影响,还有待进一步研究。
有效的授粉可使植株结实,但果实内只有少量种子可以萌发形成新的植株。安息香科植物如秤锤树属Sinojackia、长果安息香属Changiostyrax等大多已经濒危[25],栖息地被破坏、人为砍伐是直接原因,而植物种子外果皮坚硬、胚乳内源抑制物多、种子萌发率低也是重要原因。玉铃花同其他安息香科植物存在一定共性,即种皮厚、种子存在休眠,因此,玉铃花在浙江省的生存现状需要引起足够重视与并提供有效保护。
-
玉铃花为总状花序,单花序开花由基部向先端分2~3区段开放,单花开花持续3~5 d,花期为4月中旬至5月初;玉铃花花朵洁白、花药黄色具芬芳气味均为吸引传粉昆虫的花部特征,主要传粉昆虫为中华蜜蜂、日本弓背蚁等小型昆虫,体型与单花大小、花部结构相适应,玉玲花与传粉昆虫存在供食与授粉的互惠关系;玉铃花昆虫访花的时间与花粉活力、柱头可授性最强的时间一致;花粉胚珠比为(646.30±64.35),杂交指数为4,证实其授粉方式为依赖昆虫媒介为主的异交类型,繁育系统为异交且部分自交亲和。
Flowering dynamics and breeding system of Styrax obassia
-
摘要:
目的 研究玉铃花Styrax obassia的开花动态,揭示其繁育系统的基本特征,认识其生物学特性,为玉铃花杂交育种、生境保护提供理论依据,也为城市园林绿化应用推广提供技术支持。 方法 田间观测玉铃花开花动态特征、花部结构、昆虫访花特性,采用TTC染色法和联苯胺-过氧化氢法,分别测定花粉活力和柱头可授性,运用杂交指数(OCI)、花粉胚珠比(P/O)等方法确定其繁育系统类型。 结果 ①玉铃花的花期为4月中旬至5月初,始花期为4月15—18日,盛花期为4月19—26日,末花期为4月27日—5月2日,单花花期约3~5 d。②总状花序下垂,开花顺序由花梗基部向先端分2~3区段开放, 30个总状花序的小花数量平均为(25.3±1.8)个。③开花1 d后的花粉活力最强,雌雄蕊成熟时间部分重合, P/O为(646.30±64.35), OCI为4。④访花昆虫主要有中华蜜蜂Apis cerana、日本弓背蚁Camponotus japonicus等。 结论 玉铃花开花始于4月中旬,结束于5月初,盛花期持续1周时间,其繁育系统属于兼性异交、需要传粉者的类型,部分为自交亲和。图3表1参25 Abstract:Objective With an investigation of the flowering dynamics of Styrax obassia, this study is aimed to reveal the basic characteristics of its breeding system for a better understanding of its biological characteristics so as to provide theoretical basis for cross breeding and habitat protection of S. obassia as well as technical support for the application and popularization of urban landscaping. Method Observations were made of the flower dynamic characteristics, floral structure and insect visiting characteristics before the pollen viability and stigma receptivity were determined employing TTC staining and benzidine hydrogen peroxide method whereas the breeding line type was determined using hybridization index (OCI) and pollen ovule ratio (P/O). Result (1) With a single flowering period of about 3 to 5 days, the flowering period of S. obassia is from mid-April to early May with April 15 to 18 being the initial flowering period, April 19 to 26 being the full flowering period and April 27 to May 2 being the final flowering period. (2) With the racemes drooping, its flowering sequence was divided into 2−3 segments from the base of the pedicel to the apex and the average number of florets in 30 racemes was (25.3±1.8). (3) The pollen vigor was the strongest one day after flowering, and the mature time of male and female stamens partially coincided, with a P/O of (646.30±64.35) and an OCI of 4. (4) The flower visiting insects mainly include Apis cerana and Camponotus japonicus. Conclusion The flowering period of S. obassia began in mid-April and ended in early May with the bloom lasting for a week and the breeding system is featured with facultative outcrossing and pollinator and is partially self-compatible. [Ch, 3 fig. 1 tab. 25 ref.] -
Key words:
- Styrax obassia /
- flowering dynamics /
- breeding system /
- pollen vitality /
- stigma receptivity
-
表 1 玉铃花花部器官数量特征统计
Table 1. Statistics on the quantitative characteristics of floral organs of Styrax obassia
参数 花瓣长度/mm 花瓣宽度/mm 花冠直径/mm 花药长度/mm 花药宽度/mm 花丝长度/mm 花柱长度/mm 测定值 16.51±0.19 6.47±0.13 17.37±0.50 4.01±0.10 0.97±0.02 10.17±0.15 17.24±0.22 参数 雄蕊数量/个 子房长度/mm 子房宽度/mm 花筒长度/mm 花柄长度/mm 雄蕊雌蕊高度差/mm 测定值 9.2±0.2 2.79±0.04 1.96±0.05 5.68±0.12 5.61±0.20 2.50±0.16 -
[1] WYATT R. Pollinator: plant interactions and the evolution of breeding systems [M]//REAL L. Pollination Biology. Orlando: Florida Academic Press, 1983: 51 − 95. [2] DeMAURO M M. Relationship of breeding system to rarity in the lakeside daisy (Hymenoxys acaulis var. glabra) [J]. Conserv Biol, 1993, 7(3): 542 − 550. [3] 何亚平, 刘建全. 植物繁育系统研究的最新进展和评述[J]. 植物生态学报, 2003, 27(2): 151 − 163. HE Yaping, LIU Jianquan. A review on recent advances in the studies of plant breeding system [J]. Acta Phytoecol Sin, 2003, 27(2): 151 − 163. [4] 褚泽龙. 玉铃花种子休眠与萌发特性研究[D]. 泰安: 山东农业大学, 2015. CHU Zelong. Study on Dormancy and Germination Characteristics of Styrax obassia Sieb. et Zucc. Seeds [D]. Tai’an: Shandong Agricultural University, 2015. [5] 宋朝枢. 浙江清凉峰自然保护区科学考察集[M]. 北京: 中国林业出版社, 1997. SONG Chaoshu. Scientific Surver of the Qingliangfeng Nature Reserve [M]. Beijing: China Forestry Publishing House, 1997. [6] 张金菊, 叶其刚, 姚小洪, 等. 片断化生境中濒危植物黄梅秤锤树的开花生物学、繁育系统与生殖成功的因素[J]. 植物生态学报, 2008, 32(4): 743 − 750. ZHANG Jinju, YE Qigang, YAO Xiaohong, et al. Preliminary studies on the floral biology, breeding system and reproductive success of Sinojackia huangmeiensis, an endangered plant in a fragmented habitat in Hubei Province, China [J]. J Plant Ecol, 2008, 32(4): 743 − 750. [7] 王奎玲, 刘庆超, 李俊卿, 等. 玉铃花的组织培养与快速繁殖[J]. 植物生理学通讯, 2010, 46(9): 959 − 960. WANG Kuiling, LIU Qingchao, LI Junqing, et al. Tissue culture and rapid propagation of Styrax obassia [J]. Plant Physiol J, 2010, 46(9): 959 − 960. [8] 司倩倩, 臧德奎, 刘丹, 等. 玉铃花种子休眠原因及其内源激素含量变化[J]. 北方园艺, 2017(6): 91 − 95. SI Qianqian, ZANG Dekui, LIU Dan, et al. Causes of dormancy and change of endogenous hormone content in Styrax obassia seed [J]. Northern Hortic, 2017(6): 91 − 95. [9] 邢世岩, 董雷雷, 胡爱华, 等. 玉玲花种苗特性研究[J]. 种子, 2008, 27(3): 60 − 62. XING Shiyan, DONG Leilei, HU Aihua, et al. Study on seeds and seedlings characteristics of Styrax obassia Sieb. et Zucc. [J]. Seed, 2008, 27(3): 60 − 62. [10] 王萱. 玉铃花遗传多样性的AFLP分析[D]. 泰安: 山东农业大学, 2016. WANG Xuan. Genetic Diversity of Styrax obassia Sieb. et Zucc based on AFLP Markers [D]. Tai’an: Shandong Agricultural University, 2016. [11] 赵倩倩, 张艳红, 李刚. 玉玲花虫瘿中单宁含量初探[J]. 辽东学院学报(自然科学版), 2018, 25(1): 36 − 42. ZHAO Qianqian, ZHANG Yanhong, LI Gang. Tannin content of insect galls in Styrax obassia [J]. J Eastern Liaoning Univ Nat Sci Ed, 2018, 25(1): 36 − 42. [12] DAFNI A. Pollination Ecology: Apractical Approach [M]. Oxford: Oxford University Press, 1992. [13] 刘林德, 张洪军, 祝宁, 等. 刺五加花粉活力和柱头可授性的研究[J]. 植物研究, 2001, 21(3): 376 − 380. LIU Linde, ZHANG Hongjun, ZHU Ning, et al. Pollen viability and stigma receptivity of Eleutherococcus senticosus (Araliaceae) [J]. Bull Bot Res, 2001, 21(3): 376 − 380. [14] CRUDEN R W. Pollen ovule ratios: a conservative indicator of breeding systems in flowering plants [J]. Evolution, 1977, 31: 32 − 46. [15] PEAKALL R. The unique pollination of Leporella fimbriata (Orchidaceae): pollination by pseudocopulating male ants (Myrmecia urens, Formicidae) [J]. Plant Syst Evol, 1989, 167: 137 − 148. [16] 阮成江, 姜国斌. 雌雄异位和花部行为适应意义的研究进展[J]. 植物生态学报, 2006, 30(2): 210 − 220. RUAN Chengjiang, JIANG Guobin. Adaptive significance of herkogamy and floral behaviour [J]. J Plant Ecol, 2006, 30(2): 210 − 220. [17] 虞钦岚, 刘守赞, 徐韧析谋, 等. 珍稀濒危植物江南牡丹草种群结构和繁育系统研究[J]. 园艺学报, 2021, 48(3): 539 − 552. YU Qinlan, LIU Shouzan, XU Renximou, et al. Population structure and breeding systems of rare and endangered Gymnospermium kiangnanense (Berberidaceae) [J]. Acta Hortic Sin, 2021, 48(3): 539 − 552. [18] 任明迅, 姜新华, 张大勇. 植物繁殖生态学的若干重要问题[J]. 生物多样性, 2012, 20(3): 241 − 249. REN Mingxun, JIANG Xinhua, ZHANG Dayong. Some important questions in plant reproductive ecology [J]. Biodiversity Sci, 2012, 20(3): 241 − 249. [19] ZHAO Yanhui, REN Zongxin, LÁZARO A, et al . Floral traits influence pollen vectors’ choices in higher elevation communities in the Himalaya-Hengduan Mountains [J/OL]. BMC Ecol, 2016, 16: 26[2021-06-25]. doi:10.1186/s12898-016-0080-1. [20] 王淳秋, 罗毅波, 台永东, 等. 蚂蚁在高山鸟巢兰中的传粉作用[J]. 植物分类学报, 2008, 46(6): 836 − 846. WANG Chunqiu, LUO Yibo, TAI Yongdong, et al. Ants pollinate Neottia listeroides (Orchidaceae) in Sichuan, China [J]. J Syst Evol, 2008, 46(6): 836 − 846. [21] RATHCKE B J. Floral longevity and reproductive assurance: seasonal patterns and an experiment test with Kalmia latifolia (Ericaceae) [J]. Am J Bot, 2003, 90(9): 1328 − 1332. [22] 杨楠, 聂江力, 石福臣, 等. 天津地区野生山樱桃花部结构及生殖特征研究[J]. 种子, 2021, 40(1): 40 − 45. YANG Nan, NIE Jiangli, SHI Fuchen, et al. Study on floral structure and reproductive characteristics of wild Cerasus serrulate in Tianjin Region [J]. Seed, 2021, 40(1): 40 − 45. [23] 孙忆, 李玺, 丁苏芹, 等. 小苍兰开花特性与繁育系统研究[J]. 园艺学报, 2018, 45(2): 299 − 308. SUN Yi, LI Xi, DING Suqin, et al. Studies on flowering characteristics and breeding system of Freesia hybrida [J]. Acta Hortic Sin, 2018, 45(2): 299 − 308. [24] 孙维红, 袁雪艳, 吴玲娇, 等. 圆齿野鸦椿开花动态特征与繁育系统[J]. 植物生理学报, 2017, 53(12): 2215 − 2221. SUN Weihong, YUAN Xueyan, WU Lingjiao, et al. Flowering dynamics and breeding system of Euscaphis konishii Hayata [J]. Plant Physiol J, 2017, 53(12): 2215 − 2221. [25] 姚小洪. 秤锤树属与长果安息香属植物的保育遗传学研究[D]. 北京: 中国科学院, 2006. YAO Xiaohong. Studies on Conservation Genetics of Sinojackia Hu and Changiostyrax C. T. Chen [D]. Beijing: Chinese Academy of Sciences, 2006. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210455







 下载:
下载: