-
土壤固碳减排是应对全球气候变化的重要措施之一。随着城市园林绿化面积不断扩大,植物自然凋落或经人工修剪所产生的园林废弃物数量激增[1]。传统处置方式填埋和焚烧不仅会造成环境污染而且会导致生态系统物质循环和能量流动的终断,园林废弃物的合理资源化方式及还田增碳效果受到广泛关注[2]。园林废弃物具有再生周期短、可生物降解、环境友好等优点。将园林废弃物资源化后添加到土壤中可促进土壤培肥,提高土壤固碳功能,对农林业可持续发展和土壤碳增汇具有重要意义[3−4]。
园林废弃物资源化处理方式包括粉碎、堆肥、热解碳化制备生物质炭等,这些资源化产品施入土壤后会对土壤理化性质及土壤微生物代谢活性等造成不同的影响。粉碎是最简单的园林废弃物资源化处理方式,粉碎后的有机物料与土壤混合可以加速园林废弃物分解,具有改善土壤物理性质、提高土壤养分质量分数和增加微生物群落代谢活性的功能[5−7],然而分解过程需要较长的时间。园林废弃物通过堆肥过程得到的产品属于有机肥,堆肥物料施入土壤后通过微生物对有机质的分解、养分的转化等作用,提高土壤中毛管孔隙度、土壤阳离子交换量及酶活性,促进土壤有机碳、有机氮与土壤团聚体的结合,增加土壤养分质量分数,有效降低碱性土壤pH[8−10],减少氧化亚氮(N2O)和甲烷(CH4)的排放,增强土壤碳汇功能[11]。生物质炭是近年来新兴的园林废弃物资源化方式,具有含碳量丰富、多孔性、吸附能力强、容重小、稳定性强等特点,可以钝化土壤中的有害物质,增加土壤有机碳质量分数和碳固存,但其生物可利用性极低,会降低土壤微生物对碳源的利用和功能多样性指数。有研究表明:生物质炭施入土壤后的积极效果在4 a后才表现出来[12−14]。
目前,对于园林废弃物单一资源化方式对土壤影响的相关研究比较多,而不同资源化方式的比较研究较少。本研究采用林地施肥试验,比较园林废弃物不同资源化方式和施用量对土壤养分质量分数及碳源微生物功能多样性的影响,旨在为优化园林废弃物资源化利用方式和人工林土壤培肥固碳提供理论依据。
-
样地位于北京市房山区张庄村公园(39°74′N,116°08′E),该区为暖温带半湿润大陆季风气候,年平均气温为11.6 ℃,年平均降水量为602.5 mm,林分为金叶榆Ulmus pumila ‘Jinye’人工林,属于2018年北京市平原造林示范区,土壤为冲积性砂质壤土,蓄水保肥能力较差,土壤主要理化性质为:全氮 0.41 g·kg−1、全磷 0.45 g·kg−1、有机碳 5.41 g·kg−1、硝态氮(NO3 −-N) 1.40 mg·kg−1、铵态氮(NH4 +-N) 0.72 mg·kg−1、有效磷 0.08 mg·kg−1、pH 8.41、容重1.45 g·cm−3。
-
供试物料为园林废弃物3种不同资源化处理方式的产品,由北京市京圃园生物工程有限公司提供,包括粉碎物(GW1)、堆肥(GW2)和生物质炭(GW3)。3种产品性质如表1所示。
表 1 园林废弃物3种资源化处理产品的肥力相关指标
Table 1. Fertility related indexes of three treatment methods of garden waste
供试物料 pH 全氮/(g·kg−1) 全磷/(g·kg−1) 有机碳/(g·kg−1) 硝态氮/(mg·kg−1) 铵态氮/(mg·kg−1) 有效磷/(mg·kg−1) GW1 − 2.85 0.54 60.22 − 1.62 3.83 GW2 8.41 5.13 1.33 34.66 22.10 1.10 2.58 GW3 9.21 1.13 1.29 53.54 3.78 0.21 4.79 说明:−表示无法测定。 2021年6月选择地势平坦、植被分布均匀、土壤异质性小的金叶榆人工林作为研究样地,并设立标牌进行隔离保护。采用随机区组设计,3种有机物料的施用量设置为1、2、4 kg·m−2碳当量[2],分别标记为T1~T3,设置不施任何物料作为对照(ck),共10个处理,每个处理3个重复,林地内每个样方面积固定为10 m2,各样方之间设2 m隔离带。施用物料方式为撒施后再用旋耕机将物料与20 cm深度土壤混合。
-
2021年12月,在每个样方内随机选取5个点,去除土壤表层凋落物,采集0~20 cm表层土壤样品,清除石砾、植物残体根系等杂物,充分混匀形成一个混合土壤样品,装入无菌塑封袋中4 ℃低温保存,将土壤样品过2 mm筛,一部分土壤放入4 ℃冰箱保存,1周内进行Biolog-ECO分析,另外一部分室温风干用于土壤化学性质分析。
-
土壤pH测定采用电位法,土水质量比为1.0∶2.5;有机碳采用重铬酸钾氧化外加热法;铵态氮采用靛酚蓝比色法;硝态氮采用重氮耦合分光光度法;有效磷采用钼锑抗比色法[15]。
-
土壤碳源微生物群落特征采用Biolog-ECO微平板法分析,该方法是研究土壤微生物群落总体活性和微生物代谢功能多样性的有力方法[16]。具体实验步骤参考文献[17]。将接种好的Biolog-ECO板盖好盖子,放入25 ℃的培养箱中培养216 h。每隔24 h用酶标仪在590 nm下测定各孔的吸光度[18],换算为土壤微生物对6类31种碳源(包括10种糖类、7种羧酸类、6种氨基酸类、4种聚合物类、2种胺类和2种酚酸类)的平均颜色变化率(AWCD),AWCD越大,表明微生物对该碳源利用强度越强。采用168 h测定的数据分析土壤微生物群落对这6类碳源的利用特征,计算Simpson优势度指数、Shannon多样性指数和McIntosh均匀度指数,表示土壤微生物群落的功能多样性[19] 。
-
采用SPSS 25.0对数据进行双因素方差分析(two-way ANOVA),检验资源化方式与施用量及其交互作用对土壤化学性质、微生物碳源利用及功能多样性影响的差异显著性,采用LSD法进行多重比较。采用R 4.1.1的“FactoMineR”和“Factoextra”包对168 h土壤微生物利用单一碳源的特性进行主成分分析。采用Origin 2022绘图。
-
由表2可见:与ck相比,施用园林废弃物不同资源化物料极显著降低了土壤pH (P<0.001),其中GW1和GW2处理显著低于GW3处理(P<0.05)。随施用量增加,GW1和GW2处理下土壤pH极显著降低(P<0.001),GW1-T3处理下土壤pH较ck处理降低最为明显(降幅为6.78%),且不同物料和不同施用量间存在极显著交互作用(P<0.001)。
表 2 不同处理对土壤pH和养分质量分数的影响
Table 2. Effects of different treatments on soil pH and nutrient contents
处理 pH 土壤有机碳/(g·kg−1) 硝态氮/(mg·kg−1) 铵态氮/(mg·kg−1) 有效磷/(mg·kg−1) ck 8.41±0.18 Aa 7.35±2.22 Cc 1.07±0.18 Ab 0.53±0.06 Aa 0.27±0.38 Aa GW1-T1 8.02±0.03 Bb 9.56±0.80 Bc 1.28±0.25 Ab 0.46±0.63 Aa 0.13±0.06 Aa GW1-T2 7.89±0.06 Bb 10.60±0.39 Bc 1.60±0.95 Ab 0.49±0.06 Aa 0.17±0.06 Aa GW1-T3 7.84±0.08 Bb 11.08±0.52 Bc 4.23±0.99 Aa 0.58±0.11 Aa 0.17±0.06 Aa GW2-T1 7.99±0.07 Bb 13.30±0.17 Bbc 2.47±0.35 Aab 0.46±0.08 Aab 0.47±0.27 Aa GW2-T2 8.09±0.14 Bb 14.74±1.81 Bab 4.53±0.51 Aa 0.33±0.02 Bb 0.21±0.19 Aa GW2-T3 7.94±0.16 Bb 26.76±0.35 ABa 3.10±1.56 Aab 0.46±0.02 Aab 0.40±0.37 Aa GW3-T1 8.18±0.08 Bb 14.00±1.02 Bb 2.13±1.39 Ab 0.24±0.04 Bb 0.05±0.04 Aa GW3-T2 8.42±0.06 Aa 35.79±1.11 Aa 3.02±0.47 Aab 0.41±0.13 ABc 0.04±0.02 Aa GW3-T3 8.52±0.14 Aa 29.44±1.02 Aa 4.75±3.29 Aa 0.38±0.03 Bc 0.07±0.04 Aa F 物料 27.618*** 22.106*** 0.751ns 8.265** 2.868 ns 施用量 15.716*** 23.366*** 6.959** 6.293** 0.447 ns 交互作用 5.913*** 6.806*** 1.440 ns 2.826* 0.551 ns 说明:数值为均值±标准差;多重比较中,同列不同字母表示差异显著(P<0.05),大写字母用于园林废弃物不同资源化方式间比较,小写字母用于不同施用量间比较;双因素方差分析中,*、**、***分别表示P<0.05、 P<0.01、 P<0.001, ns表示差异不显著。 与ck相比,施用3种物料土壤有机碳质量分数均极显著提高(P<0.001),且GW3处理土壤有机碳质量分数显著高于GW1和GW2 (P<0.05)。随施用量增加,GW2和GW3处理有机碳质量分数极显著提高(P<0.001),GW3-T2土壤有机碳提升效果最显著,较ck升高了386.94%。不同资源化处理方式和不同施用量对土壤有机碳质量分数有极显著交互作用(P<0.001)。
土壤铵态氮、硝态氮和有效磷对不同有机物料和施用量的响应略有不同。施入不同有机物料后,土壤中硝态氮质量分数提高了19.63%~343.93%,且各处理间差异不显著。随施用量增加,各处理下的土壤硝态氮质量分数显著增加(P<0.01)。施入GW1和GW2后,土壤铵态氮质量分数无显著变化,但施用GW3后,土壤铵态氮质量分数显著降低(P<0.01),且GW3-T1效果最显著,较ck降低了54.72%。随施用量增加,GW1处理下的土壤铵态氮质量分数无显著变化,GW2和GW3处理下的土壤铵态氮质量分数显著降低(P<0.01)。不同资源化方式和不同施用量对土壤铵态氮质量分数交互作用显著(P<0.05)。不同有机物料和施用量处理对土壤有效磷质量分数的影响均不显著。
-
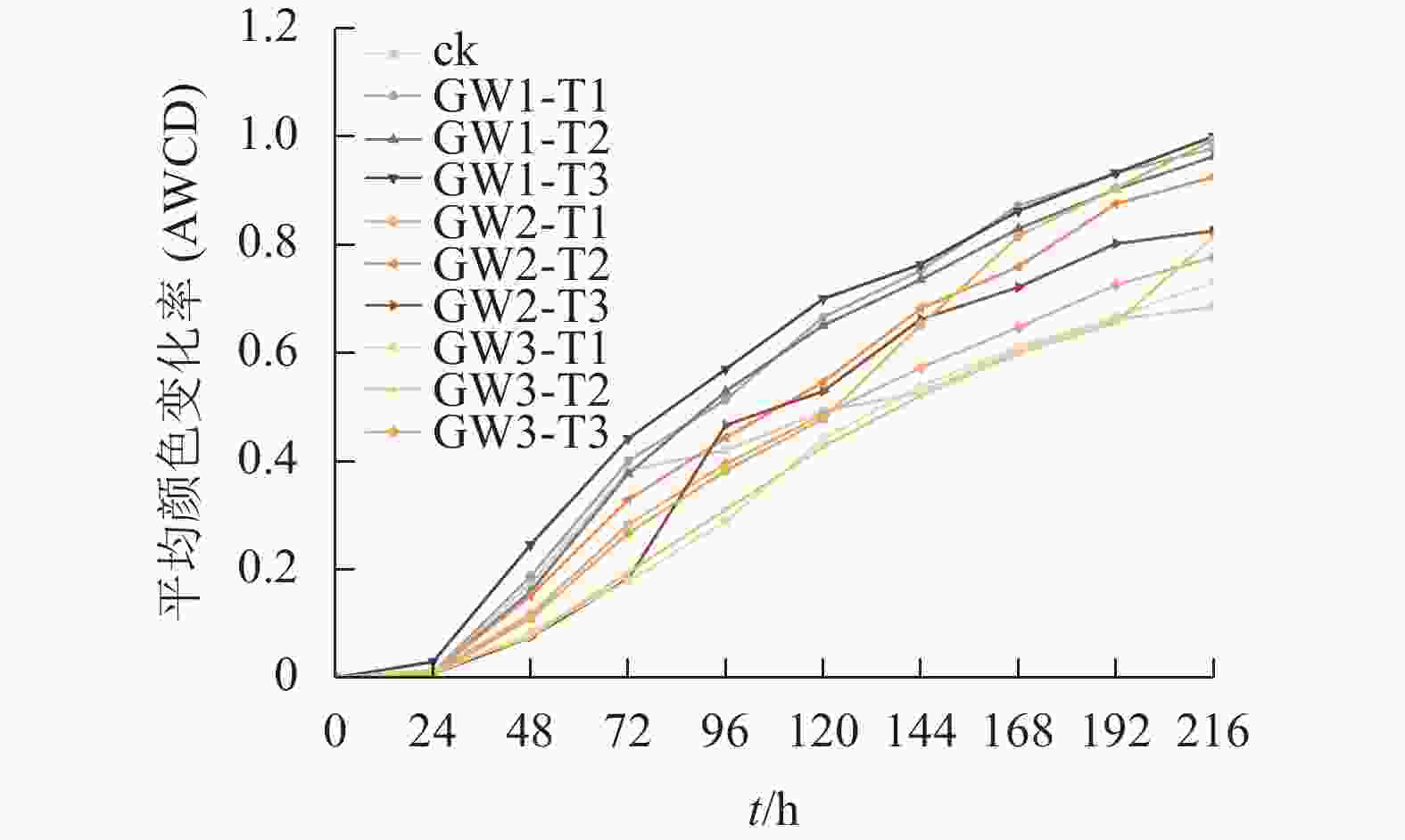
随培养时间的延长,不同处理下的土壤微生物对31种碳源的综合利用逐渐增强(图1)。在培养0~24 h内,不同处理的平均颜色变化率小于0.1,土壤微生物对碳源利用能力较低,活性较弱;在24~168 h进入迅速增长阶段,微生物活性旺盛;168 h后持续缓慢地升高。从培养稳定168 h时间点来看,GW1和GW2处理的土壤微生物代谢活性明显高于GW3,不同施用量的平均颜色变化率差异不显著。
-
由表3可见:施用GW1和GW2,土壤微生物群落功能多样性指数与ck均差异不显著;施用GW3则显著降低了土壤微生物群落Simpson优势度指数和McIntosh均匀度指数(P<0.05),对土壤Shannon丰富度指数无显著影响。不同施用量对土壤微生物多样性指数影响不显著(P>0.05),但随施用量增加,3种功能多样性指数均呈增加趋势。
表 3 土壤微生物群落功能多样性指数
Table 3. Functional diversity indices for soil microbial community
处理 Simpson
优势度指数Shannon
丰富度指数McIntosh
均匀度指数ck 0.94±0.02 Aa 2.99±0.23 Aa 5.65±0.67 Aa GW1-T1 0.95±0.01 Aa 3.06±0.17 Aa 5.92±1.47 Aa GW1-T2 0.95±0.01 Aa 3.10±0.11 Aa 5.80±0.94 Aa GW1-T3 0.95±0.01 Aa 3.13±0.17 Aa 6.04±1.50 Aa GW2-T1 0.94±0.01 Aa 2.95±0.16 Aa 5.08±0.54 ABa GW2-T2 0.95±0.01 Aa 3.09±0.07 Aa 5.40±0.93 ABa GW2-T3 0.95±0.01 Aa 3.12±0.09 Aa 5.36±0.68 ABa GW3-T1 0.94±0.01 Ba 2.76±0.09 Aa 3.56±0.40 Ba GW3-T2 0.94±0.03 Ba 2.74±0.37 Aa 3.91±1.26 Ba GW3-T3 0.95±0.01 Ba 3.10±0.12 Aa 5.81±0.08 Ba 说明:数值为均值±标准差;多重比较中,同列不同字母表示差异显著(P<0.05),大写字母用于园林废弃物不同资源化方式间比较,小写字母用于不同施用量间比较。 -
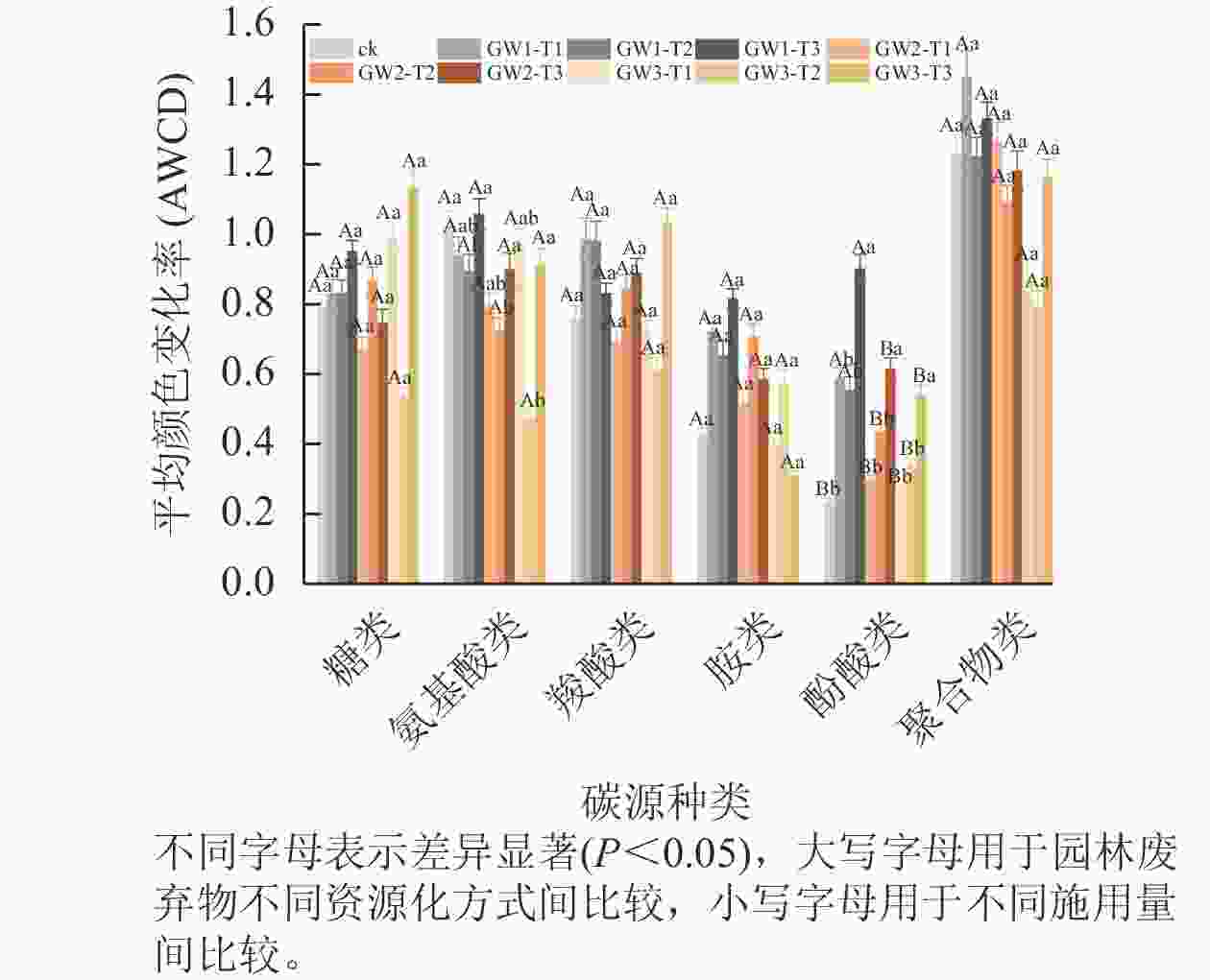
由图2可见:在6类碳源中,聚合物类是土壤微生物主要利用的碳源种类,糖类、氨基酸类和羧酸类次之,酚酸类和胺类利用最少。与ck相比,施用3种物料均增加了土壤微生物对酚酸类碳源的利用效率,其中GW1处理显著高于GW2和GW3 (P<0.05),随施用量的增加,酚酸类碳源利用率显著增加(P<0.05)。但施用物料显著降低了土壤微生物对氨基酸类碳源的利用效率(P<0.05)。不同物料和施用量处理下土壤微生物对其他4类碳源利用差异均不显著,相对而言,GW1和GW2处理对聚合物类、羧酸类、胺类碳源利用能力较高,GW3对糖类碳源利用能力较高。
-
土壤微生物利用单一碳源特性的主成分分析(图3)表明:前5个主成分的累积方差贡献率达81.7%,其中第1主成分(PC1)贡献率为30.2%,第2主成分(PC2)的贡献率为18.8%,选取 PC1 和 PC2 分析土壤微生物碳源利用情况。就不同有机物料而言,在PC1轴上,GW1分布在正方向,ck分布在负方向,GW2和GW3在正负方向上各有分布;在PC2轴上,ck和GW1分布在PC2的正方向,GW2分布在PC2的负方向,GW3在正负方向上各有分布。就不同施肥量而言,在PC1轴上,T3分布在正方向,ck分布在负方向,T1和T2在正负方向上各有分布;在PC2轴上各施用量分散不明显。整体而言,不同处理下的土壤微生物群落分异较大,离散程度从小到大依次为GW1、GW2、GW3。
在此基础上进一步分析了 31 种碳源在 PC1、PC2上的载荷值,载荷值越高表示对应碳源对主成分的影响越显著。由表4可见:对PC1贡献较大的碳源(|r|>0.5)有17种,主要包括糖类6种、羧酸类6种、氨基酸类3种和酚酸类2种。对PC2贡献较大的有8种,主要包括氨基酸类3种、聚合物类2种,胺类、羧酸类和糖类各1种。对 PC1和PC2起主要作用的是糖类、羧酸类和氨基酸类,在主成分分离中具有主要贡献。
表 4 不同碳源在 PC1 和 PC2 上的载荷值
Table 4. Loading values of different carbon sources on PC1 and PC2
碳源 PC1 PC2 碳源 PC1 PC2 聚合物类 吐温 80 0.574 氨基酸类 L-精氨酸 0.764 肝糖 0.565 L-天门冬酰胺 −0.553 0.643 L-苯丙氨酸 0.750 酚酸类 2-羟基苯甲酸 0.605 L-丝氨酸 −0.793 4-羟基苯甲酸 0.716 甘氨酰-L-谷氨酸 0.575 胺类 腐胺 −0.909 糖类 α-D-乳糖 0.714 β-甲基-D-葡萄糖苷 −0.840 羧酸类 丙酮酸甲酯 0.844 i-赤藓糖醇 0.772 D-葡糖胺酸 0.723 D-甘露醇 0.742 D-半乳糖醛酸 −0.506 0.782 N-乙酰-D葡萄糖氨 0.872 γ-羟丁酸 0.503 D, L-α-磷酸甘油 0.617 α-丁酮酸 0.574 D-半乳糖酸γ-内酯 −0.611 D-苹果酸 0.833 说明:表中列出了载荷值的绝对值|r|>0.5的碳源。 -
本研究发现:与施用粉碎物和堆肥相比,生物质炭可以显著降低土壤pH。这是由于园林废弃物经粉碎施入土壤和堆肥腐熟后会被微生物分解产生酸类物质(包括有机酸及腐殖酸等),与土壤中的碱性物质发生中和反应,进而降低土壤pH[20]。而生物质炭(pH 9.21)本身呈碱性,且含有大量羧基,可以交换降低土壤氢离子及交换性铝离子水平,使土壤pH升高。施用生物质炭无法降低碱性土壤pH,但有利于酸性土壤的改良[21]。
虽然园林废弃物3种不同资源化处理方式均可提高人工林土壤有机碳质量分数,但生物质炭对提高土壤有机碳质量分数作用最显著。园林废弃物及其堆肥产品本身富含有机物质,施入土壤后增加了土壤有机碳含量,且土壤微生物进一步促进了园林废弃物分解更多的有机碳[22]。同时微生物不易把生物质炭中结构稳定性强的多碳芳香族分解掉,可使碳在土壤中长期封存[23−24]。因此,生物质炭施入土壤后可显著提高土壤有机碳质量分数。
施用3种物料均会降低土壤铵态氮质量分数,增加硝态氮质量分数。这可能是因为施用粉碎物和堆肥会增加微生物对土壤无机氮的固持作用,使其转化为微生物氮,抑制土壤氨化作用,降低土壤铵态氮质量分数。由于土壤中铵态氮与硝态氮质量分数总是“此消彼长”,随物料施用量的增加,硝化细菌等微生物数量及种类增加,提升了土壤硝化作用,将铵态氮转化为硝态氮。但是生物质炭降低土壤铵态氮的机制可能有所不同,生物质炭施用能够提高土壤pH,进而可以调控土壤碳氮比影响氮素的有效性,影响铵态氮质量分数[25−27]。
-
本研究结果表明:施用粉碎物和堆肥能够增加土壤微生物的碳源利用能力,而生物质炭则显著降低了土壤微生物群落对碳源的利用。园林废弃物经粉碎和堆肥施入土壤后,随其分解会增加土壤微生物量碳等活性有机碳组分[28],提高蔗糖酶、磷酸酶等土壤酶的活性[29]或通过携带部分外源菌群增加土壤微生物的数量和种类,促进微生物群落对所测试碳源底物的利用。施用生物质炭会降低土壤微生物群落功能多样性的可能原因包括:①土壤中无机氮、磷相对缺乏且碳氮比高,生物质炭难以降解,微生物分解慢,不能长期提供土壤微生物易利用的碳源物质,导致微生物多样性低下。有研究表明:有效养分过高或过低都会对土壤微生物产生不利影响[14, 29]。②生物质炭能够吸附保护酶促反应结合位点,抑制酶促反应,降低酶活性[30]。③生物质炭中含有重金属、乙烯、高盐类物质和多环芳烃等对微生物有害的物质,抑制了微生物生长[31]。本研究中施加生物质炭导致土壤铵态氮和有效磷水平的降低,从而降低微生物功能多样性,支持了第一种解释,然而其内在机制还需要进一步探讨。
施用3种物料均降低了土壤微生物对氨基酸碳源的利用,增加了对酚酸类碳源的利用,这可能是由于土壤中有效养分不均衡所致。有研究表明:长期施氮肥会增加土壤中的好气性固氮菌、氨化细菌、亚硝化细菌和反硝化细菌等氮素功能菌群的数量,提高了氨基酸碳源的利用[32]。本研究中仅施入了园林废弃物而没有添加氮、磷、钾等无机肥料,可能由于有效养分不均衡限制了利用氨基酸类的微生物功能类群的生长;此外,物料中可能含有的重金属等污染物,也会改变以酚酸类为碳源的土壤微生物活性。
本研究中不同资源化处理方式下土壤微生物对碳源的利用模式具有明显的差异,糖类和羧酸类是区分粉碎物、堆肥和生物质炭的敏感碳源,氨基酸类是区分粉碎物和堆肥的敏感碳源。在糖类和羧酸类碳源中,α-D-乳糖、D-甘露醇、N-乙酰-D葡萄糖氨、D, L-α-磷酸甘油和丙酮酸甲酯、D-苹果酸、γ-羟丁酸、α-丁酮酸、D-葡糖胺酸在PC1上为正值,粉碎物和堆肥位于PC1正轴,表明粉碎物和堆肥提高了土壤微生物对这4种糖类和5种羧酸类碳源的利用。如有研究表明:施入凋落物会显著提高土壤微生物对糖类和羧酸类碳源的利用[33]。在氨基酸类碳源中,L-精氨酸、L- 酰胺和甘氨酰-L-谷氨酸在PC2轴上为正值,表明粉碎物提高了土壤微生物对这3种氨基酸类碳源的利用,所以粉碎物和堆肥高效利用的碳源种类明显多于生物质炭,这与土壤微生物对碳源的利用程度和微生物群落功能多样性结果也一致。
-
施用园林废弃物粉碎物和堆肥会降低弱碱性土壤pH,施用生物质炭可以大幅提升土壤有机碳的质量分数,降低铵态氮的有效性。3种物料能通过改变土壤化学性质而影响土壤微生物碳源利用和功能多样性。粉碎物和堆肥提高了土壤微生物群落功能多样性指数,生物质炭显著降低了土壤微生物群落的优势度和均匀度。施用粉碎物、堆肥和生物质炭均降低了土壤微生物对氨基酸碳源的利用,增加了对酚酸碳源的利用。生物质炭处理下微生物对糖类利用率最高,除糖类外,粉碎物和堆肥处理下土壤微生物对氨基酸、聚合物等5类碳源的利用率均高于生物质炭处理。糖类和羧酸类是区分粉碎物、堆肥与生物质炭的主要碳源种类,氨基酸类是区分粉碎物和堆肥的主要碳源种类。不同施用量对微生物群落碳源利用和功能多样性影响差异相对较小,随施用量增大微生物群落功能多样性增大趋势不明显。
Effects of garden waste reuse treatments on soil nutrients and microbial carbon source utilization in plantation soil
-
摘要:
目的 园林废弃物经资源化处理利用是人工林土壤培肥和增强碳汇功能的有效途径。研究园林废弃物不同资源化方式对人工林土壤化学性质和微生物群落功能的影响,可为园林废弃物的高效利用提供科学依据。 方法 在北京市房山区金叶榆Ulmus pumila ‘Jinye’人工林下开展试验,设置粉碎物、堆肥、生物质炭等3种园林废弃物资源化物料和1、2、4 kg·m−2 3个基于碳当量的施用量,采用Biolog-ECO微平板法测定土壤微生物代谢强度,分析了不同物料和施用量对土壤pH、养分质量分数、微生物碳源利用程度和功能多样性指数的影响。 结果 ① 3种物料均提高了土壤有机碳和硝态氮质量分数,粉碎物和堆肥处理显著降低了弱碱性土壤的pH,对铵态氮和有效磷质量分数影响不大;生物质炭处理则提高了土壤pH,降低了铵态氮和有效磷质量分数;② 土壤微生物对碳源利用程度和微生物群落功能多样性从大到小依次为粉碎物、堆肥、生物质炭;③在6类碳源中,糖类、羧酸类和氨基酸类是区分碳源微生物对3种物料利用的主要碳源种类;3种物料均促进了土壤微生物对酚酸碳源的利用,降低了对氨基酸碳源的利用,粉碎物和堆肥处理下微生物对氨基酸、聚合物等碳源利用强于生物质炭处理,且生物质炭处理下微生物对糖类利用最强;④ 不同施用量对土壤微生物碳源利用的影响差异不显著,随施用量增大微生物群落功能多样性有增加趋势。 结论 园林废弃物粉碎物、堆肥及生物质炭均能在一定程度上改善人工林土壤质量,其中,粉碎物和堆肥处理对降低弱碱性土壤pH、增加土壤肥力及提高土壤微生物群落功能多样性的效果优于生物质炭。图3表4参33 Abstract:Objective Resource utilization of garden waste is an effective way to improve soil fertility and enhance carbon sink function of plantations. Study on the effects of different reuse treatments of garden waste on soil chemical properties and microbial community in the plantation soil can provide scientific basis for efficient utilization of garden waste. Method Experiments were carried out in an Ulmus pumila ‘Jinye’ plantation, in Fangshan District, Beijing City. Experimentation including three types of garden wastes products, crushed material, compost and biochar, and 1, 2 and 4 kg·m−2 carbon-based amounts were set up. Biolog-ECO microplate method combined with conventional soil chemical properties measurement were conducted in order to analyze the effects of different materials of garden waste and their application amounts on soil pH, nutrient content, microbial carbon source utilization and functional diversity indices of soil microbial community. Result (1) All three types of organic materials increased the content of soil organic carbon and nitrate nitrogen while crushed material and compost significantly reduced the pH value of weakly alkaline soil, with little impact on the content of ammonium nitrogen and available phosphorus. Meanwhile, biochar increased the soil pH value and decreased the content of ammonium nitrogen and available phosphorus; (2) The microbial utilization of carbon sources and the functional diversity of microbial community are as follows: crushed material>compost>biochar. (3) Among the six types of carbon sources, carbohydrate, carboxylic acids and amino acid carbon source were the main carbon sources used by microorganisms, which could distinguish the three treatments of garden waste. The three organic materials all promoted the microbial utilization of phenolic acid carbon source and reduced the utilization of amino acid carbon source. The utilization of amino acid, polymer and other carbon sources by carbon-oriented microorganisms in treatment of crushed materials and compost were stronger than that of biochar while the microbial utilization of carbohydrate carbon source in biochar is the strongest among the three treatments; (4) The effect of application amounts on soil microbial carbon source utilization was not significant, and functional diversity of microbial community increased with the increase of application amounts. Conclusion Garden waste could be used to improve the soil quality of plantation by three types of treatments. Compared to biochar, crushed material and compost were more effective in reducing the pH of weakly alkaline soil, increasing soil fertility, and improving the functional diversity of soil microbial community. [Ch, 3 fig. 4 tab. 33 ref.] -
Key words:
- garden waste /
- crushed materials /
- compost /
- biochar /
- Biolog-ECO /
- microbial utilization of carbon sources
-
表 1 园林废弃物3种资源化处理产品的肥力相关指标
Table 1. Fertility related indexes of three treatment methods of garden waste
供试物料 pH 全氮/(g·kg−1) 全磷/(g·kg−1) 有机碳/(g·kg−1) 硝态氮/(mg·kg−1) 铵态氮/(mg·kg−1) 有效磷/(mg·kg−1) GW1 − 2.85 0.54 60.22 − 1.62 3.83 GW2 8.41 5.13 1.33 34.66 22.10 1.10 2.58 GW3 9.21 1.13 1.29 53.54 3.78 0.21 4.79 说明:−表示无法测定。 表 2 不同处理对土壤pH和养分质量分数的影响
Table 2. Effects of different treatments on soil pH and nutrient contents
处理 pH 土壤有机碳/(g·kg−1) 硝态氮/(mg·kg−1) 铵态氮/(mg·kg−1) 有效磷/(mg·kg−1) ck 8.41±0.18 Aa 7.35±2.22 Cc 1.07±0.18 Ab 0.53±0.06 Aa 0.27±0.38 Aa GW1-T1 8.02±0.03 Bb 9.56±0.80 Bc 1.28±0.25 Ab 0.46±0.63 Aa 0.13±0.06 Aa GW1-T2 7.89±0.06 Bb 10.60±0.39 Bc 1.60±0.95 Ab 0.49±0.06 Aa 0.17±0.06 Aa GW1-T3 7.84±0.08 Bb 11.08±0.52 Bc 4.23±0.99 Aa 0.58±0.11 Aa 0.17±0.06 Aa GW2-T1 7.99±0.07 Bb 13.30±0.17 Bbc 2.47±0.35 Aab 0.46±0.08 Aab 0.47±0.27 Aa GW2-T2 8.09±0.14 Bb 14.74±1.81 Bab 4.53±0.51 Aa 0.33±0.02 Bb 0.21±0.19 Aa GW2-T3 7.94±0.16 Bb 26.76±0.35 ABa 3.10±1.56 Aab 0.46±0.02 Aab 0.40±0.37 Aa GW3-T1 8.18±0.08 Bb 14.00±1.02 Bb 2.13±1.39 Ab 0.24±0.04 Bb 0.05±0.04 Aa GW3-T2 8.42±0.06 Aa 35.79±1.11 Aa 3.02±0.47 Aab 0.41±0.13 ABc 0.04±0.02 Aa GW3-T3 8.52±0.14 Aa 29.44±1.02 Aa 4.75±3.29 Aa 0.38±0.03 Bc 0.07±0.04 Aa F 物料 27.618*** 22.106*** 0.751ns 8.265** 2.868 ns 施用量 15.716*** 23.366*** 6.959** 6.293** 0.447 ns 交互作用 5.913*** 6.806*** 1.440 ns 2.826* 0.551 ns 说明:数值为均值±标准差;多重比较中,同列不同字母表示差异显著(P<0.05),大写字母用于园林废弃物不同资源化方式间比较,小写字母用于不同施用量间比较;双因素方差分析中,*、**、***分别表示P<0.05、 P<0.01、 P<0.001, ns表示差异不显著。 表 3 土壤微生物群落功能多样性指数
Table 3. Functional diversity indices for soil microbial community
处理 Simpson
优势度指数Shannon
丰富度指数McIntosh
均匀度指数ck 0.94±0.02 Aa 2.99±0.23 Aa 5.65±0.67 Aa GW1-T1 0.95±0.01 Aa 3.06±0.17 Aa 5.92±1.47 Aa GW1-T2 0.95±0.01 Aa 3.10±0.11 Aa 5.80±0.94 Aa GW1-T3 0.95±0.01 Aa 3.13±0.17 Aa 6.04±1.50 Aa GW2-T1 0.94±0.01 Aa 2.95±0.16 Aa 5.08±0.54 ABa GW2-T2 0.95±0.01 Aa 3.09±0.07 Aa 5.40±0.93 ABa GW2-T3 0.95±0.01 Aa 3.12±0.09 Aa 5.36±0.68 ABa GW3-T1 0.94±0.01 Ba 2.76±0.09 Aa 3.56±0.40 Ba GW3-T2 0.94±0.03 Ba 2.74±0.37 Aa 3.91±1.26 Ba GW3-T3 0.95±0.01 Ba 3.10±0.12 Aa 5.81±0.08 Ba 说明:数值为均值±标准差;多重比较中,同列不同字母表示差异显著(P<0.05),大写字母用于园林废弃物不同资源化方式间比较,小写字母用于不同施用量间比较。 表 4 不同碳源在 PC1 和 PC2 上的载荷值
Table 4. Loading values of different carbon sources on PC1 and PC2
碳源 PC1 PC2 碳源 PC1 PC2 聚合物类 吐温 80 0.574 氨基酸类 L-精氨酸 0.764 肝糖 0.565 L-天门冬酰胺 −0.553 0.643 L-苯丙氨酸 0.750 酚酸类 2-羟基苯甲酸 0.605 L-丝氨酸 −0.793 4-羟基苯甲酸 0.716 甘氨酰-L-谷氨酸 0.575 胺类 腐胺 −0.909 糖类 α-D-乳糖 0.714 β-甲基-D-葡萄糖苷 −0.840 羧酸类 丙酮酸甲酯 0.844 i-赤藓糖醇 0.772 D-葡糖胺酸 0.723 D-甘露醇 0.742 D-半乳糖醛酸 −0.506 0.782 N-乙酰-D葡萄糖氨 0.872 γ-羟丁酸 0.503 D, L-α-磷酸甘油 0.617 α-丁酮酸 0.574 D-半乳糖酸γ-内酯 −0.611 D-苹果酸 0.833 说明:表中列出了载荷值的绝对值|r|>0.5的碳源。 -
[1] 陈浩天, 张地方, 张宝莉, 等. 园林废弃物不同处理方式的环境影响及其产物还田效应[J]. 农业工程学报, 2018, 34(21): 239 − 244. CHEN Haotian, ZHANG Difang, ZHANG Baoli, et al. Environmental impacts and returning effects of garden wastes under different disposal methods [J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(21): 239 − 244. [2] D’HOSE T, DEBODE J, DE TENDER C, et al. Has compost with biochar applied during the process added value over biochar or compost for increasing soil quality in an arable cropping system? [J/OL]. Applied Soil Ecology, 2020, 156: 103706[2022-09-20]. doi: 10.1016/j.apsoil.2020.103706. [3] 罗玉叶, 邱龙霞, 龙军, 等. 不同秸秆还田率情境下的亚热带水田土壤的“碳汇”贡献模拟研究[J/OL]. 土壤学报, 2022[2022-09-20]. doi: 10.11766/trxb202112280700. LUO Yuye, QIU Longxia, LONG Jun, et al. Research on the carbon sink contribution of subtropical paddy field soil under different straw return rates[J]. Acta Pedologica Sinica, 2022[2022-09-20]. doi: 10.11766/trxb202112280700. [4] 方精云. 碳中和的生态学透视[J]. 植物生态学报, 2021, 45(11): 1173 − 1176. FANG Jingyun. Ecological perspectives of carbon neutrality [J]. Chinese Journal of Plant Ecology, 2021, 45(11): 1173 − 1176. [5] 程曼. 黄土丘陵区典型植物枯落物分解对土壤有机碳、氮转化及微生物多样性的影响[D]. 杨凌: 西北农林科技大学, 2015. CHENG Man. Effects of Litter Decomposition on Soil Carbon, Nitrogen, and Soil Microbial Community Structure on the Loess Plateau, China [D]. Yangling: Northwest A&F University, 2015. [6] 尹欢宇. 剩余物处理对华北落叶松人工林土壤质量和生长的影响[D]. 北京: 北京林业大学, 2016. YIN Huanyu. Effects of Residue Treatment on Growth and Soil Quality of Larix principis-rupprechtii Plantation [D]. Beijing: Beijing Forestry University, 2016. [7] 王利彦, 周国娜 朱新玉, 等. 凋落物对土壤有机碳与微生物功能多样性的影响[J]. 生态学报, 2021, 41(7): 2709 − 2718. WANG Liyan, ZHOU Guona, ZHU Xinyu, et al. Effects of litter on soil organic carbon and microbial functional diversity [J]. Acta Ecologica Sinica, 2021, 41(7): 2709 − 2718. [8] 连鹏, 范周周, 郭东矗, 等. 城市污泥与园林废弃物混合堆肥施用对林地土壤微生物量碳、氮及酶活性的影响[J]. 环境科学学报, 2018, 38(7): 2842 − 2848. LIAN Peng, FAN Zhouzhou, GUO Dongchu, et al. Effects of mixed composting of municipal sludge and garden waste on soil microbial biomass carbon, nitrogen and enzyme activities in forest land [J]. Acta Scientiae Circumstantiae, 2018, 38(7): 2842 − 2848. [9] REMIGIO P, THOMAS Z L, SABINE H, et al. Composting modifies the patterns of incorporation of OC and N from plant residues into soil aggregates [J]. Geoderma, 2019, 353: 415 − 422. [10] 司莉青, 陈利民, 郑景明, 等. 城市污泥与园林废弃物堆肥混合添加对土壤改良的影响[J]. 草业科学, 2018, 35(1): 1 − 9. SI Liqing, CHEN Limin, ZHENG Jingming, et al. Effect of mixed sewage sludge and garden waste composts on potting soil amendment [J]. Pratacultural Science, 2018, 35(1): 1 − 9. [11] NG E L, PATTI A F, ROSE M T, et al. Does the chemical nature of soil carbon drive the structure and functioning of soil microbial communities? [J]. Soil Biology &Biochemistry, 2014, 70: 54 − 61. [12] JONES D L, ROUSK J, EDWARDS-JONES G, et al. Biochar-mediated changes in soil quality and plant growth in a three year field trial [J]. Soil Biology &Biochemistry, 2012, 45: 113 − 124. [13] 武爱莲, 丁玉川, 焦晓燕, 等. 玉米秸秆生物炭对褐土微生物功能多样性及细菌群落的影响[J]. 中国生态农业学报, 2016, 24(6): 736 − 743. WU Ailian, DING Yuchuan, JIAO Xiaoyan, et al. Effect of corn-stalk biochar on soil microbial functional diversity and bacterial community in cinnamon soils [J]. Chinese Journal of Eco-Agriculture, 2016, 24(6): 736 − 743. [14] 侯建勋, 张水梅, 袁静超, 等. 玉米秸秆源有机物料对黑土养分有效性与酶活性的提升效应[J]. 植物营养与肥料学报, 2021, 27(4): 610 − 618. HOU Jianxun, ZHANG Shuimei, YUAN Jingchao, et al. Effects of maize straw-derived organic materials on improving soil nutrient availability and enzyme activities in a Mollisol [J]. Journal of Plant Nutrition and Fertilizers, 2021, 27(4): 610 − 618. [15] 田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术, 2011, 34(3): 50 − 57. TIAN Ya’nan, WANG Hongqi. Application of biolog to study of environmental microbial function diversity [J]. Environmental Science &Technology, 2011, 34(3): 50 − 57. [16] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Rukun. Methods for Agricultural Chemical Analysis of Soil [M]. Beijing: China Agricultural Science and Technology Press, 2000. [17] 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010. LIN Xiangui. Principles and Methods of Soil Microbiology Research [M]. Beijing: Higher Education Press, 2010. [18] 祝英, 王治业, 彭轶楠, 等. 有机肥替代部分化肥对土壤肥力和微生物特征的影响[J]. 土壤通报, 2015, 46(5): 1161 − 1167. ZHU Ying, WANG Zhiye, PENG Yi’nan, et al. Changes of soil nutrients and microbial communities under the condition of organic fertilizers replacing part of chemical fertilizers [J]. Chinese Journal of Soil Science, 2015, 46(5): 1161 − 1167. [19] 王晶晶, 樊伟, 崔珺, 等. 氮磷添加对亚热带常绿阔叶林土壤微生物群落特征的影响[J]. 生态学报, 2017, 37(24): 8361 − 8373. WANG Jingjing, FAN Wei, CUI Jun, et al. Effects of nitrogen and phosphorus addition on soil microbial community characteristics in a subtropical evergreen broadleaved forest [J]. Acta Ecologica Sinica, 2017, 37(24): 8361 − 8373. [20] 杜田甜, 孙向阳, 李素艳, 等. 园林绿化废弃物覆盖对城市绿地土壤肥力影响[J]. 北京林业大学学报, 2021, 43(10): 110 − 117. DU Tiantian, SUN Xiangyang, LI Suyan, et al. Effects of landscaping waste mulching on soil fertility of urban green space [J]. Journal of Beijing Forestry University, 2021, 43(10): 110 − 117. [21] SHI Renyong, HONG Zhineng, LI Jiuyu, et al. Peanut straw biochar increases the resistance of two Ultisols derived from different parent materials to acidification: a mechanism study [J]. Journal of Environmental Management, 2018, 210: 171 − 179. [22] LIU Chang, LU Meng, CUI Jun, et al. Effects of straw carbon input on carbon dynamics in agricultural soils: a meta-analysis. [J]. Global Change Biology, 2014, 20(5): 1366 − 1381. [23] 张婷, 王旭东, 逄萌雯, 等. 生物质炭和秸秆配合施用对土壤有机碳转化的影响[J]. 环境科学, 2016, 37(6): 2298 − 2303. ZHANG Ting, WANG Xudong, PANG Mengwen, et al. Impacts of biochar and straw application on soil organic carbon transformation [J]. Environmental Science, 2016, 37(6): 2298 − 2303. [24] SINGH B P, COWIE A L. Long-term influence of biochar on native organic carbon mineralisation in a low-carbon clayey soil. [J/OL]. Scientific Reports, 2014, 4(1) : 3687[2022-09-20]. doi: 10.1038/srep03687. [25] 李明, 李忠佩, 刘明, 等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学, 2015, 48(7): 1361 − 1369. LI Ming, LI Zhongpei, LIU Ming, et al. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil [J]. Scientia Agricultura Sinica, 2015, 48(7): 1361 − 1369. [26] 张登晓, 周惠民, 潘根兴, 等. 城市园林废弃物生物质炭对小白菜生长、硝酸盐含量及氮素利用率的影响[J]. 植物营养与肥料学报, 2014, 20(6): 1569 − 1576. ZHANG Dengxiao, ZHOU Huimin, PAN Genxing, et al. Effect of municipal green waste biochar addition on the growth, nitrate content and nitrogen use efficiency of greenhouse pakchoi [J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(6): 1569 − 1576. [27] MAESTRINI B, HERRMANN A M, NANNIPIERI P, et al. Ryegrass-derived pyrogenic organic matter changes organic carbon and nitrogen mineralization in a temperate forest soil [J]. Soil Biology and Biochemistry, 2014, 69: 291 − 301. [28] 冯小杰, 刘国梁, 张伟, 等. 园林绿化废弃物堆肥对土壤有机碳组分影响[J]. 北京林业大学学报, 2021, 43(7): 120 − 127. FENG Xiaojie, LIU Guoliang, ZHANG Wei, et al. Effects of green waste compost on soil organic carbon fractions [J]. Journal of Beijing Forestry University, 2021, 43(7): 120 − 127. [29] 何甜甜, 王静, 符云鹏, 等. 等碳量添加秸秆和生物炭对土壤呼吸及微生物生物量碳氮的影响[J]. 环境科学, 2021, 42(1): 450 − 458. HE Tiantian, WANG Jing, FU Yunpeng, et al. Effects of adding straw and biochar with equal carbon content on soil respiration and microbial biomass carbon and nitrogen [J]. Environmental Science, 2021, 42(1): 450 − 458. [30] 丁艳丽, 刘杰, 王莹莹. 生物炭对农田土壤微生物生态的影响研究进展[J]. 应用生态学报, 2013, 24(11): 3311 − 3317. DING Yanli, LIU Jie, WANG Yingying. Effects of biochar on microbial ecology in agriculture soil: a review [J]. Chinese Journal of Applied Ecology, 2013, 24(11): 3311 − 3317. [31] 何秀峰, 赵丰云, 于坤, 等. 生物炭对葡萄幼苗根际土壤养分、酶活性及微生物多样性的影响[J]. 中国土壤与肥料, 2020(6): 19 − 26. HE Xiufeng, ZHAO Fengyun, YU Kun, et al. Effect of biochar on nutrient, enzyme activities and microbial diversity of rhizosphere soil of grape seedlings [J]. Soil and Fertilizer Sciences in China, 2020(6): 19 − 26. [32] 张淑红, 高巍, 张恩平, 等. 长期定位施氮对连作番茄土壤可培养微生物数量的影响[J]. 土壤通报, 2012, 43(1): 60 − 65. ZHANG Shuhong, GAO Wei, ZHANG Enping, et al. Effect of long-term nitrogen application on culturable microorganisms quantity of tomato continuous cropping [J]. Chinese Journal of Soil Science, 2012, 43(1): 60 − 65. [33] 李秋梅, 黎胜杰, 王欣丽, 等. 改变碳输入对沂蒙山区典型次生林土壤微生物碳源代谢功能的影响[J]. 生态学报, 2021, 41(10): 4110 − 4119. LI Qiumei, LI Shengjie, WANG Xinli, et al. Influences of changing carbon inputs on soil microbial carbon metabolism in natural secondary forests in Yimeng mountainous area [J]. Acta Ecologica Sinica, 2021, 41(10): 4110 − 4119. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220620






 下载:
下载: