-
土壤是社会生态和自然系统中最有价值的自然资源之一[1]。土壤化学性质是衡量土壤质量的关键标准,影响林木和土壤微生物的生长和发育,为其提供有效的营养元素[2−3]。森林土壤在很大程度上决定了森林结构和功能[4] 。火是森林最重要的干扰之一,影响着植被和土壤[5−8]。全球气候变化背景下,极端高温和干旱导致全球尤其是北方森林火干扰的频率、强度和燃烧面积大幅增加[9−11]。计划烧除是林火管理的有效手段之一[11] ,在预防森林大火的同时,也影响着植被和土壤[12−21]。研究表明:计划烧除在一定程度上改变了森林土壤理化性质[12−17],尤其是土壤养分元素[18−25] ,且其效果受植被类型和烧除间隔时间等因素的影响[19−25]。如间隔周期为2 a的计划烧除使得澳大利亚昆士兰岛东南部森林土壤全碳、全氮分别降低了48%、59%,而间隔周期为4 a的计划烧除对亚热带土壤碳氮库的影响不显著[14] 。
云南松Pinus yunnanensis林分布区历来是中国林火频发和高火险区域[22],也是中国计划烧除主要实施区域[23−25]。计划烧除在一定程度上影响着云南松林土壤的理化性质[26−27]。田荣等[26]分析了每年连续计划烧除对滇中云南松林土壤养分元素的影响,表明烧除2周后云南松林烧除样地0~20 cm土层土壤有机碳、全氮和全磷显著低于未烧除样地,0~10 cm 土层土壤pH、硝态氮、全钾、速效磷和速效钾显著高于未烧除样地,然而烧除后间隔时间对云南松林土壤的影响尚不明确。本研究以云南省玉溪市新平彝族傣族自治县照壁山云南松林为研究对象,分别在连续实施计划烧除后1和3 a样地及其相应的对照(未烧除)样地采集0~10和10~20 cm土层土壤,测定其pH和碳、氮、磷、钾质量分数,探讨计划烧除及烧除后间隔时间对滇中云南松林土壤养分的影响。本研究可以为该区制定科学合理的计划烧除方案,预防森林大火并维持或提高云南松林生态功能提供参考。
-
研究区位于滇中高原玉溪市新平彝族傣族自治县照壁山。照壁山地处亚热带高原季风区南北部过渡带,年平均降水量为1 050.0 mm,年平均最高气温为 32.0 ℃,年平均最低气温为 1.0 ℃ ,年平均气温为 15.1 ℃。照壁山的土壤类型为红壤,主要植被类型为云南松林,该林分为20 世纪七八十年代经飞播造林、疏伐管理后形成的云南松林。灌木植物主要有金叶子Craibiodendron stellatum、珍珠花Lyonia ovalifolia、羊耳菊Duhaldea cappa、乌鸦果Vaccinium fragile和麻栎Quercus acutissima。草本植物主要有四脉金茅Eulalia quadrinervis、刺芒野古草Arundinella setosa、白健杆Eulalia pallens、黄背草Themeda triandra、十字薹草Carex cruciata和野拔子Elsholtzia rugulosa。研究区自2016年开始每年1—2月开展低强度计划烧除,2020和2021年中止了2 a,2022年2月再次实施低强度计划烧除,为本研究探讨不同计划烧除间隔时间对森林土壤的影响提供了条件。
-
计划烧除(轻度火烧)对土壤的影响仅限于表层土壤[2, 28]。本研究分别在2020年1月和2022年1月对烧除间隔1 a (T1)和烧除间隔3 a (T2)样地进行2次野外取样,每次取样分别设置7个烧除样地和7个对照样地(未实施过计划烧除,分别设对照1和对照2)。所有样地均为阳坡中坡位,每个样地包括3个10 m×10 m样方,相邻样方间距为50~200 m,共计84个样方。测量并记录每个10 m×10 m样方内的乔木高度和胸径,每个样方按照梅花形设置5个2 m×2 m的小样方记录灌木高度和盖度,5个1 m×1 m的小样方记录草本高度和盖度,并在每个1 m×1 m的小样方内分层(0~10、10~20 cm)采集土壤样品,合计采集土样168个。土样采集完成后立即带回实验室置于通风处风干。样地基本情况见表1。
表 1 样地基本信息
Table 1. Basic information of sample plots
样地类型 海拔/m 郁闭度 密度/(株·hm−2) 乔木高度/m 乔木胸径/cm 灌木高度/cm 灌木盖度/% 草本高度/cm 草本盖度/% T1 2 064.91±50.82 0.35±0.34 1162.50±529.69 13.67±0.47 15.50±1.93 38.82±11.90 4.06±3.60 38.72±4.28 6.14±2.00 对照1 2 118.42±48.14 0.40±0.12 1228.57±318.32 14.00±0.54 15.71±2.47 64.27±22.28 13.86±8.04 53.72±15.43 6.69±4.04 T2 2 015.30±32.91 0.40±0.06 1163.64±430.16 8.93±2.74 18.11±7.36 51.55±45.69 2.85±2.43 22.38±5.39 7.85±3.03 对照2 2 067.09±41.93 0.45±0.06 1240.00±372.02 9.40±2.33 18.71±6.30 99.35±43.03 21.03±13.87 23.25±9.25 9.40±4.68 说明:数据为平均值±标准差。 -
土壤样品风干后,通过20目土壤筛测定土壤pH,通过60目土壤筛测定土壤碳、氮、磷、钾4种元素的质量分数。土壤pH采用玻璃电极法测定(水土质量比为2.5∶1.0);土壤全碳(TC)质量分数采用燃烧-红外吸收光谱法;土壤有机碳(SOC)质量分数采用全碳分析仪测定;土壤全氮(TN) 质量分数采用微量凯氏定氮法测定;土壤碱解氮(AN) 质量分数采用连续流动分析仪(BRAN and LUEBBE AA3)测定;土壤有效磷(AP) 质量分数采用紫外可见分光光度计法测定;土壤速效钾(AK) 质量分数采用醋酸铵-火焰光度计法测定;根据全碳和全氮计算出碳氮比(C/N)。
-
采用单因素方差分析法(ANOVA)分析烧除对云南松林土壤碳、氮、磷和钾4种元素化学计量的影响,采用Spearman相关系数分析土壤养分质量分数之间及其可能影响因子的关系;采用主成分分析(PCA)探讨烧除间隔时间对土壤养分质量分数的影响;采用多因素方差分析(MANOVA)解释海拔、计划烧除、烧除间隔时间和土层深度及其交互作用对土壤养分质量分数的影响。数据统计分析和作图均采用R 4.2.3软件完成。
-
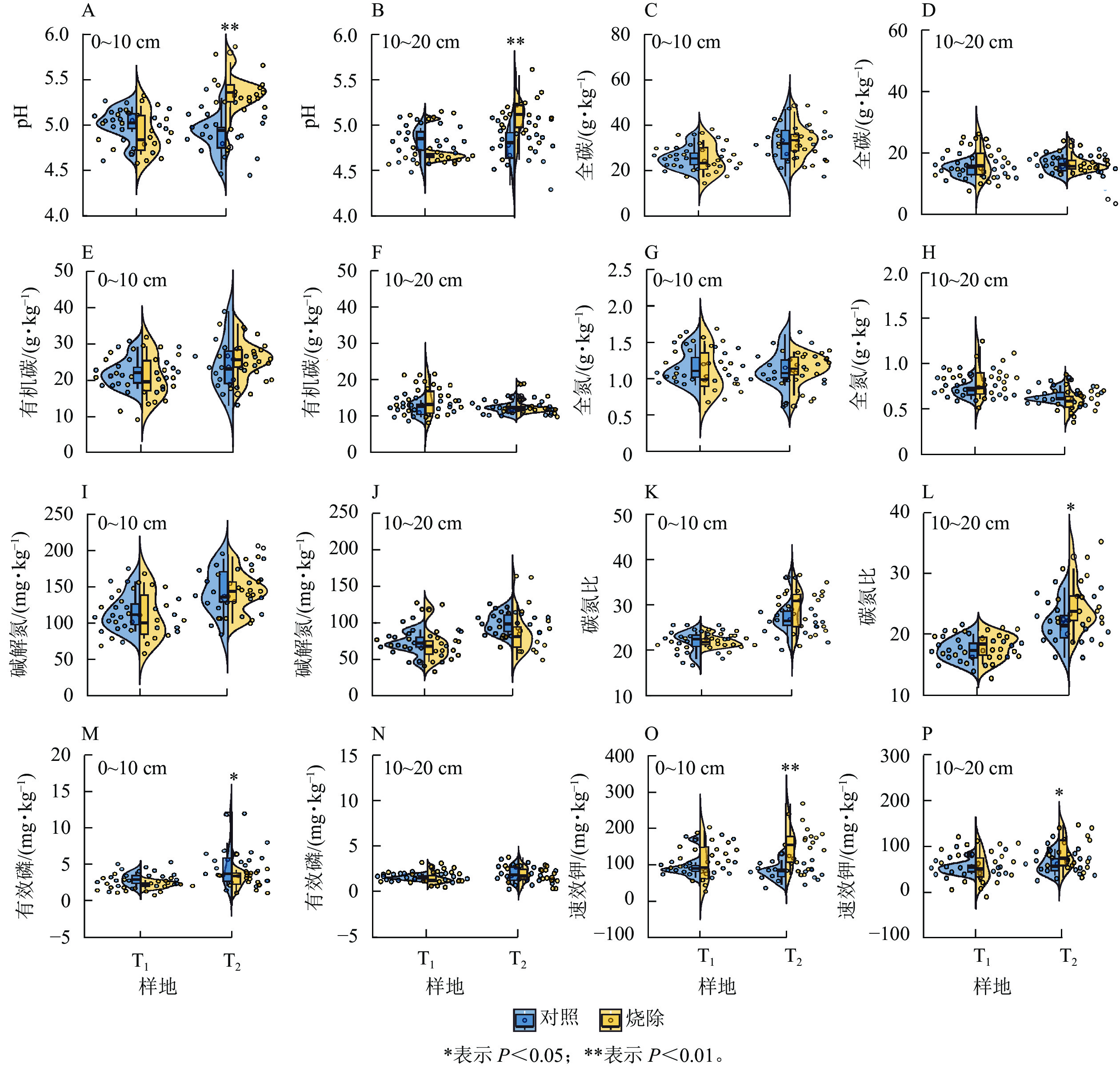
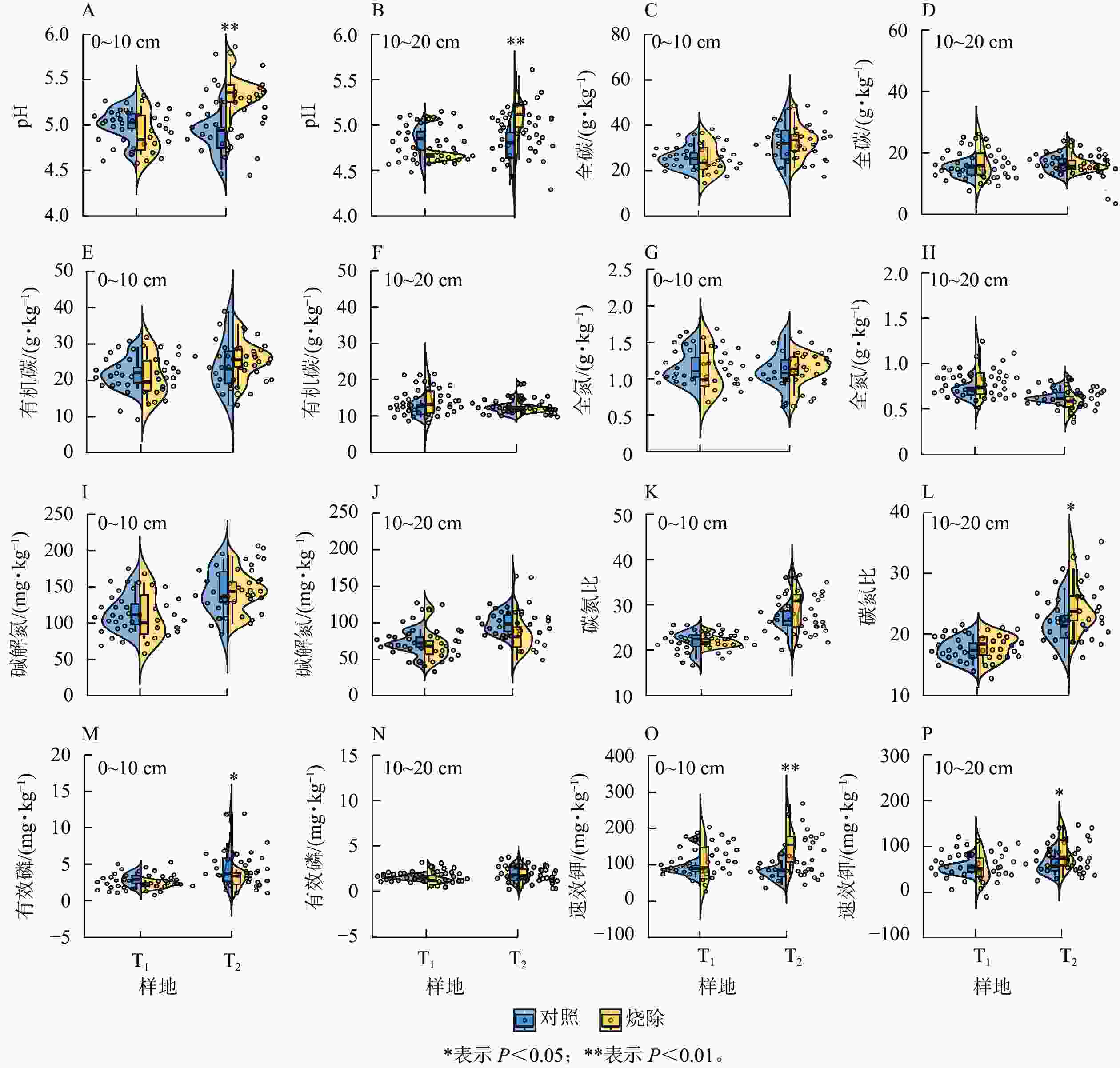
单因素方差分析表明:烧除后间隔时间对土壤pH和养分元素质量分数的影响有差异。与对照相比,T1样地0~10和10~20 cm土层的土壤pH均无显著差异,T2样地2个土层土壤pH分别极显著增加了9.42%和6.67% (图1A~B,P<0.01);T1和T2样地0~10和10~20 cm土层的土壤全碳、有机碳、全氮、碱解氮无显著变化(图1C~J),T2 样地0~10 cm土层土壤碳氮比变化不明显,T2样地10~20 cm土层土壤碳氮比显著增加了14.55% (P<0.05,图1K~L);与对照相比,T1样地0~10和10~20 cm土层土壤有效磷和速效钾质量分数均无显著差异,T2样地0~10 cm土层土壤有效磷质量分数减少了37.28% (P<0.05),0~10和10~20 cm土层土壤速效钾质量分数分别显著增加了82.23%和37.11% (P<0.05,图1M~P)。
-
土壤pH和养分元素质量分数受海拔、计划烧除、烧除后间隔时间和土层深度等因素的影响,且土壤养分元素之间存在一定的相关性(图2)。 Spearman相关系数表明:各土壤养分元素之间及其与土壤pH均呈显著正相关(P<0.05),与土层深度显著负相关(P<0.05)。
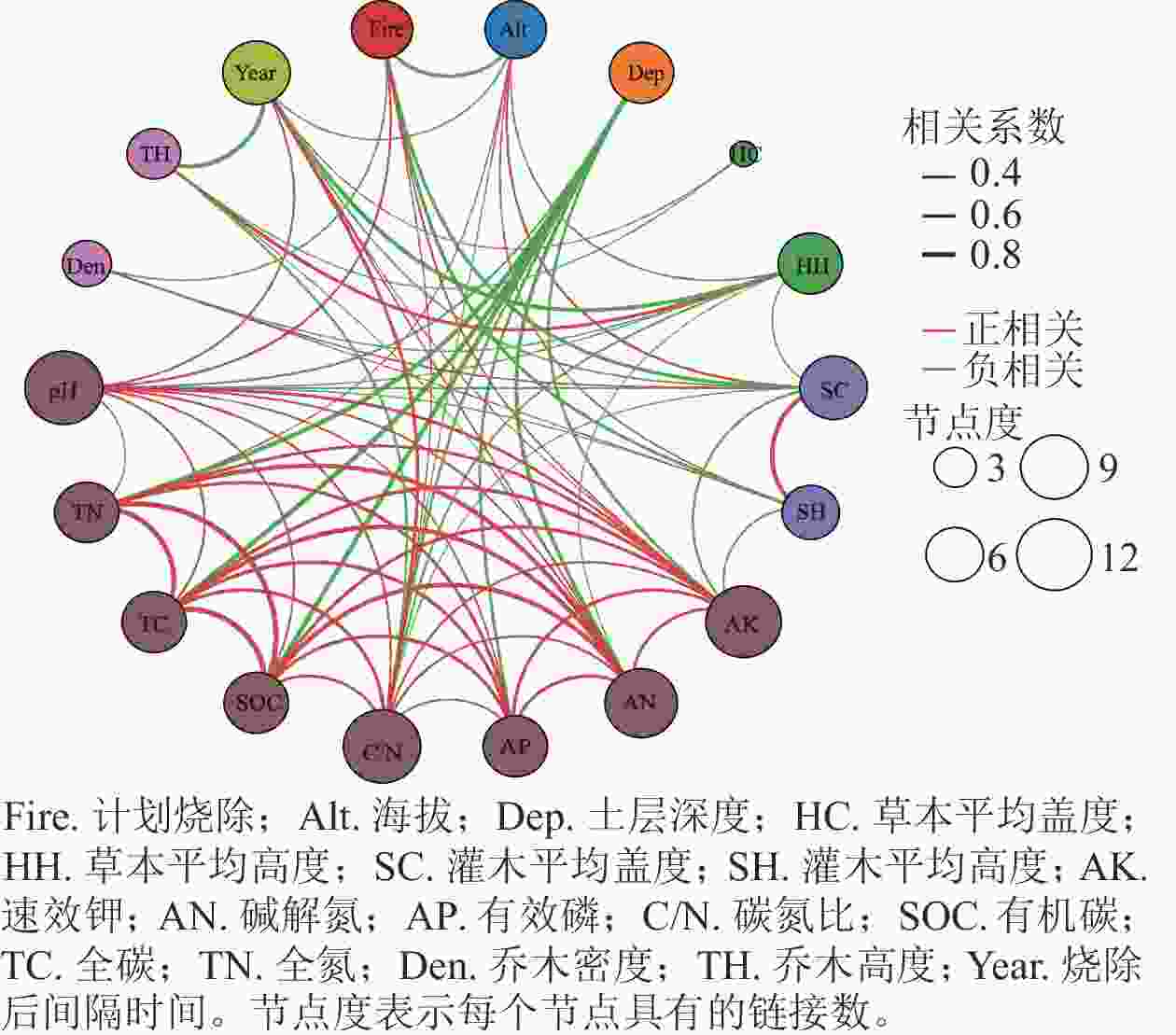
图 2 土壤pH、养分元素及潜在影响因子之间相关性
Figure 2. Relations among soil pH, nutrient and potential influencing factors
土壤各养分元素质量分数与计划烧除、植被特征、海拔、土层深度等可能影响因子的相关性有较大差异。土壤全碳和土壤有机碳仅与土层深度显著负相关(P<0.05);土壤全氮与海拔显著正相关(P<0.05),与土层深度显著负相关(P<0.05);土壤碱解氮与烧除后间隔时间显著正相关(P<0.05),与土层深度显著负相关(P<0.05);土壤速效钾与计划烧除和烧除后间隔时间显著正相关(P<0.05),与土层深度显著负相关(P<0.05);土壤有效磷与土层深度显著负相关(P<0.05)。
土壤pH与乔木高度和密度、灌草层的高度和盖度、土层深度和海拔均呈负相关,与计划烧除和烧除后间隔时间呈正相关,但仅与灌木层植物高度和盖度、草本层高度、计划烧除、烧除后间隔时间和土层深度6个因素的相关性显著(P<0.05)。
-
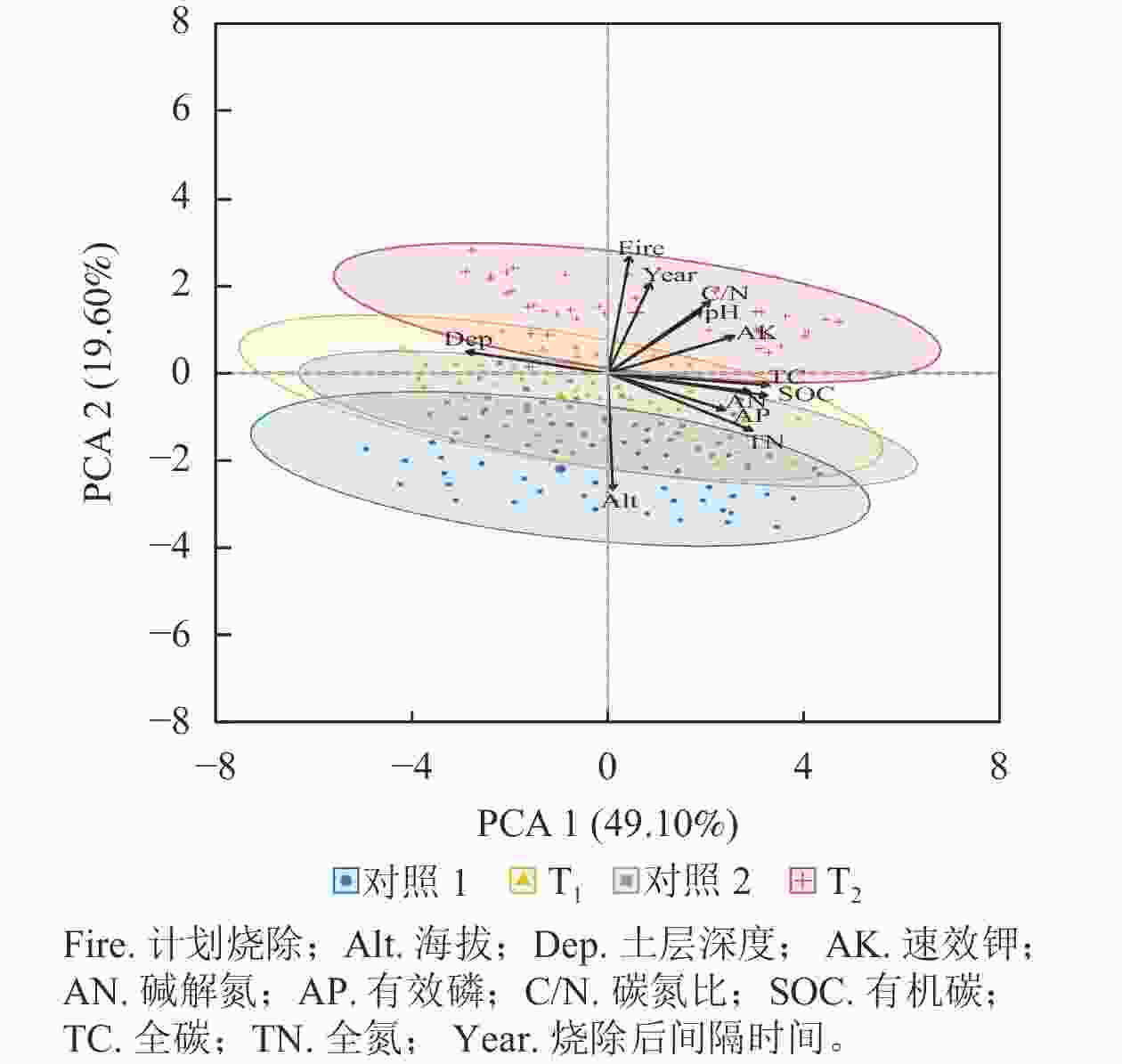
主成分分析表明:前2个轴分别解释了总方差的49.10%和19.60% (图3),土壤全碳、有机碳、全氮、碱解氮、速效钾和土层深度解释了大部分方差(表2)。土壤全碳、有机碳、全氮、碱解氮、土层深度和速效钾主要解释了第1轴的变化,烧除间隔时间、土壤全碳、土壤有机碳、土壤碱解氮、土壤有效磷与第1轴呈正相关关系,土层深度与第1轴呈负相关关系;计划烧除、海拔、烧除间隔时间和土壤碳氮比主要解释了第2轴的变化,烧除间隔时间和土层深度与第2轴存在正相关关系,土壤全碳、有机碳、碱解氮和有效磷与第2轴呈负相关关系。主成分分析同样表明:T1样地与对照样地的土壤养分质量分数几乎无差异,T2样地与对照样地的土壤养分元素质量分数有较大差异。
表 2 主成分分析前2轴各变量贡献率
Table 2. Contribution rates of variables on the first two axes of PCA
排序轴 贡献率/% 烧除后间隔时间 土层深度 pH 全碳 有机碳 全氮 碱解氮 有效磷 速效钾 碳氮比 PCA1 1.12 12.20 5.37 15.88 15.52 12.77 12.33 8.38 9.75 6.38 PCA2 15.70 0.90 7.58 0.27 0.96 6.36 0.65 2.58 2.66 9.91 -
多因素方差分析表明:计划烧除、土层深度和海拔及其交互作用对于土壤各养分元素的相对贡献有差异(表3)。土壤全碳受土层深度和烧除间隔时间的影响显著,相对贡献分别为52.80%和3.78%;土壤有机碳受土层深度和海拔及其交互作用的影响显著,其相对贡献分别为74.38%、17.62%和8.00%;土壤全氮受土层深度、海拔、烧除后间隔时间、土层深度和海拔的交互作用、烧除后间隔时间和土层深度的交互作用的影响显著,其相对贡献分别为63.37%、23.13%、1.66%、10.33%和1.51%;土壤碱解氮的显著影响因子为土层深度和烧除后间隔时间,其相对贡献分别为86.34%和17.33%;土壤有效磷的显著影响因子为海拔、土层深度、烧除后间隔时间和计划烧除,相对贡献分别为52.41%、26.77%、4.78%和2.04%,且计划烧除和土层深度及烧除后间隔时间和土层深度交互作用的影响也显著(相对贡献分别为1.91%和0.95%);土壤速效钾受土层深度和计划烧除的影响显著,相对贡献分别为71.37%和26.21%;土壤pH的显著影响因子为海拔、计划烧除、土层深度和烧除后间隔时间,相对贡献分别为52.94%、17.82%、16.07%和6.73%,因子间交互作用不明显;土壤碳氮比受烧除后间隔时间、土层深度和计划烧除的影响显著,相对贡献分别为49.67%、35.28%和13.03%,因子间交互作用不明显。
表 3 土壤养分元素主要影响因子的相对贡献
Table 3. Relative contributions of major influencing factors of soil nutrient elements
指标 相对贡献/% 计划烧除 烧除后间隔时间 土层深度 海拔 烧除后间隔时间与土层
深度交互作用土层深度与海拔
相交互作用计划烧除与土层
深度交互作用全碳 − 3.89** 52.80*** − − − − 有机碳 − − 74.38** 17.62*** − 8.00* − 全氮 − 1.66** 63.37*** 23.13** 1.51** 10.33* − 碱解氮 − 17.33*** 86.34*** − − − − 有效磷 2.04* 4.78** 26.77*** 52.41* 0.95* − 1.91* 速效钾 26.21*** − 71.37*** − − − − pH 17.82*** 6.73** 16.07*** 52.94* − − − 碳氮比 13.03*** 49.67*** 35.28*** − − − − 说明:仅列出了影响显著的各因子及其交互作用的相对贡献。−表示无显著交互作用,*表示交互作用显著(P<0.05),**表示交互作用极显著(P<0.01),***表示交互作用极其显著(P<0.001)。 -
轻度火烧对土壤的影响仅限于表层土壤[2, 26, 28−30]。本研究中计划烧除为轻度火烧,故而仅分析0~20 cm土层土壤养分元素化学计量特征对烧除的响应。本研究中云南松林实施计划烧除区域,每年烧除样地0~20 cm土层土壤pH无显著变化,而NEILL等[16]的研究表明:每年烧除显著增加了美国东北部松栎混交林土壤pH,这可能是土壤质地差异引起的。间隔3 a烧除样地0~10和10~20 cm土层土壤pH分别增加了0.46和0.32,与计划烧除对西班牙东北部松栎混交林表层土壤pH的影响相似[17]。土壤pH约0.50的差异就会影响酸性土壤养分可用性和周转[31−32]。本研究中烧除间隔1 a样地和间隔3 a样地土壤pH的变化可能不会引起养分可利用性和周转的变化。
本研究表明计划烧除间隔1 a对云南松林0~20 cm土层土壤碳、氮、磷质量分数无显著影响,这与计划烧除对美国东北部松栎混交林0~20 cm土层土壤碳、氮、磷质量分数的影响结果一致[16],但FRANCOS等[17]计划烧除显著降低了西班牙东北部松-栎混交林表层0~2.5 cm土壤碳和氮质量分数,这可能是土层深度差异造成的。本研究土壤养分质量分数与土层深度显著相关。研究区0~10和10~20 cm土层土壤碳氮比均有增加,烧除间隔3 a样地10~20 cm土层显著增加,这与NEILL等[16]和FRANCOS等[17]的研究结论相似。FRANCOS等[17]表明火后土壤碳氮比立即增加,且火后13 a碳氮比仍处于增加的状态。研究区烧除后间隔1 a样地0~10和10~20 cm土层土壤速效钾均无显著变化,间隔3 a样地0~10和10~20 cm土层的土壤速效钾均显著增加,这与ALCAÑIZ等[33]的结论相似。西班牙加泰罗尼亚森林实施计划烧除后,土壤速效钾立即增加,火后1 a土壤速效钾略有下降,火后9 a呈现增加。田荣等[26]研究表明:每年连续烧除实施半个月后,滇中云南松林土壤有机碳、全氮和有效磷显著降低,硝态氮、土壤全钾和速效钾显著增加。本研究表明:烧除1 a后云南松林土壤全碳、有机碳、全氮、碱解氮和有效磷质量分数与未烧除样地均无显著差异。
计划烧除对森林土壤养分元素和pH的影响受火烧烈度、烧除后间隔时间、气候、植被类型、海拔、土壤性质等多种因素的综合作用[34]。本研究中云南松林0~20 cm土层土壤养分元素的变化受烧除后间隔时间的影响较大。今后,将继续对研究区云南松林土壤碳、氮、磷、钾质量分数进行长期监测,综合考虑气象因素、植物生长和地形特征对计划烧除样地土壤物理和化学性质的影响,以便制定科学合理的计划烧除方案,达到既预防森林大火又能维持森林生态效益的目的。
-
本研究以云南省新平彝族傣族自治县照壁山云南松林计划烧除实施区域为例,揭示了计划烧除及烧除间隔时间对滇中云南松林土壤养分元素化学计量特征的影响。得出以下结论:计划烧除对研究区云南松林 0~20 cm土壤碳、氮、磷、钾各元素质量分数的影响受烧除后间隔时间、土层深度和海拔等因素的共同影响;相对于烧除后间隔1 a,研究区0~20 cm土层土壤各养分元素化学计量特征对烧除后间隔3 a的响应更敏感;计划烧除对土壤有效磷、土壤速效钾、土壤碳氮比和土壤pH影响显著,土壤pH与烧除后间隔时间、灌木层植物高度和盖度等因素显著相关;土壤全碳、全氮、碱解氮、速效钾、有效磷和碳氮比均与烧除后间隔时间显著相关,烧除后间隔时间是影响土壤碳氮比的最大因子,但对土壤全碳、全氮和有效磷的相对贡献均不足5%;乔灌草等植被因子与0~20 cm土层土壤碳、氮、磷、钾各养分元素化学计量特征相关性均不显著;海拔是土壤有机碳、全氮、有效磷和pH的显著影响因子,对土壤有效磷和pH的影响最大,土层深度是土壤全碳、有机碳、全氮、碱解氮和速效钾的影响最大的因子,计划烧除、烧除后间隔时间和海拔对土壤养分元素的影响均受土层深度的影响。
Effect of prescribed burning on soil nutrient content of Pinus yunnanensis forest in central Yunnan Province
-
摘要:
目的 探究计划烧除及其时间间隔对云南松Pinus yunnanensis林土壤碳氮磷钾化学计量特征的影响。 方法 以滇中地区玉溪市新平彝族傣族自治县照壁山云南松林为研究对象,分别在未烧除样地(对照)、连续每年实施计划烧除后间隔1 a样地(T1)和间隔3 a样地(T2),分层采集0~10和10~20 cm土层土壤,测定土壤碳、氮、磷、钾4种养分元素质量分数,采用方差分析、Spearman相关分析和主成分分析(PCA)探究计划烧除后不同间隔时间对滇中云南松林土壤化学计量特征的影响。 结果 与对照样地相比,T1样地的2个土层土壤pH均无显著变化,T2样地的2个土层土壤pH均极显著增加(P<0.01);T1和T2样地2个土层的土壤总碳、有机碳、总氮、碱解氮质量分数均无显著差异,T2样地的0~10 cm土层土壤有效磷质量分数显著降低(P<0.05),2个土层的土壤速效钾质量分数均显著增加(P<0.05),土壤碳氮比仅在T2样地10~20 cm土层显著增加(P<0.05)。 结论 计划烧除对研究区土壤养分质量分数的影响受烧除间隔时间和土层深度等因素的共同影响,2种烧除后间隔时间均对研究区云南松林土壤碳氮质量分数无显著影响,但对土壤pH、碳氮比、有效磷和速效钾有显著影响。图3表3参34 Abstract:Objective This study aims to analyze the impact of evaluate prescribed burning and intervals on soil chemical stoichiometry of carbon (C), nitrogen (N), phosphorus (P), and potassium (K) in Pinus yunnanensis forest. Method The study object was P. yunnanensis forest in Xinping Zhaobi Mountain, Yuxi in central Yunnan Province. Soil samples of 0 − 10 and 10 − 20 cm soil layers were collected separately from unburned plots (control), plots of 1 year after prescribed burning (T1) and plots of 3 years after prescribed burning (T2), respectively, and the mass fractions of soil C, N, P, and K were measured. The impact of prescribed burning on soil stoichiometry in P. yunnanensis forest was studied. Analysis of variance (ANOVA), Spearman’s correlation analysis and principal component analysis (PCA) were used to investigate the effects of different burning intervals on the soil stoichiometry. Result Compared with the control, there was no significant change in soil pH in both soil layers (0 − 10 and 10 − 20 cm) of T1 plot, while there was a significant increase in soil pH in both layers of T2 plot (P<0.01). In the 0 − 10 and 10 − 20 cm soil layers of T1 and T2 plots, there was no significant variation in total carbon (TC), organic carbon (SOC), total nitrogen (TN), and hydrolysable nitrogen (AN). The available phosphorus (AP) in the 0 − 10 cm soil layer of T2 plot significantly decreased (P<0.05), while the available potassium (AK) in both soil layers significantly increased (P<0.05). The soil carbon-to-nitrogen (C/N) ratio significantly increased only in the 10 − 20 cm soil layer of T2 plot (P<0.05). Conclusion The impact of the prescribed burning on the quality fraction of soil nutrients in the study area is influenced by such as factors burning interval and soil depth. Both interval time after prescribed burning has no significant impact on C and N contents of soil in P. yunnanensis forest. However, burning has a larger effect on soil pH, C/N ratio, AP, and AK. [Ch, 3 fig. 3 tab. 34 ref.] -
表 1 样地基本信息
Table 1. Basic information of sample plots
样地类型 海拔/m 郁闭度 密度/(株·hm−2) 乔木高度/m 乔木胸径/cm 灌木高度/cm 灌木盖度/% 草本高度/cm 草本盖度/% T1 2 064.91±50.82 0.35±0.34 1162.50±529.69 13.67±0.47 15.50±1.93 38.82±11.90 4.06±3.60 38.72±4.28 6.14±2.00 对照1 2 118.42±48.14 0.40±0.12 1228.57±318.32 14.00±0.54 15.71±2.47 64.27±22.28 13.86±8.04 53.72±15.43 6.69±4.04 T2 2 015.30±32.91 0.40±0.06 1163.64±430.16 8.93±2.74 18.11±7.36 51.55±45.69 2.85±2.43 22.38±5.39 7.85±3.03 对照2 2 067.09±41.93 0.45±0.06 1240.00±372.02 9.40±2.33 18.71±6.30 99.35±43.03 21.03±13.87 23.25±9.25 9.40±4.68 说明:数据为平均值±标准差。 表 2 主成分分析前2轴各变量贡献率
Table 2. Contribution rates of variables on the first two axes of PCA
排序轴 贡献率/% 烧除后间隔时间 土层深度 pH 全碳 有机碳 全氮 碱解氮 有效磷 速效钾 碳氮比 PCA1 1.12 12.20 5.37 15.88 15.52 12.77 12.33 8.38 9.75 6.38 PCA2 15.70 0.90 7.58 0.27 0.96 6.36 0.65 2.58 2.66 9.91 表 3 土壤养分元素主要影响因子的相对贡献
Table 3. Relative contributions of major influencing factors of soil nutrient elements
指标 相对贡献/% 计划烧除 烧除后间隔时间 土层深度 海拔 烧除后间隔时间与土层
深度交互作用土层深度与海拔
相交互作用计划烧除与土层
深度交互作用全碳 − 3.89** 52.80*** − − − − 有机碳 − − 74.38** 17.62*** − 8.00* − 全氮 − 1.66** 63.37*** 23.13** 1.51** 10.33* − 碱解氮 − 17.33*** 86.34*** − − − − 有效磷 2.04* 4.78** 26.77*** 52.41* 0.95* − 1.91* 速效钾 26.21*** − 71.37*** − − − − pH 17.82*** 6.73** 16.07*** 52.94* − − − 碳氮比 13.03*** 49.67*** 35.28*** − − − − 说明:仅列出了影响显著的各因子及其交互作用的相对贡献。−表示无显著交互作用,*表示交互作用显著(P<0.05),**表示交互作用极显著(P<0.01),***表示交互作用极其显著(P<0.001)。 -
[1] ALCAÑIZ M, OUTEIRO L, FRANCOS M, et al. Effects of prescribed fires on soil properties: a review [J]. Science of the Total Environment, 2018, 613: 944 − 957. [2] LIU Kezhen, SHU Lifu, HE Cheng. Effects of prescribed fire on meadow soil chemical properties in Nanwenghe Nature Reserve [J/OL]. Sustainability, 2022, 14(16): 9984[2023-06-20]. doi: 10.3390/su14169984. [3] 孙龙, 窦旭, 胡同欣. 林火对森林生态系统碳氮磷生态化学计量特征影响研究进展[J]. 南京林业大学学报(自然科学版), 2021, 45(2): 1 − 9. SUN Long, DOU Xu, HU Tongxin. Research progress on the effects of forest fire on forest ecosystem C-N-P ecological stoichiometry characteristics [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2021, 45(2): 1 − 9. [4] HE Tianhua, LAMONT B B, PAUSAS J G. Fire as a key driver of Earth’s biodiversity [J]. Biological Reviews, 2019, 94(6): 1983 − 2010. [5] ZAMUDIO D A C, GUERRA B R, VÁZQUEZ J L A, et al. Trends in global and Mexico research in wildfires: a bibliometric perspective [J]. Open Journal of Forestry, 2023, 13(2): 182 − 199. [6] ABRAM N J, HENLEY B J, GUPTA A S, et al. Connections of climate change and variability to large and extreme forest fires in southeast Australia [J/OL]. Communications Earth & Environment, 2021, 2(1): 8[2023-06-30]. doi: 10.1038/s43247-020-00065-8. [7] RICHARDSON D, BLACK A S, IRVING D, et al. Global increase in wildfire potential from compound fire weather and drought [J/OL]. NPJ Climate and Atmospheric Science, 2022, 5(1): 23[2023-06-30]. doi: 10.1038/s41612-022-00248-4. [8] RODRIGUES M, Camprubí À C, BALAGUER-ROMANO R, et al. Drivers and implications of the extreme 2022 wildfire season in southwest Europe [J/OL]. Science of the Total Environment, 2023, 859: 160320[2023-06-30]. doi: 10.1016/j.scitotenv.2022.160320. [9] RITTER S, MORICI K, STEVENS-RUMANN C. Efficacy of prescribed fire as a fuel reduction treatment in the Colorado Front Range [J]. Canadian Journal of Forest Research, 2023, 53(6): 455 − 462. [10] KEMP K B, HIGUERA P E, MORGAN P. Fire legacies impact conifer regeneration across environmental gradients in the US northern Rockies [J]. Landscape Ecology, 2016, 31(3): 619 − 636. [11] BENNETT L T, APONTE C, BAKER T G, et al. Evaluating long-term effects of prescribed fire regimes on carbon stocks in a temperate eucalypt forest [J]. Forest Ecology and Management, 2014, 328: 219 − 228. [12] PELLEGRINI A F A, AHLSTRÖM A, HOBBIE S E, et al. Fire frequency drives decadal changes in soil carbon and nitrogen and ecosystem productivity [J]. Nature, 2018, 553(7687): 194 − 198. [13] MAYER M, PRESCOTT C E, ABAKER W E A, et al. Tamm review: influence of forest management activities on soil organic carbon stocks: a knowledge synthesis [J/OL]. Forest Ecology and Management, 2020, 466: 118127[2023-06-30]. doi: 10.1016/j.foreco.2020.118127. [14] MUQADDAS B, ZHOU Xiaoqi, LEWIS T, et al. Long-term frequent prescribed fire decreases surface soil carbon and nitrogen pools in a wet sclerophyll forest of southeast Queensland, Australia [J]. Science of the Total Environment, 2015, 536: 39 − 47. [15] HINOJOSA M B, ALBERT-BELDA E, GOMEZ-MUNOZ B, et al. High fire frequency reduces soil fertility underneath woody plant canopies of Mediterranean ecosystems [J/OL]. Science of the Total Environment, 2021, 752: 141877[2023-06-30]. doi: 10.1016/j.scitotenv.2020.141877. [16] NEILL C, PATTERSON Ⅲ W A, CRARY JR D W. Responses of soil carbon, nitrogen and cations to the frequency and seasonality of prescribed burning in a Cape Cod oak-pine forest [J]. Forest Ecology and Management, 2007, 250(3): 234 − 243. [17] FRANCOS M, STEFANUTO E B, ÚBEDA X, et al. Long-term impact of prescribed fire on soil chemical properties in a wildland-urban interface, northeastern Iberian Peninsula [J]. Science of the Total Environment, 2019, 689: 305 − 311. [18] PATHAK K, NATH A J, SILESHI G W, et al. Annual burning enhances biomass production and nutrient cycling in degraded Imperata grasslands [J]. Land Degradation &Development, 2017, 28(5): 1763 − 1771. [19] ALFARO-LERANOZ A, BADIA-VILLAS D, MARTI-DALMAU C, et al. Long-term evolution of shrub prescribed burning effects on topsoil organic matter and biological activity in the Central Pyrenees (NE-Spain) [J/OL]. Science of the Total Environment, 2023, 888: 163994[2023-06-30]. doi: 10.1016/j.scitotenv.2023.163994. [20] FAJARDO-CANTOS Á, PEÑA E, de LAS HERAS J, et al. Short-term recovery of soil and pine tree canopy after late prescribed burning in a semi-arid landscape [J/OL]. Science of the Total Environment, 2023, 855: 159044[2023-06-30]. doi: 10.1016/j.scitotenv.2022.159044. [21] BINKLEY D, RICHTER D, DAVID M B, et al. Soil chemistry in a loblolly/longleaf pine forest with interval burning [J]. Ecological Applications, 1992, 2(2): 157 − 164. [22] TIAN Xiaorui, ZHAO Fengjun, SHU Lifu, et al. Distribution characteristics and the influence factors of forest fires in China [J]. Forest Ecology and Management, 2013, 310: 460 − 467. [23] 王劲, 张文文, 王秋华, 等. 云南松林下计划烧除的火行为特征[J]. 浙江农林大学学报, 2023, 40(4): 828 − 835. WANG Jin, ZHANG Wenwen, WANG Qiuhua, et al. Characteristics of fire behavior in prescribed burning under Pinus yunnanensis forest [J]. Journal of Zhejiang A&F University, 2023, 40(4): 828 − 835. [24] 杨馥羽, 陈奇伯, 黎建强, 等. 计划烧除对云南松林土壤抗蚀和抗冲性的影响[J]. 浙江农林大学学报, 2023, 40(1): 188 − 197. YANG Fuyu, CHEN Qibo, LI Jianqiang, et al. Effect of prescribed burning on soil anti-erodibility and anti-scourability of Pinus yunnanensis forest [J]. Journal of Zhejiang A&F University, 2023, 40(1): 188 − 197. [25] 王秋华, 单保君, 龚家平, 等. 滇中地区云南松纯林计划烧除研究[J]. 江西农业大学学报, 2018, 40(2): 235 − 240. WANG Qiuhua, SHAN Baojun, GONG Jiaping, et al. A study on prescribed burning in pure forest of Pinus yunnanensis franch in central Yunnan Province [J]. Acta Agriculturae Universitatis Jiangxiensis, 2018, 40(2): 235 − 240. [26] 田荣, 陈奇伯, 黎建强, 等. 计划烧除对云南松林土壤理化性质及可蚀性的影响[J]. 西北林学院学报, 2021, 36(2): 11 − 16. TIAN Rong, CHEN Qibo, LI Jianqiang, et al. Effect of prescribed burning on soil physicochemical properties and erodibility in Pinus yunnanensis forests [J]. Journal of Northwest Forestry University, 2021, 36(2): 11 − 16. [27] 付钇珊, 黎建强, 陈奇伯, 等. 计划烧除对云南松林土壤碳组分及碳库管理指数的影响[J]. 西北林学院学报, 2023, 38(4): 197 − 206. FU Yishan, LI Jianqiang, CHEN Qibo, et al. Effects of prescribed burning on soil carbon fractions and carbon pool management index in Pinus yunnanensis forests [J]. Journal of Northwest Forestry University, 2023, 38(4): 197 − 206. [28] DOU Xu, HU Tongxin, KOSTER K, et al. Temporal dynamics of soil dissolved organic carbon in temperate forest managed by prescribed burning in Northeast China [J/OL]. Environmental Research, 2023, 237: 117065[2023-06-30]. doi: 10.1016/j.envres.2023.117065. [29] SANTORUFO L, MEMOLI V, PANICO S C, et al. Early post-fire changes in properties of Andosols within a Mediterranean area [J/OL]. Geoderma, 2021, 394: 115016[2023-06-30]. doi: 10.1016/j.geoderma.2021.115016. [30] GIRONA-GARCÍA A, BADÍA-VILLAS D, MARTÍ-DALMAU C, et al. Effects of prescribed fire for pasture management on soil organic matter and biological properties: a 1-year study case in the Central Pyrenees [J]. Science of the Total Environment, 2018, 618: 1079 − 1087. [31] QUIGLEY K M, KOLKA R, STURTEVANT B R, et al. Prescribed burn frequency, vegetation cover, and management legacies influence soil fertility: implications for restoration of imperiled pine barrens habitat [J/OL]. Forest Ecology and Management, 2020, 470: 118163[2023-06-30]. doi: 10.1016/j.foreco.2020.118163. [32] HATTEN J, LILES G. A ‘healthy’ balance-the role of physical and chemical properties in maintaining forest soil function in a changing world [J]. Developments in Soil Science, 2019, 36: 373 − 396. [33] ALCAÑIZ M, OUTEIRO L, FRANCOS M, et al. Long-term dynamics of soil chemical properties after a prescribed fire in a Mediterranean forest (Montgrí Massif, Catalonia, Spain) [J]. Science of the Total Environment, 2016, 572: 1329 − 1335. [34] WANG Qingkui, ZHONG Micai, WANG Silong. A meta-analysis on the response of microbial biomass, dissolved organic matter, respiration, and N mineralization in mineral soil to fire in forest ecosystems [J]. Forest Ecology and Management, 2012, 271: 91 − 97. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230417






 下载:
下载: