-
芽孢杆菌Bacillus是一类产生耐热、耐旱,并且抗紫外线和有机溶剂的好氧细菌[1],具有在不同环境下定殖与繁殖的能力[2],同时具备抵抗真菌和病原细菌等方面的优点[2-3]。芽孢杆菌是一种理想的生防菌,所产生的拮抗物质主要有抗生素、细菌素、细胞壁降解酶、其他抗菌蛋白及挥发性等物质[4],其中脂肽类抗生素是一大类重要的拮抗物质[5]。脂肽类抗生素理化性质稳定,对高温、强酸和弱碱具有一定的耐受能力[6],对胰蛋白酶、蛋白酶K等多种蛋白酶不敏感[7],表明它是一类稳定态物质。同时脂肽类抗生素可以杀灭病原细菌、真菌和病毒,是一类抑制肿瘤生长的生物活性物质[8],成为芽孢杆菌拮抗物质领域的研究重点。因此,获得高产量的脂肽类抗生素是目前开发芽孢杆菌的主要目的,芽孢杆菌的代谢活动受到多种因素影响,如培养基、初始pH值、温度、接种量、发酵时间、通气量以及发酵工艺等[9]。探索高产量脂肽物质的最佳发酵条件需要进行大量的实验,通过对不同温度、pH值、接种量、通气等条件的试验得到优化组合。目前,主要应用重量法和液相色谱法来衡量脂肽类产量高低。而脂肽类物质定量分析前需要把该物质从发酵液中分离出来,有酸沉降法、超滤法、色谱法、液膜分离法、泡沫分离法、吸附法以及双水相法等分离方法[10],其中酸沉降法(浓盐酸沉淀法)使用最广。芽孢杆菌代谢产生的脂肽类物质产量较低,大部分低于1 000 mg·L-1,有的甚至不足100 mg·L-1[11]。重量法灵敏度较低,需要从较大量的发酵液中分离脂肽类物质,菌体分离(培养结束)和脂肽物质分离(酸沉降后)都需要进行离心,多因素探索优化条件时离心的工作量非常大。液相色谱法虽然灵敏度和准确度均较高,但需要昂贵的液相色谱仪器,色谱测定条件的摸索也费时费工,并且需要有标准样品才能进行绝对定量,而目前市场上除了表面活性素(surfactin)外没有商品化的标准样品。在优化条件时,不需要很高绝对产量的准确度,主要是比较不同培养条件脂肽物质产量相对高低。因此,简单、快捷的产量评测方法可提高工作效率。本研究试图通过测定不同初始pH值的培养基、发酵液酸沉降前后有机碳总量,计算沉降前后有机碳的差值,来推算发酵液中脂肽类粗提物含量,探索一种简单、快捷评价脂肽类物质产量的方法。同时通过测定培养基、含菌体发酵液以及去菌体发酵液的有机碳含量,来评价碳的利用效率。虽然获得脂肽类物质是酵液的最终目的,但如果能探索到一种底物碳利用效率和脂肽物质产量双高的培养条件,可节约原料成本以提高经济效益,也可减少代谢过程中二氧化碳气体排放以保护大气环境。
-
解淀粉芽孢杆菌Bacillus amyloliquefaciens WK1,菌种保藏号:CGMCC 11640,由浙江省森林生态系统碳循环与固碳减排重点实验室在-70 ℃的条件下甘油冷冻保存。
-
参考庄国宏[10]得到的解淀粉芽孢杆菌GD产脂肽类物质的优化培养基Landy:葡萄糖10.0 g,L-谷氨酸5.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,KH2PO4 1.0 g,FeSO4·7H2O 0.15 mg,MnSO4 5.00 mg,CuSO4·5H2O 0.16 mg,蒸馏水1 000 mL;马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯100 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL,自然pH值。
-
已确定菌株WK1最佳接种量为3%,最佳培养温度为37 ℃[11-12]。为了确定脂肽类物质最高产量的发酵时间,将病原菌接种到含有发酵液的平板中,观察记录病原菌生长情况。具体方法如下:①菌株WK1种子液制备:选取菌株WK1的单菌落,接种于pH 7的100 mL PDA液体培养基中,在37 ℃、摇瓶转速为180 r·min-1条件下培养14 h。②不同培养时间发酵液的制备:将WK1种子液按接种量3%(V/V)分别接种到装有100 mL PDA液体培养基的6个三角瓶中,37 ℃,180 r·min-1摇瓶培养,分别在48,60,72 h终止培养,获得不同培养时间的发酵液,将发酵液离心15 min(6 000 r·min-1)去除菌体后得上清液。③含发酵液的培养基制备:分别吸取100 mL不同时间的发酵上清液与PDA液体培养基按1:1体积比混合,加入5.0 g琼脂,115 ℃灭菌30 min后制成6个厚薄均匀的培养基。④抑制效果观察:将病原菌葡萄座腔菌Botryosphaeria dothidea单菌落打饼分别接种到混合培养基中(打饼直径为0.5 cm),放入27 ℃的真菌培养箱培养。分别在第1,2,3,4,5,10天时拍照,同时测量病原菌落直径,计算抑制率。抑制率=(对照病原菌菌落直径-处理病原菌菌落直径)/对照病原菌菌落直径×100%。
-
每个处理设置1个培养基体积为200 mL的摇瓶,用于发酵液pH值的动态监测,培养条件同1.3。分别于培养8,16,24,32,40,48,56,64,72 h时取出10 mL发酵液,用酸度计测定pH值,采样过程在超净工作台中,避免母体培养基污染。
-
在已有研究基础上,设置初始pH值分别为5,6,7的Landy培养基,以获得不同产量的脂肽物质,比较不同方法,同时检测pH值对脂肽物质产量的影响。每处理设3个重复。培养基体积为300 mL,接种3%(V菌液/V培养液),37 ℃,180 r·min-1,摇瓶72 h(从前期抑制试验得到的最佳培养时间)。摇瓶结束后,立即通过紫外灭菌以阻止芽孢杆菌继续生长繁殖,测量发酵液体积,将菌液全部离心,放到4 ℃冰箱备用。
-
吸取240 mL去除菌体的发酵液于三角瓶中,缓慢滴加浓度为6 mol·L-1的盐酸,逐渐将溶液pH值调至2以沉淀脂肽类物质,置于4 ℃冰箱过夜。准备100 mL离心管(质量为W0),分3次将液体转入100 mL的离心管,在4 500 g下离心30 min,每次离心后的上清液收集一起,用于有机碳测定;同一样品的液体转入同一离心管收集脂肽粗提物沉淀,用pH值为2的盐酸洗涤沉淀2次,以除去水溶性杂质,而后将沉淀置于-70 ℃冰箱充分冷冻,用冷冻干燥机去除水分后得脂肽类粗提物,取出放到真空干燥器内,等升至室温后称质量(W1),W1与W0的差值即为脂肽类粗提物的质量,计算得发酵液脂肽物质质量浓度。
-
脂肽类物质是芽孢杆菌代谢产生的同系物,虽然不是纯的有机化合物,但其含碳量变化不大。程敏等[11]应用液质联用技术鉴定WK1的代谢产物主要为C14~C17的芬荠素(fengycin),参考主要脂肽物质芬荠素的分子结构[13]推算出WK1的谢产物脂肽含碳率平均为0.54。因此,通过测定发酵液酸沉降(方法与重量法相同)前后的总有机碳质量浓度,计算差值可得到脂肽类粗提物质量。酸沉降前总有机碳测定,吸取2 mL去除菌体的发酵液,用去离子水稀释13倍,应用总有机碳分析仪(TOC-L CPN,津岛)测定溶液中的有机碳质量浓度。酸沉降后溶液中总有机碳测定,吸取2 mL酸沉降析出脂肽物质后上清液,用去离子水稀释13倍,同样用TOC分析仪测定溶液中的有机碳质量浓度。由于调节酸度所用的盐酸体积很小,可以忽略不计,因此,脂肽物质产量(mg·L-1)=(酸沉前有机碳质量浓度-酸沉降后有机碳质量浓度)/0.54。
-
通过脂肽物质的合成效率和二氧化碳排放损失率来间接综合评价培养基中底物碳利用效率。单位底物碳合成的脂肽类物质越多越好,而在培养过程中微生物通过好氧呼吸排放二氧化碳则越少越好。脂肽物质合成效率(mg·kg-1)=脂肽物质碳质量浓度/Landy培养基初始碳质量浓度,统一用TOC分析仪测定。二氧化碳排放量(mg·kg-1)=(Landy培养基初始碳质量浓度-含菌体发酵液的碳质量浓度)/Landy培养基初始碳质量浓度,统一用重铬酸钾法测定。
-
菌体发酵液是混浊的不透明液体,无法用TOC分析仪直接测定,因而采用重铬酸钾法测定含菌体发酵液有机碳质量浓度。72 h培养结束后,分别吸取2 mL不同处理的含菌体发酵液于硬质试管进行消煮。为了计算发酵前后培养基中有机碳的损失量,同时用重铬酸钾法测定Landy培养基初始碳质量浓度,为5 769.55 mg·L-1。
-
通过WK1对病源菌的抑制效果试验,间接确定WK1产脂肽类物质最高产量的发酵时间为72 h。对解淀粉芽孢杆菌WK1与病原菌的平板对峙培养发现,代谢产物通过破坏菌丝和孢子细胞壁、细胞膜,使细胞原生质泄露,菌丝和孢子萎缩的方式抑制山核桃干腐病原菌Bacillus dothidea的生长[11]。因此,将除菌后发酵液直接混入培养基可间接衡量代谢物的产量,通过发酵液对病原菌的抑制效果试验可确定最高产量的发酵时间。观察含有发酵液(48,60,72 h)培养基上病原菌的生长情况(图 1和表 1)发现:发酵液对病原菌生长均有抑制作用,随着培养时间的增加抑制率逐渐增加,1~5 d内抑制率增速快,抑制效果显著,5~10 d内增速变缓,甚至48与60 h共2个处理在第10天出现下降。这是因为开始接种的是单菌落病原菌,1 d时间内繁殖的数量有限,但随着时间的延长病原菌数量不断增加,而代谢产物的脂肽浓度有限,所以病原菌数量增加后抑制效果减弱。综合1~10 d的结果,WK1的发酵时间越长抑制效果越好,在72 h抑制率达到最高值,效果最为显著,培养5和10 d时的抑制率达到83.3%和84.9%,对于抗生素筛选的效果而言,已经达到较强的水平。在解淀粉芽孢杆菌HAB-7的抑菌试验中,经优化后最佳培养条件对芒果炭疽菌的抑制率达到78.3%[14]。大量研究表明[15-17]:解淀粉芽孢杆菌的最优发酵时间都在72 h以内,且在本实验中60 h的抑制率已经达80%,继续增加发酵时间对抑制率的提升不大,且会增加发酵成本。
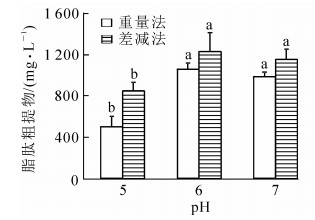
图 1 培养基不同初始pH值脂肽类物质的重量法和差减法结果比较
Figure 1. Comparison on lipopeptide production measured by weight methods and OC difference methods
表 1 不同时间PDA培养基内病原菌菌落直径平均值和抑制率
Table 1. Mean diameter and inhibition rate of pathogenic bacteria in PDA medium at different time
发酵时间/h 菌落直径/cm 1 2 3 4 5 6 10 d ck 0.5(0.0) 1.0(0.0) 2.0(0.0) 3.5(0.0) 4.8(0.0) 5.8(0.0) 8.6(0.0) 48 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.9(74.3) 1.0(79.2) 1.2(79.3) 2.1(75.6) 60 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.9(74.3) 0.9(81.3) 1.0(82.75) 1.8(79.1) 72 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.8(77.1) 0.8(83.3) 0.9(84.5) 1.3(84.9) 说明:括号中为抑菌率(%) -
初始pH值对发酵微生物的生长繁殖和代谢产物的合成有非常显著的影响。因此,选择最适合的初始pH值对微生物的培养就显得尤为重要。重量法测得不同初始pH值的培养基在72 h后脂肽物质的产量从高到低依次为pH 6,pH 7,pH 5(图 1),初始pH值为6和7条件下的脂肽物质的产量显著大于pH 5处理(P<0.05),pH值为6和7的发酵液酸沉降时沉淀明显比pH值为5的发酵液多,说明培养液pH值为5时对脂肽物质的生成不利。差减法计算得到不同处理脂肽物质产量差异规律与重量法一致,但产量比重量法高(图 1),初始pH值为5,6,7处理的差减法测定结果分别比重量法高69.9%,15.8%和17.0%。这是因为TOC能检测到溶液有机碳的微小变化,重量法则因为质量太少无法检测到微小变化,因此差减法相比重量法更加灵敏。2种方法的结果存在一定的相关性,但由于重量法的灵敏度较低,导致相关系数仅0.563 2(n=9)。
随着微生物生长繁殖脂肽类物质不断积累,微生物繁殖越多则代谢产量越多。pH值为5时产量低的原因可能是因为酸性环境不利于WK1生长。整个发酵过程中初始pH值为5的发酵液pH值始终低于6.0(图 2),而初始pH值为6和7的发酵液pH值在前24 h急速下降,之后快速回升,到48~56 h恢复到初始水平,之后继续上升,最后达8.14。发酵液pH值的下降主要是代谢过程中产生的有机酸引起的,在最初的24 h培养基中的葡萄糖被快速分解产生大量的有机酸,而之后这些有机酸又被微生物分解利用,溶液中的有机酸慢慢减少。另外,微生物的代谢过程产生氨,随着发酵过程的进行氨浓度增加,pH值逐渐回升。

图 2 不同初始pH值的Landy培养基内pH值随发酵时间的动态变化
Figure 2. Dynamics of liquid pH with increasing time of fermentation between different initial Landy medium pH
初始pH值为5处理含菌体发酵液的总有机碳质量浓度明显高于pH 6和pH 7处理(图 3),说明pH值为5条件下WK1代谢消耗最少,再次证明初始pH值为5处理不利于WK1生长。由于所有处理的初始有机碳质量浓度是相等的,微生物代谢越活跃,消耗的有机碳就越多。
-
初始pH值为5的培养基中菌株WK1脂肽物质合成效率最低(162 mg·kg-1),排放的二氧化碳也最少(205 mg·kg-1),初始pH值为6和7的培养基中菌株WK1活动排放的二氧化碳相同,显著高于初始pH值为5的处理(P<0.05),pH 6培养基中菌株WK1脂肽物质合成效率高于pH 7培养基。Landy培养基有机碳质量浓度理论值为5 769.55 mg·L-1,重铬酸钾法和TOC分析仪测得Landy培养基初始有机碳质量浓度分别为4 933.30和5 252.43 mg·L-1,分别是理论值的85.51%和90.14%,说明2种方法均不能完全检测溶液中的全部有机碳。通过分析含菌体的发酵液有机碳质量浓度(图 3)以及酸沉降前后的总有机碳质量浓度(图 4)可知:初始pH值为5条件下有机碳质量浓度显著高于其他2个处理,说明pH值为5条件下的培养基中未被微生物同化利用的碳最高。综合图 1,图 3和图 4的结果得知:初始pH值为5条件微生物代谢利用的总碳、合成的脂肽类物质、排放的二氧化碳均为最少。

图 4 不同处理发酵液酸沉降前后的总有机碳质量浓度结果比较
Figure 4. Comparison of total organic carbon in solution before and after lipopeptide being separated by acid deposition between treatments
由于重铬酸钾法和TOC法对同一溶液的测定结果存在差异,因此,计算差值时必须以同一种方法测定的结果计算。结果表明(表 2):初始pH值为5时培养基中菌株WK1脂肽物质合成效率最低(162 mg·kg-1),二氧化碳排放量也最少(205 mg·kg-1);初始pH值为6和7的培养基中菌株WK1的二氧化碳排放量相同,显著高于初始pH值为5的处理(P<0.05),但初始pH值为6的培养基中菌株WK1脂肽物质合成效率高于初始pH值为7处理,因此,初始pH值为6的培养基为最佳。由于初始pH值为6的处理二氧化碳排放量较高,后期实验可探索初始pH 5和pH 6之间菌株WK1脂肽物质合成效率的变化,有可能找到二氧化碳排放量较低,但又不影响脂肽物质合成效率的pH值。
表 2 各处理二氧化碳排放量和脂肽物质合成效率
Table 2. CO2 emission and produced lipopeptide from organic carbon medium
pH 二氧化碳排放量/(mg·kg-1) 脂肽物质合成效率/(mg·kg-1) 5 205 b 162 b 6 700 a 234 a 7 700 a 219 a 说明:不同小写字母表示处理间差异显著(P<0.05) -
解淀粉芽孢杆菌WK1获得较高产量脂肽物质的最佳培养时间为72 h,比许多已报道的芽孢杆菌长。不同细菌的生长速度不同,最佳培养时间有差异,而同样是芽孢杆菌,生长速度也存在较大差异。车晓曦等[18]得到解淀粉芽孢杆菌SAB1菌株最佳发酵时间为26 h,王帅等[19]发现枯草芽孢杆菌Bacillus subtilis G1发酵38 h时脂肽产量最高,洪鹏等[20]发现解淀粉芽孢杆菌HF-01菌株培养48 h对柑橘绿霉病菌Penicillum digitatum拮抗效果最佳。相比而言,WK1的生长速度相对较慢,获得较高脂肽产量的发酵时间为72 h,与解淀粉芽孢杆菌MH17最优发酵时间相同[21]。
初始pH值为5条件下微生物脂肽物质合成效率和二氧化碳排放量均最低,初始pH值为6与7条件下二氧化碳排放量(700 mg·kg-1)相同,但pH值为6条件下脂肽物质产量(1 228 mg·L-1培养基)和脂肽合成效率(234 mg·kg-1)最高。由此可见:WK1菌株最适初始pH值为6,而不同解淀粉芽孢杆菌菌株产脂肽最适初始pH值不同,张雷[22]对解淀粉芽孢杆菌菌株15-1-1的培养条件优化研究发现:初始pH值为7时该菌株产脂肽物质产量以及培养液D(600)值最大,陈敏等[23]在对解淀粉芽孢杆菌菌株SC1150发酵条件优化时发现最适初始pH值为6.5。
重量法与差减法测定的不同处理的脂肽物质产量规律相同,从高到低依次为pH 6,pH 7,pH 5,两者的相关系数为0.563 2(n=9),但相同初始pH值条件下差减法所得的脂肽物质产量均高于重量法。可见,差减法是评价脂肽产量的简单快速而有效的方法。
A new evaluation method of lipopeptide production and substrate carbon utilization efficiency using the WK1 strain of Bacillus amyloliquefaciens
-
摘要: 芽孢杆菌Bacillus代谢产生的脂肽类物质具有抗菌、抗肿瘤、抗病毒等多种生物活性,但芽孢杆菌脂肽产量普遍较低。探索高产量的培养条件是开发利用的重点,而简单快速的产量评价方法则可大大提高条件探索的效率。以解淀粉芽孢杆菌Bacillus amyloliquefaciens WK1为试验菌株,首先通过含发酵液培养基对病原菌的抑制实验确定最佳培养时间,然后设计初始pH值分别为5,6和7的培养基生产脂肽物质,通过测定发酵液酸沉降前后总有机碳的差值,推算脂肽类物质粗提物的产量(差减法),以传统的重量法为对照。结果表明:试验所用的解淀粉芽孢杆菌WK1菌株的最佳发酵时间为72 h。重量法与差减法所测得的不同处理脂肽物质产量差异规律相同,从高到低依次为pH 6,pH 7,pH 5,两者的相关性系数为0.563 2(n=9),但相同初始pH值条件下差减法所得的脂肽物质产量均高于重量法。初始pH值为5条件下脂肽物质合成效率和二氧化碳排放量均最低,初始pH值为6与pH值为7条件下二氧化碳排放量相同,为700 mg·kg-1,但初始pH值为6条件下产脂肽物质产量(1 228 mg·L-1)和脂肽物质合成效率(234 mg·kg-1)最高。可见,差减法是评价脂肽产量的简单快速而有效的方法。Abstract: The lipopeptide produced by Bacillus amyloliquefaciens has a variety of biological activities such as antibacterial, anti-tumor, and anti-virus; however, its production is generally very low. To explore better fermentation conditions so as to gain more lipopeptide with easy and fast evaluation methods for lipopeptide production that would greatly improve work efficiency, the yield of crude lipopeptide based on the difference of total organic carbon (TOC) in a liquid before and after lipopeptide separation was calculated using the acid deposition approach. First, optimal fermentation time for producing lipopeptide by pathogen inhibiting culture on plates containing a fermentation liquid was determined. Then, a liquid medium with pH 5, 6, and 7, for producing different concentrations of lipopeptide, was prepared. Also, CO2 emission rates for microbial activity in the pH 6 and 7 treatments were measured. Results showed that 72 hours was the optimal fermentation time. The crude yield of lipopeptide calculated from the difference of TOC in liquid before and after lipopeptide separation was positive compared to traditional weight methods with the coefficient being 0.563 2 (n=9). For both methods, pH 6 > pH 7 > pH 5. However, for the same pH of the liquid medium, crude yield was lower with weight methods than the TOC difference methods. Lipopeptide production efficiency and CO2 emissions rate with the WK1 strain were lowest for the pH 5 treatment. However, crude yield of lipopeptide (in a 1 228 mg·L-1 medium) and lipopeptide production efficiency (in a 234 mg·kg-1 OC medium) were highest at pH 6. Thus, the TOC difference method was an easy and fast method for lipopeptide production evaluation.
-
芽孢杆菌Bacillus是一类产生耐热、耐旱,并且抗紫外线和有机溶剂的好氧细菌[1],具有在不同环境下定殖与繁殖的能力[2],同时具备抵抗真菌和病原细菌等方面的优点[2-3]。芽孢杆菌是一种理想的生防菌,所产生的拮抗物质主要有抗生素、细菌素、细胞壁降解酶、其他抗菌蛋白及挥发性等物质[4],其中脂肽类抗生素是一大类重要的拮抗物质[5]。脂肽类抗生素理化性质稳定,对高温、强酸和弱碱具有一定的耐受能力[6],对胰蛋白酶、蛋白酶K等多种蛋白酶不敏感[7],表明它是一类稳定态物质。同时脂肽类抗生素可以杀灭病原细菌、真菌和病毒,是一类抑制肿瘤生长的生物活性物质[8],成为芽孢杆菌拮抗物质领域的研究重点。因此,获得高产量的脂肽类抗生素是目前开发芽孢杆菌的主要目的,芽孢杆菌的代谢活动受到多种因素影响,如培养基、初始pH值、温度、接种量、发酵时间、通气量以及发酵工艺等[9]。探索高产量脂肽物质的最佳发酵条件需要进行大量的实验,通过对不同温度、pH值、接种量、通气等条件的试验得到优化组合。目前,主要应用重量法和液相色谱法来衡量脂肽类产量高低。而脂肽类物质定量分析前需要把该物质从发酵液中分离出来,有酸沉降法、超滤法、色谱法、液膜分离法、泡沫分离法、吸附法以及双水相法等分离方法[10],其中酸沉降法(浓盐酸沉淀法)使用最广。芽孢杆菌代谢产生的脂肽类物质产量较低,大部分低于1 000 mg·L-1,有的甚至不足100 mg·L-1[11]。重量法灵敏度较低,需要从较大量的发酵液中分离脂肽类物质,菌体分离(培养结束)和脂肽物质分离(酸沉降后)都需要进行离心,多因素探索优化条件时离心的工作量非常大。液相色谱法虽然灵敏度和准确度均较高,但需要昂贵的液相色谱仪器,色谱测定条件的摸索也费时费工,并且需要有标准样品才能进行绝对定量,而目前市场上除了表面活性素(surfactin)外没有商品化的标准样品。在优化条件时,不需要很高绝对产量的准确度,主要是比较不同培养条件脂肽物质产量相对高低。因此,简单、快捷的产量评测方法可提高工作效率。本研究试图通过测定不同初始pH值的培养基、发酵液酸沉降前后有机碳总量,计算沉降前后有机碳的差值,来推算发酵液中脂肽类粗提物含量,探索一种简单、快捷评价脂肽类物质产量的方法。同时通过测定培养基、含菌体发酵液以及去菌体发酵液的有机碳含量,来评价碳的利用效率。虽然获得脂肽类物质是酵液的最终目的,但如果能探索到一种底物碳利用效率和脂肽物质产量双高的培养条件,可节约原料成本以提高经济效益,也可减少代谢过程中二氧化碳气体排放以保护大气环境。
1. 材料与方法
1.1 供试菌株
解淀粉芽孢杆菌Bacillus amyloliquefaciens WK1,菌种保藏号:CGMCC 11640,由浙江省森林生态系统碳循环与固碳减排重点实验室在-70 ℃的条件下甘油冷冻保存。
1.2 培养基配方
参考庄国宏[10]得到的解淀粉芽孢杆菌GD产脂肽类物质的优化培养基Landy:葡萄糖10.0 g,L-谷氨酸5.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,KH2PO4 1.0 g,FeSO4·7H2O 0.15 mg,MnSO4 5.00 mg,CuSO4·5H2O 0.16 mg,蒸馏水1 000 mL;马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯100 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL,自然pH值。
1.3 培养条件优化及抑制效果观察
已确定菌株WK1最佳接种量为3%,最佳培养温度为37 ℃[11-12]。为了确定脂肽类物质最高产量的发酵时间,将病原菌接种到含有发酵液的平板中,观察记录病原菌生长情况。具体方法如下:①菌株WK1种子液制备:选取菌株WK1的单菌落,接种于pH 7的100 mL PDA液体培养基中,在37 ℃、摇瓶转速为180 r·min-1条件下培养14 h。②不同培养时间发酵液的制备:将WK1种子液按接种量3%(V/V)分别接种到装有100 mL PDA液体培养基的6个三角瓶中,37 ℃,180 r·min-1摇瓶培养,分别在48,60,72 h终止培养,获得不同培养时间的发酵液,将发酵液离心15 min(6 000 r·min-1)去除菌体后得上清液。③含发酵液的培养基制备:分别吸取100 mL不同时间的发酵上清液与PDA液体培养基按1:1体积比混合,加入5.0 g琼脂,115 ℃灭菌30 min后制成6个厚薄均匀的培养基。④抑制效果观察:将病原菌葡萄座腔菌Botryosphaeria dothidea单菌落打饼分别接种到混合培养基中(打饼直径为0.5 cm),放入27 ℃的真菌培养箱培养。分别在第1,2,3,4,5,10天时拍照,同时测量病原菌落直径,计算抑制率。抑制率=(对照病原菌菌落直径-处理病原菌菌落直径)/对照病原菌菌落直径×100%。
1.4 发酵液pH值动态测定
每个处理设置1个培养基体积为200 mL的摇瓶,用于发酵液pH值的动态监测,培养条件同1.3。分别于培养8,16,24,32,40,48,56,64,72 h时取出10 mL发酵液,用酸度计测定pH值,采样过程在超净工作台中,避免母体培养基污染。
1.5 脂肽物质产量测定
在已有研究基础上,设置初始pH值分别为5,6,7的Landy培养基,以获得不同产量的脂肽物质,比较不同方法,同时检测pH值对脂肽物质产量的影响。每处理设3个重复。培养基体积为300 mL,接种3%(V菌液/V培养液),37 ℃,180 r·min-1,摇瓶72 h(从前期抑制试验得到的最佳培养时间)。摇瓶结束后,立即通过紫外灭菌以阻止芽孢杆菌继续生长繁殖,测量发酵液体积,将菌液全部离心,放到4 ℃冰箱备用。
1.5.1 重量法
吸取240 mL去除菌体的发酵液于三角瓶中,缓慢滴加浓度为6 mol·L-1的盐酸,逐渐将溶液pH值调至2以沉淀脂肽类物质,置于4 ℃冰箱过夜。准备100 mL离心管(质量为W0),分3次将液体转入100 mL的离心管,在4 500 g下离心30 min,每次离心后的上清液收集一起,用于有机碳测定;同一样品的液体转入同一离心管收集脂肽粗提物沉淀,用pH值为2的盐酸洗涤沉淀2次,以除去水溶性杂质,而后将沉淀置于-70 ℃冰箱充分冷冻,用冷冻干燥机去除水分后得脂肽类粗提物,取出放到真空干燥器内,等升至室温后称质量(W1),W1与W0的差值即为脂肽类粗提物的质量,计算得发酵液脂肽物质质量浓度。
1.5.2 差减法
脂肽类物质是芽孢杆菌代谢产生的同系物,虽然不是纯的有机化合物,但其含碳量变化不大。程敏等[11]应用液质联用技术鉴定WK1的代谢产物主要为C14~C17的芬荠素(fengycin),参考主要脂肽物质芬荠素的分子结构[13]推算出WK1的谢产物脂肽含碳率平均为0.54。因此,通过测定发酵液酸沉降(方法与重量法相同)前后的总有机碳质量浓度,计算差值可得到脂肽类粗提物质量。酸沉降前总有机碳测定,吸取2 mL去除菌体的发酵液,用去离子水稀释13倍,应用总有机碳分析仪(TOC-L CPN,津岛)测定溶液中的有机碳质量浓度。酸沉降后溶液中总有机碳测定,吸取2 mL酸沉降析出脂肽物质后上清液,用去离子水稀释13倍,同样用TOC分析仪测定溶液中的有机碳质量浓度。由于调节酸度所用的盐酸体积很小,可以忽略不计,因此,脂肽物质产量(mg·L-1)=(酸沉前有机碳质量浓度-酸沉降后有机碳质量浓度)/0.54。
1.5.3 底物碳利用效率
通过脂肽物质的合成效率和二氧化碳排放损失率来间接综合评价培养基中底物碳利用效率。单位底物碳合成的脂肽类物质越多越好,而在培养过程中微生物通过好氧呼吸排放二氧化碳则越少越好。脂肽物质合成效率(mg·kg-1)=脂肽物质碳质量浓度/Landy培养基初始碳质量浓度,统一用TOC分析仪测定。二氧化碳排放量(mg·kg-1)=(Landy培养基初始碳质量浓度-含菌体发酵液的碳质量浓度)/Landy培养基初始碳质量浓度,统一用重铬酸钾法测定。
1.6 培养基和含菌体发酵液有机碳质量浓度测定
菌体发酵液是混浊的不透明液体,无法用TOC分析仪直接测定,因而采用重铬酸钾法测定含菌体发酵液有机碳质量浓度。72 h培养结束后,分别吸取2 mL不同处理的含菌体发酵液于硬质试管进行消煮。为了计算发酵前后培养基中有机碳的损失量,同时用重铬酸钾法测定Landy培养基初始碳质量浓度,为5 769.55 mg·L-1。
2. 结果与分析
2.1 最高产量的发酵时间确定
通过WK1对病源菌的抑制效果试验,间接确定WK1产脂肽类物质最高产量的发酵时间为72 h。对解淀粉芽孢杆菌WK1与病原菌的平板对峙培养发现,代谢产物通过破坏菌丝和孢子细胞壁、细胞膜,使细胞原生质泄露,菌丝和孢子萎缩的方式抑制山核桃干腐病原菌Bacillus dothidea的生长[11]。因此,将除菌后发酵液直接混入培养基可间接衡量代谢物的产量,通过发酵液对病原菌的抑制效果试验可确定最高产量的发酵时间。观察含有发酵液(48,60,72 h)培养基上病原菌的生长情况(图 1和表 1)发现:发酵液对病原菌生长均有抑制作用,随着培养时间的增加抑制率逐渐增加,1~5 d内抑制率增速快,抑制效果显著,5~10 d内增速变缓,甚至48与60 h共2个处理在第10天出现下降。这是因为开始接种的是单菌落病原菌,1 d时间内繁殖的数量有限,但随着时间的延长病原菌数量不断增加,而代谢产物的脂肽浓度有限,所以病原菌数量增加后抑制效果减弱。综合1~10 d的结果,WK1的发酵时间越长抑制效果越好,在72 h抑制率达到最高值,效果最为显著,培养5和10 d时的抑制率达到83.3%和84.9%,对于抗生素筛选的效果而言,已经达到较强的水平。在解淀粉芽孢杆菌HAB-7的抑菌试验中,经优化后最佳培养条件对芒果炭疽菌的抑制率达到78.3%[14]。大量研究表明[15-17]:解淀粉芽孢杆菌的最优发酵时间都在72 h以内,且在本实验中60 h的抑制率已经达80%,继续增加发酵时间对抑制率的提升不大,且会增加发酵成本。
表 1 不同时间PDA培养基内病原菌菌落直径平均值和抑制率Table 1. Mean diameter and inhibition rate of pathogenic bacteria in PDA medium at different time发酵时间/h 菌落直径/cm 1 2 3 4 5 6 10 d ck 0.5(0.0) 1.0(0.0) 2.0(0.0) 3.5(0.0) 4.8(0.0) 5.8(0.0) 8.6(0.0) 48 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.9(74.3) 1.0(79.2) 1.2(79.3) 2.1(75.6) 60 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.9(74.3) 0.9(81.3) 1.0(82.75) 1.8(79.1) 72 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.8(77.1) 0.8(83.3) 0.9(84.5) 1.3(84.9) 说明:括号中为抑菌率(%) 2.2 重量法和差减法结果比较
初始pH值对发酵微生物的生长繁殖和代谢产物的合成有非常显著的影响。因此,选择最适合的初始pH值对微生物的培养就显得尤为重要。重量法测得不同初始pH值的培养基在72 h后脂肽物质的产量从高到低依次为pH 6,pH 7,pH 5(图 1),初始pH值为6和7条件下的脂肽物质的产量显著大于pH 5处理(P<0.05),pH值为6和7的发酵液酸沉降时沉淀明显比pH值为5的发酵液多,说明培养液pH值为5时对脂肽物质的生成不利。差减法计算得到不同处理脂肽物质产量差异规律与重量法一致,但产量比重量法高(图 1),初始pH值为5,6,7处理的差减法测定结果分别比重量法高69.9%,15.8%和17.0%。这是因为TOC能检测到溶液有机碳的微小变化,重量法则因为质量太少无法检测到微小变化,因此差减法相比重量法更加灵敏。2种方法的结果存在一定的相关性,但由于重量法的灵敏度较低,导致相关系数仅0.563 2(n=9)。
随着微生物生长繁殖脂肽类物质不断积累,微生物繁殖越多则代谢产量越多。pH值为5时产量低的原因可能是因为酸性环境不利于WK1生长。整个发酵过程中初始pH值为5的发酵液pH值始终低于6.0(图 2),而初始pH值为6和7的发酵液pH值在前24 h急速下降,之后快速回升,到48~56 h恢复到初始水平,之后继续上升,最后达8.14。发酵液pH值的下降主要是代谢过程中产生的有机酸引起的,在最初的24 h培养基中的葡萄糖被快速分解产生大量的有机酸,而之后这些有机酸又被微生物分解利用,溶液中的有机酸慢慢减少。另外,微生物的代谢过程产生氨,随着发酵过程的进行氨浓度增加,pH值逐渐回升。
初始pH值为5处理含菌体发酵液的总有机碳质量浓度明显高于pH 6和pH 7处理(图 3),说明pH值为5条件下WK1代谢消耗最少,再次证明初始pH值为5处理不利于WK1生长。由于所有处理的初始有机碳质量浓度是相等的,微生物代谢越活跃,消耗的有机碳就越多。
2.3 培养基底物碳的利用效率评价
初始pH值为5的培养基中菌株WK1脂肽物质合成效率最低(162 mg·kg-1),排放的二氧化碳也最少(205 mg·kg-1),初始pH值为6和7的培养基中菌株WK1活动排放的二氧化碳相同,显著高于初始pH值为5的处理(P<0.05),pH 6培养基中菌株WK1脂肽物质合成效率高于pH 7培养基。Landy培养基有机碳质量浓度理论值为5 769.55 mg·L-1,重铬酸钾法和TOC分析仪测得Landy培养基初始有机碳质量浓度分别为4 933.30和5 252.43 mg·L-1,分别是理论值的85.51%和90.14%,说明2种方法均不能完全检测溶液中的全部有机碳。通过分析含菌体的发酵液有机碳质量浓度(图 3)以及酸沉降前后的总有机碳质量浓度(图 4)可知:初始pH值为5条件下有机碳质量浓度显著高于其他2个处理,说明pH值为5条件下的培养基中未被微生物同化利用的碳最高。综合图 1,图 3和图 4的结果得知:初始pH值为5条件微生物代谢利用的总碳、合成的脂肽类物质、排放的二氧化碳均为最少。
由于重铬酸钾法和TOC法对同一溶液的测定结果存在差异,因此,计算差值时必须以同一种方法测定的结果计算。结果表明(表 2):初始pH值为5时培养基中菌株WK1脂肽物质合成效率最低(162 mg·kg-1),二氧化碳排放量也最少(205 mg·kg-1);初始pH值为6和7的培养基中菌株WK1的二氧化碳排放量相同,显著高于初始pH值为5的处理(P<0.05),但初始pH值为6的培养基中菌株WK1脂肽物质合成效率高于初始pH值为7处理,因此,初始pH值为6的培养基为最佳。由于初始pH值为6的处理二氧化碳排放量较高,后期实验可探索初始pH 5和pH 6之间菌株WK1脂肽物质合成效率的变化,有可能找到二氧化碳排放量较低,但又不影响脂肽物质合成效率的pH值。
表 2 各处理二氧化碳排放量和脂肽物质合成效率Table 2. CO2 emission and produced lipopeptide from organic carbon mediumpH 二氧化碳排放量/(mg·kg-1) 脂肽物质合成效率/(mg·kg-1) 5 205 b 162 b 6 700 a 234 a 7 700 a 219 a 说明:不同小写字母表示处理间差异显著(P<0.05) 3. 结论与讨论
解淀粉芽孢杆菌WK1获得较高产量脂肽物质的最佳培养时间为72 h,比许多已报道的芽孢杆菌长。不同细菌的生长速度不同,最佳培养时间有差异,而同样是芽孢杆菌,生长速度也存在较大差异。车晓曦等[18]得到解淀粉芽孢杆菌SAB1菌株最佳发酵时间为26 h,王帅等[19]发现枯草芽孢杆菌Bacillus subtilis G1发酵38 h时脂肽产量最高,洪鹏等[20]发现解淀粉芽孢杆菌HF-01菌株培养48 h对柑橘绿霉病菌Penicillum digitatum拮抗效果最佳。相比而言,WK1的生长速度相对较慢,获得较高脂肽产量的发酵时间为72 h,与解淀粉芽孢杆菌MH17最优发酵时间相同[21]。
初始pH值为5条件下微生物脂肽物质合成效率和二氧化碳排放量均最低,初始pH值为6与7条件下二氧化碳排放量(700 mg·kg-1)相同,但pH值为6条件下脂肽物质产量(1 228 mg·L-1培养基)和脂肽合成效率(234 mg·kg-1)最高。由此可见:WK1菌株最适初始pH值为6,而不同解淀粉芽孢杆菌菌株产脂肽最适初始pH值不同,张雷[22]对解淀粉芽孢杆菌菌株15-1-1的培养条件优化研究发现:初始pH值为7时该菌株产脂肽物质产量以及培养液D(600)值最大,陈敏等[23]在对解淀粉芽孢杆菌菌株SC1150发酵条件优化时发现最适初始pH值为6.5。
重量法与差减法测定的不同处理的脂肽物质产量规律相同,从高到低依次为pH 6,pH 7,pH 5,两者的相关系数为0.563 2(n=9),但相同初始pH值条件下差减法所得的脂肽物质产量均高于重量法。可见,差减法是评价脂肽产量的简单快速而有效的方法。
-
表 1 不同时间PDA培养基内病原菌菌落直径平均值和抑制率
Table 1. Mean diameter and inhibition rate of pathogenic bacteria in PDA medium at different time
发酵时间/h 菌落直径/cm 1 2 3 4 5 6 10 d ck 0.5(0.0) 1.0(0.0) 2.0(0.0) 3.5(0.0) 4.8(0.0) 5.8(0.0) 8.6(0.0) 48 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.9(74.3) 1.0(79.2) 1.2(79.3) 2.1(75.6) 60 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.9(74.3) 0.9(81.3) 1.0(82.75) 1.8(79.1) 72 0.5(0.0) 0.5(50.0) 0.5(75.0) 0.8(77.1) 0.8(83.3) 0.9(84.5) 1.3(84.9) 说明:括号中为抑菌率(%) 表 2 各处理二氧化碳排放量和脂肽物质合成效率
Table 2. CO2 emission and produced lipopeptide from organic carbon medium
pH 二氧化碳排放量/(mg·kg-1) 脂肽物质合成效率/(mg·kg-1) 5 205 b 162 b 6 700 a 234 a 7 700 a 219 a 说明:不同小写字母表示处理间差异显著(P<0.05) -
[1] 王晓彤, 金黎明, 宫小明, 等.枯草芽孢杆菌产生的抗菌物质的研究进展[J].轻工科技, 2018, 34(11):14-15. WANG Xiaotong, JIN Liming, GONG Xiaoming, et al. Research progress of antibacterial substances produced by Bacillus subtilis[J]. Light Ind Sci Technol, 2018, 34(11):14-15. [2] 陈中义, 张杰, 黄大昉.植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J].植物病理学报, 2003, 33(2):97-103. CHEN Zhongyi, ZHANG Jie, HUANG Dafang. Research progress on antimicrobial mechanism and genetic engineering of Bacillus for plant diseases biocontrol[J]. Acta Phytopathol Sin, 2003, 33(2):97-103. [3] 彭研, 陈相艳, 裘纪莹, 等.生防芽孢杆菌的研究进展[J].山东农业科学, 2013, 45(7):138-140. PENG Yan, CHEN Xiangyan, QIU Jiying, et al. Research progress on biocontrol Bacillus[J]. Shandong Agric Sci, 2013, 45(7):138-140. [4] 赵东洋.解淀粉芽孢杆菌SWB16脂肽类代谢产物对球孢白僵菌的拮抗作用及发酵条件的初步优化[D].重庆: 西南大学, 2014. ZHAO Dongyang. Antagonism of the Lipopeptide Metabolites Produced by Bacillus amyloliquefaciens Strain SWBl6 against Beauveria bassiana and Prelimary Optimization of Its Fermation[D]. Chongqing: Southwest University, 2014. [5] 陆雅琴, 郭丽琼, 孙丽仪, 等.芽孢杆菌P6产抗菌脂肽条件优化及发酵液性质研究[J].中国食品学报, 2018, 18(11):90-96. LU Yaqin, GUO Liqiong, SUN Liyi, et al. Condition optimization of Bacteria bacillus P6 producing antibacterial lipid and study on its physical and chemical property[J]. Chin J Food Sci, 2018, 18(11):90-96. [6] 徐杨, 王楠, 李伟, 等.海洋枯草芽孢杆菌3512A抗真菌脂肽的分离纯化及结构特性鉴定[J].中国生物防治, 2009, 25(4):328-333. XU Yang, WANG Nan, LI Wei, et al. Purification and structural identifications of the antifungal lipopeptides produced by marine bacterium Bacillus subtilis 3512A[J]. Chin J Biol Control, 2009, 25(4):328-333. [7] 龚国利, 王忠忠.短短芽孢杆菌的鉴定及其抑菌物质的初步研究[J].陕西科技大学学报, 2017, 35(4):126-131. GONG Guoli, WANG Zhongzhong. Identification of Brevibacillus brevis and preliminary study on its antibacterial substances[J]. J Shaanxi Univ Sci Technol, 2017, 35(4):126-131. [8] ONGENA M, JACQUES P. Bacillus lipopeptides:versatile weapons for plant disease biocontrol[J]. Trends Microbiol, 2008, 16(3):115-125. [9] 吴一晶, 林艺芬, 林河通, 等.生防菌解淀粉芽孢杆菌研究进展[J].包装与食品机械, 2012, 30(6):49-52. WU Yijing, LIN Yifen, LIN Hetong, et al. Adbances in the researches of biocontrol baceterial Bacillus amyloliquefaciens[J]. Packag Food Mach, 2012, 30(6):49-52. [10] 庄国宏.产抗菌脂肽GD菌株筛选及脂肽分离、鉴定与应用研究[D].扬州: 扬州大学, 2014. ZHUANG Guohong. Screening of GD Strain Producing Antimicrobial Lipopeptide and Studying on Its Separation, Identification and Application[D]. Yangzhou: Yangzhou University, 2014. [11] 程敏, 徐秋芳.解淀粉芽孢杆菌植物亚种CGMCC 11640对山核桃干腐病菌的抑制机制[J].浙江农林大学学报, 2017, 34(2):326-331. CHENG Min, XU Qiufang. Inhibitory mechanism of Bacillus amyloliquefaciens subsp. plantarum CGMCC 11640 against Botryosphaeria dothidea, the pathogen of canker disease of Carya cathayensis[J]. J Zhejiang A & F Univ, 2017, 34(2):326-331. [12] 艾嘉.芽胞杆菌发酵液中抗菌脂肽的定量检测方法及应用[D].南京: 南京农业大学, 2008. AI Jia. Quantitative Detection Method and Application of Antibacterial Lipopeptide in Bacillus cereus Fermentation Broth[D]. Nanjing: Nanjing Agricultural University, 2008. [13] 侯红漫, 靳艳, 金美芳, 等.环脂肽类生物表面活性剂结构、功能及生物合成[J].微生物学通报, 2006, 33(5):122-128. HOU Hongman, JIN Yan, JIN Meifang, et al. Structure, function and biosynthesis of cyclic lipopeptidic biosurfactants[J]. Acta Microbiol Sin, 2006, 33(5):122-128. [14] 刘文波, 熊燕红, 秦春秀, 等.解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HAB-7的培养基优化及抑菌活性[J].中国植保导刊, 2017, 37(6):5-13. LIU Wenbo, XIONG Yanhong, QIN Chunxiu, et al. Antifungal activity of Bacillus amyloliquefaciens HAB-7 and optimization of its culture medium[J]. China Plant Prot, 2017, 37(6):5-13. [15] 汪晶晶, 曹雪梅, 李欢, 等.抗菌海洋解淀粉芽孢杆菌GM-1-2菌株摇瓶发酵培养基和发酵条件优化[J].江苏农业科学, 2018, 46(8):291-295. WANG Jingjing, CAO Xuemei, LI Huan, et al. Optimization of fermentation medium and fermentation conditions for antibacterial marine Bacillus amyloliquefaciens GM-1-2 strain shake flask[J]. Jiangsu Agric Sci, 2018, 46(8):291-295. [16] 杨冬静, 赵永强, 孙厚俊, 等.解淀粉芽孢杆菌(Bacillus amyloliquefaciens)XZ-1发酵条件的优化[J].江西农业学报, 2017, 29(10):35-39. YANG Dongjing, ZHAO Yongqiang, SUN Houjun, et al. Optimization of fermentation conditions for Bacillus amyloliquefaciens XZ-1[J]. Acta Agric Jiangxi, 2017, 29(10):35-39. [17] 陈哲, 梁宏, 黄静, 等.解淀粉芽孢杆菌CM3培养基及发酵条件优化[J].山西农业科学, 2016, 44(11):1577-1583. CHEN Zhe, LIANG Hong, HUANG Jing, et al. Optimization of culture medium and fermentation conditions of Bacillus amyloliquefaciens CM3[J]. Shanxi Agric Sci, 2016, 44(11):1577-1583. [18] 车晓曦, 李社增, 李校堃. 1株解淀粉芽孢杆菌发酵培养基的设计及发酵条件的优化[J].安徽农业科学, 2010, 38(18):9402-9405. CHE Xiaoxi, LI Shezeng, LI Xiaokun. Research on the design of the medium for the Amyloliquefacien Bacillus fermentation and optimization of its fermentation condition[J]. J Anhui Agric Sci, 2010, 38(18):9402-9405. [19] 王帅, 高圣风, 高学文, 等.枯草芽孢杆菌脂肽类抗生素发酵和提取条件[J].中国生物防治学报, 2007, 23(4):342-347. WANG Shuai, GAO Shengfeng, GAO Xuewen, et al. Fermentation optimization in lipopeptide productivity of Bacillus subtilis G1[J]. Chin J Biol Control, 2007, 23(4):342-347. [20] 洪鹏, 安国栋, 胡美英, 等.解淀粉芽孢杆菌HF-01发酵条件优化[J].中国生物防治学报, 2013, 29(4):569-578. HONG Peng, AN Guodong, HU Meiying, et al. Optimizing fermentation condition for Bacillus amyloliquefaciens HF-01[J]. Chin J Biol Control, 2013, 29(4):569-578. [21] 卢彩鸽, 董红平, 张殿朋, 等.解淀粉芽胞杆菌MH71摇瓶发酵培养基及发酵条件优化[J].中国生物防治学报, 2015, 31(3):369-377. LU Caige, DONG Hongping, ZHANG Dianpeng, et al. Detection of the genes encoding lipopeptide antibiotics and biocontrol activity of Bacillus amyloliquefaciens MH71[J]. Chin J Biol Control, 2015, 31(3):369-377. [22] 张雷.解淀粉芽孢杆菌15-1-1发酵条件优化及对辣椒根腐病防治效果初探[D].哈尔滨: 东北农业大学, 2014. ZHANG Lei. Studies on Optimization of Fermentation Conditions and Biocontrol Effects Against Fusarium Solar of Bacillus amyloliguefaciens 15-1-1[D]. Harbin: Northeast Agricultural University, 2014. [23] 陈敏, 郭旭文, 李春远, 等.解淀粉芽孢杆菌SC1150的抑菌活性及其液体发酵条件的优化[J].生态科学, 2015, 34(3):7-12. CHEN Min, GUO Xuwen, LI Chunyuan, et al. Studies on fungicidal activity and liquid fermentation optimization of Bacillus amyloliquefaciens strain SC1150[J]. Ecol Sci, 2015, 34(3):7-12. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2019.06.016




 下载:
下载:

 下载:
下载:

