-
抗寒研究一直是植物抗逆性研究的热点。近年来,国内外许多学者围绕着蔬菜、果树等园艺资源和大田作物资源做了大量的研究。在观赏植物方面,有杜鹃Rhododendron spp.,月季Rose chinensis,梅花Prumus mume,地被菊Chrysanthemum morifolium,百合Lilium spp.等少量研究报道。这些抗寒研究主要集中在以下几个方面进行:植物的外部形态观察与抗寒性,生理生化变化与抗寒性,其中包括叶绿素含量,植物组织含水量,细胞膜透性,保护酶活性,渗透调节物质的含量等。彩叶芋Caladium bicolor,又名花叶芋、五彩芋,属天南星科Araceae花叶芋属Caladium,是目前流行的室内观叶植物[1]。它们的叶形、叶色及叶片各种斑纹千变万化,绚丽非凡。通常作为盆栽,也可以在园林和家庭庭院中应用,或是作为晚春或初夏的花坛植物,有很高的观赏应用价值[2]。它们原产热带,在中国大部分地区不能自然越冬,这样就大大减少了彩叶芋的观赏期,降低了彩叶芋的观赏性。因此,研究不同品种彩叶芋的抗寒性有着重要的现实意义。关于彩叶芋的抗寒性只有刘伟坚等[3]做过初步研究。本研究通过人工低温处理,观察彩叶芋生长变化,测定相关生理指标,得出综合评价,可以为彩叶芋在中国大部分地区的引种、栽培、应用提供实践依据和理论指导。
HTML
-
本试验的植物材料是漆斑彩叶芋Caladium bicolor ‘Wightii’和红艳彩叶芋Caladium bicolor ‘Postman Joyner’的组培苗。2种彩叶芋于2010年10月利用叶片进行组织培养,扩繁增殖,于2011年4月移栽驯化,放置在室内光线充足通风温暖处盆中栽植,夏天适当遮光,保持较高的空气湿度,秋天待叶片全部枯萎后,剪去地上部分,使块茎在盆土内越冬。2012年4月块茎重新萌芽,栽植3个月后采样进行抗寒性试验,此时彩叶芋植株高30 cm左右,叶片长15 cm,宽10 cm左右。选取长势良好一致的整株彩叶芋作为试验材料。试验在浙江农林大学农业与食品科学学院实验室进行。
-
将盆栽彩叶芋放进人工气候箱(宁波海曙赛福实验仪器厂PRX-250B),控温范围(0~50±0.5) ℃,设置6个温度处理:室温26 (对照ck),20,15,10,5,0 ℃的处理放在改良后的冷柜(确保处理环境与人工气候箱相似)中进行。以1 ℃·h-1·处理-1的速度降温,达到处理温度后持续3 d。光照14 h,黑暗10 h,湿度70%,光强4 800 lx。9株·处理-1,设3组重复,将每组处理后的成熟展开叶剪下,分别混匀,立刻进行各项生理生化指标的测定,设重复3次·测定-1。
-
采用电导法测定电解质外渗率,考马斯亮蓝G-250法测定可溶性蛋白质量分数,蒽酮法测定可溶性糖质量分数,酸性茚三酮法测定游离脯氨酸质量分数,氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)的活性[4]。
1.1. 试验材料
1.2. 处理方法
1.3. 相关生理生化指标测定方法
-
叶片的形态变化是植物低温伤害的直接反应[5]。本试验彩叶芋2个品种在低温胁迫下叶片形态的变化情况基本相同。在20 ℃和15 ℃胁迫时,彩叶芋叶片基本无变化,10 ℃时叶片轻度萎蔫、卷缩;5 ℃时叶片色泽加深,卷缩加重;0 ℃时叶片全部萎蔫,呈暗绿色,大面积煮熟状,严重水渍,汁液外渗。
-
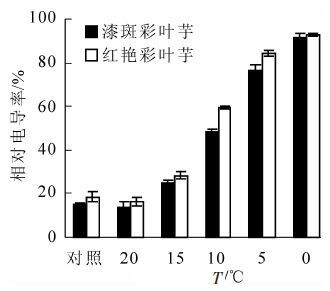
图 1表明:随着处理温度的降低,彩叶芋2个品种的相对电导率都呈现增加的趋势。在最初低温胁迫时,相对电导率上升缓慢,随后在15~5 ℃急剧上升,5 ℃后又趋于缓慢,在0 ℃达到最大值,5 ℃时2个品种的相对电导率都超过了50%,表明细胞膜被破坏的程度已经很严重。在20 ℃到0 ℃的低温胁迫过程中,红艳彩叶芋的相对电导率一直高于漆斑彩叶芋的电导率,说明红艳彩叶芋对低温比较敏感,漆斑彩叶芋对低温的适应能力强于红艳彩叶芋。经方差分析,不同低温处理和不同品种间相对电导率差异极显著(P<0.01)。多重比较分析的结果表明,20 ℃处理和对照间相对电导率差异不显著,其余各处理间的相对电导率差异极显著。
-
本试验根据测得的电导率拟合成Logistic方程:y=k/(1+ae-bt),求该方程的二阶导数并令其为0,可获得曲线拐点的t值,即半致死温度TLT50[6]。彩叶芋2个品种的Logistic方程及计算得出的半致死温度TLT50见表 1。从表中的关系式可以看出:该曲线有较好的拟合度,到达显著水平。在3 d低温胁迫下,漆斑彩叶芋和红艳彩叶芋的半致死温度分别为10.5和11.9 ℃,由此可以看:出彩叶芋的耐寒性较差,半致死温度都在10 ℃以上。
品种 t/d a b Logistic 方程 TLT50/℃ 相关系数r 漆斑彩叶芋 3 0.105 -0.214 y=100/ (1+0.105e0214t) 10.5 0.994 红艳彩叶芋 3 0.073 -0.221 y=100/ (1+0.073e0221t) 11.9 0.995 Table 1. Logistic equation of low-temperature effect electrolytic leakage of the two cultivars of Caladium bicolor
多项式也是常用的拟合曲线的方法,本试验除了用Logistic方程确定半致死温度也采用了多项式拟合曲线求拐点值的方法,得出的拐点值即半致死温度TLT50。在3 d低温胁迫下,漆斑彩叶芋和红艳彩叶芋的半致死温度分别为7.8和10.0 ℃。用多项式拟合曲线得出的半致死温度TLT50比Logistic方程计算得出的半致死温度TLT50低,更符合图 1的彩叶芋2个品种电导率变化的趋势,也与不同温度下叶片形态观察的结果吻合。
-
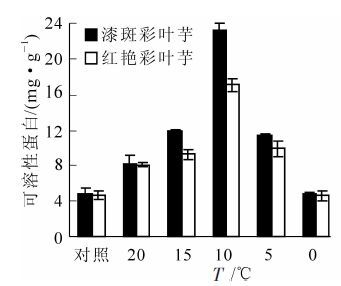
由图 2可以看出:随着温度的降低,彩叶芋2个品种叶片的可溶性蛋白质量分数都呈现先升后降的趋势,在10 ℃达到最大值,然后随温度的降低而下降。说明在开始受到低温胁迫时,可溶性蛋白质量分数增加有助于增强彩叶芋的抗寒性,漆斑彩叶芋在10 ℃胁迫3 d时,可溶性蛋白达到最大值23.29 mg·g-1。红艳彩叶芋也在10 ℃胁迫3 d时出现最大可溶性蛋白17.06 mg·g-1,之后随着胁迫加剧,可溶性蛋白下降,说明植株此时可能己经出现结构损坏。从图 2中还看出:彩叶芋2个品种可溶性蛋白的增幅不同,漆斑彩叶芋的增幅较红艳彩叶芋大,从4.87 mg·g-1增加到23.29 mg·g-1。而彩叶芋2个品种都在15~10 ℃之间可溶性蛋白增加幅度最大,说明15~10 ℃的低温对这2个品种可溶性蛋白的积累影响较大。

Figure 2. Change of the soluble protein during an artificial drop of temperature in two Caladium bicolor cultivars
经方差分析,可溶性蛋白质量分数在不同温度间的差异达到极显著水平(P<0.01),在不同品种间的差异也达到极显著水平(P<0.01)。多重比较分析表明:0 ℃处理和对照温度,5 ℃和15 ℃处理下可溶性蛋白质量分数差异不显著,其余各温度处理间的可溶性蛋白质量分数差异极显著。
-
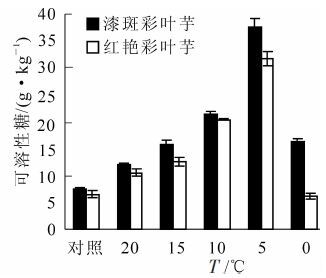
如图 3所示:随着胁迫温度的降低,彩叶芋2个品种可溶性糖均呈现先增加后降低的趋势,在5 ℃达到最大值。与对照相比,漆斑彩叶芋与红艳彩叶芋可溶性糖分别增加了393.4%和386.2%,彩叶芋2个品种都在10~5 ℃之间可溶性糖急剧增加,且漆斑彩叶芋的增加幅度较大。在5 ℃以后可溶性糖的质量分数出现快速降低的变化,说明植物此时已经出现细胞内结构损坏的可能,可能已经死亡,但是漆斑彩叶芋的可溶性糖仍然高于红艳彩叶芋。

Figure 3. Change of the soluble sugar during an artificial drop of temperature in two Caladium bicolor cultivars
经方差分析,不同温度、不同品种间可溶性糖质量分数差异均达到极显著水平(P<0.01)。经多重比较分析,0 ℃和20 ℃处理下可溶性糖含量差异不显著,其余各温度处理间的可溶性糖质量分数差异极显著。
-
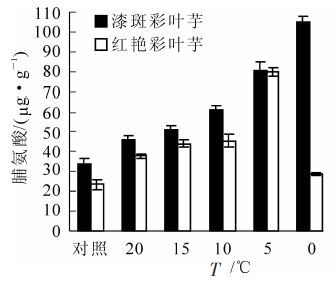
如图 4所示:在不同低温胁迫温度下,彩叶芋2个品种叶片游离脯氨酸的变化趋势不相同,漆斑彩叶芋呈现逐渐增加的趋势,在0 ℃胁迫时到达最大值105.14 μg·g-1。红艳彩叶芋呈现先增加后降低的趋势,在5 ℃胁迫时到达最大值80.11 μg·g-1。彩叶芋2个品种在低温胁迫下脯氨酸质量分数分别比对照增加了210.1%和242.2%,红艳彩叶芋脯氨酸的增加幅度大于漆斑彩叶芋。

Figure 4. Change of the proline during an artificial drop of temperature in two Caladium bicolor cultivars
经方差分析,不同低温处理和不同品种间游离脯氨酸质量分数的差异均达到极显著水平(P<0.01)。多重比较分析的结果表明10 ℃和15 ℃,15 ℃和20 ℃处理之间游离脯氨酸质量分数差异显著,其余处理之间的游离脯氨酸含量差异极显著。
-
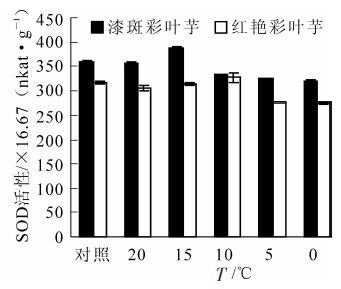
如图 5所示:随着温度的降低,彩叶芋2个品种叶片的SOD的活性总体表现出先升后降的趋势。在20 ℃胁迫时,SOD的活性低于对照组(26 ℃),可能是刚开始胁迫,植株各方面稳定性被打破,细胞内代谢发生紊乱造成的。接下来SOD活性缓慢上升,说明在降温初期,低温促使SOD活性增强,从而清除自由基,保护植物免受低温伤害。但在10 ℃以后SOD活性开始下降,可能是植物无法承受该低温,内部细胞被破坏,SOD在该温度下活性下降或者消失。

Figure 5. Change of the SOD activities during an artificial drop of temperature in two Caladium bicolor cultivars
经方差分析,不同低温处理和不同品种间SOD活性差异极显著(P<0.01)。多重比较分析的结果表明0 ℃和5 ℃之间,10 ℃,20 ℃,对照温度相互之间SOD活性差异不显著,其余处理之间SOD活性差异极显著。
2.1. 叶片形态的变化
2.2. 电导率变化
2.3. 不同品种彩叶芋叶片半致死温度(TLT50)的确定
2.4. 可溶性蛋白的变化
2.5. 可溶性糖的变化
2.6. 游离脯氨酸的变化
2.7. 超氧化物歧化酶(SOD)活性的变化
-
植物抗寒性是植物抗逆性的一个重要的指标。测定植物抗寒性的方法很多,其中相对电导率是比较常用的方法。植物在低温下最先受到伤害的是膜系统,通过相对电导率来表示植物在低温胁迫下的细胞膜透性变化[7],然后利用Logistic方程计算半致死温度,可以较为快捷、客观地评估植物的抗寒性。宋尚伟等[8]以石榴Punica granatum枝条为试验材料,进行了相对电导率的测定,得出相对电导率越小的品种抗寒性越强;反之,抗寒性越弱。本试验彩叶芋2个品种叶片相对电导率、半致死温度与抗寒性成负相关,这与其他学者的研究结论一致。另外,采用多项式拟合曲线得出的半致死温度与利用Logistic方程计算半致死温度有所不同,前者更符合各项生理生化指标的变化趋势。采用多项式拟合曲线的方法在求植物半致死温度的研究中不常用,在今后的研究中也应该适当增加这方面的内容。
可溶性蛋白与植物抗寒性的关系一方面表现在可溶性蛋白随温度的降低而增加;另一方面表现在抗寒性强的品种,具有更高的可溶性蛋白质量分数[9]。可溶性糖作为主要的渗透调节物质,在植物遭遇低温胁迫时,可溶性糖的积累可以提高细胞液的浓度,降低渗透势,增加保水能力,从而使冰点下降,保持细胞不致遇冷凝固,提高植物机体抗寒能力[10]。本试验彩叶芋叶片可溶性蛋白、可溶性糖都随着温度的降低呈现先升高后降低的趋势。在刚开始低温胁迫时,质量分数增加有助于增强彩叶芋的抗寒性,之后随着胁迫加剧,彩叶芋2个品种生理指标质量分数下降,说明植物此时可能己经出现不可逆转的伤害。和对照组相比,漆斑彩叶芋可溶性蛋白、可溶性糖的增加幅度大于红艳彩叶芋,这也和半致死温度反映出的结果吻合,漆斑彩叶芋的抗寒性大于红艳彩叶芋。
脯氨酸与植物抗寒性的关系尚不统一。一种观点认为脯氨酸的累积与植物抗寒性之间有一定的相关性,随着温度的降低,游离脯氨酸呈明显增加趋势;另一种观点与此相反,认为脯氨酸的累积与抗寒性无关[11]。杨惠等[12]研究陕西核桃Juglans regia栽培品种优系的抗寒性,发现大部分品种优系的游离脯氨酸随温度的变化先增大后减小,抗寒能力较强的品种优系最大值远高于其他品种优系。本试验彩叶芋2个品种游离脯氨酸的变化不尽相同,总体是随着温度的降低呈现增加的趋势,但是在10~5 ℃胁迫时,漆斑彩叶芋的游离脯氨酸继续上升,而红艳彩叶芋下降,并且红艳彩叶芋脯氨酸的增加幅度大于漆斑彩叶芋,这和其他指标呈现的变化不同。因此,笔者认为脯氨酸质量分数的变化与植物抗寒性的关系还值得进一步研究。
超氧化物歧化酶(SOD)是植物体内重要的保护酶,它可以清除超氧阴离子自由基,防止膜脂的过氧化[13]。司剑华等[14]在研究5种柽柳Tamarix 的抗寒性中发现各低温胁迫的5种青海柽柳植物的SOD活性都显著高于对照。本试验彩叶芋2个品种叶片SOD活性的变化趋势基本相同,都是在胁迫开始阶段先降低,然后上升,表明其对低温有一个适应过程,植物体内SOD活性增强起到保护的作用。但是温度进一步降低,超过了一定的范围,植物发生不可逆转的伤害,细胞死亡,SOD失活。
彩叶芋2个品种各个生理指标在低温胁迫下的变化趋势和前人研究的植物抗寒性生理指标变化趋势基本相同[15-16]。根据各个指标的方差分析结果,各个指标在不同温度和不同品种间的差异都达到了极显著水平。
综合比较以上5个抗寒指标,我们可以初步得出漆斑彩叶芋的抗寒性大于红艳彩叶芋的结论。另外,本试验研究的是彩叶芋组培苗的抗寒性,组培苗与块茎繁殖的苗在营养状况和抗性上都有所不同,比刘伟坚等[3]用块茎繁殖的苗抗寒性差。同时刘伟坚等采用经过一个完整生长季节,已进入秋季的苗进行抗寒性试验,彩叶芋叶片已积累了较多的养分,植株已为进入自然越冬阶段做好准备,而本研究采用7月刚进入旺长期的植株,叶片水分高,养分积累较少,抗寒性偏弱。同时,值得注意的是植物的抗寒性受环境的影响较大,在自然界中的生长受到多种环境因子和生物因子的综合作用,该试验是在人工模拟低温的条件下进行抗寒性研究,是以理想气候条件为前提,因此,还应该结合自然环境下彩叶芋的生长情况进行综合考虑。










 DownLoad:
DownLoad: