-
无患子Sapindus mukurossi属于无患子科Sapindaceae无患子属Sapindus,是一种非常有潜力的经济树种,其果可以用来制作洗涤剂,种仁能提取生物柴油,树形美观,可用于园林观赏等。日本、法国、中国台湾等对其蕴含的经济价值有一定的开发利用,而中国大陆虽早在几百年前就已对其有初步利用,但深度开发这方面却尚在起步阶段[1-3]。目前,对无患子的研究主要集中在生物学特性、繁殖技术[1, 4]、化学成分和分离提取技术及其利用价值的开发研究[5-7]等方面,而在分子生物学方面的研究报道不多[8-9]。分子标记技术是研究种质资源遗传背景的重要手段,2001年美国加州大学蔬菜作物系Li与Quiros博士提出了一种新型的基于聚合酶链式反应(PCR)的标记方法的相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)标记方法[8, 10]。该标记通过独特的双引物设计对基因的ORFs(open reading frames)的特定区域进行扩增。与其他分子标记相比,该方法具有简单高效、多态性高、重复性较好等特点,并已成功应用于多种蔬菜、经济树种的种质资源分析中[5-7, 11-13]。但在无患子的遗传多样性以及种质鉴定等方面还鲜见报道。为此,本研究以无患子叶片为材料,采用单因素优化的方法建立无患子SRAP-PCR的最佳反应体系,旨在为不同地理种源无患子的遗传多样性分析、亲缘关系鉴定、遗传图谱构建、遗传改良等奠定基础。
HTML
-
试验材料采于福建顺昌无患子种源收集区,共12个种源地36份种质材料。本优化试验以福建南平种源地的基因组DNA为试验材料。
-
试验中所用的三磷酸碱基脱氧核苷酸(dNTP)s,TaqDNA酶,琼脂糖和DNA 标记物均购自上海生工生物工程有限公司,其中100 bp 标记物是加DNA 梯度。所用的SRAP引物序列由上海生物工程(上海)股份有限公司合成,其序列参照Li等[10]和Ren等[14]的方法。
优化试验引物选用me2-em7组合,体系验证引物选用me2-em7和me6-em1,序列具体如表 1。
引物名称 引物序列 me2 5′-TGAGTCCAAACCGGAGC-3′ me6 5′-TGAGTCCAAACCGGTAA-3′ em1 5′-GACTGCGTACGAATTAAT-3′ em7 5′-GACTGCGTACGAATTCAA-3′ 说明:me2和me6为正向引物; em1和em7为反向引物。 Table 1. Primer sequence
-
无患子总DNA提取采用改良的十六烷基三甲基溴化铵(CTAB)法[15-16]。DNA的浓度和纯度,分别用质量浓度为1%的琼脂糖凝胶电泳和紫外分光光度计分析检测。样品稀释至10 μg·L-1后,置-20 ℃冰箱保存备用。
-
SRAP-PCR基本反应体系:在20.0 μL总体积中,含2.0 μL 10×PCR 缓冲液(free Mg2+),2.0 mmol·L-1 镁离子(Mg2+),0.2 mmol·L-1 dNTPs,2.0×16.67 nkat(2.0 U) TaqDNA聚合酶,正反引物各0.5 μmol·L-1,用双蒸水补足至20 μL。
SRAP-PCR扩增程序为:94 ℃预变性3 min;94 ℃变性l min,35 ℃复性l min,72 ℃延伸l min;共5个循环。随后94 ℃变性l min,50 ℃复性1min,72 ℃延伸l min,共35个循环;最后72 ℃延伸10 min。PCR仪为ABI梯度PCR仪。
本试验采用单因素法对反应体系进行优化,分别调整模板DNA,镁离子,dNTPs,引物,TaqDNA聚合酶各因子的用量(表 2)。
水平 DNA用量/ng 镁离子浓度/ (mmol • L-1) dNTPs 浓度/ (mmol • L-1) TaqDNA/ (×16.67 nkat) 引物浓度/ (μmol • L-1) 1 10 1.00 0.05 0.5 0.2 2 20 1.25 0.10 0.6 0.3 3 30 1.50 0.15 0.7 0.4 4 40 1.75 0.20 0.8 0.5 5 50 2.00 0.25 0.9 0.6 6 60 2.25 0.30 1.0 0.7 7 70 2.50 0.35 1.2 0.8 8 80 2.75 0.40 1.5 0.9 9 90 3.00 0.45 2.0 1.0 10 100 Table 2. Reaction system in each factor level
-
将PCR产物与上样缓冲液混合后于质量分数为1.5%琼脂糖凝胶上电泳,用溴化乙锭(EB)染色后,在凝胶成像系统(AlphaImager HP)上观察。
1.1. 材料来源
1.2. 主要试剂
1.3. 无患子总DNA的提取
1.4. 反应体系的优化
1.5. PCR产物的检测
-
无患子叶片内富含多酚、多糖、蛋白质及其他次生代谢物质[14],操作时易发生褐变,干扰DNA的提取,这些物质若残留在DNA样品中将会严重影响PCR的效果,导致DNA的酶切、扩增失败,对后续试验研究的开展有很大的影响。本研究采用改良的CTAB法,成功提取出质量较高的基因组DNA,条带较为清晰、完整、无拖尾,符合SRAP分子标记对DNA质量的要求(图 1)。
经紫外分光光度计测定,其D260/D280为1.2~2.2(表 3),经纯化均能达到1.8左右的比值。所有样品质量浓度均大于430 μg·L-1,在SRAP分析中可获得较为清晰、稳定的扩增结果产物。
序号 产地 D260 D280 D310 D260/D280 DNA质量浓度 (μg·L-1) 1 广西钦州 0.121 0.089 0.056 1.361 605.0 2 福建南平 0.149 0.116 0.081 1.285 745.0 3 福建清流 0.158 0.104 0.05 1.515 790.0 4 福建三明 0.319 0.157 0.008 2.030 1 595.0 5 福建漳州龙海 0.342 0.160 -0.006 2.134 1 710.0 6 福建顺昌高阳 0.219 0.119 0.026 1.834 1 095.0 7 浙江杭州 0.149 0.097 0.043 1.534 745.0 8 江西樟树 0.164 0.089 0.013 1.835 820.0 9 福建顺昌 0.086 0.043 0.002 1.983 430.0 10 印度 0.156 0.113 0.065 1.377 780.0 11 福建永安 0.130 0.088 0.045 1.486 650.0 12 印度(林科院) 0.118 0.085 0.046 1.379 590.0 Table 3. Concentration detection of total genomic DNA from 12 different Sapindus mukurossi provenances
-
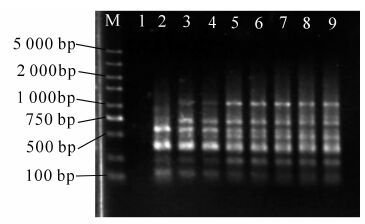
本试验设定了10个用量梯度(10~100 ng),研究不同模板DNA用量对PCR扩增的影响。模板DNA使用量在设定范围内,都能扩增出几乎相同的清晰条带(图 2)。10 ng时条带比较模糊;70~100 ng时,条带较淡、呈波浪状,20~60 ng时主带比较清晰。DNA较长时间保存会部分降解,致使有效含量降低。考虑到试验时间较长,为避免DNA降解对试验结果的影响,最终选择50 ng作为模板优化用量。
-
镁离子浓度对PCR扩增影响较大。镁离子浓度过高时,TaqDNA聚合酶催化非特异性扩增,降低反应的忠实性;反之,镁离子浓度过低时,则又会使TaqDNA聚合酶的活性下降,反应产物减少。当镁离子浓度为1.00 mmol·L-1时,未扩增出条带;当Mg2+浓度为1.25~1.75 mmol·L-1时,条带模糊,出现缺失现象;当镁离子浓度为2.00~2.50 mmol·L-1时,扩增带型基本一致;当镁离子浓度增至2.75,3.00 mmol·L-1时,条带呈弥散趋势(图 3)。高浓度镁离子易产生非特异性产物,为避免高浓度镁离子对后续试验的影响。本研究最终选择2.00 mmol·L-1作为镁离子的优化浓度。
-
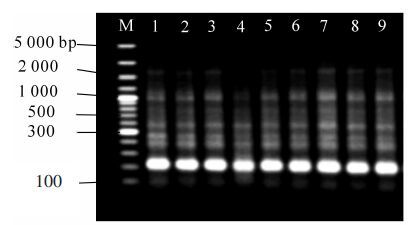
dNTPs对SRAP-PCR反应有极其重要的作用,dNTPs浓度过高会增加DNA聚合酶的错配率,而浓度过低又会降低产量。dNTPs浓度为0.05~0.15 mmol·L-1时,条带较少且模糊,0.20~0.25 mmol·L-1时条带较为清晰,在0.30~0.45 mmol·L-1时条带又开始模糊,最终确定0.20 mmol·L-1为dNTPs的优化浓度(图 4)。
-
TaqDNA聚合酶的用量与反应体积、酶活性等因素有关。一般酶用量过多会使非特异性增加、弥散背景增强,用量过少则会降低产量,使条带不够明亮。当TaqDNA聚合酶用量为0.5×16.67 nkat(0.5 U)和1.0×16.67 nkat(1.0 U)时,条带均较多,但0.5×16.67 nkat(0.5 U)时,条带亮度更佳;当TaqDNA聚合酶用量(0.6~0.9)×16.67 nkat(0.6~0.9 U)时,条带较少;当TaqDNA聚合酶用量为(1.2~2.0)×16.67 nkat(1.2~2.0 U)时,条带少(图 5)。综上,当TaqDNA聚合酶用量为0.5×16.67 nkat(0.5 U)时,扩增效果最理想,以此作为TaqDNA聚合酶的优化用量。
-
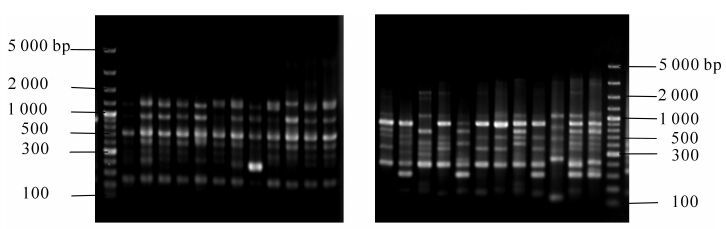
引物过多会产生引物二聚体,引物过低则降低产量。在设定的引物浓度范围内,PCR产物量基本相同(图 6)。当引物浓度为0.2~0.4 μmol·L-1有较清晰、一致的条带,且0.4 μmol·L-1时,条带较亮;当引物浓度为0.5~1.0 μmol·L-1开始条带渐变弱,扩增效果不佳,均较模糊。综上,选择0.4 μmol·L-1作为引物的优化浓度。
-
本研究用引物组合m2e7和m6e1在无患子材料中进行SRAP-PCR优化反应体系验证,扩增结果比较稳定、条带清晰(图 7),且引物组合m6e1扩增出的多态性条带较引物组合m2e7多,表现出更高的多态性。由此说明,该体系适宜无患子SRAP-PCR反应。
通过对反应体系的验证,从结果的稳定性和经济性出发,确立了适合无患子的SRAP-PCR反应体系为:在20 μL反应体系中,含模板DNA为50 ng,镁离子 2.0 mmol·L-1,dNTPs 0.2 mmol·L-1,TaqDNA聚合酶0.5×16.67 nkat(0.5 U),引物0.4 μmol·L-1。
2.1. 无患子基因组DNA检测
2.2. 模板DNA对PCR扩增的影响
2.3. 镁离子浓度对PCR扩增的影响
2.4. dNTPs浓度对PCR扩增的影响
2.5. TaqDNA聚合酶用量对PCR扩增的影响
2.6. 引物浓度对PCR扩增的影响
2.7. SRAP-PCR反应体系的确立
-
SRAP标记是一种基于PCR的新型分子标记技术,具有以下优点:①有一套通用引物,可任意搭配,通过筛选获取适合引物对,极大降低了引物合成费用。②反应条件相对固定,试验重复性较好,操作简易。因此,在林木种质资源遗传多样性、品种鉴定等方面应用前景广阔[17-19]。
SRAP-PCR反应体系主要包含5个影响因素,即DNA模板、镁离子、dNTPs、引物和TaqDNA聚合酶。各个因素用量不同,将明显影响扩增效果,进而影响SRAP分子标记的可靠性。高质量DNA的获取是PCR成功的根本性因素,DNA中残留的蛋白、酚类等物质,会抑制DNA聚合酶。本研究中,采用改良的CTAB法提取了较高质量的DNA,符合SRAP-PCR反应要求。
PCR混合物中,DNA模板、引物和dNTPs的磷酸碱基均可与镁离子结合,降低镁离子的实际浓度;而对TaqDNA聚合酶起作用的是游离的镁离子,因此,镁离子加入量应高于dNTPs[13]。本试验中,镁离子浓度比dNTPs 高出1.8 mmol·L-1。PCR扩增产物的大小是由引物限定的,引物浓度过高,不仅会促进非特异性产物的合成,而且还会增加引物二聚体的形成,本研究最终选择0.4 μmol·L-1作为引物的优化浓度。
本试验采用传统的单因素法,确立了适合无患子的SRAP-PCR反应体系。利用该体系对12个种源地的无患子进行扩增,得到了稳定清晰的条带,效果良好,说明优化后的体系适宜无患子种质资源的分子标记分析,但需对SRAP引物进行筛选。SRAP-PCR优化体系的建立,为SRAP分子标记在无患子地理种源多态性分析、遗传图谱构建、品种鉴定等方面打下良好的基础。

















 DownLoad:
DownLoad: