-
楠木自古以来被誉为江南四大名木之首,国家二级保护植物,主要包括樟科Lauraceae润楠属Machilus和桢楠属Phoebe植物,多为高大乔木,树干通直,树型优美,且具有驱虫等功效,深受人们喜爱,是中国重要的景观树种和经济树种[1-2]。炭疽病是近年来危害楠木健康的主要病害之一,侵染叶片边缘、叶尖,病斑呈灰褐色至暗褐色,枝部感染处为黑褐色,病健交界处明显。此前学者在广西南宁市良凤江国家森林苗圃基地和博白县林业科学研究所,以及广东省肇庆市北岭山珍贵树种种植基地调查发现该病害发生严重[3-4]。目前,关于楠木炭疽病防治研究相对较少,且仅限于病原菌鉴定及其发病规律,植物诱导抗性用于楠木病害防治未见报道。化学防治是林业病害防治中最快速、有效的方法。然而,重复使用化学杀菌剂已经导致许多问题,如抗药性、环境污染、化学残留等。植物抗病性是利用植物自身的免疫性来对抗病原物的侵染,是近年来的研究热点。很多研究证明通过天然或化学合成物等可以诱导植物产生抗性,抵抗病原物入侵,从而达到防治效果。水杨酸(SA)是一种内源性激发子,是信号传导系统中的重要组成部分,参与调控植物生理生化等过程[5-6]。水杨酸可以诱导植物局部获得性抗性和系统获得性抗性(SAR)[7-9],在1979年对感染花叶病毒(TMV)的烟草Nicotiana tabacum 栽培种Xanthi-NC研究中首次证明[10],随后人们通过大量实验对水杨酸可以提高植物的抗病性加以验证,如山茶Camellia japonica灰斑病[11]、桉树Eucalyptus焦枯病[12]、油茶C. oleifera炭疽病[13]等。本研究分析了SA对楠木炭疽病的诱导抗性,测定可溶性蛋白质、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的变化来探究其作用机理,旨在为病害防治提供依据。
HTML
-
紫楠Phoebe sheareri又名紫金楠、金丝楠等,由建德市欣林林木服务中心提供,为2年生盆栽苗。供试菌株胶孢炭疽菌Colletotrichum gloeosporioides由浙江农林大学森林保护学科菌种储存室提供。
-
配制质量浓度为500、200、100、50 mg·L−1水杨酸溶液(pH 6.8)进行喷雾试验,约30 mL·株−1,1 d后重复喷洒,并设置无菌水对照。5 d后采集叶片,选择心叶下完全展开的功能叶片,用灭菌剪刀取样,样品成熟度保持一致。每处理3株,4次重复。采用孢子悬浮液进行离体刺伤接种,以不刺穿叶片为宜。于25 ℃下12 h光照12 h黑暗保湿培养,7 d后统计叶片发病情况,采用网格法测病斑面积,重复3次取平均值,计算病斑减小率。病斑减小率 = (对照处理病斑面积−诱导处理病斑面积)/对照处理病斑面积×100%
-
选取长势良好大小一致的2年生紫楠植株,配置SA的最终质量浓度为500、200、100、50 mg·L−1,均匀喷洒于植株上,以溶液布满叶片不流下为宜。以无菌水喷洒作为对照,1 d后重复喷洒,使植物充分吸收,5 d后采集长势均一的成熟叶片进行生理测定,包括可溶性蛋白质、SOD、POD、CAT,每处理3次重复。可溶性蛋白质采用紫外吸收法测定[14]。取紫楠叶片0.5 g,按照1∶9的体积比加入9倍体积0.1 mol·L−1磷酸缓冲液(pH 7),5 000 r·min−1离心10 min,上清液为蛋白质提取液。取蛋白质原液0.5 mL稀释至5 mL,利用紫外分光光度计测取280 nm及260 nm处的光密度D(280)和D(260),以pH=7.0磷酸缓冲液进行空白调0。蛋白质质量浓度(g·L−1)=1.45×D(280)−0.74×D(260)。其中1.45和0.74为校正值。SOD活性测定:本研究通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基,氧化羟胺形成子纠缠亚硝酸盐,在显色剂的反应下呈现紫红色,根据南京建成生物工程研究所测试盒步骤进行测定,用可见光分光光度计测其光密度。组织中SOD活力定义:每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位(1 U=16.67 nkat)。SOD活力(16.67 nkat·g−1)=[(对照光密度−测定光密度)÷对照光密度]÷50% ×反应液总体积(mL)÷取样量(mL)÷匀浆液浓度(kg·L−1)。CAT活性测定:CAT分解过氧化氢(H2O2)的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,按照南京建成生物工程研究所测试盒处理结果在405 nm处测定其变化量,可计算出CAT的活力。CAT活力定义:每毫克组织蛋白每秒种分解1 μmol的H2O2的量为1个活力单位。CAT活力(16.67 nkat·g−1)=(对照光密度−测定光密度)×271÷60÷取样量(mL)÷匀浆液浓度(kg·L−1)。POD活性测定:过氧化氢酶可催化过氧化氢反应,根据南京建成生物工程研究所测试盒测定420 nm处可见光光密度变化来计算酶活性。组织中POD活力定义:在37 ℃条件下,每毫克组织蛋白每分钟催化1 μg底物的酶量定义为一个活力单位(1 U=16.67 nkat)。POD活力(16.67 nkat·g−1)=[(对照光密度−测定光密度)÷(12×1 cm比色光径)]×反应液总体积(mL)÷取样量(mL)÷反应时间(30 min)÷匀浆液浓度(kg·L−1)×1 000。
-
为确定SA对孢子萌发是否有影响,配置含SA的最终质量浓度为0、50、100、200、500 mg·L−1的楠木炭疽病病原菌孢子悬浮液,采用凹玻片萌发法[14],调节pH至6.8进行25 ℃全黑暗保湿培养,每处理3次重复,12 h后观察孢子萌发情况,计算孢子萌发率。孢子萌发率 = 已萌发孢子数/观察孢子总数×100%;
-
根据质量浓度诱导结果,选用最适宜质量浓度SA进行喷雾处理,1 d后重复喷施,对照为等量无菌水。本实验共设置4个处理:在第2次SA处理2 h后活体接种(A);SA处理不接种(B);无菌水处理并接种(C);无菌水处理不接种(ck)。每处理3株,4次重复。采用孢子悬浮液针刺接种,脱脂棉保湿处理。不同处理在第2次SA或无菌水喷施后1、2、3、5、7、10、15 d采集生长状况一致的叶片,于−80 ℃冰箱保存备用,进行后续生理指标变化测定。
1.1. 供试材料
1.2. 不同质量浓度SA诱导效果测定
1.2.1. 不同质量浓度SA诱导对楠木炭疽病病斑大小的影响
1.2.2. 不同质量浓度SA诱导与楠木生理指标变化测定
1.2.3. 不同质量浓度SA对孢子萌发率的影响测定
1.3. SA处理和炭疽病接种后楠木生理指标变化测定
-
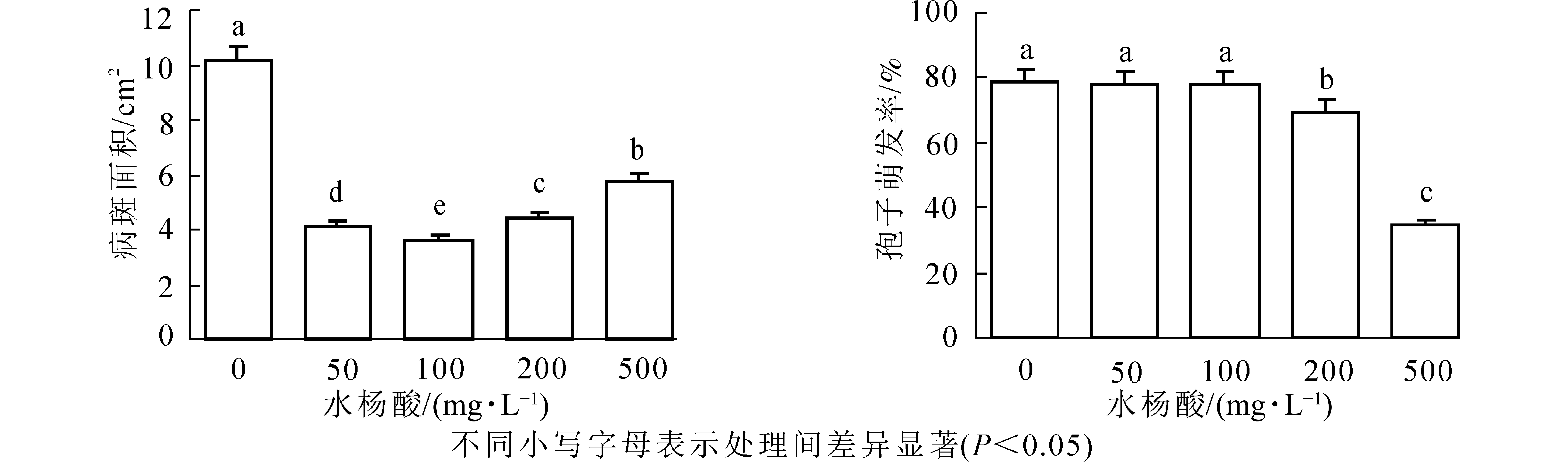
由图1可以看出:不同质量浓度的SA对紫楠均具有诱导作用,对病斑抑制效果差异显著(P<0.05)。与无菌水喷洒处理相比SA质量浓度为100 mg·L−1诱导植物叶片病斑减小率最高,达64.28%,其次是50和200 mg·L−1,诱导效果为59.8%、56.72%,500 mg·L−1诱导效果最差,其中各质量浓度诱导植物病斑大小差异显著。
-
结果表明(图1):低质量浓度SA处理孢子萌发率与对照相比无显著差异,即对孢子萌发无明显抑制作用,当SA质量浓度为200、500 mg·L−1时抑制作用显著(P<0.05),分别为69.58%和34.75%,同低质量浓度相比差异较大。
-
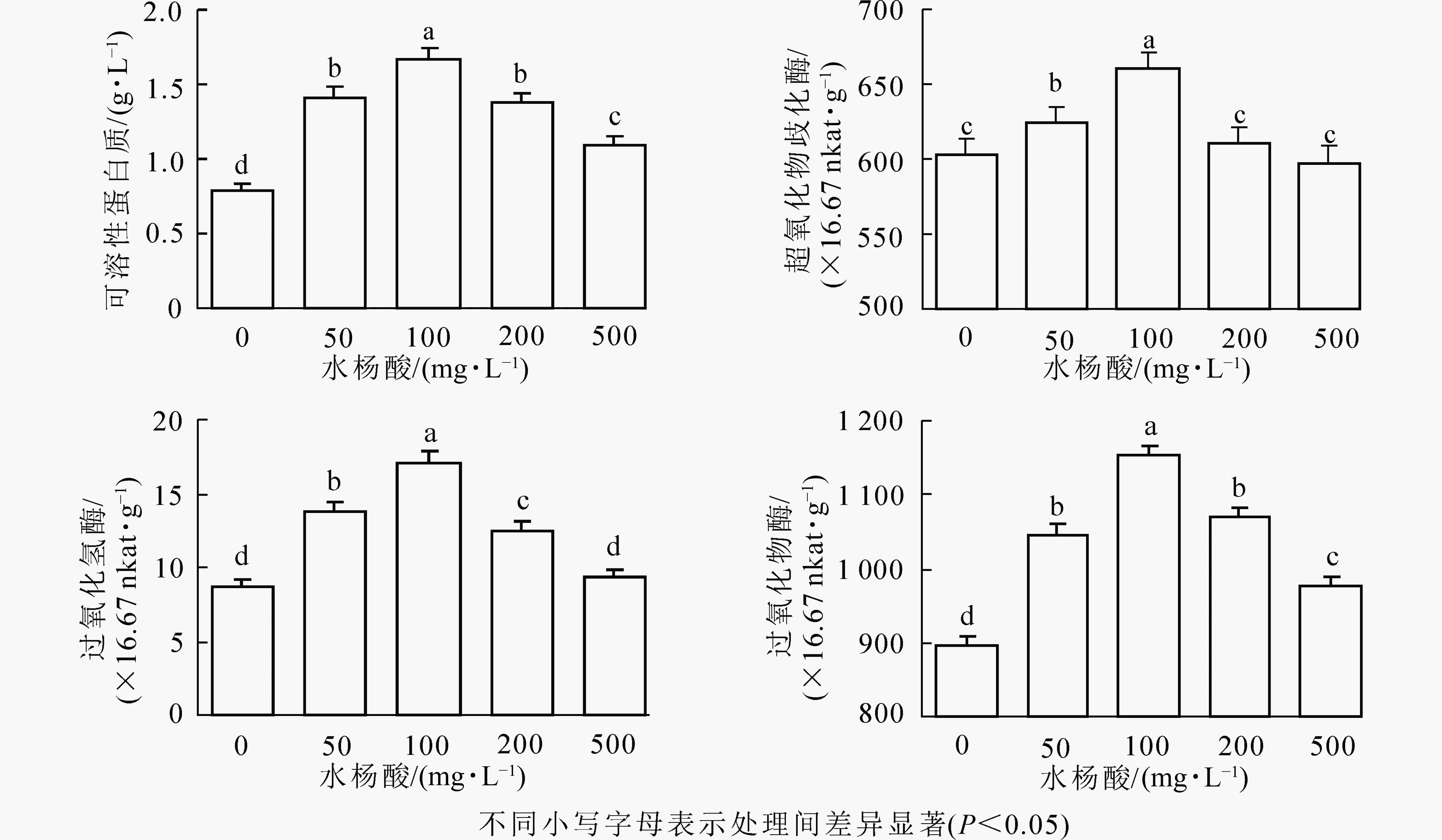
从图2可以看出:不同质量浓度SA均可诱导可溶性蛋白质的增加(P<0.05),100 mg·L−1所诱导的蛋白质质量浓度是对照的2.11倍,50和200 mg·L−1的诱导效果差异不显著,与对照相比差异显著,分别是对照的1.77和1.69倍。500 mg·L−1 SA诱导后,可溶性蛋白质质量浓度较其他处理低,但显著高于对照(P<0.05)。
-
SOD是植物体内重要的抗氧化酶,SA施用后引起植株SOD活性升高(图2)。其中500和200 mg·L−1与对照之间无显著差异,SA质量浓度为100 mg·L−1时酶活性高于50 mg·L−1时的酶活性,差异显著(P<0.05)。表明不同质量浓度SA对植物中SOD酶活性的影响不同。
-
CAT活性随SA质量浓度的上升表现出先升高后降低的趋势(图2),500 mg· L−1质量浓度处理与对照的CAT相比无显著差异,200、100、50 mg·L−1处理差异显著(P<0.05),均能使CAT活性增加。其中100 mg·L−1的SA处理对楠木植株CAT活性诱导效果最好,是对照的2.03倍。
-
不同质量浓度SA处理对POD活性的影响与CAT趋势相似(图2),均为随SA质量浓度的增加表现为先上升后下降。100 mg·L−1SA诱导的POD活性最高,是对照的1.3倍。200和50 mg·L−1诱导的CAT活性无显著差异,但显著高于500 mg·L−1和对照处理。不同质量浓度SA均可引起POD活性增加。上述研究表明:不同质量浓度SA对楠木诱导效果均存在差异,500 mg·L−1诱导效果最差,100 mg·L−1诱导效果最好,因此选择100 mg·L−1的SA进行下一步实验。
-
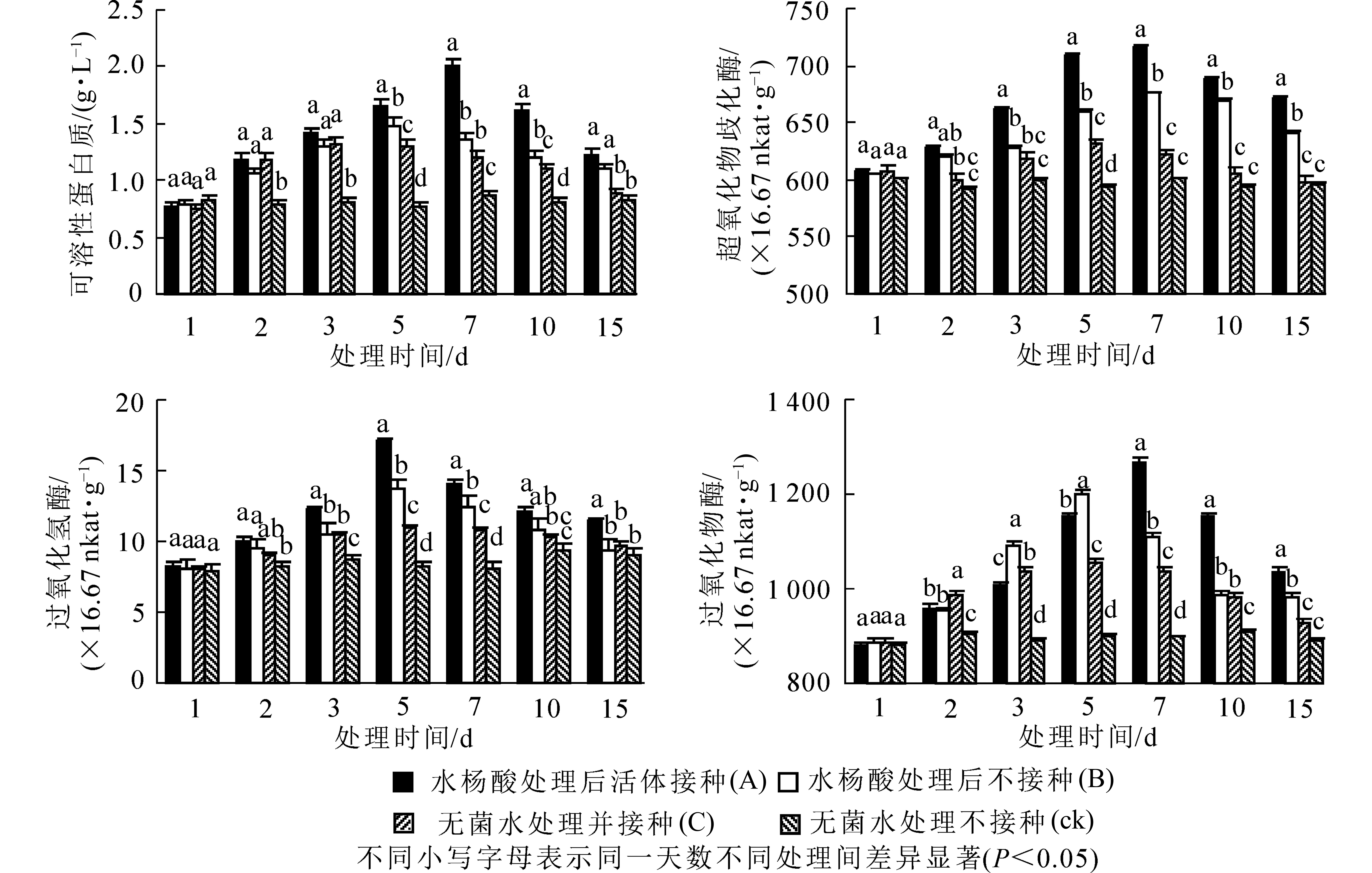
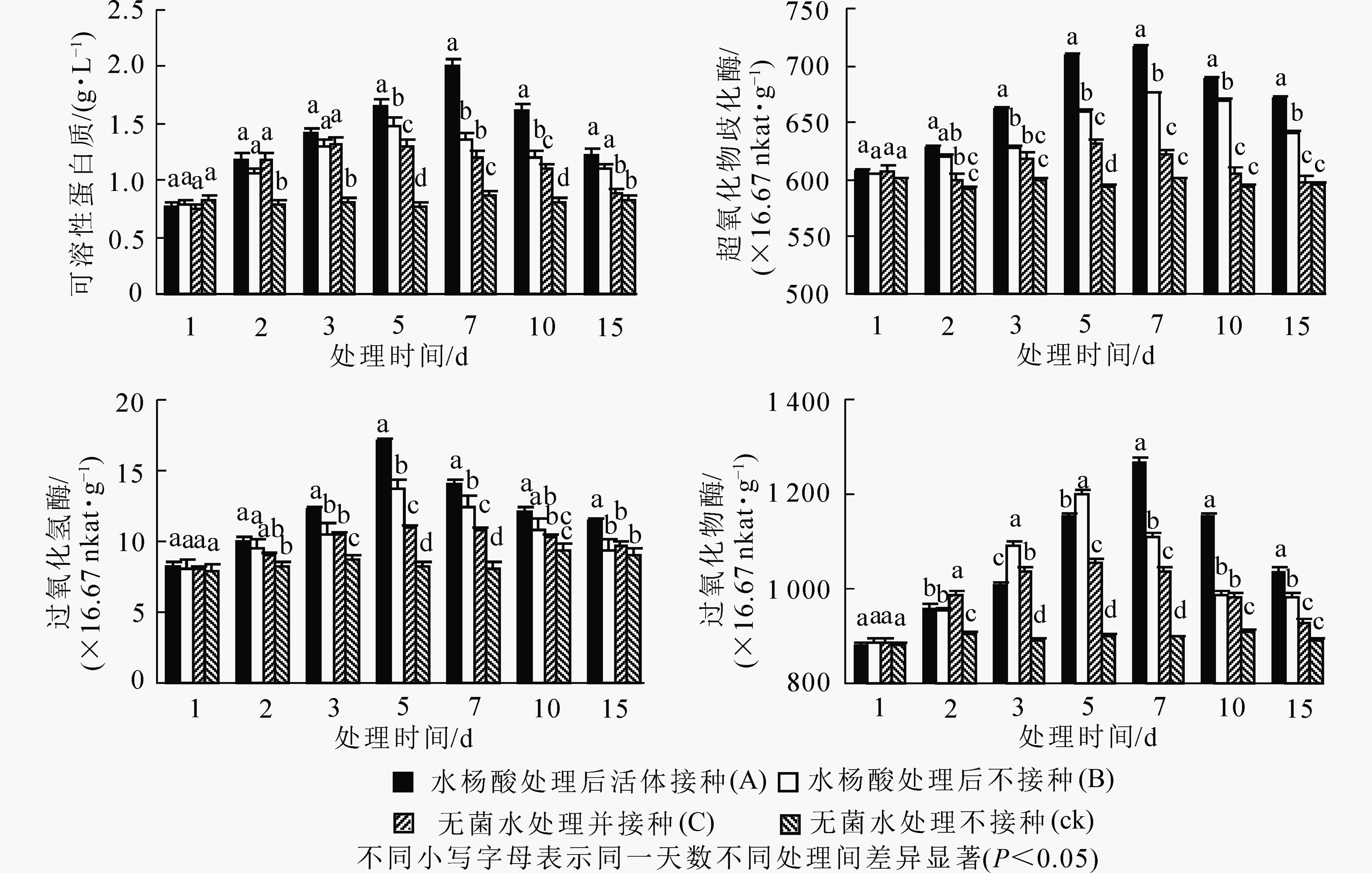
从图3可以看出:不同处理均可引起紫楠叶片可溶性蛋白质质量浓度的增加。SA处理后其蛋白质质量浓度在1~5 d持续增加,5 d时达峰值,处理A在第7天达峰值,随后下降,可溶性蛋白质质量浓度显著高于未经SA处理过的处理C和ck。处理A效果最好,第7天时是ck的2.57倍,经SA处理过的植株第15天可溶性蛋白质质量浓度仍显著高于对照,处理C在第1~3天升高随后下降,趋势相较于A处理和B处理趋势较为平缓。15 d时SA处理过的植株可溶性蛋白质质量浓度显著高于对照,因此SA可以诱导紫楠植株可溶性蛋白质增加。
-
本研究SA处理均可引起紫楠叶片SOD活性增加(图3),随SA的作用时间先逐渐升高后缓慢下降。当SA作用时间为7 d时,处理A的SOD活性达最大值,是ck的1.21倍,之后开始下降,处理A和处理B的SOD活性始终显著高于处理C和ck。
-
SA诱导后可引起紫楠体内CAT活性增加(图3),有利于增强植株抗病性。紫楠叶片经SA处理和接种处理后,CAT活性在第5天达到峰值,处理A是ck的2.04倍,处理B是ck的1.63倍,5 d后CAT活性下降。处理C的CAT活性虽有增加但到后期与ck相比差异不显著。
-
100 mg·L−1的SA诱导后,植株POD活性迅速升高(图3),处理A与处理B的POD活性具有基本相似的变化趋势,处理A相较于处理B迟一些达到最大值,且POD活性是ck的1.46倍,SA诱导15 d后的植株POD活性仍显著高于未诱导的植株。
2.1. 不同质量浓度SA对紫楠的诱导效果
2.1.1. 对病斑大小的影响
2.1.2. 对楠木炭疽病孢子萌发的影响
2.1.3. 对可溶性蛋白质的影响
2.1.4. 对SOD的影响
2.1.5. 对CAT的影响
2.1.6. 对POD的影响
2.2. SA处理和炭疽病接种引起的楠木生理指标变化
2.2.1. 对可溶性蛋白质的影响
2.2.2. 对SOD的影响
2.2.3. 对CAT的影响
2.2.4. 对POD的影响
-
诱抗剂有着更好的抗病性和低毒性[15-16]。目前,诱导剂在农业等方面应用广泛,在林业方面研究相对较少。将诱导剂应用于林业实践可减少化学杀菌剂的使用,与杀菌剂、生物防治等相结合可达到更好的效果[17-19]。当SA质量浓度低于500 mg·L−1时对孢子萌发无影响,可以证明低质量浓度外源SA的施用对病原菌孢子无直接毒力。本研究证实:不同质量浓度SA对紫楠均具有诱导抗性作用。100 mg·L−1为SA最适宜质量浓度,酶活性均达到最大值,差异显著。SA处理后可溶性蛋白质质量浓度,SOD、CAT、POD活性先上升然后下降至稳定水平,实验持续了15 d,所测结果仍高于正常水平,其中CAT变化最为明显,经SA诱导的紫楠接种或不接种处理,生理指标活性均显著高于对照,这与山茶[11]、橡胶树Hevea brasiliensis [20]等抗性诱导研究结果一致。
SA是存在于植物体内的内源性生长物质,可以引起植物体内H2O2浓度升高,促进H2O2生成的化合物,诱导SAR相关蛋白及防御酶等活性的增加,促进相关基因的表达[21-22]。外源SA可以诱发植物触发病理相关蛋白基因的表达,在诱导植物产生抗病性的同时大量积累病程相关蛋白。外源SA的应用可诱导植物内源性CAT和POD活性增加,以及相关基因的表达,能引发植物的诱导抗性[23]。POD除了具有解毒作用外,还是植物体内多种次生代谢产物生物合成的关键调控酶之一,植物次生代谢产物参与了植物对病原体的防御反应,SOD在清除高毒性和不稳定活性氧中起重要作用,CAT、POD和SOD被认为是保护细胞免受氧化损伤的主要抗氧化系统,多种酶活性的升高可能是使植物体产生抗性,抵抗病原菌侵染的重要原因。因此,SA可以诱导楠木对病原菌的入侵产生抗性,为防治提供依据。









 DownLoad:
DownLoad: