-
白及Bletilla striata为兰科Orchidaceae白及属Bletilla多年生草本植物,主产于安徽、浙江、江西、贵州等地[1],以干燥块茎入药,又名甘根、白给、白芨等[2]。具有收敛止血,消肿生肌的功效,对于咯血、吐血、疮疡肿毒、皮肤皲裂等有效[3]。因白及以其干燥块茎入药,故国内外对白及花的研究较少。白及花期为每年4−5月,花序具花3~10朵,花色为紫红色、粉红色[4],具有较高的观赏价值,还富含多种花青素等活性成分,其水提物具有较好的抗氧化能力,可作为饮品进行开发利用[5]。花青素(anthocyanidins)为水溶性天然色素,属于多酚化合物中的类黄酮化合物,是由花色苷水解得到的有颜色的苷元[6−7],但在自然界中很少以游离的苷元而多以糖苷的形式存在[8]。花青素不仅是植物中的主要呈色物质,还具有抗氧化[9]、降血脂[10]、抗癌[11]、抑制神经炎症、改善血管功能[12]、平衡肠道微生物群落[13]、减缓与肝功能及结构有关的衰老恶化[14]与改善轻度至中度痴呆老年人的特定认知结果[15]等功效。花青素稳定性差,在提取纯化过程中易发生降解[16]。微波法对天然色素的提取具有色素产率高、色价高、节省溶剂、节省时间等优点[17]。pH示差法和高效液相色谱法(HPLC)是定量测定花青素的常用方法,两者具有很高的相关性[18],其中pH示差法被农业化学家协会(AOAC)正式作为研究实验室和食品工业中各种水果和蔬菜总花青素的基本测量方法[19−20]。本研究采用微波法进行响应面优化白及花花青素提取,并采用pH示差法测定白及总花青素,以期为白及花中花青素的综合开发提供理论依据。
HTML
-
白及花采于浙江省湖州市安吉县上墅乡白及基地。采摘盛花期的白及花,去除花茎部分后,于烘箱50 ℃烘干至恒量(±0.005 g),打粉后过24目筛。于−20 ℃避光储存,备用。氯化钾(西陇化工股份有限公司)、无水乙酸钠(西陇化工股份有限公司)、盐酸(上海凌峰化学试剂有限公司)、无水甲醇(浙江汉诺化工科技有限公司)均为分析纯。pH计FE20[梅特勒-托利多仪器(上海)有限公司],AK-1000A 500克摇摆式中药粉碎机(温岭市奥力中药机械有限公司),DHG-9031A电热恒温干燥箱(上海精宏实验设备有限公司),FA2204电子分析天平(上海力辰仪器科技有限公司),NJL07-3型实验微波炉(南京杰全微波设备有限公司),RE-2000A旋转蒸发器(上海亚荣生化仪器厂),TDL-50C低速离心机(上海安亭科学仪器厂),Epoch2酶标仪(美国BioTek仪器有限公司)。
-
取白及花粉末加入甲醇溶液(以体积分数为1%盐酸作溶剂)进行微波萃取,离心取上清液,残渣进行再次提取,合并2次上清液于35 ℃旋蒸1 h后用提取剂定容至10 mL,−20 ℃避光保存直至测定。
-
因深色花色苷在可见光区的吸收波长范围为465~560 nm[7],所以取花青素提取液0.2与0.6 mL的pH 1.0缓冲液混匀,于450~600 nm波长范围内以步长5 nm进行扫描,以确定最大吸收波长。
-
分别取花青素提取液0.2与0.6 mL的pH 1.0缓冲液或pH 4.5缓冲液混匀,室温下避光反应0~120 min,每隔10 min测定D(530)、D(700),以确定最佳平衡时间。
-
精确称取样品,在料液比为1∶40(料单位为g,溶液单位为mL)、体积分数为80%的甲醇溶液(以体积分数为1%盐酸稀释)、微波功率400 W的条件下提取10 min,冷却至室温后4 000 r·min−1离心15 min,取上清液于35 ℃旋蒸,用提取剂定容至10 mL,为第1次提取液。将残渣重复上述操作,为第2次提取液。共进行4次提取,按2.4分别进行总花青素质量浓度测定,以确定最佳提取次数。
-
参考李文峰等[21]总花青素质量浓度测定方法并略作调整。取0.2 mL花青素提取液,分别与0.6 mL的pH 1.0氯化钾缓冲液、pH 4.5醋酸钠缓冲液混匀。室温下避光静置80 min后测定D(530)、D(700)。3次重复,取平均值。总花青素(TAC)质量分数以矢车菊素-3-O-葡萄糖苷(C3G)的含量为标准进行计算,计算公式[22]为:TAC= {[D(530)pH1.0− D(700)pH1.0]−[D(530)pH4.5−D(700)pH4.5]}MWDF/(εL)。其中,TAC青素质量浓度(g·L−1),D为各pH值下不同波长对应的吸光度,MW为C3G的分子量(449.2),DF为稀释倍数,ε为C3G的克分子吸光率常数(26 900),L为比色皿光程(1 cm时,L=1)。再将总花青素质量浓度换算成质量分数进行对比分析。
-
以微波功率、甲醇体积分数、提取时间和料液比为单因素,分别进行参数范围的确定,考察不同因素对总花青素提取量的影响。精确称取样品,在甲醇体积分数为80%、料液比(溶质单位为g,溶剂单位mL)1∶40、提取20 min的条件下,进行微波功率(160、240、320、400、480、560、640 W,误差为±5 W)的范围确定;在微波功率560 W、料液比1∶40、提取20 min的条件下,确定甲醇体积分数(20%、40%、60%、80%、100%)的区间范围;在微波功率560 W、甲醇体积分数80%、料液比1∶40的条件下,考察微波时间(2、5、10、20、30 min)的影响;在微波功率560 W、提取20 min、体积分数为80%甲醇的条件下,进行料液比(1∶10、1∶20、1∶30、1∶40、1∶50、1∶60)的范围确定。按2.4分别进行总花青素提取量的计算。
-
为获得白及花中花青素的最佳提取工艺条件,在单因素结果的基础上,以总花青素提取量为响应值,选取微波功率(A)、甲醇体积分数(B)、微波时间(C)和料液比(D)为自变量,应用Design-Expert.V8.0.6.1软件,按照Box-Behnken中心组合设计原理,设计4因素3水平的响应面实验。设计因素与水平如表1所示。
水平 微波功率
A/W甲醇体积
分数B/%微波时间
C/min料液比
D−1 480 70 10 1∶30 0 560 80 20 1∶40 1 640 90 30 1∶50 Table 1. Coded levels and corresponding actual levels of independent variables used in Box-Behnken design
2.1. 总花青素的提取
2.2. pH示差法测定花青素条件优化
2.2.1. 吸收波长的确定
2.2.2. 平衡时间的确定
2.3. 提取次数的确定
2.4. 总花青素质量浓度测定
2.5. 单因素实验
2.6. 响应面实验
-
由图1所示:溶液吸光度在450~530 nm区间逐渐升高,在530 nm处达最大值(0.37),当波长继续增加溶液吸光度逐渐下降。因此白及花中花青素在可见光谱范围内的最大吸收波长为530 nm。
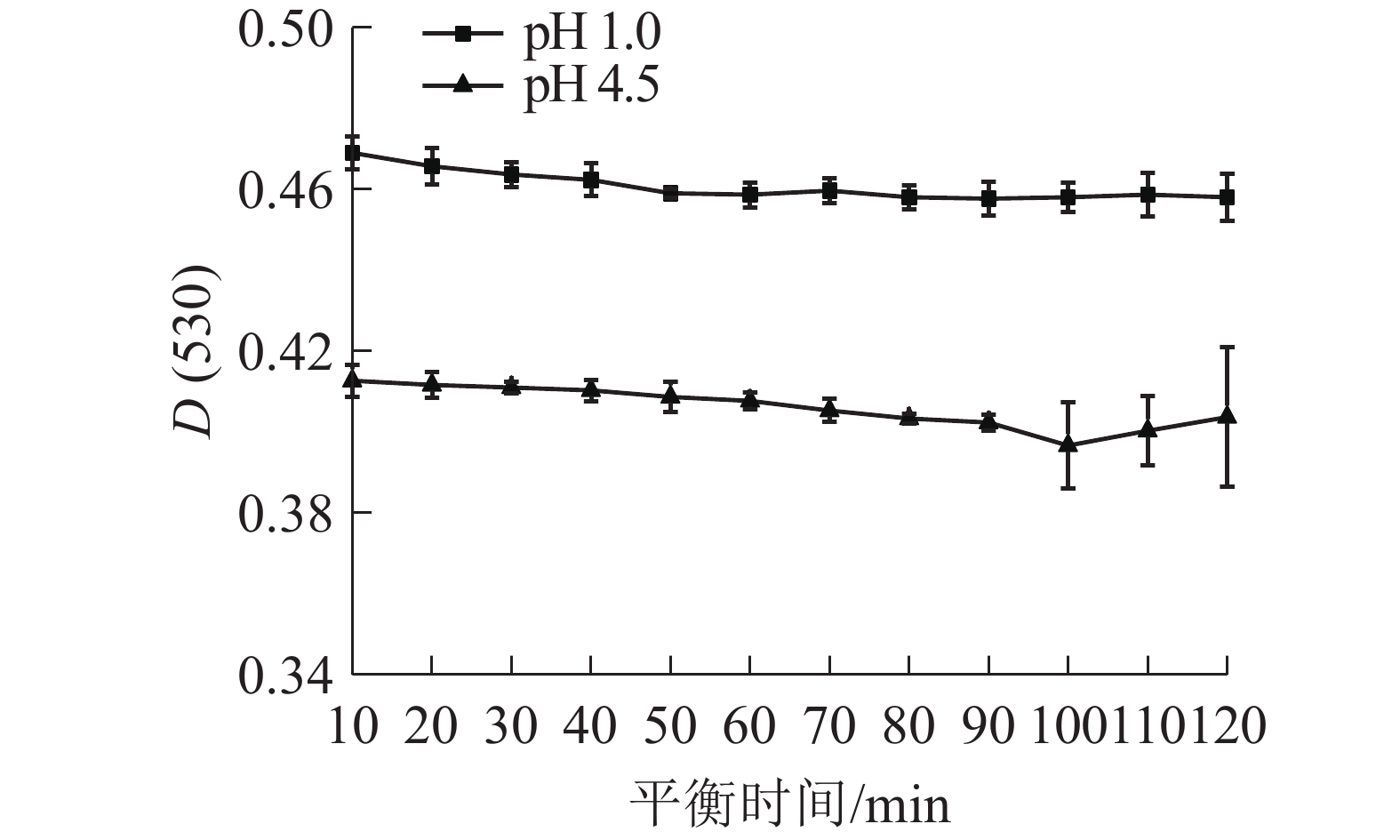
由图2所示: D(530)随着时间的延长而降低,50 min后吸光度变化平稳,并在80~100 min范围内最为平稳;在pH 4.5缓冲液中,随着时间的增加,D(530)逐渐降低,在80~90 min时,吸光度相对处于稳定状态。因此,80 min为花青素在缓冲液中的平衡时间。
-
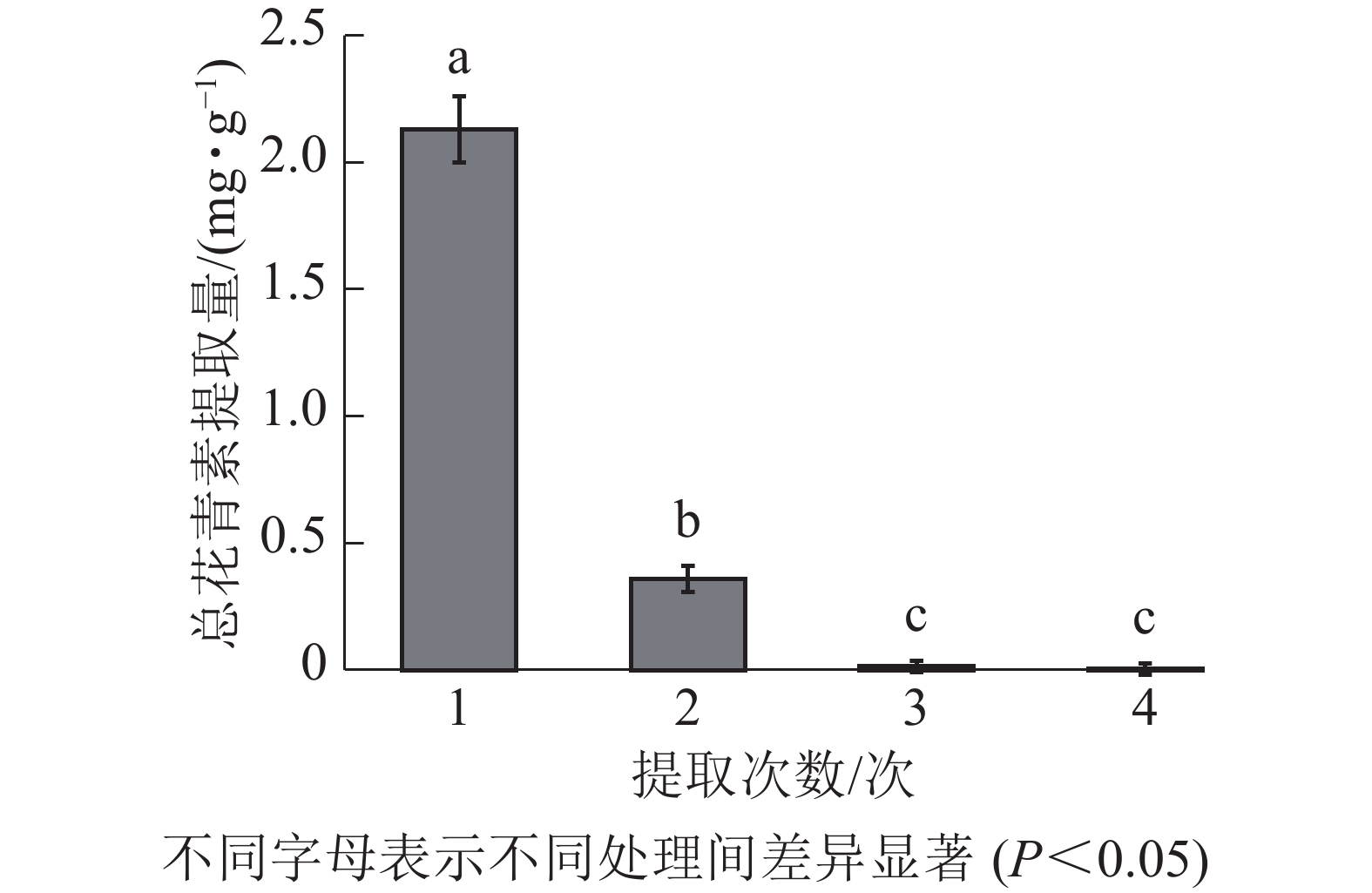
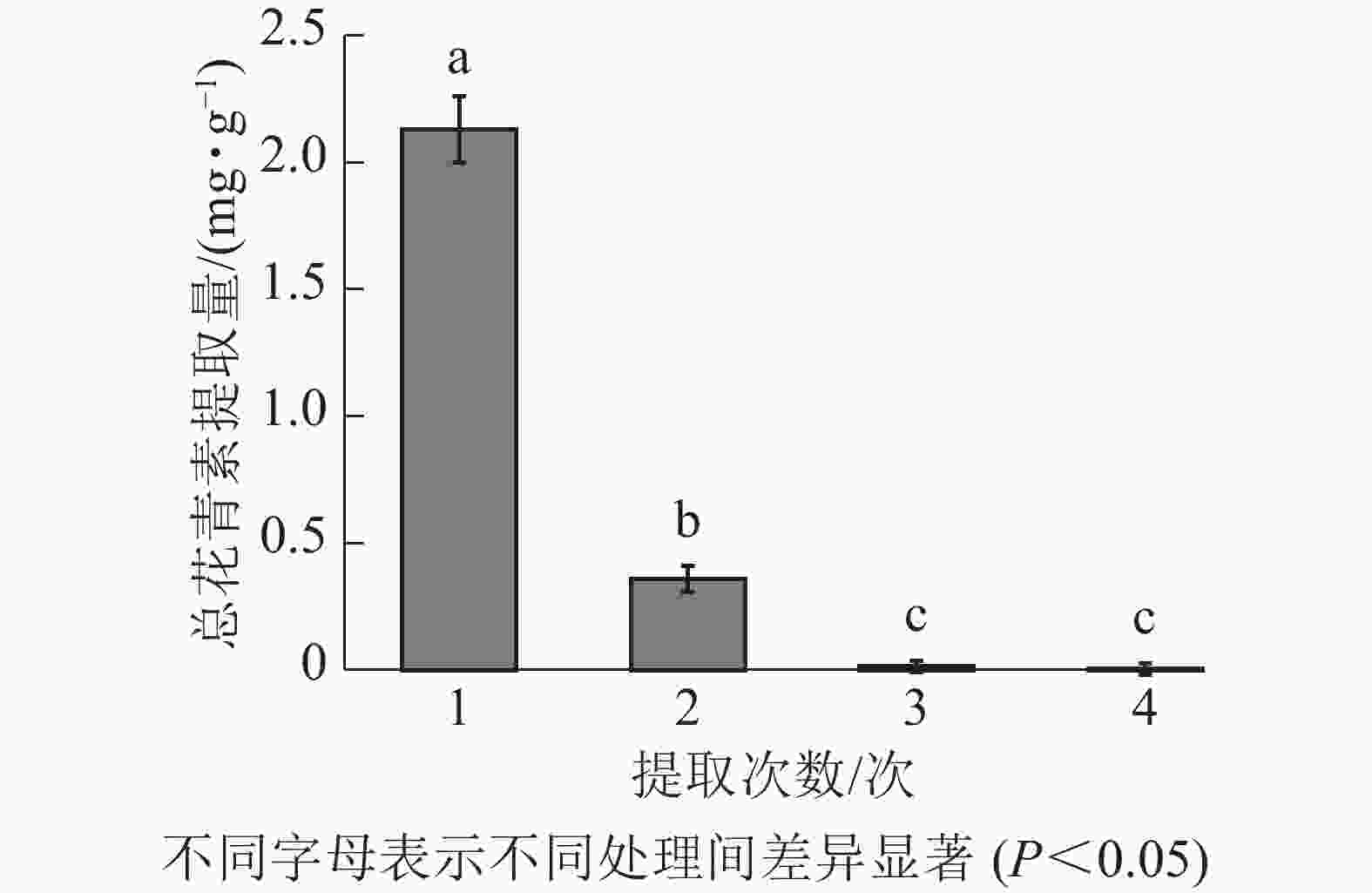
由图3所示:白及花中花青素随提取次数增加而降低。第1次提取所得总花青素的提取量最大,第2次提取的提取量约为第1次的16.90%,第3、4次提取的提取量约为第1次的0.70%、0.17%。因此,为尽可能对样品提取完全,且提高提取效率不造成溶剂浪费,选择对样品进行2次提取。
-
由图4所示:当微波功率为160~560 W时,总花青素的提取量随着微波功率的增大而提高;微波功率为560 W时出现顶点,而后随着功率增大出现了下降趋势。这是因为在一定范围内,随着微波功率的增大对细胞的破坏力也逐步增强,花青素溶出物增多;但功率过高使得温度升高,对花青素造成了一定程度的破坏,使得提取量降低。因此依据结果选择微波功率480、560和640 W进行响应面实验。
-
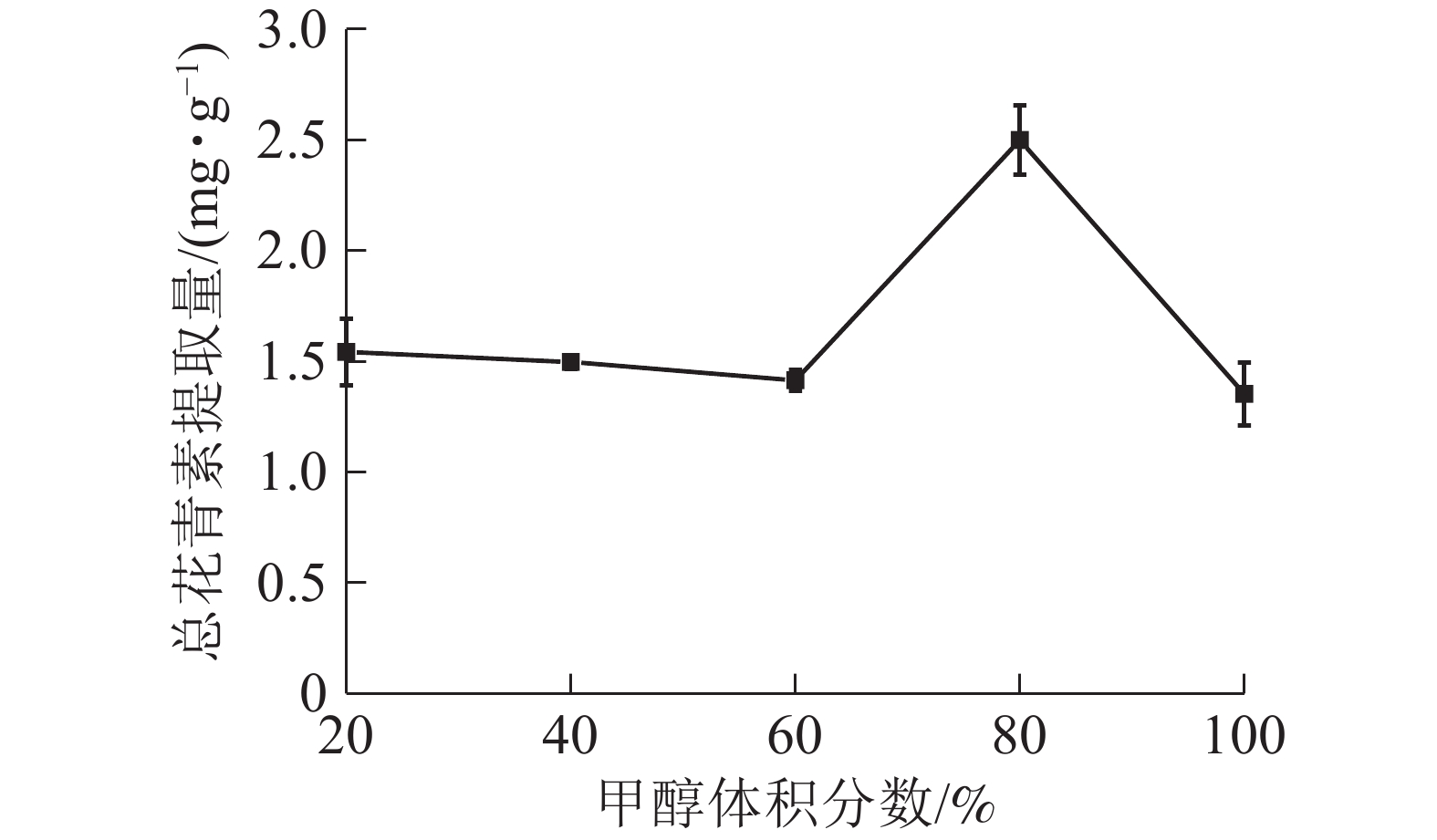
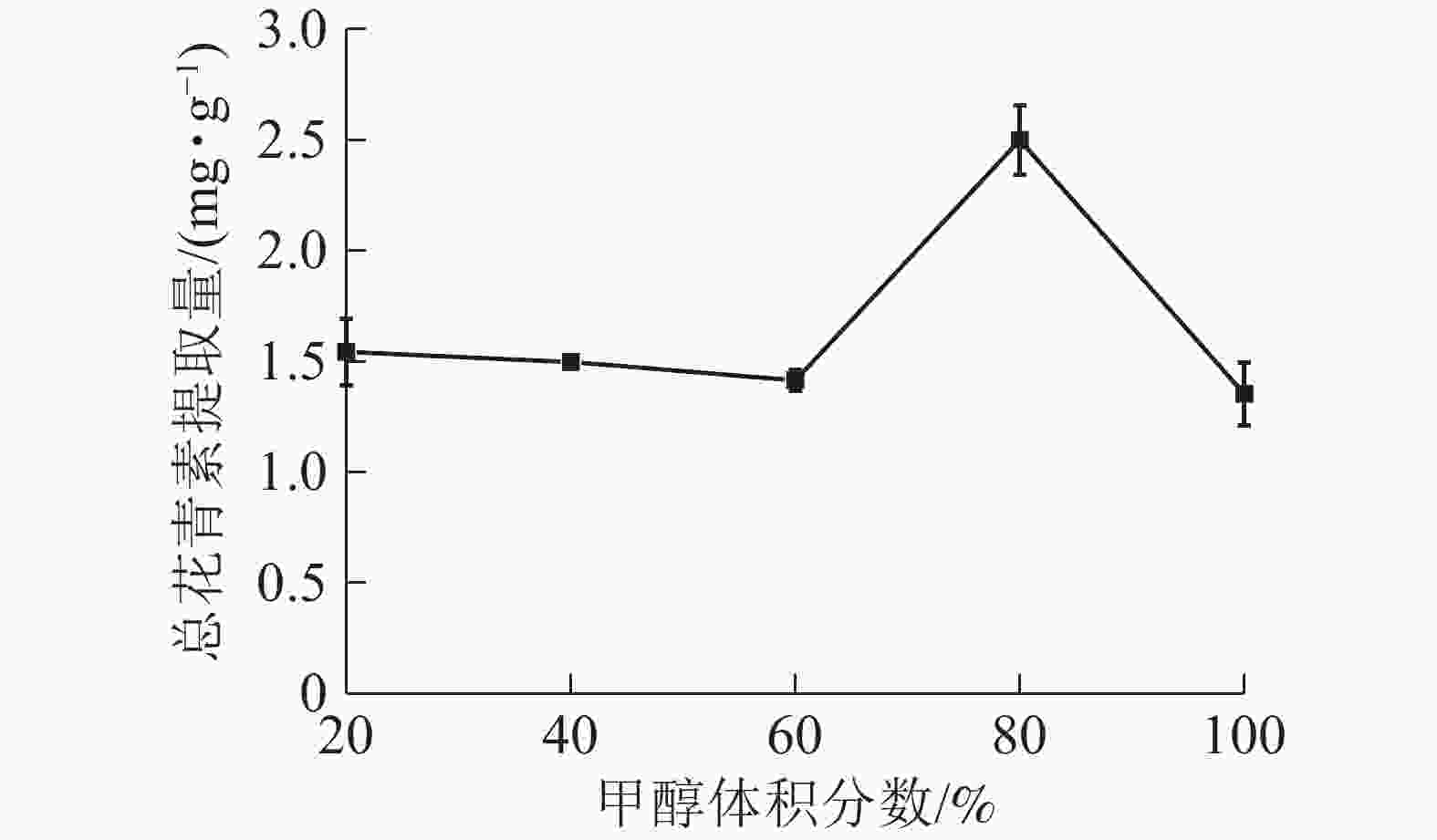
由图5所示:当甲醇体积分数为20%~60%时,总花青素的提取量没有明显变化;当甲醇体积分数为60%~80%时,提取量随着甲醇体积分数的增加而提高,在80%处达到最大值,随后逐渐下降。说明在一定范围内,提高甲醇体积分数有利于花青素的提取。因此依据实验结果选择甲醇体积分数为70%、80%和90%进行响应面实验。
-
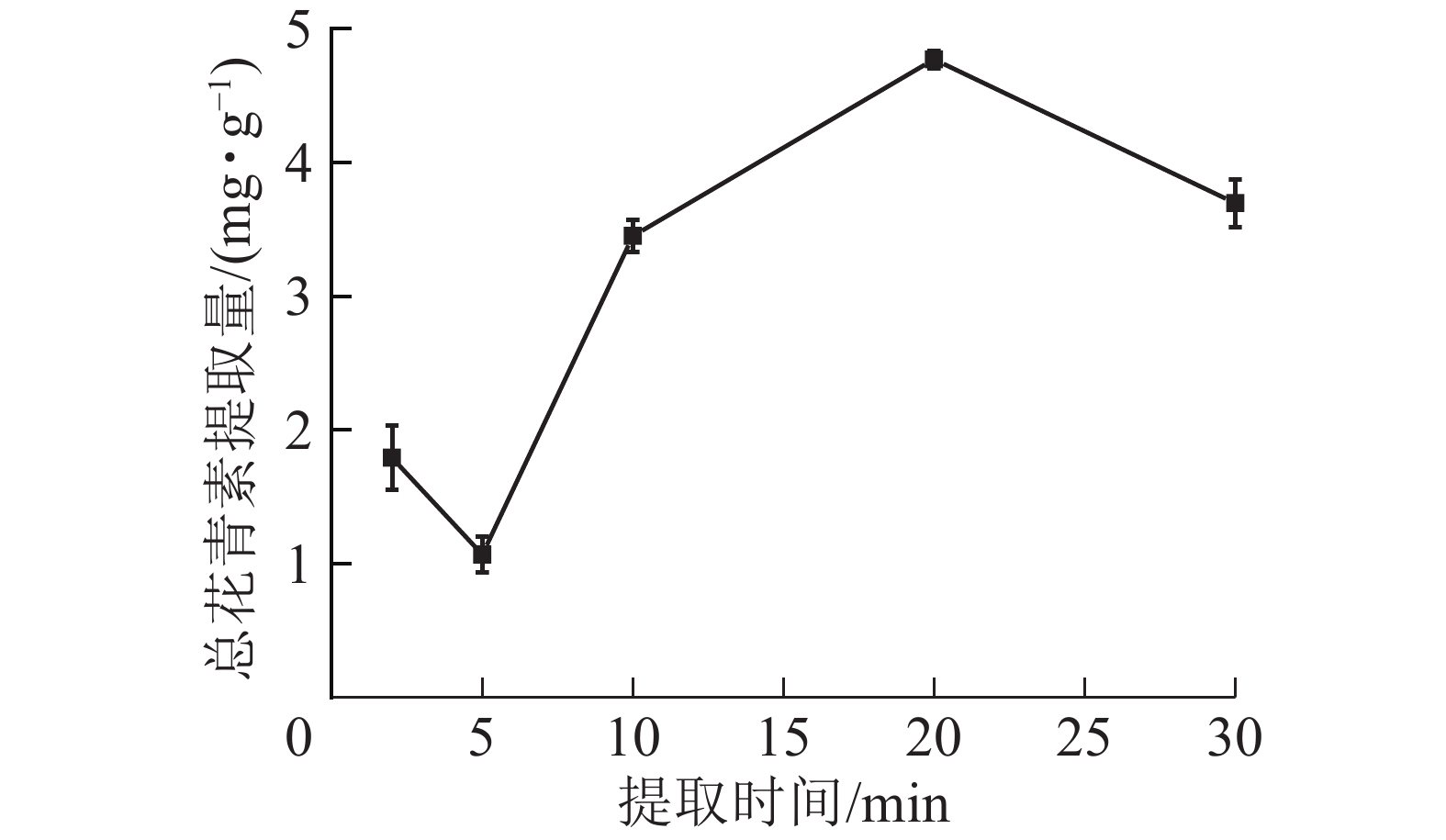
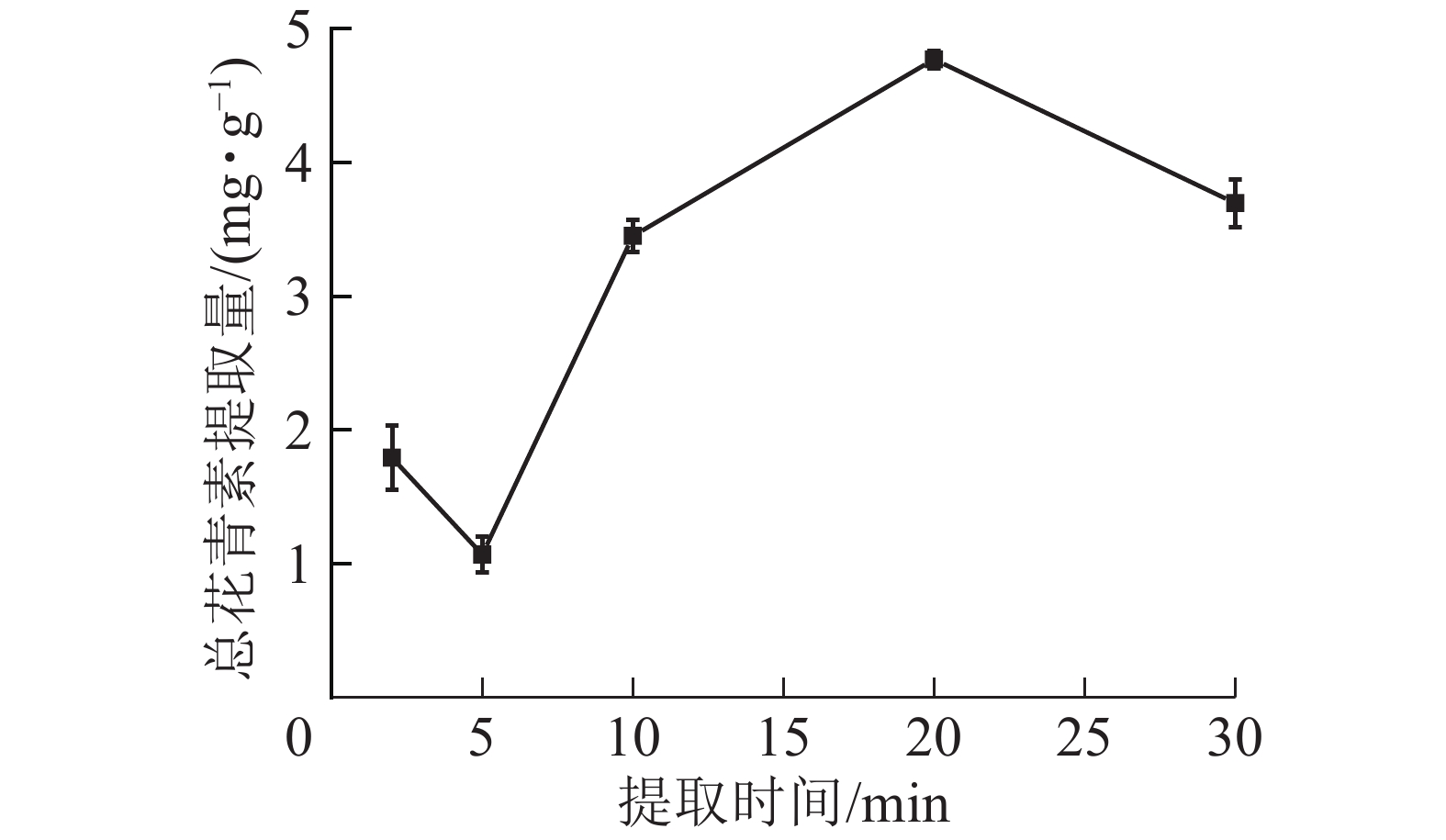
由图6所示:在微波时间为2~20 min时,总花青素的提取量随微波时间的延长而提高,在20 min时达到最大值;继续加长提取时间,提取量则下降。这是由于在一定的微波功率下,微波时间越长,对细胞的破坏越彻底,花青素溶出物越多;但微波时间过长会使高温对花青素破坏速度大于花青素浸出速度,花青素总提取量降低。因此依据结果选择微波时间为10、20和30 min进行响应面实验。
-
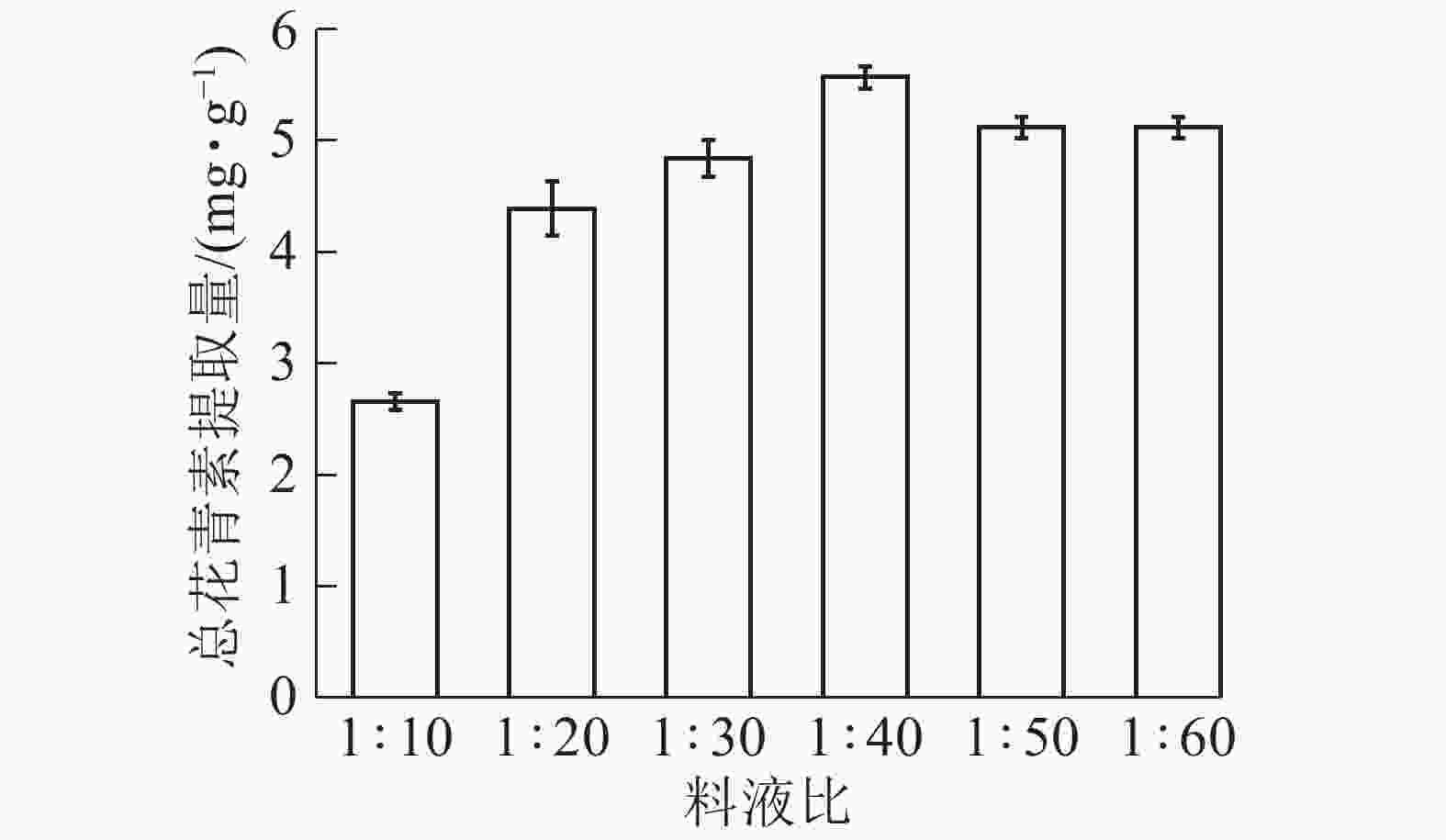
由图7所示:在料液比为1∶10 ~ 1∶40时,总花青素的提取量随着溶剂量的加大逐渐提高;当料液比为1∶40时,提取量达到最大,而后缓慢下降。这是因为增加溶剂量有利于花青素的溶出,但溶剂增加比溶质增加倍数过大会稀释提取液并浪费资源,故提取量下降。依据研究结果选择料液比1∶30、1∶40和1∶50进行响应面实验。
-
在单因素实验结果的基础上,设计4因素3水平的响应面实验,以总花青素提取量(Y)为响应值,微波功率(A)、甲醇体积分数(B)、微波时间(C)和料液比(D)为自变量,共进行29次实验,其中5次为验证实验。将结果运用Design-Expert.V8.0.6.1软件进行多元回归拟合,得到回归方程模型:Y=−10.774 63− 0.017 17A+0.153 27B+0.382 88C+0.175 19D+0.000 78AB+0.000 19AC+0.000 78AD−0.002 40BC+0.001 45BD+0.000 23CD−0.000 06A2−0.003 45B2−0.006 70C2−0.008 43D2。
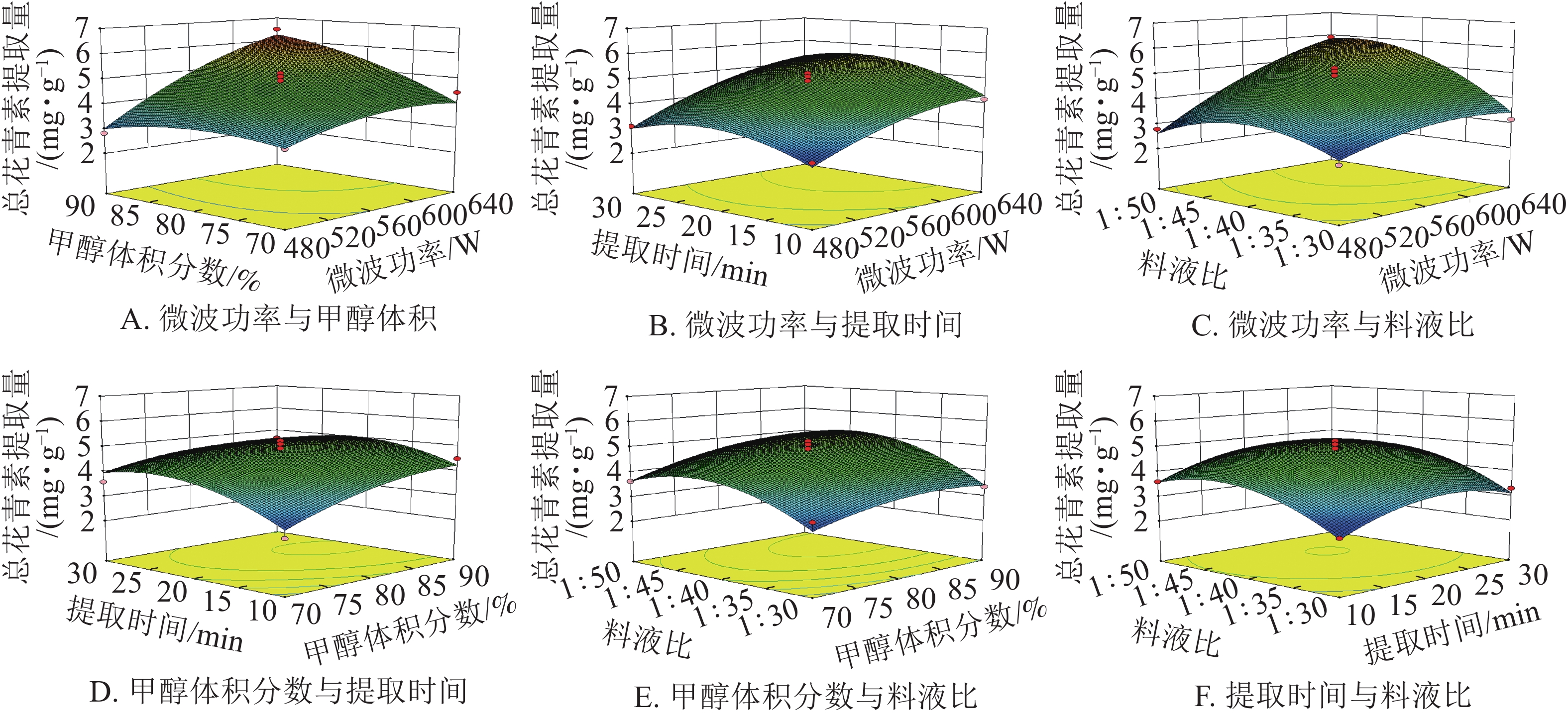
从表2可知:模型项为极显著,其中单项因素A、B、C、D与交叉项AB、AD及二次项C2、D2对总花青素提取量的影响达到极显著水平(P<0.01),二次项A2、B2达到显著水平(P<0.05),其余项因素不显著(P>0.05)。该模型失拟项不显著,表明该模型建模成功。其中决定系数R2为0.95,校正系数R2Adj为0.90,表明建立的模型与实际情况拟合度较好,可用来进行分析与预测。由表2中F值可知:4个自变量在本研究实验范围内对提取量影响从大到小依次为A(微波功率)、D(料液比)、B(甲醇体积分数)、C(微波时间)。
方差来源 平方和 自由度 均方 F P 显著性 样本 30.65 14 2.19 19.85 <0.000 1 *** A 11.98 1 11.98 108.61 <0.000 1 *** B 2.89 1 2.89 26.18 0.000 2 *** C 1.52 1 1.52 13.83 0.002 3 ** D 4.16 1 4.16 37.70 <0.000 1 *** AB 1.56 1 1.56 14.16 0.002 1 ** AC 0.09 1 0.09 0.80 0.387 2 AD 1.57 1 1.57 14.19 0.002 1 ** BC 0.23 1 0.23 2.09 0.170 3 BD 0.08 1 0.08 0.76 0.398 2 CD 0.00 1 0.00 0.02 0.892 0 A2 0.97 1 0.97 8.83 0.010 1 * B2 0.77 1 0.77 6.99 0.019 3 * C2 2.91 1 2.91 26.42 0.000 2 *** D2 4.61 1 4.61 41.81 <0.000 1 *** 残差 1.54 14 0.11 失拟项 1.19 10 0.12 1.35 0.413 3 纯误差 0.35 4 0.09 总离差 32.19 28 R2=0.95 R2Adj=0.90 说明:*表示显著(P<0.05),**表示极显著(P<0.01),***表示极显著(P<0.001) Table 2. Analysis of variance (ANOVA) of regression model
-
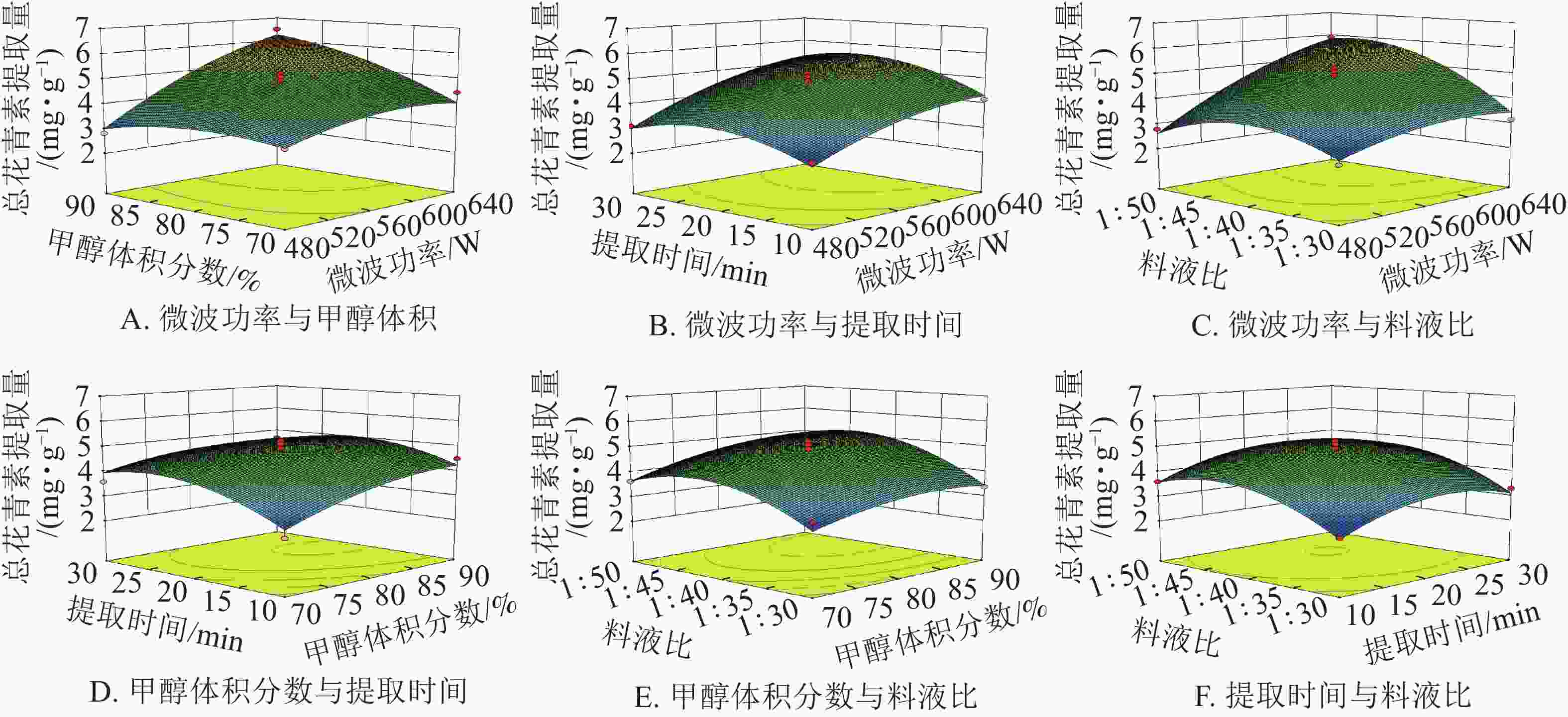
由图8可知:微波功率对提取量的影响最为显著。微波功率与甲醇体积分数和料液比,两两之间交互作用较强,表现为响应面坡度较陡。随着微波功率的增大,花青素的提取量逐渐增加。其余因素间,交互作用相对较弱,即响应面坡度较缓。根据所建立的响应面拟合方程进行参数最优分析,所得预测最佳工艺条件为:微波功率640 W,甲醇体积分数90%,微波时间22.14 min,料液比1∶48.10,在此条件下总花青素提取量为6.83 mg·g−1。结合模型预测最佳条件和实际情况,采用优化条件:微波功率640 W,甲醇体积分数90%,微波时间22 min,料液比1∶48。进行3组平行验证试验,其平均提取量为(6.68 ±0.13) mg·g−1,与理论预测值6.83 mg·g−1基本一致,表明模型与实际拟合情况较好。因此响应面法对白及花中花青素提取工艺的优化具有可行性。
3.1. pH示差法测定花青素条件优化
3.2. 花青素的提取次数
3.3. 单因素实验结果
3.3.1. 微波功率对总花青素提取量的影响
3.3.2. 甲醇体积分数对总花青素提取量的影响
3.3.3. 微波时间对总花青素提取量的影响
3.3.4. 料液比对总花青素提取量的影响
3.4. 响应面优化结果
3.4.1. 响应面实验设计及结果分析
3.4.2. 响应面交互作用结果分析
-
本研究采用微波萃取法进行白及花中花青素的提取。在单因素实验的基础上,采用响应面分析法进行提取条件的优化,并建立了微波功率、甲醇体积分数、提取时间和料液比对总花青素提取量的二次回归方程模型。得到最佳的提取工艺条件为:微波功率640 W,甲醇体积分数90%,微波时间22.14 min,料液比1∶48.10。结合实际情况调整参数为:微波功率640 W,甲醇体积分数90%,微波时间22 min,料液比1∶48。在此条件下,白及花中总花青素的提取量为(6.68±0.13) mg·g−1,与预测值6.83 mg·g−1基本吻合。













 DownLoad:
DownLoad: