-
毛竹Phyllostachys edulis是中国面积最广、经济价值最高的竹种[1],但其主要分布区土壤有效磷含量偏低[2],严重影响毛竹的生长和产量。研究表明:低磷胁迫降低了毛竹叶片叶绿素和金属含量[3],导致磷组分[4]和内源激素含量[5]等也发生变化,进而降低了整体生物量。常用施磷肥来增加土壤磷有效性,但过度施磷会引起水体富营养化、磷矿资源枯竭等问题[6]。因此,为应对缺磷带来的生产危机,研究植物对低磷胁迫的响应机制显得尤为重要[7]。低磷胁迫下,植物根系会分泌化学物质,影响根际土壤养分有效性[8];同时毛竹等植物会调整根冠比[5,9]等生物量分配格局来适应低磷环境。低磷胁迫还会促使植物改变自身对养分的需求,协调植物体内养分平衡[10]。但不同生长时期植物对养分的需求和获取存在差异[11]。快速生长时期,植物对养分需求较大,土壤供应可能不足,会促使植物发挥养分重吸收作用[12]。LU等[13]研究表明:低磷胁迫使紫花苜蓿Medicago sativa的磷素利用效率增强,但其效率随育苗时间延长而降低。张文元[14]研究表明:不同生长阶段毛竹对养分的需求及所处根际土壤化学性质存在差异。低磷胁迫会打破土壤原有的养分平衡,使植物体内养分调控机制发生变化。但施磷肥后不同生长时期土壤养分动态变化及毛竹实生苗适应性响应的研究尚无报道。综上,本研究模拟不同土壤磷环境,旨在探究低磷胁迫对不同生长时期根际土壤养分环境、毛竹幼苗生长和养分生理的影响及其持续效应,为植物对低磷环境的适应机制提供理论基础。
-
试验地设在浙江农林大学果木园大棚。毛竹种子采自广西桂林灵川县,用质量浓度为0.3%高锰酸钾消毒和无菌水冲洗并浸种24 h后催芽。供试土壤挖取于浙江省杭州市临安区青山湖仙人洞毛竹林地1 m以下土层,自然风干过20目筛后,以V(土壤)∶V(珍珠岩)=3∶1混匀成育苗基质。土壤理化性质:有机质5.02 g·kg−1,总氮0.46 g·kg−1,全磷0.24 g·kg−1,全钾13.01 g·kg−1,碱解氮93.63 mg·kg−1,有效磷2.58 mg·kg−1,速效钾54.99 mg·kg−1,pH 4.83。育苗容器采用高14.0 cm、底径11.8 cm、上口径14.0 cm的BN170型PP5塑料育苗软盆,盆底有16个透水孔,且各配套1个塑料托盘。
-
以毛朝明等[2]对松阳县毛竹林土壤养分分级为依据,采用单因素随机区组试验设计,共设4个初始土壤有效磷水平,分别模拟极低磷(2.5 mg·kg−1,P1)、低磷(5.0 mg·kg−1,P2)、中磷(10.0 mg·kg−1,P3)和适磷(20.0 mg·kg−1,P4)土壤环境。每盆装基质1.4 kg,磷肥采用磷酸二氢钾(分析纯),溶解于水后施入基质并均匀搅拌,每盆浇施100 mL,其质量浓度分别为0、153.5、460.6和1 074.8 mg·L−1,折合每盆分别添加磷为0、3.5、10.5和24.5 mg。本底氮肥已足够支撑幼苗生长所需,不再额外施加氮肥。对于低磷土壤,施加分析纯硫酸钾以补齐钾元素,保证单一磷变量。2019年6月14日,每盆播8粒饱满健康的毛竹种子,长出4片真叶后间苗,留2株健壮且长势一致的幼苗,每处理设4个重复,每重复150株苗木,共2 400株。进行常规栽培管理,为减少边缘效应,隔半月随机移动苗木1次,并在培育过程中摒弃异常植株。
-
根据毛竹幼苗苗高增长变化及普遍生长节律[15],于2019年12月中旬(当年生长季末,T1)和2020年6月中旬(翌年快速生长期,T2)进行破坏性取样,分为根、茎、叶3个部分在105 ℃烘箱中杀青30 min后,70 ℃烘至恒量,测定生物量后,粉碎并过100目筛,用于测定养分。测试样品采用H2SO4-H2O2消煮[16],分别采用凯氏定氮法、钼锑抗比色法和火焰光度法测定全氮、全磷、全钾质量分数,并计算毛竹幼苗根冠比、养分积累量、养分分配比例和磷素利用效率[17]。每个指标重复测定4次,每次重复分别随机取6株均匀混合样。
同时将附着在根系上的土壤作为根际土壤。采用pH计电位法测定根际土壤pH,高温外热重铬酸钾-容量法测定有机质质量分数,H2SO4消煮-凯氏定氮法测定全氮质量分数,乙酸铵浸提法测定速效钾质量分数,盐酸-氟化铵-钼锑抗比色法测定有效磷质量分数[16],并计算土壤有效磷变化幅度。有效磷变化幅度=(某时期有效磷质量分数−初始有效磷质量分数)/初始有效磷质量分数×100%。
-
采用Excel 2010和SPSS 19.0统计和分析数据,SigmaPlot 12.5作图。采用单因素方差分析(one-way ANOVA),Duncan法在α=0.05水平上进行多重比较。
-
表1所示:T1时期,与初始有效磷水平相比,P3和P4处理下的根际土壤有效磷质量分数降低,但低磷处理组(P1和P2)处理下反而增加;此时低磷处理组的根际土壤pH分别较P4显著降低了10.60%和8.55% (P<0.05);但根际土壤全氮质量分数随初始有效磷水平降低而增加,其中P1较P4显著提高了19.23% (P<0.05);此时根际土壤有机质和速效钾质量分数在不同土壤有效磷水平间均无显著差异(P>0.05)。T2时期,根际土壤有效磷质量分数与初始设置水平相比均降低,但低磷处理组降幅较P4显著减小(P<0.05);此时根际土壤pH仅在P1下较P4显著降低3.53% (P<0.05);而低磷处理组的根际土壤全氮质量分数分别较P4显著增加了30.76%和11.82% (P<0.05);此时根际土壤速效钾质量分数在不同有效磷水平间仍无显著差异(P>0.05),但低磷处理组的根际土壤有机质质量分数分别较P4均显著增加了10.70% (P<0.05)。
生长时期 初始土壤有效磷水平 有效磷/(mg·kg−1) 有效磷变化幅度/% pH 有机质/(g·kg−1) 全氮/(mg·kg−1) 速效钾/(mg·kg−1) T1 P1 3.05±0.11 d 22.13±4.56 a 4.81±0.07 b 5.53±0.33 a 902.26±37.64 a 65.47±0.89 a P2 6.57±0.04 c 31.47±0.75 a 4.92±0.03 b 5.90±0.31 a 805.16±38.17 ab 65.94±1.63 a P3 8.47±0.21 b −15.30±2.09 b 5.40±0.03 a 5.83±0.42 a 868.47±4.46 ab 64.94±1.13 a P4 14.98±0.87 a −25.10±4.33 b 5.38±0.04 a 5.17±0.07 a 756.77±42.93 b 63.58±0.64 a T2 P1 2.32±0.04 D −7.33±1.76 A 5.19±0.03 B 7.45±0.21 A 1013.74±29.97 A 93.92±3.87 A P2 4.34±0.12 C −13.27±2.48 A 5.42±0.04 A 7.45±0.19 A 866.91±24.09 B 82.20±1.46 A P3 7.53±0.30 B −24.73±2.99 B 5.43±0.01 A 7.21±0.03 AB 836.34±17.01 BC 75.43±2.63 A P4 12.16±0.28 A −39.20±1.39 C 5.38±0.03 A 6.73±0.23 B 775.27±6.81 C 78.91±10.97 A 说明:数据为平均值±标准误。大小写字母分别表示T2和T1时期不同处理间差异显著(P<0.05);有效磷变化幅度中的−表示土壤有效 磷质量分数与初始水平相比降低,否则表示增加 Table 1. Effects of initial soil available phosphorus level on soil nutrient environment in rhizosphere
-
表2所示:T1时,低磷处理组(P1和P2)的毛竹幼苗单株生物量分别较P4显著降低了27.09%和15.93% (P<0.05);根冠比较P4分别显著降低22.22%和14.29% (P<0.05);但各土壤有效磷水平下的毛竹幼苗生物量分配率从大到小均依次为根、叶、茎。T2时,低磷处理组的单株生物量较P4分别显著降低了48.96%和43.40% (P<0.05);但根冠比较P4分别显著增加了44.30%和37.97% (P<0.05);此时毛竹幼苗生物量分配率在各土壤有效磷水平下均从大到小依次为根、茎、叶。
生长时期 初始土壤
有效磷水平生物量/(g·株−1) 生物量分配/% 根冠比 根 茎 叶 T1 P1 0.197±0.005 c 49.40±1.19 d 23.35±0.74 a 27.25±0.98 a 0.98±0.05 c P2 0.227±0.003 b 52.00±0.54 c 20.14±0.04 b 27.86±0.58 a 1.08±0.02 c P3 0.264±0.005 a 60.03±0.43 a 17.00±0.42 c 22.97±0.04 b 1.50±0.03 a P4 0.270±0.009 a 55.82±0.65 b 19.50±0.46 b 24.68±0.24 b 1.26±0.03 b T2 P1 0.243±0.020 B 54.56±1.39 A 29.17±2.40 AB 16.27±1.05 B 1.14±0.10 A P2 0.270±0.025 B 52.09±1.33 A 32.06±0.67 A 15.85±1.12 B 1.09±0.06 A P3 0.307±0.012 B 53.34±1.05 A 25.02±0.83 B 21.64±1.31 A 1.14±0.05 A P4 0.477±0.050 A 43.97±1.35 B 32.37±1.43 A 23.66±0.61 A 0.79±0.04 B 说明:数据为平均值±标准误。大小写字母分别表示T2和T1时期不同处理间差异显著(P<0.05) Table 2. Effects of initial soil available phosphorus level on biomass and allocation of Ph. edulis seedlings
-
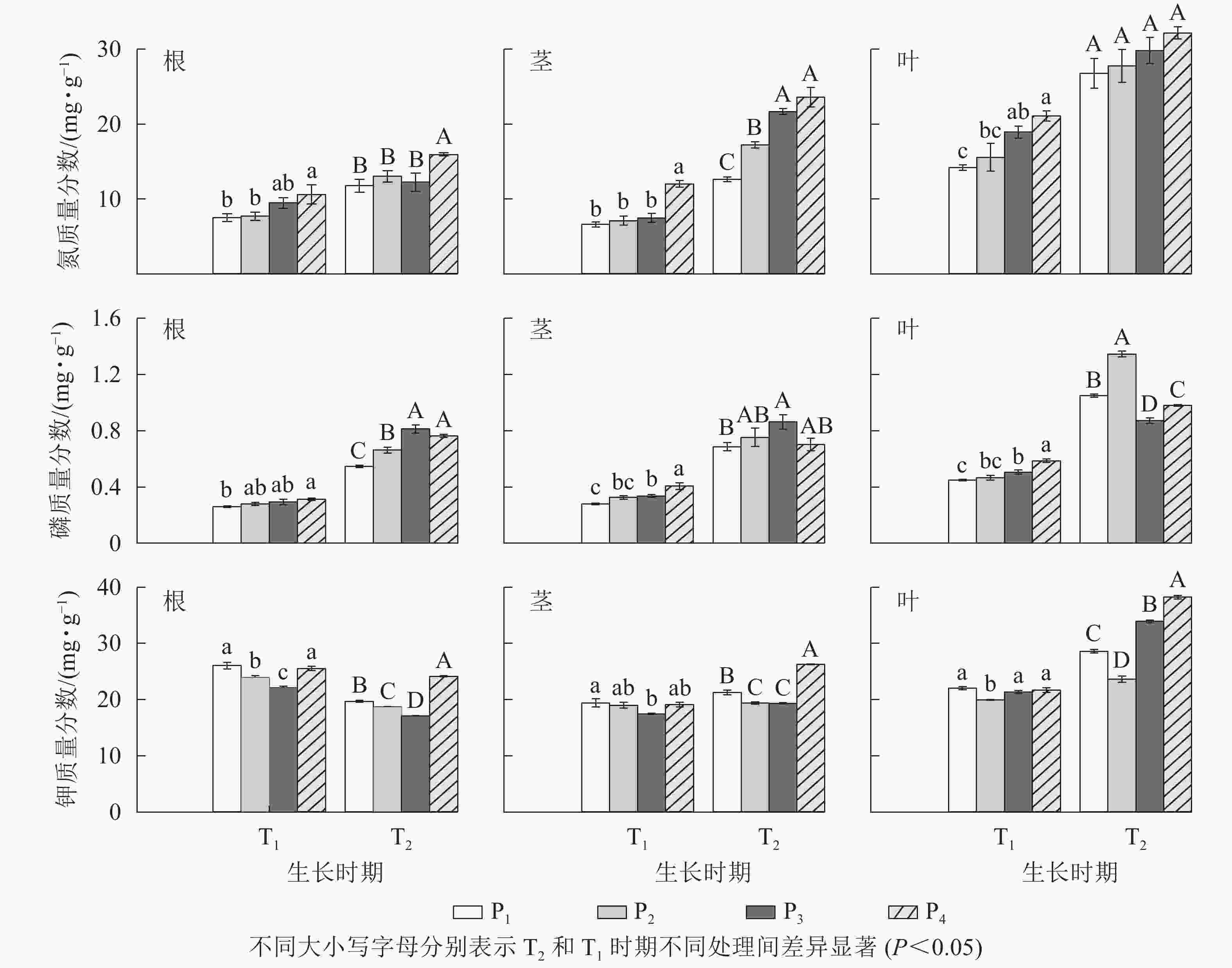
由图1可见:T1时,低磷处理组(P1和P2)较P4均显著降低了毛竹各组织氮质量分数(P<0.05),也显著降低了茎和叶的磷质量分数(P<0.05),但根的磷质量分数仅在P1处理下较P4显著降低了17.01% (P<0.05);此时P1和P4处理的毛竹各组织钾质量分数均无显著差异(P>0.05),但P2处理根和叶的钾质量分数较P4显著降低了6.18%和8.05% (P<0.05)。T2时,毛竹各组织氮质量分数也均随土壤有效磷水平降低而减小,其中低磷处理显著降低了根和茎的氮质量分数(P<0.05),但叶的氮质量分数在不同土壤有效磷水平间无显著差异(P>0.05);此时低磷处理显著降低了根磷质量分数(P<0.05),叶中则显著增加(P<0.05),但茎上无显著差异(P>0.05);而低磷处理组较P4均显著降低了该时期各组织钾质量分数(P<0.05)。
-
由表3显示:无论T1还是T2时期,低磷处理(P1和P2)均显著降低了毛竹幼苗各组织和整株氮、磷、钾积累量(P<0.05)。其中T1时,P1和P2处理的氮积累量较P4分别显著降低了50.28%和38.74% (P<0.05),磷积累量则分别显著降低了42.59%和28.70% (P<0.05),钾积累量则分别显著减小了27.10%和21.55% (P<0.05);T2时,P1和P2处理的氮、磷、钾养分积累量分别依次较P4显著降低了66.86%和57.03%、57.11%和43.16%、60.94%和60.42% (P<0.05)。
生长
时期初始土壤有效磷水平 根养分积累量/(mg·株−1) 茎养分积累量/(mg·株−1) 氮 磷 钾 氮 磷 钾 T1 P1 0.74±0.08 b 0.025±0.001 b 2.53±0.07 b 0.31±0.02 b 0.013±0.001 b 0.89±0.03 b P2 0.91±0.07 b 0.033±0.001 b 2.82±0.06 b 0.33±0.03 b 0.015±0.000 b 0.87±0.01 bc P3 1.50±0.08 a 0.046±0.004 a 3.50±0.09 a 0.34±0.03 b 0.015±0.001 b 0.78±0.01 c P4 1.60±0.18 a 0.047±0.003 a 3.85±0.19 a 0.63±0.01 a 0.021±0.001 a 1.01±0.05 a T2 P1 1.57±0.18 B 0.073±0.009 B 2.62±0.26 B 0.89±0.02 C 0.048±0.002 B 1.49±0.03 B P2 1.81±0.06 B 0.093±0.004 B 2.61±0.18 B 1.50±0.19 B 0.065±0.008 B 1.68±0.17 B P3 2.01±0.23 B 0.133±0.003 A 2.79±0.06 B 1.66±0.05 B 0.066±0.003 B 1.48±0.06 B P4 3.36±0.42 A 0.160±0.016 A 5.08±0.62 A 3.59±0.11 A 0.109±0.015 A 4.03±0.32 A 生长
时期初始土壤有效磷水平 叶养分积累量/(mg·株−1) 整株养分积累量/(mg·株−1) 氮 磷 钾 氮 磷 钾 T1 P1 0.77±0.02 c 0.024±0.001 c 1.18±0.02 b 1.81±0.10 c 0.062±0.001 d 4.60±0.09 c P2 0.99±0.11 bc 0.029±0.001 b 1.26±0.04 b 2.23±0.19 c 0.077±0.001 c 4.95±0.08 c P3 1.16±0.07 b 0.031±0.001 b 1.29±0.04 b 2.99±0.08 b 0.092±0.004 b 5.57±0.13 b P4 1.41±0.02 a 0.039±0.001 a 1.45±0.06 a 3.64±0.20 a 0.108±0.003 a 6.31±0.28 a T2 P1 1.06±0.08 C 0.042±0.006 B 1.14±0.16 C 3.51±0.24 C 0.163±0.016 C 5.25±0.39 B P2 1.24±0.26 BC 0.059±0.010 B 1.03±0.17 C 4.55±0.46 BC 0.216±0.022 BC 5.32±0.51 B P3 2.02±0.31 B 0.058±0.005 B 2.26±0.24 B 5.69±0.57 B 0.257±0.003 B 6.54±0.33 B P4 3.65±0.38 A 0.111±0.014 A 4.33±0.54 A 10.59±0.86 A 0.380±0.045 A 13.44±1.43 A 说明:数据为平均值±标准误。大小写字母分别表示T2和T1时期不同处理间差异显著(P<0.05) Table 3. Effects of initial soil available phosphorus level on nutrient accumulation of Ph. edulis seedlings
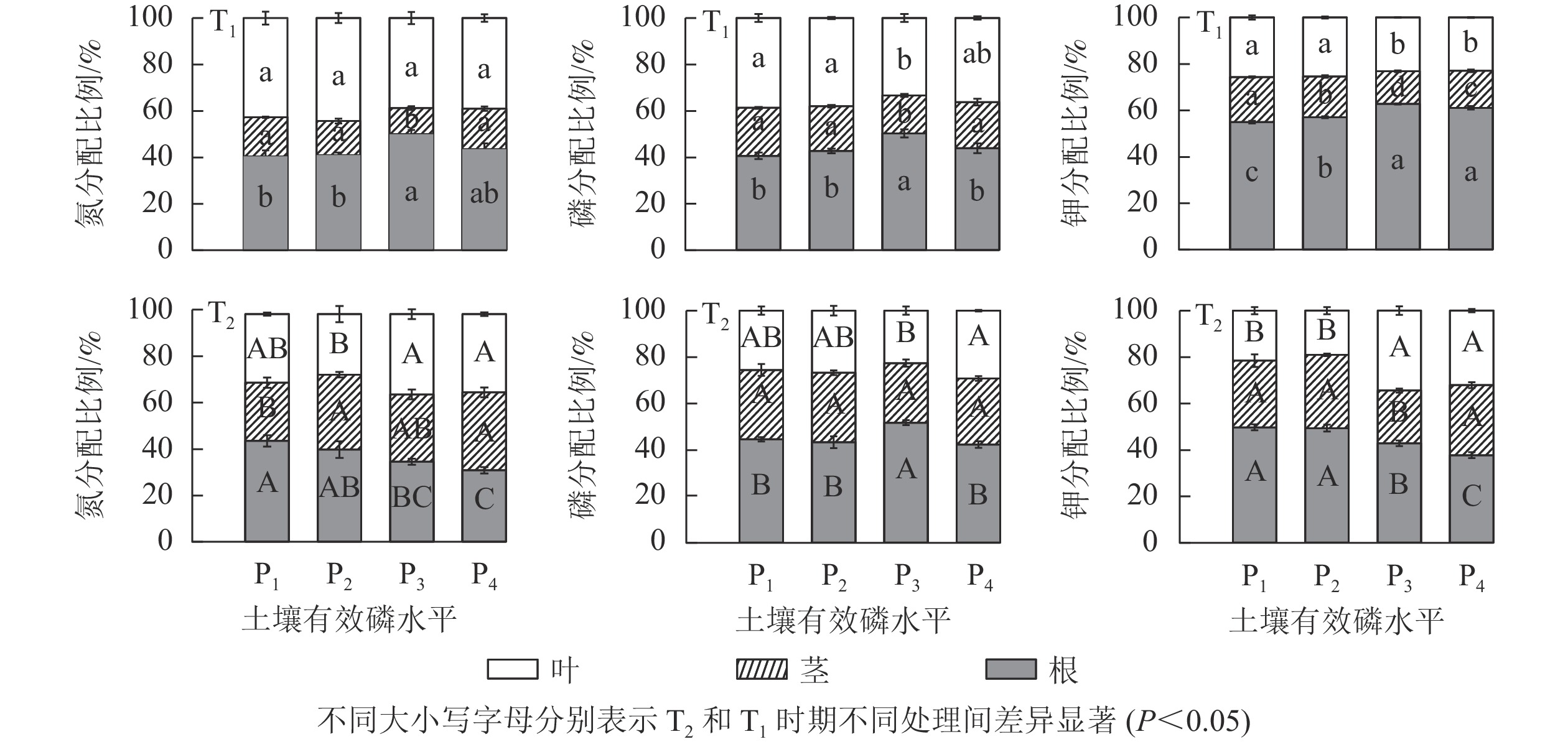
由图2显示:T1时期,氮养分主要分配在根和叶上,分别占40%,且低磷处理组(P1和P2)较P3显著降低了氮在根的分配比例(P<0.05);此时磷养分在各组织分配比例从大到小均依次为根、叶、茎,且低磷处理组也较P3显著降低了磷分配在根的比例(P<0.05);钾养分与磷相似,分配比例从大到小均依次为根、叶、茎,此时低磷处理组较P3和P4均显著降低了其在根的分配比例(P<0.05)。T2时期,氮分配在各组织比例相当,且低磷处理组的氮分配在根的比例较P4均分别显著增加了41.05%和28.85% (P<0.05);钾养分分配比例因土壤有效磷水平不同而异,其中低磷处理组的钾分配比例从大到小依次为根、茎、叶,但中适磷则为根、叶、茎,此时低磷处理组的钾养分分配在根的比例较P4分别显著增加了31.79%和30.86% (P<0.05)。
-
由表4可见:T1时期,低磷处理(P1和P2)显著增加了毛竹茎、叶及整株磷素利用效率,但根的磷素利用效率仅在P1下较P4显著增加了20.31%(P<0.05)。T2时期,低磷处理显著增加了根的磷素利用效率(P<0.05),叶中则显著降低(P<0.05),茎上无显著差异(P>0.05);此时仅P1的整株磷素利用效率较P4显著增加了19.05%,P2与P4间无显著差异(P>0.05)。
生长
时期初始土
壤有效
磷水平磷素利用效率/(g·mg−1) 根 茎 叶 整株 T1 P1 3.85±0.09 a 3.57±0.07 a 2.22±0.03 a 3.16±0.02 a P2 3.58±0.15 ab 3.07±0.11 b 2.15±0.08 ab 2.93±0.07 b P3 3.44±0.21 ab 2.97±0.08 b 1.98±0.06 b 2.86±0.07 b P4 3.20±0.09 b 2.48±0.15 c 1.71±0.03 c 2.50±0.02 c T2 P1 1.83±0.03 a 1.46±0.06 a 0.95±0.01 c 1.50±0.03 a P2 1.51±0.05 b 1.35±0.11 a 0.74±0.01 d 1.25±0.04 b P3 1.23±0.04 c 1.17±0.07 a 1.15±0.02 a 1.19±0.04 b P4 1.31±0.02 c 1.43±0.09 a 1.02±0.01 b 1.26±0.02 b 说明:磷素利用效率=生物量/磷素积累量;数据为平均值±标准误;大小写字母分别表示T2和T1时期不同处理间差异显著(P<0.05) Table 4. Effects of initial soil available phosphorus level on phosphorus utilization efficiency of Ph. edulis seedlings
-
根际土壤环境直接影响土壤养分的转化、迁移及被植物吸收的能力[18],根际土壤有效磷作为表征土壤供磷能力的重要指标,是植物吸收磷素的直接形态[19]。本研究中,低磷胁迫显著降低了当年生长季末根际土壤pH,但其有效磷质量分数较初始设置水平增加,这可能是磷素缺乏时,毛竹根系会分泌苹果酸、草酸等有机酸物质进入土壤[20],增强根际酸化能力,并与土壤中磷酸铁、磷酸铝等难溶性磷酸盐作用,释放出磷酸盐,可相对提高磷的有效性;此时根际土壤全氮质量分数随有效磷水平降低而增加,但有机质和速效钾质量分数无显著差异,这表明当年生长季末时,极低磷胁迫会相对更阻碍毛竹幼苗吸收根际土壤氮素,抑制幼苗生长发育。随育苗时间推移,低磷胁迫显著增加了翌年快速生长期的根际土壤有机质质量分数,但有效磷降幅较小,这可能是由于低磷胁迫下的毛竹根系会随着生长分泌更多有机物质,缓解难溶性磷酸盐在土壤中的沉积,维持土壤磷肥力。此时,低磷环境均会显著限制毛竹幼苗吸收土壤氮素。
-
低磷胁迫显著抑制了当年生长季末毛竹幼苗生物量的积累,这可能是由于磷素不足会导致植物体内核酸、核蛋白合成受阻,抑制细胞形成和分裂[21]。植物养分平衡作为生物量积累的基础,其养分浓度和积累量受土壤养分有效性影响[22]。本研究中,养分浓度与积累量随土壤磷水平降低变化规律并不完全一致,主要原因是各组织养分积累量和生物量均随土壤磷水平降低而减小,但两者降幅不完全同步,从而对某些养分浓度造成相对稀释或浓缩[23],这是植物养分协调供应的表现形式之一。养分利用效率反映了植物对养分的利用和适应情况,本研究表明:低磷胁迫显著提高了当年生长季末毛竹整体磷素利用效率,与目前主流观点一致:缺磷素环境下的植物养分利用效率高于富态营养环境[23]。低磷胁迫显著降低了当年生长季末毛竹幼苗根冠比,也相对减少了氮、磷、钾养分在根系的分配比例,这表明生长季末时,低磷胁迫会提高毛竹叶片储存养分的比例,增强光合作用,并尽可能多的制造有机物质,在来年春季新生长时,作为源将养分输送到其他组织促进生长发育。
-
低磷胁迫显著降低毛竹生物量和养分积累量的作用持续到翌年快速生长期,且降幅较当年生长季末更高,这表明了低磷胁迫对毛竹幼苗吸收根际土壤养分的抑制作用随育苗时间延长有所增强,并进一步抑制了生物量的积累。在翌年快速生长期,低磷胁迫显著降低了根的磷质量分数,但叶相反,这可能是毛竹幼苗为应对低磷胁迫采用的“被动”策略,即通过活化细胞壁中所储存的磷素[24],促进磷素内循环,从而提高叶片光合效率[25],以维持正常生理生化活动所需。毛竹整体磷素利用效率至翌年快速生长期时仅在极低磷胁迫下显著增加,这表明毛竹幼苗对低磷胁迫的适应性随育苗时间延长而增强。此外,至翌年快速生长期,低磷胁迫显著提高了毛竹幼苗根冠比和氮、钾养分分配到根系的比例,这可能是由于低磷土壤迫使快速生长期的毛竹幼苗分配更多养分用于支持根系生长,提高根系活力;也可能是当年生长季末储存在叶片中的养分被更多地转运到根系,以维持苗木正常生长发育。
-
低磷胁迫降低了当年生长季末毛竹幼苗根际土壤pH,但维持了根际土壤高氮质量分数,这种作用持续到了翌年快速生长期,此时低磷胁迫还显著增加了根际土壤有机质质量分数。此外,低磷胁迫显著抑制了毛竹生物量和养分的积累,但提高了整株磷素利用效率;低磷抑制作用随育苗时间推移增强,但毛竹幼苗会通过提高根冠比、根系养分分配比例来提高对低磷胁迫的适应性。
Effect of low phosphorus stress on growth and nutrient physiology of Phyllostachys edulis seedlings
doi: 10.11833/j.issn.2095-0756.20210782
- Received Date: 2021-11-29
- Accepted Date: 2022-05-19
- Rev Recd Date: 2022-05-01
- Available Online: 2022-09-22
- Publish Date: 2022-10-20
-
Key words:
- low phosphorus stress /
- rhizosphere soil nutrient environment /
- Phyllostachys edulis seedlings /
- biomass /
- nutrient accumulation and allocation
Abstract:
| Citation: | ZHOU Jianfei, SHI Wenhui, PAN Kaiting, et al. Effect of low phosphorus stress on growth and nutrient physiology of Phyllostachys edulis seedlings[J]. Journal of Zhejiang A&F University, 2022, 39(5): 1010-1017. DOI: 10.11833/j.issn.2095-0756.20210782 |











 DownLoad:
DownLoad: