-
氨基甲酸酯类杀虫剂杀虫活性高,在工农业中被广泛应用,由此带来的农残问题已成为影响人类健康与环境安全的重大隐患。目前,常用于农残检测的手段主要有液相色谱、气相色谱、质谱、薄层色谱和气质联用等方法[1-5]。这些方法预处理繁琐[2-6],检测周期长,仪器昂贵,尚不能满足现场检测的要求,因此,建立快速可靠灵敏的新型分析方法日益重要,电化学生物传感器由于在农残检测中具有诸多优点,已成为农残检测分析领域的研究热点[7-10],其基本原理是传感器上的酶与底物相互作用后,生成具有电化学活性的物质,产生氧化还原峰,当酶受到农药抑制时,峰电流会相应减少[11],进而通过峰电流的降低值来判断农药对酶的抑制程度,完成农药的定量检测[12]。多壁碳纳米管(multi-walled carbon nanotubes,CNTs)因它在酶活性中心和电极表面的高速电子转移能力而被用于酶生物传感器中电子转移的“导线”,该类生物传感器已被广泛报道[13-14]。多壁碳纳米管在溶液中极易发生团聚[15],而将多壁碳纳米管用强氧化剂进行功能化处理,能够有效地阻止多壁碳纳米管发生团聚,使多壁碳纳米管很好地分散在溶液中,形成均一、稳定的分散液[12, 14],将其用于修饰电极,预期可以制备多用途的生物传感器[17]。在电化学生物传感器的构建过程中,酶在电极上的固定是关键。目前,使用的方法有吸附法、包埋法、共价键合法、交联法、溶胶-凝胶法及电聚合法等[18-20],这些方法将酶直接修饰于电极表面,酶层容易脱落,传感器稳定性差。双醛纤维素(dialdehyde cellulose,DAC)作为纤维素的衍生物之一,其分子结构上的羟基容易与极性官能基团形成氢键,使其具有较强的吸附能力,同时其分子结构中的醛基可以与酶分子中的氨基通过共价键联生成Schiff碱化合物[21-22],能使酶稳定地固定于载体上,是一种极具前景的固定化酶载体材料。本研究将新型材料与新型方法结合,将游离酶通过化学键联技术固定在载体上制成固定化酶,再通过自组装法制备多层壳聚糖/固定化乙酰胆碱酯酶/功能化碳纳米管电化学生物传感器(Chi/DAC-AChE/F-CNTs/GCE)。与现有常规方法相比,该方法吸附酶量大,酶层不易脱落,传感器性能稳定,线性范围宽,灵敏度高,可为氨基甲酸酯类杀虫剂检测提供快速灵敏的方法,具有一定的新意。
-
CHI660C电化学工作站(上海辰华仪器有限公司,中国);三电极系统:修饰的CHI104玻碳电极(glassy carbon electrode,GCE,直径3 mm)作为工作电极,饱和甘汞电极(saturated calomel electrode,SCE)作为参比电极,铂电极作为对电极;SK3210HP超声波清洗器(上海科导超声仪器有限公司,中国);电子分析天平(Sartorius公司,德国);DF-101S型集热式恒温加热磁力搅拌器(河南巩义予华仪器设备有限公司,中国);DHG-9123A 电热恒温鼓风干燥箱(上海一恒科学仪器有限公司,中国)。
双醛纤维素(DAC,水热合成法合成);1-萘基-N-甲基氨基甲酸酯(CAB,纯度>99.6%,上海市农药研究所),乙酰胆碱酯酶(acetylcholinesterase,AChE,220 mol·s-1·g-1,上海源叶生物科技有限公司),碘化乙酰硫代胆碱(acetylthiocholine iodid,ATCh,纯度>98%,阿拉丁公司);多壁碳纳米管(CNTs,纯度>95%,中国科学院成都化学有限公司);壳聚糖(Chi,脱乙酰度≥90%,国药集团化学试剂有限公司);其他试剂均为分析纯;实验用水为双蒸蒸馏水。
-
取10.0 mg多壁碳纳米管置于50.0 mL浓盐酸中,磁力搅拌下加热回流7.0 h,以去除金属催化剂。纯化后的多壁碳纳米管置于80.0 mL酸液[V(硝酸):V(硫酸) = 1:3]中,室温下超声反应10.0 h。蒸馏水洗至中性,得到羧基化的多壁碳纳米管(functional carbon nanotubes,F-CNTs)[12],干燥成粉末,取10.0 mg羧基化的多壁碳纳米管溶于N,N-二甲基甲酰胺中,超声20 min使其分散均匀备用。
-
磷酸盐缓冲液中,28 ℃温度下双醛纤维素与乙酰胆碱酯酶磁力搅拌反应2.5 h后取出分离,蒸馏水洗涤至无游离酶,抽滤干燥,制成固定化乙酰胆碱酯酶悬浊液(DAC-AChE),4 ℃冰箱中保存备用。
-
玻碳电极分别用0.30和0.05 μm的氧化铝粉末在抛光布上进行抛光,大量二次蒸馏水冲洗,后将玻碳电极移入超声清洗仪中依次用二次蒸馏水、无水乙醇、二次蒸馏水超声清洗(5 min·次-1),室温晾干。取5.0 μL 羧基化的多壁碳纳米管(F-CNTs)溶液滴涂至预处理好的玻碳电极表面,晾干后再滴涂5.0 μL 固定化乙酰胆碱酯酶(DAC-AChE),自然干燥,最后滴涂5.0 μL壳聚糖溶液(Chi,5.0 g·L-1),制成Chi/DAC-AChE/F-CNTs/GCE传感器,4 ℃冰箱中保存。同条件下制备Chi/DAC-AChE/GCE,Chi/DAC/F-CNTs/GCE修饰电极。
采用传统三电极体系,以 5.0 mmol·L-1[Fe(CN)6]4-/3-为氧化还原探针,以修饰电极为工作电极,饱和甘汞电极为参比电极,铂丝为辅助电极,于0.l mol·L-1 氯化钾电解质溶液中,进行电化学阻抗表征。
-
传感器浸入0.2 mmol·L-1 碘化乙酰硫代胆碱的磷酸盐缓冲溶液(pH 6.6)中进行差分脉冲伏安扫描,记录未受氨基甲酸酯类杀虫剂抑制的传感器的峰电流I0;然后将该传感器侵入含不同浓度氨基甲酸酯类杀虫剂的磷酸盐缓冲溶液中抑制14 min,洗净后于0.2 mmol·L-1碘化乙酰硫代胆碱的磷酸盐缓冲溶液(pH 6.6)中进行差分脉冲伏安扫描,检测受氨基甲酸酯类杀虫剂抑制后的传感器的峰电流I1,按公式(1)计算氨基甲酸酯类杀虫剂对该传感器中酶的抑制率I(%)。
$$I\left( \% \right) = {{{I_0} - {I_1}} \over {{I_0}}} \times 100\% $$ (1) -
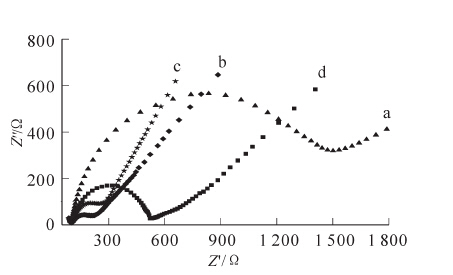
利用交流阻抗对传感器进行表征,结果如图 1所示。由图 1可知:裸电极(a)的界面电子传递阻力很大,将羧基化的多壁碳纳米管和双醛纤维素修饰到电极表面(b),阻抗值明显减少。这是因为功能化的碳纳米管极易被溶剂润湿,能形成较好的电极/溶液界面,加速电子传递。而当固定化乙酰胆碱酯酶固定到电极表面(c),阻抗值增加。这是因为乙酰胆碱酯酶的加入,一方面增大了[Fe(CN)6]4-/3-通过膜时的阻力,另一方面使[Fe(CN)6]4-/3-向电极表面扩散的有效截面积也进一步变小,从而导致阻抗值增大,这也说明固定化酶制备成功,且已修饰到电极表面。加Chi/DAC-AChE/F-CNTs/GCE电极(c)与Chi/DAC-AChE/GCE电极(d)相比,阻抗值小很多,这是由于羧基化的多壁碳纳米管表面带有大量的羧基,不仅改进了多碳纳米管的分散性,而且能加速氧化还原物质与电极间的电子转移。
-
图 2A为Chi/DAC-AChE/F-CNTs/GCE 电极在5.0 mmol·L-1 铁氰化钾[K3Fe(CN)6]-0.1 mol·L-1 氯化钾溶液中不同扫描速率下的循环伏安图,图 2B为峰电流与扫速平方根的线性关系图。由图 2可知,在铁氰化钾-氯化钾溶液中随着扫描速率的增加,电极的还原峰电流和氧化峰电流与扫描速率平方根呈线性关系,线性回归方程列于表 1。图 2结合表 1可知:随着扫速(v)的增加,峰电流(I)亦相应增加,峰电流与扫描速率平方根呈良好的线性关系,说明该电极反应过程受扩散控制。

图 2 传感器在不同扫描速率下的循环伏安图(A)和峰电流与扫速平方根的关系图(B)
Figure 2. Cyclic voltammograms of sensor at different scan rates&A) and the dependence of peak currents vs.v1/2(B)
表 1 扫速对峰电流影响数据的拟合方程
Table 1. Equation of the effect of scan rate on the peak current
拟合方程 相关系数R 标准差S 样本数% P值 还原(Red) I=33.374 7v1/2 + 7.955 5 0.991 8 11.987 3 8 <0.01 氧化(Ox) I=-26.612 4v1/2 - 16.104 3 0.996 0 6.652 7 8 <0.01 裸GCE,Chi/DAC/F-CNTs/GCE,Chi/DAC-AChE/F-CNTs/GCE和Chi/DAC-AChE/GCE的循环伏安曲线如图 3所示。由图 3可知:在pH 6.6的磷酸盐缓冲溶液中,Chi/DAC/F-CNTs/GCE修饰电极(a),Chi/DAC-AChE/F-CNTs/GCE 修饰电极(b)和Chi/DAC-AChE/GCE修饰电极(c)均未观察到峰出现,说明底物碘化乙酰硫代胆碱不存在时,未见明显的氧化还原反应。当加入碘化乙酰硫代胆碱后,裸GCE电极(d)和Chi/DAC/F-CNTs/GCE修饰电极(e)上仍没有峰出现,说明羧基化的多壁碳纳米管和双醛纤维素在该电势范围无活性,而Chi/DAC-AChE/F-CNTs/GCE 修饰电极(f)和Chi/DAC-AChE/GCE修饰电极(g)都出现不可逆氧化峰,此氧化峰是由于乙酰胆碱酯酶催化碘化乙酰硫代胆碱水解生成电活性物质硫代胆碱,硫代胆碱中的巯基被氧化所产生的,且Chi/DAC-AChE/F-CNTs/GCE 修饰电极(f)的峰电流明显比Chi/DAC-AChE/GCE修饰电极(g)的大,说明羧基化的多壁碳纳米管有助于氧化还原物质与电极间的电子转移,电极灵敏度增强。将Chi/DAC-AChE/F-CNTs/GCE 修饰电极和Chi/DAC-AChE/GCE修饰电极在杀虫剂1-萘基-N-甲基氨基甲酸酯中抑制后,再于碘化乙酰硫代胆碱-磷酸盐缓冲溶液中测试循环伏安曲线(k和h),结果显示硫代胆碱的氧化电流下降,说明1-萘基-N-甲基氨基甲酸酯抑制了电极上乙酰胆碱酯酶的活性。利用硫代胆碱氧化产生的电流变化情况可定量分析乙酰胆碱酯酶的活性,表征氨基甲酸酯类杀虫剂在抑制反应中的作用,通过抑制率可定量检测氨基甲酸酯类杀虫剂含量。

图 3 Chi/DAC/F-CNTs/GCE ( a ,e), Chi/DAC-AChE/ F-CNTs/GCE (b,f,k), Chi/DAC-AChE/GCE(c,g,h),裸GCE(d)在碘化乙酰硫代胆碱- 磷酸盐缓冲液中的循环伏安曲线
Figure 3. Cyclic voltammograms of the Chi/DAC/F-CNTs/GCE (a, e ) ,Chi/DAC-AChE/F-CNTs/GCE ( b ,f ,k) ,Chi/DAC - AChE/GCE(c,g,h),bare GCE (d) in ATCh-PBS
图 4(A)为Chi/DAC-AChE/F-CNTs/GCE传感器对碘化硫代乙酰胆碱的差分脉冲伏安图,显示了传感器对不同浓度碘化乙酰硫代胆碱检测的响应性。从图 4(A)可以看出:随着浓度的增加,电流亦增加,表明乙酰胆碱酯酶已经成功修饰到电极上,且能催化溶液中的碘化乙酰硫代胆碱发生水解。

图 4 传感器对碘化乙酰硫代胆碱的差分脉冲伏安图(A)和 峰电流与碘化乙酰硫代胆碱浓度的关系图(B)
Figure 4. Differential pulse voltammetry of ATCh (A) and relationships between peak current and ATCh concentration (B)
提取图 4(A)中峰电流,考察峰电流与碘化乙酰硫代胆碱浓度的关系,结果表明:峰电流(I)与碘化乙酰硫代胆碱浓度(c)呈现良好的线性关系,其相关方程为:I=-6.757 9c-4.138 0(R=0.995 8,S=0.0738,N=7,P<0.01),详见图 4(B)。
-
基于农药对乙酰胆碱酯酶的抑制作用制备传感器用于农药的检测,传感器的性能主要受电解质溶液pH值和传感器在农药中的抑制时间的影响,为此,本研究主要考察了电解质溶液的pH值和传感器在氨基甲酸类杀虫剂中的抑制时间对峰电流的影响,结果如图 5所示。对测定数据进行非线性拟合,获得理论方程如表 2所示。

图 5 pH值对Chi/DAC-AChE/F-CNTs/GCE的影响(A)和抑制时间与酶抑制率的关系曲线(B)
Figure 5. Effect of pH on Chi/DAC-AChE/F-CNTs/GCE and relationships between inhibitin time and inhibition rate (B)
表 2 pH和抑制时间对传感器影响数据的拟合方程
Table 2. Equation of the effect of pH and inhibiting time on the sensor
系统 拟合方程 相关系数R 样本数n A $y=2.2845+\frac{-4.9084}{0.9610\sqrt{\pi/2}}{{e}^{-2\frac{{{\left( x-6.7099 \right)}^{2}}}{{{0.9610}^{2}}}}}$ 0.9759 10 B $I\left( \% \right) = {{7.7991 - 45.4808} \over {1 + {e^{{{t - 8.3566} \over {1.8397}}}}}} + 45.4808$ 0.9988 9 从图 5A可知:当磷酸盐缓冲溶液pH 6.6 时,测得的峰电流最大,说明电解质的pH 6.6时更易保持酶的活性,所以本实验选择 pH 6.6 的磷酸盐缓冲溶液作为底液。由图 5B可知:在1-萘基-N-甲基氨基甲酸酯溶液中随着时间的延长,Chi/DAC-AChE/F-CNTs/GCE电极在碘化乙酰硫代胆碱中的峰电流明显降低,1-萘基-N-甲基氨基甲酸酯对乙酰胆碱酯酶的抑制作用加强,酶活性在抑制作用的前14 min 内迅速减小,当抑制时间超过14 min,乙酰胆碱酯酶的抑制率趋于稳定,表明1-萘基-N-甲基氨基甲酸酯与乙酰胆碱酯酶中有效基团的结合作用已到达饱和状态,因此,在1-萘基-N-甲基氨基甲酸酯的测定过程中,抑制时间选择为14 min。
-
将Chi/DAC-AChE/F-CNTs/GCE传感器分别浸泡在不同浓度的杀虫剂1-萘基-N-甲基氨基甲酸酯标准品中抑制后,测试碘化乙酰硫代胆碱在传感器上的氧化峰电流,结果如图 6所示。随着杀虫剂质量浓度的增大,峰电流逐渐减小,电流的衰减与杀虫剂的浓度存在一定的关系。以1-萘基-N-甲基氨基甲酸酯对乙酰胆碱酯酶的抑制率对1-萘基-N-甲基氨基甲酸酯的质量浓度作图,如图 6所示,可分为2个线性段:1.5~6.0 μg·L-1和6.0~16.0 μg·L-1。线性回归方程列于表 3。按抑制率为10%时为氨基甲酸酯类杀虫剂的最低检出限,得到该传感器的检出限为3.5 μg·L-1,传感器的灵敏度为3.7~5.1 μg·L-1。

图 6 Chi/DAC-AChE/F-CNTs/GCE在不同浓度1-萘基-N-甲基氨基甲酸酯中的微分脉冲伏安图(A)和酶抑制率与1-萘基-N-甲基氨基甲酸酯浓度的关系图(B)
Figure 6. Differential pulse voltammograms of Chi/DAC-AChE/F-CNTs/GCE for different concentration CAB (A) and relationships between inhibition rate and CAB concentration (B)
表 3 1-萘基-N-甲基氨基甲酸酯浓度对酶抑制率影响数据的拟合方程
Table 3. Equation of the effect of CAB concentration on the inhibition rate
质量浓度 c/(μg.L-1) 拟合方程 相关系数R 标准差S 样本数n P值 1.5~6.0 I(%)=3.728 8c-3.130 1 0.995 6 0.565 5 10 <0.01 6.0~16 I(%)=5.051 0c-10.438 3 0.998 2 0.984 9 10 <0.01 -
利用1-萘基-N-甲基氨基甲酸酯标准品,配制10.0 μg·L-1溶液,采用标准加入法测定样品回收率,结果如表 4所示。5次平行测定的回收率为97.89%,说明该生物传感器用于实际样品的检测结果是比较准确的。
表 4 传感器对1-萘基-N-甲基氨基甲酸酯的回收率测定
Table 4. Recoveries of the sensor for CAB
样品 初始质量浓度/(g.L-1) 标准加入质量浓度/(g.L-1) 检测质量浓度/(g.L-1) 相对标准差/% 回收率/% 相对误差/% CAB 1.0×10-7 1.0×10-7 1.952 4×10-7 1.66 97.89 2.12 1.983 6×10-7 1.961 8×10-7 1.938 9×10-7 1.951 7×10-7 -
同一支传感器在含1-萘基-N-甲基氨基甲酸酯的磷酸盐缓冲溶液(pH 6.6)中抑制14 min后,放入含碘化乙酰硫代胆碱的磷酸盐缓冲溶液中平行测定10次,峰电流值的相对标准偏差为1.57%,说明该电极的重复性较好。
将传感器浸泡于磷酸盐缓冲溶液(pH 6.6)中4 ℃冰箱保存,10 d后,该传感器的峰电流无明显降低,1个月后再次测量,响应电流仍能保持初始响应电流的85.0%,说明此法制备的传感器寿命长且稳定性较好,为酶提供了良好的生物相容性。
氨基甲酸酯类杀虫剂对乙酰胆碱酯酶的强抑制性限制了该类传感器的重复利用。参照文献方法[23]将酶电极浸泡在磷酸盐缓冲溶液中去除部分失活的酶,实现酶片的重复利用。4 ℃冰箱中,将酶电极在0.1 mol·L-1 pH 6.6的磷酸盐缓冲溶液中浸泡3 d,其峰电流值能够恢复到原来的 93.5%,与文献相比[24],此法简捷可靠。
-
氨基甲酸酯类杀虫剂抑制乙酰胆碱酯酶活性的机制是:氨基甲酸酯类杀虫剂进入人体后,抑制乙酰胆碱酯酶活性使酶活性中心丝氨酸的羟基被氨基甲酰化因而失去酶对乙酰胆碱的水解能力,以致体内乙酰胆碱大量蓄积,使中枢神经系统及胆碱能神经过度兴奋,最后转入抑制和衰竭,引发一系列疾病[25]。有机磷类杀虫剂进入人体后,其磷酰基会与乙酰胆碱酯酶的活性部分紧密结合形成磷酰化胆碱酯酶,同样可使乙酰胆碱酯酶丧失分解乙酰胆碱的能力,因此,本研究提供的传感器不但可用于氨基甲酸酯类杀虫剂的检测,还可用于有机磷类杀虫剂的检测,可以说是有机磷类杀虫剂检测的一种新方法。
-
本研究通过化学键联技术将游离酶固定化后修饰到玻碳电极,成功制得了Chi/DAC-AChE/F-CNTs/GCE传感器,利用酶抑制原理建立了检测氨基甲酸酯类杀虫剂的方法。该传感器对典型氨基甲酸酯类杀虫剂1-萘基-N-甲基氨基甲酸酯的检出限可达3.5 μg·L-1。该法与目前直接用游离酶修饰的酶电极方法不同,此法是以固定化酶的形式间接修饰在电极上,制备简单,方法新颖,不但能较好地保持酶的活性,而且能增强酶在电极表面的稳定性,同时利用羧基化的多壁碳纳米管的多孔性,大比表面积,来增强电子传递。由于其他氨基甲酸酯类杀虫剂与1-萘基-N-甲基氨基甲酸酯对乙酰胆碱酯酶的抑制原理相同,因此,此传感器同样适用于其他的氨基甲酸酯类杀虫剂,在检测氨基甲酸酯类杀虫剂残留的应用中具有广阔的前景。
A new biosensor from immobilized acetylcholinesterase to detect carbamate pesticides
-
摘要: 以双醛纤维素(dialdehyde cellulose,DAC)为固载酶基质材料,通过固定化酶化学键联技术制备固定化乙酰胆碱酯酶(DAC-AChE),采用自组装法制备多层壳聚糖/固定化乙酰胆碱酯酶/功能化碳纳米管生物传感器(Chi/DAC-AChE/F-CNTs/GCE),利用交流阻抗法(AC impedance,ACI),循环伏安法(cyclic voltammetry,CV)及差分脉冲伏安法(differential pulse voltammetry,DPV)考察新型传感器对农残的检测性能。结果表明:成功制备了新型固定化乙酰胆碱酯酶电化学传感器;新型传感器对氨基甲酸酯杀虫剂1-萘基-N-甲基氨基甲酸酯(carbary,CAB)具有良好的响应,检测方法响应快速,线性范围宽,灵敏度高,最低检出限可达3.5 μg·L-1,具有很好的重现性和稳定性,有关结果可为氨基甲酸酯类杀虫剂的检测提供一种新的分析方法。Abstract: Dialdehyde cellulose(DAC), an immobilized enzyme matrix material,was used to prepare an immobilized acetylcholinesterase according to immobilized enzyme chemical linking technology.The immobilized acetylcholinesterase was then used to prepare a new multilayer chitosan/immobilized acetylcholinesterase/functionalized carbon nanotube/glassy carbon electrode (Chi/DAC-AChE/F-CNTs/GCE) biosensor.AC impedance (ACI), cyclic voltammetry(CV), and differential pulse voltammetry(DPV) were utilized to characterize the detection performance of pesticides acting on the biosensor.Results showed that the new Chi/DAC-AChE/F-CNTs/GCE biosensor was successfully prepared and had a good response to carbaryl (CAB).This new sensor provided a quick and easy detection method with a wide range and a high sensitivity having a minimum detection limit of 3.5 μg·L-1 with good reproducibility and stability.These results could provide a new analytical method for the detection of carbamate pesticides.
-
Key words:
- dialdehyde cellulose /
- acetylcholinesterase /
- biosensors /
- carbamate pesticides /
- pesticide residue /
- detection
-
表 1 扫速对峰电流影响数据的拟合方程
Table 1. Equation of the effect of scan rate on the peak current
拟合方程 相关系数R 标准差S 样本数% P值 还原(Red) I=33.374 7v1/2 + 7.955 5 0.991 8 11.987 3 8 <0.01 氧化(Ox) I=-26.612 4v1/2 - 16.104 3 0.996 0 6.652 7 8 <0.01 表 2 pH和抑制时间对传感器影响数据的拟合方程
Table 2. Equation of the effect of pH and inhibiting time on the sensor
系统 拟合方程 相关系数R 样本数n A $y=2.2845+\frac{-4.9084}{0.9610\sqrt{\pi/2}}{{e}^{-2\frac{{{\left( x-6.7099 \right)}^{2}}}{{{0.9610}^{2}}}}}$ 0.9759 10 B $I\left( \% \right) = {{7.7991 - 45.4808} \over {1 + {e^{{{t - 8.3566} \over {1.8397}}}}}} + 45.4808$ 0.9988 9 表 3 1-萘基-N-甲基氨基甲酸酯浓度对酶抑制率影响数据的拟合方程
Table 3. Equation of the effect of CAB concentration on the inhibition rate
质量浓度 c/(μg.L-1) 拟合方程 相关系数R 标准差S 样本数n P值 1.5~6.0 I(%)=3.728 8c-3.130 1 0.995 6 0.565 5 10 <0.01 6.0~16 I(%)=5.051 0c-10.438 3 0.998 2 0.984 9 10 <0.01 表 4 传感器对1-萘基-N-甲基氨基甲酸酯的回收率测定
Table 4. Recoveries of the sensor for CAB
样品 初始质量浓度/(g.L-1) 标准加入质量浓度/(g.L-1) 检测质量浓度/(g.L-1) 相对标准差/% 回收率/% 相对误差/% CAB 1.0×10-7 1.0×10-7 1.952 4×10-7 1.66 97.89 2.12 1.983 6×10-7 1.961 8×10-7 1.938 9×10-7 1.951 7×10-7 -
[1] HAYAMA T, YOSHIDA H, TODOROKI K, et al.Determination of polar organophosphorus pesticides in water samples by hydrophilic interaction liquid chromatography with tandem mass spectrometry[J].Rapid Commun Mass Spectrom, 2008, 22(14):2203-2210. [2] 赵颖,蒋施,金雁,等.食用菌中多种氨基甲酸酯类农药残留的超高效液相色谱-串联质谱法测定研究[J].化学通报,2012,75(2):150-154. ZHAO Ying, JIANG Shi, JIN Yan, et al.Study on UPLC-MS/MS method for determination of carbamate pesticide residue in mushrooms[J].Chemistry, 2012, 75(2):150-154. [3] 金立弟,赵明会,韩宇.GC-MS法测定银杏叶中3种氨基甲酸酯类农药的残留量[J].药物分析,2011,31(7):1379-1380. JIN Lidi, ZHAO Minghui, HAN Yu.GC-MS determination 3 kinds of carbamate pesticides in Ginkgo biloba[J].Chin J Pharmacl Anal, 2011, 31(7):1379-1380. [4] XU Zhixiang, FANG Guozhen, WANG Shou.Molecularly imprinted solid phase extraction coupled to highperformance liquid chromatography for determination of trace dichlorvos residues in vegetables[J].Food Chem, 2010, 119(2):845-850. [5] 林诗云,吴晓波,陈海云,等.固相萃取-高效液相色谱法测定水中6种氨基甲酸酯类农药残留量[J].农药,2010,49(12):909-911. LIN Shiyun, WU Xiaobo, CHEN Haiyun, et al.Determination of six carbamates pesticide residues in water by SPE-HPLC[J].Chin J Pest, 2010, 49(12):909-911. [6] 杜晓婷,周敏,张剑,等.蔬菜中甲胺磷等5种有机磷农药残留量的分散液-液微萃取/气质联用技术检测[J].分析测试学报,2010,29(7):751-754. DU Xiaoting, ZHOU Min, ZHANG Jian, et al.Determination of five organophosphorus pesticide residues in vegetables based on dispersive liquid-liquid microextraction coupled with gas chromatography-mass spectrometry[J].J Instrum Anal, 2010, 29(7):751-754. [7] 闵红,曲云鹤,李晓华,等.Au掺杂Fe3O4纳米粒子酶传感器的制备及其应用于有机磷农药检测的研究[J].化学学报,2007,65(20):2303-2308. MIN Hong, QU Yunhe, LI Xiaohua, et al.Au-doped Fe3O4 nanoparticle immobilized acetylcholinesterase sensor for the detection of organophosphorus pesticide[J].Acta Chem Sin, 2007, 65(20):2303-2308. [8] 孙春燕,李宏坤,平红,等.AuNPs/Sol-gel复合膜法固定乙酰胆碱酯酶生物传感器检测有机磷农药[J].高等学校化学学报,2011,32(11):2533-2538. SUN Chunyan, LI Hongkun, PING Hong, et al.Determination of organophosphorus pesticides using a biosensor based on acetylcholinesterase immobilized by AuNPs/Sol-gel composite membrane[J].Chem J Chin Univ, 2011, 32(11):2533-2538. [9] 干宁,王峰,杨欣,等.采用纳米修饰双酶电极生物传感器检测有机膦与氨基甲酸酯类农药[J].农药学学报,2008,10(3):329-334. GAN Ning, WANG Feng, YANG Xin, et al.A nano particles modified bienzyme electrode biosensor for the detection of carbamate and organophosphorus pesticides[J].Chin J Pest Sci, 2008, 10(3):329-334. [10] 张君,王月伶,袁倬斌.可检测有机磷农药残留的丝网印刷酶电极[J].化学学报,2006,64(5):428-434. ZHANG Jun, WANG Yuelian, YUAN Zhoubin.Screen-printed enzyme electrodes for detection of organophosphate pesticide residue[J].Acta Chem Sin, 2006, 64(5):428-434. [11] CHEN Haode, ZUO Xiaolei, SU Shao, et al.An electrochemical sensor for pesticide assays based on carbon nanotube-enhanced acetychoinesterase activity[J].Analyst, 2008, 133(9):1182-1186. [12] DU Dan, CHEN Shizhen, CAI Jie, et al.Electrochemical pesticide sensitivity test using acetylcholines-terase biosensor based on colloidal gold nanoparticle modified sol-gel interface[J].Talanta, 2008, 74(4):766-772. [13] DU Dan, CAI Jie, SONG Dandan, et al.Rapid determination of triazophos using acetylcholinesterase biosensor based on sol-gel interface assembling multiwall carbon nanotubes[J].J Appl Electrochem, 2007, 37(8):893-898. [14] SUN Xia, WANG Xiangyou, ZHAO Wenping.Multiwall carbon nanotube-based acetylcholinesterase biosensor[J].Sensor Lett, 2010, 8(2):247-252. [15] DU Dan, WANG Minghui, CAI Jie, et al.Sensitive acetylcholinesterase biosensor based on assembly of β-cyclodextrins onto multiwall carbon nanotubes for detection of organophosphates pesticide[J].Sens Actu B Chem, 2010, 146(1):337-341. [16] WU Haichen,CHANG Xueling, LIU Lei, et al.Chemistry of carbon nanotubes in biomedical applications[J].J Mater Chem, 2010, 20(6):1036-1052. [17] 孙霞,赵文苹,刘中合,等.基于功能化多壁碳纳米管的乙酰胆碱酯酶生物传感器制备[J].食品科学, 2012,33(4):282-286. SUN Xia, ZHAO Wenping, LIU Zhonghe, et al.Preparation of acetylcholinesterase biosensor based on functionalized multi-walled carbon nanotubes for pesticides detection[J].Food Sci, 2012, 33(4):282-286. [18] 高慧丽,康天放,王小庆,等.溶胶-凝胶法固定乙酰胆碱酯酶生物传感器测定有机磷农药[J].环境化学,2005,24(6):707-710. GAO Huili, KANG Tianfang, WANG Xiaoqing, et al.Determ ination of organophosphorus pesticides using a biosensor of acetylcholinesterase mmobilized by sol-gel method[J].Environ Chem, 2005, 24(6):707-710. [19] SHULGA O, KIRCHHOFF J R.An acetylcholinesterase enzyme electrode stabilized by an electrodepo-sited gold nanoparticle layer[J].Electrochem Commun, 2007, 9(5):935-940. [20] 高盐生,王媛,狄俊伟.硅溶胶-凝胶包埋纳米金和酶的葡萄糖生物传感器[J].应用化学,2011,27(3):363-366. GAO Yansheng, WANG Yuan, DI Junwei.Glucose biosensor based on gold nanoparticles and enzyme embedded in silica sol-gel network[J].Chin J Appl Chem, 2011, 27(3):363-366. [21] MA Houyi, CHEN Shenhao, NIU Lin, et al.Studies on electrochemical behavior of copper in aerated NaBr solutions with Schiff bases[J].Electrochem Soc, 2001, 148(5):208-216. [22] GROSS A R, KALRA B.Biodegradable polymers for the environment[J].Science, 2002, 297:803-807. [23] SUN Xia, WANG Xiangyou, LIU Zhen.Study on immobilization methods of acetylcholinesterase[J].Int J Food Eng, 2008, 4(8):1-11. [24] ANITHA K, MOHAN S V, REDDY S J.Development of acetylcholinesterase silica sol-gel immobilized biosensoran application towards oxydemeton methyl detection[J].Bios Bioelectr, 2004, 20(4):848-856. [25] GARBIN J R, MILORI D M B P, SIMOES M L, et al.Influence of humic substances on the photolysis of aqueous pesticide residues[J].Chemosphere, 2007, 66(9):1692-1698. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2014.03.020







 下载:
下载: