-
光系统Ⅱ(PSⅡ)是植物对温度胁迫最敏感的光合系统组分[1-3],利用非损伤、检测时间短、灵敏度高的快速叶绿素荧光诱导动力学技术[4-5],可以方便地研究温度与PSⅡ光化学活性之间的关系。低温胁迫会引起快速叶绿素荧光诱导动力学曲线(OJIP曲线)趋向平缓、O相升高、J相下降或上升、I相和P 相下降、K 点和L点出现[6-8]等变化,反映出PSⅡ有活性的反应中心数量减少[9],反应中心吸收和热耗散的能量增加[9-11],以及PSⅡ受体侧的电子传递速率降低等光合作用的“内在变化”[11-12]。低温胁迫还会使叶片叶绿素降解[12-13],导致光合作用的物质基础发生改变。目前多数研究采用离体试验材料、野外观测、设置单一温度处理等方式,温度与PSⅡ光化学活性的关系难以被准确描述。为获得不同胁迫程度下叶绿素荧光的综合性指标,当前研究主要利用隶属函数法[14-15]、主成分分析法[16-17]、TOPSIS综合评价法[18-19]和综合生物反应指数(integrated biomarker response,IBR)[20]计算综合指标。其中IBR评价法具有操作简单、实用性强和应用广泛的特点,但尚未用于计算低温胁迫下的叶绿素荧光综合指标。南极假山毛榉Nothofagus antarctica为壳斗科Fagaceae假山毛榉属Nothofagus落叶乔木或灌木,主要分布在南美洲南部的温带森林,耐寒能力极强[21],为探索低温环境下南极假山毛榉光合生理特性,本研究采用连续测定与控制试验的方法,观测低温胁迫下南极假山毛榉叶片相对叶绿素含量(relative chlorophyll content)、OJIP曲线特征、快速叶绿素荧光诱导动力学测量(JIP-test)参数等的变化,并将JIP-test参数代入IBR评价法,用以阐明低温胁迫对南极假山毛榉PSⅡ光化学活性的影响规律,并检验IBR评价法用于计算低温胁迫下的叶绿素荧光综合指标的可行性。
-
供试材料为2年生南极假山毛榉实生苗(山西省林业科学研究院基地培育),株高(50±5) cm。2018年9月初,选取长势良好,无病虫害,大小相近的南极假山毛榉5盆,置于人工气候箱中适应培养3 d。人工气候箱参数为:温度25 ℃;昼夜相隔时间12 h;光照强度500 μmol·m−2·s−1;相对湿度(60±3)%,根据表土干燥情况适量浇水。设置25、15、5、−5、−15和−25 ℃等6个测试温度,从25 ℃依次降低,降温速率为2 ℃·h−1,待植株在5 ℃的人工气候箱中测试完毕,转移到3 ℃预冷的冰柜中,继续以2 ℃·h−1的速率依次降到−5、−15和−25 ℃;各温度下处理时间为24 h。冰柜装有人工光源,光照强度500 μmol·m−2·s−1,采用大气采样仪(QC-1S,北京市科安劳保新技术公司)从冰柜门缝隙处向内缓慢送气。
各测试温度下处理完成后,在原处理环境下关闭光源,使植株暗适应20 min;立刻进行快速叶绿素荧光诱导动力学测量,随后立即测定相对叶绿素含量。同1株上的2项测量均在同1片健康、成熟的叶片上进行,测量位置相互错开。每个处理5盆,每盆作为1个独立重复实验,测定5片·盆−1。以25 ℃处理为对照(ck)。10:00测定各项指标。
-
采用叶绿素测定仪(SPAD-502Plus,KONICA MINOLTA,日本)测定各温度处理下植株的相对叶绿素含量(SPAD值)。
-
采用叶绿素荧光仪(Yaxin-116G,雅欣理仪公司)测定快速叶绿素荧光诱导动力学曲线(OJIP),测定前暗适应20 min,选取叶肉部分用3 000 μmol·m−2·s−1饱和蓝闪光照射1 s,以10 μs (300 μs之前)、100 μs (300 μs~3 ms)和1 ms (3 ms之后)的间隔记录荧光信号,并计算叶绿素荧光动力学参数。
-
叶片经过暗适应后再给予饱和蓝闪光照射,散发的荧光随时间变化的曲线,构成叶绿素荧光诱导动力学曲线。暗适应后出现最小荧光O相,此时PSⅡ处于“完全开放”状态;照射强光后,陆续出现J、I相,最终由于PSⅡ反应中心关闭,达到P相。将不同温度处理的OJIP曲线离差标准化。应用公式VO-P=(Ft−FO)/(FP−FO)计算FO与FP间相对可变荧光强度(VO-P),其中Ft表示t时的荧光强度,FO表示暗适应后的最小荧光强度,FP表示暗适应后的最大荧光强度。应用公式△VO-P=VO-P(处理)−VO-P(ck)计算FO与FP间相对可变荧光强度差值(△VO-P)。FO与FJ、FK间的相对可变荧光强度差值(△VO-J和△VO-K)的计算方式同VO-P和△VO-P。
-
暗适应后照光,O、L、K、J、I、P点分别表示最小荧光、0.15 ms荧光,0.30 ms荧光,2.00 ms荧光、30.00 ms荧光和最大荧光[22],其中0.15和0.30 ms时的相对荧光强度用VL和VK表示,PSⅡ单位面积反应中心数量(RC/CSO)、单位反应中心吸收的能量(ABS/RC)、单位反应中心以热能形式耗散的能量(DIO/RC)、单位反应中心捕获的用于还原初级醌受体(QA)的能量(TRO/RC)、单位反应中心用于将电子从QA−传递到质体醌(PQ)的能量(ETO/RC)、单位反应中心用于将电子从QA−传递到光系统Ⅰ(PSⅠ)的能量(REO/RC)、PSⅡ光化学初级最大效率(φPO,意义与暗适应下PSⅡ的最大量子产额Fv/Fm相同)、PSⅡ捕获的电子从QA−传递到PQ的效率(ψEO)、电子从PQH2传递到PSⅠ最终受体侧的效率(δRO)、叶片性能指数(PIABS)等参数计算参照文献[22]和[23]。
-
计算方法参照文献并略有改动:①计算各项荧光参数在所有处理下的平均值m和标准差s;②代入公式(1)对各处理下的各项荧光参数(X)标准化,得到Y;③对不同温度处理下的各项荧光参数进行回归拟合,如果某项荧光参数的拟合曲线随着温度降低而上升,则Z=Y,反之则Z=−Y;④依据公式(2)计算不同温度处理下单项荧光参数的得分Si,其中|Zm
in|是某温度处理下所有荧光参数Z值的最小值的绝对值;⑤以某温度处理下某项荧光参数的Si值作为辐射线的长度绘制星状图,各温度处理下的综合生物反应指数(IBR)由顺时针相邻荧光参数的辐射线围成的三角形面积Ai之和得到公式(3),公式(3)中的Ai依据公式(4)计算,公式(4)中的n为参与计算的荧光参数的个数。 $$ Y = \frac{{X - m}}{s}\text{;} $$ (1) $$ {S_i} = Z + {\rm{ }}\left| Z_{\rm{min}} \right|\text{;} $$ (2) $$ {I_{{\rm{BR}}}} = \mathop \sum \limits_{t = 11}^n {A_i}\text{;} $$ (3) $$ {A_i} = \frac{\,1\,}{\,2\,}\sin \left( {\frac{{360}}{n}} \right){S_i}{S_i}_{ + 1}\text{。} $$ (4) -
将各处理所得的IBR、Fv/Fm、
PIABS、相对叶绿素含量进行相关性分析,依据Pearson参数和显著性,检验IBR评价法用于计算低温胁迫下的叶绿素荧光综合指标的可行性。采用SPSS 22进行数据统计分析,应用最小显著差法(LSD)进行多重比较,采用Origin 2018进行回归分析和绘图。 -
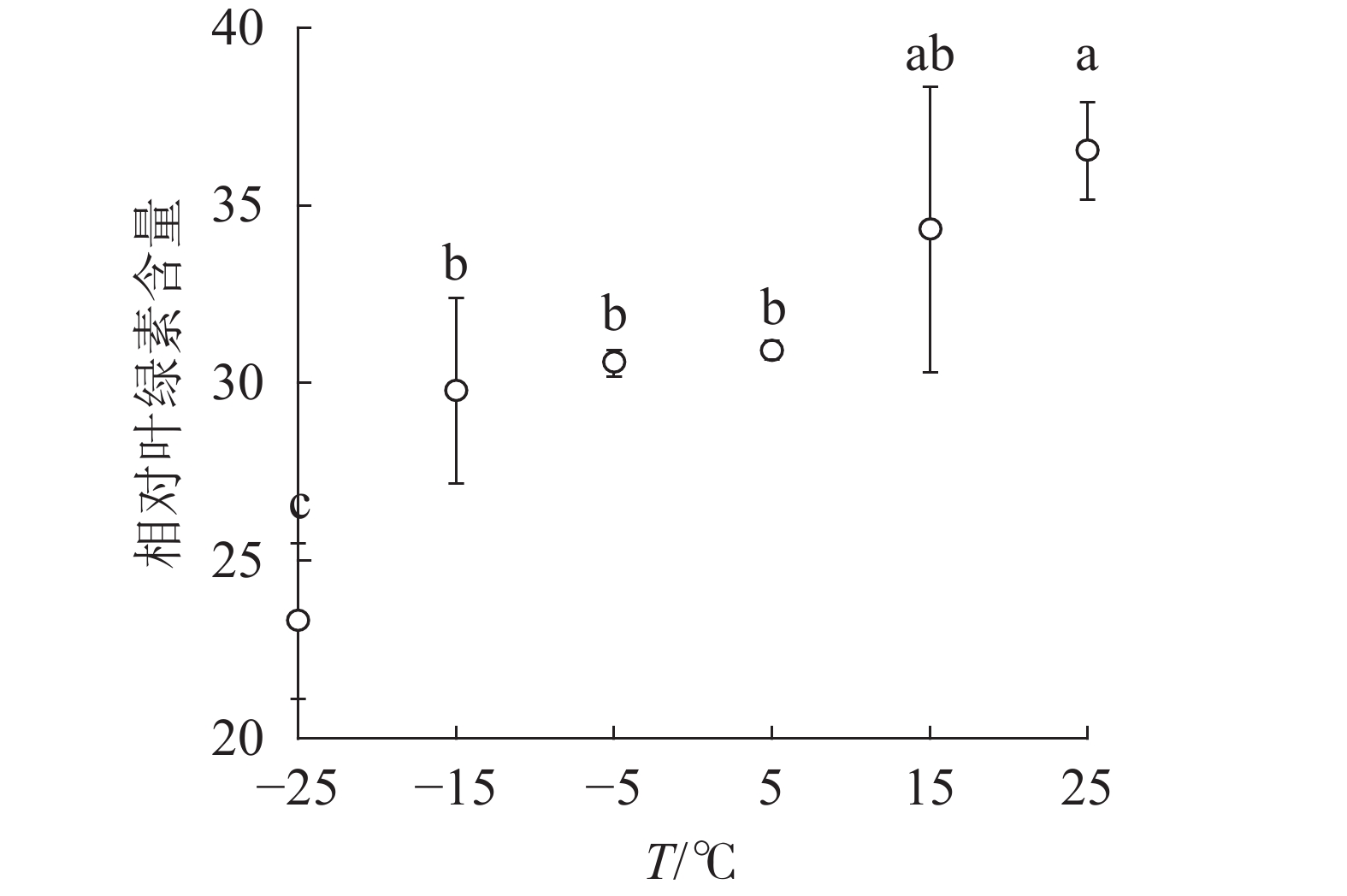
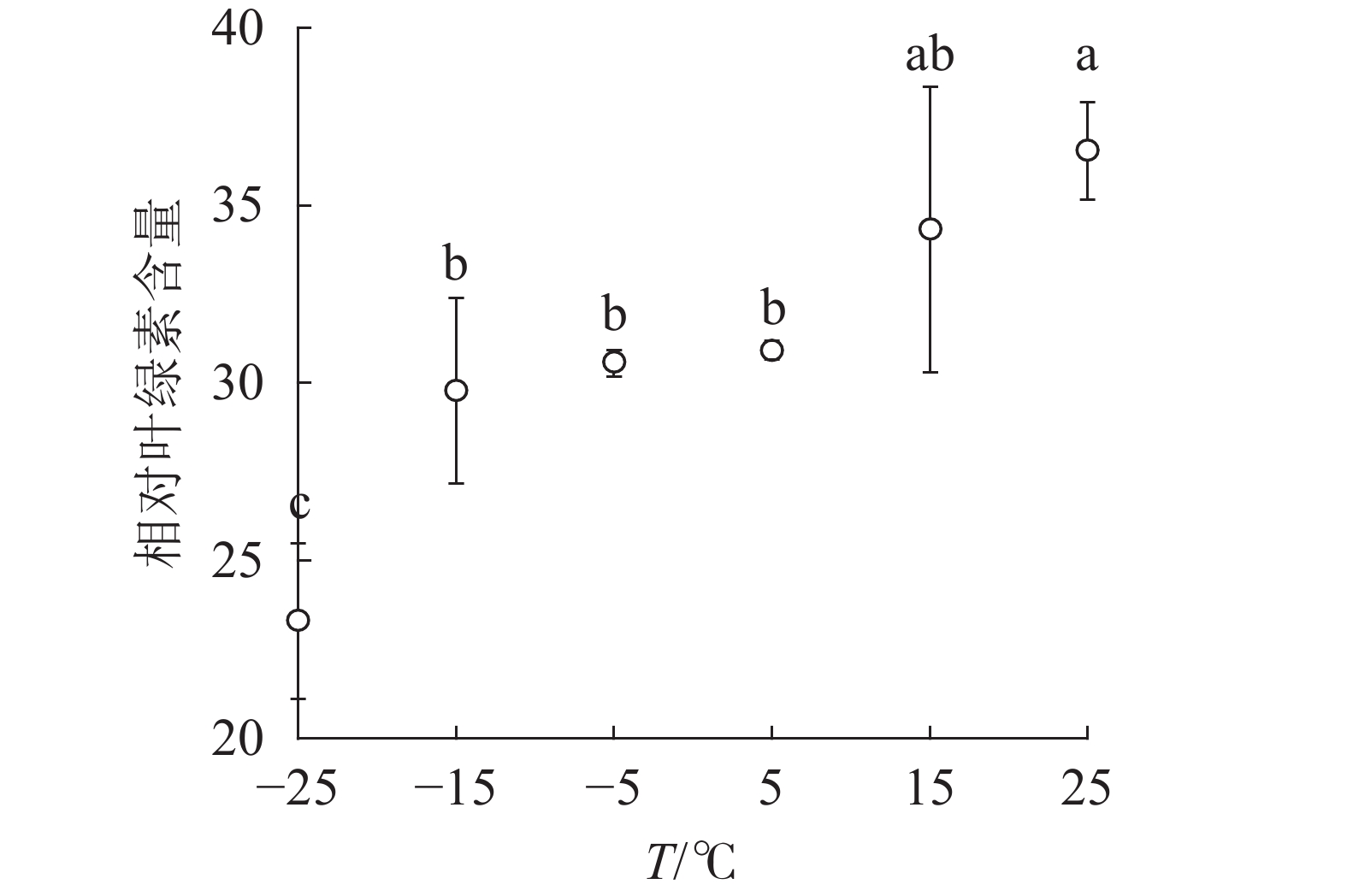
由图1可知:15和5 ℃时相对叶绿素含量无显著变化,−5 ℃时开始显著下降,−25 ℃时极显著降低,与对照相比降低了63.8%。表明≤−5 ℃的低温环境会导致南极假山毛榉叶片相对叶绿素含量显著降低。
-
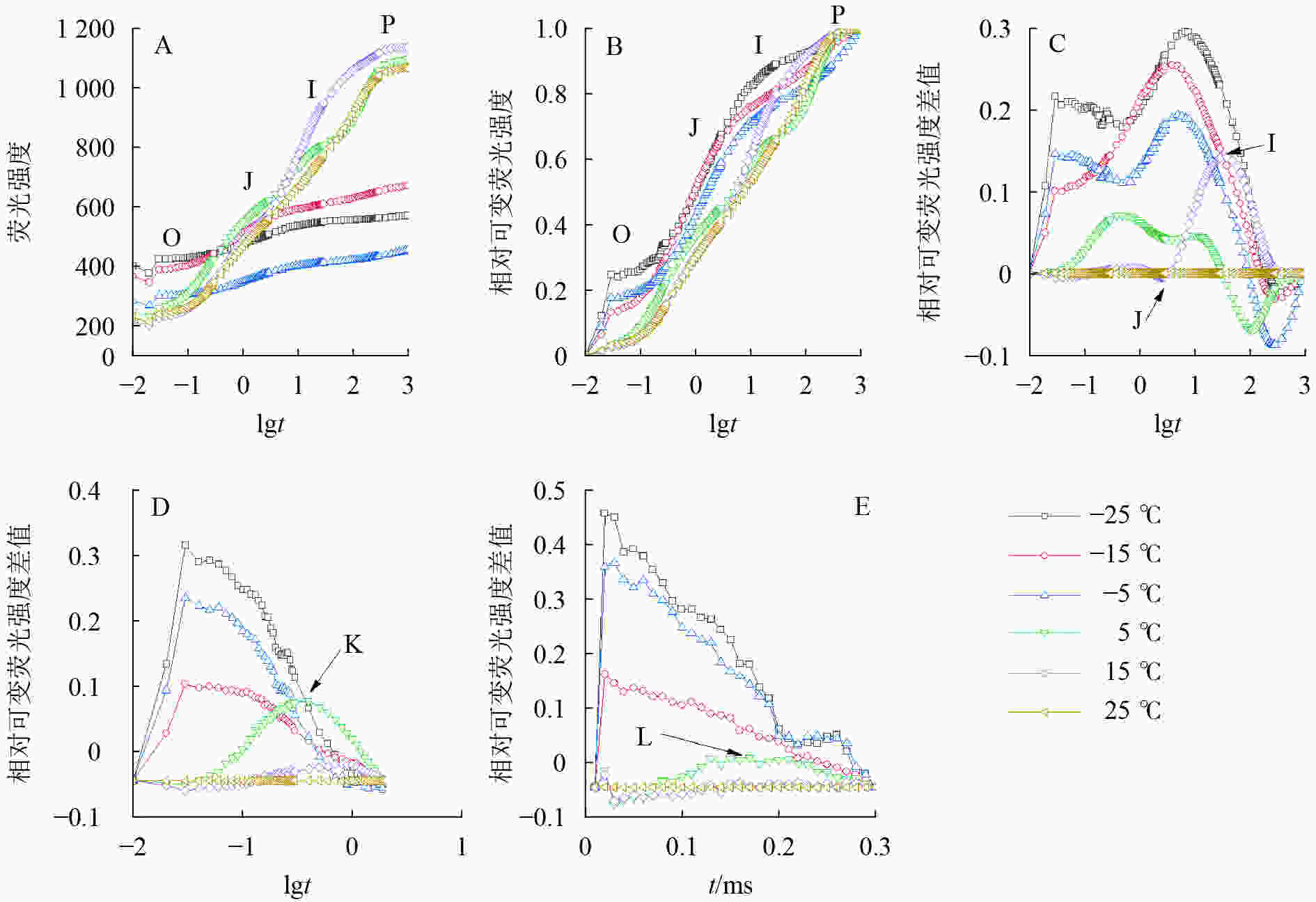
由图2可知:5、15和25 ℃处理下OJIP曲线出现O、J、I、P各相(图2A、B),表明这些温度下电子传递链运转正常;−5、−15和−25 ℃的OJIP曲线较为平缓(图2A),缺少J相和I相(图2B)。将标准化的各处理曲线与ck相减,可见J相和I相合并,并且在光照极短时间(约0.03 ms)出现1个较大峰(图2C),表明电子传递链严重受阻。OJIP曲线在5 ℃出现典型的K点(图2D)和L点(图2E),表明PSⅡ供体侧和PSⅡ反应中心受损。
-
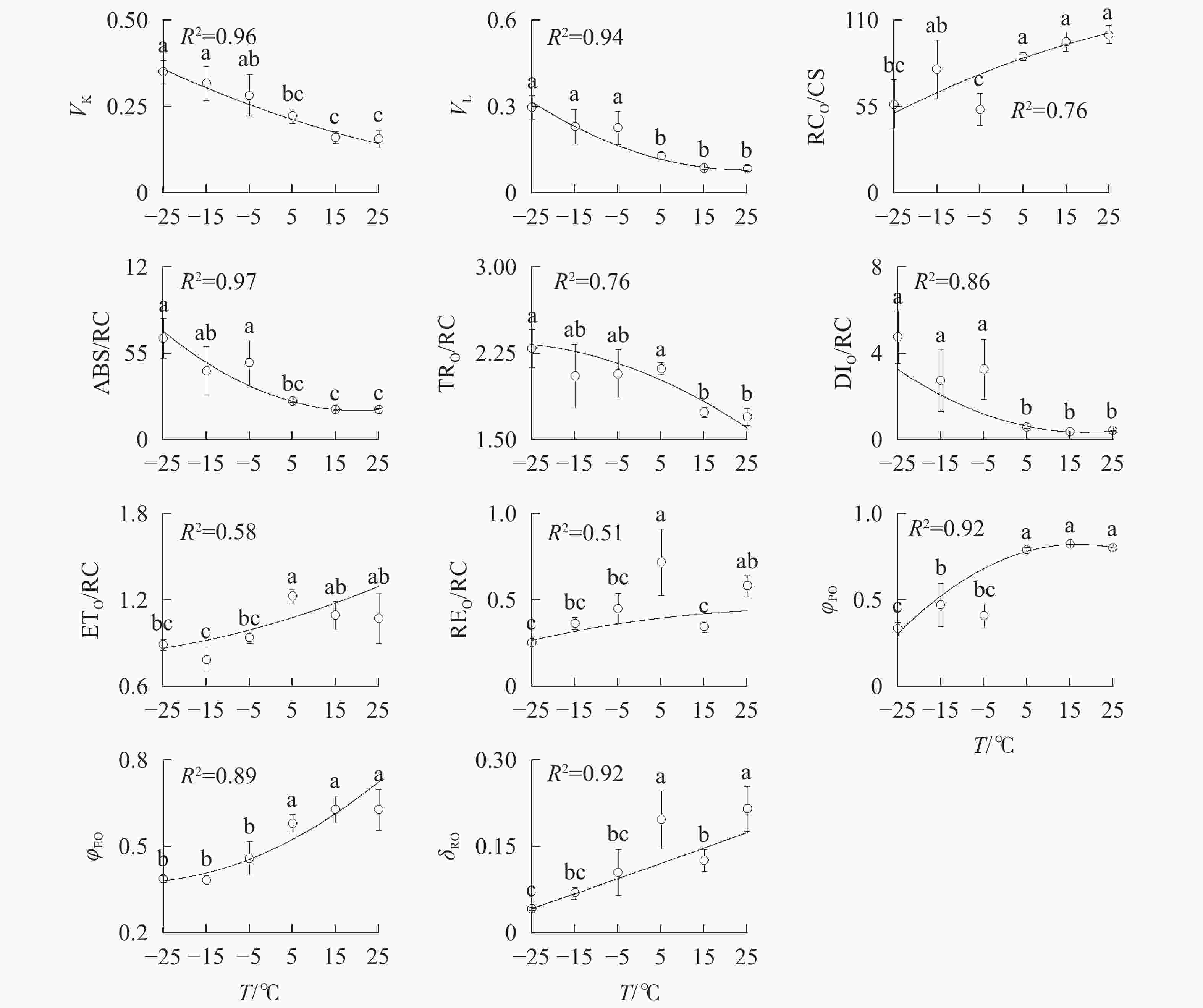
由图3A可知:VK
随着温度降低,−5、−15和−25 ℃时均与对照达到显著差异,表明≤−5 ℃的低温处理会造成PSⅡ供体侧损伤。 -
−5、−15、−25 ℃处理下VL
上升明显(图3B),表明≤−5 ℃的低温导致PSⅡ各单位之间的能量流通不畅。从−5 ℃到−25 ℃,RC/CSO随着温度降低逐渐减少(图3C),但−15 ℃的RC/CSO显著高于−5 ℃,表明−15 ℃时PSⅡ单位面积反应中心数量出现短暂回升。从−5 ℃开始,随着温度降低,ABS/RC(图3D)、TRO/RC(图3E)和DIO/RC(图3F)持续增加,−25 ℃时分别比对照增加331.0%、134.7%和1 112.7%,表明由于缺少可供还原的QA,PSⅡ单位反应中心集聚了大量能量。 -
与对照相比,ETO/RC(图3G)和REO/RC(图3H)在−15和15 ℃时短暂下降,REO/RC在−25 ℃时又显著下降,表明高于−15 ℃的温度对PSⅡ受体侧的能量传输影响较小。当温度从25 ℃降低到5 ℃时,φPO(图3I)和ψEO(图3J)与对照相比无显著差异,δRO(图3K)仅在15 ℃时出现短暂下降;当温度继续降低到−5 ℃时,3项参数均显著下降,表明≤−5 ℃的低温对PSⅡ的电子传递效率有显著负面影响。
-
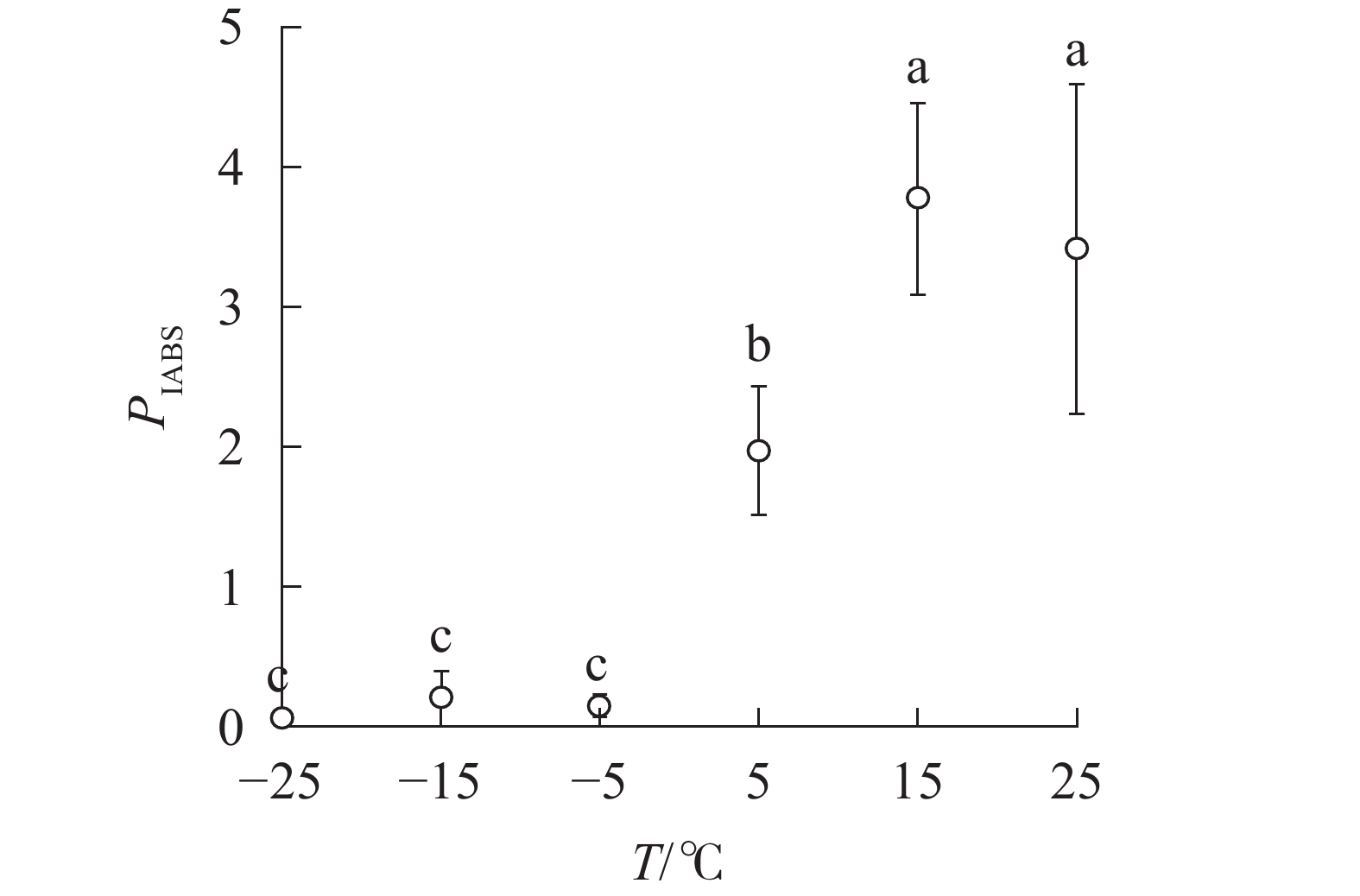
随着温度降低,Fv/Fm与φPO的变化趋势相同(图4)。5 ℃时,
PIABS显著低于对照,−5、−15和−25 ℃时, PIABS接近于0,表明≥15 ℃的环境温度对南极假山毛榉叶片的光能吸收无显著影响,≤5 ℃时开始出现低温胁迫,≤−5 ℃会造成严重的冰冻胁迫(图5)。 -
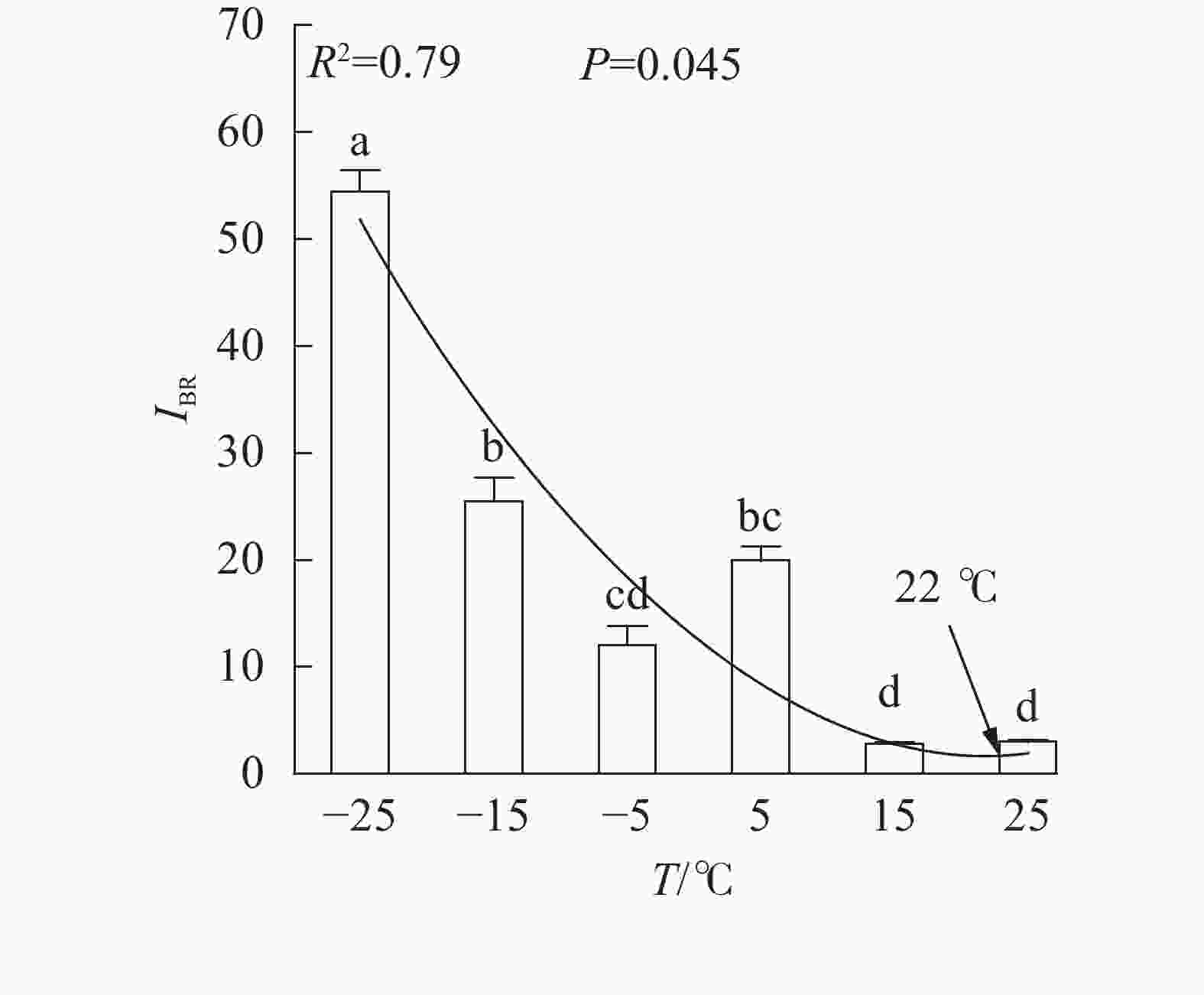
随着温度从25 ℃降至−25 ℃,VK
、VL、ABS/RC、DIO/RC、TRO/RC的拟合曲线持续上升,其余参数的拟合曲线持续下降(图3),因此对VL 、VK、ABS/RC、DIO/RC、TRO/RC的标准后数值取正值,其余参数取负值,绘制星状图(图6)并计算IBR(图7)。与对照相比,IBR在5、−5和−15 ℃时显著增加,−25 ℃极显著升高。对IBR作回归分析显示:22 ℃为IBR拐点,高于或低于此温度均导致IBR升高;表明IBR与温度胁迫程度呈正相关,南极假山毛榉叶片对光能的吸收利用效率最佳值在22 ℃,≤5 ℃的低温会对南极假山毛榉PSⅡ光化学活性造成胁迫。 -
对各温度处理下的Fv/Fm、PIABS、相对叶绿素含量、IBR和各测试温度进行相关性分析可见(表1):IBR、相对叶绿素含量和温度均为显著负相关,表明IBR能较准确反映温度对南极假山毛榉PSⅡ光化学活性以及对相对叶绿素含量的影响。Fv/Fm和PIABS虽然也与温度呈显著相关,但与相对叶绿素含量无显著相关,表明IBR与相对叶绿素含量的相关度高于上述2项参数。
表 1 Fv
/Fm、IABS、相对叶绿素含量、IBR和温度的相关性分析 Table 1. Correlation analysis of Fv
/Fm, PIABS, SPAD value, IBR and temperature 参数 IBR PIABS Fv/Fm 相对叶绿
素含量测试
温度IBR 1 PIABS −0.73 1 Fv/Fm −0.72 0.94** 1 相对叶绿素含量 −0.95** 0.79 0.77 1 测试温度 −0.88* 0.90* 0.92* 0.90* 1 说明:*表示P<0.05,**表示P<0.01 -
本研究中,当温度从25 ℃降低到15 ℃时,相对叶绿素含量、OJIP曲线、快速叶绿素荧光诱导动力学测量参数和IBR没有显著变化,说明15 ℃的环境温度对南极假山毛榉PSⅡ光化学活性的扰动轻微。当温度降低到5 ℃时,OJIP曲线出现K点和L点,PIABS开始显著下降,表明此阶段的低温主要对PSⅡ供体侧和反应中心构成胁迫,即放氧复合体(OCE)出现损伤,PSⅡ各单位之间的能量流通不畅。从−5 ℃降至−25 ℃,相对叶绿素含量显著降低,PSⅡ供体侧受损加剧;进入电子传递链的电子减少,引起电子传递效率下降;光反应的激发能不能及时传递到PSⅡ受体侧而大量积累,最终造成PSⅡ各单位之间的能量流通混乱,部分能量只能以热能的形式耗散。
OJIP曲线特征位点的变化能直观地反映出PSⅡ反应中心原初光化学反应的变化。HU等[9]发现低温处理下狗牙根Cynodon dactylon叶片OJIP曲线的相对荧光强度降低;曲丽娜等[7]进一步发现低温处理导致风箱果Physocarpus amurensis叶片的OJIP 曲线趋于平缓、P相下降、K点和L点出现;刘倩倩等[6]也得出相似结论,并发现低温处理导致O相上升。本研究发现:随着温度降低,南极假山毛榉叶片OJIP曲线的O相逐渐上升,−5、−15和−25 ℃的OJIP曲线趋于平滑,与前述研究结论相似;但前述物种均只涉及冷害胁迫(>0 ℃),而南极假山毛榉经历冻害胁迫(<0 ℃)才出现上述现象,这可能与其耐寒性强有关。−5、−15和−25 ℃处理时OJIP曲线在0.03 ms附近出现新拐点,可能因为冰冻胁迫导致PSⅡ反应中心成为能量陷阱,能吸收光能但不能推动电子传递[22],大量能量的积聚造成的。
JIP-test分析以OJIP曲线为数据基础,可提供大量反映光合器官的结构和功能的变化[23]。刘倩倩等[6]发现低温胁迫导致PSⅡ供体侧电子传递速率降低,PSⅡ反应中心数量减少;曲丽娜等[7]研究表明低温会造成放氧复合体受损,PSⅡ反应中心各单位之间的能量流通不畅,以及PSⅡ受体侧电子由初级电子受体(QA)向次级电子受体(QB)的传递过程受阻。伴随温度降低,南极假山毛榉的VK、VL、ABS/RC、TRO/RC和DIO/RC逐渐升高,RC/CSO逐渐减少,与前人研究结果相似;−15 ℃时RC/CSO出现短暂显著回升,推测是南极假山毛榉面对低温胁迫的应激反应,即通过增加PSⅡ单位面积光合机构含有的反应中心数量,以加大光能吸收量,弥补由于PSⅡ受体侧电子传递受阻而缺失的能量。
DUARTE等[20]利用IBR评价法,以JIP-test参数为数据源构建了光化学胁迫指数,证实了该参数与环境胁迫程度呈负相关关系。本研究发现IBR值与温度呈显著负相关,与DUARTE等[20]的结论相似。本研究还观察到,与Fv/Fm和
PIABS不同,IBR与相对叶绿素含量亦存在极显著负相关关系,可能预示IBR对低温胁迫的反映更具有广泛性。 多项研究显示,5 ℃的低温会引起Fv/Fm和PIABS显著降低[6-8,11];本研究发现:高于5 ℃时南极假山毛榉叶片的Fv/Fm和IBR无显著变化,高于15 ℃时PIABS无显著变化,表明南极假山毛榉叶片PSⅡ的温度适应性强,这可能是南极假山毛榉耐寒性强的生理基础之一。研究还发现:冰冻胁迫对PSⅡ的光吸收能力抑制明显,预示在南极假山毛榉的生长季需要预防零度以下的寒潮侵袭。STECCONI等[24]发现南极假山毛榉的最适生长温度为18.5 ℃/7.0 ℃(昼/夜),回归分析显示IBR的最小值出现在22 ℃,这一温度与上述研究结果仍有差距,可能与低温处理时间,以及参与计算IBR的参数种类有关,还需进一步探究。
Effect of low temperature on photosystem Ⅱ in Nothofagus antarctica
-
摘要:
目的 探究低温对南极假山毛榉Nothofagus antarctica光系统Ⅱ(PSⅡ)的影响,利用综合生物反应指数(IBR)评价法计算低温胁迫下的叶绿素荧光综合指标的可行性。 方法 采取逐步降低环境温度的方法(从25 ℃降至−25 ℃),测量并分析南极假山毛榉叶片的相对叶绿素含量和快速叶绿素荧光,计算各温度下植株的综合生物反应指数,综合评价温度降低对PSⅡ光化学活性的影响。 结果 环境温度为15 ℃时,PSⅡ光化学活性无变化;环境温度为5 ℃时,放氧复合体损伤,PSⅡ各单位之间的能量流通受阻。低温(−5、−15和−25 ℃)导致相对叶绿素含量显著降低,PSⅡ供体侧受损加剧,电子传递效率下降,PSⅡ各单位之间的能量流通混乱,热耗散显著增加。各温度处理下植株的综合生物反应指数和相对叶绿素含量与测试温度均表现为显著负相关。 结论 低于−5 ℃的低温会对南极假山毛榉PSⅡ的光化学活性造成严重胁迫,综合生物反应指数可以综合评价低温胁迫对植株PSⅡ光化学活性和相对叶绿素含量的影响。图7表1参24 Abstract:Objective Nothofagus antarctica PSⅡ photochemical performance under low temperature was assessed and its results were used in calculation integrated biomarker response (IBR) to assess the synthetical indicator of chlorophyll fluorescence under low temperature stress. Method The environment temperature of N. antarctica was changed gradually (from 25 ℃ to −25 ℃). After exposed, relative chlorophyll content (SPAD value) and fast chlorophyll fluorescence were measured and analysed, IBR were calculated, to assess the effect of low temperature PSⅡ photochemical activity. Result 15 ℃ hardly affects the PSⅡ photochemical activity. Oxygen-evolving complex and energy flow between PSⅡ units were disturbed under −5 ℃. Under the low temperature of −5, −15 and −25 ℃, SPAD value was remarkably reduced, and the PSⅡ donor side, electron transport of PSⅡ, energy flow between PSⅡunits were all disturbed seriously; heat dissipation was remarkably increased. IBR under different temperature treatments have a significant negative correlation with SPAD value and temperature. Conclusion The damage of PSⅡ photochemical activity by low temperature (below −5 ℃) was serious, and IBR can be used as a comprehensive parameter to evaluate the effect of low temperatures on PSⅡ photochemical activity and SPAD value. [Ch, 7 fig. 1 tab. 24 ref.] -
表 1 Fv
/Fm、IABS、相对叶绿素含量、IBR和温度的相关性分析 Table 1. Correlation analysis of Fv
/Fm, PIABS, SPAD value, IBR and temperature 参数 IBR PIABS Fv/Fm 相对叶绿
素含量测试
温度IBR 1 PIABS −0.73 1 Fv/Fm −0.72 0.94** 1 相对叶绿素含量 −0.95** 0.79 0.77 1 测试温度 −0.88* 0.90* 0.92* 0.90* 1 说明:*表示P<0.05,**表示P<0.01 -
[1] POSPÍŠIL P, YAMAMOTO Y. Damage to photosystem Ⅱ by lipid peroxidation products [J]. BBA Gen Subj, 2017, 1861(2): 457 − 466. [2] SZYMAŃSKA R, ŚLESAK I, ORZECHOWSKA A, et al. Physiological and biochemical responses to high light and temperature stress in plants [J]. Environ Exp Bot, 2017, 139: 165 − 177. [3] CAMEJO D, RODRÍGUEZ P, MORALES M A, et al. High temperature effects on photosynthetic activity of two tomato cultivars with different heat susceptibility [J]. J Plant Physiol, 2005, 162(3): 281 − 289. [4] 周哲宇,徐超,胡策,等. 毛竹快速生长期的叶绿素荧光参数特征[J]. 浙江农林大学学报, 2018, 35(1): 75 − 80. ZHOU Zheyu, XU Chao, HU Ce, et al. Chlorophyll fluorescence characteristics of Phyllostachys edulis during its fast growth period [J]. J Zhejiang A&F Univ, 2018, 35(1): 75 − 80. [5] GOLTSEV V N, KALAJI H M, PAUNOV M, et al. Variable chlorophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus [J]. Russ J Plant Physiol, 2016, 63(6): 869 − 893. [6] 刘倩倩,马寿宾,冯希环,等. 嫁接对高温和低温胁迫下辣椒幼苗快速叶绿素荧光诱导动力学特性的影响[J]. 园艺学报, 2016, 43(5): 885 − 896. LIU Qianqian, MA Shoubin, FENG Xihuan, et al. Effects of grafting on the fast chlorophyll fluorescence induction dynamics of pepper seedlings under temperature stress [J]. Acta Hortic Sin, 2016, 43(5): 885 − 896. [7] 曲丽娜,许楠,张会慧. 风箱果和紫叶风箱果叶片光系统Ⅱ功能对秋季低温的响应[J]. 东北林业大学学报, 2018, 46(8): 44 − 50. QU Lina, XU Nan, ZHANG Huihui. Response of photosynthetic function of photosystem Ⅱ in leaves of Physocarpus amurensis Maxim and P. opulifolius in autumn low temperature stress in cold regions [J]. J Northeast For Univ, 2018, 46(8): 44 − 50. [8] PAGTER M, LIU Fulai, JENSEN C R, et al. Effects of chilling temperatures and short photoperiod on PSⅡ function, sugar concentrations and xylem sap ABA concentrations in two Hydrangea species [J]. Plant Sci, 2008, 175(4): 547 − 555. [9] HU Zhengrong, FAN Jibiao, XIE Yan, et al. Comparative photosynthetic and metabolic analyses reveal mechanism of improved cold stress tolerance in bermudagrass by exogenous melatonin [J]. Plant Physiol Biochem, 2016, 100: 94 − 104. [10] ZHANG Kun, CHEN Baihong, HAO Yan, et al. Effects of short-term heat stress on PSⅡ and subsequent recovery for senescent leaves of Vitis vinifera L. cv. Red Globe [J]. J Integrative Agric, 2018, 17(12): 2683 − 2693. [11] 马飞,徐婷婷,陈立同,等. 低温胁迫下二倍体杂交种高山松光系统Ⅱ功能稳定性研究[J]. 西北植物学报, 2011, 31(6): 1174 − 1179. MA Fei, XU Tingting, CHEN Litong, et al. Functional stability of photosystem Ⅱ in the diploid hybrid species (Pinus densata) under low temperature stress [J]. Acta Bot Boreal-Occident Sin, 2011, 31(6): 1174 − 1179. [12] 许改平,刘芳,吴兴波,等. 低温胁迫下毛竹叶片色素质量分数与反射光谱的相关性[J]. 浙江农林大学学报, 2014, 31(1): 28 − 36. XU Gaiping, LIU Fang, WU Xingbo, et al. Pigment content correlated to reflectance spectrums in Phyllostachys edulis leaves stressed by low temperature [J]. J Zhejiang A&F Univ, 2014, 31(1): 28 − 36. [13] KOOCHEKI A, SEYYEDI S M. Mother corm origin and planting depth affect physiological responses in saffron (Crocus sativus L.) under controlled freezing conditions [J]. Ind Crops Prod, 2019, 138: 111468. [14] 丁龙,赵慧敏,曾文静,等. 5种西北旱区植物对干旱胁迫的生理响应[J]. 应用生态学报, 2017, 28(5): 1455 − 1463. DING Long, ZHAO Huimin, ZENG Wenjing, et al. Physiological responses of five plants in northwest China arid area under drought stress [J]. Chin J Appl Ecol, 2017, 28(5): 1455 − 1463. [15] 吴久赟,廉苇佳,刘志刚,等. 不同葡萄品种叶绿素荧光参数的高温响应及其耐热性评价[J]. 西北农林科技大学学报(自然科学版), 2019, 47(6): 80 − 88. WU Jiuyun, LIAN Weijia, LIU Zhigang, et al. High temperature response of chlorophyll fluorescence parameters and heat tolerance evaluation of different grape cultivars [J]. J Northwest A&F Univ Nat Sci Ed, 2019, 47(6): 80 − 88. [16] KALAJI H M, SCHANSKER G, LADLE R J, et al. Frequently asked questions about in vivo chlorophyll fluorescence: practical issues [J]. Photosynth Res, 2014, 122(2): 121 − 158. [17] 李惠,梁曼曼,赵丹,等. 不同砧木对‘绿岭’核桃叶片光合和叶绿素荧光特性的影响[J]. 西北林学院学报, 2017, 32(2): 90 − 96. LI Hui, LIANG Manman, ZHAO Dan, et al. Effects of different rootstocks on photosynthesis and chlorophyll fluorescence characteristics in ‘Lyulin’ walnut [J]. J Northwest For Univ, 2017, 32(2): 90 − 96. [18] 李孟洋,巢建国,谷巍,等. 不同产地茅苍术对淹水胁迫的生理生化响应及耐淹性的TOPSIS综合评价[J]. 生态学杂志, 2016, 35(2): 407 − 414. LI Mengyang, CHAO Jianguo, GU Wei, et al. Physiological-biochemical response of Atractylodes lancea from different habitats to waterlogging stress and comprehensive evaluation of their waterlogging tolerance with TOPSIS approach [J]. Chin J Ecol, 2016, 35(2): 407 − 414. [19] 韩晓,王海波,王孝娣,等. 不同砧木对‘87-1’葡萄光合特性及荧光特性的影响[J]. 中国农业科学, 2018, 51(10): 1972 − 1981. HAN Xiao, WANG Haibo, WANG Xiaodi, et al. Effects of different rootstocks on ‘87-1’ grape photosynthetic and chlorophyll fluorescence characteristics [J]. Sci Agric Sin, 2018, 51(10): 1972 − 1981. [20] DUARTE B, PEDRO S, MARQUES J C, et al. Zostera noltii development probing using chlorophyll a transient analysis (JIP-test) under field conditions: integrating physiological insights into a photochemical stress index [J]. Ecol Indic, 2017, 76: 219 − 229. [21] SØNDERGAARD P. Experiences with Nothofagus in West-Norway and East-Denmark [J]. Dansk Dendrologisk Arsskrift, 1997, 15: 61 − 94. [22] 李鹏民,高辉远,STRASSER R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物 学学报, 2005, 31(6): 559 − 556. LI Pengmin, GAO Huiyuan, STRASSER R J. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study [J]. J Plant Physiol Mol Biol, 2005, 31(6): 559 − 556. [23] TSIMILLI-MICHAEL M, STRASSER R J. In vivo assessment of impact on plants’ vitality: applications in detecting and evaluating the impact of mycorrhization on host plants[M]//VARMA A. Mycorrhiza: Genetics and Molecular Biology, Eco-Function, Biotechnology, Eco-Physiology, Structure and Systematics, 3rd ed. Berlin Herdebelg: Springer-Verlaf, 2008: 679 − 703. [24] STECCONI M, PUNTIERI J, BARTHÉLÉMY D. Annual shoot-growth in Nothofagus Antarctica (G. Forster) Oersted (Nothofagaceae) from northern Patagonia [J]. Trees, 2000, 14(5): 289 − 296. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190366






 下载:
下载: