-
杜仲Eucommia ulmoides具有补肝肾、强筋骨、安胎等功效,可用于治疗腰脊酸、高血压等疾病[1−2],其树皮和树叶中含多种次级代谢产物(烯醚萜类、酚类、木脂素类和甾醇类等)[3−5],其中京尼平苷、桃叶珊瑚苷、绿原酸等化合物被应用于杜仲药品、保健品、饲料添加剂和化妆品等行业中。QI等[6]研究发现:杜仲叶提取的绿原酸具有调节免疫力的功效;王琴等[7]研究发现:松脂二聚葡萄糖苷在缓解自发性高血压疾病上具有较好的表现。由于杜仲次级代谢产物在药理调节方面的较好作用,近年来杜仲作为具有开发潜力和商业前景的药用材料受到了科研工作者的广泛关注。
植物生长调节剂是人工合成的(或从微生物中提取的天然的),具有和天然植物激素相似调节作用的有机化合物,对植物生长发育过程以及次级代谢物的产生有重要影响[8]。β-吲哚乙酸(β-indoleacetic acid, IAA)、α-萘乙酸(α-naphtalene acetic acid, NAA)和6-苄基腺嘌呤(6-benzylaminopurine, 6-BA)等属于生长刺激型激素[9−10],张睿等[11]研究表明:植物生长调节剂能有效促进植物叶片中次级代谢产物的积累。例如施加生长素IAA、6-BA和赤霉素(GA3)可有效提升盐肤木Rhus chinensis植株叶片中的酚酸质量分数[12]。宁倩等[13]研究表明:在低氮胁迫条件下外施IAA,可提高水稻Oryza sativa养分吸收和累积的能力。在杜仲愈伤组织诱导过程中施加6-BA等植物生长调节剂,可提升主要次级代谢产物绿原酸的含量[14−15]。目前,植物生长调节剂对杜仲生长以及主要次级代谢产物影响的研究,大部分停留在对单一指标和特定次级代谢产物的影响上,综合多指标评估植物生长调节剂对杜仲影响的研究较少。鉴于此,本研究利用不同质量浓度的植物生长调节剂配比,探讨了杜仲次级代谢产物质量分数的变化规律,分析了杜仲次级代谢产物生物合成的调控机制,以期为杜仲植物生长调节剂的调控和次级代谢产物质量分数的提升提供理论依据。
-
2年生的杜仲苗购自山西花卉市场,在实验室盆栽1个月后,于5月初挑选长势一致的苗放于自然光,(20±3) ℃下培养,并于每天17:00浇水1次。
-
将不同质量浓度配比的IAA以及6-BA (表1)均匀地喷洒在长势一致的杜仲叶片上(每隔10 d喷施1次,共喷施2次,每个处理组设3个重复组),选择喷洒等量的蒸馏水作为对照(ck)。在处理30 d后,收集杜仲顶芽下方完全展开的第1片叶片,测定各项生长指标以及绿原酸、桃叶珊苷、京尼平、京尼平苷、京尼平苷酸、松脂醇二葡萄糖苷、哈巴苷、咖啡酸、车叶草苷的质量分数。每个处理均随机取样,重复3次。
表 1 不同植物生长调节剂质量浓度与配比情况
Table 1. Specific concentrations of plant growth regulators
处理 IAA/
(mg·L−1)6-BA/
(mg·L−1)处理 IAA/
(mg·L−1)6-BA/
(mg·L−1)ck 0 0 T8 100 300 T1 100 0 T9 100 500 T2 300 0 T10 300 100 T3 500 0 T11 300 300 T4 0 100 T12 300 500 T5 0 300 T13 500 100 T6 0 500 T14 500 300 T7 100 100 T15 500 500 -
用直尺测量杜仲叶长和叶宽,用天平测量叶片鲜质量和干质量,选用游标卡尺测量其叶厚和干径(距地面10 cm处树干直径)。根据描形数格法计算叶面积。
-
杜仲主要次级代谢产物质量分数的测定参考付金颖等[16]的研究方法,利用超高效液相色谱-质谱联用(UPLC-MS)测定杜仲主要次级代谢产物。称取杜仲鲜叶0.4 g置于10 mL试管中,随后加入 8 mL色谱级甲醇,并放入研磨器60 Hz震荡120 s。研磨成匀浆液后,40 ℃超声45 min,4 ℃低温离心10 min,并吸取上清液于新的离心管中,随后46 ℃下浓缩挥干。
上机检测前用质谱级别的甲醇复溶至1 mL,离心10 min取上清液,并用0.25 μm微孔滤膜过滤。采用C18 (2.1 mm×100 nm,1.6 μm);流动相体积比为:62%水(溶剂A)与38%的甲醇(溶剂B),流速为0.25 mL·min−1,柱温为25 ℃,进样量为5 μL。标准品采购于阿拉丁官网。
-
使用MassLynx (Version 4.1)软件分析UPLC-MS数据。利用SPSS 22.0进行显著性检验(P<0.05)以及主成分分析和因子分析。使用Origin作图。文中数据为平均值±标准误。
-
由表2可知:相较于ck,单施加低质量浓度的IAA (100 mg·L−1,T1)时,杜仲叶片的叶面积、叶周长、叶宽、叶厚度、叶鲜质量以及叶干质量分别增加了9.80%、3.16%、24.75%、9.06%、78.26%以及71.43%。当IAA增加至300 mg·L−1 (T2)时,杜仲叶片的叶面积、叶周长、叶长、叶宽相较于ck分别降低了31.78%、14.21%、12.43%、25.54%。当IAA为500 mg·L−1 (T3)时,各形态指标数值均高于T2处理;除叶面积外,其他叶片形态指标均低于ck和T1。表明较低质量浓度的IAA更有利于叶片的生长。单施6-BA对叶鲜质量和叶干质量的影响规律与单施IAA一致,当单施6-BA为100 mg·L−1时,相较于ck,叶鲜质量和叶干质量分别增加了23.91%和14.29%,其余指标变化不显著。
表 2 杜仲叶片形态指标对植物生长调节剂配比的响应
Table 2. Response of leaf morphological indexes of E. ulmoides to concentration ratio of plant growth regulators
处理 叶面积/cm2 叶周长/cm 叶长/cm 叶宽/cm 叶厚度/mm 比叶面积/(cm2·g−1) 叶鲜质量/g 叶干质量/g ck 39.25±8.56 bc 28.14±3.07 b 13.03±1.49 a 5.05±0.65 bcd 0.320±0.043 cdef 287.92±54.31 bc 0.46±0.00 jh 0.140±0.06 d T1 43.10±6.36 b 29.08±2.43 b 12.61±1.07 abc 6.30±0.62 a 0.349±0.043 bcd 186.81±38.09 f 0.80±0.04 b 0.240±0.011 a T2 26.78±9.32 d 24.14±3.21 efj 11.41±1.95 cdef 3.76±0.68 f 0.321±0.037 cdef 244.63±41.97 cde 0.42±0.02 hij 0.110±0.050 f T3 31.40±4.86 bcd 23.99±2.15 defj 10.47±1.05 fjh 4.82±0.36 de 0.299±0.030 fj 343.40±74.98 a 0.39±0.02 ij 0.094±0.005 j T4 38.05±5.53 bcd 26.95±1.92 bcde 11.92±1.06 abcde 5.45±0.62 bc 0.326±0.036 cdef 250.00±50.93 cde 0.57±0.02 d 0.160±0.005 c T5 27.28±4.87 d 22.81±1.77 fj 9.53±0.91 h 4.85±0.52 cde 0.362±0.032 ab 221.09±36.13 ef 0.43±0.02 hi 0.130±0.003 e T6 33.08±3.97 bcd 24.49±1.46 defj 10.63±0.72 efjh 5.02±0.37 bcd 0.350±0.026 bcde 258.36±46.50 cde 0.46±0.02 jh 0.130±0.004 e T7 34.33±5.75 bcd 25.37±2.57 bcdef 11.18±0.96 def 4.83±0.46 cde 0.360±0.019 ab 321.08±40.46 ab 0.43±0.02 hi 0.110±0.004 f T8 40.37±6.42 b 27.71±2.04 bc 12.19±0.90 abcd 5.50±0.62 b 0.390±0.025 a 229.79±37.17 def 0.61±0.03 cd 0.180±0.006 b T9 31.13±5.32 cd 24.91±2.36 efj 11.10±0.90 def 4.37±0.35 e 0.350±0.041 abc 291.41±44.84 bc 0.45±0.02 jh 0.110±0.056 f T10 28.15±5.02 d 22.07±2.32 e 9.67±1.30 jh 4.41±0.52 e 0.280±0.039 h 331.78±35.29 ab 0.33±0.02 j 0.085±0.004 j T11 40.20±10.74 b 26.40±3.76 bcde 11.64±3.76 bcde 5.20±0.69 bcd 0.310±0.028 ef 274.26±51.65 de 0.56±0.03 e 0.160±0.004 c T12 37.10±5.36 bcd 26.80±2.95 bcde 11.90±2.95 abcde 5.28±0.36 bcd 0.340±0.047 bcde 237.54±38.21 cdef 0.59±0.03 de 0.160±0.007 c T13 37.31±4.53 bcd 27.18±1.55 bcd 11.96±1.55 defj 5.12±0.37 bcd 0.340±0.030 bcde 289.99±17.43 bc 0.51±0.02 f 0.130±0.004 e T14 34.87±4.43 bcd 25.46±1.77 cdefj 10.97±1.77 defj 5.10±0.21 bcd 0.320±0.030 def 269.77±55.03 cd 0.53±0.00 f 0.130±0.003 e T15 56.00±31.70 a 30.38±7.02 a 13.00±7.02 ab 6.41±1.46 a 0.330±0.027 bcdef 266.97±69.23 cde 0.90±0.04 a 0.230±0.001 a 说明:同列不同字母表示处理间差异显著(P<0.05)。 相较于ck,复合施加500 mg·L−16-BA+500 mg·L−1IAA时(T15),杜仲叶片形态以及生长指标显著升高(P<0.05),其中叶面积、叶周、叶宽、叶厚度、叶鲜质量以及叶干质量分别增加了42.68%、7.96%、26.93%、3.12%、95.65%、64.29%。
-
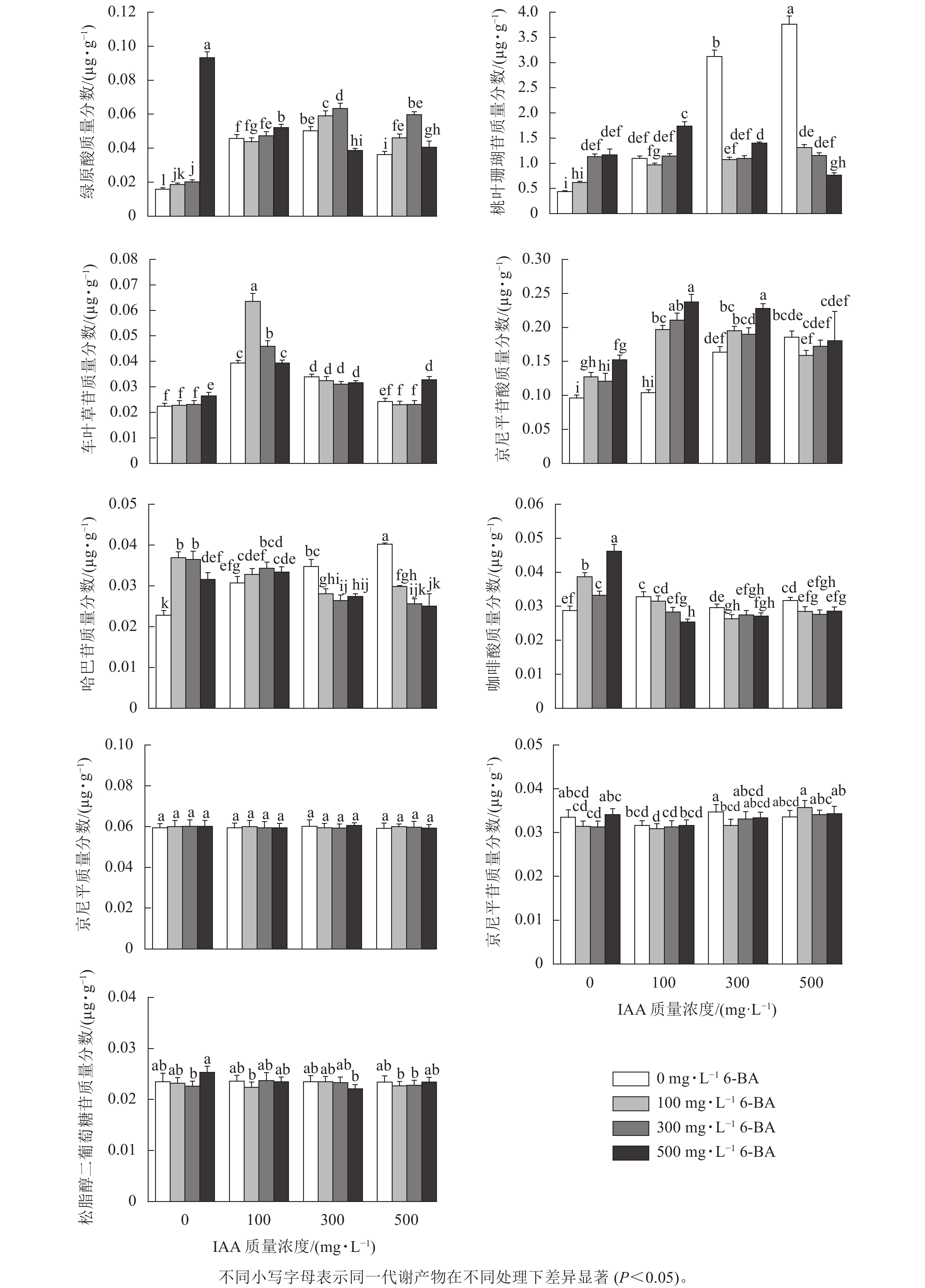
从图1可见:单施6-BA时(T4~T6),绿原酸、桃叶珊瑚苷、车叶草苷、京尼平苷酸以及咖啡酸的质量分数总体随6-BA质量浓度的增加而升高;哈巴苷质量分数变化趋势为先增加后下降;京尼平、京尼平苷、松脂醇二聚葡萄糖质量分数各组间差异不明显。单施IAA时(T1~T3),桃叶珊瑚苷、京尼平苷酸、哈巴苷质量分数随IAA施加质量浓度的增加而逐渐升高。其中施加500 mg·L−1的6-BA时(T6),绿原酸、咖啡酸、松脂醇二葡萄糖苷质量分数达到峰值;施加100 mg·L−1 IAA+100 mg·L−1 6-BA (T7)时,车叶草苷质量分数比ck处理增加了0.041 µg·g−1(P<0.05);当施加100 mg·L−1 IAA+ 500 mg·L−1 6-BA时(T9),京尼平苷酸质量分数达到峰值,与ck相比增加了0.140 µg·g−1,并显著高于其他处理组(P<0.05);当施加500 mg·L−1 IAA时,桃叶珊瑚苷和哈巴苷质量分数最高,分别为3.760和0.040 µg·g−1,比ck处理增加了3.340和0.017 µg·g−1。
-
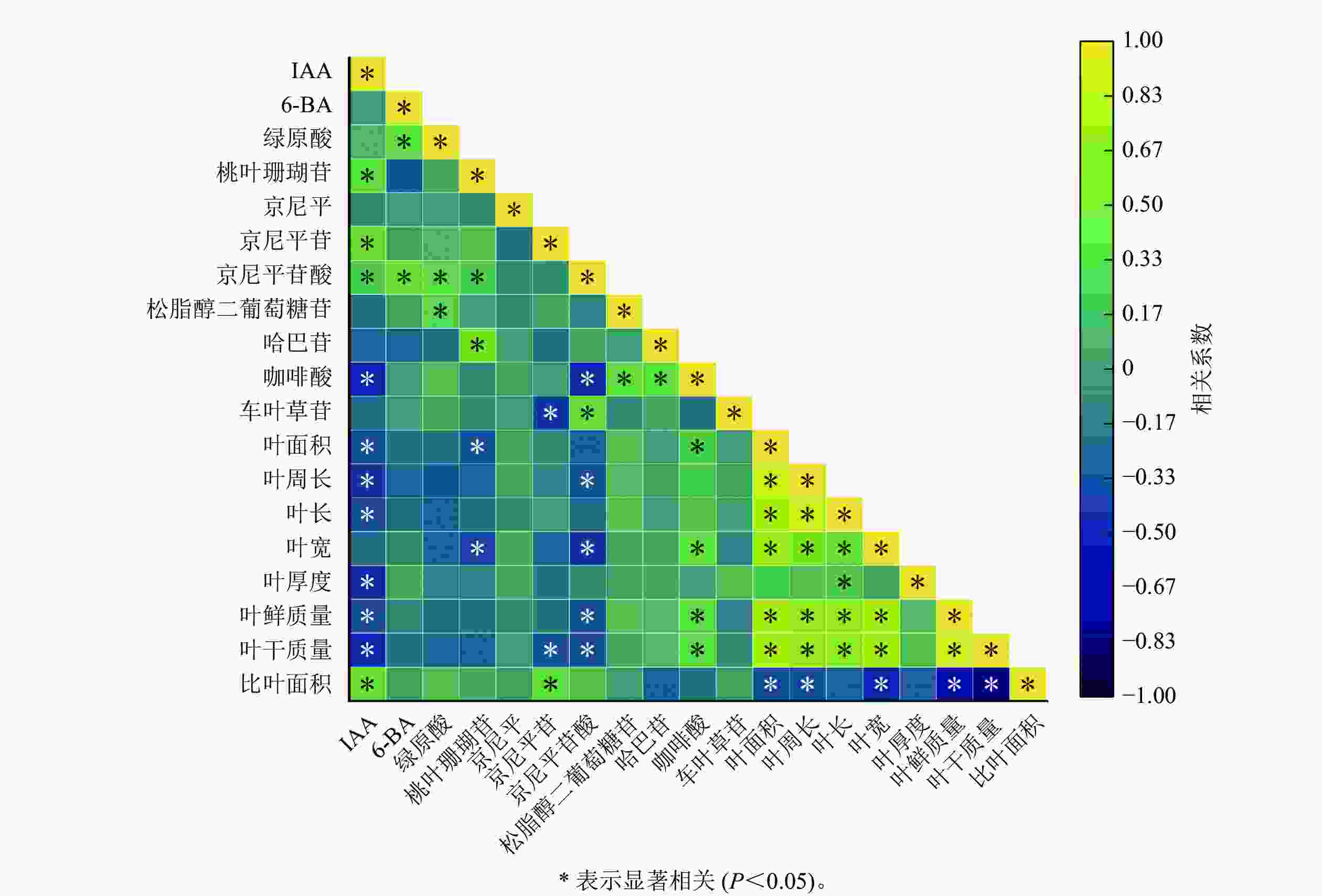
如图2所示:IAA与比叶面积、桃叶珊瑚苷、京尼平苷、京尼平苷酸呈显著正相关(P<0.05),与咖啡酸、叶面积、叶周长、叶长、叶宽、叶厚度、叶鲜质量、叶干质量呈显著负相关(P<0.05);6-BA与绿原酸以及京尼平苷酸呈显著正相关(P<0.05),与其他指标之间的相关性不显著;叶鲜质量与京尼平苷酸呈显著负相关(P<0.05),与咖啡酸呈显著正相关(P<0.05);叶干质量与京尼平苷京、尼平苷酸呈现显著负相关(P<0.05),与咖啡酸呈现显著正相关(P<0.05);叶周长、叶长、叶宽、叶面积与叶鲜质量和干质量都呈显著正相关(P<0.05)。
-
提取物的产量不仅受叶片生物量的影响,还与活性物质有关。因此,本研究对叶片的干质量(x1)、鲜质量(x2)、绿原酸(x3)、桃叶珊瑚苷(x4)、咖啡酸(x5)、京尼平苷酸(x6)、松脂醇二葡萄糖苷(x7)、京尼平(x8)、哈巴苷(x9)、车叶草苷(x10)、京尼平苷(x11)9种次级代谢产物在内的11个指标进行主成分以及因子分析,以达到综合评价的目的。
如表3所示:主成分1中,绿原酸、桃叶珊瑚苷的特征向量分别为0.43、0.41,相较于其他指标较大,这解释了主成分1是从绿原酸和桃叶珊瑚苷化合物质量分数上进行评估;主成分2中,叶鲜质量、京尼平、京尼平苷酸和松脂醇二葡萄糖苷的特征向量较大;主成分3中,哈巴苷的特征向量较大;主成分4中,叶鲜质量、叶干质量、京尼平、京尼平苷、京尼平苷酸、咖啡酸和车叶草苷的系数较大,表明主成分4主要是从上述7个维度对处理组进行解释和打分。
表 3 杜仲次级代谢物产量主成分分析的特征向量与载荷值
Table 3. Characteristic vector and load value of principal component analysis (PCA) for secondary metabolites of of E. ulmoides
性能指标 主成分1 主成分2 主成分3 主成分4 特征向量 载荷值 特征向量 载荷值 特征向量 载荷值 特征向量 载荷值 干质量 −0.52 −0.88 0.11 0.18 −0.11 −0.15 0.10 0.12 鲜质量 −0.52 −0.88 0.04 0.07 −0.06 −0.08 0.11 0.13 绿原酸 0.43 0.71 0.08 0.13 −0.31 −0.42 −0.07 −0.08 桃叶珊瑚苷 0.41 0.69 −0.14 −0.22 0.17 0.23 −0.10 −0.12 咖啡酸 0.11 0.19 0.55 0.86 −0.05 −0.06 0.21 0.26 京尼平苷酸 0.17 0.29 −0.49 −0.78 0.06 0.08 0.35 0.43 松脂醇二葡萄糖苷 0.10 0.16 0.46 0.72 0.16 0.22 0.31 0.37 京尼平 0.21 0.36 0.36 0.57 −0.3 −0.41 0 0 哈巴苷 −0.02 −0.04 0.03 0.05 0.66 0.90 −0.11 −0.13 车叶草苷 0 −0.01 −0.27 −0.43 −0.43 −0.59 0.48 0.58 京尼平苷 0.09 0.16 0.04 0.06 0.34 0.46 0.68 0.82 特征值 2.82 2.47 1.84 1.46 贡献率/% 25.59 22.46 16.74 12.26 累积贡献率/% 25.59 48.05 64.79 78.05 结合11个指标的特征向量,主成分1得分(y1)、主成分2得分(y2)、主成分3得分(y3)、主成分4得分(y4)的线性组合公式为:
y1=−0.523x1−0.522x2+0.426x3+0.408x4+0.114x5+0.170x6+0.095x7+0.213x8−0.024x9−0.005x10+0.094x11;
y2=0.111x1+0.043x2+0.081x3−0.139x4+0.546x5−0.494x6+0.457x7+0.363x8+0.033x9−0.273x10+0.039x11;
y3=−0.107x1−0.060x2−0.309x3+0.171x4−0.046x5+0.061x6+0.162x7−0.301x8+0.662x9−0.433x10+0.337x11;
y4=0.100x1+0.11x2−0.066x3−0.098x4+0.211x5+0.354x6+0.307x7+0.003x8−0.107x9+0.476x10+0.679x11。
通过4个主成分的得分,可得出综合得分(Y):Y=0.255 9y1+0.480 5y2+0.647 9y3+0.700 8y4。
-
如表4所示:500 mg·L−16-BA (T6)处理组y1得分高达2.14分,表明其配比最利于绿原酸、桃叶珊瑚苷以及松脂醇二葡萄糖苷的积累,500 mg·L−1 IAA+500 mg·L−1 6-BA (T15)的得分为−2.883,不利于3种化合物产量的提高。
表 4 各主成分得分和综合分析
Table 4. Principal component scores and comprehensive analysis
处理 y1 y2 y3 y4 Y 排名 处理 y1 y2 y3 y4 Y 排名 ck −0.901 −1.251 −1.293 −1.052 −0.867 15 T8 −0.842 0.768 0.899 0.404 0.161 7 T1 −2.304 0.344 −0.837 0.369 −0.604 14 T9 1.082 1.081 1.211 −0.241 0.690 2 T2 1.990 −0.120 1.012 0.256 0.686 3 T10 1.533 0.966 0.011 −0.639 0.526 4 T3 1.829 −1.194 1.879 −1.069 0.373 5 T11 −0.103 −0.006 −0.503 −0.199 −0.138 10 T4 −1.596 0.207 −0.172 −0.213 −0.419 13 T12 −0.631 −0.558 0.597 0.435 −0.129 9 T5 −0.202 0.869 0.329 −0.791 0.094 8 T13 0.180 −1.548 0.135 −0.387 −0.330 12 T6 2.140 0.177 −3.089 1.285 0.241 6 T14 0.281 −0.449 −0.671 −0.490 −0.206 11 T7 0.428 1.066 1.628 1.774 0.857 1 T15 −2.883 −0.353 −1.136 0.558 −0.933 16 说明:y1、y2、y3、y4分别表示主成分1、主成分2、主成分3、主成分4的得分,Y表示综合得分,排名为综合得分的排名。 y2各组得分中,100 mg·L−1IAA+ 100 mg·L−16-BA (T7)和100 mg·L−1IAA+ 500 mg·L−16-BA (T9)处理组得分分别为1.066、1.081,表明在叶鲜质量、京尼平、京尼平苷酸和松脂醇二葡萄糖苷积累上表现良好,500 mg·L−1 IAA (T3)和500 mg·L−1 IAA+ 100 mg·L−1 6-B (T13)处理组得分分别为−1.194和−1.548,所以在y2中的表现不佳。
y3各组得分中,T3、T7和T9处理的得分分别为1.879、1.628和1.211,是最有利于哈巴苷积累的处理组;T6处理组得分为−3.089,不利于哈巴苷得积累。T6和T7处理组y4得分为1.285、1.774,这表明T6和T7处理组对叶鲜质量、叶干质量、京尼平、京尼平苷、京尼平苷酸、咖啡酸和车叶草苷7个指标是有利的。11个指标的综合得分从大到小依次为T7、T9、T2 (300 mg·L−1IAA)、其他处理组和ck,是最有利于杜仲主要次级代谢产物产量提升的处理组。
-
植物的生长发育过程中,激素起着重要的调控作用[17]。植物生长调节剂通过影响植物体内激素的平衡,促使植物发生生理生态方面的改变。本研究施加500 mg·L−1IAA+500 mg·L−16-BA,与对照相比,叶面积、叶宽、叶周长明显增加,这与李彩龙等[18]和石海燕等[19]的研究结果一致,表明IAA和6-BA可以通过影响叶片的生长过程,影响植物的形态指标及生物量的积累。植物生长调节剂还能调节植物细胞中次级代谢产物的产生[20−21]。施加IAA可显著地促进黄芩Scutellaria baicalensis中黄芩苷、黄芩素质量分数的提高,并且在条件一致的情况下,黄芩中的不同次级代谢物对植物生长调节剂的敏感性程度有所不同[22]。谷宇超等[23]研究发现:单施6-BA可引起烤烟Nicotiana tabacum中烟碱的积累量增加,这与本研究结果一致。在本研究中,500 mg·L−16-BA的处理组有利于促进绿原酸、松脂醇二葡萄糖苷和咖啡酸的积累,500 mg·L−1 IAA的处理组,有利于桃叶珊瑚苷、京尼平苷以及哈巴苷的积累。同样的结果还出现在薰衣草Lavandula angustifolia的研究中,不同剂量的植物生长调节剂对薰衣草植株中挥发性物质的合成影响效果不同[24]。
利用主成分分析法可从多方面综合评估植株的品质以及产量高低[25]。韩德志等[26]利用主成分分析综合评价大豆Glycine max种质资源的耐密性,从90个品种中筛选出了具有高耐密性优良种质的8个品种。本研究采用相关性分析结合主成分分析的方法,优化了不同质量浓度植物生长调节剂配比对杜仲次级代谢产物的影响,最后得出100 mg·L−1 IAA+100 mg·L−1 6-BA、100 mg·L−1 IAA+ 500 mg·L−1 6-BA和300 mg·L−1 IAA的处理组在提升叶用杜仲可利用部位生物量积累的同时,可最大限度促进9种主要次级代谢产物的产量提高。
-
综上所述,单施500 mg·L−1IAA或6-BA(T6),杜仲叶面积降低,生物量积累不明显,但能促进叶中绿原酸、松脂醇二葡萄糖苷、咖啡酸和桃叶珊瑚苷、京尼平苷、哈巴苷质量分数的增加。复合喷洒500 mg·L−1IAA和6-BA以及100 mg·L−1IAA+300 mg·L−16-BA可促进叶片的生长;此外100 mg·L−1IAA+100 mg·L−16-BA、100 mg·L−1 IAA+500 mg·L−1 6-BA可达到提升主要次级代谢产物的产量(既能促进叶片生长又能促进9种次级代谢产物积累)。
Effects of plant growth regulators on the main secondary metabolites in Eucommia ulmoides leaves
-
摘要:
目的 探讨不同质量浓度植物生长调节剂对杜仲Eucommia ulmoides叶片次级代谢产物积累的影响,筛选促进次级代谢产物生成的最适植物生长调节剂配比条件,为杜仲次级代谢产物的调控提供参考。 方法 以2年生杜仲幼苗作为研究材料,施加不同质量浓度配比的吲哚乙酸(IAA)和6-苄氨基嘌呤(6-BA),测量杜仲叶片生长形态特征以及叶干、鲜质量,利用超高效液相色谱-质谱(UPLC-MS)测定9种次级代谢产物的质量分数,结合生物量进行主成分分析及因子分析,筛选高产量的次级代谢产物的最适生长调剂配比条件。 结果 与对照组相比,500 mg·L−1 IAA + 500 mg·L−1 6-BA处理时,杜仲叶面积、叶周长、叶宽、叶干质量、叶鲜质量显著提高(P<0.05);相关性分析表明:IAA质量浓度与比叶面积、桃叶珊瑚苷、京尼平苷、京尼平苷酸质量分数呈显著正相关(P<0.05);6-BA质量浓度与绿原酸以及京尼平苷酸质量分数呈显著正相关(P<0.05);综合指标分析表明:单独施加500 mg·L−1 6-BA时,绿原酸、桃叶珊瑚苷、松脂醇二葡萄糖苷积累量最高,分别为0.036、0.046、0.031 µg·g−1。 结论 IAA质量浓度对桃叶珊瑚苷、车叶草苷酸积累作用显著;6-BA质量浓度对绿原酸、咖啡酸的积累作用显著。当复合施加100 mg·L−1 IAA+300 mg·L−1 6-BA时有利于植株的生长;施加100 mg·L−1 IAA+ 100 mg·L−1 6-BA时,不仅利于提高杜仲生物量,也促进次级代谢产物的积累。图2表4参26 Abstract:Objective The objective is to explore the effects of different concentrations of plant growth regulators on the accumulation of secondary metabolites in Eucommia ulmoides leaves and screen the optimal ratio conditions of plant growth regulator to promote the generation of secondary metabolites, so as to provide reference for the regulation of secondary metabolites in E. ulmoides. Method The 2-year-old E. ulmoides seedlings with different concentrations of 3-indole acetic acid (IAA) and 6-benzylaminopurine (6-BA) (15 groups) were used as materials, and growth morphological characteristics and dry and fresh weight of E. ulmoides leaves were measured. The contents of 9 secondary metabolites were determined by ultra high performance liquid chromatography-mass spectrometry (UPLC-MS). The optimal growth ratio conditions for high-yield secondary metabolites were selected by principal component analysis (PCA) and factor analysis combined with biomass. Result Compared with the control, the leaf area, leaf circumference, leaf width, dry and fresh weight significantly increased (P<0.05) when the conditions of plant growth regulators was 500 mg·L−1 IAA + 500 mg·L−1 6-BA. Correlation analysis showed that the IAA concentration was significantly positively correlated with leaf area, aucubin, geniposide and geniposidic acid (P<0.05). The concentration of 6-BA was significantly positively correlated with the content of chlorogenic acid and geniposidic acid (P<0.05). The comprehensive indicator analysis showed that when 500 mg·L−1 6-BA was applied alone, the accumulation of chlorogenic acid, aucubin and pinoresinol diglucoside were the highest , which were 0.036, 0.046 and 0.031 μg·g−1 respectively. Conclusion The concentration of IAA has significant effects on the accumulation of aucubin and asperulosidic acid, while the concentration of 6-BA has significant effects on the accumulation of chlorogenic acid and caffeic acid (P<0.05). When 100 mg·L−1 IAA + 300 mg·L−1 6-BA is applied in combination, it is beneficial for plant growth. When 100 mg·L−1 IAA + 100 mg·L−1 6-BA is applied, it is beneficial both for the biomass and the accumulation of secondary metabolites in E. ulmoides. [Ch, 2 fig. 4 tab. 26 ref.] -
表 1 不同植物生长调节剂质量浓度与配比情况
Table 1. Specific concentrations of plant growth regulators
处理 IAA/
(mg·L−1)6-BA/
(mg·L−1)处理 IAA/
(mg·L−1)6-BA/
(mg·L−1)ck 0 0 T8 100 300 T1 100 0 T9 100 500 T2 300 0 T10 300 100 T3 500 0 T11 300 300 T4 0 100 T12 300 500 T5 0 300 T13 500 100 T6 0 500 T14 500 300 T7 100 100 T15 500 500 表 2 杜仲叶片形态指标对植物生长调节剂配比的响应
Table 2. Response of leaf morphological indexes of E. ulmoides to concentration ratio of plant growth regulators
处理 叶面积/cm2 叶周长/cm 叶长/cm 叶宽/cm 叶厚度/mm 比叶面积/(cm2·g−1) 叶鲜质量/g 叶干质量/g ck 39.25±8.56 bc 28.14±3.07 b 13.03±1.49 a 5.05±0.65 bcd 0.320±0.043 cdef 287.92±54.31 bc 0.46±0.00 jh 0.140±0.06 d T1 43.10±6.36 b 29.08±2.43 b 12.61±1.07 abc 6.30±0.62 a 0.349±0.043 bcd 186.81±38.09 f 0.80±0.04 b 0.240±0.011 a T2 26.78±9.32 d 24.14±3.21 efj 11.41±1.95 cdef 3.76±0.68 f 0.321±0.037 cdef 244.63±41.97 cde 0.42±0.02 hij 0.110±0.050 f T3 31.40±4.86 bcd 23.99±2.15 defj 10.47±1.05 fjh 4.82±0.36 de 0.299±0.030 fj 343.40±74.98 a 0.39±0.02 ij 0.094±0.005 j T4 38.05±5.53 bcd 26.95±1.92 bcde 11.92±1.06 abcde 5.45±0.62 bc 0.326±0.036 cdef 250.00±50.93 cde 0.57±0.02 d 0.160±0.005 c T5 27.28±4.87 d 22.81±1.77 fj 9.53±0.91 h 4.85±0.52 cde 0.362±0.032 ab 221.09±36.13 ef 0.43±0.02 hi 0.130±0.003 e T6 33.08±3.97 bcd 24.49±1.46 defj 10.63±0.72 efjh 5.02±0.37 bcd 0.350±0.026 bcde 258.36±46.50 cde 0.46±0.02 jh 0.130±0.004 e T7 34.33±5.75 bcd 25.37±2.57 bcdef 11.18±0.96 def 4.83±0.46 cde 0.360±0.019 ab 321.08±40.46 ab 0.43±0.02 hi 0.110±0.004 f T8 40.37±6.42 b 27.71±2.04 bc 12.19±0.90 abcd 5.50±0.62 b 0.390±0.025 a 229.79±37.17 def 0.61±0.03 cd 0.180±0.006 b T9 31.13±5.32 cd 24.91±2.36 efj 11.10±0.90 def 4.37±0.35 e 0.350±0.041 abc 291.41±44.84 bc 0.45±0.02 jh 0.110±0.056 f T10 28.15±5.02 d 22.07±2.32 e 9.67±1.30 jh 4.41±0.52 e 0.280±0.039 h 331.78±35.29 ab 0.33±0.02 j 0.085±0.004 j T11 40.20±10.74 b 26.40±3.76 bcde 11.64±3.76 bcde 5.20±0.69 bcd 0.310±0.028 ef 274.26±51.65 de 0.56±0.03 e 0.160±0.004 c T12 37.10±5.36 bcd 26.80±2.95 bcde 11.90±2.95 abcde 5.28±0.36 bcd 0.340±0.047 bcde 237.54±38.21 cdef 0.59±0.03 de 0.160±0.007 c T13 37.31±4.53 bcd 27.18±1.55 bcd 11.96±1.55 defj 5.12±0.37 bcd 0.340±0.030 bcde 289.99±17.43 bc 0.51±0.02 f 0.130±0.004 e T14 34.87±4.43 bcd 25.46±1.77 cdefj 10.97±1.77 defj 5.10±0.21 bcd 0.320±0.030 def 269.77±55.03 cd 0.53±0.00 f 0.130±0.003 e T15 56.00±31.70 a 30.38±7.02 a 13.00±7.02 ab 6.41±1.46 a 0.330±0.027 bcdef 266.97±69.23 cde 0.90±0.04 a 0.230±0.001 a 说明:同列不同字母表示处理间差异显著(P<0.05)。 表 3 杜仲次级代谢物产量主成分分析的特征向量与载荷值
Table 3. Characteristic vector and load value of principal component analysis (PCA) for secondary metabolites of of E. ulmoides
性能指标 主成分1 主成分2 主成分3 主成分4 特征向量 载荷值 特征向量 载荷值 特征向量 载荷值 特征向量 载荷值 干质量 −0.52 −0.88 0.11 0.18 −0.11 −0.15 0.10 0.12 鲜质量 −0.52 −0.88 0.04 0.07 −0.06 −0.08 0.11 0.13 绿原酸 0.43 0.71 0.08 0.13 −0.31 −0.42 −0.07 −0.08 桃叶珊瑚苷 0.41 0.69 −0.14 −0.22 0.17 0.23 −0.10 −0.12 咖啡酸 0.11 0.19 0.55 0.86 −0.05 −0.06 0.21 0.26 京尼平苷酸 0.17 0.29 −0.49 −0.78 0.06 0.08 0.35 0.43 松脂醇二葡萄糖苷 0.10 0.16 0.46 0.72 0.16 0.22 0.31 0.37 京尼平 0.21 0.36 0.36 0.57 −0.3 −0.41 0 0 哈巴苷 −0.02 −0.04 0.03 0.05 0.66 0.90 −0.11 −0.13 车叶草苷 0 −0.01 −0.27 −0.43 −0.43 −0.59 0.48 0.58 京尼平苷 0.09 0.16 0.04 0.06 0.34 0.46 0.68 0.82 特征值 2.82 2.47 1.84 1.46 贡献率/% 25.59 22.46 16.74 12.26 累积贡献率/% 25.59 48.05 64.79 78.05 表 4 各主成分得分和综合分析
Table 4. Principal component scores and comprehensive analysis
处理 y1 y2 y3 y4 Y 排名 处理 y1 y2 y3 y4 Y 排名 ck −0.901 −1.251 −1.293 −1.052 −0.867 15 T8 −0.842 0.768 0.899 0.404 0.161 7 T1 −2.304 0.344 −0.837 0.369 −0.604 14 T9 1.082 1.081 1.211 −0.241 0.690 2 T2 1.990 −0.120 1.012 0.256 0.686 3 T10 1.533 0.966 0.011 −0.639 0.526 4 T3 1.829 −1.194 1.879 −1.069 0.373 5 T11 −0.103 −0.006 −0.503 −0.199 −0.138 10 T4 −1.596 0.207 −0.172 −0.213 −0.419 13 T12 −0.631 −0.558 0.597 0.435 −0.129 9 T5 −0.202 0.869 0.329 −0.791 0.094 8 T13 0.180 −1.548 0.135 −0.387 −0.330 12 T6 2.140 0.177 −3.089 1.285 0.241 6 T14 0.281 −0.449 −0.671 −0.490 −0.206 11 T7 0.428 1.066 1.628 1.774 0.857 1 T15 −2.883 −0.353 −1.136 0.558 −0.933 16 说明:y1、y2、y3、y4分别表示主成分1、主成分2、主成分3、主成分4的得分,Y表示综合得分,排名为综合得分的排名。 -
[1] 杜红岩. 杜仲优质高产栽培 [M]. 北京: 中国林业出版社, 1996. DU Hongyan. High-Quality and High-Yield Cultivation of Eucommia ulmoides [M]. Beijing: China Forestry Press, 1996. [2] 杜红岩, 杜庆鑫. 我国杜仲产业高质量发展的基础、问题与对策[J]. 经济林研究, 2020, 38(1): 1 − 10. DU Hongyan, DU Qingxin. Foundation, problems and countermeasures of Eucommia ulmoides industry high-quality development in China [J]. Non-wood Forest Research, 2020, 38(1): 1 − 10. [3] 杜红岩, 李钦, 赫锦锦, 等. 不同变异类型杜仲皮中几种主要活性成分含量的比较[J]. 林业科学研究, 2011, 24(2): 230 − 233. DU Hongyan, LI Qin, HE Jinjin, et al. Comparison of the main active components contents in barks of different variance-types of Eucommia ulmoides [J]. Forest Research, 2011, 24(2): 230 − 233. [4] REN Xiaomei, HAN Zhuzhen, SONG Leixin, et al. Four new phenolic compounds from the tender leaves of Eucommia ulmoides Oliv. and their anti-inflammatory activities [J]. Phytochemistry Letters, 2021, 44: 173 − 177. [5] RUI Han, TIAN Yuan, ZHI Yang, et al. An unusual nortriterpenoid from Eucommia ulmoides Oliv. leaves prevents neuroinflammation by targeting the PU. 1 transcriptional signaling pathway [J]. Bioorganic Chemistry, 2021, 116: 105 − 345. [6] QI Huang, FENG Yuzhang, SHAO Liu, et al. Systematic investigation of the pharmacological mechanism for renal protection by the leaves of Eucommia ulmoides Oliver. using UPLC-Q-TOF/MS combined with network pharmacology analysis [J/OL]. Biomedicine & Pharmacotherapy, 2021, 140: 111735[2022-11-10]. doi:10.1016/j.biopha.2021.111735. [7] 王琴, 张晓艳, 刘雪婷, 等. 杜仲纯中药制剂和松脂醇二葡萄糖苷对自发性高血压大鼠肾脏微循环血流灌注及其频谱特征的影响[J]. 微循环学杂志, 2022, 32(3): 1 − 7. WANG Qin, ZHANG Xiaoyan, LIU Xueting, et al. The protective effects of Eucommia ulmoides Oliver. and pinoresinol diglucoside on renal micirculatory blood perfusion and vasomotion in spontaneously hypertensive rats [J]. Chinese Journal of Microcirculation, 2022, 32(3): 1 − 7. [8] SVOBODA T, THON M R, STRAUSS J. The role of plant hormones in the interaction of Colletotrichum species with their host plants[J/OL]. International Journal of Molecular Sciences, 2021, 22(22): 12454[2022-11-10]. doi: https://doi.org/10.3390/ijms222212454. [9] 陶奇波, 白梦杰, 韩云华, 等. 植物生长调节剂在牧草种子生产中的应用[J]. 草业科学, 2017, 34(6): 1238 − 1246. TAO Qibo, BAI Mengjie, HAN Yunhua, et al. Use of plant growth regulators in forage seed production [J]. Pratacultural Science, 2017, 34(6): 1238 − 1246. [10] 宋吉轩. 干旱胁迫下植物生长调节剂对羊草生长及生理特性的影响与转录组分[D]. 重庆: 西南大学, 2017. SONG Jixuan. Effects of Plant Growth Regulators on the Growth and Physiological Characteristics of Leymus chinensis under Drought Stress and Transcription Components [D]. Chongqing: Southwest University, 2017. [11] 张睿, 王秀娟, 高伟. 植物激素对次级代谢产物的调控研究[J]. 中国中药杂志, 2020, 45(17): 4205 − 4210. ZHANG Rui, WANG Xiujuan, GAO Wei. Regulation mechanism of plant hormones on secondary metabolites [J]. Journal of Chinese Materia Medica, 2020, 45(17): 4205 − 4210. [12] 胡克特, 张萍, 陈荣祥, 等. 外源性植物激素对盐肤木叶片次生次级代谢产物及其抗氧化活性的影响[J]. 西南师范大学学报(自然科学版), 2022, 47(2): 43 − 49. HU Kete, ZHANG Ping, CHEN Rongxiang, et al. Effect of exogenous plant hormones on content of secondary metabolites in the leaves of Rhus chinensis and on their antioxodant activitie [J]. Journal of Southweat China Normal University (Natural Science Edition), 2022, 47(2): 43 − 49. [13] 宁倩, 吴金水, 李宝珍, 等. 水稻苗期生长特性对不同浓度IAA的响应[J]. 农业现代化研究, 2013, 34(2): 235 − 238. NING Qian, WU Jinshui, LI Baozhen, et al. Response of growth characteristics to different IAA concentrations in rice seedling [J]. Research of Agricultural Modernization, 2013, 34(2): 235 − 238. [14] LI Ziyun, LI Biao, ZHAO Yichen, et al. Cloning and characterization of the DIR1 promoter from Eucommia ulmoides Oliv. and its response to hormonal and abiotic stress [J]. Plant Cell,Tissue,and Organ Culture, 2021, 146(2): 313 − 322. [15] 雷燕妮, 崔娇娇, 张小斌. 外源激素对杜仲愈伤组织中绿原酸含量的影响[J]. 陕西农业科学, 2019, 65(9): 24 − 28. LEI Yanni, CUI Jiaojiao, ZHANG Xiaobing. Effect of exogenous hormones on chlorogenic acid content in Eucommia callus [J]. Shaanxi Journal of Agricultural Sciences, 2019, 65(9): 24 − 28. [16] 付金颖, 杨超, 李德文, 等. 环境UV-B辐射增强对叶用杜仲林叶片光合作用与活性物质含量的影响[J]. 安徽农业科学, 2017, 45(26): 6 − 10. FU Jinying, YANG Chao, LI Dewen, et al. Effects of elevated UV-B radiation on photosynthesis and contents of active substance of Eucommia ulmoides plantation [J]. Anhui Agricultural Science, 2017, 45(26): 6 − 10. [17] ANDREA V, JOS ANTONIO O. Nitrate and hormonal signaling crosstalk for plant growth and development [J]. Current Opinion in Plant Biology, 2019, 52: 155 − 163. [18] 李彩龙, 李毛毛, 高彦龙, 等. 外源6-BA对干旱胁迫下苹果砧木M26的生理效应[J]. 甘肃农业大学学报, 2022, 57(5): 126 − 137. LI Cailong, LI Maomao, GUO Yanlong, et al. Physiological effects of exogenous 6-BA on apple rootstock M26 under drought stress [J]. Journal of Gansu Agricultural University, 2022, 57(5): 126 − 137. [19] 石海燕, 张志刚, 李宏, 等. IAA对幼苗期夏橡生长及光合特性的影响[J]. 河北大学学报(自然科学版), 2022, 42(5): 519 − 529. SHI Haiyan, ZHANG Zhigang, LI Hong, et al. Effect of IAA on the growth and photosynthetic characteristics of Quercus sessilis at seedling stage [J]. Journal of Hebei University (Natural Science Edition), 2022, 42(5): 519 − 529. [20] 耿达立, 卢恒, 刘伟, 等. 冬季修剪调控新梢内植物激素影响金银花的生长与产量[J]. 中国中药杂志, 2022, 47(14): 3749 − 3755. GENG Dali, LU Heng, LIU Wei, et al. Winter pruning boosts growth and yield of Lonicera japonica by regulating plant hormone content [J]. China Journal of Chinese Materia Medica, 2022, 47(14): 3749 − 3755. [21] AHAMMED G J, LI Xin. Hormonal regulation of health-promoting compounds in tea (Camellia sinensis L. ) [J]. Plant Physiology and Biochemistry, 2022, 185: 390 − 400. [22] 方强, 乔勇进, 王海宏. 不同植物生长调节剂、碳源对黄芩细胞生长及次级代谢产物的影响[J]. 上海交通大学学报(农业科学版), 2008, 26(1): 33 − 37. FANG Qiang, QIAO Yongjing, WANG Haihong. Effect of different plant growth regulators and carbon sources on the growth of calluses and production of secondary metabolites of Scutellaria baicalensis Georgi [J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2008, 26(1): 33 − 37. [23] 谷宇超, 杨懿德, 鄢敏, 等. 打顶后喷施不同浓度赤霉素GA3和6-BA对烤烟农艺性状和化学成分的影响[J]. 作物杂志, 2021(6): 171 − 176. GU Yuchao, YANG Yide, YAN Min, et al. Effects of GA3 and 6-BA on agronomic characters and chemical components of flue-cured tobacco after topping [J]. Crops, 2021(6): 171 − 176. [24] DONG Yanmei, LI Jingrui, ZHANG Wenying. Exogenous application of methyl jasmonate affects the emissions of volatile compounds in lavender (Lavandula angustifolia) [J]. Plant Physiology and Biochemistry, 2022, 185: 25 − 34. [25] MEHMOOD M, PÉREZ-LLORCA M, CASADESÚS A, et al. Leaf size modulation by cytokinins in sesame plants [J]. Plant Physiology and Biochemistry, 2021, 167: 763 − 770. [26] 韩德志, 王舒, 贾鸿昌, 等. 耐密指数与主成分分析法综合评价并筛选高耐密性大豆种质[J]. 大豆科学, 2021, 40(4): 445 − 456. HAN Dezhi, WANG Shu, JIA Hongchang, et al. Comprehensive evaluation and screening of high density resistant soybean germplasm based on tightness tolerance index and principal component analysis [J]. Soybean Science, 2021, 40(4): 445 − 456. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220705






 下载:
下载: