-
森林生态系统是陆地生物圈最大的植物碳库,占全球植物生物量的80%~90%[1−2]。森林植物光合作用引起的碳汇效应对实现碳中和目标具有不可替代的作用。研究指出:全球森林每年吸收约(2.4±0.4) Gt碳(约8.8 Gt 二氧化碳),森林碳汇效率每提升1个百分点,理论上可中和0.88 Gt工业源二氧化碳排放[3]。然而,森林群落自然更新过程中普遍存在冠层郁闭或遮光现象,严重抑制森林的碳汇效应。冠层遮光可使乔木林下光合有效辐射(PAR)年总量比全光照衰减29.28%~99.22%[4],导致幼苗面临持续性光饥饿状态。研究表明:相较于全光照条件,遮光环境下植物生物量平均降低59.9% [5]。木本植物幼苗建植的成败不仅影响群落演替进程和碳汇功能,而且制约成熟林分跨代际的碳封存稳定性。因此,阐明遮光胁迫下木本植物幼苗的光适应调控网络,既关乎生态恢复的短期成效,更有利于碳中和目标的长期路径,也是连接生态恢复工程与气候治理目标的科学桥梁。
植物在长期进化过程中形成了应对遮光胁迫的二元适应策略体系。以避光反应综合征(shade avoidance syndrome, SAS)为代表的木本植物形态可塑性策略通过促进茎秆伸长、增大比叶面积等表型变化主动获取光资源,而耐光响应策略(shade tolerance response, STR)中木本植物则通过动态调节叶绿素a/b、优化光系统Ⅱ复合体稳定性等生理适应机制提升光能利用效率[6−7]。近年研究表明:外源硅不仅能通过促进植株生长,提升叶绿素质量分数[8],还可通过激活过氧化物酶(POD)、过氧化氢酶(CAT)等增强抗氧化防御系统,减少丙二醛(MDA)和活性氧积累[9]。当前研究聚焦于外源硅对水稻Oryza sativa[10]、小麦Triticum aestivum[11]、玉米Zea mays [12]等禾本科Poaceae作物及木荷Schima superba[13]等阔叶树种的调控作用,对常绿针叶树种硅吸收转运的调控网络,以及遮光胁迫下硅的调控机制缺乏系统阐释,特别是硅介导的“形态-生理”协同调控网络及其类群特异性表达规律尚未明晰。这种研究失衡不仅制约着硅肥技术在森林生态系统修复中的精准施用,也限制了植物抗逆理论的发展。因此,解析硅在常绿针叶植物遮光胁迫中的双重调控机制,对完善植物环境适应理论体系,指导退化生态系统定向修复均具有重要的理论和实践价值。
侧柏Platycladus orientalis是中国北方半干旱和干旱区人工林的重要树种。本研究选择侧柏为研究对象,通过黑尼龙网遮光模拟0~70%遮光梯度,结合0和2 mmol·L−¹硅酸钠施硅处理,系统解析侧柏幼苗生长特征(基径和株高异速生长)、光合效能(叶绿素a/b动态)及抗逆响应(渗透调节物质与抗氧化酶活性)的多维度适应策略。探究外源硅是否通过“基径增粗-株高抑制”的双向调控介导碳分配重构,并阐明遮光胁迫下渗透调节物质(可溶性糖、游离脯氨酸)与抗氧化酶(过氧化物酶、过氧化氢酶)等的协同响应规律,以期为干旱区人工林优化配置(如林窗补植密度调控)和硅肥精准施用提供理论依据。
-
研究区位于河南省洛阳市洛龙区(34°62′N, 112°45′E)。该区属于亚热带向暖温带过渡地带,四季分明,夏季高温多雨,冬季寒冷干燥。根据1966—2015年洛阳市气象局孟津县国家基本观测站气象观测资料,该地区年平均降水量为615.2 mm,年平均气温为14.1 ℃,年平均日照时数为2 178.8 h。
-
选择长势均匀、生长良好的3年生盆栽侧柏幼苗,所用基质为当地土壤与营养土以4∶1的质量比混合。花盆口径为30.5 cm,高为20.0 cm。平均苗高为25.34 cm,平均基径为3.08 mm。于2023年5月1日置于通风、阳光充足的环境下缓苗7 d。2023年5月7日开始处理,采用双因素完全随机区组设计。设置4个遮光梯度(自然光、低度遮光、中度遮光和高度遮光)和2个施硅水平[无硅(Si0)、施硅(Si1)],每处理8盆,均分用于生长和生理指标测定。利用黑色聚乙烯遮阳网层数控制遮光水平,利用照度计测量并计算遮光水平。施硅处理为2 mmol·L−1 Na2SiO3·5H2O,无硅处理为4 mmol·L−1 NaCl以平衡钠离子[14],每月处理1次,处理时长为120 d。根据天气情况进行定量浇水,同时定期除草除虫。
-
选择天气晴朗无云,于13:00利用CEM牌照度计(DT-8808),在同一水平高度下测定不同遮光处理下的光照度,计算不同处理下相对光照强度范围(表1)。
表 1 不同遮光处理下相对光照强度
Table 1. Relative light intensity under different shading treatments
处理 光照度/lx 相对光照强度/% 处理 光照度/lx 相对光照强度/% 自然光 85.60±0.98 100.00 中度遮光 (50%遮光) 38.35±3.52 41.67~51.66 低度遮光 (30%遮光) 60.03±3.41 65.63~76.84 高度遮光 (70%遮光) 24.13±2.12 25.81~32.19 说明:光照度数值为平均值±标准差。 -
于2023年5月7日、9月7日分别利用卷尺、游标卡尺测量株高(植株顶端到盆栽基质表面垂直高度)和基径(距盆栽基质表面1 cm处的直径),同时记录主茎的侧枝分枝数(幼苗顶端侧枝长度小于2 cm不计数)。株高增长量(hg)、基径的增长量(Sg)、侧枝增长量(Li)按以下公式计算:Δx=xb−xa。其中:Δx表示某一指标的增长量;xa表示处理前的初始测量值;xb表示处理后的最终测量值。
-
选用当年生新鲜小枝作为功能叶,清洗干净待用,采用乙醇丙酮混合提取液,V(乙醇)∶V(丙酮)∶V(水)=4.5∶4.5∶1.0,将叶片剪碎后加入提取液,在遮光条件下到叶片变白,取上清,用紫外分光光度计分别测定663、645 nm处吸光度D(663)、D(645),并计算叶绿素质量分数[15]。
-
参照高俊凤[16]和李小方等[17]的方法,可溶性蛋白(SP)质量分数采用考马斯亮蓝G-250法测定,可溶性糖(SS)质量分数采用蒽酮比色法测定,过氧化氢酶活性采用紫外分光光度法测定,游离脯氨酸(Pro)质量分数采用酸性茚三酮比色法测定,丙二醛质量摩尔浓度采用硫代巴比妥酸法测定,过氧化物酶活性采用愈创木酚法测定。
-
通过 Excel 2022 对数据进行计算和整理,使用DPS软件进行双因素方差分析,采用Duncan法进行多重比较检验不同处理间的差异显著性,显著水平为0.05。使用 SPSS 26.0 进行指标间相关性分析,采用Pearson相关分析法检验指标在不同遮光与施硅处理间的相关性,显著水平为0.01。使用Origin 2018 作图。
-
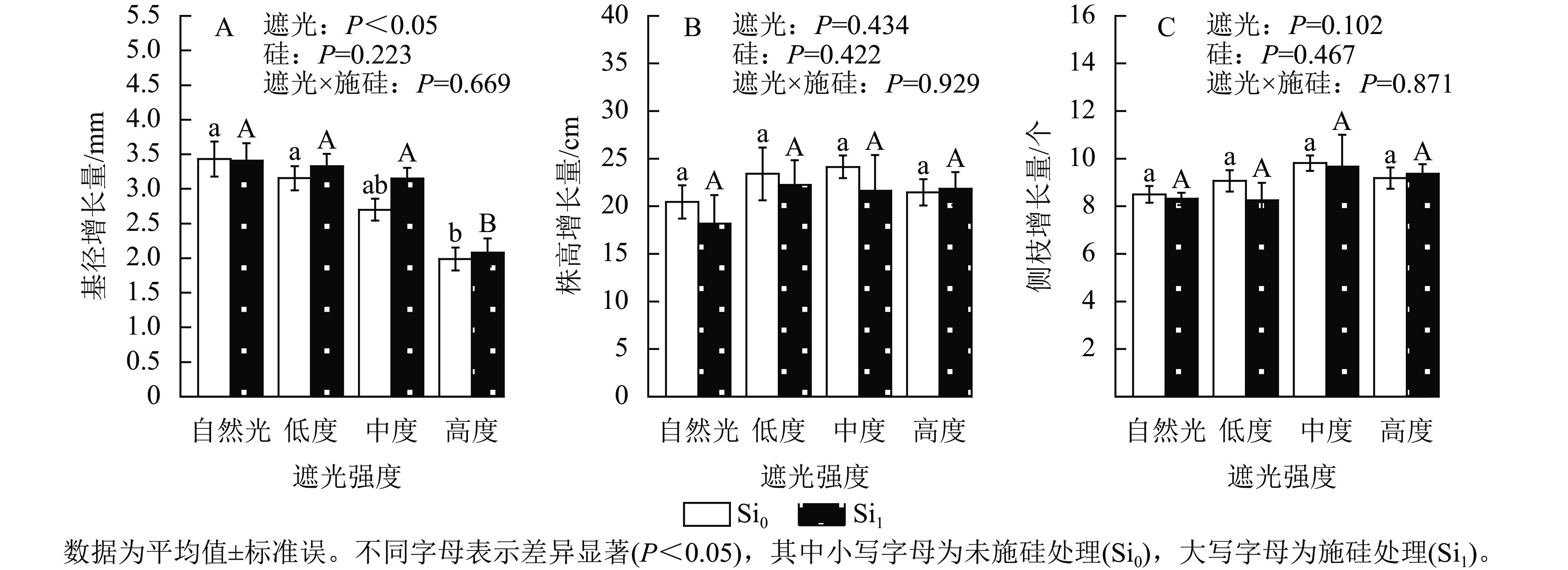
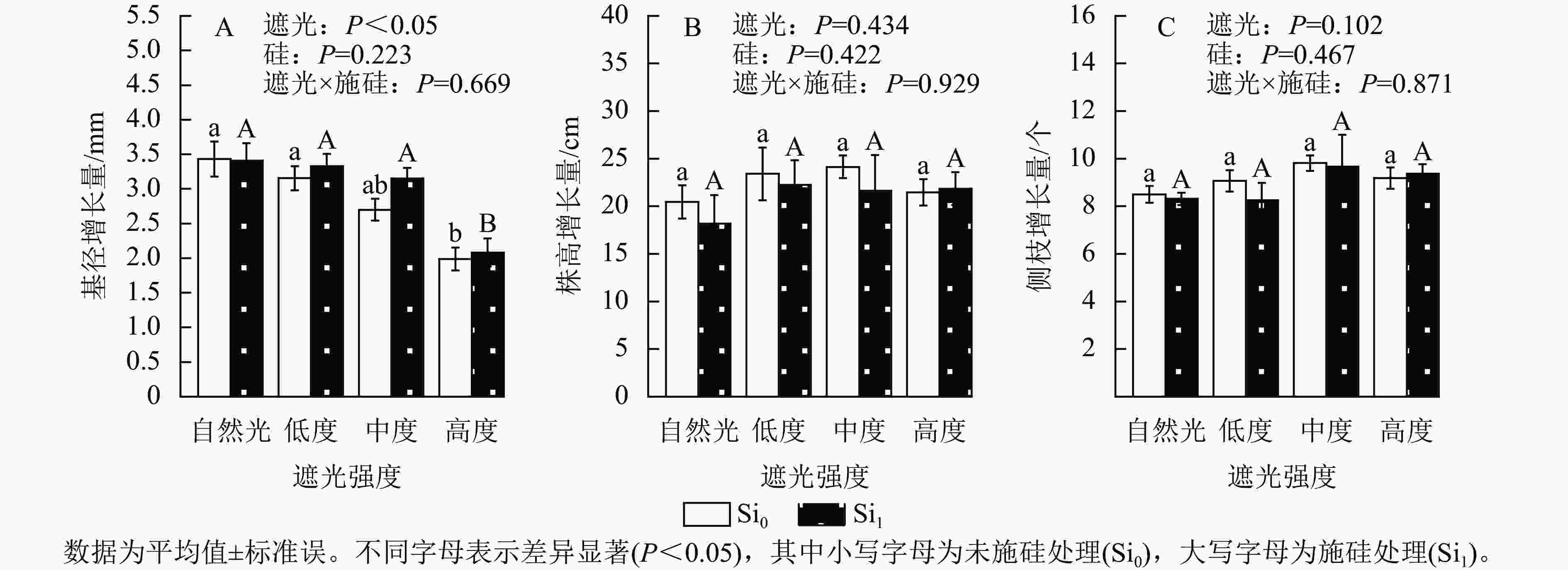
遮光强度与侧柏幼苗基径生长量呈显著负相关(P<0.05)。相较于自然光+未施硅对照处理,低度遮光+未施硅、中度遮光+未施硅及高度遮光+未施硅处理分别导致侧柏基径增长量降低8.01%、21.31%和42.08%。其中高度遮光处理的侧柏基径增长量显著低于其他处理(图1A,P<0.05)。相较于自然光+未施硅对照处理,低度、中度、高度遮光+未施硅处理株高增长量与侧枝增长量呈典型单峰曲线,两者最大值均出现在中度遮光处理(图1B~C),较自然光+未施硅对照处理分别提升17.96%和15.44%,但遮光处理间未达显著水平。相较于自然光+施硅对照处理,低度、中度、高度遮光+施硅处理侧柏基径增长量呈下降趋势。同一遮光强度下,与未施硅处理相比施硅处理下均促进基径发育,其增幅随遮光强度变化呈现非线性特征:低度遮光、中度遮光、高度遮光处理下施硅处理分别较未施硅处理提高5.48%、16.67%和4.72%。同一遮光强度下,施硅处理对株高生长无显著效应;低度遮光和中度遮光处理下,施硅处理的株高和侧枝增长量低于未施硅处理,但在高度遮光处理下,施硅处理的株高和侧枝增长量仍较未施硅处理分别提升1.75%和2.04%。以上结果表明:侧柏幼苗通过株高延展的形态可塑性策略适应弱光环境,但超过50%光强衰减将触发生长抑制。施硅有利于减缓弱光变化引起的生长抑制和形态变化。
-
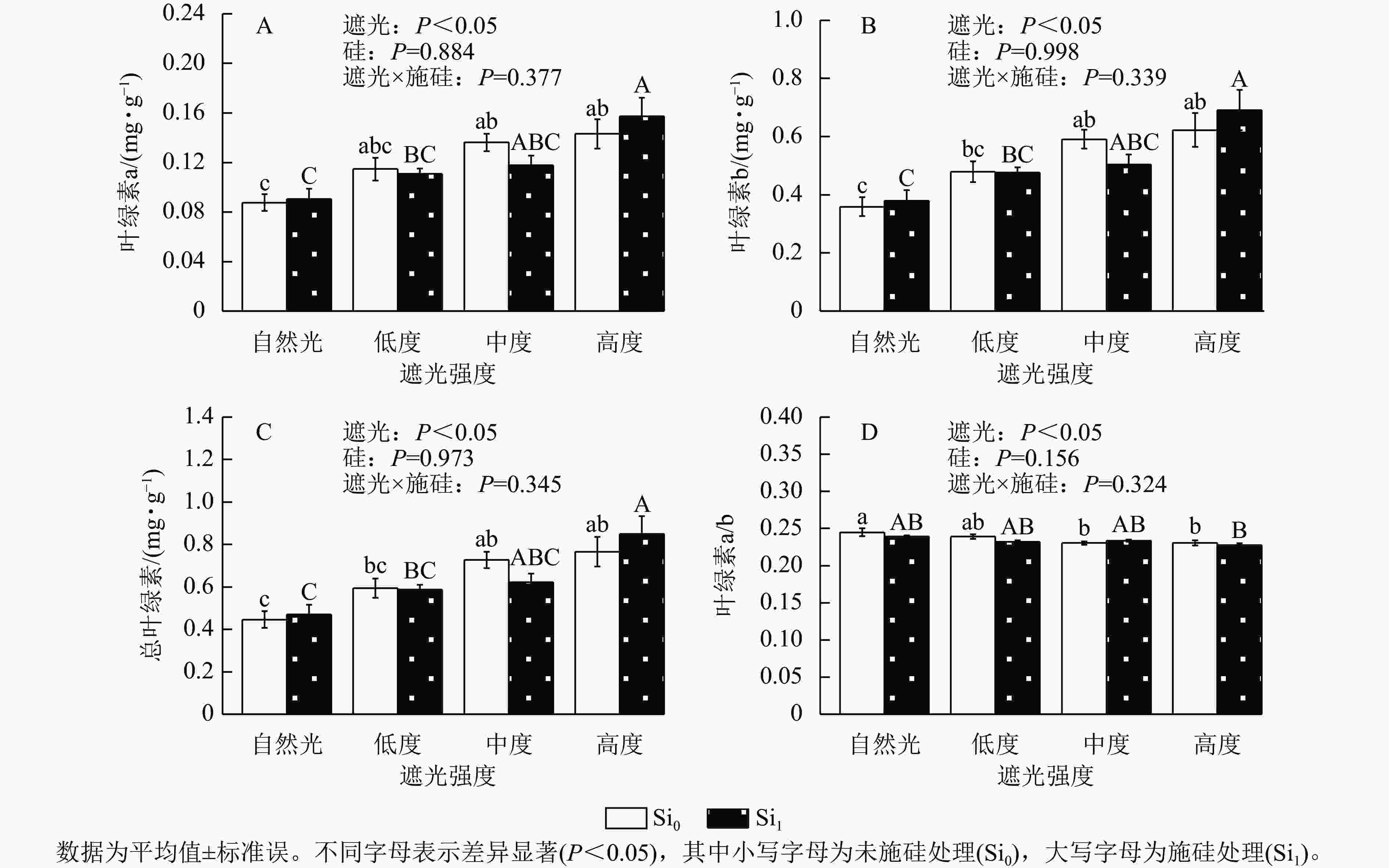
遮光处理显著诱导侧柏幼苗叶片色素积累,总叶绿素、叶绿素a及叶绿素b质量分数均随遮光强度增加而上升(P<0.05)。相较于自然光+未施硅对照处理,低度遮光+未施硅、中度遮光+未施硅、高度遮光+未施硅处理下叶绿素a对应增幅为31.04%、55.54%、63.48% (图2A),叶绿素b增幅达33.54%、64.77%、73.52% (图2B),总叶绿素分别提升33.05%、62.96%和71.55% (图2C)。与之形成对照,低度、中度、高度遮光+未施硅处理叶绿素a/b随遮光强度增加而降低,各处理较自然光+未施硅对照组分别减少2.30%、5.89%、5.81% (图2D),表明光捕获色素的组成发生适应性调整。相较于自然光+施硅对照处理,低度、中度、高度遮光+施硅处理侧柏叶绿素a、叶绿素b、总叶绿素质量分数均呈升高趋势,硅素调控对叶绿素代谢的影响具有光强依赖性。低度和高度遮光处理,未施硅处理下侧柏叶绿素a、叶绿素b、总叶绿素均高于施硅处理。在高度遮光处理下,施硅处理使总叶绿素、叶绿素a及叶绿素b质量分数较未施硅分别提升10.82%、9.85%和11.04%;在自然光及低度遮光、中度遮光处理中,硅对叶绿素积累的调节效应呈现非一致性波动。可见,遮光胁迫下,侧柏幼苗通过增加总叶绿素和叶绿素b相对占比提高适应性;只有高度遮光处理下,硅展现生理增益效应,提升叶绿素质量分数。
-
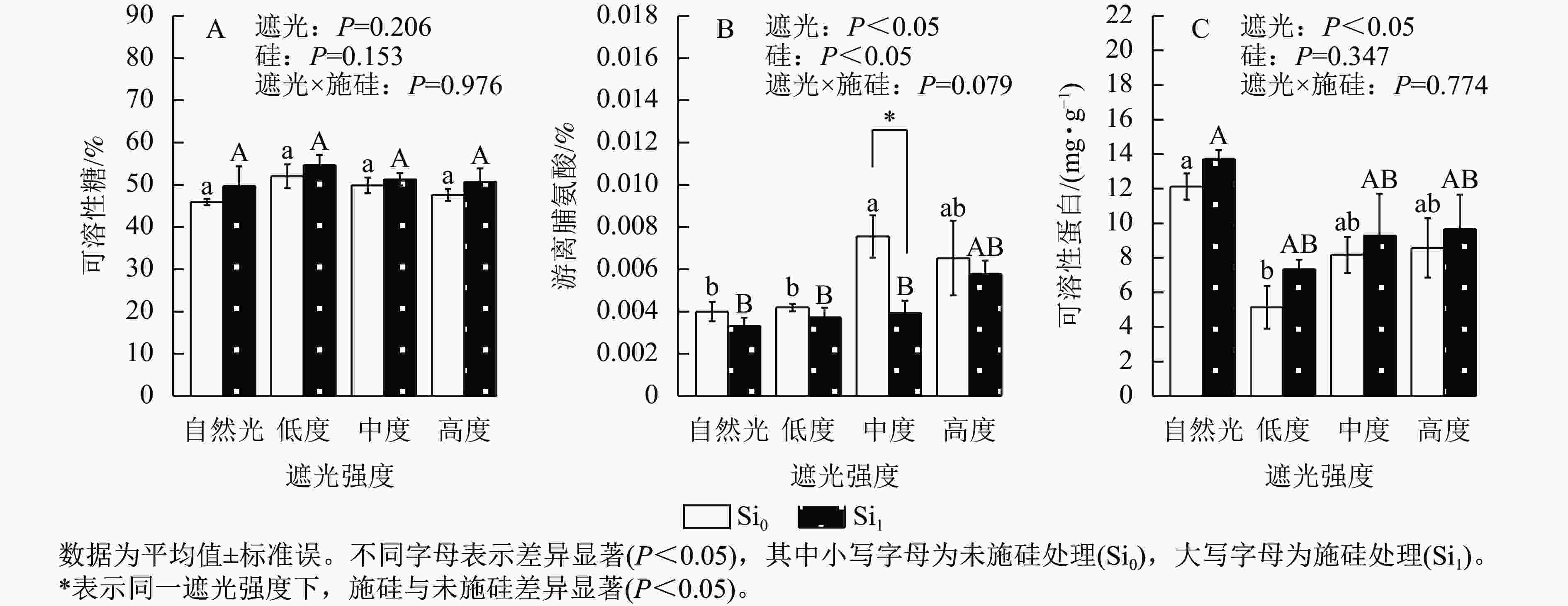
遮光强度变化诱导侧柏幼苗渗透调节物质呈现差异化积累模式。相较于自然光+未施硅对照处理,低度遮光+未施硅、中度遮光+未施硅、高度遮光+未施硅处理下可溶性糖质量分数分别提升了13.21%、8.51%、3.57% (图3A)。与自然光+未施硅对照处理相比,低度、中度、高度遮光+未施硅处理侧柏游离脯氨酸质量分数均高于对照组(图3B);低度、中度、高度遮光+未施硅处理可溶性蛋白质量分数则均低于对照组(图3C)。相较于自然光+施硅对照处理,低度、中度、高度遮光+施硅处理可溶性糖质量分数均高于对照组。与自然光+施硅对照组相比,低度、中度、高度遮光+施硅处理均提高了游离脯氨酸质量分数;低度、中度、高度遮光+施硅处理均降低了可溶性蛋白质量分数。同一遮光处理下,施硅处理下可溶性糖、可溶性蛋白质量分数均高于未施硅处理,而游离脯氨酸则相反。可溶性蛋白质量分数呈现“V”型动态变化(图3C),暗示遮光胁迫下氮代谢平衡发生重构。施硅处理明显提高了可溶性糖和可溶性蛋白质量分数,而施硅处理显著降低了游离脯氨酸质量分数(P<0.05),表明其调控途径独立于常规胁迫响应机制。可见,遮光胁迫可以改变碳氮代谢相关的渗透调节物质,而施硅优化可溶性糖和可溶性蛋白的积累。
-
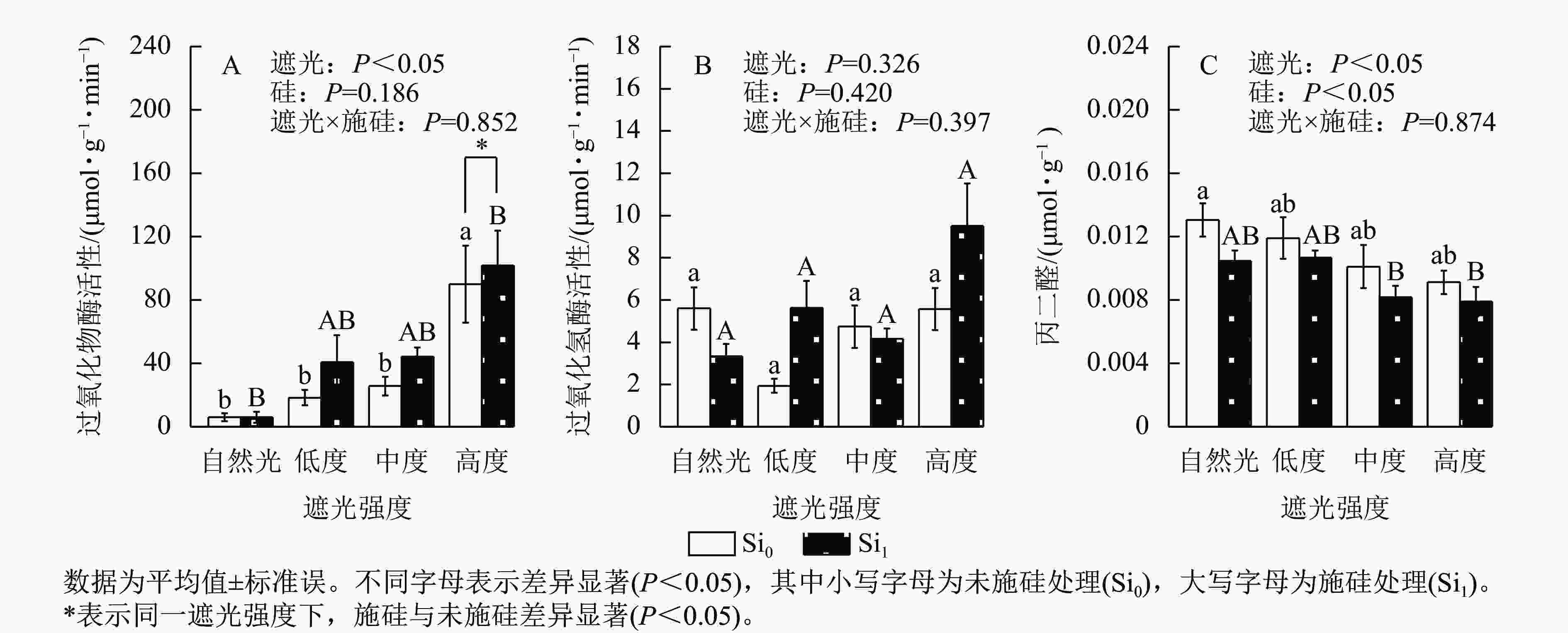
遮光强度变化显著调控侧柏叶片过氧化物酶活性(P<0.05)和丙二醛质量摩尔浓度(P<0.05)。过氧化物酶活性呈现光强依赖性响应,相较于自然光+未施硅对照处理,低度、中度、高度遮光+未施硅处理过氧化物酶活性随遮光强度增加呈线性上升趋势(图4A)。与自然光+未施硅对照处理相比,低度、中度、高度遮光+未施硅处理过氧化氢酶活性整体低于对照组(图4B)。低度、中度、高度+未施硅处理相较于自然光+未施硅对照处理丙二醛质量摩尔浓度呈下降趋势(图4C)。相较于自然光+施硅对照处理,低度、中度、高度遮光+施硅处理过氧化物酶活性、过氧化氢酶活性均高于对照组。除自然光外,同一遮光强度下,施硅处理过氧化物酶活性高于未施硅处理,施硅处理均明显诱导过氧化物酶活性升高;同一遮光强度下,施硅处理过氧化氢酶活性则呈非线性动态变化;同一遮光强度下,与未施硅处理相比,施硅处理丙二醛质量摩尔浓度均低于未施硅处理。尽管遮光处理与施硅处理过氧化氢酶均未达显著水平,但在重度遮光处理下,施硅处理的过氧化氢酶活性较未施硅处理表现出潜在激活特征。遮光与施硅处理对脂质过氧化指标丙二醛产生协同调控效应,相较于自然光对照处理,低度、中度、高度遮光处理丙二醛质量摩尔浓度降低,而硅处理进一步强化该抑制效应(P<0.05)。可见,弱光环境下侧柏通过协同激活过氧化物酶和过氧化氢酶抗氧化反应,有效缓解膜脂过氧化损伤,而高度遮光处理下,施硅引起的抗氧化适应策略更明显。
-
由表2可知:基径增长量与叶绿素a、叶绿素b、总叶绿素质量分数存在极显著负相关关系(Ρ<0.01),与叶绿素a/b存在极显著正相关关系(Ρ<0.01);基径增长量与游离脯氨酸质量分数和过氧化物酶活性呈极显著负相关关系(Ρ<0.01),与丙二醛质量摩尔浓度则呈显著正相关关系(Ρ<0.05)。侧枝增长量只与游离脯氨酸质量分数呈极显著正相关关系(Ρ<0.01),株高增长量与各生理指标的相关性都不显著。可见,遮光引起基径生长的变化与光合色素、游离脯氨酸的积累以及过氧化物酶活性等生理特性的改变密切相关,其对植物适应遮光的特征和生理有较好的生理指示意义。
表 2 侧柏幼苗生长与生理指标相关性分析
Table 2. Correlation analysis of growth and physiological indicators of P. orientalis seedlings
指标 hg Sg Li Chl a Chl b Chl a+b Chl a/b SS SP Pro CAT POD MDA hg 1 0.015 0.604** 0.034 0.044 0.042 −0.100 −0.147 0.058 0.243 0.054 −0.079 0.159 Sg 0.015 1 −0.336 −0.684** −0.698** −0.696** 0.592** 0.137 0.161 −0.496** −0.130 −0.669** 0.401* Li 0.604** −0.336 1 0.185 0.182 0.183 −0.087 −0.157 0.201 0.524** 0.162 0.050 0.065 说明:样本数量为32。hg. 株高增长量;Sg. 基径增长量;Li. 侧枝增长量;Chl a. 叶绿素a;Chl b. 叶绿素b;Chl a+b. 总叶绿素;Chl a/b. 叶绿素a/b;SS. 可溶性糖;SP. 可溶性蛋白;Pro. 游离脯氨酸;CAT. 过氧化氢酶;POD. 过氧化物酶;MDA. 丙二醛。*. 显著相关(P<0.05);**. 极显著相关(P<0.01)。 -
硅作为植物有益营养元素,可通过调控形态可塑性增强植株的逆境适应能力。本研究揭示了侧柏幼苗形态建成对硅响应的光强依赖性调控规律。在中低遮光条件下,硅处理诱导“基径增粗-顶端抑制”双相表型,即基径部次生生长显著增强,株高和侧枝的生长速率降低。这种形态调控可能与硅介导的光合产物分配和激素调节密切相关。一方面,硅可促进蔗糖向基径部的极性运输,使更多光合产物定向分配至次生生长[18];另一方面,硅能激活赤霉素(GA),抑制顶端分生组织的细胞分裂活性,可能是限制顶端生长的原因[19−20]。然而,在高度遮光处理下,施硅表现出差异调控效应,植株可能启动“生存优先”策略,通过快速构建光合器官(茎秆伸长)和同化组织(侧枝增殖)以优化光能截获[21]。高度遮光下施硅会提高侧柏的叶绿素a、叶绿素b质量分数,这有助于提高植物对光能的捕获能力,从而使其能够更好地适应弱光环境[22−23]。此外,施硅可促进植物体内形成硅化细胞,这同样有利于增强植物对光的捕获能力[24]。上述结果表明:硅处理诱导“基径增粗-顶端抑制”双相表型特征,推测硅-碳互作构成了植物应对弱光胁迫的适应策略,其调控网络的解析为植物抗逆栽培和生态修复材料筛选提供新思路。
植物通过激活抗氧化系统维持氧化还原稳态是其适应逆境的关键策略。本研究发现:施硅可提高侧柏幼苗抗氧化酶(过氧化物酶和过氧化氢酶)活性,有助于减轻活性氧对植物的伤害,进而使膜脂过氧化标志物丙二醛积累量减少,这也是植物提升抵抗逆境胁迫能力的一种体现[25]。添加外源硅增强了侧柏幼苗的抗氧化防御能力,进而提高植物的抗逆性[26]。进一步分析渗透调节物质动态发现:在高度遮光处理下,施硅处理增加可溶性糖质量分数,降低游离脯氨酸质量分数。这种差异响应与遮光诱导的碳饥饿胁迫密切相关,硅促进光合同化物向可溶性糖的转化和极性运输,优先保障碳骨架供应以维持细胞渗透平衡[27]。弱光条件下游离脯氨酸合成途径可能因能量限制而受抑制,进一步凸显碳代谢在硅介导渗透调节中的核心作用,表明硅调控显著改变渗透调节网络,通过碳氮分配策略优化细胞渗透势,建立新的生理缓冲系统,增强幼苗对光限制的适应性。
-
光照是影响植物生长和生理的重要环境因素之一。本研究发现:中低度遮光促进侧柏茎干伸长,而抑制基径增长,呈“细高”生长特征,即遮光下植物优先增加垂直生长而减少基径生长[28−29],这有利于植物提高光能获取效率[30]。叶绿素质量分数直接影响植物光的捕获和光合能力。本研究发现:随遮光强度增大,侧柏幼苗叶片叶绿素a、叶绿素b和总叶绿素质量分数均呈升高趋势,叶绿素a/b则呈下降趋势。可见,在弱光环境下侧柏幼苗通过增加叶绿素质量分数来提高对光的捕获和利用,是植物适应低光环境的生存策略[31]。叶绿素b主要吸收蓝紫光。遮光往往引起光质的改变,如导致蓝光比例增高而红光比例降低[32],因此,提高叶绿素b比例有利于弱光环境下侧柏的光能吸收和生存竞争。以上结果为理解植物表型可塑性、优化人工林管理及预测群落演替提供了重要的理论依据。
-
非生物胁迫下植物通过代谢重构实现抗逆表型可塑性,其中渗透调节是重要的原因。本研究发现:遮光强度诱导侧柏幼苗渗透调节物质差异化积累;可溶性糖与游离脯氨酸质量分数较自然光处理显著提升,可溶性蛋白呈现“V”型动态变化。这种碳氮化合物分配模式与栓皮栎Quercus variabilis等阔叶树种的线性响应特征形成显著种间差异[33],揭示裸子植物可能存在独特的遮光适应策略。一般认为,遮光抑制光合碳同化限制生长性分配,降低光呼吸消耗,促进防御性碳分配,可能是促进可溶性糖积累的重要原因[34]。游离脯氨酸因防御性次生防御代谢的加强,可能呈现动态周转[35],引起其质量分数的降低。为此,侧柏幼苗可溶性糖在渗透调节中发挥主导作用,而游离脯氨酸的渗透调节缓冲功能可能受物种特异性分配与次生代谢转化的双重调控。
逆境往往导致植物体内代谢平衡受到破坏,导致活性氧产生增多,但植物可以通过抗氧化系统清除过多的活性氧以维持细胞内氧化还原的平衡。因此,过氧化氢酶、过氧化物酶等抗氧化酶活性增强可以提高植物抗逆性[36]。随遮光强度增强,侧柏幼苗过氧化物酶活性增高,过氧化氢酶活性先降低后升高,但两者活性在重度遮光下均最高。这表明:遮光胁迫下,侧柏幼苗可以通过提高过氧化物酶和过氧化氢酶活性增强抗氧化胁迫的能力。在对辽东栎Quercus mongolica幼苗的相关研究中也发现了相似的研究结果[37]。轻度遮光下,过氧化物酶和过氧化氢酶变化不同,可能与酶对光照变化的敏感性和种间差异有关[38]。丙二醛质量摩尔浓度的高低反映逆境下植物膜系统受到的损害程度,但随遮光强度增加,侧柏幼苗丙二醛质量摩尔浓度降低,这可能源于遮光提高了侧柏幼苗过氧化物酶和过氧化氢酶活性,有利于清除体内多余活性氧,维持细胞氧化还原的平衡[39]。因此,弱光下丙二醛质量摩尔浓度降低,进一步说明侧柏对遮光存在较强的抗氧化调节能力。
-
遮光胁迫诱导侧柏幼苗产生典型的光形态建成可塑性响应,如茎干伸长生长与径向生长的拮抗特征,而外源硅重构生长分配格局可有效缓解这一矛盾,说明硅调控植物“基径增粗-顶端抑制”的多维特征。在生理层面,施硅处理增强抗氧化酶系统活性并降低膜脂过氧化损伤,还提高了可溶性糖和可溶性蛋白质量分数,由此形成了硅介导的“形态重构-生理优化”调节,提升植株的弱光生态适应能力。本研究揭示了针叶树种光-硅协同作用提升林木碳汇的可能性,为发展基于硅肥精准调控的针叶林碳汇提升技术提供理论范式,对退化林地生态修复具有重要指导价值。
Regulatory effects of exogenous silicon on morphological characteristics and physiological stress resistance of Platycladus orientalis seedlings under shading stress
-
摘要:
目的 探索侧柏Platycladus orientalis幼苗对弱光环境的适应机制,阐明外源硅对遮光胁迫的缓解效应。 方法 以3年生侧柏幼苗为材料,采用黑尼龙网覆盖,设置自然光、低度遮光、中度遮光和高度遮光的4种遮光梯度,结合0 (Si0)和2 mmol·L−1 (Si1)硅酸钠外源硅处理水平,两者随机组合为8种处理。测定不同处理侧柏幼苗生长指标以及光合色素、渗透调节和抗氧化等的生理指标,分析幼苗弱光适应特征及硅的调控效应。 结果 ①遮光处理显著抑制侧柏基径生长,抑制幅度达5.18%~40.51% (Ρ<0.05);施硅处理促进基径生长,增粗幅度达4.72%~16.67%。遮光环境可促进株高生长,但在自然光和中低度遮光条件下,施硅处理抑制株高生长。说明在一定的光强范围内施硅处理具有“基径增粗-顶端抑制”双向调控效应。②光强降低,叶绿素a和叶绿素b质量分数总体呈上升趋势,叶绿素a/b总体呈下降趋势,有利于在低光强时提升光合系统对光的捕获效率。③遮光诱导渗透调节物质动态响应(可溶性糖、游离脯氨酸质量分数先升后降,可溶性蛋白质量分数先降后升),增强抗氧化酶保护[过氧化物酶和过氧化氢酶活性升高,丙二醛质量摩尔浓度显著降低(Ρ<0.01) ];外源硅强化渗透调节和抗氧化能力,提升了可溶性糖、蛋白质质量分数及过氧化物酶活性,降低了丙二醛质量摩尔浓度。 结论 侧柏幼苗利用叶绿素合成增强光捕获能力,激活抗氧化酶防御以提高耐荫性;外源硅能不同程度地优化形态建成,并通过提高渗透调节和抗氧化特性,提升幼苗抵御弱光胁迫的能力。图4表2参39 Abstract:Objective This study aims to explore the adaptation mechanism of Platycladus orientalis seedlings to weak light environment and clarify the alleviation effect of exogenous silicon on shading stress. Method Three-year-old P. orientalis seedlings were used as materials, covered with black nylon mesh, and subjected to four shading gradients: natural light, low shading, moderate shading, and high shading. Combined with 0 (Si0) and 2 mmol·L−1 (Si1) sodium silicate exogenous silicate treatment levels, a total of eight treatments were randomly set up. Physiological indicators such as growth, photosynthetic pigments, osmotic regulation, and antioxidant physiology of seedlings under different treatments were measured, and low-light adaptation characteristics of seedlings and the regulatory effect of silicon were analyzed Result (1) Shading treatment significantly inhibited the growth of ground diameter of P. orientalis by 5.18%−40.51% (Ρ<0.05). The silicon treatment promoted the growth of ground diameter, and the thickening rate reached 4.72%−16.67%. The shading environment promoted plant height growth, but under natural light and low to moderate shading conditions, silicon application treatment inhibited plant height growth, indicating that silicon application within a certain range of light intensity exerted a dual regulatory effect of “ground diameter thickening-apical inhibition”. (2) As the light intensity decreased, the contents of chlorophyll a and b increased, while chlorophyll a/b showed a downward trend, which was beneficial to improving the capture efficiency of the photosynthetic system at week light intensity. (3) Light shading induced dynamic responses of osmotic regulatory substances. Soluble sugars and proline first increased then declined, while soluble proteins exhibited the inverse trend, which activated the antioxidant protection system such as elevating peroxidase (POD) and catalase (CAT) activities and reducing malondialdehyde (MDA) (Ρ<0.01) content. Exogenous silicon enhanced osmotic regulation and antioxidant capacity, soluble sugars (SS) and proteins (SP) contents and POD activity, while reducing the mass molar concentration of MDA. Conclusion P. orientalis seedlings enhance their light capture capacity by increasing chlorophyll synthesis and activating antioxidant enzymes to improve their shade tolerance. Exogenous silicon can optimize morphogenesis to varying degrees, and enhance the osmotic regulation and antioxidant properties, thereby improving the ability of the seedlings to resist weak light stress. [Ch, 4 fig. 2 tab. 39 ref.] -
表 1 不同遮光处理下相对光照强度
Table 1. Relative light intensity under different shading treatments
处理 光照度/lx 相对光照强度/% 处理 光照度/lx 相对光照强度/% 自然光 85.60±0.98 100.00 中度遮光 (50%遮光) 38.35±3.52 41.67~51.66 低度遮光 (30%遮光) 60.03±3.41 65.63~76.84 高度遮光 (70%遮光) 24.13±2.12 25.81~32.19 说明:光照度数值为平均值±标准差。 表 2 侧柏幼苗生长与生理指标相关性分析
Table 2. Correlation analysis of growth and physiological indicators of P. orientalis seedlings
指标 hg Sg Li Chl a Chl b Chl a+b Chl a/b SS SP Pro CAT POD MDA hg 1 0.015 0.604** 0.034 0.044 0.042 −0.100 −0.147 0.058 0.243 0.054 −0.079 0.159 Sg 0.015 1 −0.336 −0.684** −0.698** −0.696** 0.592** 0.137 0.161 −0.496** −0.130 −0.669** 0.401* Li 0.604** −0.336 1 0.185 0.182 0.183 −0.087 −0.157 0.201 0.524** 0.162 0.050 0.065 说明:样本数量为32。hg. 株高增长量;Sg. 基径增长量;Li. 侧枝增长量;Chl a. 叶绿素a;Chl b. 叶绿素b;Chl a+b. 总叶绿素;Chl a/b. 叶绿素a/b;SS. 可溶性糖;SP. 可溶性蛋白;Pro. 游离脯氨酸;CAT. 过氧化氢酶;POD. 过氧化物酶;MDA. 丙二醛。*. 显著相关(P<0.05);**. 极显著相关(P<0.01)。 -
[1] LI Wei, LIN Y J, CHEN Yinglan, et al. Woody plant cell walls: fundamentals and utilization[J]. Molecular Plant, 2024, 17(1): 112−140. DOI: 10.1016/j.molp.2023.12.008. [2] MO Lidong, ZOHNER C M, REICH P B, et al. Integrated global assessment of the natural forest carbon potential[J]. Nature, 2023, 624(7990): 92−101. DOI: 10.1038/s41586-023-06723-z. [3] PAN Yude, BIRDSEY R A, FANG Jingyun, et al. A large and persistent carbon sink in the world’s forests[J]. Science, 2011, 333(6045): 988−993. DOI: 10.1126/science.1201609. [4] 李元, 宋亮, 莫雨轩, 等. 西双版纳热带季节雨林光合有效辐射的垂直分布格局和季节动态[J]. 生态学杂志, 2022, 41(9): 1683−1690. LI Yuan, SONG Liang, MO Yuxuan, et al. Vertical distribution pattern and seasonal dynamics of photosynthetically active radiation in a tropical seasonal rain forest, Xishuangbanna[J]. Chinese Journal of Ecology, 2022, 41(9): 1683−1690. DOI: 10.13292/j.1000-4890.202207.007. LI Yuan, SONG Liang, MO Yuxuan, et al. Vertical distribution pattern and seasonal dynamics of photosynthetically active radiation in a tropical seasonal rain forest, Xishuangbanna[J]. Chinese Journal of Ecology, 2022, 41(9): 1683−1690. [5] LIU Yanjie, DAWSON W, PRATI D, et al. Does greater specific leaf area plasticity help plants to maintain a high performance when shaded?[J]. Annals of Botany, 2016, 118(7): 1329−1336. DOI: 10.1093/aob/mcw180. [6] CARRIEDO L G, MALOOF J N, BRADY S M. Molecular control of crop shade avoidance[J]. Current Opinion in Plant Biology, 2016, 30: 151−158. DOI: 10.1016/j.pbi.2016.03.005. [7] 刘佩, 邬玉芬, 王肖峰, 等. 荫蔽环境下植物生理形态及光响应机制研究进展[J]. 浙江农林大学学报, 2024, 41(6): 1313−1322. LIU Pei, WU Yufen, WANG Xiaofeng, et al. Research progress on plant physiological morphology and light response mechanism in shaded environments[J]. Journal of Zhejiang A&F University, 2024, 41(6): 1313−1322. DOI: 10.11833/j.issn.2095-0756.20240187. LIU Pei, WU Yufen, WANG Xiaofeng, et al. Research progress on plant physiological morphology and light response mechanism in shaded environments[J]. Journal of Zhejiang A&F University, 2024, 41(6): 1313−1322. [8] DUANGPAN S, TONGCHU Y, HUSSAIN T, et al. Beneficial effects of silicon fertilizer on growth and physiological responses in oil palm[J]. Agronomy, 2022, 12(2): 413. DOI: 10.3390/agronomy12020413. [9] LI Linfeng, AI Shaoying, LI Yichun, et al. Exogenous silicon mediates alleviation of cadmium stress by promoting photosynthetic activity and activities of antioxidative enzymes in rice[J]. Journal of Plant Growth Regulation, 2018, 37(2): 602−611. DOI: 10.1007/s00344-017-9758-7. [10] MEHARG C, MEHARG A A. Silicon, the silver bullet for mitigating biotic and abiotic stress, and improving grain quality, in rice?[J]. Environmental and Experimental Botany, 2015, 120: 8−17. DOI: 10.1016/j.envexpbot.2015.07.001. [11] CHRISTIAN M M, SHIMELIS H, LAING M D, et al. The effect of silicon fertilizers on agronomic performance of bread wheat under drought stress and non-stress conditions[J]. Journal of Agronomy and Crop Science, 2023, 209(6): 827−840. DOI: 10.1111/jac.12668. [12] SANTOS Da SILVA E, de MELLO PRADO R, de AQUINO VIDAL LACERDA SOARES A, et al. Response of corn seedlings (Zea mays L. ) to different concentrations of nitrogen in absence and presence of silicon[J]. Silicon, 2021, 13(3): 813−818. DOI: 10.1007/s12633-020-00480-8. [13] 李沛瑶, 李钰如, 黄海峰, 等. 不同光照强度下硅肥添加对木荷幼苗叶片性状及光合生理特性的影响[J]. 林业科学研究, 2024, 37(6): 136−145. LI Peiyao, LI Yuru, HUANG Haifeng, et al. Effects of silicon fertilizer addition on leaf traits and photosynthetic characteristics of Schima superba seedlings under different light intensities[J]. Forest Research, 2024, 37(6): 136−145. DOI: 10.12403/j.1001-1498.20230507. LI Peiyao, LI Yuru, HUANG Haifeng, et al. Effects of silicon fertilizer addition on leaf traits and photosynthetic characteristics of Schima superba seedlings under different light intensities[J]. Forest Research, 2024, 37(6): 136−145. [14] CONCEIÇÃO S S, de OLIVEIRA NETO C F, MARQUES E C, et al. Silicon modulates the activity of antioxidant enzymes and nitrogen compounds in sunflower plants under salt stress[J]. Archives of Agronomy and Soil Science, 2019, 65(9): 1237−1247. DOI: 10.1080/03650340.2018.1562272. [15] LI Youzhi, CUI Lijuan, YAO Xin, et al. Trade-off between leaf chlorophyll and betacyanins in Suaeda salsa in the Liaohe estuary wetland in Northeast China[J]. Journal of Plant Ecology, 2018, 11(4): 569−575. DOI: 10.1093/jpe/rtx025. [16] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. GAO Junfeng. Experimental Guidance for Plant Physiology[M]. Beijing: Higher Education Press, 2006. GAO Junfeng. Experimental Guidance for Plant Physiology[M]. Beijing: Higher Education Press, 2006. [17] 李小方, 张志良. 植物生理学实验指导[M]. 5版. 北京: 高等教育出版社, 2016 LI Xiaofang, ZHANG Zhiliang. Experimental Instruction of Plant Physiology[M]. 5th ed. Beijing: Higher Education Press, 2016. LI Xiaofang, ZHANG Zhiliang. Experimental Instruction of Plant Physiology[M]. 5th ed. Beijing: Higher Education Press, 2016. [18] ZHAO Daqiu, XU Cong, LUAN Yuting, et al. Silicon enhances stem strength by promoting lignin accumulation in herbaceous peony (Paeonia lactiflora Pall. )[J]. International Journal of Biological Macromolecules, 2021, 190: 769−779. DOI: 10.1016/j.ijbiomac.2021.09.016. [19] JANG S W, KIM Y, KHAN A L, et al. Exogenous short-term silicon application regulates macro-nutrients, endogenous phytohormones, and protein expression in Oryza sativa L.[J]. BMC Plant Biology, 2018, 18(1): 4. DOI: 10.1186/s12870-017-1216-y. [20] KHAN A, BILAL S, KHAN A L, et al. Silicon and gibberellins: synergistic function in harnessing ABA signaling and heat stress tolerance in date palm (Phoenix dactylifera L. )[J]. Plants, 2020, 9(5): 620. DOI: 10.3390/plants9050620. [21] HUSSAIN S, MUMTAZ M, MANZOOR S, et al. Foliar application of silicon improves growth of soybean by enhancing carbon metabolism under shading conditions[J]. Plant Physiology and Biochemistry, 2021, 159: 43−52. DOI: 10.1016/j.plaphy.2020.11.053. [22] 廖晓丽, 蔡思莹, 李沛瑶, 等. 楠木幼苗对不同光照强度及硅肥的生理响应[J]. 西北农林科技大学学报(自然科学版), 2024, 52(12): 28−38. LIAO Xiaoli, CAI Siying, LI Peiyao, et al. Physiological responses of Phoebe bournei seedlings to different light intensities and silicon fertilizer applications[J]. Journal of Northwest A&F University (Natural Science Edition), 2024, 52(12): 28−38. DOI: 10.13207/j.cnki.jnwafu.2024.12.004. LIAO Xiaoli, CAI Siying, LI Peiyao, et al. Physiological responses of Phoebe bournei seedlings to different light intensities and silicon fertilizer applications[J]. Journal of Northwest A&F University (Natural Science Edition), 2024, 52(12): 28−38. [23] 邓波, 燕李鹏, 刘桂华, 等. 遮光和施肥对桢楠苗期生长和氮素积累的影响[J]. 浙江农林大学学报, 2020, 37(3): 489−495. DENG Bo, YAN Lipeng, LIU Guihua, et al. Effects of shading and fertilization on growth and nitrogen accumulation of Phoebe zhennan seedlings[J]. Journal of Zhejiang A&F University, 2020, 37(3): 489−495. DOI: 10.11833/j.issn.2095-0756.20190399. DENG Bo, YAN Lipeng, LIU Guihua, et al. Effects of shading and fertilization on growth and nitrogen accumulation of Phoebe zhennan seedlings[J]. Journal of Zhejiang A&F University, 2020, 37(3): 489−495. [24] 朱永兴, 夏雨晨, 刘乐承, 等. 外源硅对植物抗盐性影响的研究进展[J]. 植物营养与肥料学报, 2019, 25(3): 498−509. ZHU Yongxing, XIA Yuchen, LIU Lecheng, et al. Beneficial effects of silicon on salt tolerance in plants[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(3): 498−509. DOI: 10.11674/zwyf.18094. ZHU Yongxing, XIA Yuchen, LIU Lecheng, et al. Beneficial effects of silicon on salt tolerance in plants[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(3): 498−509. [25] 汪小荣, 邱红, 张启香, 等. 雌雄香榧嫩枝扦插生根及响应干旱的生理差异[J]. 浙江农林大学学报, 2024, 41(3): 478−485. WANG Xiaorong, QIU Hong, ZHANG Qixiang, et al. Physiological differences in rooting and response to drought in shoots of female and male Torreya grandis ‘Merrillii’[J]. Journal of Zhejiang A&F University, 2024, 41(3): 478−485. DOI: 10.11833/j.issn.2095-0756.20230471. WANG Xiaorong, QIU Hong, ZHANG Qixiang, et al. Physiological differences in rooting and response to drought in shoots of female and male Torreya grandis ‘Merrillii’[J]. Journal of Zhejiang A&F University, 2024, 41(3): 478−485. [26] 吴之涛, 张英英, 高正睿, 等. 喷施硅对蒙古黄芪抗氧化酶活性以及产量和品质的影响[J]. 西北植物学报, 2022, 42(5): 837−844. WU Zhitao, ZHANG Yingying, GAO Zhengrui, et al. Effect of spraying silicon on antioxidant enzyme activity, yield and quality of Astragalus membranaceus var. mongholicus[J]. Acta Botanica Boreali-Occidentalia Sinica, 2022, 42(5): 837−844. DOI: 10.7606/j.issn.1000-4025.2022.05.0837. WU Zhitao, ZHANG Yingying, GAO Zhengrui, et al. Effect of spraying silicon on antioxidant enzyme activity, yield and quality of Astragalus membranaceus var. mongholicus[J]. Acta Botanica Boreali-Occidentalia Sinica, 2022, 42(5): 837−844. [27] RANGWALA T, BAFNA A, VYAS N, et al. Effect of soluble silica fertiliser on total sugar, protein, starch content along with amylase and cellulase activity in banana[J]. Plant Science Today, 2021, 8(2): 283−288. DOI: 10.14719/pst.2021.8.2.1032. [28] 徐飞, 郭卫华, 徐伟红, 等. 不同光环境对麻栎和刺槐幼苗生长和光合特征的影响[J]. 生态学报, 2010, 30(12): 3098−3107. XU Fei, GUO Weihua, XU Weihong, et al. Effects of light intensity on growth and photosynthesis of seedlings of Quercus acutissima and Robinia pseudoacacia[J]. Acta Ecologica Sinica, 2010, 30(12): 3098−3107. DOI: 10.20103/j.stxb.2010.12.002. XU Fei, GUO Weihua, XU Weihong, et al. Effects of light intensity on growth and photosynthesis of seedlings of Quercus acutissima and Robinia pseudoacacia[J]. Acta Ecologica Sinica, 2010, 30(12): 3098−3107. [29] 顾雪丹, 吕东, 赵祜, 等. 遮阴对红砂幼苗生长及光合特性的影响[J]. 干旱区资源与环境, 2023, 37(8): 145−152. GU Xuedan, LÜ Dong, ZHAO Hu, et al. Influence of shading on growth and photosynthetic characteristics of Reaumuria soongorica seedlings[J]. Journal of Arid Land Resources and Environment, 2023, 37(8): 145−152. DOI: 10.13448/j.cnki.jalre.2023.195. GU Xuedan, LÜ Dong, ZHAO Hu, et al. Influence of shading on growth and photosynthetic characteristics of Reaumuria soongorica seedlings[J]. Journal of Arid Land Resources and Environment, 2023, 37(8): 145−152. [30] 梁俊林, 毛绘友, 郭丽, 等. 遮阴对3种珍贵乡土阔叶树种幼苗生长及光合作用的影响[J]. 西北林学院学报, 2019, 34(4): 57−63. LIANG Junlin, MAO Huiyou, GUO Li, et al. Influence of shading on the seedling growth of three precious native tree species and photosynthesis[J]. Journal of Northwest Forestry University, 2019, 34(4): 57−63. DOI: 10.3969/j.issn.1001-7461.2019.04.08. LIANG Junlin, MAO Huiyou, GUO Li, et al. Influence of shading on the seedling growth of three precious native tree species and photosynthesis[J]. Journal of Northwest Forestry University, 2019, 34(4): 57−63. [31] 刘柿良, 马明东, 潘远智, 等. 不同光环境对桤木幼苗生长和光合特性的影响[J]. 应用生态学报, 2013, 24(2): 351−358. LIU Shiliang, MA Mingdong, PAN Yuanzhi, et al. Effects of light regime on the growth and photosynthetic characteristics of Alnus formosana and A. cremastogyne seedlings[J]. Chinese Journal of Applied Ecology, 2013, 24(2): 351−358. LIU Shiliang, MA Mingdong, PAN Yuanzhi, et al. Effects of light regime on the growth and photosynthetic characteristics of Alnus formosana and A. cremastogyne seedlings[J]. Chinese Journal of Applied Ecology, 2013, 24(2): 351−358. [32] MORELLI L, PAULIŠIĆ S, QIN Wenting, et al. Light signals generated by vegetation shade facilitate acclimation to low light in shade-avoider plants[J]. Plant Physiology, 2021, 186(4): 2137−2151. DOI: 10.1093/plphys/kiab206. [33] 薛旭鹏, 尤海舟, 吴一晗, 等. 遮阴对栓皮栎幼苗的生长生理及叶片解剖结构的影响[J]. 东北林业大学学报, 2022, 50(8): 15−21. XUE Xupeng, YOU Haizhou, WU Yihan, et al. Effect of shading on the growth physiology and leaf anatomical structure of Quercus variabilis seedlings[J]. Journal of Northeast Forestry University, 2022, 50(8): 15−21. DOI: 10.13759/j.cnki.dlxb.2022.08.004. XUE Xupeng, YOU Haizhou, WU Yihan, et al. Effect of shading on the growth physiology and leaf anatomical structure of Quercus variabilis seedlings[J]. Journal of Northeast Forestry University, 2022, 50(8): 15−21. [34] WU Wenyuan, CHEN Long, LIANG Rentao, et al. The role of light in regulating plant growth, development and sugar metabolism: a review[J]. Frontiers in Plant Science, 2025, 15: 1507628. DOI: 10.3389/fpls.2024.1507628. [35] 李楠, 李贺鹏, 江波, 等. 短枝木麻黄幼苗对低温胁迫的生理响应[J]. 浙江农林大学学报, 2019, 36(4): 678−686. LI Nan, LI Hepeng, JIANG Bo, et al. Physiological response to low temperature stress in Casuarina equisetifolia seedlings[J]. Journal of Zhejiang A&F University, 2019, 36(4): 678−686. DOI: 10.11833/j.issn.2095-0756.2019.04.007. LI Nan, LI Hepeng, JIANG Bo, et al. Physiological response to low temperature stress in Casuarina equisetifolia seedlings[J]. Journal of Zhejiang A&F University, 2019, 36(4): 678−686. [36] 范苏鲁, 苑兆和, 冯立娟, 等. 干旱胁迫对大丽花生理生化指标的影响[J]. 应用生态学报, 2011, 22(3): 651−657. FAN Sulu, YUAN Zhaohe, FENG Lijuan, et al. Effects of drought stress on physiological and biochemical parameters of Dahlia pinnata[J]. Chinese Journal of Applied Ecology, 2011, 22(3): 651−657. DOI: 10.13287/j.1001-9332.2011.0130. FAN Sulu, YUAN Zhaohe, FENG Lijuan, et al. Effects of drought stress on physiological and biochemical parameters of Dahlia pinnata[J]. Chinese Journal of Applied Ecology, 2011, 22(3): 651−657. [37] 张兰, 王静, 张金峰, 等. 辽东栎幼苗生长和生理特性对光照强度的响应[J]. 中南林业科技大学学报, 2021, 41(11): 73−81. ZHANG Lan, WANG Jing, ZHANG Jinfeng, et al. Responses of growth and physiological characteristics of Quercus wutaishanica seedlings to the light intensity[J]. Journal of Central South University of Forestry & Technology, 2021, 41(11): 73−81. DOI: 10.14067/j.cnki.1673-923x.2021.11.009. ZHANG Lan, WANG Jing, ZHANG Jinfeng, et al. Responses of growth and physiological characteristics of Quercus wutaishanica seedlings to the light intensity[J]. Journal of Central South University of Forestry & Technology, 2021, 41(11): 73−81. [38] RAZA M A, FENG Lingyang, IQBAL N, et al. Effects of contrasting shade treatments on the carbon production and antioxidant activities of soybean plants[J]. Functional Plant Biology, 2020, 47(4): 342−354. DOI: 10.1071/FP19213. [39] 张玲, 张东来. 遮荫条件下黄檗生长和生理响应的性别差异研究[J]. 植物研究, 2020, 40(5): 735−742. ZHANG Ling, ZHANG Donglai. Gender differences in growth and physiological respond of Phellodendron amurense Rupr. in condition of overshadow[J]. Bulletin of Botanical Research, 2020, 40(5): 735−742. DOI: 10.7525/j.issn.1673-5102.2020.05.012. ZHANG Ling, ZHANG Donglai. Gender differences in growth and physiological respond of Phellodendron amurense Rupr. in condition of overshadow[J]. Bulletin of Botanical Research, 2020, 40(5): 735−742. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250246






 下载:
下载: