-
凤丹Paeonia ostii是中国著名的观赏兼油用、药用牡丹,也是观赏牡丹嫁接的优良砧木,在牡丹种苗产业化生产中具有重要地位[1]。凤丹在传统育苗中主要为露地播种繁殖,种子萌发时间长,萌发率较低[2]。凤丹种子存在双休眠特性[3],新鲜成熟种子需要经过一段时间的后熟作用,解除下胚轴休眠才能萌发生根,生根后还需解除上胚轴休眠才长成正常成苗。前人研究表明:低浓度的赤霉素(GA3)比吲哚乙酸(IAA)和6-苄氨基腺嘌呤(6-BA)更适合诱导凤丹种子萌发,凤丹种子萌发率随GA3浓度的升高而下降[4]。栽培牡丹种子生根前,各种物理或化学处理都未能打破上胚轴休眠,只有在种子根长至3 cm时,用赤霉素或低温处理才能有效解除其上胚轴休眠[5]。但有研究表明:GA3处理的种子从开始萌芽到出齐苗所需时间长达82 d,而低温处理的种子出齐苗所需时间仅有46 d左右[6]。因此,本研究将重点探讨低温处理和GA3处理对凤丹种子萌发的影响,寻找促进其萌发的最佳处理方法。穴盘育苗作为现代种苗繁殖方式,可以实现规模化、机械化生产,同时能有效地保护根系,提高出苗率[7]。本试验采用穴盘育苗的方式,用不同方法处理凤丹种子,探索促进凤丹种子萌发的有效方法,期望为牡丹种苗产业化生产提供参考。
-
种子采自河南栾川。采种时间为2013年9月13日,千粒重471.64 g,实验开始时间为2013年10月21日。50目林木穴盘,规格为25 cm×48 cm×10 cm,穴孔口径为4.5 mm。基质:进口草炭、珍珠岩。
-
清水浸种1 h后,取出饱满下沉的种子,用体积分数为0.1%的甲醛消毒30 min后,作以下处理:100 mg·L-1GA3,200 mg·L-1GA3,300 mg·L-1GA3溶液分别浸种24 h。100粒·处理-1,3次重复。对照组清水浸种24 h。
将处理后的种子播进穴盘,覆基质1.5~2.0 cm,穴盘内基质为草炭:珍珠岩(1:1),将穴盘分别置于10,15,20℃的人工气候箱内,保持穴盘内基质湿度基本一致,隔7 d观察1次,记录生根时间。100 d后计算生根率和根长大于5 cm的种子比例。
生根率=(生根种子数/种子总数量)×100%。根长大于5 cm的种子比例=(根长大于5 cm的种子数量/种子总数量)×100%。
-
将穴盘内主根长1~5 cm的种子和主根长>5 cm的种子分别于4℃中处理30 d,取出后在20℃温室内进行发芽实验,50粒·处理-1,3次重复。隔3 d观察种子萌发情况,记录种子萌发时间,60 d后统计萌发率。种子萌发以上胚轴伸出1 cm时为标准。萌发时间为种子从温室取出到萌发时的时间。萌发率=(萌发种子数/冷藏种子总数量)×100%。萌发时间和萌发率用DPS 9.50进行ANOVA方差分析。
-
将生根后根长>5 cm的种子于4℃中分别处理15,30,45,52 d后取出,移入温室。温室温度为20℃。50粒·处理-1,3次重复。记录种子萌发时间,60 d后统计萌发率。
萌发率=(萌发种子数/冷藏种子总数量)×100%。试验数据用DPS 9.50进行ANOVA方差分析。
-
分别测量根长>5 cm的生根种子的下胚轴最膨大处直径和侧根数量,之后将其于4℃中分别处理30,45,52 d,记录种子萌发的时间,观察前5粒和最后5粒萌发种子下胚轴最膨大处直径和侧根数量对发芽时间的影响。用Excel计算下胚轴最膨大处直径和侧根数量的相关性。50粒·处理-1,3次重复。
相关系数取绝对值后,0~0.09为没有相关性,0.1~0.3为弱相关,0.3~0.5为中等相关,0.5~1.0为强相关。用DPS 9.50进行ANOVA方差分析。
-
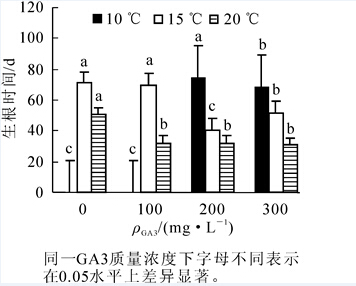
图 1可知,10℃条件下,对照及100 mg·L-1 GA3处理种子均不发芽,在200 mg·L-1或300 mg·L-1质量浓度GA3处理下发芽时间也较长,达到70 d以上。在15℃培养条件下,随着GA3质量浓度增加发芽时间缩短;在4种质量浓度GA3处理下,20℃培养箱内发芽时间均较短,但差异不显著。结果显示:20℃和300 mg·L-1综合处理下,生根时间最短,在30 d左右即可开始生根。
不同处理对凤丹种子生根率的影响见图 2。相同温度条件下,种子生根率随GA3质量浓度升高而升高。10℃条件下,对照及100 mg·L-1 GA3处理的种子未生根;200 mg·L-1和300 mg·L-1 GA3处理下,生根率也均低于10%。15℃条件下,200 mg·L-1GA3处理生根率最高,较300 mg·L-1 GA3处理差异显著(P<0.05),但均低于20℃处理。20℃条件下,300 mg·L-1 GA3处理种子生根率最高,达到92%。
同一处理条件下,一般认为根长越长生根质量越好[8]。播种100 d后统计主根长>5 cm的幼苗比例,结果如图 3。10℃条件下,不同质量浓度GA3处理,主根长>5 cm的幼苗均较少或没有。15℃和20℃条件下,随着GA3质量浓度升高,主根长>5 cm的幼苗比例均呈增长趋势。15℃条件下,200 mg·L-1 GA3质量浓度处理的主根长>5 cm的幼苗数量最多,优良植株比例占68%。20℃条件下,300 mg·L-1 GA3处理,主根长>5 cm的种子比例在92%以上,生根质量最好。

图 3 不同处理下主根长>5 cm的种子比例
Figure 3. Proportion of seeds with 5 cm longer main root under different treatments
综上可知,为了缩短凤丹种子萌发时间,提高种子萌发率和发芽质量,可以用20℃和300 mg·L-1 GA3同时诱导凤丹种子的萌发。
-
HAO等[8]将根长1.5,3.0,4.5,6.0 cm的种子分别进行低温处理,结果表明:只有根长为6.0 cm的种子会萌发,低温处理只能打破根长为6.0 cm的种子的休眠。景新明等[5]认为只有根长大于3 cm的种子经过低温处理后才能萌发。林松明等[6]在打破凤丹种子上胚轴休眠的研究中将根长4 cm作为判断标准。本研究发现,当穴盘透气不良时,根长小于5 cm的种子易腐烂,根长大于5 cm的种子极少有腐烂现象。综合以上因素,本研究选择根长大于5 cm的生根种子作为低温打破上胚轴休眠的试验材料。
第24天时根长大于5 cm的种子上胚轴开始萌发,根长小于5 cm的种子第39天时开始萌发,差异显著(P<0.05)。至60 d时,根长大于5 cm的种子萌发率达到80.67%,而根长小于5 cm的种子萌发率仅为32.17%,差异显著(P<0.05)。故需低温处理打破生根凤丹种子上胚轴休眠时,选择根长>5 cm者效果最佳。
表 1 不同根长对生根凤丹种子萌发的影响
Table 1. Effect of different root length on rooted Paeonia ostii
根长/cm 萌发时间/d 萌发率/% ≤5 38.67±1.53 a 32.17 ± 1.26 b >5 23.67±1.53 b 80.67 ±2.57 a -
由图 4可知:生根凤丹种子随低温处理时间的增加,萌发所需的时间缩短,处理45 d时所需萌发时间最短,为9 d,此后随着低温处理时间的增加,所需萌发时间增加,但种子萌发率呈上升趋势。处理52 d后萌发率最高,达到84%,但耗时过长,且与低温处理30 d的萌发率差异不大,故以低温处理30 d较好。

图 4 不同低温处理时间对生根凤丹种子发芽的影响
Figure 4. Effect of different cold treatments on seed germination of rooted Paeonia ostii
低温处理45 d的生根种子需要9 d开始萌发,共耗时54 d,低温处理30 d的生根种子24 d后开始萌发,同样共耗时54 d,2种处理下萌发率差异不大,从生产角度考虑,30 d为适宜的低温处理时间。
-
生根种子下胚轴最膨大处直径和侧根数量与种子萌发存在一定相关性,统计结果见表 2和表 3。
表 2 相关系数统计
Table 2. Statistic table of correlation coefficients
最膨大处直径 侧根数量 萌发时间 最膨大处直径 1 侧根数量 0.40 ± 0.13 1 萌发时间 -0.63 ± 0.02 -0.70 ± 0.01 1 表 3 下胚轴最膨大处直径及侧根数量对生根凤丹种子发芽的影响
Table 3. Eifect of the largest-hypocotyl diameter and lateral root-number on germination of rooted Paeonia ostii
萌发顺序 处理30d 处理45d 处理52d 直径/mm 侧根数量/根 萌发时间/d 直径/mm 侧根数量/根 萌发时间/d 直径/mm 侧根数量/根 萌发时间/d 1 3.23±0.02 5.00±0.00 24.00±1.00 a 3.48±0.02 18.33±0.58 9.00±1.00 a 2.59±0.02 10.00±0.00 15.00 ± 1.00 a 2 3.03±0.03 14.33±0.58 24.33±1.53 a 3.5±0.05 17.00±2.00 9.33±0.58 a 3.34±1.20 11.00±1.00 15.33±0.58 a 3 2.98±0.01 12.00±1.00 27.33±0.58 a 3.5±0.10 11.00±2.00 12.33±0.58 a 3.16±0.05 5.33±0.58 15.33±1.53 a 4 2.41±0.04 13.33±0.58 27.00±1.00 a 3.05±0.08 6.33±1.53 11.67±0.58 a 3.34±0.01 11.33±0.58 18.00±0.00 a 5 2.89±0.03 10.33±1.53 27.33±0.58 a 2.86±0.02 15.33±1.53 12.33±1.53 a 2.9±0.03 8.67±0.58 18.33±0.58 a 46 2.50±0.10 6.00±1.00 51.33±1.53 b 2.74±0.03 7.00±0.00 30.00±0.00 b 2.71±0.11 8.67±1.53 32.67±0.58 b 47 2.91±0.09 6.00±2.00 51.33±0.58 b 2.90±0.02 8.33±0.58 30.33±0.58 b 2.57±0.09 6.00±1.00 32.67±0.58 b 48 2.73±0.20 9.00±3.00 54.00±1.00 b 1.84±0.35 3.33±1.53 32.67±0.58 b 2.67±0.56 5.33±1.53 33.33±0.58 b 49 2.67±0.12 6.00±.002 54.33±1.53 b 2.49±0.10 1.33±0.58 33.33±1.53 b 2.85±0.02 8.00±0.00 36.00±1.00 b 50 2.53±0.05 5.00±1.00 57.00±2.00 b 2.56±0.15 6.33±1.53 36.00±2.00 b 2.82±0.04 2.00±0.00 39.00±2.00 b 表 2显示,最膨大处直径和侧根数量相关系数为0.40,相关性不显著;最膨大处直径和萌发时间的相关系数绝对值为0.63,呈显著负相关;侧根数量和萌发时间的相关系数绝对值为0.70,呈显著负相关。因此,下胚轴最膨大处直径对侧根数量影响较小,随着下胚轴最膨大处直径的增加,所需萌发时间缩短,随着侧根数量增加,所需萌发时间缩短。
表 3显示,同一处理天数下,如30 d,优先萌发的5粒生根种子下胚轴最膨大处直径达到3.0 mm或侧根数量大于10根,自24 d即开始萌发,而最后5粒种子则在51 d后萌发,它们下胚轴最膨大处直径<3.0 mm且侧根数量小于10根,萌发所需时间明显长于前者。45和52 d处理的生根种子同样有此规律。故初步认定,生根种子下胚轴膨大至3.0 mm或侧根数量大于10根时,可以优先萌发。
-
本研究发现,以20℃结合300 mg·L-1GA3处理穴盘内的凤丹种子,生根率最高,生根时间最短。这与刘心民[9]在15℃下处理同样穴盘内凤丹种子生根率最高的结论不一致;4℃处理30 d后可有效打破凤丹种子上胚轴休眠,处理时间越长萌发率越高,出苗整齐度也随之增加。这与张玉刚等[10]的报道基本一致,与郑相穆等[3]认为的凤丹种子低温(5℃)春化阶段所需的临界时间是60 d的研究不一致。但4℃处理时间过长会导致萌发时间延迟。低温打破凤丹种子上胚轴休眠的原理,可能是因为在低温春化期种子的内含物质发生了变化。周仁超等[11]推断紫斑牡丹Paeonia rockii种子萌发需要一定的营养支持,但其胚乳主要为脂类物质,不易水溶,难被胚吸收,低温后某些脂类物质发生了变化,成为易被胚吸收的物质,从而促进了种子的萌发。GA3处理亦能打破凤丹种子上胚轴休眠。林松明等[6]发现:300 mg·kg-1 GA3处理的凤丹种子萌发较快,只需31 d,这低于本实验从低温处理到萌发的54 d,但GA3处理的种子幼苗初期生长势强,生长迅速,且生长速度很快减慢,生长势变弱,而低温处理的种子幼苗萌发后一直保持较强的生长势头,且抗病能力强,从生产优质种苗的角度考虑,合适的低温处理时间是打破凤丹上胚轴休眠的最好方法。
主根长>5 cm时打破上胚轴所需时间短,萌发率高,与景新明等[12]认为根长>3 cm时才能打破休眠基本一致,但本实验发现生根的凤丹种子在根长>5 cm时萌发率更高。林松明[13]的研究表明,根长达到4 cm时,胚的后熟已经完成,并生长到足以感受低温信号的体积,根长6~7 cm时胚中可溶性糖的含量急剧降低,上胚轴不再需要大量营养。这一结果验证了本实验将根长>5 cm作为判断标准的可靠性。其中主根长>5 cm且下胚轴最膨大处直径>3.0 mm,或侧根数量达到10根或以上均可优先萌发。因此凤丹种子穴盘育苗中,20℃结合300 mg·L-1GA3处理,30 d左右即可生根,40 d后多数生根种子主根长>5 cm,低温处理30 d后,下胚轴最膨大处直径>3.0 mm或侧根数量达到10根的生根种子移入温室5 d后即可萌发。
采用容器育苗,可以促进凤丹根系的发育,有利于地上部的生长。Durgea等[14]认为,容器苗是所有苗型中最优良的苗型,也是成本最低的育苗体制。实验过程中发现,长时间不生根的种子在穴盘中容易腐烂,特别是根长<5 cm的生根种子,低温处理移入温室后腐烂率较高,穴盘的透气性、基质含水量过高等原因可能导致这一状况的发生。完善穴盘的透气透水性,加强基质水分管理是将来实验需要改进的地方。
Seed germination of Paeonia ostii with GA3 and temperature treatments
-
摘要: 为研究不同处理对凤丹Paeonia ostii种子萌发的影响,采用穴盘育苗的方法,研究不同质量浓度赤霉素(GA3,0,100,200,300 mg·L-1)结合不同温度(10,15,20℃)的处理对凤丹种子生根的影响,不同主根长(根长1~5 cm,根长>5 cm)对生根种子萌发的影响,不同低温处理时间(15,30,45,52 d)对已生根种子萌发的影响以及下胚轴最膨大处直径和侧根数量对根长>5 cm种子萌发的影响。结果表明:20℃结合300 mg·L-1 赤霉素(GA3)处理,最有利于凤丹种子生根;对已生根种子4℃低温处理52 d后萌发率最高,达到84%,但耗时过长,且与低温处理30 d的萌发率差异不大,故30 d的低温处理是打破已生根凤丹种子上胚轴休眠的最佳方法;当穴盘透气不良时,根长小于5 cm的种子易腐烂,根长大于5 cm的种子极少有腐烂现象,且根长大于5 cm的种子移入温室60 d时,萌发率达到80%,远高于根长<5 cm的种子萌发率;在同一处理条件下,生根种子下胚轴最膨大处直径大于3.0 mm或侧根数量大于10根时,上胚轴可优先萌发。图4表3参14Abstract: To determine the effects on seed germination and rooting rate of Paeonia ostii, gibberellic acid (GA3) (concentrations of 100, 200, and 300 mg·L-1) and temperature (10, 15, and 20℃) treatments were applied to P. ostii seeds in plugs. The effects on germination of rooted seeds was tested for length of the main root (1-5 cm and more than 5 cm) and low temperature treatment times (15, 30, 45, and 52 d). The relationships for hypocotyl diameter at its greatest point, total lateral roots of rooted seeds, and germination time were studied. Results showed that 20℃ combined with 300 mg·L-1-GA3 was significantly different from other treatments for root development of P. ostii(P < 0.05). Seed took root after 30 d, and the seed rooting rate reached 92% after 100 d. Also, the proportion of seed whose root length was more than 5 cm reached 92%, and 4℃ for 30 d was the best treatment to release epicotyl dormancy with rooted seeds. Low temperature treatment for 52 d had the highest germination rate (84%), whereas low temperature treatment for 30 d had a similar germination rate(81%). The main root with a length of more than 5 cm broke epicotyl dormancy effectively with a high germination rate of 80.7% and low rotten seed rate. For the same treatment, epicotyls germinated first if the rooted seed hypocotyl diameter at the greatest point was more than 3.0 mm or if the total for lateral roots was more than 10. However, the hypocotyl diameter at the greatest point had little impact on lateral roots(correlation coefficient is 0.4). As the hypocotyl diameter at its greatest point increased and as the lateral root number increased, germination time shortened from 51 d to 24 d.[Ch, 4 fig. 3 tab. 14 ref.]
-
Key words:
- horticulture /
- Paeonia ostii seeds /
- GA3 /
- cold treatment /
- epicotyl dormancy
-
表 1 不同根长对生根凤丹种子萌发的影响
Table 1. Effect of different root length on rooted Paeonia ostii
根长/cm 萌发时间/d 萌发率/% ≤5 38.67±1.53 a 32.17 ± 1.26 b >5 23.67±1.53 b 80.67 ±2.57 a 表 2 相关系数统计
Table 2. Statistic table of correlation coefficients
最膨大处直径 侧根数量 萌发时间 最膨大处直径 1 侧根数量 0.40 ± 0.13 1 萌发时间 -0.63 ± 0.02 -0.70 ± 0.01 1 表 3 下胚轴最膨大处直径及侧根数量对生根凤丹种子发芽的影响
Table 3. Eifect of the largest-hypocotyl diameter and lateral root-number on germination of rooted Paeonia ostii
萌发顺序 处理30d 处理45d 处理52d 直径/mm 侧根数量/根 萌发时间/d 直径/mm 侧根数量/根 萌发时间/d 直径/mm 侧根数量/根 萌发时间/d 1 3.23±0.02 5.00±0.00 24.00±1.00 a 3.48±0.02 18.33±0.58 9.00±1.00 a 2.59±0.02 10.00±0.00 15.00 ± 1.00 a 2 3.03±0.03 14.33±0.58 24.33±1.53 a 3.5±0.05 17.00±2.00 9.33±0.58 a 3.34±1.20 11.00±1.00 15.33±0.58 a 3 2.98±0.01 12.00±1.00 27.33±0.58 a 3.5±0.10 11.00±2.00 12.33±0.58 a 3.16±0.05 5.33±0.58 15.33±1.53 a 4 2.41±0.04 13.33±0.58 27.00±1.00 a 3.05±0.08 6.33±1.53 11.67±0.58 a 3.34±0.01 11.33±0.58 18.00±0.00 a 5 2.89±0.03 10.33±1.53 27.33±0.58 a 2.86±0.02 15.33±1.53 12.33±1.53 a 2.9±0.03 8.67±0.58 18.33±0.58 a 46 2.50±0.10 6.00±1.00 51.33±1.53 b 2.74±0.03 7.00±0.00 30.00±0.00 b 2.71±0.11 8.67±1.53 32.67±0.58 b 47 2.91±0.09 6.00±2.00 51.33±0.58 b 2.90±0.02 8.33±0.58 30.33±0.58 b 2.57±0.09 6.00±1.00 32.67±0.58 b 48 2.73±0.20 9.00±3.00 54.00±1.00 b 1.84±0.35 3.33±1.53 32.67±0.58 b 2.67±0.56 5.33±1.53 33.33±0.58 b 49 2.67±0.12 6.00±.002 54.33±1.53 b 2.49±0.10 1.33±0.58 33.33±1.53 b 2.85±0.02 8.00±0.00 36.00±1.00 b 50 2.53±0.05 5.00±1.00 57.00±2.00 b 2.56±0.15 6.33±1.53 36.00±2.00 b 2.82±0.04 2.00±0.00 39.00±2.00 b -
[1] 钱仙云. 温度与GA3解除凤丹种子休眠的生理代谢变化及对其幼苗质量的影响[D]. 南京: 南京农业大学, 2009. QIAN Xianyun. Physiological Mechanism of Breaking Seed Dormancy and Effect of Seedling Quality on Paeonia ostii by Different Tempreture and Gibberellic Acid [D]. Nanjing: Nanjing Agricultural University, 2009. [2] 成仿云,杜秀娟. 低温与GA3处理对'凤丹'牡丹种子萌发和幼苗生长的影响[J]. 园艺学报, 2008, 35(4): 553-558. CHENG Fangyun, DU Xiujuan. Effect of chilling and gibberellic acid on the seed germination and seedling growth in Paeonia ostii 'Feng Dan'[J]. Acta Hortic Sin, 2008, 35(4): 553-558. [3] 郑相穆, 周阮宝, 谷丽萍, 等. 凤丹种子的休眠和萌发特性[J]. 植物生理学通讯, 1995, 31(4): 260-262. ZHENG Xiangmu, ZHOU Ruanbao, GU Liping, et al. The properties of dormancy and germination of Paeonia suffruticosa [J]. Plant Physiol Commun, 1995, 31(4): 260-262. [4] 覃逸明, 黄雨清, 王千, 等. 不同处理对凤丹种子萌发的影响[J]. 中国种业, 2009(1): 38-40. QIN Yiming, HUANG Yuqing, WANG Qian, et al. The effects of different treatments on seed germination of 'Feng Dan'[J]. China Seed Ind, 2009(1): 38-40. [5] 高水平, 刘涛, 刘改秀, 等. GA3对牡丹种子发芽及幼苗生长的影响[J]. 种子, 2009, 28(4): 49- 50, 53. GAO Shuiping, LIU Tao, LIU Gaixiu, et al. The effect of GA3 on seed germination and seedling growth of Paeonia suffruticosa [J]. Seed, 2009, 28(4): 49-50, 53. [6] 林松明, 徐迎春, 蔡志仁, 等. 打破凤丹种子上胚轴休眠的研究[J]. 江苏农业科学, 2006(1): 84-86. LIN Songming, XU Yingchun, CAI Zhiren, et al. Study on breaking seed epicotyl dormancy of Peonia ostii 'Feng Dan'[J]. Jiangsu Agric Sci, 2006(1): 84-86. [7] 葛红英, 江胜德. 穴盘种苗生产[M]. 北京: 中国林业出版社, 2003. [8] HAO Haiping, HE Zhi, LI Hui, et al. Effect of root length on epicotyl dormancy release in seeds of Paeonia ludlowii, Tibetan peony [J]. Ann Bot, 2013, 113(3): 443-452. [9] 刘心民. 牡丹种子穴盘育苗试验研究[D]. 北京: 北京林业大学,2006. LIU Xinmin. Pilot Study on Cultivating Plug Seedlings of Tree Peony Seeds [D]. Beijing: Beijing Forestry University, 2006. [10] 张玉刚, 郭绍霞, 王莲英. 牡丹容器育苗的初步研究[J]. 中国农学通报, 2004, 20(1): 182-184. ZHANG Yugang, GUO Shaoxia, WANG Lianying. Preliminary study of culturing treepeony containerized seedlings[J]. Chin Agric Sci Bull, 2004, 20(1): 182-184. [11] 周仁超, 姚崇怀, 潘俊, 等. 紫斑牡丹种子休眠和萌发特性初步研究[J]. 湖北农业科学, 2002(1): 59-60. ZHOU Renchao, YAO Chonghuai, PAN Jun, et al. Studies on charaeteristics of dormancy and germination of Paeonia rockii [J]. Hubei Agric Sci, 2002(1): 59-60. [12] 景新明, 郑光华, 洪德元. 栽培牡丹的种子萌发和储藏特性[J]. 植物生理学通讯, 1995, 31(4): 268-270. JING Xinming, ZHENG Guanghua, HONG Deyuan. Characteristic of germination and storage of seed in cultural Paeonia suffruticosa [J]. Plant Physiol Commun, 1995, 31(4): 268-270. [13] 林松明. 激素与低温处理对凤丹种子萌发及幼苗生长的影响[D]. 南京: 南京农业大学, 2007. LIN Songming. Effect of Different Hormone and Moist-chilling on Seed Germination and Seedling Growth of Fengdan[D]. Nanjing: Nanjing Agricultural University, 2007. [14] DURYEA M L, LANDIS T D. Forest Nursery Manual: Production of Mareroot Seedling [M]. Hingham: Kluwer Boston Inc., 1984: 165-181. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2016.03.024







 下载:
下载: