-
类胡萝卜素是广泛分布于自然界的一类色素,迄今已发现了近800种[1],主要存在于植物的叶、花、果实和根等器官中,在吸引昆虫、鸟类传播花粉和种子中发挥作用[2]。类胡萝卜素可作为多种生物活性物质的前体,经过氧合酶或非酶裂解作用可以形成阿朴类胡萝卜素[3],后者及其衍生物可生成β-紫罗兰酮(β-ionone)等香气物质及脱落酸(abscisic acid,ABA)等植物生长调节剂[4]。作为类胡萝卜素裂解氧合酶(carotenoid cleavage oxygenases,CCO)中的重要成员,类胡萝卜素裂解双加氧酶1(carotenoid cleavage dixoygenase 1,CCD1)在不同的植物中所裂解的底物、作用位点不尽相同。研究发现[5],CCD1在C9~C10(C9′~C10′)位时剪切番茄红素、胡萝卜素、玉米黄质或脱辅基类胡萝卜素等,形成β-紫罗兰酮,β-环柠檬醛(β-cyclocitral),香叶基丙酮(geranylacetone)和假紫罗兰酮(pseudoionone)等芳香类物质;在番茄红素C5~C6(C5′~C6′)位裂解时则形成6-甲基-5-庚烯-2-酮[6],认为CCD1对基于类胡萝卜素代谢途径的香气物质合成发挥着重要作用。桂花Osmanthus fragrans在中国栽培历史悠久,集绿化、美化和香化为一体,花香和花色是其重要观赏性状。类胡萝卜素裂解双加氧酶1(OfCCD1)[7]降解桂花中的着色物质——α-胡萝卜素和β-胡萝卜素[8],合成主要香气物质α-紫罗酮和β-紫罗酮[9]。基因启动子控制着基因在特定的组织[10]、特定的发育阶段[11]以及一定的环境条件下表达[12];分离相关基因启动子,分析其序列及其作用元件,并研究其功能,可明确该基因的调控因子及其作用机制。本研究利用染色体步移技术克隆了OfCCD1启动子,通过启动子序列分析、载体构建和瞬时表达分析,初步明确了其功能,为揭示OfCCD1基因调控花色花香代谢机制奠定基础。
-
供试材料为6~8年生地栽丹桂品种‘堰虹桂’‘Yanhong Gui’,栽植于浙江农林大学桂花资源圃。
-
Taq聚合酶、限制酶(DraⅠ,EcoRⅤ,PvuⅡ,StuⅠ),质粒载体PMD18-T,大肠埃希菌Escherichia coli DH5α,胶回收试剂盒,DNA片段纯化试剂盒和无缝连接试剂盒均购自Takara公司(大连)。
-
参照十六烷基三甲基溴化铵法(CTAB)提取‘堰虹桂’基因组DNA[13]。
-
根据‘堰虹桂’转录组数据库中的CCD1序列(GenBank登录号MG138152)[14]和BALDERMANN等发表的OfCCD1(GenBank登录号AB526197.1)序列[9],用Primer Primer 5.0设计下游特异性引物1(GSP1),特异性引物2(GSP2)和特异性引物4(GSP4);利用上述2段序列的重复序列设计特异性引物3(GSP3);利用接头引物1(AP1)与GSP1,接头引物2(AP2)与GSP2经2轮聚合酶链式反应(PCR)获得的启动子片段设计特异性引物5(GSP5)。利用pBI121质粒上的β-葡萄糖苷酸酶(β-Glucosidase,GUS)基因序列设计上游引物GUS-F和下游引物GUS-R。引物及接头均由上海生工合成(表 1)。
表 1 OfCCD1启动子克隆所用引物
Table 1. Primer sequences used in the cloning of OfCCD1 promoters
引物名 称序列(5'→3') GSP1 CTTCACAAACAGCCATTCCAACCAGTCTAT GSP2 TCGGGCTTTACTGCCACCACACCATTTTC GSP3 GAGGAGGAGTCTCATCAACTGGAGCAAAAT GSP4 GCATCATTTTCACAAACAGCCATTCCAAC GSP5 AGCCTCAAGTTTTGTCCTATTGCCAC AP1 GTAATACGACTCACTATAGGGC AP2 ACTATAGGGCACGCGTGGT GWA GTAATACGACTCACTATAGGGCACGCGTGGTCGACGGCCCGGGCTGGT CCD1P-L-F TGATTACGCCAAGCTAAAGGAAGAGTATTCACTTTTGGC CCD1P-L-R CCGGGGATCCTCTAGCTGTTGATCCTAATTGAACTCTCAC CCD1P-S-F TGATTACGCCAAGCTGAAGCACATGTCTCCCA CCD1P-S-R CCGGGGATCCTCTAGCTCTTGGTTCTGAATTGA GUS-F TGATTACGCCAAGCTGATCAGTTCGCCGATGCAG GUS-R CCGGGGATCCTCTAGAAGTGCGCTTGCTG -
① DNA文库的构建。分别用Dra Ⅰ,EcoR Ⅴ,Pvu Ⅱ,Stu Ⅰ 4种限制性内切酶对提取到的DNA进行酶切。酶切体系为基因组DNA 25.0 μL(100 mg·L-1),限制内切酶8.0 μL,10×限制酶buffer 10.0 μL,灭菌水57.0 μL,总体积100.0 μL,37 ℃过夜。取5.0 μl酶切产物用质量分数0.6%琼脂糖进行检测。按照DNA纯化试剂盒的说明书对酶切产物进行纯化后加接头。分别取4组酶切纯化的DNA各4.8 μL,染色体步移接头GWA 1.9 μL,10×连接缓冲液0.8 μL,T4 DNA连接酶0.5 μL,16.0 ℃过夜;70.0 ℃水浴5 min,加入32.0 μL去离子水。②聚合酶链式反应(PCR)扩增。取AP1,引物GSP1/GSP3,模板各1.0 μL,预混合Taq酶10.0 μL,去离子水补至20.0 μL进行第1轮PCR。扩增程序为94.0 ℃ 5 min;94.0 ℃ 25 s,72.0 ℃ 3 min,7循环;94.0 ℃ 25 s,65.0 ℃ 3 min,32循环;67.0 ℃ 7 min。取第1轮产物1.0 μL并稀释50倍作为第2轮PCR的模板。第2轮PCR体系为:AP2,GSP2/GSP4/GSP5,模板各1.0 μL,预混合Taq酶10.0 μL,去离子水补至20.0 μL。扩增程序为94.0 ℃ 5 min;94.0 ℃ 25 s,72.0 ℃ 3 min,5循环;94.0 ℃ 25 s,65.0 ℃ 3 min,20循环;67.0 ℃ 7 min。取GUS-F,GUS-R和pBI121质粒各1.0 μL,预混合Taq酶10.0 μL,去离子水补至20.0 μL进行GUS序列扩增。扩增程序为95.0 ℃ 5 min;95.0 ℃ 30 s,69.8 ℃ 30 s,72.0 ℃ 1 min,35循环;72.0 ℃ 10 min;4.0 ℃ 10 min。质量分数为1.2%的琼脂糖凝胶电泳检测。
-
切胶回收按照MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(TaKaRa,大连)的说明书进行。载体连接按照PMD18-T载体说明书(Takara,大连)进行,连接后的重组质粒导人大肠埃希菌DH5α感受态细胞中,在50 mg·L-1氨苄青霉素的固体LB培养基上进行蓝白斑筛选,挑取白色单菌落菌液PCR检测后将阳性克隆送公司测序。序列初步分析采用DNAMAN软件进行。启动子序列作用元件分析采用在线网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行。
-
根据获得的OfCCD1的启动子序列,利用Takara(http://www.clontech.com)无缝连接引物设计软件设计3对无缝连接引物CCD1P-S-F和CCD1P-S-R,CCD1P-L-F和CCD1P-L-R,GUS-F和GUS-R。具体操作步骤按照Takara无缝连接试剂盒的说明书进行。将重组好的表达载体利用冻融法转入农杆菌Agrobacterium tumefaciens GV3101感受态。随后将烟草Nicotiana tabacum叶片剪切成0.5 cm × 0.5 cm的叶块,在农杆菌菌液吸光度D(600)为0.6的侵染液中浸染10 min;无菌滤纸吸干叶片表面的菌液,将侵染的外植体移至于无菌水浸润的滤纸上培养24 h并进行GUS染色,37 ℃下保温16~24 h。V(乙酸):V(乙醇)=3:1的混合液脱色后取出,对染色结果进行拍照。
-
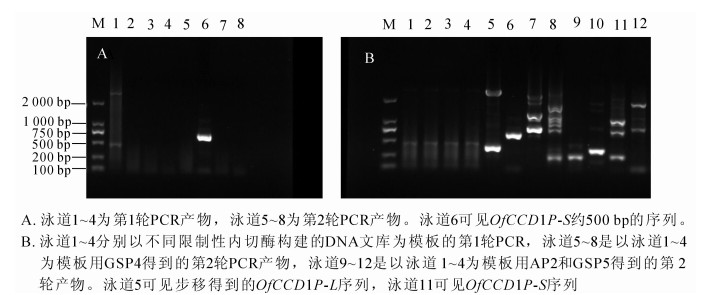
以‘堰虹桂’DNA为模板,分别利用引物GSP1和GSP2,接头引物AP1和AP2进行2轮PCR,在EcoR文库扩增得到条带;经比对和拼接得到长度为511 bp的序列(图 1A)。利用引物GSP3和GSP4,接头引物AP1和AP2经过2轮PCR,在DraⅠ文库中得到约2 000 bp的条带(图 1B)。测序后,经比对和拼接得到长度为2 747 bp的条带,命名为OfCCD1P-L(图 2)。利用GSP3和GSP5经过2轮PCR后在Pvu Ⅱ文库中得到750 bp左右的条带(图 1B),经过拼接比对得到OfCCD1上游981 bp的启动子序列,命名为OfCCD1P-S(图 3)。
-
利用PlantCARE网站对启动子序列进行序列分析发现,OfCCD1P-L有TATA-box和CAAT-box等基本作用元件,同时有7个响应元件,响应茉莉酸甲酯、赤霉素、水杨酸、乙烯的元件,以及热激元件,鸟类成髓细胞性白血病病毒癌基因同源物(MYB)结合位点,并有4个响应脱落酸(ABA)的核心序列ACGT(表 2)。OfCCD1P-S中含有TATA-box和CAAT-box等基本作用元件,同时有3个光响应元件,1个热激响应元件以及1个ABA响应元件(表 3),并有4个ABA响应元件(ABRE)核心序列ACGT。
表 2 OfCCD1P-L中顺式作用元件
Table 2. Cis-acting elements in OfCCD1P-L
顺式作用元件名称 位置 序列(5′→3′) 功能 G-Box -326, -664, -2 584 CACGTA 光响应元件 GA-motif -257, -2 738 AAAGATGA 光响应元件的一部分 ATCT-motif -2 564 AATCTAATCT 参与光响应的部分保守DNA序列 Box I -429, -l 649 TTTCAAA 光响应元件 AE-box -737 AGAAACAT 光响应元件的一部分 Box 4 -733 ATTAAT 参与光响应的部分保守DNA序列 GAG-motif -300 AGAGATG 光响应元件的一部分 CAAT-box -ll5, -569 CAAT 一般元件 CAT-box -l 839 GCCACT 与分生组织相关的顺式元件 CGTCA-motif -2 580 CGTCA 茉莉酸甲酯响应元件 TGACG-motif -486 TGACG 茉莉酸甲酯响应元件 HSE -2 066 AAAAAATTTC 热激响应元件 LTR -l 4ll CCGAAA 低温响应元件 MBS -96l, -l 256 TAACTG MYB结合位点 P-box -2 002 CCTTTTG 赤霉素响应元件 Skn-l_motif -968, -l 3l0, -l 544, -2 33l GTCAT 胚乳中表达的必备元件 TATA-box -268, -356, -879, -894, -909 TATA 一般元件 TC-rich repeats -l l49, -2 5l9 ATTTTCATCA 参与防御和胁迫的元件 TCA-element -42l, -l 340 TCAGAAGAGGA 水杨酸响应元件 GCN4_motif -402 TGTGTCA 胚乳中表达的必备元件 ERE -428 ATTTCAAA 乙烯响应元件 GCN4_motif -402 TGTGTCA 胚乳中表达的必备元件 表 3 OfCCD1P-S中顺式作用元件
Table 3. Cis-acting elements in OfCCD1P-S
顺式作用元件名称 位置 序列(5'→3') 功能 3-AF1 binding site -911 AAGAGATATTT 光响应元件 GATA-motif -102 AAGATAAGATT 光响应元件的一部分 ACE -316 ACGTGGA 光响应元件 AAGAA-motif -443 GAAAGAA ABRE -324 ACGT 脱落酸响应元件 CAAT-box -12, -267, -530, -547, -566, -659, -723 CAAT(T) 一般元件 HSE -901 AAAAAATTTC 热激响应元件 Skn-1_motif -278, -503 GTCAT 在胚乳中表达所必须的元件 TATA-box -54, -158, -472, -623 TAATA/TATA 基本元件 TC-rich repeats -673 ATTTTCTTCA 参与防御和胁迫的元件 -
将克隆得到的启动子和GUS片段分别与pBI121质粒进行重组(图 4),以含GUS::GUS表达载体的菌株为阴性对照(ck1),以含pBI 121载体菌株为阳性对照(ck2),对构建的OfCCD1P-L::GUS和OfCCD1P-S::GUS表达载体进行瞬时表达分析(图 5)。从图 5可以看出,阴性对照没有着色,阳性对照着色范围和程度最好,OfCCD1P-L::GUS表达载体和OfCCD1P-S::GUS表达载体均有着色,但着色都比阳性对照要弱。
-
桂花OfCCD1基因有2个拷贝[14]。在启动子克隆过程中,第1次步移并未得到足够长的序列。目前,已报道的OfCCD1序列有2个:ZHANG等[14]发现的CCD1序列(GenBank登录号MG138152)和BALDERMANN发表的OfCCD1序列(GenBank登录号AB526197.1)[9]。本研究利用上述2个序列的重复序列设计了引物GSP3,并在GSP3 5′上游设计了GSP4,利用已获得的部分OfCCD1启动子序列设计了引物GSP5,分别步移从而获得了OfCCD1P-S和OfCCD1P-L的启动子序列。其中OfCCD1P-L长度为2 747 bp,OfCCD1P-S长度为981 bp。原因是OfCCD1启动子区域的2个拷贝所含酶切位点不同,构建文库时OfCCD1P-L启动子区域被内切酶截断的区域短,步移得到的启动子就较长;而OfCCD1P-S启动子区域大部分被截断,所得的启动子序列就较短。类似地,已报道的CCD家族其他成员的启动子长度也有差异,如拟南芥Arabidopsis thaliana的AtCCD7[10]和AtNCED2[15],花生Arachis hypogaea的AhNCED1[16]启动子都有2 000 bp左右,而菊花Chrysanthemum morifolium的CmCCD4a-5[17]和桂花的OfCCD4[18]启动子则分别为1 094 bp和1 337 bp。上述文献中进行启动子克隆所用方法不尽相同,这也是造成获得启动子长度不一的因素。
本研究所获得的2个OfCCD1启动子所含元件种类是具有一致性的,都含有光响应元件、热激响应元件和ABA响应元件,其中较多的是光响应元件。在桂花中,OfCCD1的表达受光照影响[9],证实了OfCCD1启动子中的光响应元件的存在。同一个亚家族的其他成员,如CCD4[19]和CCD2[20]的启动子中也发现了光响应元件。这表明光响应元件在CCD家族的启动子中可能是普遍存在的。不过功能上可能有差异,因为在藏红花Crocus sativus中,CsCCD2的表达是受光抑制的[20]。
此外,克隆得到的2个启动子中含有4个ACGT序列[21]。ACGT是启动子中一个重要的顺式作用元件,该序列可以响应水杨酸(salicylic acid,SA),紫外线,ABA和茉莉酸(jasmonic acid,JA)[22]的处理。有研究表明:响应ABA至少需要2个ACGT序列,且2个ACGT之间的碱基数不同,响应的激素种类也不同。MEHROTRA等[23]的研究发现:当2个ACGT序列之间的距离是5 bp时,这段序列响应SA的处理;当距离是25 bp时,该序列响应ABA处理。在碱蓬Suaeda salsa[24]和大豆Glycine max[25]中ABA处理会使CCD1的表达量升高,因此,桂花中OfCCD1的表达极有可能响应ABA的诱导,具体的响应机制还需要进一步研究。
Cloning and transient expression assay of OfCCD1 gene promoters from Osmanthus fragrans
-
摘要: 类胡萝卜素裂解双加氧酶(CCDs)参与植物中多种类胡萝卜素的代谢,在桂花Osmanthus fragrans中类胡萝卜素裂解双加氧酶基因1(OfCCD1)对花香物质的合成具有重要作用。根据前期获得的桂花‘堰虹桂’O.fragrans ‘Yanhong Gui’转录组数据库中OfCCD1的序列和前人已发表的OfCCD1序列设计引物,利用染色体步移技术从桂花基因组DNA中扩增获得OfCCD1基因2个拷贝的启动子序列OfCCD1P-L和OfCCD1P-S,其长度分别为2 747 bp和981 bp。2个启动子序列中均含有参与光响应的元件,热激响应元件(HSE),脱落酸(ABA)响应元件(ABRE)和乙烯响应元件;此外,2个启动子中均含有4个ACGT序列。将2个启动子序列分别替代pBI121上的35 S启动子,将构建的载体通过农杆菌Agrobacterium tumefaciens介导转化烟草Nicotiana tabacum叶片进行瞬时表达,发现2个启动子都具有驱动GUS报告基因表达的功能。Abstract: Charge-coupled devices(CCDs) are involved in the degradation and biosynthesis pathways of carotenoid metabolism, and in Osmanthus fragrans, OfCCD1 plays an important role in the biosynthesis of scent compounds. In this study, primers were designed based on the transcriptome database of O. fragrans 'Yanhong Gui' and another reported OfCCD1 gene sequence. Two promoter sequences of OfCCD1, named OfCCD1P-L and OfCCD1P-S, were cloned by genome walking. Results showed that the two promoter sequences in length were 981 bp for OfCCD1P-L and 2 747 bp for OfCCD1P-S. Also, the light responsive element, heat stress element, abscisic acid (ABA) responsive element, and ethylene responsive element were found in the two promoter sequences which including four sequences:ACGT Adenine (A), cytosine (C), guanine (G), and thymine (T). The 35 S promoter in pBI121 was replaced by OfCCD1P-L and OfCCD1P-S. Afterward, the new vectors were transformed into Nicotiana tabacum leaves by Agrobacterium tumefaciens. The transient expression showed that the two cloned promoters could drive the expression of downstream reporter genes.
-
Key words:
- forest tree breeding /
- Osmanthus fragrans /
- carotenoid /
- CCD /
- promoter /
- transient expression analysis
-
表 1 OfCCD1启动子克隆所用引物
Table 1. Primer sequences used in the cloning of OfCCD1 promoters
引物名 称序列(5'→3') GSP1 CTTCACAAACAGCCATTCCAACCAGTCTAT GSP2 TCGGGCTTTACTGCCACCACACCATTTTC GSP3 GAGGAGGAGTCTCATCAACTGGAGCAAAAT GSP4 GCATCATTTTCACAAACAGCCATTCCAAC GSP5 AGCCTCAAGTTTTGTCCTATTGCCAC AP1 GTAATACGACTCACTATAGGGC AP2 ACTATAGGGCACGCGTGGT GWA GTAATACGACTCACTATAGGGCACGCGTGGTCGACGGCCCGGGCTGGT CCD1P-L-F TGATTACGCCAAGCTAAAGGAAGAGTATTCACTTTTGGC CCD1P-L-R CCGGGGATCCTCTAGCTGTTGATCCTAATTGAACTCTCAC CCD1P-S-F TGATTACGCCAAGCTGAAGCACATGTCTCCCA CCD1P-S-R CCGGGGATCCTCTAGCTCTTGGTTCTGAATTGA GUS-F TGATTACGCCAAGCTGATCAGTTCGCCGATGCAG GUS-R CCGGGGATCCTCTAGAAGTGCGCTTGCTG 表 2 OfCCD1P-L中顺式作用元件
Table 2. Cis-acting elements in OfCCD1P-L
顺式作用元件名称 位置 序列(5′→3′) 功能 G-Box -326, -664, -2 584 CACGTA 光响应元件 GA-motif -257, -2 738 AAAGATGA 光响应元件的一部分 ATCT-motif -2 564 AATCTAATCT 参与光响应的部分保守DNA序列 Box I -429, -l 649 TTTCAAA 光响应元件 AE-box -737 AGAAACAT 光响应元件的一部分 Box 4 -733 ATTAAT 参与光响应的部分保守DNA序列 GAG-motif -300 AGAGATG 光响应元件的一部分 CAAT-box -ll5, -569 CAAT 一般元件 CAT-box -l 839 GCCACT 与分生组织相关的顺式元件 CGTCA-motif -2 580 CGTCA 茉莉酸甲酯响应元件 TGACG-motif -486 TGACG 茉莉酸甲酯响应元件 HSE -2 066 AAAAAATTTC 热激响应元件 LTR -l 4ll CCGAAA 低温响应元件 MBS -96l, -l 256 TAACTG MYB结合位点 P-box -2 002 CCTTTTG 赤霉素响应元件 Skn-l_motif -968, -l 3l0, -l 544, -2 33l GTCAT 胚乳中表达的必备元件 TATA-box -268, -356, -879, -894, -909 TATA 一般元件 TC-rich repeats -l l49, -2 5l9 ATTTTCATCA 参与防御和胁迫的元件 TCA-element -42l, -l 340 TCAGAAGAGGA 水杨酸响应元件 GCN4_motif -402 TGTGTCA 胚乳中表达的必备元件 ERE -428 ATTTCAAA 乙烯响应元件 GCN4_motif -402 TGTGTCA 胚乳中表达的必备元件 表 3 OfCCD1P-S中顺式作用元件
Table 3. Cis-acting elements in OfCCD1P-S
顺式作用元件名称 位置 序列(5'→3') 功能 3-AF1 binding site -911 AAGAGATATTT 光响应元件 GATA-motif -102 AAGATAAGATT 光响应元件的一部分 ACE -316 ACGTGGA 光响应元件 AAGAA-motif -443 GAAAGAA ABRE -324 ACGT 脱落酸响应元件 CAAT-box -12, -267, -530, -547, -566, -659, -723 CAAT(T) 一般元件 HSE -901 AAAAAATTTC 热激响应元件 Skn-1_motif -278, -503 GTCAT 在胚乳中表达所必须的元件 TATA-box -54, -158, -472, -623 TAATA/TATA 基本元件 TC-rich repeats -673 ATTTTCTTCA 参与防御和胁迫的元件 -
[1] JOHNSON J D. Do carotenoids serve as transmembrane radical channels?[J]. Free Rad Biol Med, 2009, 47(3):321-323. [2] CAZZONELLI C I, POGSON B J. Source to sink:regulation of carotenoid biosynthesis in plants[J]. Trends Plant Sci, 2010, 15(5):266-274. [3] HOU Xin, RIVERS J, LEÓN P, et al. Synthesis and function of apocarotenoid signals in plants[J]. Trends Plant Sci, 2016, 21(9):792-803. [4] WALTER M H, FLOSS D S, STRACK D. Apocarotenoids:hormones, mycorrhizal metabolites and aroma volatiles[J]. Planta, 2010, 232(1):1-17. [5] SIMKIN A J, SCHWARTZ S H, AULDRIDGE M, et al. The tomato carotenoid cleavage dioxygenase 1 genes contribute to the formation of the flavor volatiles β-ionone, pseudoionone, and geranylacetone[J]. Plant J Cell Mol Biol, 2004, 40(6):882-892. [6] ILG A, BEYER P, ALBABILI S. Characterization of the rice carotenoid cleavage dioxygenase 1 reveals a novel route for geranial biosynthesis[J]. Febs J, 2009, 276(3):736-747. [7] BALDERMANN S, KATO M, FLEISCHMANN P, et al. Biosynthesis of α-and β-ionone, prominent scent compounds, in flowers of Osmanthus fragrans[J]. Acta Biochim Pol, 2012, 59(1):79-81. [8] HAN Yuanji, WANG Xiaohui, CHEN Weicai, et al. Differential expression of carotenoid-related genes determines diversified carotenoid coloration in flower petal of Osmanthus fragrans[J]. Tree Genet Genomes, 2014, 10(2):329-338. [9] BALDERMANN S, KATO M, KUROSAWA M, et al. Functional characterization of a carotenoid cleavage dioxygenase 1 and its relation to the carotenoid accumulation and volatile emission during the floral development of Osmanthus fragrans Lour.[J]. J Exp Bot, 2010, 61(11):2967-2977. [10] LIANG Yingshi, JEON Y A, LIM S H, et al. Vascular-specific activity of the Arabidopsis carotenoid cleavage dioxygenase 7 gene promoter[J]. Plant Cell Rep, 2011, 30(6):973-980. [11] ZHENG Xiongjie, XIE Zongzhou, ZHU Kaijie, et al. Isolation and characterization of carotenoid cleavage dioxygenase 4 genes from different citrus species[J]. Mol Genet Genomics, 2015, 290(4):1589-1603. [12] RUBIO-MORAGA A, RAMBLA J L, FERNÁNDEZ-de-CARMEN A, et al. New target carotenoids for CCD4 enzymes are revealed with the characterization of a novel stress-induced carotenoid cleavage dioxygenase gene from Crocus sativus[J]. Plant Mol Biol, 2014, 86(4/5):555-569. [13] 徐沂春, 胡绍庆, 赵宏波.基于AFLP分子标记的不同类型野生桂花种群遗传结构分析[J].浙江农林大学学报, 2014, 31(2):217-223. XU Yichun, HU Shaoqing, ZHAO Hongbo. Genetic structure of different natural Osmanthus fragrans populations based on AFLP method[J]. J Zhejiang A&F Univ, 2014, 31(2):217-223. [14] ZHANG Chao, WANG Yiguang, FU Jianxin, et al. Transcriptomic analysis and carotenogenic gene expression related to petal coloration in Osmanthus fragrans 'Yanhong Gui'[J]. Trees, 2016, 30(4):1207-1223. [15] 万小荣, 莫爱琼, 潘家辉, 等.拟南芥AtNCED2基因启动子区域序列克隆及其活性分析[J].生物技术, 2010, 20(6):18-23. WAN Xiaorong, MO Aiqiong, PAN Jiahui, et al. Molecular cloning and GUS-aided activity analysis of promoter region sequence of AtNCED2 gene from Arabidopsis thaliana L.[J]. Biotechnology, 2010, 20(6):18-23. [16] 万小荣, 莫爱琼, 刘帅, 等.粤油7号花生AhNCED1基因启动子克隆及其活性分析[J].核农学报, 2011, 25(4):692-699. WAN Xiaorong, MO Aiqiong, LIU Shuai, et al. Molecular cloning and GUS-aided activity analying of promoter sequence of AhNCED2 gene from Arachis hypogaea L. cv.Yueyou 7[J]. J Nucl Agri Sci, 2011, 25(4):692-699. [17] IMAI A, TAKAHASHI S, NAKAYAMA K, et al. The promoter of the carotenoid cleavage dioxygenase 4a-5 gene of Chrysanthemum morifolium (CmCCD4a-5) drives petal-specific transcription of a conjugated gene in the developing flower[J]. J Plant Physiol, 2013, 170(14):1295-1299. [18] 韩远记. 桂花花色变异的机理和不同花色品种花瓣的cDNA-AFLP差异分析[D]. 开封: 河南大学, 2014. HAN Yuanji. Mechanism of Flower Color Variation and cDNA-AFLP Analysis of 2 Cultivers with Different Flower Color in Osmanthus fragrans[D]. Kaifeng: Henan University, 2014. [19] AHRAZEM O, TRAPERO A, GÓMEZ M D, et al. Genomic analysis and gene structure of the plant carotenoid dioxygenase 4 family:a deeper study in Crocus sativus and its allies[J]. Genomics, 2010, 96(4):239-250. [20] AHRAZEM O, RUBIO-MORAGA A, ARGANDOÑA-PICAZO J, et al. Intron retention and rhythmic diel pattern regulation of carotenoid cleavage dioxygenase 2 during crocetin biosynthesis in saffron[J]. Plant Mol Biol, 2016, 91(3):355-374. [21] CHOI H I, HONG J H, HA J O, et al. ABFs, a family of ABA-responsive element binding factors[J]. J Biol Chem, 2000, 275(3):1723-1730. [22] BHALOTHIA P, SANGWAN C, ALOK A, et al. PP2C-like promoter and its deletion variants are induced by aba but not by MeJA and SA in Arabidopsis thaliana[J]. Front Plant Sci, 2016, 7(14):547. doi:10.3389/fpls.2016.00547. [23] MEHROTRA R, MEHROTRA S. Promoter activation by ACGT in response to salicylic and abscisic acids is differentially regulated by the spacing between two copies of the motif[J]. J Plant Physiol, 2010, 167(14):1214-1218. [24] CAO Yongrong, GUO Xiaoli, ZHANG Quan, et al. Isolation and characterization of carotenoid cleavage dioxygenase gene in halophyte Suaeda salsa[J]. Plant Growth Regul, 2005, 46(1):61-67. [25] WANG Ruikai, WANG Chune, FEI Yunyan, et al. Genome-wide identification and transcription analysis of soybean carotenoid oxygenase genes during abiotic stress treatments[J]. Mol Biol Rep, 2013, 40(8):4737-4745. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2018.04.003







 下载:
下载: