-
《全国土壤污染调查公报》显示:中国近1/5的土壤(面积约0.1亿 hm2)受重金属不同程度的污染,其中铅、镉为主要污染元素,以工矿区企业周围和南方耕地较为突出。土壤重金属污染不仅损害植物生长,造成作物减产和粮食重金属含量超标,而且威胁生态环境安全[1]。长期重金属污染破坏土壤养分转化和能量流动平衡,抑制土壤动物和微生物的生长和繁衍,危及正常的土壤生态过程和生态服务功能[2]。与非污染土壤相比,矿区附近污染土壤的微生物生物量明显较低,存在显著的重金属胁迫作用[3]。重金属胁迫作用一方面使得微生物的细胞代谢功能降低,从而导致微生物的底物利用效率降低;另一方面改变了微生物多样性和数量,从而抑制微生物的养分转化功能。因此,高效修复重金属污染土壤,提升土壤生物功能,对保障粮食安全和耕地可持续发展具有重要意义。
生物质炭由生物质废弃物经厌氧热解产生,其较好的土壤改良作用和较强的重金属固定能力,已被学者们广泛关注。生物质炭不仅具有高度孔隙结构、巨大的比表面积、碱性,可使土壤有机碳、pH和通气性大幅度增加[4],而且其表面含有丰富的含氧官能团(如羧基、酚基、羰基、羟基、醌类物质等)和较高的阳离子交换量,可以吸附、固定和降低重金属迁移率和有效性[5-6]。生物质炭对土壤重金属的修复效果与制备材料、热解温度、添加比例以及土壤性质等密切相关[7]。YU等[8]研究表明:以草本植物为原材料的生物质炭,相较于木本植物制备的生物质炭,具有较高的灰分含量和较低的有机碳含量。此外,生物质炭进入土壤显著改变了土壤环境,对土壤微生物数量和活性也有广泛影响[5]。JONES等[9]报道:生物质炭输入提高了土壤微生物生物量,可能与其孔隙结构所提供的天敌庇护和土壤养分吸附能力有关。生物质炭可通过改变微生物生物量来影响土壤酶活性,间接影响土壤微生物的代谢能力[10]。目前,施用生物质炭对土壤重金属迁移性和生物有效性、作物的重金属累积特征以及缓解植物的重金属胁迫等方面已有广泛报道[1, 11]。然而,不同原料制备的生物质炭对重金属有效性的影响存在差异[11],其对缓解微生物活性的胁迫效应尚不清楚。山核桃Carya cathayensis蒲壳作为山核桃主产区的主要废弃物之一,其制备成生物质炭后对重金属污染土壤的修复效果是否与竹材、秸秆等常规原料制备的生物质炭具有可比性也值得进一步研究。
为此,本研究采集了长期受铅镉污染的农田土壤,以竹材边角料、山核桃蒲壳和玉米Zea mays秸秆为原料制备了3种生物质炭,通过盆栽试验分析了生物质炭添加对土壤性质、铅镉有效性、土壤微生物丰度和活性的影响,为长期铅镉污染土壤微生物功能恢复和生态修复提供科学参考。
-
土壤样品采集自江苏省宜兴市宜丰镇(31°24′N,119°41′E)。该地区属亚热带季风气候,年平均气温为15.7 ℃,年平均降水量为1 177.0 mm。研究区土壤类型为太湖地区第四纪湖积物发育的典型脱潜型水稻土-乌泥土。采样区重金属污染农田位于20世纪60年代末发展起来的金属冶炼和加工产业区的下风向约500 m。根据前期调研,采集污染样地表层0~20 cm土壤,放入无菌塑料袋,带回实验室。挑去所采土壤样品中的植物残体,自然风干,磨细,过2 mm筛,混匀备用。山核桃蒲壳、竹材边角料、玉米秸秆自然风干后,剪成小块,置于特制的密闭容器中,在马弗炉中350 ℃下限氧热裂解4 h制得生物质炭。磨细制得的生物质炭,过1 mm筛,混合均匀后备用。供试土壤和生物质炭基本性状如表1所示。
表 1 供试土壤和生物质炭基本性质
Table 1. Basic properties of tested soil and biochar
样品 pH 有机碳/(g·kg−1) 全氮/(g·kg−1) 比表面积/(m2·g−1) 得率/% 容重/(g·cm−3) 铅/(mg·kg−1) 镉/(mg·kg−1) 土壤(ck) 6.14 19.45 2.11 − − − 412.00 13.37 竹炭(BB) 9.32 135.62 4.31 0.89 59 0.21 山核桃蒲壳炭(PB) 10.26 337.10 5.24 2.58 45 0.17 玉米秸秆炭(CB) 9.48 436.81 9.53 2.61 32 0.19 说明:−表示未检测;空白表示未检测到 -
设置4个处理,分别为对照(ck)、竹炭(BB)、山核桃蒲壳炭(PB)、玉米秸秆炭(CB),每个处理3个重复。3种生物质炭分别以3%炭土质量比添加到重金属污染土壤中,以不加生物质炭的土壤为对照。每盆设置3 kg土,将生物质炭样品与土壤充分混合后装入塑料盆(盆高和内径均为20 cm)中,盆的位置随机摆放。每盆播种20粒大小均匀饱满的黑麦草Lolium perenne种子作为指示植物,等黑麦草种子萌发1周后,每盆间苗至8株。用去离子水调节土壤湿度至约60%田间最大持水量(WHC)。盆栽试验培养时间为90 d,培养期间不添加肥料以免混淆生物质炭的影响,定期补充去离子水。盆栽90 d后剪取黑麦草地上部分,置于60 ℃烘箱中烘干至恒量,称量。采集土壤样品,过2 mm筛,混匀,分成3份。一份自然风干,用于土壤基本性质测定;一份放在4 ℃冰箱冰柜保存,用于土壤呼吸和酶活性测定;剩余的一份冷冻干燥后保存至−70 ℃冰箱。
-
土壤pH、有机碳、全氮、碱解氮质量分数分析参照鲁如坤[12]的方法进行,其中土壤pH按1.0∶2.5土水比测定。土壤总铅、镉质量分数采用HF-HNO3-HClO4(10∶2.5∶2.5, 体积比)消煮法测定,土壤氯化钙可提取态铅、可提取态镉质量分数采用0.1 mol·L−1 氯化钙浸提,然后分别用电感耦合等离子色谱仪(ICP-OES)测定。
-
土壤微生物磷脂脂肪酸(PLFAs)提取参考吴愉萍[13]报道的方法。通过气相色谱(Agilent 6890 N, 美国)结合MIDI Sherlocks微生物识别软件(Version 4.5, MIDI, 美国)对PLFAs进行定量和鉴别。用i14:0、i15:0、a15:0、i16:0、i17:0和a17:0表征革兰氏阳性细菌(G+)PLFAs质量摩尔浓度,cy17:0、cy19:0、16:1 w9c、16:1 w7c、18:1 w5c和18:1w7c表征革兰氏阴性细菌(G−)PLFAs质量摩尔浓度;10Me16:0、10Me17:0和10Me18:0表征放线菌PLFAs质量摩尔浓度,18:1w9c和18:2w6,9c表征真菌PLFAs质量摩尔浓度[14]。本研究中PLFA质量摩尔浓度总量为所列磷脂脂肪酸质量摩尔浓度之和,G+/G−表示革兰氏阳性细菌与革兰氏阴性细菌PLFAs质量摩尔浓度之比,F/B表示真菌与细菌的磷脂脂肪酸质量摩尔浓度之比,cy17:0/16:1ω7c表示对细菌污染胁迫效应[14]。
-
土壤脱氢酶采用氯化三苯基四唑还原法测定,催化产物为三甲基甲臜(TPF),结果以μg·g−1·h−1表示[15]。土壤基础呼吸速率测定:称相当于10 g 干质量的已预培养的土壤于120 mL培养瓶中,调整土壤湿度至60%最大田间持水量(WHC),用硅胶塞密封,25 ℃恒温好氧培养1 d。培养结束采集二氧化碳气体,气体样品采用岛津气相色谱仪测定(FID检测器),生成的二氧化碳用μg·g−1·h−1来表示。底物诱导呼吸速率测定方法与基础呼吸速率相似,培养开始前加入30 mg·g−1葡萄糖(溶解在蒸馏水中),培养6 h后测定二氧化碳浓度。
-
所得数据采用SPSS 18.0 进行单因素方差分析(one-way ANOVA),Duncan法多重比较检验各因素处理间的差异显著性,显著性水平设为 P=0.05。采用CANOCO软件,利用土壤微生物磷脂脂肪酸质量摩尔浓度数据进行群落结构与环境因子相关性冗余分析(RDA)。利用R “vegan”包,采用置换多元方差分析(permutational multivariate analysis of variance, PERMANOVA)检验不同处理间土壤微生物群落结构差异显著性。
-
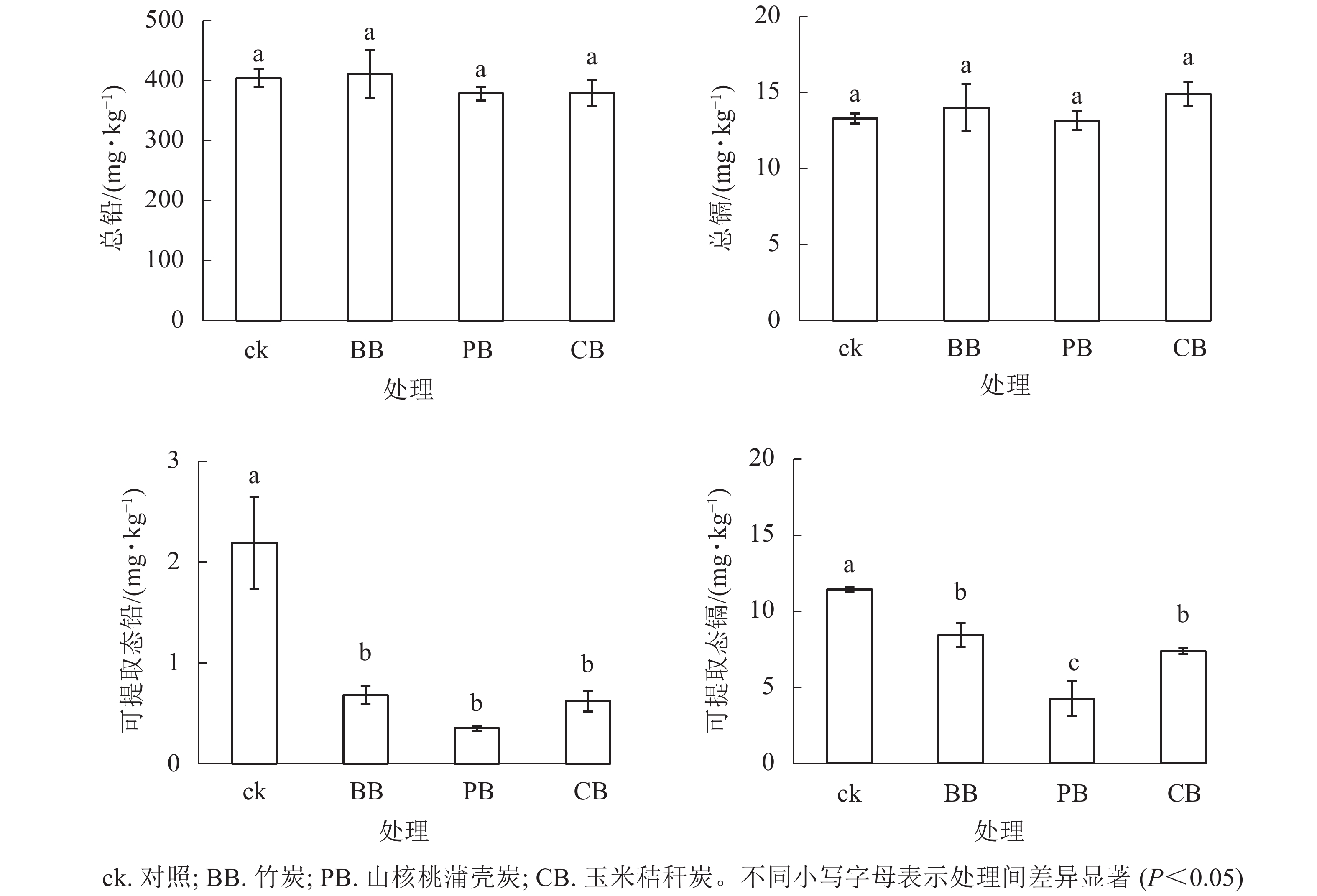
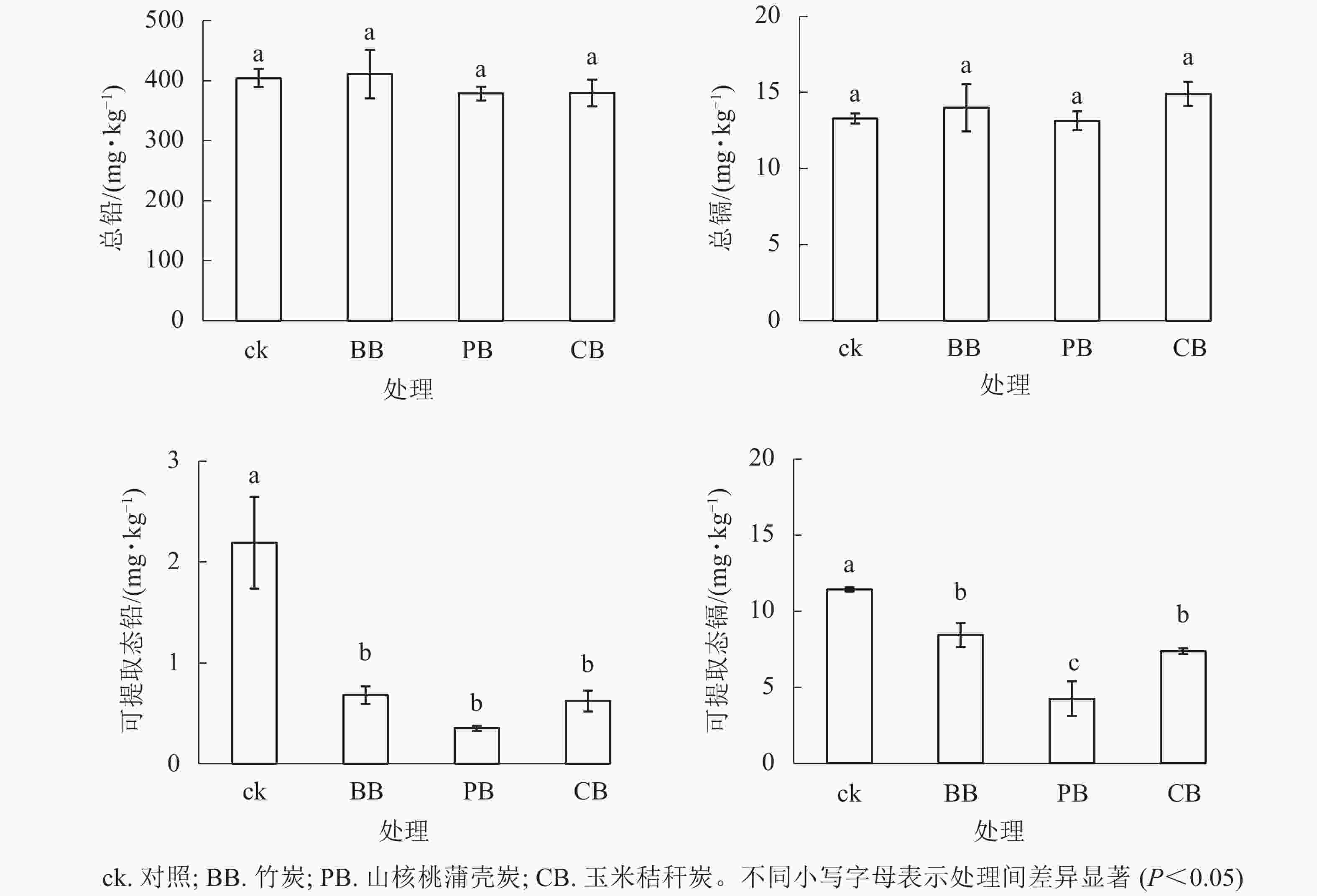
如图1所示:3种生物质炭均未影响土壤重金属全量,而显著(P<0.05)降低了氯化钙可提取态铅质量分数;与对照相比,竹炭、山核桃蒲壳炭、玉米秸秆炭分别使可提取态铅质量分数降低了69%、84%和72%,但三者间无显著差异;竹炭、山核桃蒲壳炭、玉米秸秆炭分别使可提取态镉质量分数降低了26%、63%和36%,其中山核桃蒲壳炭的降低幅度最大。
-
如表2所示:山核桃蒲壳炭和玉米秸秆炭显著(P<0.05)提高了pH、土壤有机碳和全氮以及碳氮比,而竹炭对其无显著影响;与对照相比,山核桃蒲壳炭提高pH幅度最大,为12%,而玉米秸秆炭提高土壤有机碳和全氮幅度较其他2种生物质炭大,分别为74%和41%;尽管生物质炭添加后各处理碳氮比均值要高于对照,但无统计学显著差异;3种生物质炭显著(P<0.05)降低了土壤碱解氮质量分数,以山核桃蒲壳炭降低幅度为最大;玉米秸秆炭添加显著提高了黑麦草生物量,而其他2种生物质炭对其无影响。
表 2 不同原料生物质炭添加下土壤基础性质和黑麦草生物量变化
Table 2. Changes of soil properties and ryegrass biomass with the addition of different biochars
处理 pH 有机碳/(g·kg−1) 全氮/(g·kg−1) 碳氮比 碱解氮/(mg·kg−1) 黑麦草生物量/g 对照(ck) 6.36±0.19 c 20.59±1.15 c 2.07±0.09 c 9.95±0.21 b 157.00±5.28 a 1.54±0.15 b 竹炭(BB) 6.59±0.25 bc 23.29±0.72 c 2.16±0.12 bc 10.78±0.31 b 148.00±3.70 b 1.96±0.35 ab 山核桃蒲壳炭(PB) 7.15±0.11 a 28.25±2.48 b 2.32±0.13 b 12.16±0.44 a 135.00±6.27 c 2.17±0.37 ab 玉米秸秆炭(CB) 6.87±0.08 ab 35.83±4.18 a 2.92±0.08 a 12.26±1.14 a 143.00±3.52 bc 2.29±0.42 a 说明:不同小写字母表示处理间差异显著(P<0.05) -
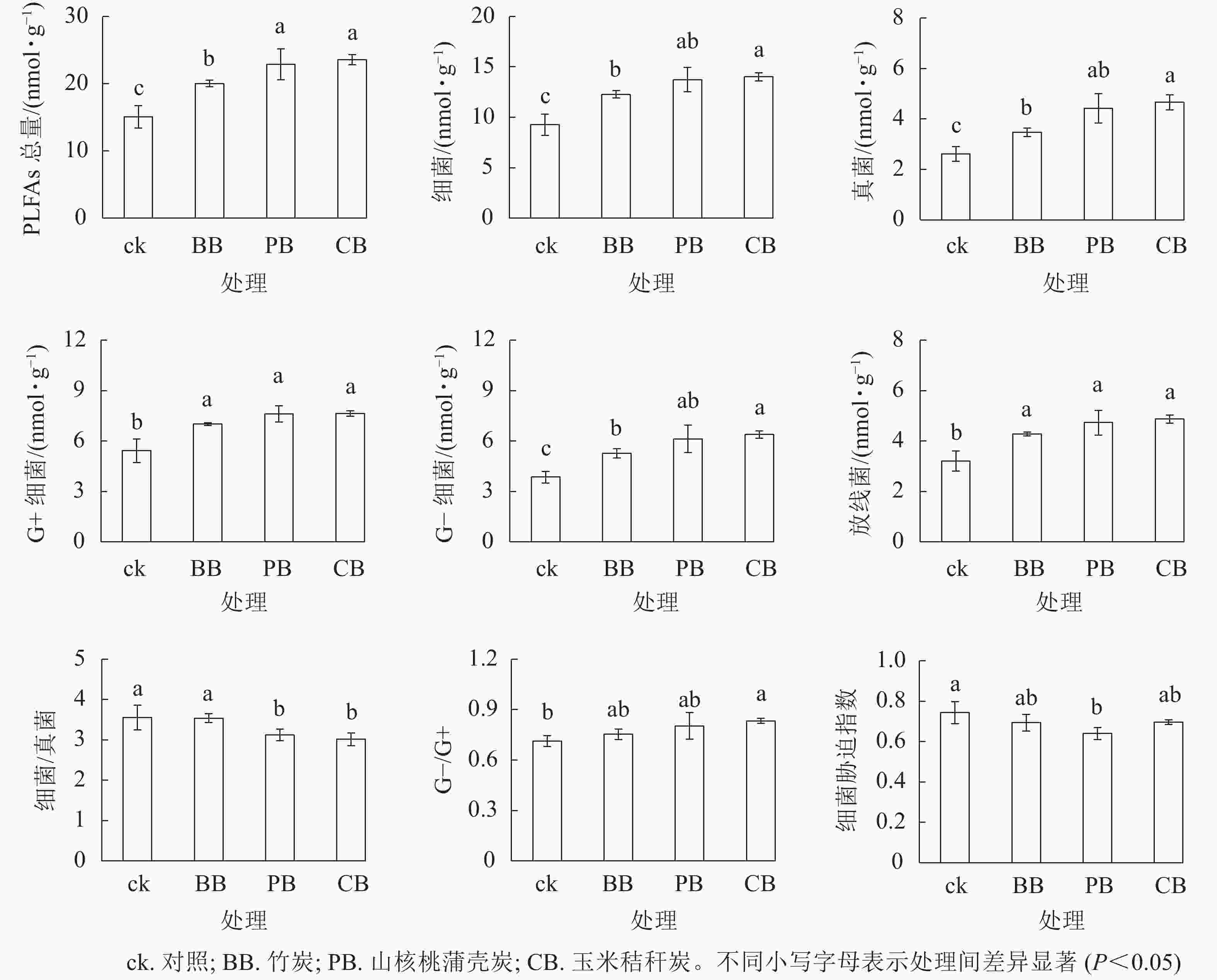
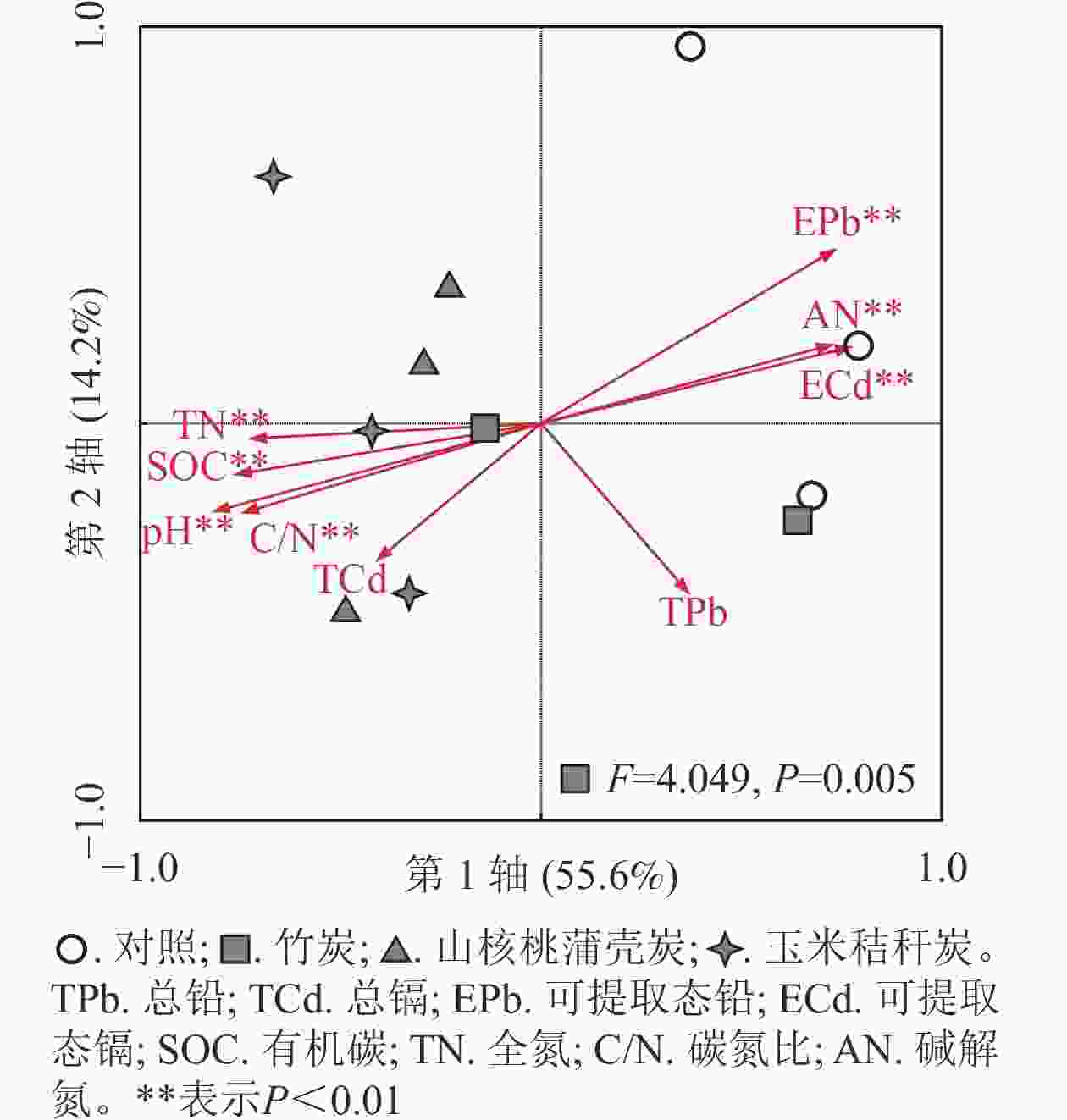
单因素方差分析显示:3种生物质炭均显著(P<0.05)提高了土壤PLFAs质量摩尔浓度。与对照相比,竹炭、山核桃蒲壳炭、玉米秸秆炭分别使PLFAs质量摩浓度提高了33%、52%和56%(图2)。与此相似,3种生物质炭均提高了G+、G−、放线菌和真菌的磷脂脂肪酸质量摩浓度,提高幅度分别为30%~41%、40%~66%、34%~52%和33%~79%,其中竹炭的提高幅度要小于山核桃蒲壳炭和玉米秸秆炭。山核桃蒲壳炭和玉米秸秆炭均显著降低了细菌真菌比(P<0.05),而仅山核桃蒲壳炭显著降低了细菌胁迫指数(P<0.05)。冗余分析结果表明:第1轴、第2轴分别解释了微生物PLFAs变异的55.6%和14.2%,两者累积解释度为69.8%(图3)。山核桃蒲壳炭和玉米秸秆炭处理与其他处理样品在第1轴上有比较明显的分异。置换多元方差分析表明,生物质炭处理显著(F=4.049,P=0.005)改变了土壤微生物群落结构。
-
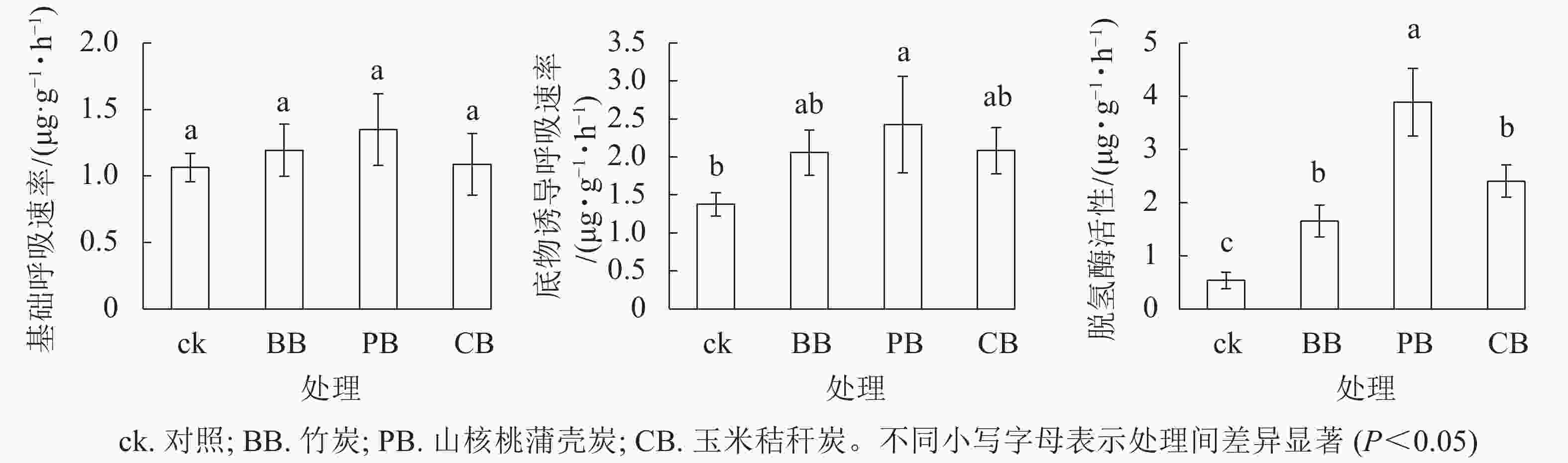
3种生物质炭处理均未显著影响土壤基础呼吸速率(图4)。与对照相比,山核桃蒲壳炭显著(P<0.05)提高了底物诱导呼吸速率,提高幅度为49%~76%。3种生物质炭均显著(P<0.05)提高了土壤脱氢酶活性,其中竹炭、山核桃蒲壳炭、玉米秸秆炭的提高幅度分别为208%、625%和347%。
-
由表3可见:底物诱导呼吸与pH显著正相关(P<0.05),而与可提取铅、可提取镉、碱解氮质量分数显著负相关 (P<0.05),脱氢酶活性与可提取铅、可提取镉、碱解氮质量分数极显著负相关(P<0.01)。细菌胁迫指数与pH显著负相关(P<0.05),而与可提取铅、可提取镉、碱解氮质量分数显著正相关(均为P<0.01)。G−/G+与pH、土壤有机碳、全氮和碳氮比(C/N)显著正相关,而与可提取铅和可提取镉质量分数显著负相关(P<0.05)。
表 3 微生物活性与环境因子相关性分析
Table 3. Correlations between soil microbial activities and environmental factors
项目 pH 有机碳 全氮 碳氮比 碱解氮 总铅 总镉 可提取态铅 可提取态镉 基础呼吸速率 0.46 0.09 −0.10 0.27 −0.21 0.03 −0.25 −0.38 −0.54 底物诱导呼吸速率 0.62* 0.39 0.36 0.30 −0.60* −0.26 0.08 −0.69* −0.68* 脱氢酶活性 0.87** 0.55 0.39 0.59* −0.79** −0.42 −0.03 −0.81** −0.97** PLFA质量摩尔分数 0.78** 0.80** 0.62* 0.78** −0.78** −0.31 0.39 −0.81** −0.83** 细菌胁迫指数 −0.68* −0.25 −0.16 −0.32 0.59* 0.07 −0.08 0.79** 0.76** G−/G+ 0.72** 0.76** 0.62* 0.67* −0.66* −0.14 0.53 −0.65* −0.62* 细菌/真菌 −0.63* −0.72** −0.74** −0.48 0.56 0.46 −0.28 0.53 0.63* 说明:**表示P<0.01;*表示P<0.05 -
本研究发现:竹炭、山核桃蒲壳炭和玉米秸秆炭对土壤总铅和总镉质量分数无影响,但均显著降低了土壤氯化钙可提取态铅和可提取态镉的质量分数,表明3种原料制备的生物质炭均可吸附、固定重金属,降低其生物有效性。UCHIMIYA等[16]研究表明:不同原料制备的生物质炭均显著提高了土壤对可溶态重金属铜、镉、镍的固定,尤其是对可溶态铅的固定作用。张迪等[17]表明:添加质量分数为2.5%和5.0%的水稻Oryza sativa秸秆炭可使镉和铅有效态大幅度下降,并且促进镉、铅由酸溶态向还原态和残渣态转化。本研究中,重金属总量没有显著变化,是由于生物质炭尽管吸附、固定了部分重金属在其表面,但是经过强酸处理和高温消煮,这部分重金属依然可以检测到。可提取态重金属被认为是生物可利用的组分,其含量的降低是修复的重要内容,对降低植物重金属吸收和保证粮食安全具有重要的意义。生物质炭降低可提取态铅和镉含量一方面与其吸附固定能力有关,另一方面与提高的土壤pH有关。生物质炭表面含有丰富的含氧官能团(如羧基、酚基、羰基、羟基、醌类物质等)与其较大的比表面积密切相关,可与重金属离子形成表面络合物,增加土壤对重金属的专性吸附量,从而达到固定和钝化重金属[5]。3种生物质炭对可提取态铅和可提取态镉的吸附固定能力从大到小为山核桃蒲壳炭、玉米秸秆炭、竹炭。相比竹炭,山核桃蒲壳炭与玉米秸秆炭具有更高的比表面积,且提高土壤pH能力也高于竹炭,从而具有更高的吸附和固定能力。本研究中,竹炭的容重高于其他2种生物质炭,当添加相同质量的炭时,竹炭拥有更小的体积,因而加入土壤后具有更低的土壤颗粒接触面积,对重金属的吸附作用也可能降低。
添加生物质炭提高了黑麦草生物量、土壤pH、有机碳和全氮水平,结果与大多数报道一致[9, 18],表明生物质炭可通过改善和提高土壤肥力,促进植物生长。生物质材料热解成生物质炭后,其pH、有机官能团、碳酸盐、灰分碱含量与生物质材料相比均得到了明显提高,能够有效中和土壤酸性[19-20]。本研究中玉米秸秆炭和山核桃蒲壳炭改良效果较好,这可能由于玉米秸秆炭和山核桃蒲壳炭具有较高的灰分碱,能快速中和土壤酸度。另一方面,生物质炭降低了重金属有效性,从而降低了对植物的毒害,也可能是促进植物生长的重要原因。相比其他2种生物质炭,玉米秸秆炭提高土壤有机碳和全氮的幅度最大,这与其本身含有较高的有机碳和全氮质量分数有关。生物质炭具有高度芳香性的碳组分和较高的碳氮比,在土壤中不易被微生物降解,土壤中添加生物质炭可长期增加土壤碳含量[20]。碱解氮含量降低可能与生物质炭具有较强的有机物和矿质态氮吸附能力有关。TAGHIZADEH-TOOSI等[21]研究表明:生物质炭能吸附土壤中的铵态氮,且吸附的这些氮素是生物可利用的。
-
本研究表明:3种生物质炭添加均显著提高了铅镉污染土壤微生物磷脂脂肪酸质量摩尔浓度和各类群微生物丰度,显著降低了细菌胁迫指数和细菌真菌比。这种改善作用在山核桃蒲壳炭和玉米秸秆炭作用下更为明显。现已证明:生物质炭可以通过直接或间接作用影响土壤微生物的丰度、组成及功能,进而影响土壤各种生物化学过程[4, 22]。包建平等[23]研究证实:生物质炭添加不仅能显著提高养分较为贫瘠的红壤有机质含量,对微生物丰度也有明显的促进作用。这种改善作用被认为与生物质炭孔隙结构所提供的天敌庇护和土壤养分吸附能力有关,为微生物的生存繁殖提供了各种碳源、能源和矿物养分以及适宜的微生境[24]。LEHMANN等[4]认为:生物质炭对土壤酸度的改善和养分含量的提高,均有利于提高土壤微生物丰度,促进微生物活性。本研究中生物质炭显著提高了有机碳和全氮质量分数,并与磷脂脂肪酸质量摩尔浓度显著相关也支持了这一说法。另外,生物质炭吸附和固定土壤中重金属,尤其是生物可利用的重金属,对于消减重金属对微生物的负面效应有重要作用。黄家庆等研究[25]表明:花生Arachis hypogaea壳生物质炭有利于改善土壤的理化性质,减轻重金属镉的毒害作用,促使细菌群落恢复生长,提高土壤酶活性。因此,本研究中生物质炭显著降低了可提取态铅和可提取态镉质量分数,极大程度降低了重金属污染对土壤微生物的抑制作用,改善了微生物生境,从而提高了微生物丰度。这从土壤可提取态铅和可提取态镉质量分数与微生物磷脂脂肪酸质量摩尔浓度呈极显著负相关得到印证。
目前,生物质炭对土壤酶活性的影响还存在争议,如添加量、酶的种类、生物质炭性质等。如BAILEY 等[26]研究发现:β-葡萄糖苷酶和N-乙酰氨基葡萄糖甘酶活性对生物质炭响应并不一致,主要与生物质炭对酶或底物的吸附作用及土壤微生物的变化有关。ZHENG等[27]发现:施用生物质炭后土壤脱氢酶活性和葡萄糖苷酶活性均显著下降。先前研究表明:重金属污染可显著降低土壤脱氢酶活性和微生物数量,反映了重金属污染对微生物的胁迫效应[28]。本研究中,3种生物质炭均显著提高了土壤脱氢酶和底物诱导呼吸速率,表明生物质炭可促进受重金属污染的土壤微生物活性。这可能与生物质炭降低或解除了铅镉污染对微生物的抑制作用和土壤环境改善有关。土壤脱氢酶和底物诱导呼吸速率与可提取态铅镉质量分数的显著负相关性也支持了这一推测。有研究认为:在重金属污染环境中,土壤微生物为了保持基本的代谢和繁殖功能,需要付出额外的能量以抵抗重金属的胁迫,表现出单位生物量具有更高的呼吸速率,即更高的代谢熵[29]。然而,本研究发现:3种生物质炭尽管显著提高了微生物磷脂脂肪酸质量摩尔浓度,但均未显著提高基础呼吸速率。这也进一步表明生物质炭解除了重金属胁迫,使得微生物不需要额外消耗能量去适应环境,因此改善了土壤微生物的生存环境。
-
3种不同原料制备的生物质炭添加均降低了铅镉生物有效性,山核桃蒲壳炭和玉米秸秆炭在提高土壤pH、有机碳和全氮质量分数,改善土壤养分状况和降低重金属有效性方面优于竹炭。山核桃蒲壳炭和玉米秸秆炭提高了土壤微生物丰度,降低了铅镉污染胁迫作用,这与其降低重金属的有效性有密切关系。山核桃蒲壳和玉米秸秆制备的生物质炭在钝化重金属和恢复微生物活性方面具有较好的应用潜力。
Effects of biochar from different raw materials on microbial activity in heavy metal contaminated soil
-
摘要:
目的 探究不同原料制备的生物质炭能否缓解长期重金属污染对土壤微生物活性的胁迫效应,为污染土壤生物质炭修复提供科学依据。 方法 将竹材边角料(BB)、山核桃Carya cathayensis蒲壳(PB)和玉米Zea mays秸秆(CB)制备的3种生物质炭分别以3%比例(炭土质量比)添加到长期受铅、镉污染土壤中,分析生物质炭短期施用下土壤养分、重金属有效质量分数和土壤微生物活性的变化特征。 结果 3种生物质炭添加均未影响土壤重金属全量,而显著(P<0.05)降低了土壤氯化钙可提取态铅、镉质量分数。与不施生物质炭处理相比,BB、PB和CB分别使可提取态铅质量分数显著(P<0.05)降低了69%、84%和72%;使可提取态镉质量分数显著(P<0.05)降低了26%、63%和36%,且PB处理显著(P<0.05)低于BB和CB处理。PB和CB添加均显著(P<0.05)提高了土壤pH(0.79和0.51个pH单位)、有机碳质量分数(37%和74%)、全氮质量分数(12%和41%),而BB添加对其影响不显著。BB、PB和CB分别使土壤磷脂脂肪酸总量提高了33%~56%、革兰氏阳性菌提高了30%~41%、革兰氏阴性菌提高了40%~66%、放线菌提高了34%~52%、真菌提高了33%~79%,但3种处理间无显著差异(除PB和CB处理的磷脂脂肪酸总量显著高于BB处理)。3种生物质炭均显著(P<0.05)提高了脱氢酶活性(2~6倍),但未影响土壤基础呼吸速率,而PB处理显著(P<0.05)降低了细菌胁迫指数(13.9%),提高了底物诱导呼吸速率。 结论 山核桃蒲壳制备的生物质炭可作为较好的改良剂,降低土壤铅镉有效性,恢复土壤微生物的数量和活性。图4表3参29 Abstract:Objective This study aims to investigate whether biochar prepared from different raw materials can alleviate the stress effect of long-term heavy metal pollution on soil microbial activity, so as to provide scientific basis for biochar remediation of contaminated soil. Method Three kinds of biochar prepared from bamboo leftover (BB), Carya cathayensis peels (PB) and Zea mays straw (CB) were added to the long-term lead (Pb) and cadmium (Cd) contaminated soil at a ratio of 3% (biochar soil mass ratio) respectively. The changes of soil nutrients, available mass fraction of heavy metals, soil microbial activity under short-term application of biochar were analyzed. Result The addition of three kinds of biochar did not affect the total amount of heavy metals in soil, but significantly (P<0.05) reduced the mass fraction of extractable Pb and Cd in soil calcium chloride (CaCl2). Compared with ck, BB, PB and CB significantly (P<0.05) decreased CaCl2-extractable Pb concentration by 69%, 84% and 72%, and CaCl2-extractable Cd by 26%, 63% and 36%, respectively. PB treatment was significantly (P<0.05) lower than BB and CB treatments. PB and CB significantly increased soil pH (0.79 and 0.51 pH units), soil organic carbon (37% and 74%) and total nitrogen (12% and 41%), respectively, but BB addition had no significant effect. BB, PB and CB significantly (P<0.05) increased the total amount of phospholipid fatty acids (PLFAs) in soil by 33%−56%, gram-positive bacteria by 30%−41%, gram-negative bacteria by 40%−66%, actinobacteria by 34%−52% and fungi by 33%−79%, respectively, but there was no significant difference among the three treatments (except that the total amount of phospholipid fatty acids in PB and CB treatment was significantly higher than that in BB treatment). The three biochar treatments significantly increased the activity of dehydrogenase (2−6 times), but did not affect the soil basal respiration, while PB treatment significantly (P< 0.05) decreased the bacterial stress index (13.9%) and increased the substrate induced respiration rate. Conclusion PB and CB can be used as a better modifier to decrease heavy metal availability and restore the number and activity of soil microorganisms. [Ch, 4 fig. 3 tab. 29 ref.] -
Key words:
- heavy metal stress /
- phospholipid fatty acids /
- microbial abundance /
- soil respiration
-
表 1 供试土壤和生物质炭基本性质
Table 1. Basic properties of tested soil and biochar
样品 pH 有机碳/(g·kg−1) 全氮/(g·kg−1) 比表面积/(m2·g−1) 得率/% 容重/(g·cm−3) 铅/(mg·kg−1) 镉/(mg·kg−1) 土壤(ck) 6.14 19.45 2.11 − − − 412.00 13.37 竹炭(BB) 9.32 135.62 4.31 0.89 59 0.21 山核桃蒲壳炭(PB) 10.26 337.10 5.24 2.58 45 0.17 玉米秸秆炭(CB) 9.48 436.81 9.53 2.61 32 0.19 说明:−表示未检测;空白表示未检测到 表 2 不同原料生物质炭添加下土壤基础性质和黑麦草生物量变化
Table 2. Changes of soil properties and ryegrass biomass with the addition of different biochars
处理 pH 有机碳/(g·kg−1) 全氮/(g·kg−1) 碳氮比 碱解氮/(mg·kg−1) 黑麦草生物量/g 对照(ck) 6.36±0.19 c 20.59±1.15 c 2.07±0.09 c 9.95±0.21 b 157.00±5.28 a 1.54±0.15 b 竹炭(BB) 6.59±0.25 bc 23.29±0.72 c 2.16±0.12 bc 10.78±0.31 b 148.00±3.70 b 1.96±0.35 ab 山核桃蒲壳炭(PB) 7.15±0.11 a 28.25±2.48 b 2.32±0.13 b 12.16±0.44 a 135.00±6.27 c 2.17±0.37 ab 玉米秸秆炭(CB) 6.87±0.08 ab 35.83±4.18 a 2.92±0.08 a 12.26±1.14 a 143.00±3.52 bc 2.29±0.42 a 说明:不同小写字母表示处理间差异显著(P<0.05) 表 3 微生物活性与环境因子相关性分析
Table 3. Correlations between soil microbial activities and environmental factors
项目 pH 有机碳 全氮 碳氮比 碱解氮 总铅 总镉 可提取态铅 可提取态镉 基础呼吸速率 0.46 0.09 −0.10 0.27 −0.21 0.03 −0.25 −0.38 −0.54 底物诱导呼吸速率 0.62* 0.39 0.36 0.30 −0.60* −0.26 0.08 −0.69* −0.68* 脱氢酶活性 0.87** 0.55 0.39 0.59* −0.79** −0.42 −0.03 −0.81** −0.97** PLFA质量摩尔分数 0.78** 0.80** 0.62* 0.78** −0.78** −0.31 0.39 −0.81** −0.83** 细菌胁迫指数 −0.68* −0.25 −0.16 −0.32 0.59* 0.07 −0.08 0.79** 0.76** G−/G+ 0.72** 0.76** 0.62* 0.67* −0.66* −0.14 0.53 −0.65* −0.62* 细菌/真菌 −0.63* −0.72** −0.74** −0.48 0.56 0.46 −0.28 0.53 0.63* 说明:**表示P<0.01;*表示P<0.05 -
[1] 杨文浩, 李佩, 周碧青, 等. 生物炭缓解污染土壤中植物的重金属胁迫研究进展[J]. 福建农林大学学报(自然科学版), 2019, 48(6): 695 − 705. YANG Wenhao, LI Pei, ZHOU Biqing, et al. Biochar-mediated alleviation of heavy metal stress in plants growing in contaminated soils: a review [J]. J Fujian Agric For Univ Nat Sci Ed, 2019, 48(6): 695 − 705. [2] 程金金, 宋静, 陈文超, 等. 镉污染对红壤和潮土微生物的生态毒理效应[J]. 生态毒理学报, 2013, 8(4): 577 − 586. CHENG Jinjin, SONG Jing, CHEN Wenchao, et al. The ecotoxicity effects of cadmium on microorganism in Udic-Ferrosols and Aquic-Cambosols [J]. Asian J Ecotoxicol, 2013, 8(4): 577 − 586. [3] KHAN K S, XIE Zhengmiao, HUANG Changyong. Effect of cadmium, lead on size of microbial biomass in red soil [J]. Pedosphere, 1998, 8(1): 27 − 32. [4] LEHMANN J, RILLIG M C, THIES J, et al. Biochar effects on soil biota: a review [J]. Soil Biol Biochem, 2011, 43(9): 1812 − 1836. [5] ZHANG Xiaokai, WANG Haolong, HE Lizhi, et al. Using biochar for remediation of soils contaminated with heavy metals and organic pollutants [J]. Environ Sci Pollut Res, 2013, 20(12): 8472 − 8483. [6] 戴志楠, 温尔刚, 陈翰博, 等. 施用原始及铁改性生物质炭对土壤吸附砷(Ⅴ)的影响[J]. 浙江农林大学学报, 2021, 38(2): 346 − 354. DAI Zhinan, WEN Ergang, CHEN Hanbo, et al. Effect of raw and iron-modified biochar on the sorption of As (Ⅴ) by soils [J]. J Zhejiang A&F Univ, 2021, 38(2): 346 − 354. [7] ZHU Xiaomin, CHEN Baoliang, ZHU Lizhong, et al. Effects and mechanisms of biochar-microbe interactions in soil improvement and pollution remediation: a review [J]. Environ Pollut, 2017, 227: 98 − 115. [8] YU Z, CHEN L, PAN S, et al. Feedstock determines biochar-induced soil priming effects by stimulating the activity of specific microorganisms [J]. Eur J Soil Sci, 2018, 69(3): 521 − 534. [9] JONES D L, ROUSK J, EDWARDS-JONES G, et al. Biochar-mediated changes in soil quality and plant growth in a three year field trial [J]. Soil Biol Biochem, 2012, 45: 113 − 124. [10] GUO Kangying, ZHAO Yingzhi, LIU Yang, et al. Pyrolysis temperature of biochar affects ecoenzymatic stoichiometry and microbial nutrient-use efficiency in a bamboo forest soil[J/OL]. Geoderma, 2020, 363: 114162[2021-05-18]. doi: 10.1016/j.geoderma.2019.114162. [11] 李鸿博, 钟怡, 张昊楠, 等. 生物炭修复重金属污染农田土壤的机制及应用研究进展[J]. 农业工程学报, 2020, 36(13): 173 − 185. LI Hongbo, ZHONG Yi, ZHANG Haonan, et al. Mechanism for the application of biochar in remediation of heavy metal contaminated farmland and its research advances [J]. Trans Chin Soc Agric Eng, 2020, 36(13): 173 − 185. [12] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Rukun. The Analysis Method of Soil Agricultural Chemistry [M]. Beijing: China Agricultural Science and Technology Press, 2000. [13] 吴愉萍. 基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[D]. 杭州: 浙江大学, 2009. WU Yuping. Studies on Soil Microbial Community Structure Based on Phospholipid Fatty Acid (PLFA) Analysis[D]. Hangzhou: Zhejiang University, 2009. [14] ZELLES L. Phospholipid fatty acid profiles in selected members of soil microbial communities [J]. Chemosphere, 1997, 35(1/2): 275 − 294. [15] SERRA-WITTLING C, HOUOT S, BARRIUSO E. Soil enzymatic response to addition of municipal solid-waste compost [J]. Biol Fert Soil, 1995, 20: 226 − 236. [16] UCHIMIYA M, CHANG S C, KLASSON K T. Screening biochars for heavy metal retention in soil: role of oxygen functional groups [J]. J Hazardous Mater, 2013, 190(1): 432 − 441. [17] 张迪, 李婷, 方炫, 等. 钝化剂对土壤镉铅有效性和微生物群落多样性影响[J]. 农业环境科学学报, 2019, 38(12): 2729 − 2737. ZHANG Di, LI Ting, FANG Xuan, et al. Effects of passivating agents on the availability of Cd and Pb and functional diversity of the microbial community in contaminated soils [J]. J Agro-Environ Sci, 2019, 38(12): 2729 − 2737. [18] LIU Yang, GUO Kangying, ZHAO Yingzhi, et al. Change in composition and function of microbial communities in an acid bamboo (Phyllostachys praecox) plantation soil with the addition of three different biochars[J/OL]. For Ecol Manage, 2020, 473(2): 118336[2021-05-05]. doi:10.1016/j.foreco.2020.118336. [19] YUAN Jinhua, XU Renkou, ZHANG Hong. The forms of alkalis in the biochar produced from crop residues at different temperatures [J]. Bioresour Technol, 2011, 102(3): 3488 − 3497. [20] 包骏瑶, 赵颖志, 严淑娴, 等. 不同农林废弃物生物质炭对雷竹林酸化土壤的改良效果[J]. 浙江农林大学学报, 2018, 35(1): 43 − 50. BAO Junyao, ZHAO Yingzhi, YAN Shuxian, et al. Soil amelioration with biochars pyrolyzed from different feedstocks of an acidic bamboo (Phyllostachys violascens) plantation [J]. J Zhejiang A&F Univ, 2018, 35(1): 43 − 50. [21] TAGHIZADEH-TOOSI A, CLOUGH T J, SHERLOCK R R, et al. Biochar adsorbed ammonia is bioavailable [J]. Plant Soil, 2012, 350(1): 57 − 69. [22] PALANSOORIYA K N, WONG J T F, HASHIMOTO Y, et al. Response of microbial communities to biochar-amended soils: a critical review [J]. Biochar, 2019, 1(1): 3 − 22. [23] 包建平, 袁根生, 董方圆, 等. 生物质炭与秸秆施用对红壤有机碳组分和微生物活性的影响[J]. 土壤学报, 2020, 57(3): 721 − 729. BAO Jianping, YUAN Gensheng, DONG Fangyuan, et al. Effects of biochar application and straw returning on organic carbon fractionations and microbial activities in a red soil [J]. Acta Pedol Sin, 2020, 57(3): 721 − 729. [24] WARNOCK D D, LEHMANN J, KUYPER T W, et al. Mycorrhizal responses to biochar in soil: concepts and mechanisms [J]. Plant Soil, 2007, 300(1): 9 − 20. [25] 黄家庆, 赖永翔, 翁伯琦, 等. 花生壳生物炭对镉污染菜园土壤细菌群落结构的影响[J]. 应用与环境生物学报, 2020, 26(5): 1115 − 1128. HUANG Jiaqing, LAI Yongxiang, WENG Boqi, et al. Effect of peanut shell biochar on the bacterial community structure in cadmium-containing vegetable soil [J]. Chin J Appl Environ Biol, 2020, 26(5): 1115 − 1128. [26] BAILEY V L, FANSLER S J, SMITH J L, et al. Reconciling apparent variability in effects of biochar amendment on soil enzyme activities by assay optimization [J]. Soil Biol Biochem, 2011, 43(2): 296 − 301. [27] ZHENG Jufeng, CHEN Junhui, PAN Genxing, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China [J]. Sci Total Environ, 2016, 571: 206 − 217. [28] CHEN Junhui, HE Feng, ZHANG Xuhui, et al. Heavy metal pollution decreases microbial abundance, diversity and activity within particle-size fractions of a paddy soil [J]. FEMS Microbiol Ecol, 2014, 87(1): 164 − 181. [29] GILLER K E, WITTER E, MCGRATH S P. Heavy metals and soil microbes [J]. Soil Biol Biochem, 2009, 41(10): 2031 − 2037. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210438






 下载:
下载: