-
西红花Crocus sativus为鸢尾科Iridaceae番红花属Crocus多年生草本植物,又称藏红花、番红花,为新“浙八味”之一。西红花柱头是其主要药用部分,具活血祛瘀、凉血解毒、解郁安神等功效[1],西红花花丝富含藏红花素、藏红花甙等成分,对心脑血管以及神经性疾病都有较好的预防和治疗效果[2-3]。西红花是三倍体植物,只能够通过球茎来繁种。生产上,种球芽过多会分散营养运输,不利用单个种球膨大为成品种球。因此,种植前抹芽是西红花种球田间复壮的常规操作。常年无性繁殖,产生的抹芽伤口使得病害入侵并逐年累积,病害高发年份部分产区的茎腐病发病率可达40%[4],使得西红花产量急剧降低,很大程度上制约了西红花产业的发展。目前已知的药用植物病害中,真菌性病害占比高达80%[5],真菌性病害也是导致西红花发生球茎腐烂的主要病害。张国辉等[6]从贵州西红花茎腐病病害样本中分离鉴定出尖孢镰刀菌Fusarium oxysporum和炭疽菌Anthracnose sp.等2种真菌,证实西红花球茎腐烂病由两者共同感染所致。吴李芳[7]发现浙江西红花茎腐病的致病真菌为尖孢镰刀菌 的ZJU-1菌株和茄病镰刀菌F. solani的ZJU-2菌株。ZHANG等[8]采用组织分离法从浙江西红花中分离鉴定得到离生青霉菌Penicillium solitum,认为这是一种新的能导致西红花茎腐病的致病真菌。可见不同品种西红花感染的致病真菌是不同的。‘番红花1号’C. sativus ‘Saffron No. 1’是目前西红花在浙江省的主栽品种,具有一定的抗茎腐病抗性,对引起该品种球茎茎腐病的致病真菌的分离与鉴定工作报道不多。本研究以浙江建德产‘番红花1号’球茎为材料,分离并鉴定引起其该品种茎腐病的病原菌,以期为完善西红花茎腐病致病菌数据,也为西红花茎腐病科学防控和特效杀菌剂的开发提供科学依据。
-
健康及具有典型球茎腐烂病病症的西红花‘番红花1号’种球均采自浙江省建德市三都西红花专业合作社同一区块种植基地。离生青霉菌由浙江中医药大学药学院分离并保存,已研究证实具有球茎腐烂致病性[8]。
-
采用组织分离法对西红花球茎腐烂病的病原真菌进行分离。腐烂球茎去种皮,流水冲洗后用体积分数75%的乙醇消毒浸泡1 min,再用体积分数5%次氯酸钠溶液浸泡2 min,无菌水彻底冲洗后控干。无菌条件下切取球茎病健交界处组织块约2 mm3,接种于马铃薯葡萄糖琼脂(PDA)培养板中,25 ℃恒温培养。待组织边缘长出菌落后,挑取不同颜色或形态差异明显的菌落接种于新鲜PDA培养板上,继续培养5~7 d。采用梯度稀释划线法对菌落进行3轮纯化,直至挑取的单菌落生长速度相近、边缘清晰,即可初步判定该真菌已纯化完全。纯化的真菌菌株保存于新鲜PDA培养板上,4 ℃倒置保存备用。
-
将分离纯化得到的致病真菌回接至健康球茎和植株,验证其致病性;以离生青霉菌为致病性检测的阳性对照,无菌水为空白对照。
-
取健康球茎,依据1.2方法进行表面消毒,并用无菌解剖刀切出表面积约1 cm2的浅伤口。将已纯化的致病真菌接种到PDA培养板上,于25 ℃恒温培养7 d后,使用打孔器在致病真菌菌落边沿打取直径为1 cm的菌饼,接种至球茎伤口处,并将切开的球茎组织小块放回原位。回接后的球茎25 ℃恒温培养,定期观察并拍照记录种球的生长状况和病变特性。
-
将已纯化的致病真菌接种于PDA培养板,25 ℃恒温培养7 d,逐步稀释配制成孢子密度为106个·mL−1的悬浮液。取健康球茎,依据1.2方法表面消毒后用无菌解剖刀沿球茎外圈划细浅伤口,球茎种植于灭菌基质中,并浇灌孢子悬浮液。置于20 ℃,8 h·d−1光照下培养,每7 d浇灌1次。培养至30 d时挖出种球,分别观察拍照,并按病情分级标准将球茎进行分级,统计发病率。病情分级标准:0级,无病斑;1级(轻症),腐烂面积占整个球茎≤20%;2级(中症),20%<腐烂面积<40%;3级(重症),腐烂面积≥40%。发病率=(腐烂球茎个数/处理球茎个数)×100%[9]。
各处理生物学重复3次,采用t检验法进行差异显著性分析[10]。
-
将已纯化完全的病原真菌接种于PDA培养板上,25 ℃恒温培养5~7 d,观察并记录菌落的生长形态、大小、边缘、颜色、光泽、生长速度、质地等基本特征。
-
采用改良透明胶带法[11],粘取适量已分离纯化的致病真菌菌丝,制片,光学显微镜下观察并测定分生孢子形态大小、菌丝附着胞及产孢结构等显微特征。
-
采用改良的十六烷基三甲基溴化铵(CTAB)法[12]提取纯化致病真菌总基因组DNA,用通用引物ITS1/ITS6、ITS4R、rPB2-5F、rPB2-7CR分别对真菌核糖体基因内部转录间隔区(ITS)序列、RNA聚合酶Ⅱ亚基(RPB2)序列进行PCR扩增[5, 7]。产物经琼脂糖凝胶电泳法检测,切胶回收后送至浙江尚亚生物技术有限公司测序,测序结果在美国国家生物技术信息中心(NCBI)网站(www.ncbi.nlm.nih.gov)进行BLAST相似性比对分析。
-
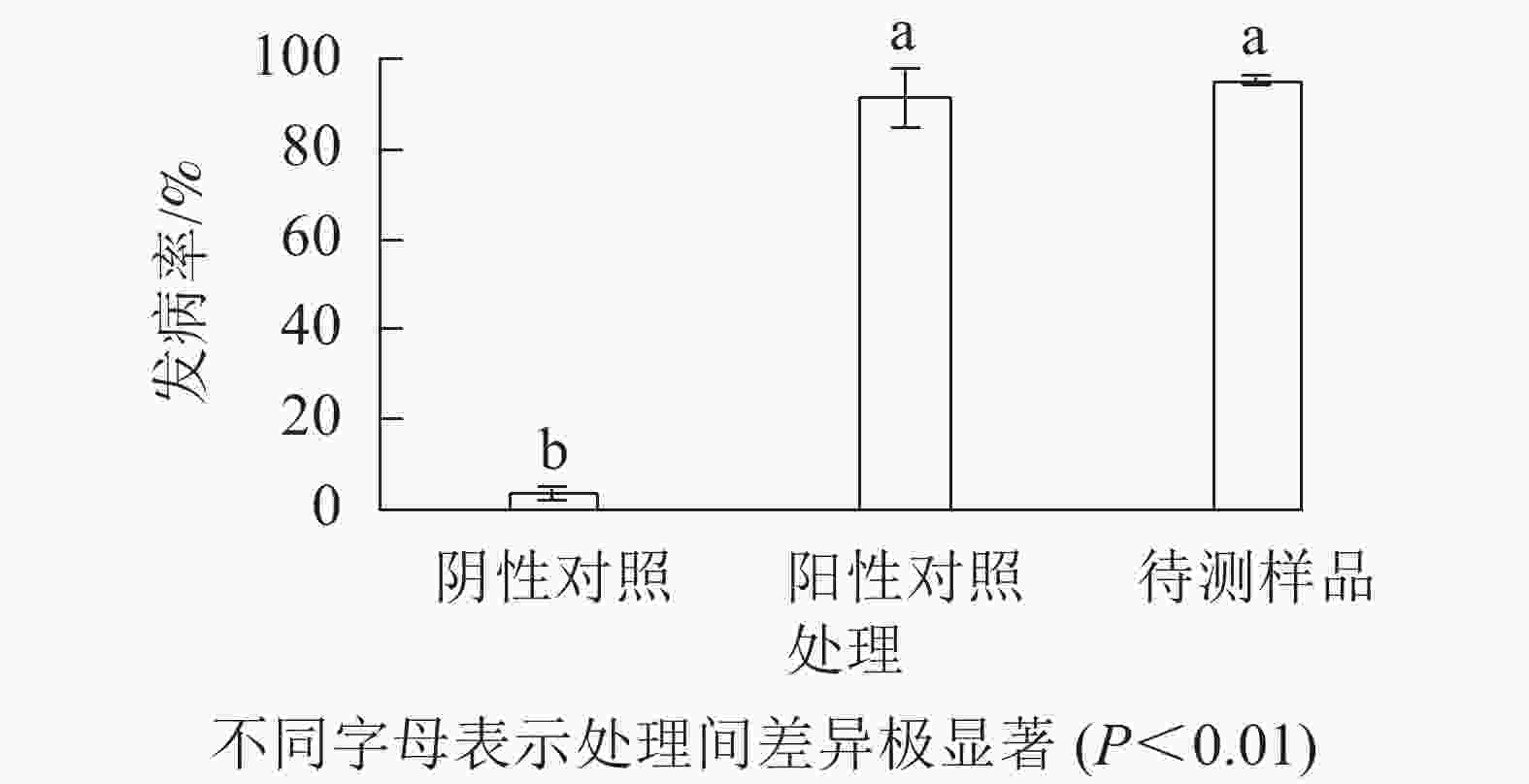
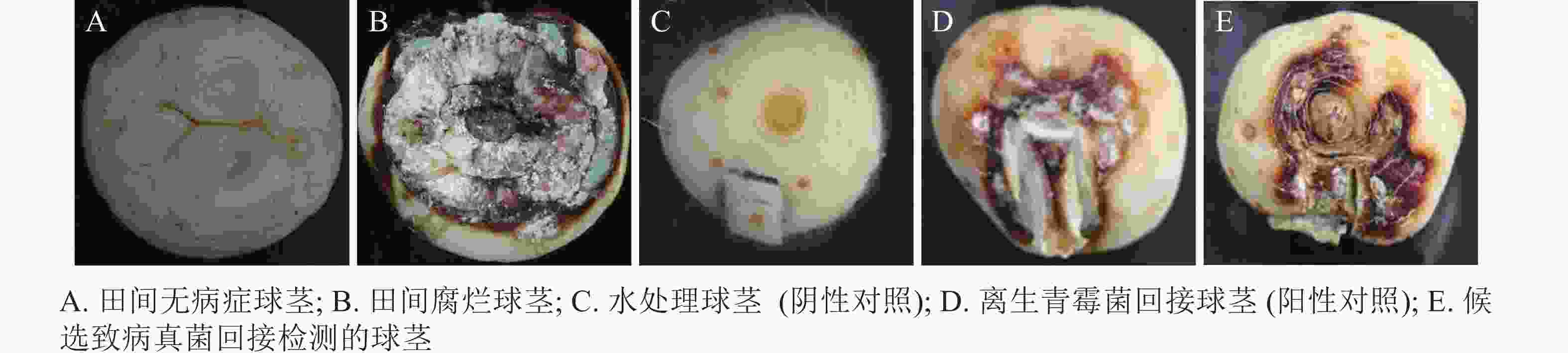
与无腐烂症状的球茎相比(图1A),患球茎腐烂病的西红花地上部分叶片逐渐枯黄,球茎腐烂严重(图1B)。采用组织分离法从田间感病西红花种球中分离纯化获得真菌115株。选取1株菌落表型相对一致且检测频率占主要优势的菌斑,经3轮分离纯化,获得生长速率一致、边际清晰的纯化菌斑。由图1C~E可见:该真菌菌液接种到带有小伤口的健康种球上培养7 d,种球出现感病症状,其腐烂症状与离生青霉菌阳性回接的阳性对照相似,而无菌水处理的阴性对照未产生明显症状。统计不同处理下的球茎腐烂率,由图2可知:处理组球茎腐烂率高达97.3%,阳性对照为93.7%,均极显著高于阴性对照(P<0.01)。推测分离得到的真菌是引起西红花球茎腐烂的主要病害之一。
-
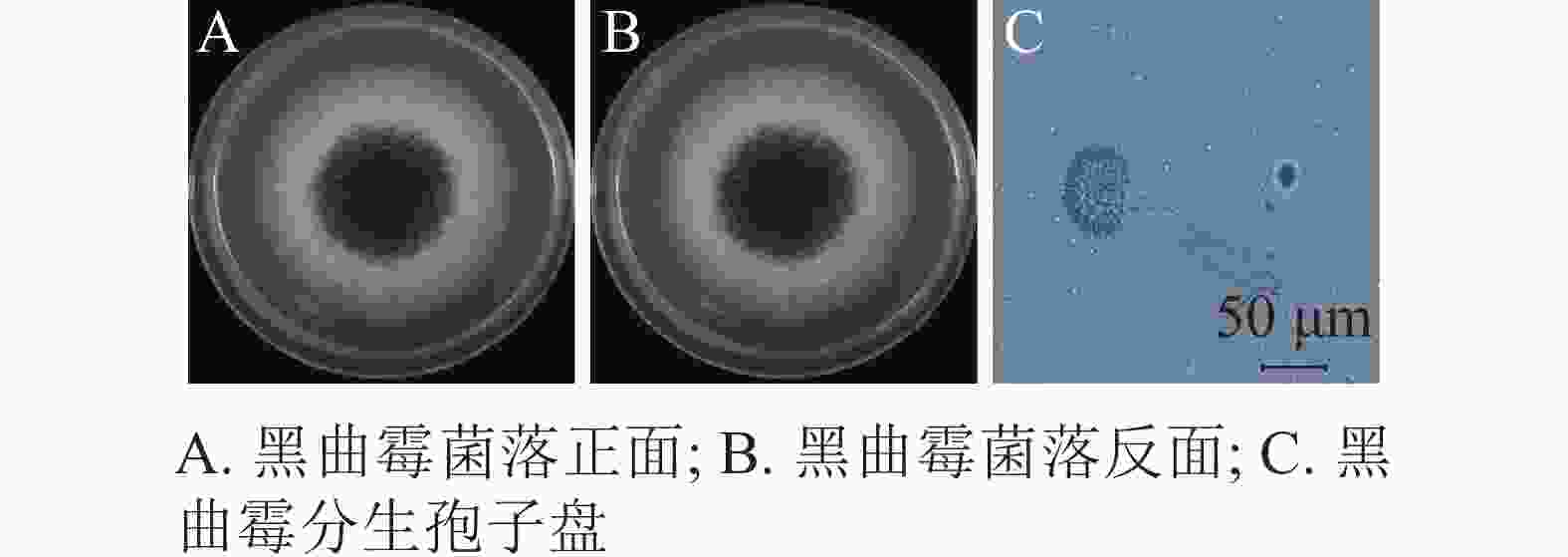
将纯化后的病原真菌接种于PDA平板上25 ℃恒温培养。培养3 d为淡黄色圆形菌落,周围呈绒毛状分布;5 d时菌落中间出现褐黑色的颗粒状孢子;7 d时形成圆形褐黑色厚绒状菌落,表面粗糙,外围包裹环状白色绒毛,中心为褐黑色颗粒状,背面为淡黄色,颜色较浅(图3A和3B)。光学显微镜下,该菌顶囊呈大球形,双层小梗呈放射状着生于顶囊表面,长度一致,较为整齐;分生孢子呈褐黑色球形或椭球形(图3C)。就形态特征而言,该菌与曲霉属Aspergillus黑曲霉A. niger高度相似,初步鉴定该菌为黑曲霉[5]。
-
为进一步明确所分离所得到的真菌菌株,用通用引物对该真菌核糖体ITS和RPB2序列进行PCR扩增和电泳检测(图4),对阳性菌落的PCR扩增产物进行测序。NCBI比对结果显示:扩增获得的RPB2和ITS扩增序列都与不同物种来源的黑曲霉同源性最高,达99.6%以上。此外,将从西红花中扩增获得的ITS序列分别与其他物种组织中分离到的黑曲霉、乔治亚青霉P. georgiense、臭曲霉A. foetidus以及曲霉属菌株进行序列进化亲缘关系分析,结果显示(图5):扩增获得的真菌ITS序列A. niger Z2与其他物种组织中获得的黑曲霉ITS序列聚在同一分支上;RPB2序列与黑曲霉亲缘关系较近。基于以上结果,推测本研究从西红花中分离纯化的致病真菌为黑曲霉。
-
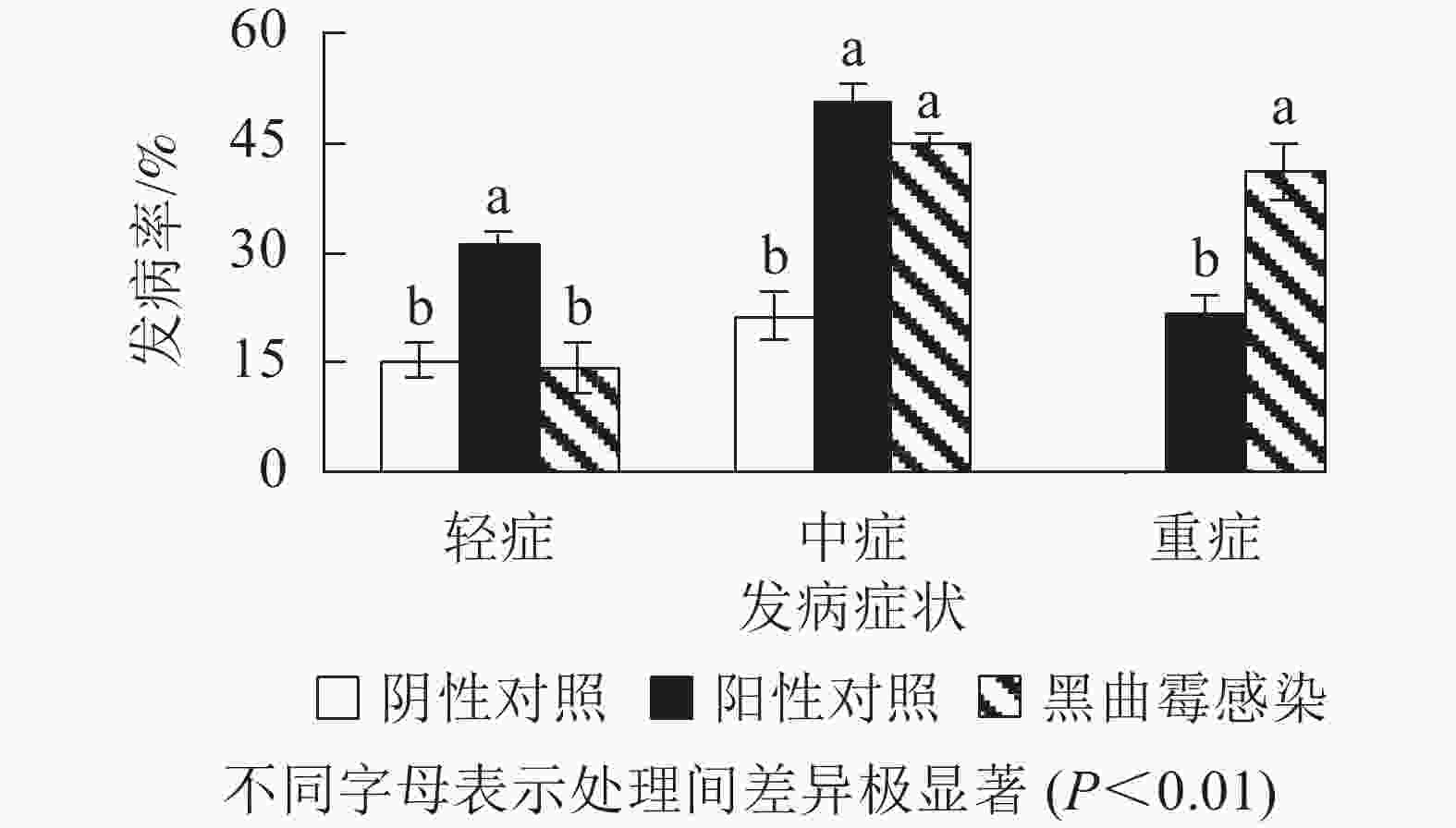
为进一步验证黑曲霉对西红花生长期间植株的致病特性,将分离纯化的黑曲霉接种到生长期为1.5个月、生长势较好、带叶片的西红花育苗箱中,每周1次用黑曲霉稀释菌液浇灌。培养1个月后发现(图6和图7):水浇灌阴性对照西红花种球正常生长,仅有15.3%的轻症和21.3%的中度腐烂症状,无重度腐烂种球。离生青霉菌浇灌阳性对照所有种球均无法正常生长, 其中轻症、中症和重症比例分别为31.0%、50.3%和21.7%;测试组茎腐病发病率同样为100%,其中轻症比例为14.3%、中度腐烂种球为44.7%,重度腐烂种球为41.0%。进一步证实黑曲霉是引起该品种西红花球茎腐烂的致病真菌之一。
-
本研究从浙江省建德市一西红花种植基地患病西红花球茎中分离纯化得到1株病原真菌;形态学、分子生物学和致病性试验鉴定可知:该菌为黑曲霉,是引起该基地西红花球茎腐烂的致病真菌。
黑曲霉为半知菌亚门Deuteromycotina丝孢纲Hyphomycetes丛梗孢科Moniliaceae曲霉属常见种,能引起植物落花或导致多汁果实腐烂[13],抑制植物苗和根的生长[14],产生果实采后病害[15]等。本研究分离得到的黑曲霉可在PDA培养基上快速生长,培养5 d的菌落呈圆形,淡黄色至黑色,与张倩[16]、畅引东等[17]报道的黑曲霉培养初期呈白色的结果存在差异,这可能是所用材料不同所致。光学显微镜下,从‘番红花1号’中分离到的黑曲霉分生孢子呈球形,分生孢子梗壁光滑,顶囊较大,呈球形,产孢梗双层,与黄勋娟等[18]观察到的黑曲霉结构相似。
黑曲霉菌是一种腐生性真菌,通常在有伤口或坏死的植物组织上定殖引起植物组织坏死或是腐烂。田间生产中常用种植前抹芽的方式对西红花种球进行复壮,抹芽产生的伤口极有利于黑曲霉的感染。本研究采用横断面切割产生的伤口接种黑曲霉,证实黑曲霉极容易感染西红花种球,种球腐烂病发生率显著上升。因此,建议种球复壮生产上的抹芽操作最好放在种植前半个月,待伤口愈合后再种植,以减少黑曲霉感染的概率;或是用生防菌剂处理种球后再种植,以减少黑曲霉等腐生性真菌的感染[19]。
细菌、真菌、病毒等微生物都能引起西红花病害,以真菌引起的病害最为常见,造成的经济损失也最为严重[20]。目前已报道从腐烂种球中分离获得的西红花致病真菌包括尖孢镰刀菌、巴西曲霉A. brasiliensis[21−22]、桔青霉菌Penicillium citrinum[23]、链格孢菌Alternaria alternata[22]、离生青霉菌[8]、茄病镰刀菌[7]、炭疽菌[6]、红棕孔韧革菌Porostereum sp.[24]、齐整小核菌Sclerotium rolfsii[25]等。以上研究表明:导致西红花球茎腐烂的致病真菌具有种属多样性。各种致病菌之间是否存在相互作用使球茎腐烂症状加剧以及侵染西红花球茎的机制,还有待进一步研究。
此外,西红花球茎核心致病真菌的分离与鉴定工作也能为球茎腐烂病生防菌剂的开发与精准防控应用提供科学依据。生防菌是存在于土壤或根系表面的微生物,抑制病原菌的作用机制复杂,如拮抗[26]、溶菌、营养和空间竞争[27]、提高植物抗性[28]、促进植物生长[29]、产生抗生素或刺激植物防御反应等都可一定程度抑制病原菌。生产上,生防菌可有效替代化学药剂,降低西红花的发病率,但对环境和寄主却无显著的损伤作用。目前以主要致病菌为功能验证菌株,已成功鉴定的生防真菌包括假单胞菌 Pseudomonas[30]、木霉菌Trichoderma[31] 和芽孢杆菌 Bacillus[32] 等,通过离体和平板对峙等实验中证实其在致病真菌的防控中起显著的拮抗作用。因此,西红花球茎核心致病真菌的分离与鉴定的工作将为特效生防菌剂的开发提供鉴定靶标,具有重要的理论和生产意义。
Isolation and identification of pathogenic fungi of stem rot in Crocus sativus
-
摘要:
目的 真菌性病害是西红花Crocus sativus的主要病害。分离鉴定西红花茎腐病致病菌可为西红花茎腐病科学防控及特效杀菌剂开发提供科学依据。 方法 以‘番红花1号’C. sativus ‘Saffron No. 1’为供试材料,采用组织分离法从感病球茎中分离获得致病真菌。通过PCR扩增、测序与进化树构建对真菌保守内部转录间隔区序列(ITS)和RNA聚合酶 Ⅱ 亚家族(RPB2)基因序列进行同源性比对与进化分析。对感病球茎进行致病菌再分离并回接到植株,验证真菌在种球种植模式下的致病特性。 结果 所分离获得的球茎致病真菌与黑曲霉Aspergillus niger的形态特征高度相似;候选致病真菌的ITS和RPB2保守序列与其他植物来源的黑曲霉同一DNA序列同源性高达99.6%,与黑曲霉处在同一进化分支上;基质种植模式下,接种黑曲霉菌液极显著(P<0.01)增加了西红花球茎的发病率。 结论 黑曲霉是引起西红花种球腐烂的真菌病害之一。图7参32 Abstract:Objective This study, with an investigation into the identification and isolation of the rot disease pathogen of Crocus sativus, the main disease of which is fungal disease, is intended to provide scientific basis for the prevention and control of saffron stem rot and the development of special fungicides. Method First, the pathogenic fungi were isolated from infected corms by tissue separation method using ‘Saffron No. 1’ as the test material. Then an analysis was made of the sequences of conserved internal transcribed spacer (ITS) and RNA polymerase Ⅱ subfamily (RPB2) by PCR amplification, sequencing and phylogenetic tree construction. At last, pathogenic bacteria were isolated from infected corms and grafted back to plants to verify the pathogenic characteristics of fungi under the planting mode of saffron. Result The morphological characteristics of the corm-pathogenic fungi isolated were highly similar to those of Aspergillus niger. The conserved sequences of ITS and RPB2 of the candidate pathogenic fungi had 99.6% homology to the same DNA sequence of A. niger from other plants with the same evolutionary branch. In the soil planting mode, inoculation with A. niger solution significantly increased the incidence of corm (P<0.01). Conclusion A. niger is one of the fungal diseases that cause the rot of saffron bulbs. [Ch, 7 fig. 32 ref.] -
Key words:
- Crocus sativus /
- stem rot /
- corm /
- molecular identification /
- fungal disease /
- Aspergillus niger
-
-
[1] RAHAIEE S, MOINI S, HASHEMI M, et al. Evaluation of antioxidant activities of bioactive compounds and various extracts obtained from saffron (Crocus sativus L. ): a review [J]. J Food Sci Technol, 2015, 52(4): 1881 − 1888. [2] MAGESH V, SINGH J P V, SELVENDIRAN K, et al. Antitumour activity of crocetin in accordance to tumor incidence, antioxidant status, drug metabolizing enzymes and histopathological studies [J]. Mol Cell Biochem, 2006, 287(1): 127 − 135. [3] 邓颖, 郭志刚, 曾兆麟, 等. 藏红花的药理研究进展[J]. 中国中药杂志, 2002, 27(8): 565 − 568. DENG Ying, GUO Zhigang, ZENG Zhaolin, et al. Studies on the pharmacological effects of saffron (Crocus sativus L. ): a review [J]. China J Chin Mater Med, 2002, 27(8): 565 − 568. [4] LIU Tao, TIAN Li, FU Xuefeng, et al. Saffron inhibits the proliferation of hepatocellular carcinoma via inducing cell apoptosis [J]. Panminerva Med, 2020, 62(1): 7 − 12. [5] 杨霞, 曹尚, 于广宇, 等. 黑龙江省高粱炭疽病致病真菌分离与鉴定[J]. 微生物学通报, 2021, 48(5): 1571 − 1579. YANG Xia, CAO Shang, YU Guangyu, et al. Isolation and identification of pathogenic fungi causing sorghum anthracnose in Heilongjiang Province [J]. Microbiol China, 2021, 48(5): 1571 − 1579. [6] 张国辉, 张西平, 张年富, 等. 藏红花球茎腐烂病的病原鉴定及药剂预防[J]. 凯里学院学报, 2009, 27(3): 47 − 49. ZHANG Guohui, ZHANG Xiping, ZHANG Nianfu, et al. Investigation and medicament prevention on stem rot disease of Crocus sativus [J]. J Kaili Univ, 2009, 27(3): 47 − 49. [7] 吴李芳. 西红花球茎腐烂病的致病菌鉴定及其生防菌解淀粉芽孢杆菌C612的筛选和应用[D]. 杭州: 浙江大学, 2017. WU Lifang. Identification of Crocus sativus Corm Rot Pathogenic Fungi and Application on Screening Bacillus amyloliquefaciens C612 [D]. Hangzhou: Zhejiang University, 2017. [8] ZHANG Tong, HUANG Chao, DENG Cangping, et al. First report of corm rot on saffron caused by Penicillium solitum in China [J/OL]. Plant Dis, 2019, 104(2)[2021-11-20]. doi: 10.1094/PDIS-09-19-1927-PDN. [9] 吴威, 刘世禹, 王诗语, 等. 白术内生细菌 AM14 的分离鉴定及其对宿主根腐病的防效研究[J]. 中草药, 2021, 52(10): 3075 − 3080. WU Wei, LIU Shiyu, WANG Shiyu, et al. Isolation and identification of Atractylodes macrocephala endophytic bacteria AM14 and its biological control for host plant root-rot disease [J]. Chin Tradit Herbal Drugs, 2021, 52(10): 3075 − 3080. [10] 黎阳, 张欣怡, 袁梓洢, 等. 引起乙烯褪绿蜜橘果实腐烂的主要致病真菌分离及鉴定[J]. 植物保护学报, 2019, 46(1): 184 − 191. LI Yang, ZHANG Xinyi, YUAN Ziyi, et al. Isolation and identification of main pathogenic fungi causing the decay of ethylene-degreened satsuma mandarin fruit [J]. J Plant Prot, 2019, 46(1): 184 − 191. [11] 韩小敏, 李凤琴. 黑曲霉群菌种多相分类和鉴定方法最新研究进展[J]. 食品与发酵工业, 2020, 46(23): 279 − 285. HAN Xiaomin, LI Fengqin. Advances in the polyphasic classification and identification method of Aspergillus niger isolates [J]. Food Ferment Ind, 2020, 46(23): 279 − 285. [12] 刘丽, 张永军, 许长征, 等. 一种改良的CTAB法提取产多糖真菌DNA[J]. 中国生物工程杂志, 2014, 34(5): 75 − 79. LIU Li, ZHANG Yongjun, XU Changzheng, et al. A modified CTAB method for isolating genome DNA from fungus with abundant polysaccharose [J]. China Biotechnol, 2014, 34(5): 75 − 79. [13] 苟凡铖, 侯怡铃, 宋波, 等. rDNA-ITS 序列分析法和传统分类法对真菌进行分类鉴定[J]. 西华师范大学学报(自然科学版), 2017, 38(4): 382 − 386. GOU Fancheng, HOU Yiling, SONG Bo, et al. The application of rDNA-ITS sequence analysis method and traditional classification method in the classification of fungi [J]. J China West Norm Univ Nat Sci, 2017, 38(4): 382 − 386. [14] 马婷燕, 李彦忠. 32个紫花苜蓿品种的种带真菌种类及致病性研究[J]. 草业学报, 2020, 29(12): 131 − 139. MA Tingyan, LI Yanzhong. Species and pathogenicity of seed-borne fungi in 32 varieties of alfalfa [J]. Acta Pratacult Sin, 2020, 29(12): 131 − 139. [15] 尉莹莹, 梁晨, 赵洪海, 等. 华东地区蓝莓采后病害病原鉴定及其多样性分析[J]. 山东农业科学, 2017, 49(7): 112 − 115. YU Yingying, LIANG Chen, ZHAO Honghai, et al. Pathogen identification and their diversity of blueberry postharvest diseases in east China [J]. Shandong Agric Sci, 2017, 49(7): 112 − 115. [16] 张倩. 甜樱桃采后致腐微生物鉴定及其生防菌筛选和作用机制研究[D]. 泰安: 山东农业大学, 2020. ZHANG Qian. Identification and Biocontrol Mechanism Research of Postharvest Spoilage Microorganisms in Sweet Cherry [D]. Tai’an: Shangdong Agricultural University, 2020. [17] 畅引东, 贾俊, 解宇洁, 等. 石榴果腐病病原的分离鉴定[J]. 山西农业科学, 2020, 48(5): 806 − 811. CHANG Yindong, JIA Jun, XIE Yujie, et al. Isolation and identification of pathogen of pomegranate fruit rot [J]. J Shanxi Agric Sci, 2020, 48(5): 806 − 811. [18] 黄勋娟, 刁宁宁, 张建国. 黑曲霉菌丝球的形成及应用研究综述[J]. 食品与发酵工业, 2014, 40(11): 171 − 176. HUANG Xunjuan, DIAO Ningning, ZHANG Jianguo. Review on the formation of Aspergillus niger pellets and its application [J]. Food Ferment Ind, 2014, 40(11): 171 − 176. [19] SAMSOM R A, VISAGIE C M, HOUBRAKEN J, et al. Phylogeny, identification and nomenclature of the genus Aspergillus [J]. Stud Mycol, 2014, 78: 141 − 173. [20] 王梧嵋. 植物病原真菌效应蛋白研究进展[J]. 农业技术与装备, 2020, 368(8): 52 − 54. WANG Wumei. Studies on effector proteins of plant pathogenic fungi [J]. Agric Technol Equip, 2020, 368(8): 52 − 54. [21] 杜雪, 李秀娟, 桂思琦, 等. 西红花真菌性病害与生防菌鉴定研究进展[J]. 浙江农林大学学报, 2021, 38(6): 1279 − 1288. DU Xue, LI Xiujuan, GUI Siqi, et al. Research progress of fungal diseases in Crocus sativus and identification of biocontrol bacteria [J]. J Zhejiang A&F Univ, 2021, 38(6): 1279 − 1288. [22] 邹凤莲, 汪志平, 卢钢. 番红花链格孢菌的分离及其生物学特性研究[J]. 浙江大学学报(农业与生命科学版), 2006, 32(2): 162 − 167. ZOU Fenglian, WANG Zhiping, LU Gang. Studies on biological characteristics of Alternaria alternata obtained from the corms of Crocus sativus L. [J]. J ZhejiangUniv Agric Life Sci, 2006, 32(2): 162 − 167. [23] 王海玲. 西红花花柱离体培养技术及培养物特征特性的研究[D]. 苏州: 苏州大学, 2011. WANG Hailing. Study on Technique System of Tissue Culture and Characteristics of Cultures from Style in Crocus sativus L. [D]. Suzhou: Soochow University, 2011. [24] WANI Z A, AHMAD T, NALLI Y, et al. Porostereum sp., associated with saffron (Crocus sativus L. ), is a latent pathogen capable of producing phytotoxic chlorinated aromatic compounds [J]. Curr Microbiol, 2018, 75(7): 880 − 887. [25] KALHA C S, GUPTA V, GUPTA D, et al. First report of sclerotial rot of saffron caused by Sclerotium rolfsii in India [J]. Plant Dis, 2007, 91(9): 1203. [26] ROMERO D, de VICENTE A, RAKOTOALY R H, et al. The iturin and fengycin families of lipopeptides are key factors in antagonism of Bacillus subtilis toward Podosphaera fusca [J]. Mol Plant Microbe Interact, 2007, 20(4): 430 − 440. [27] 周洋子. 产脂肽类菌株 QHZ-3 对马铃薯黑痣病的生防效果及其机理研究[D]. 兰州: 甘肃农业大学, 2020. ZHOU Yangzi. Studies on the Biocontrol Effects and Mechanism of Lipopolypeptide Producing Strain QHZ-3 on Black Scurf Disease of Potato [D]. Lanzhou: Gansu Agricultural University, 2020. [28] 叶旻硕, 马艳, 黄有军. 生防芽孢杆菌防控辣椒疫病研究进展[J]. 中国农学通报, 2020, 36(15): 123 − 129. YE Minshuo, MA Yan, HUANG Youjun. The control of pepper blight by Bacillus spp. : research progress [J]. Chin Agric Sci Bull, 2020, 36(15): 123 − 129. [29] 要雅倩, 成娜娜, 李培根, 等. 解淀粉芽胞杆菌 Bacillus amyloliquefaciens T-6 的分离鉴定及抗病促生潜力[J]. 生物技术通报, 2020, 36(9): 202 − 210. YAO Yaqian, CHENG Nana, LI Peigen, et al. Isolation and identification of Bacillus amyloliquefaciens T-6 and its potential of resisting disease and promoting growth [J]. Biotechnol Bullet, 2020, 36(9): 202 − 210. [30] KONG H G, KIM N H, LEE S Y, et al. Impact of a recombinant biocontrol bacterium, Pseudomonas fluorescens pc78, on microbial community in tomato rhizosphere [J]. Plant Pathol J, 2016, 32(2): 136 − 144. [31] SOOD M, KAPOOR D, KUMAR V, et al. Trichoderma: the “secrets”of a multitalented biocontrol agent [J]. Plants, 2020, 9(6): E762[2021-11-20]. doi: 10.3390/plants9060762. [32] TIAN Lei, SHI Shaohua, JI Li, et al. Effect of the biocontrol bacterium Bacillus amyloliquefaciens on the rhizosphere in ginseng plantings [J]. Int Microbiol, 2018, 21: 153 − 162. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210768






 下载:
下载: