-
在以往的认知中,仅用活体微生物量来评估微生物活动过程对土壤有机质的贡献,无法真正反映微生物对有机质的固持作用,导致了微生物来源碳组分对土壤有机质的贡献长期被低估。微生物死亡残体对于土壤有机质长期固存和积累有重要意义,不能仅以细菌和真菌的生物量来衡量微生物对土壤有机质累积的贡献[1]。氨基糖是土壤中微生物死亡残体的特异性生物标志物。植物不含大量的氨基糖,相对于与土壤中微生物死亡残体结合的氨基糖而言,微生物生物量中的游离氨基糖很少[2]。因此,微生物细胞壁成分水解的结合氨基糖已被广泛用作微生物残基的替代物[3]。JOERGENSEN等[4]指出:在土壤微生物中已鉴定出26种氨基糖,但大多数研究仅量化了葡萄糖、半乳糖、胞壁酸、甘露糖等4种土壤氨基糖,且葡萄糖主要存在于真菌细胞的几丁质中,胞壁酸主要存在于细菌细胞壁的肽聚糖中。
氨基糖在调控有机碳库方面也发挥着重要作用[5]。土壤碳库常以土壤有机质为稳定的存在形式,而至少有一半的土壤有机质来源于微生物死亡残体,微生物可作为碳泵发挥续埋作用,从而促进土壤固碳过程[6−8]。同时,氨基糖也影响着土壤氮素留存过程[9]。土壤微生物利用进入微生物氮转化循环的氮元素合成自身细胞,而当微生物细胞凋亡后,这些氮素将以氨基糖等形式储存在土壤之中。此外,在土壤养分缺乏时,氨基糖也能作为有效氮素以供微生物细胞使用[10]。随着分析测定技术逐渐发展完善,将氨基糖作为微生物标志物来研究土壤功能逐渐成为热点,氨基糖也已被应用于评估各种生态系统中微生物对土壤有机质的贡献[11−12]。但氨基糖积累与生物、非生物因素之间相互关系及耦联机制尚不清晰,仍无法通过调节某一影响因素来增加土壤氨基糖。
本研究将树种多样性、优势树种重要值与土壤氨基糖质量分数变化联系起来,综合不同树种多样性、不同优势树种重要值及土壤理化性质下30个样地的土壤氨基糖的测量结果,试图回答以下科学问题:①树种多样性和优势树种重要值如何影响土壤氨基糖质量分数?②与土壤理化性质相比,是树种多样性还是优势树种重要值对土壤氨基糖积累的贡献更大?
-
样地位于黑龙江省哈尔滨市香坊区东北林业大学实验林场(45°42′~45°44′N,127°35′~127°39′E),海拔136~140 m。地处寒温带半湿润半干旱区,年平均气温为3.6 ℃,年平均降水量为600.0 mm。原生植被为榆树Ulmus pumila疏林草原,于20世纪60年代初进行人工补苗,经自然更新和演替后,自然混交带状分布明显。当前实验林场内主要有落叶松 Larix gmelinii 、暴马丁香 Syringa reticulata、 樟子松Pinus sylvestris、黄檗Phellodendron amurense、榆树、水曲柳Fraxinus mandshurica、胡桃楸 Juglans mandshurica、蒙古栎Quercus mongolica、黑皮油松Pinus tabuliformis var. mukdensis、金银忍冬Lonicera maackii、梣叶槭Acer negundo等乔灌木20多种[13]。
在实验林场的中心区域建立1块7.2 hm2 (300 m × 240 m) 的永久地块,并于2018年8月将其划分为720个样方 (10 m ×10 m)。每个样方中的所有木本植物 (胸径≥1 cm)均按物种分类,记录名称、个体高度、净树干高度、乔木的胸径以及灌木高度、灌木胸径[14]。进一步应用聚类分析将720个样方划分为9个关键树种相关的森林类型。2018年8月在每个样方中心使用挖穴机挖出 1 m深土壤剖面的土壤,采集 0~20 cm深度土壤样品,风干后过20目土壤筛,拣去大的土壤颗粒和植物枯枝碎屑,再用粉碎机研磨过60目土壤筛,装瓶备用,并根据聚类分析结果筛选出30个样地的土样,测定土壤氨基糖及碳、氮、pH及电导率。
-
土壤有机碳 (SOC)采用重铬酸钾外加热法测定,土壤全氮 (TN)采用半微量凯氏定氮法测定, 土壤酸碱度(pH)用酸度计测定(水土质量比为5∶1),土壤电导率 (EC)采用电导法测定[15]。
土壤氨基糖质量分数采用盐酸水解,经纯化后,气相色谱法测定[16]。即将0.4 g土壤样品与10 mL 6 mol·L−1盐酸于105 ℃下水解,过滤后加入100 μL肌醇 (内标),干燥后将pH调至6.6~6.8,离心取上清液,再次冻干后用无水甲醇溶解残留物,离心后转移到衍生瓶内,在45 ℃下用氮气(N2)吹干,加入1 mL超纯水和 100 μL 内标 2 (N-甲基氨基葡萄糖,MGlcN),冻干后进行衍生,利用气相色谱法测定[17]。土壤氨基糖指标包括葡萄糖 (Glu)、半乳糖 (Gal)、胞壁酸 (Mur)、总氨基糖 (TA)、葡萄糖/总氨基糖(Glu/TA)、半乳糖/总氨基糖(Gal/TA)、胞壁酸/总氨基糖 (Mur/TA)。
-
依据马克平等[18]的方法计算每个样地中的Shannon-Wiener指数、Simpson指数、Patrick丰富度指数、Pielou均匀度指数。依据WANG等[19]的方法计算样方中树种的重要值、相对多度、相对频度和相对显著度。
-
数据统计分析采用SPSS 22.0软件,绘图采用Origin 2018 和Canoco 5.0软件。应用Pearson相关方法分析土壤氨基糖质量分数与影响因素的相关性。采用方差分解法 (variance partitioning)、冗余分析 (RDA)和蒙特卡罗检验 (Monte Carlo Hypothesis Testing)解析土壤理化性质、植物多样性指数、9个树种的重要值对土壤氨基糖积累的贡献和耦合关系。
-
由表1可知:30个样地的土壤电导率、pH、有机碳和全氮分别为30.69~101.43 μs·cm−1、4.87~6.71、14.42~100.31 g·kg−1和0.34~2.31g·kg−1。样地中Shannon-Wiener 指数、Simpson指数、Pielou均匀率指数和Patrick丰富度指数分别为0~2.12、0~0.86、0~0.92和1.00~10.00,均值分别为1.24、0.61、0.73和5.63。
表 1 30个样地的土壤理化性质及树种多样性指标
Table 1. Soil physicochemical index values and diversity index values of tree species in 30 plots
样地号 电导率/
(μs·cm−1)pH 有机碳/
(g·kg−1)全氮/
(g·kg−1)Shannon-
Wiener
指数Simpson
指数Pielou
均匀度
指数Patrick
丰富度
指数样地号 电导率/
(μs·cm−1)pH 有机碳/
(g·kg−1)全氮/
(g·kg−1)Shannon-
Wiener
指数Simpson
指数Pielou
均匀度
指数Patrick
丰富度
指数1 46.92 6.14 24.65 0.71 0.00 0.00 0.00 1.00 17 39.12 5.52 32.43 1.78 1.75 0.80 0.90 7.00 2 46.74 6.17 17.63 0.71 0.67 0.48 0.97 2.00 18 76.15 6.60 24.66 1.13 1.17 0.63 0.84 4.00 3 41.65 5.76 23.10 0.92 1.07 0.65 0.98 3.00 19 64.39 5.80 48.87 1.53 0.41 0.24 0.59 2.00 4 44.90 5.96 26.14 0.67 1.16 0.56 0.72 5.00 20 75.88 6.22 61.29 0.59 1.59 0.69 0.76 8.00 5 97.67 5.48 41.92 1.01 1.77 0.76 0.77 10.00 21 95.36 6.24 68.42 1.78 1.31 0.68 0.81 5.00 6 30.79 5.86 14.42 0.70 0.24 0.12 0.35 2.00 22 70.70 6.71 28.81 2.11 1.58 0.75 0.88 6.00 7 48.94 5.06 100.31 1.79 1.70 0.79 0.88 7.00 23 101.43 6.23 56.75 1.54 1.19 0.65 0.86 4.00 8 43.31 5.79 38.80 1.50 1.25 0.70 0.90 4.00 24 49.39 6.28 27.31 1.37 1.21 0.63 0.75 5.00 9 36.16 5.02 38.23 1.61 1.44 0.65 0.74 7.00 25 56.65 5.96 45.60 1.34 0.73 0.42 0.66 3.00 10 57.18 5.38 37.56 1.16 1.20 0.62 0.75 5.00 26 76.50 6.21 57.60 1.78 2.00 0.85 0.91 9.00 11 30.69 5.86 19.79 0.73 0.00 0.00 0.00 1.00 27 68.02 5.52 69.13 1.82 1.59 0.74 0.76 8.00 12 57.74 4.87 34.29 0.97 1.30 0.68 0.81 5.00 28 47.71 5.89 31.18 1.67 1.14 0.46 0.49 10.00 13 55.11 5.28 42.61 1.20 1.47 0.71 0.75 7.00 29 66.48 6.23 40.27 2.31 1.84 0.82 0.88 8.00 14 69.02 6.32 29.48 1.92 1.81 0.77 0.82 9.00 30 56.49 5.98 46.95 1.92 2.12 0.86 0.92 10.00 15 55.43 5.65 50.68 0.34 1.66 0.79 0.93 6.00 均值 59.54 5.87 41.22 1.33 1.24 0.61 0.73 5.63 16 79.58 6.08 57.78 1.20 0.97 0.87 0.54 6.00 通过计算各样方树种重要值(表2),筛选出重要值排名前9位的树种,分别是樟子松、黄檗、榆树、水曲柳、胡桃楸、蒙古栎、黑皮油松、金银忍冬、梣叶槭。经计算可知:研究区域内9种树种的重要值均值排序由大到小依次为水曲柳(0.17)、黄檗(0.14)、蒙古栎(0.10)、胡桃楸(0.10)、榆树(0.09)、金银忍冬(0.08)、黑皮油松(0.07)、樟子松(0.06 )、梣叶槭(0.04)。
表 2 30个样地的优势树种重要值
Table 2. Important values of tree species index in 30 plots
样地号 樟子松 黑皮
油松水曲柳 黄檗 梣叶槭 金银
忍冬蒙古栎 榆树 胡桃楸 样地号 樟子松 黑皮
油松水曲柳 黄檗 梣叶槭 金银
忍冬蒙古栎 榆树 胡桃楸 1 0.00 1.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 17 0.00 0.00 0.14 0.30 0.00 0.15 0.00 0.26 0.08 2 0.00 0.28 0.28 0.00 0.00 0.00 0.00 0.00 0.00 18 0.00 0.00 0.48 0.00 0.10 0.00 0.00 0.21 0.00 3 0.49 0.00 0.32 0.19 0.00 0.00 0.00 0.00 0.00 19 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.87 4 0.07 0.40 0.13 0.00 0.00 0.00 0.00 0.00 0.00 20 0.00 0.00 0.29 0.23 0.00 0.08 0.00 0.11 0.24 5 0.00 0.00 0.19 0.11 0.20 0.06 0.05 0.09 0.00 21 0.00 0.00 0.00 0.43 0.00 0.13 0.00 0.00 0.13 6 0.00 0.00 0.00 0.22 0.00 0.00 0.78 0.00 0.00 22 0.00 0.00 0.47 0.00 0.11 0.10 0.00 0.24 0.00 7 0.00 0.00 0.19 0.13 0.16 0.13 0.07 0.00 0.00 23 0.00 0.00 0.00 0.22 0.00 0.39 0.00 0.17 0.22 8 0.00 0.00 0.31 0.00 0.24 0.10 0.00 0.00 0.00 24 0.00 0.00 0.53 0.10 0.00 0.00 0.00 0.00 0.29 9 0.52 0.00 0.12 0.09 0.00 0.07 0.07 0.12 0.00 25 0.00 0.00 0.64 0.12 0.00 0.00 0.00 0.00 0.24 10 0.53 0.00 0.17 0.00 0.00 0.08 0.08 0.14 0.00 26 0.00 0.00 0.16 0.42 0.06 0.12 0.06 0.00 0.11 11 0.00 0.00 0.00 0.00 0.00 0.00 1.00 0.00 0.00 27 0.00 0.00 0.12 0.09 0.00 0.19 0.05 0.15 0.11 12 0.00 0.00 0.00 0.11 0.00 0.00 0.40 0.30 0.00 28 0.00 0.00 0.09 0.13 0.05 0.30 0.00 0.06 0.05 13 0.00 0.00 0.13 0.17 0.00 0.00 0.07 0.32 0.27 29 0.00 0.00 0.00 0.39 0.11 0.14 0.07 0.00 0.13 14 0.00 0.00 0.11 0.11 0.20 0.08 0.00 0.14 0.05 30 0.00 0.00 0.13 0.29 0.06 0.08 0.05 0.14 0.06 15 0.00 0.40 0.22 0.00 0.00 0.00 0.10 0.12 0.08 均值 0.06 0.07 0.17 0.14 0.04 0.08 0.10 0.09 0.10 16 0.29 0.00 0.00 0.21 0.00 0.14 0.09 0.10 0.00 如表3所示:30个样地中土壤葡萄糖质量分数为 0.41~1.15 g·kg−1,半乳糖为0.13~0.49 g·kg−1, 胞壁酸为0.02~0.1 g·kg−1、总氨基糖为0.59~1.74 g·kg−1;土壤氨基糖、半乳糖、胞壁酸和总氨基糖质量分数的均值分别为0.79、0.33、0.06和1.17 g·kg−1。
表 3 30个样地的土壤氨基糖指标
Table 3. Values of soil amino sugar indexes in 30 plots
样地
号葡萄糖/
(g·kg−1)半乳糖/
(g·kg−1)胞壁酸/
(g·kg−1)总氨基糖/
(g·kg−1)葡萄糖/
总氨基糖半乳糖/
总氨基糖胞壁酸/
总氨基糖样地
号葡萄糖/
(g·kg−1)半乳糖/
(g·kg−1)胞壁酸/
(g·kg−1)总氨基糖/
(g·kg−1)葡萄糖/
总氨基糖半乳糖/
总氨基糖胞壁酸/
总氨基糖1 0.44 0.14 0.04 0.62 0.70 0.23 0.07 17 0.63 0.23 0.03 0.89 0.71 0.26 0.03 2 0.41 0.15 0.03 0.59 0.69 0.26 0.05 18 0.77 0.34 0.06 1.16 0.66 0.29 0.05 3 0.51 0.21 0.04 0.76 0.67 0.28 0.05 19 0.96 0.44 0.06 1.46 0.66 0.30 0.04 4 0.42 0.17 0.03 0.61 0.68 0.27 0.05 20 1.05 0.41 0.05 1.51 0.69 0.27 0.03 5 0.76 0.36 0.06 1.19 0.64 0.31 0.05 21 1.04 0.42 0.07 1.53 0.68 0.28 0.05 6 0.44 0.13 0.04 0.60 0.72 0.21 0.06 22 1.05 0.49 0.07 1.61 0.65 0.30 0.05 7 0.97 0.48 0.09 1.54 0.63 0.31 0.06 23 0.91 0.32 0.07 1.30 0.70 0.24 0.06 8 0.79 0.37 0.07 1.23 0.64 0.30 0.06 24 0.94 0.43 0.07 1.44 0.66 0.30 0.05 9 0.99 0.37 0.07 1.43 0.69 0.26 0.05 25 0.92 0.39 0.07 1.39 0.66 0.28 0.05 10 0.69 0.28 0.05 1.02 0.68 0.27 0.05 26 1.03 0.40 0.08 1.51 0.68 0.26 0.05 11 0.47 0.14 0.05 0.66 0.72 0.21 0.07 27 1.00 0.39 0.08 1.47 0.68 0.27 0.05 12 0.51 0.19 0.05 0.75 0.68 0.25 0.07 28 0.88 0.37 0.07 1.33 0.66 0.28 0.05 13 0.81 0.33 0.05 1.20 0.68 0.28 0.05 29 1.15 0.49 0.10 1.74 0.66 0.28 0.05 14 0.89 0.43 0.07 1.38 0.64 0.31 0.05 30 1.03 0.46 0.09 1.57 0.65 0.29 0.05 15 0.50 0.21 0.02 0.73 0.68 0.29 0.03 均值 0.79 0.33 0.06 1.17 0.68 0.27 0.05 16 0.70 0.27 0.06 1.04 0.68 0.26 0.06 -
由表4可知:土壤总氨基糖和氨基葡萄糖与土壤电导率、土壤总有机碳质量分数和土壤全氮质量分数呈极显著正相关(P<0.01)。土壤氨基半乳糖和胞壁酸与土壤总有机碳质量分数和土壤全氮质量分数呈极显著正相关(P<0.01),与土壤电导率呈显著正相关(P<0.05)。土壤pH与氨基糖指标均无显著相关关系。
表 4 土壤理化性质与土壤氨基糖质量分数的相关性
Table 4. Correlation coefficients between soil amino sugar contents and soil properties
土壤理化性质 氨基葡萄糖 氨基半乳糖 胞壁酸 总氨基糖 氨基葡萄糖/总氨基糖 氨基半乳糖/总氨基糖 胞壁酸/总氨基糖 电导率 0.486** 0.448* 0.367* 0.476** −0.264 0.305 −0.199 酸碱度 0.196 0.197 0.075 0.194 −0.053 0.104 −0.155 总有机碳 0.566** 0.534** 0.528** 0.563** −0.301 0.318 −0.145 全氮 0.780** 0.773** 0.791** 0.791** −0.457* 0.427* −0.070 说明:* P<0.05;** P<0.01。 -
由表5可知:Shannon-Wiener指数与氨基葡萄糖、氨基半乳糖、总氨基糖和氨基半乳糖/总氨基糖极显著正相关(P<0.01),与胞壁酸和氨基葡萄糖/总氨基糖显著正相关(P<0.05),与胞壁酸/总氨基糖极显著负相关(P<0.01),与氨基葡萄糖/总氨基糖显著负相关(P<0.05)。Simpson 指数与氨基葡萄糖、氨基半乳糖、氨基半乳糖/总氨基糖和总氨基糖极显著正相关(P<0.01),与氨基葡萄糖/总氨基糖、胞壁酸/总氨基糖显著负相关(P<0.05)。Patrick丰富度指数与氨基半乳糖、总氨基糖显著正相关,与氨基葡萄糖/总氨基糖显著负相关(P<0.05),与氨基半乳糖/总氨基糖极显著正相关,与胞壁酸/总氨基糖极显著负相关(P<0.01)。Pielou指数同氨基葡萄糖、氨基半乳糖、总氨基糖和氨基半乳糖/总氨基糖极显著正相关(P<0.01),与胞壁酸显著正相关,而与氨基葡萄糖/总氨基糖呈显著负相关(P<0.05)。
表 5 土壤氨基糖质量分数和树种多样性指标的相关性
Table 5. Correlation coefficients between soil amino sugar contents and tree species diversity indexes
多样性指数 氨基葡萄糖 氨基半乳糖 胞壁酸 总氨基糖 氨基葡萄糖/总氨基糖 氨基半乳糖/总氨基糖 胞壁酸/总氨基糖 Shannon-Wiener指数 0.560** 0.588** 0.399* 0.570** −0.452* 0.573** −0.474** Simpson指数 0.473** 0.508** 0.333 0.485** −0.458* 0.574** −0.461* Patrick丰富度指数 0.356 0.423* 0.182 0.374* −0.455* 0.601** −0.540** Pielou均匀度指数 0.572** 0.577** 0.452* 0.577** −0.397* 0.475** −0.341 说明:* P<0.05;** P<0.01。 -
由表6可知:所有的氨基糖指标与樟子松和榆树这2种树种的重要值均无显著相关性。氨基葡萄糖、氨基半乳糖、胞壁酸和总氨基糖与黑皮油松重要值呈极显著负相关(P<0.01)。氨基葡萄糖与黄檗、金银忍冬、胡桃楸重要值均显著正相关(P<0.05),与蒙古栎重要值呈显著负相关(P<0.05)。氨基半乳糖与梣叶槭重要值极显著正相关(P<0.01),与蒙古栎重要值极显著负相关(P<0.01)。胞壁酸与梣叶槭重要值呈显著正相关(P<0.05),与金银忍冬重要值极显著正相关(P<0.01)。总氨基糖与黄檗、梣叶槭、金银忍冬、胡桃楸重要值呈显著正相关(P<0.05),与黑皮油松和蒙古栎重要值分别呈极显著负相关(P<0.01)和显著负相关(P<0.05)。胞壁酸/总氨基糖仅与蒙古栎重要值极显著正相关(P<0.01),与其他8种树种的重要值均无显著的相关性。
表 6 树种重要值与土壤氨基糖指标的相关性分析
Table 6. Correlation of important value of tree species and soil amino sugar index
氨基糖 樟子松 黑皮油松 水曲柳 黄檗 梣叶槭 金银忍冬 蒙古栎 榆树 胡桃楸 氨基葡萄糖 −0.122 −0.515** 0.150 0.442* 0.297 0.460* −0.417* 0.056 0.370* 氨基半乳糖 −0.162 −0.491** 0.262 0.303 0.471** 0.349 −0.489** 0.026 0.360 胞壁酸 −0.114 −0.466** 0.012 0.359 0.432* 0.466** −0.188 −0.084 0.150 总氨基糖 −0.137 −0.513** 0.181 0.400* 0.365* 0.432* −0.435* 0.040 0.362* 葡萄糖/总氨基糖 0.092 0.262 −0.397* 0.142 −0.715** −0.025 0.514** 0.048 −0.125 半乳糖/总氨基糖 −0.079 −0.260 0.479** −0.085 0.605** 0.030 −0.678** 0.046 0.234 胞壁酸/总氨基糖 −0.004 0.081 −0.351 −0.105 0.060 −0.021 0.607** −0.234 −0.333 说明:* P<0.05;** P<0.01。 -
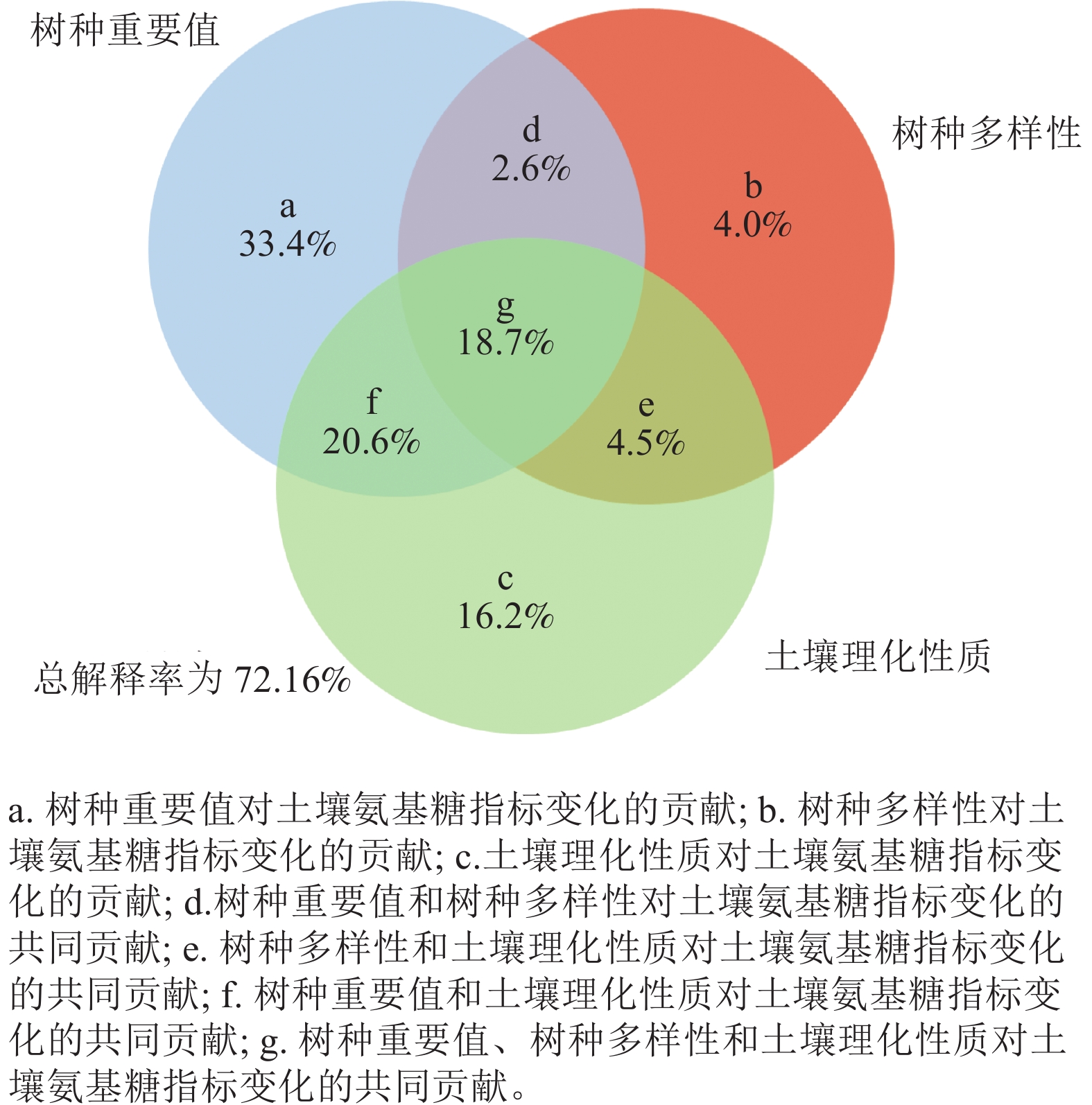
方差分解分析表明:树种重要值、树种多样性和土壤理化性质对土壤氨基糖积累的贡献程度不同,土壤氨基糖质量分数差异大部分由树种重要值解释,解释程度达到33.4%,其次是土壤理化性质(16.2%)和树种多样性(4.0%)(图1),3组因素交互作用能解释18.7%的土壤氨基糖质量分数差异。3组变量对土壤氨基糖质量分数变化的差异总解释率达到72.1%。
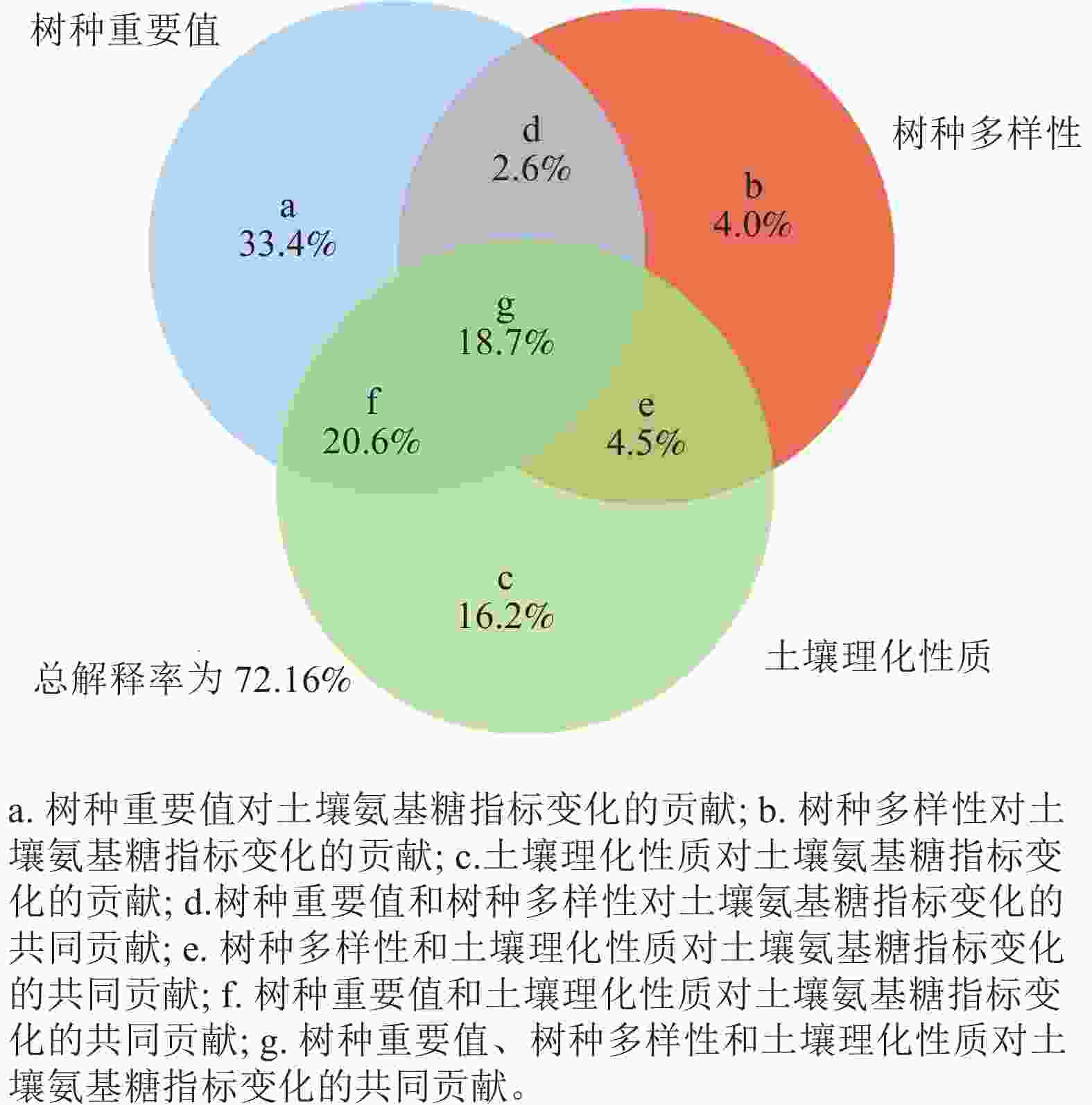
图 1 树种重要值、树种多样性及土壤理化性质对土壤氨基糖贡献的方差分解分析
Figure 1. Variance partitioning analysis between important values of tree species, tree species diversity and soil physical and chemical properties
冗余分析结果如图2所示。第1轴解释91.97%的变化,第2轴解释0.69%的变化。蒙特卡罗检验结果表明:土壤全氮对氨基糖质量分数变化的解释程度最大,解释率达61.7%(P<0.01),即土壤全氮是土壤氨基糖积累的最大驱动因子;其次是土壤有机碳、水曲柳重要值、胡桃楸重要值和Patrick丰富度指数,解释率分别为9.8%、6.0%、4.1%和3.9% (表7)。
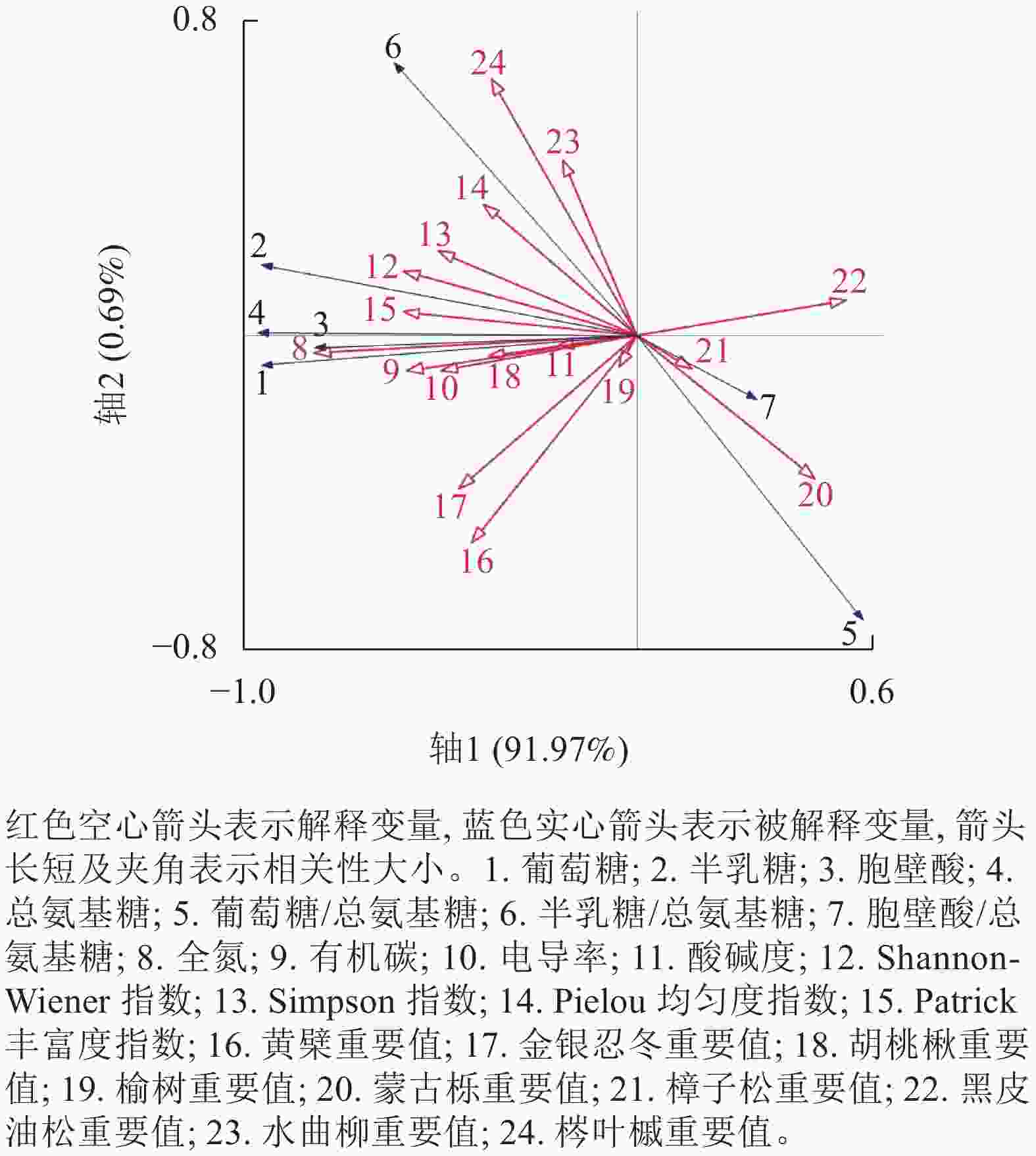
图 2 氨基糖质量分数与树种重要值、树种多样性、土壤理化性质的冗余排序
Figure 2. RDA ordination between amino sugars parameters and species dominance, species diversity and soil properties
表 7 影响因子的蒙特卡罗检验
Table 7. Monte Carlo test of influencing factors
影响因子 解释率/% F P 影响因子 解释率/% F P 土壤全氮 61.7 66.5 0.002 梣叶槭重要值 0.8 0.9 0.180 土壤有机碳 9.8 10.5 0.010 电导率 0.6 0.6 0.292 水曲柳重要值 6.0 6.4 0.010 Shannon-Wiener指数 0.3 0.3 0.458 胡桃楸重要值 4.1 4.5 0.056 金银忍冬重要值 0.1 0.1 0.610 Patrick丰富度指数 3.9 4.2 0.026 黄檗重要值 <0.1 <0.1 0.800 酸碱度 1.9 2.0 0.072 榆树重要值 <0.1 <0.1 0.714 Simpson指数 1.2 1.3 0.148 黑皮油松重要值 <0.1 <0.1 0.946 樟子松重要值 1.3 1.4 0.116 Pielou均匀度指数 <0.1 <0.1 0.928 蒙古栎重要值 0.9 1.0 0.196 -
土壤理化性质、树种重要值、树种多样性均会对土壤氨基糖产生不同程度的影响。GLASER等[20]研究发现:土壤氨基糖与土壤全氮、土壤有机碳显著相关;NI等[21]发现:土壤全氮能驱动氨基糖质量分数发生变化。上述结果均与本研究中土壤氨基糖与土壤全氮、有机碳质量分数显著相关的结果一致。在NI等[21]的研究中还发现了土壤pH对表层土壤氨基糖质量分数有消极影响,而在本研究中,土壤pH与氨基糖并无显著相关性,原因可能是在本研究中未设置不同的pH梯度。JIA等[17]研究表明:物种丰富度升高,增加了枯枝落叶输入,也可能增加可溶性有机质和有效氮可用性,从而刺激微生物活性并促进土壤有机碳积累的微生物途径,促使氨基糖质量分数增加。这与本研究中土壤氨基糖质量分数随树种多样性升高而升高的结果一致。
树种多样性与土壤碳、氮固存关系及其相互作用机制是近几年来的研究热点。SHEN等[22]的研究也表明:树种多样性在一定程度上增加了土壤碳储量和养分状况。较高的植物多样性,往往有着高微生物分泌物多样性,土壤微生物可利用的底物增多,使得微生物分泌物及其残留物也增多[23],有助于土壤有机质的累积。不同树种对氨基糖的积累也有不同影响。井艳丽等[24]研究表明:固氮树种赤杨Alnus sibirica引入单一辽东落叶松Larix kaempferi林,增加了植物丰富度,同时也增加了凋落物输入和土壤可利用的速效氮,进而刺激了土壤微生物,最终使氨基糖质量分数增高。本研究结果表明:黑皮油松、蒙古栎的重要值与氨基糖质量分数均呈负相关,对氨基糖变化有反向作用;而水曲柳、梣叶槭、黄檗、金银忍冬等的重要值均与氨基糖质量分数呈正相关,对氨基糖变化有显著的正向作用。这可能与树种本身的固碳、固氮能力或自身性状有关。
土壤氨基糖源于土壤微生物死亡残体,作为解释生物、非生物因素与土壤碳氮循环之间关系的重要指标,能有效指示土壤微生物在土壤碳氮固持中的作用。在人工育林过程中,可将梣叶槭、水曲柳、黄檗、胡桃楸等有助于土壤氨基糖积累的树种引入到单一树种人工林中,合理调配森林树种组成,提高森林树种多样性,促使土壤氨基糖质量分数增高,提高森林土壤碳氮固存能力。
-
本研究人工林表层土壤(0~20 cm)中氨基糖质量分数主要受优势树种重要值的影响,其解释率高达35.4%,显著高于树种多样性(6.4%)和土壤理化性质(17.2%)的解释率。植物物种丰富度是土壤氨基糖质量分数变化的最大解释因子,土壤葡萄糖、土壤半乳糖、土壤胞壁酸和土壤总氨基糖质量分数均随着树种多样性的升高而升高。黄檗、水曲柳、榆树有助于土壤葡萄糖、土壤半乳糖和土壤总氨基糖的积累,樟子松和蒙古栎不利于土壤葡萄糖、土壤半乳糖和土壤总氨基糖的积累,金银忍冬、梣叶槭有利于土壤胞壁酸的积累,而黑皮油松不利于土壤胞壁酸的积累。可将梣叶槭、黄檗、胡桃楸等有助于土壤氨基糖积累的树种引入到单一树种人工林中,合理调配森林树种组成,提高森林树种多样性,促使土壤氨基糖质量分数增高。
Effects of tree species importance, diversity and soil physicochemical properties on soil amino sugars
-
摘要:
目的 土壤氨基糖是土壤微生物死亡残体的特异性标志物,对土壤碳、氮固存有重要作用。探究树种多样性和优势树种重要值对土壤氨基糖的影响机制。 方法 以东北林业大学实验林场为研究样地,采取0~20 cm的表层土壤,测定土壤葡萄糖(Glu)、土壤半乳糖(Gal)、土壤胞壁酸(Mur)及土壤总氨基糖 (TA)质量分数,计算样地内树种多样性指数和优势树种重要值,通过相关分析、冗余分析、方差分解分析研究确定影响土壤氨基糖的主要因素及其贡献程度。 结果 ①土壤葡萄糖、土壤半乳糖、土壤胞壁酸、土壤总氨基糖质量分数与土壤全氮质量分数、土壤电导率和土壤有机碳质量分数显著正相关(P<0.05);②土壤葡萄糖、土壤半乳糖、土壤胞壁酸、土壤总氨基糖质量分数与黑皮油松Pinus tabuliformis var. mukdensis重要值显著负相关(P<0.01);土壤葡萄糖、土壤半乳糖、土壤总氨基糖质量分数与蒙古栎Quercus mongolica重要值显著负相关(P<0.05);土壤葡萄糖、土壤总氨基糖质量分数与黄檗Phellodendron amurense、金银忍冬Lonicera maackii、胡桃楸Juglans mandshurica重要值均显著正相关(P<0.05);土壤半乳糖、土壤胞壁酸、土壤总氨基糖质量分数与梣叶槭Acer negund重要值显著正相关(P<0.05)。冗余分析发现:黑皮油松、蒙古栎不利于氨基糖积累,而黄檗、梣叶槭、金银忍冬、胡桃楸有利于土壤氨基糖的积累。③方差分解分析表明:树种重要值对土壤氨基糖质量分数变化的贡献程度(35.4%)显著高于树种多样性(6.4%)和土壤理化性质(17.2%)。 结论 通过增加梣叶槭、金银忍冬、黄檗和胡桃楸等树种来为维持较高的树种多样性,能更好地促进人工林土壤氨基糖的积累,进而改善土壤碳氮固存能力。图2表7参24 Abstract:Objective Soil amino sugars are specific markers of soil microbial death residues, and play an important role in soil carbon and nitrogen sequestration. This study aims to explore the impact mechanism of tree species diversity and dominant tree species importance on soil amino sugars. Method The experimental forest farm of Northeast Forestry University was taken as the research sample, and 0 − 20 cm surface soil was used to measure glucosamine (Glu), galactosamine (Gal), muramic acid (Mur) and total amino sugar (TA). The diversity index of tree species and important values (IV) of dominant tree species were calculated. The main factors and contribution affecting soil amino sugars were determined through correlation analysis, redundancy analysis, and variance decomposition analysis. Result (1) The contents of Glu, Gal, Mur, TA were significantly positively correlated with those of total nitrogen (TN), electrical conductivity (EC), and organic carbon in soil (P<0.05). (2) The contents of Glu, Gal, Mur, TA were significantly negatively correlated with IV of Pinus tabulaeformis var. mukdensis (P<0.01). The contents of Glu, Gal, TA were negatively correlated with IV of Quercus mongolica (P<0.05). The contents of Glu and TA were significantly positively correlated with IV of Phellodendron amurense, Lonicera maackii, and Juglans mandshurica (P<0.05), while the contents of Ga, Mur and TA were significantly positively correlated with IV of Acer negundo (P<0.05). Redundancy analysis found that Pinus tabuliformis var. mukdensis and Q. mongolica were not conducive to the accumulation of amino sugars, while A. negundo, Phellodendron amurense, L. maackii, and J. mandshurica were conducive to the accumulation of amino sugars. (3) Variance decomposition analysis showed that the contribution of IV of tree species to changes in soil amino sugar content (35.4%) was significantly higher than that of tree species diversity (6.4%) and soil physical and chemical properties (17.2%). Conclusion The rich diversity of tree species maintained by increasing tree species such as A. negundo, L. maackii, Phellodendron amurense and J. mandshurica can better promote the accumulation of amino sugars in soil and improve soil carbon and nitrogen sequestration capacity. [Ch, 2 fig. 7 tab. 24 ref.] -
Key words:
- species diversity /
- important value of tree species /
- soil properties /
- soil amino sugars
-
表 1 30个样地的土壤理化性质及树种多样性指标
Table 1. Soil physicochemical index values and diversity index values of tree species in 30 plots
样地号 电导率/
(μs·cm−1)pH 有机碳/
(g·kg−1)全氮/
(g·kg−1)Shannon-
Wiener
指数Simpson
指数Pielou
均匀度
指数Patrick
丰富度
指数样地号 电导率/
(μs·cm−1)pH 有机碳/
(g·kg−1)全氮/
(g·kg−1)Shannon-
Wiener
指数Simpson
指数Pielou
均匀度
指数Patrick
丰富度
指数1 46.92 6.14 24.65 0.71 0.00 0.00 0.00 1.00 17 39.12 5.52 32.43 1.78 1.75 0.80 0.90 7.00 2 46.74 6.17 17.63 0.71 0.67 0.48 0.97 2.00 18 76.15 6.60 24.66 1.13 1.17 0.63 0.84 4.00 3 41.65 5.76 23.10 0.92 1.07 0.65 0.98 3.00 19 64.39 5.80 48.87 1.53 0.41 0.24 0.59 2.00 4 44.90 5.96 26.14 0.67 1.16 0.56 0.72 5.00 20 75.88 6.22 61.29 0.59 1.59 0.69 0.76 8.00 5 97.67 5.48 41.92 1.01 1.77 0.76 0.77 10.00 21 95.36 6.24 68.42 1.78 1.31 0.68 0.81 5.00 6 30.79 5.86 14.42 0.70 0.24 0.12 0.35 2.00 22 70.70 6.71 28.81 2.11 1.58 0.75 0.88 6.00 7 48.94 5.06 100.31 1.79 1.70 0.79 0.88 7.00 23 101.43 6.23 56.75 1.54 1.19 0.65 0.86 4.00 8 43.31 5.79 38.80 1.50 1.25 0.70 0.90 4.00 24 49.39 6.28 27.31 1.37 1.21 0.63 0.75 5.00 9 36.16 5.02 38.23 1.61 1.44 0.65 0.74 7.00 25 56.65 5.96 45.60 1.34 0.73 0.42 0.66 3.00 10 57.18 5.38 37.56 1.16 1.20 0.62 0.75 5.00 26 76.50 6.21 57.60 1.78 2.00 0.85 0.91 9.00 11 30.69 5.86 19.79 0.73 0.00 0.00 0.00 1.00 27 68.02 5.52 69.13 1.82 1.59 0.74 0.76 8.00 12 57.74 4.87 34.29 0.97 1.30 0.68 0.81 5.00 28 47.71 5.89 31.18 1.67 1.14 0.46 0.49 10.00 13 55.11 5.28 42.61 1.20 1.47 0.71 0.75 7.00 29 66.48 6.23 40.27 2.31 1.84 0.82 0.88 8.00 14 69.02 6.32 29.48 1.92 1.81 0.77 0.82 9.00 30 56.49 5.98 46.95 1.92 2.12 0.86 0.92 10.00 15 55.43 5.65 50.68 0.34 1.66 0.79 0.93 6.00 均值 59.54 5.87 41.22 1.33 1.24 0.61 0.73 5.63 16 79.58 6.08 57.78 1.20 0.97 0.87 0.54 6.00 表 2 30个样地的优势树种重要值
Table 2. Important values of tree species index in 30 plots
样地号 樟子松 黑皮
油松水曲柳 黄檗 梣叶槭 金银
忍冬蒙古栎 榆树 胡桃楸 样地号 樟子松 黑皮
油松水曲柳 黄檗 梣叶槭 金银
忍冬蒙古栎 榆树 胡桃楸 1 0.00 1.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 17 0.00 0.00 0.14 0.30 0.00 0.15 0.00 0.26 0.08 2 0.00 0.28 0.28 0.00 0.00 0.00 0.00 0.00 0.00 18 0.00 0.00 0.48 0.00 0.10 0.00 0.00 0.21 0.00 3 0.49 0.00 0.32 0.19 0.00 0.00 0.00 0.00 0.00 19 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.87 4 0.07 0.40 0.13 0.00 0.00 0.00 0.00 0.00 0.00 20 0.00 0.00 0.29 0.23 0.00 0.08 0.00 0.11 0.24 5 0.00 0.00 0.19 0.11 0.20 0.06 0.05 0.09 0.00 21 0.00 0.00 0.00 0.43 0.00 0.13 0.00 0.00 0.13 6 0.00 0.00 0.00 0.22 0.00 0.00 0.78 0.00 0.00 22 0.00 0.00 0.47 0.00 0.11 0.10 0.00 0.24 0.00 7 0.00 0.00 0.19 0.13 0.16 0.13 0.07 0.00 0.00 23 0.00 0.00 0.00 0.22 0.00 0.39 0.00 0.17 0.22 8 0.00 0.00 0.31 0.00 0.24 0.10 0.00 0.00 0.00 24 0.00 0.00 0.53 0.10 0.00 0.00 0.00 0.00 0.29 9 0.52 0.00 0.12 0.09 0.00 0.07 0.07 0.12 0.00 25 0.00 0.00 0.64 0.12 0.00 0.00 0.00 0.00 0.24 10 0.53 0.00 0.17 0.00 0.00 0.08 0.08 0.14 0.00 26 0.00 0.00 0.16 0.42 0.06 0.12 0.06 0.00 0.11 11 0.00 0.00 0.00 0.00 0.00 0.00 1.00 0.00 0.00 27 0.00 0.00 0.12 0.09 0.00 0.19 0.05 0.15 0.11 12 0.00 0.00 0.00 0.11 0.00 0.00 0.40 0.30 0.00 28 0.00 0.00 0.09 0.13 0.05 0.30 0.00 0.06 0.05 13 0.00 0.00 0.13 0.17 0.00 0.00 0.07 0.32 0.27 29 0.00 0.00 0.00 0.39 0.11 0.14 0.07 0.00 0.13 14 0.00 0.00 0.11 0.11 0.20 0.08 0.00 0.14 0.05 30 0.00 0.00 0.13 0.29 0.06 0.08 0.05 0.14 0.06 15 0.00 0.40 0.22 0.00 0.00 0.00 0.10 0.12 0.08 均值 0.06 0.07 0.17 0.14 0.04 0.08 0.10 0.09 0.10 16 0.29 0.00 0.00 0.21 0.00 0.14 0.09 0.10 0.00 表 3 30个样地的土壤氨基糖指标
Table 3. Values of soil amino sugar indexes in 30 plots
样地
号葡萄糖/
(g·kg−1)半乳糖/
(g·kg−1)胞壁酸/
(g·kg−1)总氨基糖/
(g·kg−1)葡萄糖/
总氨基糖半乳糖/
总氨基糖胞壁酸/
总氨基糖样地
号葡萄糖/
(g·kg−1)半乳糖/
(g·kg−1)胞壁酸/
(g·kg−1)总氨基糖/
(g·kg−1)葡萄糖/
总氨基糖半乳糖/
总氨基糖胞壁酸/
总氨基糖1 0.44 0.14 0.04 0.62 0.70 0.23 0.07 17 0.63 0.23 0.03 0.89 0.71 0.26 0.03 2 0.41 0.15 0.03 0.59 0.69 0.26 0.05 18 0.77 0.34 0.06 1.16 0.66 0.29 0.05 3 0.51 0.21 0.04 0.76 0.67 0.28 0.05 19 0.96 0.44 0.06 1.46 0.66 0.30 0.04 4 0.42 0.17 0.03 0.61 0.68 0.27 0.05 20 1.05 0.41 0.05 1.51 0.69 0.27 0.03 5 0.76 0.36 0.06 1.19 0.64 0.31 0.05 21 1.04 0.42 0.07 1.53 0.68 0.28 0.05 6 0.44 0.13 0.04 0.60 0.72 0.21 0.06 22 1.05 0.49 0.07 1.61 0.65 0.30 0.05 7 0.97 0.48 0.09 1.54 0.63 0.31 0.06 23 0.91 0.32 0.07 1.30 0.70 0.24 0.06 8 0.79 0.37 0.07 1.23 0.64 0.30 0.06 24 0.94 0.43 0.07 1.44 0.66 0.30 0.05 9 0.99 0.37 0.07 1.43 0.69 0.26 0.05 25 0.92 0.39 0.07 1.39 0.66 0.28 0.05 10 0.69 0.28 0.05 1.02 0.68 0.27 0.05 26 1.03 0.40 0.08 1.51 0.68 0.26 0.05 11 0.47 0.14 0.05 0.66 0.72 0.21 0.07 27 1.00 0.39 0.08 1.47 0.68 0.27 0.05 12 0.51 0.19 0.05 0.75 0.68 0.25 0.07 28 0.88 0.37 0.07 1.33 0.66 0.28 0.05 13 0.81 0.33 0.05 1.20 0.68 0.28 0.05 29 1.15 0.49 0.10 1.74 0.66 0.28 0.05 14 0.89 0.43 0.07 1.38 0.64 0.31 0.05 30 1.03 0.46 0.09 1.57 0.65 0.29 0.05 15 0.50 0.21 0.02 0.73 0.68 0.29 0.03 均值 0.79 0.33 0.06 1.17 0.68 0.27 0.05 16 0.70 0.27 0.06 1.04 0.68 0.26 0.06 表 4 土壤理化性质与土壤氨基糖质量分数的相关性
Table 4. Correlation coefficients between soil amino sugar contents and soil properties
土壤理化性质 氨基葡萄糖 氨基半乳糖 胞壁酸 总氨基糖 氨基葡萄糖/总氨基糖 氨基半乳糖/总氨基糖 胞壁酸/总氨基糖 电导率 0.486** 0.448* 0.367* 0.476** −0.264 0.305 −0.199 酸碱度 0.196 0.197 0.075 0.194 −0.053 0.104 −0.155 总有机碳 0.566** 0.534** 0.528** 0.563** −0.301 0.318 −0.145 全氮 0.780** 0.773** 0.791** 0.791** −0.457* 0.427* −0.070 说明:* P<0.05;** P<0.01。 表 5 土壤氨基糖质量分数和树种多样性指标的相关性
Table 5. Correlation coefficients between soil amino sugar contents and tree species diversity indexes
多样性指数 氨基葡萄糖 氨基半乳糖 胞壁酸 总氨基糖 氨基葡萄糖/总氨基糖 氨基半乳糖/总氨基糖 胞壁酸/总氨基糖 Shannon-Wiener指数 0.560** 0.588** 0.399* 0.570** −0.452* 0.573** −0.474** Simpson指数 0.473** 0.508** 0.333 0.485** −0.458* 0.574** −0.461* Patrick丰富度指数 0.356 0.423* 0.182 0.374* −0.455* 0.601** −0.540** Pielou均匀度指数 0.572** 0.577** 0.452* 0.577** −0.397* 0.475** −0.341 说明:* P<0.05;** P<0.01。 表 6 树种重要值与土壤氨基糖指标的相关性分析
Table 6. Correlation of important value of tree species and soil amino sugar index
氨基糖 樟子松 黑皮油松 水曲柳 黄檗 梣叶槭 金银忍冬 蒙古栎 榆树 胡桃楸 氨基葡萄糖 −0.122 −0.515** 0.150 0.442* 0.297 0.460* −0.417* 0.056 0.370* 氨基半乳糖 −0.162 −0.491** 0.262 0.303 0.471** 0.349 −0.489** 0.026 0.360 胞壁酸 −0.114 −0.466** 0.012 0.359 0.432* 0.466** −0.188 −0.084 0.150 总氨基糖 −0.137 −0.513** 0.181 0.400* 0.365* 0.432* −0.435* 0.040 0.362* 葡萄糖/总氨基糖 0.092 0.262 −0.397* 0.142 −0.715** −0.025 0.514** 0.048 −0.125 半乳糖/总氨基糖 −0.079 −0.260 0.479** −0.085 0.605** 0.030 −0.678** 0.046 0.234 胞壁酸/总氨基糖 −0.004 0.081 −0.351 −0.105 0.060 −0.021 0.607** −0.234 −0.333 说明:* P<0.05;** P<0.01。 表 7 影响因子的蒙特卡罗检验
Table 7. Monte Carlo test of influencing factors
影响因子 解释率/% F P 影响因子 解释率/% F P 土壤全氮 61.7 66.5 0.002 梣叶槭重要值 0.8 0.9 0.180 土壤有机碳 9.8 10.5 0.010 电导率 0.6 0.6 0.292 水曲柳重要值 6.0 6.4 0.010 Shannon-Wiener指数 0.3 0.3 0.458 胡桃楸重要值 4.1 4.5 0.056 金银忍冬重要值 0.1 0.1 0.610 Patrick丰富度指数 3.9 4.2 0.026 黄檗重要值 <0.1 <0.1 0.800 酸碱度 1.9 2.0 0.072 榆树重要值 <0.1 <0.1 0.714 Simpson指数 1.2 1.3 0.148 黑皮油松重要值 <0.1 <0.1 0.946 樟子松重要值 1.3 1.4 0.116 Pielou均匀度指数 <0.1 <0.1 0.928 蒙古栎重要值 0.9 1.0 0.196 -
[1] 邵帅, 何红波, 张威, 等. 土壤有机质形成与来源研究进展[J]. 吉林师范大学学报(自然科学版), 2017, 38(1): 126 − 130. SHAO Shuai, HE Hongbo, ZHANG Wei, et al. Soil organic matter formation and origin: a view [J]. Journal of Jilin Normal University (Natural Science Edition), 2017, 38(1): 126 − 130. [2] AMELUNG W, BRODOWSKI S, SANDHAGE-HOFMANN A, et al. Combining biomarker with stable isotope analyses for assessing the transformation and turnover of soil organic matter [J]. Advances in Agronomy, 2008, 100(8): 155 − 250. [3] HU Yuntao, ZHENG Qin, NOLL L S, et al. Direct measurement of the in-situ decomposition of microbial-derived soil organic matter [J/OL]. Soil Biology and Biochemistry, 2020, 141: 107660[2023-09-23]. doi: 10.1016/j.soilbio.2019.107660. [4] JOERGENSEN R G, WICHERN F. Alive and kicking: why dormant soil microorganisms matter [J]. Soil Biology and Biochemistry, 2018, 116: 419 − 430. [5] CHEN Jungang, JI Chengjun, FANG Jingyun, et al. Dynamics of microbial residues control the responses of mineral-associated soil organic carbon to N addition in two temperate forests [J/OL]. Science of the Total Environment, 2020, 748: 141318[2023-09-23]. doi: 10.1016/j.scitotenv.2020.141318. [6] COTRUFO M F, WALLENSTEIN M D, BOOT C M, et al. The microbial efficiency-matrix stabilization framework integrates plant litter decomposition with soil organic matter stabilization: do labile plant inputs form stable soil organic matter [J]. Global Change Biology, 2013, 19(4): 988 − 995. [7] LIANG Chao, SCHIMEL J P, JASTROW J D. The importance of anabolism in microbial control over soil carbon storage [J/OL]. Nature Microbiology, 2017, 2(8): 17105[2023-09-23]. doi: 10.1038/nmicrobiol.2017.105. [8] 梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论[J]. 中国科学: 地球科学, 2021, 51(5): 680 − 695. LIANG Chao, ZHU Xuefeng. The soil microbial carbon pump as a new concept for terrestrial carbon sequestration [J]. Scientia Sinica (Terrae), 2021, 51(5): 680 − 695. [9] BENGTSSON G, BERGWALL C. Fate of 15N labelled nitrate and ammonium in a fertilized forest soil [J]. Soil Biology and Biochemistry, 2000, 32(4): 545 − 557. [10] CUI Jun, ZHU Zhenke, XU Xingliang, et al. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming [J/OL]. Soil Biology and Biochemistry, 2020, 142: 107720[2023-09-23]. doi: 10.1016/j.soilbio.2020.107720. [11] APPUHN A, JOERGENSEN R G. Microbial colonisation of roots as a function of plant species [J]. Soil Biology and Biochemistry, 2006, 38(5): 1040 − 1051. [12] DING Xueli, CHEN Shengyun, ZHANG Bin, et al. Warming increases microbial residue contribution to soil organic carbon in an alpine meadow [J]. Soil Biology and Biochemistry, 2019, 135: 13 − 19. [13] WANG Wenjie, LU Jiali, DU Hongju, et al. Ranking thirteen tree species based on their impact on soil physiochemical properties, soil fertility, and carbon sequestration in northeastern China [J]. Forest Ecology and Management, 2020, 404: 214 − 229. [14] 陈胜仙, 张喜亭, 佘丹琦, 等. 森林植物多样性、树种重要值与土壤理化性质对球囊霉素相关土壤蛋白的影响[J/OL]. 生物多样性, 2022, 30: 21115[2023-09-23]. doi: 10.17520/biods.2021115. CHEN Shengxian, ZHANG Xiting, YU Danqi, et al. Effects of plant species diversity, dominant species importance, and soil properties on glomalin-related soil protein [J/OL]. Biodiversity Science, 2022, 30: 21115[2023-09-23]. doi: 10.17520/biods.2021115. [15] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Rukun. The Analysis Method of Soil Agricultural Chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000. [16] ZHANG Xudong, AMELUNG W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils [J]. Soil Biology and Biochemistry, 1996, 28(9): 1201 − 1206. [17] JIA Yufu, ZHAI Guoqing, ZHU Shanshan, et al. Plant and microbial pathways driving plant diversity effects on soil carbon accumulation in subtropical forest [J/OL]. Soil Biology and Biochemistry, 2021, 161: 108375[2023-09-23]. doi: 10.1016/j.soilbio.2021.108375. [18] 马克平, 黄建辉, 于顺利, 等. 北京东灵山地区植物群落多样性的研究(Ⅱ)丰富度、均匀度和物种多样性指数[J]. 生态学报, 1995, 15(3): 268 − 277. MA Keping, HUANG Jianhui, YU Shunli, et al. Plant community diversity in Dongling Mountain, Beijing, China (Ⅱ) species richness, evenness and species diversities [J]. Acta Ecologica Sinica, 1995, 15(3): 268 − 277. [19] WANG Yuanyuan, YU Jinghua, XIAO Lu, et al. Dominant species abundance, vertical structure and plant diversity response to nature forest protection in northeastern China: conservation rffects and implications[J/OL]. Forests, 2020, 11(3): 295[2023-09-23]. doi. org/10.3390/f11030295. [20] GLASER B, TURRIÓN M-B, ALEF K. Amino sugars and muramic acid—biomarkers for soil microbial community structure analysis [J]. Soil Biology and Biochemistry, 2004, 36(3): 399 − 407. [21] NI Xiangyin, LIAO Shu, TAN Siyi, et al. A quantitative assessment of amino sugars in soil profiles [J/OL]. Soil Biology and Biochemistry, 2020, 143: 107762[2023-09-23]. doi: 10.1016/j.soilbio.2020.107762. [22] SHEN Congcong, WANG Jiang, HE Jizheng, et al. Plant diversity enhances soil fungal diversity and microbial resistance to plant invasion [J/OL]. Applied and Environmental Microbiology, 2021, 87: e00251-21[2023-09-23]. doi: 10.1128/AEM.00251-21. [23] STEINAUER K, CHATZINOTAS A, EISENHAUER N. Root exudate cocktails: the link between plant diversity and soil microorganisms[J]. Ecology & Evolution, 2016, 6(20): 7387 − 7396. [24] 井艳丽, 刘世荣, 殷有, 等. 赤杨对辽东落叶松人工林土壤氨基糖积累的影响[J]. 生态学报, 2018, 38(8): 2838 − 2845. JING Yanli, LIU Shirong, YIN You, et al. Effect of N-fixing tree species (Alnus sibirica) on amino sugars in the soil of a Larix kaempferi plantation in eastern Liaoning Province, China [J]. Acta Ecologica Sinica, 2018, 38(8): 2838 − 2845. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230527






 下载:
下载: