-
玉米赤霉烯酮(zearalenone,ZEN)是主要由镰刀菌属Fusarium产生的一类具有类雌激素效应的有毒次级代谢产物,1962年首次从霉变玉米Zea mays中分离得到[1−2]。因具有细胞、免疫和生殖等多种毒性以及可致癌、致畸和致突变,ZEN已被国际癌症研究机构(IARC)列为Ⅲ类致癌物[3−4]。在中国,ZEN是小麦Triticum aestivum和玉米及其制品中最常见的真菌毒素,可通过污染谷类作物或动物源性食品,经食物链危害动物及人类健康[5−7]。鉴于其污染的广泛性和危害的严重性,建立快速高灵敏的定量分析方法,实现ZEN暴露评估和风险防控,对保障人畜健康具有重要意义。
目前,ZEN的常用检测方法主要包括仪器分析法和免疫学检测法[8]。其中,以液相色谱-串联质谱联用技术(LC-MS/MS)为代表的仪器分析法虽可实现精准检测,但繁琐的样品前处理、昂贵的设备和复杂的检测流程使其难以在基层单位推广使用[9−10]。免疫学分析法由于对操作人员和场地要求低,特别是酶联免疫吸附法(ELISA),检测信号易读取,省时高效的同时成本较低,并且对实验结果可进行定量分析,在真菌毒素检测领域备受青睐[11−13]。
近年来,为提高检测灵敏度,包括量子点、荧光微球和磁性颗粒等在内的新型标记物以及基于化学发光、电信号转导和离子交换等策略的信号增强系统被广泛应用于免疫学方法的建立[14−16]。其中磁性颗粒如纳米磁珠,因粒径小且具有超顺磁性,可与抗原/抗体进行偶联修饰,已成为免疫标记领域的研究热点[17−18];生物素-亲合素信号增强系统(biotin-avidin-system, BAS)不受反应环境温度、酸碱度以及离子种类和浓度的干扰,在提高检测灵敏度的同时具有较高的稳定性[19-20]。利用上述原理,本研究设计了一种基于纳米磁珠和生物素-链霉亲和素系统的高灵敏检测方法,以实现对农产品中ZEN的快速定量检测与分析。
-
真菌毒素标准品、N, N′-二环己基碳二亚胺(DCC)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、二甲基甲酰胺(DMF)、羧甲基羟胺半盐酸盐(CMO)购自Sigma公司;生物素标记试剂盒(21435)、ZebaTM脱盐柱和羧基修饰的纳米磁珠M270 (15305D)购自Thermo公司;牛血清白蛋白(BSA)和BSA多克隆抗体购自上海生工;辣根过氧化物标记的链霉亲和素(HRP-SA)购自Anaspec公司;3, 3′, 5, 5′-四甲基联苯胺(TMB)购自泰天和生物科技有限公司;玉米赤霉烯酮单克隆抗体(mAb)和辣根过氧化物酶标记玉米赤霉烯酮单克隆抗体(mAb-HRP)为实验室自制;其他试剂购自上海国药;谷物样本由浙江省检验检疫科学技术研究院提供。
-
称取2 mg ZEN标准品、4 mg CMO溶于2.0 mL吡啶,37 ℃振荡(100次·min−1)反应6 h;所得产物经旋转蒸发仪干燥后溶于8.0 mL蒸馏水并调pH至8.0;使用苯溶液分3次(2.0 mL·次−1)对产物抽提以去除未反应的ZEN;收集液相,调pH至3.0,出现白色沉淀;使用20.0 mL乙酸乙酯分4次(5.0 mL·次−1)抽提沉淀;产物蒸发干燥后即为ZEN肟化物(ZENO);ZENO溶于0.8 mL无水四氢呋喃后再分别加入12.0 mg DCC和6.0 mg NHS,常温条件下振荡反应(100次·min−1) 2 h后,常温条件下离心(2 500 g) 45 min弃沉淀;上清经真空干燥后溶于4.0 mL二甲基甲酰胺;称取40 mg牛血清白蛋白溶于4.0 mL 0.13 mol·L−1碳酸盐缓冲液(pH 7.4),并将ZENO溶液逐滴加至其中,常温缓慢混匀反应2 h后离心弃沉淀;上清经0.01 mol·L−1 pH 7.4磷酸盐缓冲液(PBS) 4 ℃透析48 h后所得产物即为完全抗原BSA-ZEN,ELISA鉴定后置于−20 ℃冰箱分装保存。
-
采用两步法制备。第1步,制备纳米磁珠-抗体复合物(MNPs-Anti-BSA)。取30 g·L−1磁珠储存液 200 μL置于eppendorf管(EP管)中,磁性分离后弃去液体,使用25 mmol·L−1 pH为 5.0的等体积硼酸盐缓冲液重悬洗涤3次后收集磁珠;加入200 μL预冷的含10 mg EDC和12 mg NHS混合溶液(摩尔比为1∶2),常温振荡活化45 min后采用上述相同方法重悬洗涤3次弃上清;加入0.6 g·L−1 BSA多克隆抗体 (Anti-BSA)溶液200 μL,常温振荡反应2 h;洗涤3次后加入50 mmol·L−1缓冲液 (Tris,pH 7.4) 100 μL,常温振荡反应15 min,淬灭未反应的羧基;洗涤收集磁珠,经200 μL pH 为7.4的PBS,重悬,4 ℃保存备用。
第2步,将BSA-ZEN与MNPs-Anti-BSA孵育,制备MNPs-BSA-ZEN。取75 μL上述制备的MNPs-Anti-BSA置于EP管中,磁性分离后使用10 mmol·L−1PBS (pH 7.4)洗涤3次;加入3 μg·mL−1 BSA-ZEN 500 μL,37 ℃振荡孵育45 min,按照相同方法洗涤3次后加入10 mmol·L−1 PBS (pH 7.4) 200 μL重悬,ELISA鉴定后,4 ℃保存备用。
-
使用Thermo fisher公司的EZ-Link™ Sulfo-NHS生物素化试剂盒(21425)对抗体进行标记。称取3.5 mg 磺基琥珀酰亚胺-6-(生物素)己酸(Sulfo-NHS-LC-Biotin)溶于700 μL超纯水,配置质量浓度为5.0 g·L−1的生物素溶液。标记时,生物素的摩尔数应为抗体的20倍左右。经计算,吸取145 μL上述生物素溶液加入待标记的1 mL单克隆抗体mAb中(质量浓度为2.0 g·L−1),上下颠倒充分混匀后常温静置反应2 h;标记产物经ZebaTM脱盐柱1 000 g离心1 min,重复3次,以去除体系中未反应的生物素分子,采用4'-羟基偶氮苯-2-羧酸(HABA)法[21]和ELISA鉴定后4 ℃保存备用。
-
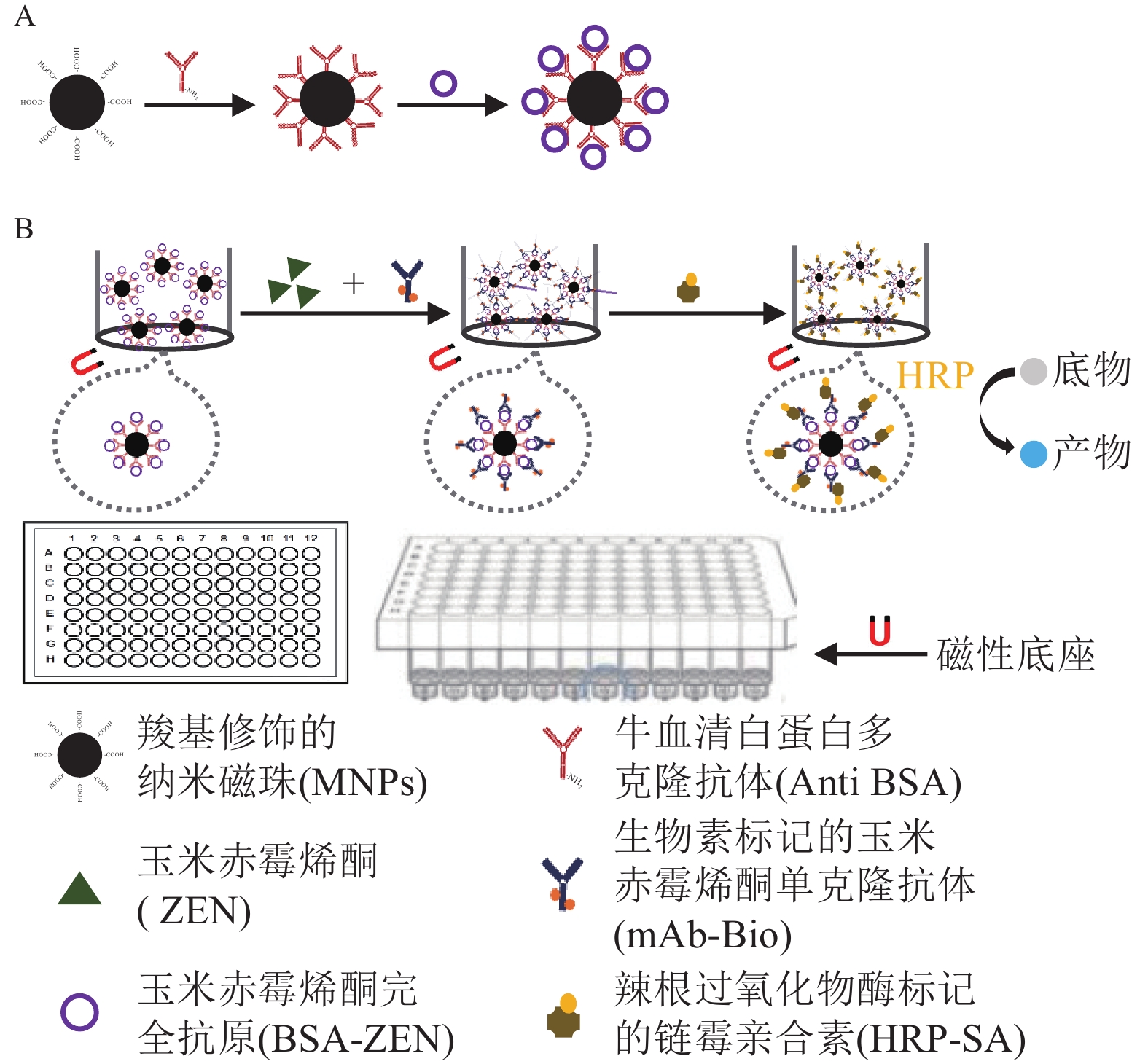
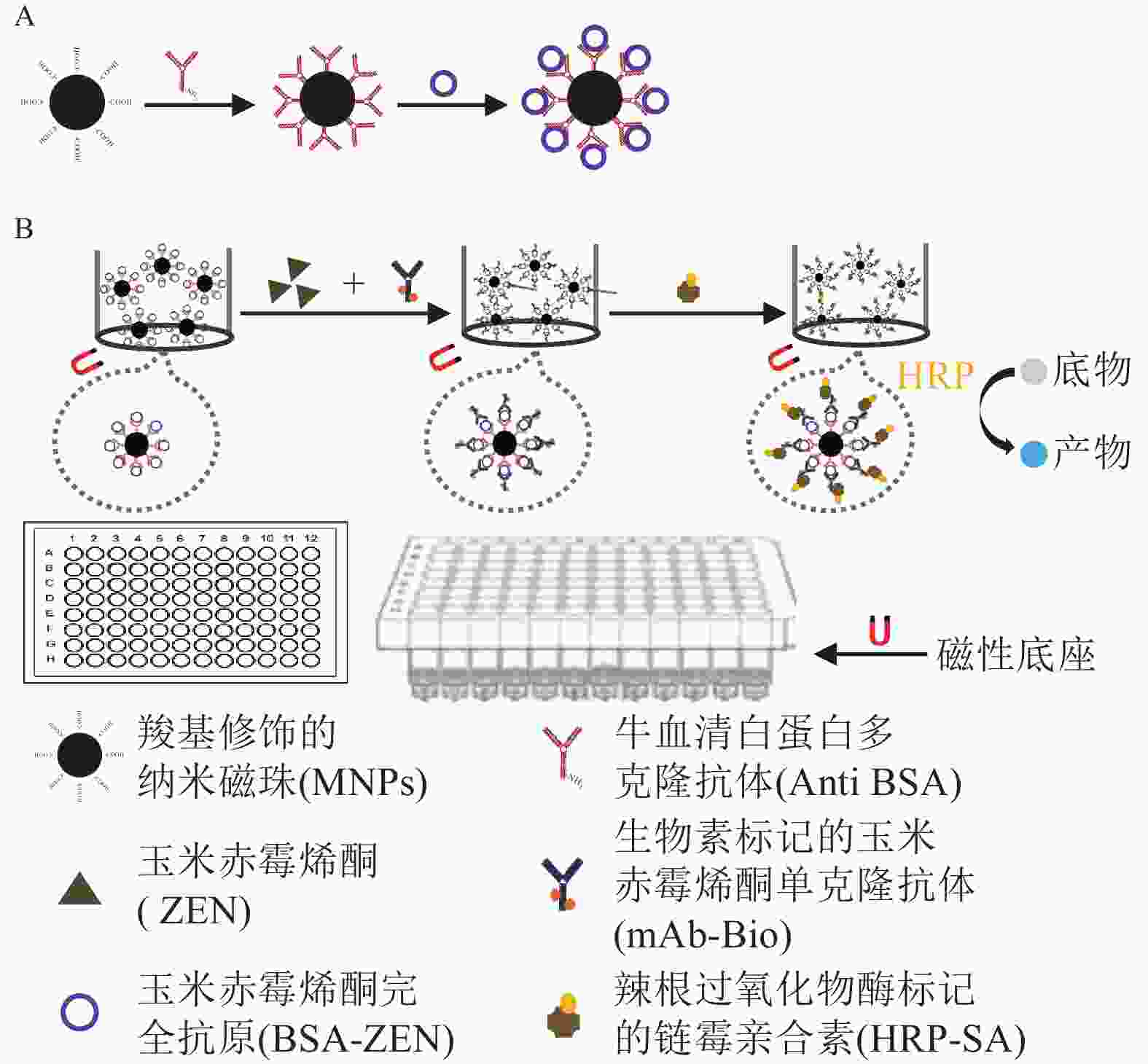
检测原理如图1所示:包被 MNPs-BSA-ZEN与游离ZEN竞争结合mAb-Bio,再与HRP-SA形成免疫反应复合物,催化底物显色后通过测定产物吸光度,对样本中ZEN质量浓度进行分析。
具体步骤:取稀释后的MNPs-BSA-ZEN 10 μL于96孔板,设置3个平行孔,250 μL梯度稀释的ZEN标准品与250 μL生物素标记mAb-Bio混匀后,加入反应孔,150 μL·孔−1,37 ℃水平振荡充分反应;待反应结束后,富集并洗涤磁珠,洗涤缓冲液为体积分数为0.05%吐温-20 (Tween-20)的10 mmol·L−1的PBS (PBST),200 μL·孔−1;每孔加入150 μL辣根过氧化物酶标记的0.5 μg·mL−1HRP-SA,37 ℃水平振荡反应45 min;按照相同方法富集和洗涤磁珠后,加入底物TMB,100 μL·孔−1,37 ℃水平混匀显色5 min,2 mmol·L−1H2SO4终止反应(50 μL·孔−1),读取450 nm处的吸光度[D(450)]。
在该反应模式下MNPs-BSA-ZEN过量会造成背景值过高,导致检测灵敏度降低, mAb-Bio用量同样影响检测效果。采用棋盘方阵法[22]对MNPs-BSA-ZEN和mAb-Bio作用稀释倍数进行优化,在达到最佳检测灵敏度的同时降低实验成本。MNPs-BSA-ZEN稀释倍数依次为1∶10、1∶20、1∶40和1∶80;mAb-Bio稀释倍数依次为1∶1 000、1∶2 000、1∶4 000、1∶8 000和1∶16 000。选择D(450)在1.0左右的抗原抗体稀释倍数组合为最佳。
竞争反应体系中,竞争时间会影响最终的检测效果。时间过短会导致竞争不完全,影响检测灵敏度,时间过长则影响检测效率。分别设置竞争时间为15、30、45、60、75 min,在相同稀释倍数竞争抗原条件下,计算抑制率,确定最佳时间。相关实验条件的优化均重复进行3次测定,取均值进行数据分析。
在最佳条件下,梯度稀释ZEN标准品(起始质量浓度为8 ng·mL−1,依次进行2倍稀释,共10个梯度),每个稀释倍数3个平行,同时设置阴性对照和空白对照。阴性对照为标准品稀释液和含质量分数为0.05%脱脂奶粉的PBST等体积混合液,空白对照为mAb-Bio和标准品稀释液等体积混合液。以ZEN质量浓度的对数为横坐标,抑制率为纵坐标,进行线性拟合分析,计算检测限(10%抑制质量浓度,IC10)、检测区间(20%~80%抑制质量浓度,IC20~IC80)和半数抑制质量浓度(IC50),评价该检测方法的敏感性。
-
分别将ZEN、黄曲霉毒素B1 (AFB1)、赭曲霉毒素A (OTA)、伏马毒素(FB1)、呕吐毒素(DON)、桔青霉毒素(CIT)和展青霉毒素(PAT)作为竞争抗原,通过配制成梯度质量浓度的标准品溶液,作为竞争抗原,绘制标准抑制曲线并获得IC50,按照下列公式计算交叉反应率,确定该方法的特异性[23]。交叉反应率=(AZEN)/(A类似物)×100%。其中:AZEN为ZEN的IC50,A类似物为类似物的IC50。
-
检测时因涉及对谷物类样本的萃取,为降低有机溶剂和样本中蛋白质、纤维素等对检测效果的影响,同时避免稀释倍数过高降低检测灵敏度,参考文献[24]对萃取液的最佳稀释倍数进行优化。
-
参考文献[25]进行样本萃取和加标。萃取:待检样本干燥后研磨过筛,取3 g 置于50 mL离心管,加入15 mL体积比为7∶3的甲醇∶水溶液,振荡萃取(150次·min−1) 15 min,静置10 min 后4 000 g离心20 min,取上清定量滤纸过滤,检测前需使用超纯水稀释。加标:ZEN阴性样本烘干后研磨过筛,加入ZEN标准品溶液并充分混匀,放置过夜待检。不同质量分数分别设置3个平行,重复测定3次,分别计算回收率和变异系数。
-
分别采用MNPs-ELISA检测法、商品化检测试剂盒和LC-MS/MS平行检测天然ZEN阳性样本,并分析检测结果的一致性。
-
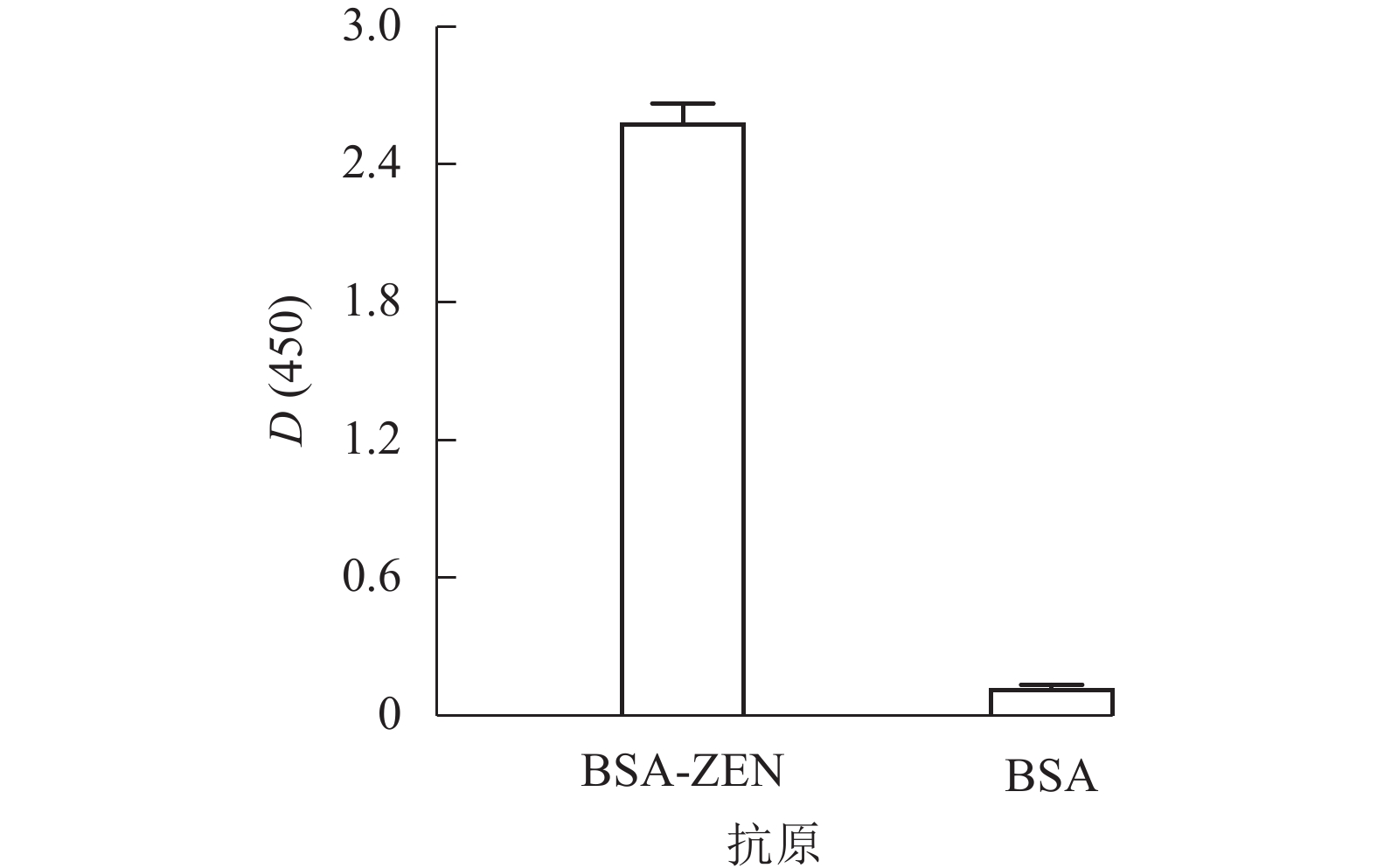
使用辣根过氧化物酶标记的ZEN单克隆抗体对两步法制备的BSA-ZEN进行ELISA鉴定。结果如图2所示:BSA-ZEN的D(450)与BSA对照组比值远大于2.1,表明其可被特异性抗体检出,完全抗原合成成功,满足建立相关免疫学检测方法的需求。
-
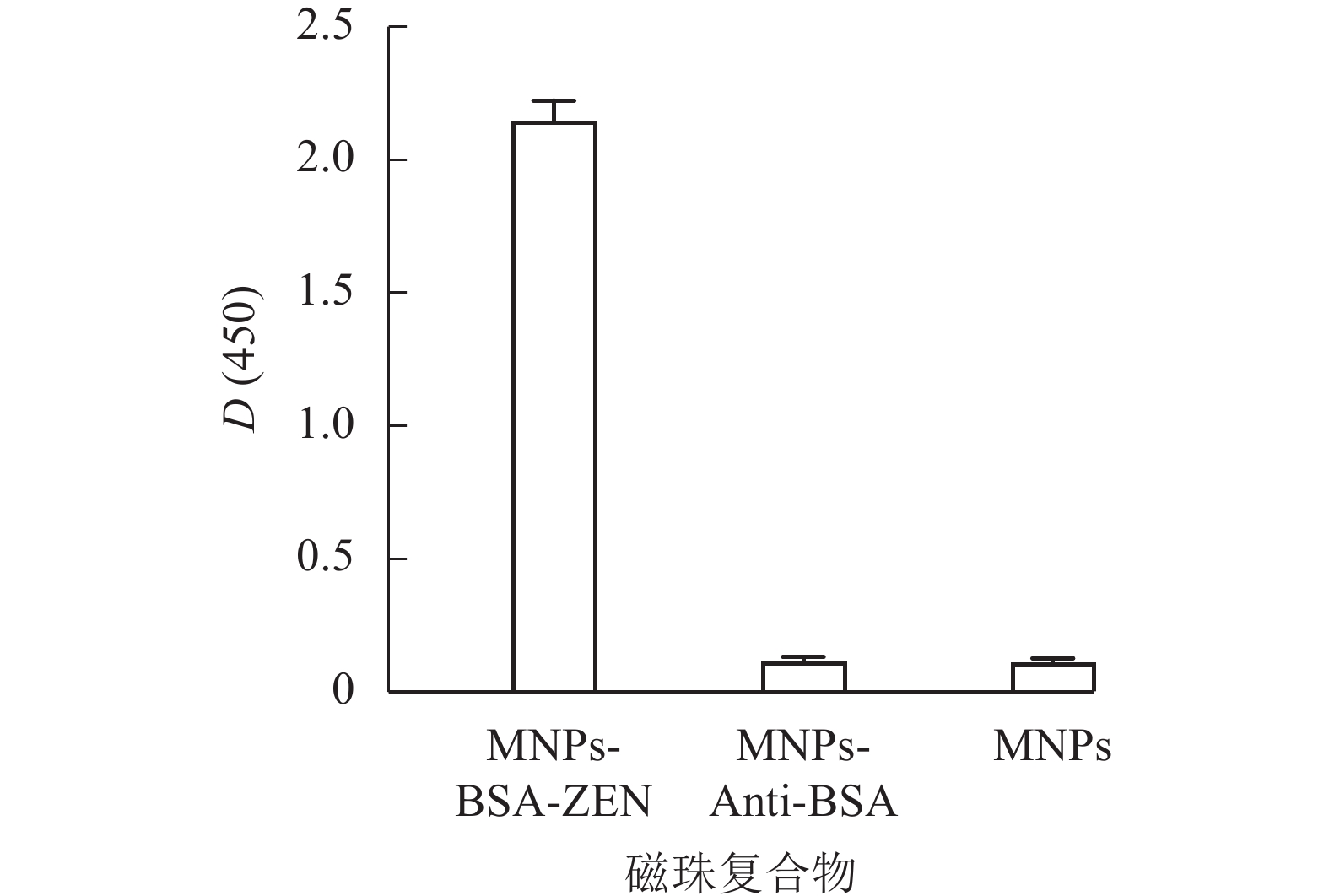
取等量纳米磁珠(MNPs)、纳米磁珠-BSA多克隆抗体复合物(MNPs-Anti-BSA)和纳米磁珠-ZEN完全抗原复合物(MNPs-BSA-ZEN),使用辣根过氧化物酶标记的ZEN单克隆抗体(mAb-HRP)进行ELISA鉴定。结果如图3所示:MNPs-BSA-ZEN的D(450)与各对照组比值均远大于2.1,表明复合物制备成功,后续可作为免疫反应载体用于检测方法的建立。
-
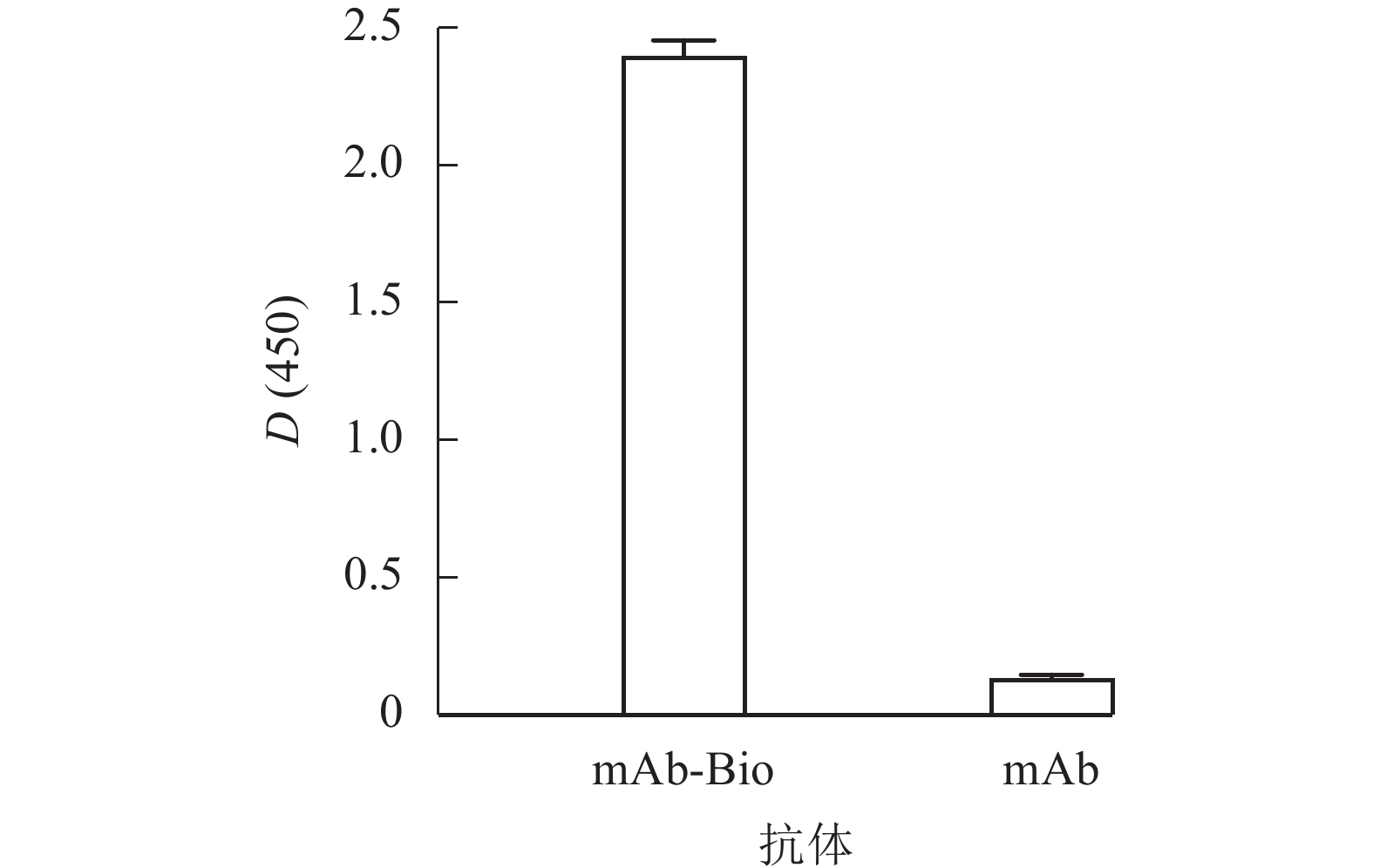
分别采用HABA法和ELISA对生物素标记抗体进行鉴定。经HABA法计算单克隆抗体标记效率,结果显示:mAb与Bio的摩尔比为4.5∶1.0,即每分子单克隆抗体上约标记有4.5分子的生物素,初步证明标记成功。
将mAb-Bio和未标记单克隆抗体(mAb)作为包被原,使用辣根过氧化物标记的链霉亲和素(HRP-SA)进行ELISA鉴定,结果如图4所示。mAb-Bio的D(450)与未标记对照组的比值远大于2.1,表明抗体标记成功,为基于生物-链霉亲和素系统的高效识别奠定基础。
-
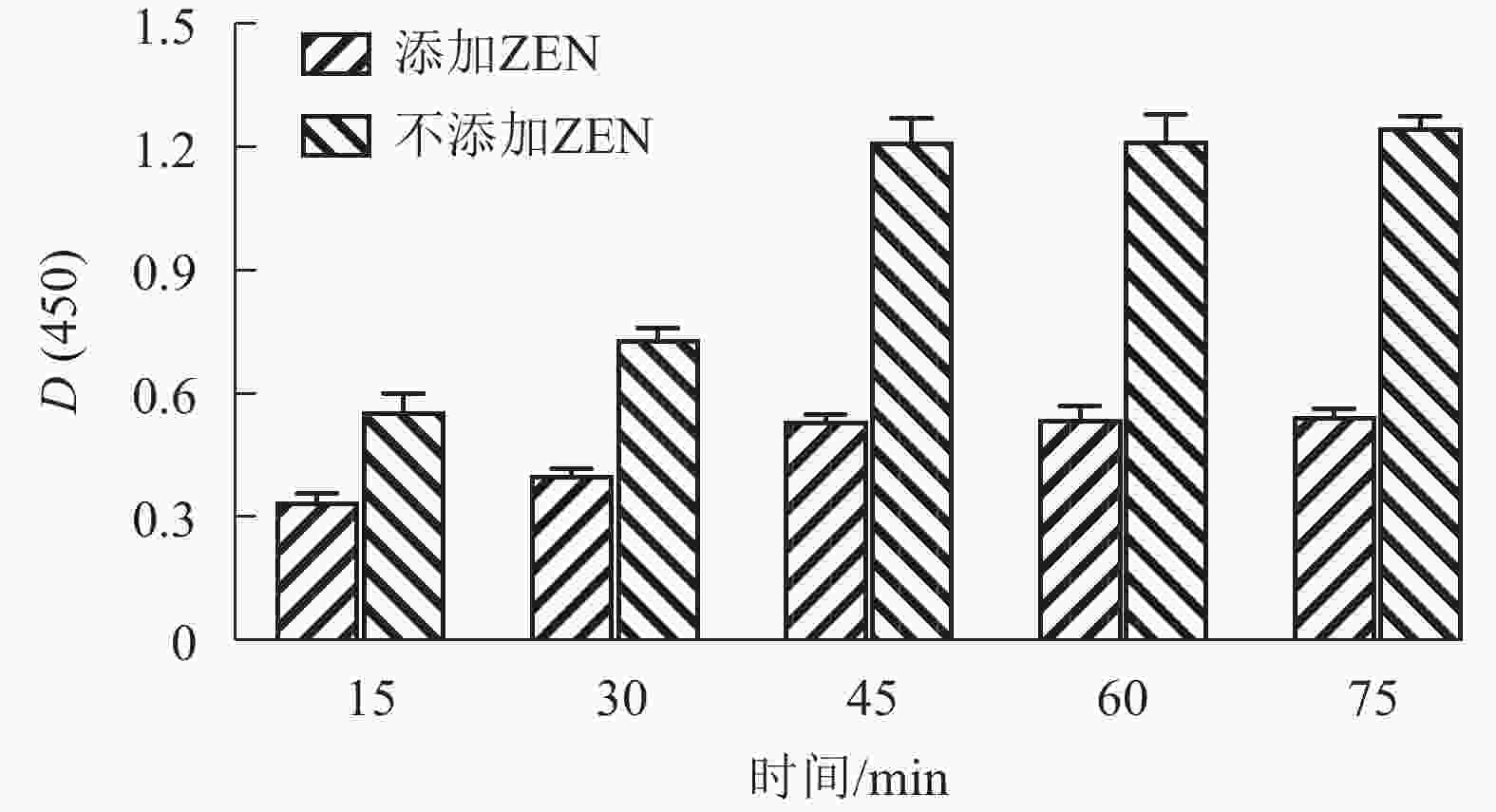
按照1.5中所述,棋盘方阵法D(450)结果如表1所示。MNPs-BSA-ZEN和mAb-Bio最佳稀释倍数分别为1∶40和1∶4 000。由竞争时间优化结果(图5)可知:综合检测时间和灵敏度,将竞争反应时间确定为45 min。
表 1 纳米磁珠完全抗原复合物和生物素标记抗体组合浓度棋盘法结果
Table 1. Chessboard titration of MNPs-BSA-ZEN and the mAb-Bio
MNPs-BSA-ZEN稀释倍数 不同mAb-Bio稀释倍数所对应的D(450) 阴性对照 1∶1 000 1∶2 000 1∶4 000 1∶8 000 1∶16 000 1∶10 2.787 2 2.620 9 1.957 7 1.729 5 0.879 3 0.063 5 1∶20 2.438 6 2.260 2 1.504 9 0.869 1 0.397 1 0.053 9 1∶40 1.829 3 1.629 3 1.139 2 0.521 8 0.267 5 0.043 8 1∶80 1.614 5 1.447 6 0.809 2 0.517 5 0.250 1 0.041 7 -
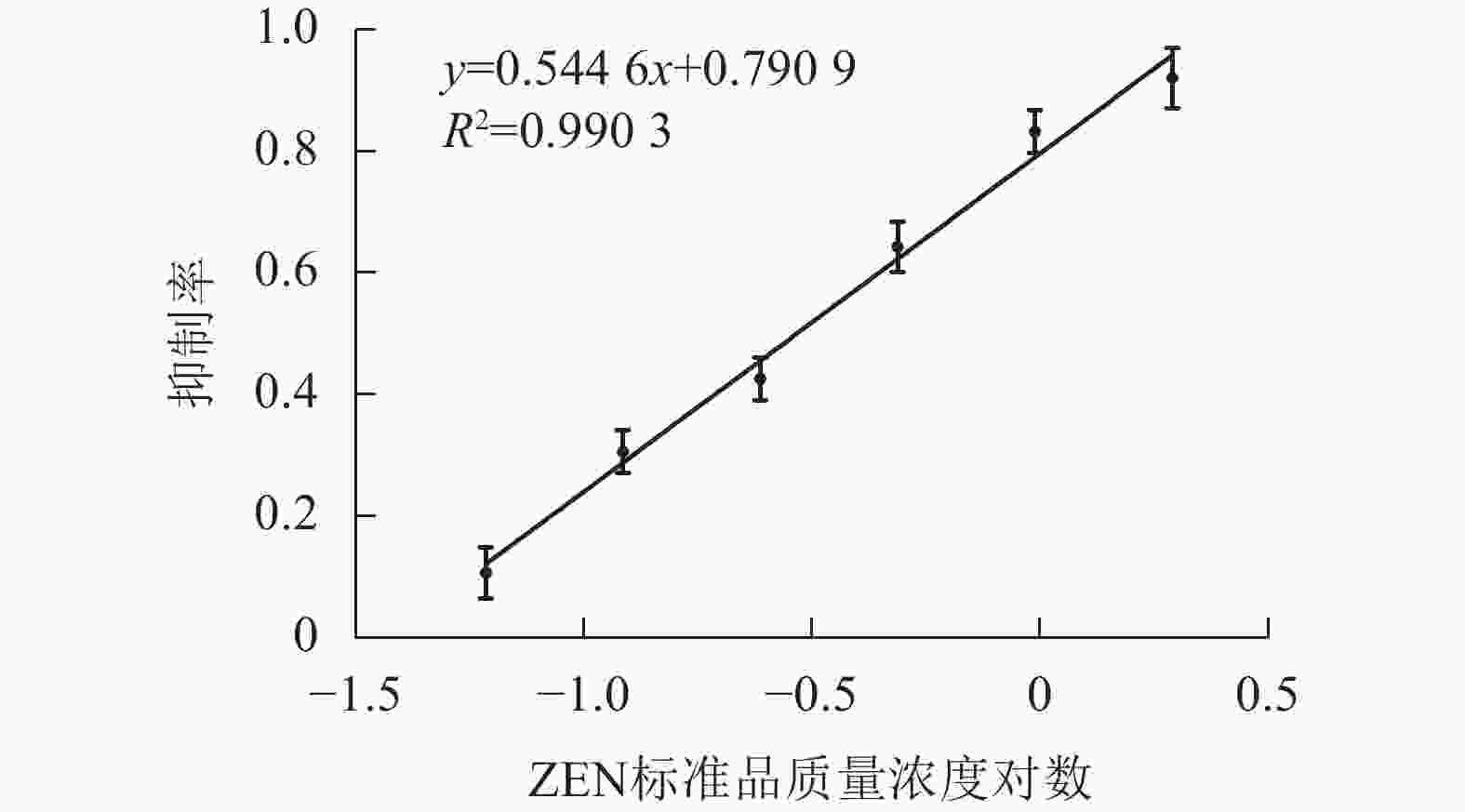
在2.4中确定的最佳条件下,按照1.5中所述步骤,采用MNPs-ELISA对ZEN进行检测。以竞争抗原ZEN标准品质量浓度对数为横坐标,以抑制率为纵坐标,通过GraphPad Prism 7软件进行线性拟合分析(图6)。根据所得的线性方程,经计算,检测下限(IC10)和半数抑制率(IC50)分别为0.05和0.29 ng·mL−1,定量检测范围(IC20~IC80)为0.08~1.04 ng·mL−1。
-
采用建立的MNPs-ELISA按照1.6中所述对常见真菌毒素进行检测,并分别绘制标准抑制曲线(图7),交叉反应率计算结果见表2,表明该方法对农产品中其他常见真菌毒素基本无交叉反应,特异性高。
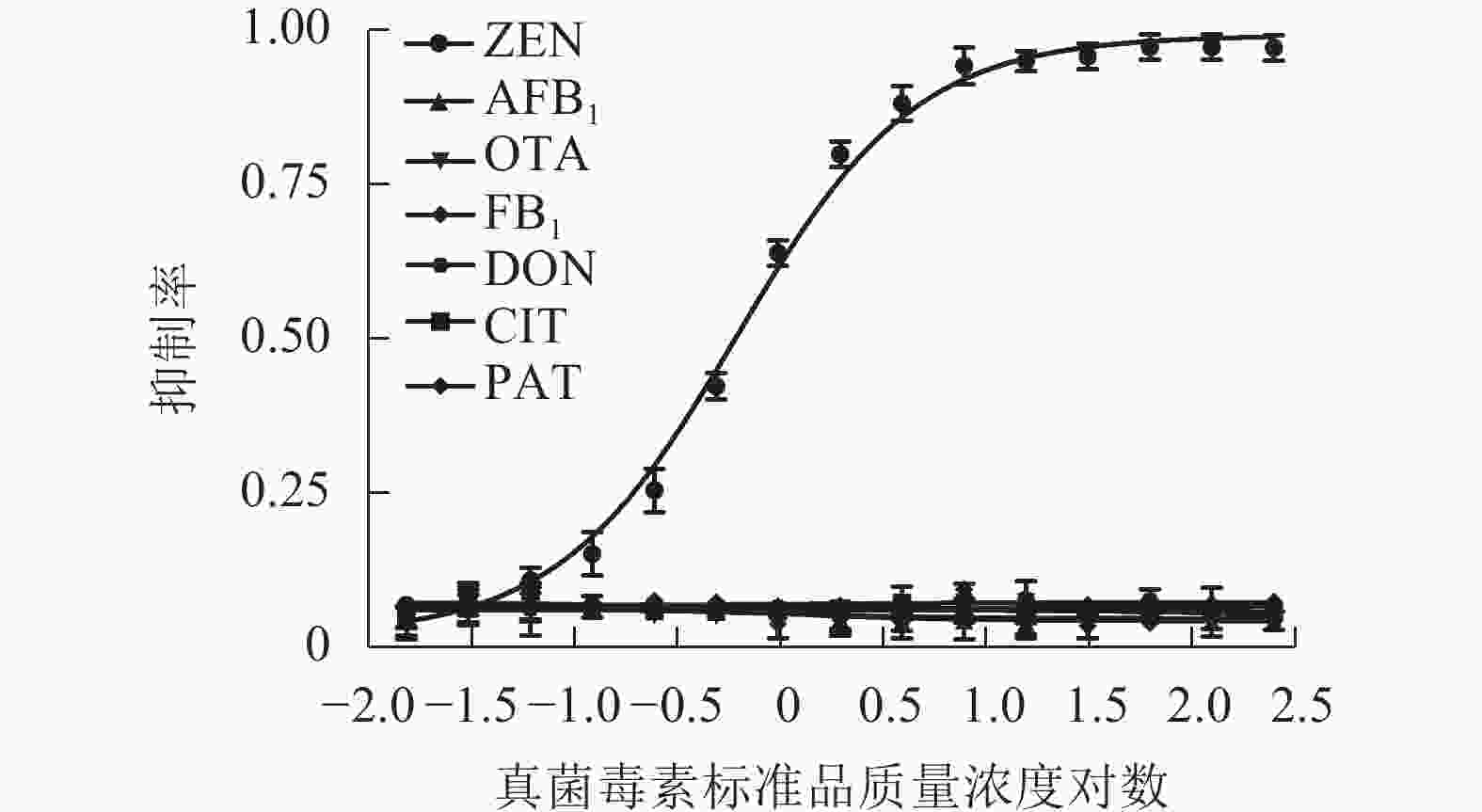
图 7 MNPs-ELISA检测不同真菌毒素标准抑制曲线
Figure 7. Competitive inhibition rates of different mycotoxins in MNPs-ELISA
表 2 MNPs-ELISA交叉反应率计算结果
Table 2. Results of cross reactivity rate calculation for MNPs-ELISA
竞争物 IC50/
(ng·mL−1)交叉反
应率/%竞争物 IC50/
(ng·mL−1)交叉反
应率/%ZEN 0.29 100 DON >500 <0.058 AFB1 >500 <0.058 CIT >500 <0.058 OTA >500 <0.058 PAT >500 <0.058 FB1 >500 <0.058 -
分别选取玉米、小麦和大豆Glycine max阴性样本,按照1.8所述制备萃取液,采用稀释法消除基质影响。通过绘制不同稀释倍数萃取液的基质添加曲线,并与标准抑制曲线进行对比。结果显示:上述样本萃取液基质效应在经超纯水4倍稀释后,基本消除。在后续检测时,萃取样本经超纯水4倍稀释后即可用于检测,简单快捷。
-
根据MNPs-ELISA的定量检测范围,设置加标质量分数依次为1.25、2.50、5.00和10.00 μg·kg−1,分别对玉米、小麦和大豆样本(LC-MS/MS验证ZEN阴性)进行加标试验,各质量分数设置3个平行且重复测定3次。结果表明:本研究建立的MNPs-ELISA加标回收率为83.2%~110.5%,且较为稳定(变异系数为6.3%~10.5%,表3)。
表 3 样本的加标回收率和批间变异系数
Table 3. Recovery and co-efficient of variances of samples spiked with different levels of ZEN by MNPs-ELISA
样本 ZEN质量分数/(μg·kg−1) 回收率/% 变异系数/% 加标 检出 玉米 1.25 1.04 83.2±5.3 6.4 2.50 2.16 86.4±6.5 7.5 5.00 5.19 103.8±9.4 9.1 10.00 9.37 93.7±7.1 7.6 小麦 1.25 1.12 89.6±5.6 6.3 2.50 2.69 107.6±8.9 8.3 5.00 5.23 104.6±7.7 7.4 10.00 11.05 110.5±9.8 8.9 大豆 1.25 1.08 86.4±8.2 9.5 2.50 2.13 85.2±6.1 7.2 5.00 5.17 103.4±10.9 10.5 10.00 9.53 95.3±8.3 8.7 说明:回收率数据为平均值±标准差。 -
分别运用MNPs-ELISA、商品化试剂盒和LC-MS/MS对ZEN污染的阳性样本进行定量检测,结果如表4所示。相关性分析显示:MNPs-ELISA检测结果与商品化试剂盒和LC-MS/MS间一致性较好(皮尔逊相关系数分别为
0.9647 和0.927 7),表明MNPs-ELISA方法可满足对实际样本中ZEN污染的快速定量检测需求。表 4 MNPs-ELISA、商品化试剂盒和LC-MS/MS对天然样本中ZEN的定量检测结果
Table 4. Quantitative detection of ZEN in natural samples by the MNPs-ELISA, commercial ELISA kit and LC-MS/MS
样本
编号ZEN/(μg·kg−1) 样本
编号ZEN/(μg·kg−1) MNPs-ELISA 商品化试剂 LC-MS/MS MNPs-ELISA 商品化试剂 LC-MS/MS 1 6.21±0.75 5.98±0.62 8.35±0.69 9 24.59±1.62 23.17±2.06 27.16±1.35 2 17.39±1.53 18.05±1.71 21.47±1.82 10 8.16±0.65 7.93±0.61 10.86±0.57 3 7.13±0.61 6.95±0.52 9.31±0.29 11 17.68±1.39 18.03±1.67 15.71±1.35 4 9.07±0.82 10.35±0.97 12.91±1.14 12 11.32±0.83 10.65±0.83 13.74±1.03 5 14.25±1.46 13.81±1.15 16.07±1.45 13 20.71±1.63 21.29±1.95 23.51±2.17 6 3.93±0.68 5.07±0.43 4.32±0.29 14 19.34±2.05 20.17±1.63 18.05±1.39 7 15.23±1.37 16.15±1.45 18.68±0.87 15 11.17±0.56 15.61±1.25 13.92±0.61 8 14.38±1.21 17.59±1.62 16.03±1.18 16 17.67±1.45 16.28±1.46 14.15±1.26 说明:数据为平均值±标准差。 -
本研究通过合成ZEN完全抗原,并包被至纳米磁珠表面,制备纳米磁珠-ZEN完全抗原复合物(MNPs-BSA-ZEN)作为免疫反应载体;同时采用生物素标记ZEN单克隆抗体(mAb-Bio),将纳米磁珠和生物素-链霉亲和素系统相结合,优化建立了高灵敏酶联免疫检测法(MNPs-ELISA)。与基于相同抗体的常规ci-ELISA相比(检测下限为0.12 ng·mL−1),在不增加检测时间的基础上,检测下限达0.05 ng·mL−1,灵敏度得到显著提升,实际样品检出限为1.00 μg·kg−1,完全满足谷物及饲料中ZEN的限量标准[26]。
作为应用最为广泛的免疫标记技术,酶免疫技术具有特异性高和方便快捷等优势;纳米磁珠虽粒径小但总表面积大,能结合更多抗原或抗体,提升反应效率,其表面的特异性修饰可减少免疫反应过程的非特异性结合,降低背景信号,通过外部磁场即可实现磁珠-靶标复合物与样本的快速分离;生物素与链霉亲和素间的结合稳定且几乎不可逆,不受其他生物分子干扰,属于自然界中已知最强的非共价互作,可实现信号放大,提升检测灵敏度。基于此,本研究利用纳米磁珠和生物素-链霉亲和素系统建立的MNPs-ELISA,相较常规固相反应模式,通过借助纳米磁珠的液相竞争使得反应更加充分;生物素-链霉亲和素系统的联合使用进一步提升了检测灵敏度;虽然纳米磁珠具有一定的使用成本,但该检测模式无需预包被检测板,磁珠复合物性质稳定,4 ℃条件可放置1 a,根据样本的具体数量随用随取,节约时间和人力,并且对酶标板的要求较低,总体降低了使用成本;酶免疫技术经简单的免疫反应,通过检测吸光度即可对结果进行定量分析,相较于LC-MS/MS等仪器法,无需借助复杂设备,操作简单,因此该新型酶联免疫检测法在基层检验机构和饲料食品加工企业中更易推广使用,具有较好的应用前景。
Development and application of a highly sensitive detection method for zearalenone based on magnetic nanoparticles and biotin-streptavidin system
-
摘要:
目的 作为镰刀菌属Fusarium产生的具有类雌激素效应的有毒次级代谢产物,玉米赤霉烯酮(ZEN)可广泛污染玉米Zea mays、大豆Glycine max和小麦Triticum aestivum等农作物,在谷物类食品和饲料中较为常见。因具有慢性、免疫和生殖毒性,建立ZEN高灵敏检测方法,对其进行暴露评估和风险防控具有重要意义。 方法 通过制备ZEN完全抗原-纳米磁珠复合物和生物素标记的ZEN单克隆抗体,并基于生物素-链霉亲和素系统,建立ZEN高灵敏酶联免疫检测法(MNPs-ELISA)。 结果 建立的MNPs-ELISA对ZEN检测下限(10%抑制质量浓度,IC10)达0.05 ng·mL−1,定量检测区间(20%~80%抑制质量浓度,IC20~IC80) 为0.08~1.04 ng·mL−1,半数抑制质量浓度(IC50)为0.29 ng·mL−1,与其他常见真菌毒素几乎无交叉反应。加标回收率高且稳定性好,对天然污染样本中ZEN的定量检测结果显示:该方法与商品化试剂盒及液相色谱-串联质谱联用技术一致性较好。 结论 本研究建立的MNPs-ELISA可满足对谷物和饲料样本中ZEN的快速定量检测,适用于基层检验机构和农产品加工企业对样本进行ZEN的筛查,具有较好的应用前景。图7表4参26 -
关键词:
- 玉米赤霉烯酮 /
- 纳米磁珠 /
- 生物素-链霉亲和素系统 /
- 单克隆抗体 /
- 定量检测
Abstract:Objective Zearalenone (ZEN), an estrogenic mycotoxin produced by Fusarium species, can widely contaminate cereal crops such as Zea mays, Glycine max, and Triticum aestivum, and is commonly found in cereal foods and feed. Due to its chronic, immunological, and reproductive effects, ZEN poses significant health risks. It will be of great significance to establish a highly sensitive ZEN detection method for exposure assessment and risk prevention and control. Method Based on the biotin-streptavidin amplification system, a highly sensitive enzyme-linked immunosorbent assay (MNPs-ELISA) for ZEN detection was developed by preparing ZEN complete antigen-conjugated magnetic nanoparticles (MNPs) and biotin-labeled ZEN monoclonal antibodies. Result The established MNPs-ELISA achieved a detection limit of 0.05 ng·mL−1 for ZEN (10% inhibitory concentration, IC10), a quantitative detection range of 0.08−1.04 ng·mL−1 (20%−80% inhibitory concentration range, IC20−IC80) and 50% inhibitory concentration of 0.29 ng·mL−1 (IC50), and there was almost no cross-reactivity with other common mycotoxins. Spike-recovery tests revealed high accuracy and stability. The quantitative detection results of ZEN in natural contaminated samples demonstrated that this method had good consistency with both commercial ELISA kits and liquid chromatography-tandem mass spectrometry (LC-MS/MS). Conclusion The established MNPs-ELISA method can meet the requirements for rapid quantitative detection of ZEN in cereal and feed samples, suitable for screening ZEN samples by grassroots inspection institutions and agricultural product processing enterprises, with good application prospects. [Ch, 7 fig. 4 tab. 26 ref.] -
表 1 纳米磁珠完全抗原复合物和生物素标记抗体组合浓度棋盘法结果
Table 1. Chessboard titration of MNPs-BSA-ZEN and the mAb-Bio
MNPs-BSA-ZEN稀释倍数 不同mAb-Bio稀释倍数所对应的D(450) 阴性对照 1∶1 000 1∶2 000 1∶4 000 1∶8 000 1∶16 000 1∶10 2.787 2 2.620 9 1.957 7 1.729 5 0.879 3 0.063 5 1∶20 2.438 6 2.260 2 1.504 9 0.869 1 0.397 1 0.053 9 1∶40 1.829 3 1.629 3 1.139 2 0.521 8 0.267 5 0.043 8 1∶80 1.614 5 1.447 6 0.809 2 0.517 5 0.250 1 0.041 7 表 2 MNPs-ELISA交叉反应率计算结果
Table 2. Results of cross reactivity rate calculation for MNPs-ELISA
竞争物 IC50/
(ng·mL−1)交叉反
应率/%竞争物 IC50/
(ng·mL−1)交叉反
应率/%ZEN 0.29 100 DON >500 <0.058 AFB1 >500 <0.058 CIT >500 <0.058 OTA >500 <0.058 PAT >500 <0.058 FB1 >500 <0.058 表 3 样本的加标回收率和批间变异系数
Table 3. Recovery and co-efficient of variances of samples spiked with different levels of ZEN by MNPs-ELISA
样本 ZEN质量分数/(μg·kg−1) 回收率/% 变异系数/% 加标 检出 玉米 1.25 1.04 83.2±5.3 6.4 2.50 2.16 86.4±6.5 7.5 5.00 5.19 103.8±9.4 9.1 10.00 9.37 93.7±7.1 7.6 小麦 1.25 1.12 89.6±5.6 6.3 2.50 2.69 107.6±8.9 8.3 5.00 5.23 104.6±7.7 7.4 10.00 11.05 110.5±9.8 8.9 大豆 1.25 1.08 86.4±8.2 9.5 2.50 2.13 85.2±6.1 7.2 5.00 5.17 103.4±10.9 10.5 10.00 9.53 95.3±8.3 8.7 说明:回收率数据为平均值±标准差。 表 4 MNPs-ELISA、商品化试剂盒和LC-MS/MS对天然样本中ZEN的定量检测结果
Table 4. Quantitative detection of ZEN in natural samples by the MNPs-ELISA, commercial ELISA kit and LC-MS/MS
样本
编号ZEN/(μg·kg−1) 样本
编号ZEN/(μg·kg−1) MNPs-ELISA 商品化试剂 LC-MS/MS MNPs-ELISA 商品化试剂 LC-MS/MS 1 6.21±0.75 5.98±0.62 8.35±0.69 9 24.59±1.62 23.17±2.06 27.16±1.35 2 17.39±1.53 18.05±1.71 21.47±1.82 10 8.16±0.65 7.93±0.61 10.86±0.57 3 7.13±0.61 6.95±0.52 9.31±0.29 11 17.68±1.39 18.03±1.67 15.71±1.35 4 9.07±0.82 10.35±0.97 12.91±1.14 12 11.32±0.83 10.65±0.83 13.74±1.03 5 14.25±1.46 13.81±1.15 16.07±1.45 13 20.71±1.63 21.29±1.95 23.51±2.17 6 3.93±0.68 5.07±0.43 4.32±0.29 14 19.34±2.05 20.17±1.63 18.05±1.39 7 15.23±1.37 16.15±1.45 18.68±0.87 15 11.17±0.56 15.61±1.25 13.92±0.61 8 14.38±1.21 17.59±1.62 16.03±1.18 16 17.67±1.45 16.28±1.46 14.15±1.26 说明:数据为平均值±标准差。 -
[1] ZHEN Hongmin, HU Yumeng, XIONG Ke, et al. The occurrence and biological control of zearalenone in cereals and cereal-based feedstuffs: a review [J]. Food Additives & Contaminants Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2024, 41(10): 1344−1359. [2] NESIC K, IVANOVIC S, NESIC V. Fusarial toxins: secondary metabolites of Fusarium fungi [J]. Reviews of Environmental Contamination and Toxicology, 2014, 228: 101−120. [3] RAI A, DAS M, TRIPATHI A. Occurrence and toxicity of a fusarium mycotoxin, zearalenone [J]. Critical Reviews in Food Science and Nutrition, 2020, 60(16): 2710−2729. [4] ESCRIVÁ L, FONT G, MANYES L. In vivo toxicity studies of fusarium mycotoxins in the last decade: a review [J]. Food and Chemical Toxicology, 2015, 78: 185−206. [5] 李凯龙, 刘昆仑, 辛颖, 等. 玉米赤霉烯酮生物降解及其脱毒机制研究进展[J]. 食品科学, 2025, 46(1): 246−254. LI Kailong, LIU Kunlun, XIN Ying, et al. Research progress on zearalenone biodegradation and its detoxification mechanism [J]. Food Science, 2025, 46(1): 246−254. [6] HUDU A R, ADDY F, MAHUNU G K, et al. Zearalenone contamination in maize, its associated producing fungi, control strategies, and legislation in Sub-Saharan Africa [J]. Food Science & Nutrition, 2024, 12(7): 4489−4512. [7] ESAN O O, OKANLAWON A A, OGUNRO B N, et al. Seasonal variation of mycotoxin levels in poultry feeds and feed ingredients in Oyo State, Nigeria [J]. Mycotoxin Research, 2024, 40(2): 319−325. [8] QU Zheng, REN Xianfeng, DU Zhaolin, et al. Fusarium mycotoxins: the major food contaminants [J]. mLife, 2024, 3(2): 176−206. [9] 莫凡, 姚婷, 胡深, 等. 免疫磁珠高通量全自动净化结合高效液相色谱快速测定饲料中玉米赤霉烯酮含量[J]. 动物营养学报, 2024, 36(11): 7454−7466. MO Fan, YAO Ting, HU Shen, et al. Determination of feed zearalenone content using high-throughput automatic immunomagnetic beads purification combined with high-performance liquid chromatography [J]. Chinese Journal of Animal Nutrition, 2024, 36(11): 7454−7466. [10] 章先, 王继璇, 程高钏, 等. 黄曲霉毒素B1高灵敏定性定量免疫层析检测方法的建立[J]. 浙江农林大学学报, 2022, 39(5): 1096−1103. ZHANG Xian, WANG Jixuan, CHENG Gaochuan, et al. A highly sensitive qualitative and quantitative immunochromatographic method for the detection of aflatoxin B1 [J]. Journal of Zhejiang A&F University, 2022, 39(5): 1096−1103. [11] CHEN Chaochao, LUO Liang, SHEN Jianzhong, et al. Metal-organic framework-based cascade catalysis-enabled fluorescent ELISA with higher enzymatic stability for zearalenone detection in maize [J]. Journal of Agricultural and Food Chemistry, 2025, 73(1): 790−797. [12] 朱燕, 姚香澳, 宫智勇. 稻谷中真菌毒素的暴露污染、检测技术及防控研究进展[J]. 食品安全质量检测学报, 2024, 15(15): 264−274. ZHU Yan, YAO Xiang’ao, GONG Zhiyong, et al. Research progress on exposure, detection and control of mycotoxins in rice grains [J]. Journal of Food Safety & Quality, 2024, 15(15): 264−274. [13] SARMAST E, FALLAH A A, JAFARI T, et al. Occurrence and fate of mycotoxins in cereals and cereal-based products: a narrative review of systematic reviews and meta-analyses studies [J]. Current Opinion in Food Science, 2021, 39: 68−75. [14] 文湘郡, 滕鑫, 丁星宇, 等. 一种新型检测大肠杆菌O157∶H7的免疫磁珠-量子点纳米颗粒的制备和应用[J]. 食品与发酵工业, 2022, 48(13): 48−54. WEN Xiangjun, TENG Xin, DING Xingyu, et al. Preparation and application of a novel immunomagnetic beads-quantum dot nanoparticles for the detection of Escherichia coli O157∶H7 [J]. Food and Fermentation Industries, 2022, 48(13): 48−54. [15] XING Yanping, LAN Xianli, LIU Xiyu, et al. Nanomaterial-mediated immunosensors and their performance in detecting tumor markers [J]. Discovery Medicine, 2024, 36(186): 1316−1333. [16] HANG Tianxiang, MENG Xingxing, WU Yueyue, et al. Ion-exchange reaction-mediated hierarchical dual z-scheme heterojunction for split-type photoelectrochemical immunoassays [J]. Analytical Chemistry, 2022, 94(49): 17295−17302. [17] HA Y, KIM I. Recent developments in innovative magnetic nanoparticles-based immunoassays: from improvement of conventional immunoassays to diagnosis of COVID-19 [J]. BioChip Journal, 2022, 16(4): 351−365. [18] HUANG Jingjie, ZHAO Kunxia, LI Miao, et al. Development of an immunomagnetic bead clean-up ELISA method for detection of Maduramicin using single-chain antibody in chicken muscle [J]. Food and Agricultural Immunology, 2021, 32(1): 820−836. [19] DENG Daokun, LI Xuan, ZHANG Jiujiu, et al. Biotin-avidin system-based delivery enhances the therapeutic performance of MSC-derived exosomes [J]. ACS Nano, 2023, 17(9): 8530−8550. [20] WARD T R. Artificial Metalloenzymes Based on the biotin-avidin technology: enantioselective catalysis and beyond [J]. Accounts of Chemical Research, 2011, 44(1): 47−57. [21] DIDEVARA E, SADOOGH ABBASIAN S, SADEGHI A, et al. Production of mutant streptavidin protein and investigation of its effect on the performance of streptavidin [J]. Iranian Journal of Basic Medical Sciences, 2023, 26(5): 572−578. [22] JIANG Wenxiao, LUO Pengjie, WANG Xia, et al. Development of an enzyme-linked immunosorbent assay for the detection of nitrofurantoin metabolite, 1-amino-hydantoin, in animal tissues [J]. Food Control, 2012, 23(1): 20−25. [23] 章先, 徐浩瑜, 赵鹿如, 等. 基于CdSe阳离子交换的玉米赤霉烯酮新型荧光免疫检测方法的建立及应用[J]. 菌物学报, 2022, 41(5): 819−829. ZHANG Xian, XU Haoyu, ZHAO Luru, et al. Sensitive fluorescence immunoassay for the detection of zearalenone base on signal amplification induced by cation exchange in CdSe quantum dots [J]. Mycosystema, 2022, 41(5): 819−829. [24] 章先, 方云, 付子贤, 等. 基于纳米金和辣根过氧化物酶双标记抗体的黄曲霉毒素B1高灵敏检测方法的建立及应用[J]. 菌物学报, 2018, 37(11): 1516−1524. ZHANG Xian, FANG Yun, FU Zixian, et al. An efficient method for aflatoxin B1 detection based on gold nanoparticles labeled with monoclonal antibody-horseradish peroxidase complex [J]. Mycosystema, 2018, 37(11): 1516−1524. [25] WANG Yuankai, YAN Yaxian, JI Wenhui, et al. Novel chemiluminescence immunoassay for the determination of zearalenone in food samples using gold nanoparticles labeled with streptavidin-horseradish peroxidase [J]. Journal of Agricultural and Food Chemistry, 2013, 61(18): 4250−4256. [26] 魏振, 王秋玲, 石继超, 等. 玉米赤霉烯酮检测方法研究现状[J]. 动物医学进展, 2022, 43(1): 117−121. WEI Zhen, WANG Qiuling, SHI Jichao, et al. Progress on detection methods of zearalenone [J]. Progress in Veterinary Medicine, 2022, 43(1): 117−121. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250120






 下载:
下载: