-
紫叶李Prunus cerasifera为蔷薇科Rosaceae李属Prunus落叶小乔木,其叶片色彩独特、树姿婀娜,较其他红色叶树种具长势迅速、树型优良、观赏期长等特点,通常被应用于园林绿地及观赏树种,效果甚佳。近年来,随着经济的不断发展,人们对园林绿化的重视程度不断提高,国内外出现越来越多关于观赏树种花、叶等器官的成色机制与环境影响因素相关性的研究成果。Deal[1]的研究表明红叶鸡爪槭Acer palmatum会因昼夜温差变大而出现叶色褪失的现象;彩叶秋海棠Begonia purpureofolia和紫叶矮樱Prunus cistena ‘Pissardii’会在较强光照下呈现深紫色,若光照减弱,叶片中花青苷合成量减少,导致叶色偏绿影响最佳观赏效果[2];万寿菊Tagetes erecta叶片中花青苷的合成与低温、高辐射和高光强等诸多环境因素有关[3];紫叶李、金叶接骨木Sambucus racemosa的日照时间超过12 h时,叶片颜色会更加鲜艳[4]。到目前为止,对紫叶李叶色的研究多集中于内外环境与花青苷的相关性分析[5-6],对其叶片各类色素的提取与成分的定性、定量分析未有报道。本研究从紫叶李叶片中提取相关色素,并运用紫外-可见分光光度计、薄层层析色谱法和高效液相色谱仪对提取的色素进行定性与定量分析,确定了其叶片成色的主要色素成分,以期为紫叶李品种改良、利用基因工程等手段调控叶片成色机制研究奠定理论基础。
HTML
-
采集生长于西北农林科技大学南校区内的紫叶李向阳面紫红色叶片为试材,采集时间为2012年6月。将采集的叶片表面用流水冲洗干净,轻柔吸干表面水珠后置于-80 ℃冰箱内保存待用。
-
试剂中色谱级甲醇、乙腈购自Spectrum公司;类黄酮标准样品根皮素、对香豆酸和芦丁购自天津一方科技有限公司;表儿茶素、槲皮素和儿茶素购自天津金测分析技术有限公司;其余标品均购自Sigma公司。仪器为高效液相色谱-二极管阵列检测仪(日立L-2000)、紫外-可见分光光度计(岛津-2450)。
-
取保存于-80 ℃冰箱中的紫叶李叶片,真空冷冻干燥72 h后研磨成粉待用。
-
叶绿素与类胡萝卜素萃取参考高俊凤[7]的方法并改进。在叶绿素萃取方法中,先称取0.50 g粉末,再用体积分数为90%丙酮溶液[V(丙酮):V(乙醇)=9:1]萃取并定容至20.0 mL,然后放置于4 ℃冰箱冷藏室萃取48 h。类胡萝卜素萃取,称取0.50 g粉末,用V(丙酮):V(石油醚)=1:1提取,定容至20.0 mL,提取条件同叶绿素萃取。花青苷的萃取参照 Li[8]的方法,称取1.00 g粉末,用体积分数为1%的甲醇盐酸(97.0 mL甲醇+ 3.0 mL 体积分数为36%的盐酸)萃取,定容至25.0 mL,完全遮光后放置在4 ℃冰箱冷藏室中萃取24 h,将上清转入新的容器中4 ℃遮光保存,再向残渣中加入25.0 mL甲醇盐酸,相同条件下萃取12 h,重复该操作2次,将3次萃取液的上清合并,旋转蒸发仪浓缩后用甲醇盐酸定容至25.0 mL。花青苷萃取液的水解参照辛转霞[9]的方法并加以改进,吸取600.0 μL甲醇盐酸萃取液与750.0 μL的2.0 mol·L-1盐酸混匀,恒温(95 ℃)加热45 min。加热后迅速冰上冷却,加入370.0 μL异戊醇剧烈震荡混匀,4 ℃下6 000 r min-1离心5 min ,待混合液分层后,将上相移至新的离心管中用于检测。其他类黄酮的萃取参照Li[8]的方法,称取1.00 g粉末,用25.0 mL甲醇溶液超声提取3次,合并萃取液,旋转蒸发浓缩后并定容至25.0 mL。
-
用紫外可见分光光度计分别检测上述萃取液的吸收峰及吸光度,波长范围为200~700 nm。叶绿素和类胡萝卜素的含量测定以文献[4]中的方法作为参考;总黄酮的含量测定采用中国药典[10]所记载的方法:用芦丁(rutin)为样品,制备梯度标准液,510 nm波长下测定吸光度值,得到质量浓度(c)与吸光度D(λ)的标准曲线,然后以紫叶李甲醇萃取液为样相同条件重复测定3次。紫叶李叶片总黄酮质量分数(mg·g-1)测定的公式为M=10×c×V1/(m×0.2 )。c为上述方法求得的总黄酮质量浓度(g·L-1);m为样品干质量(g);V1为样品定容体积(mL);0.2为待测萃取液的所用量(mL);10为测定液终定容体积(mL)[11]。花青苷水解液的检测,还需向萃取液中加入200.0 μL 体积分数为5% 氯化铝甲醇溶液后再次检测吸收峰[12]。
-
用玻璃毛细管虹吸待测萃取液和色素标样,点滴到纤维素层析板上,放入层析槽用不同的流动相进行色谱分离。该试验所用流动相为以下5种:Forestal溶液[V(浓盐酸):V(冰乙酸):V(水)=3:30:10];BAW溶液[V(正丁醇): V(冰乙酸):V(水)=6:1:2];30% HoAc溶液[V(冰乙酸):V(水)=3:7];Formic溶液[V(浓盐酸):V(甲酸):V(水)=2:5:3];BuHCL溶液[V(正丁醇):V(2 mol·L-1盐酸)=1:1]。萃取液各成分分离后,测定显色色斑在色谱上的Rf值,即色斑中心距原点的距离与溶剂展开前沿距原点距离的比值[13-14]。色素鉴定:多种类黄酮呈无色或淡黄色,很难用肉眼观察到。在本试验中,首先在正常光照条件下,测量显色色斑的Rf值,通过与标样对照确定化合物种类,然后将层析后的纤维素板用紫外光照射,观察类黄酮的颜色变化,通过对比标样并参考李玲等[15]的方法进行鉴定。将检测到的显色斑点用刀片轻轻刮下,用1.0 mL 体积分数为1%的甲醇盐酸溶液萃取,静置6 h后于14 000 r·min-1下离心1 min,将上清液用0.22 μm的滤膜过滤,置于4 ℃冰箱保存待用[8]。
-
本研究所用高效液相色谱仪(L-2000)选用L-2455型二极管阵列检测器进行检测。仪器参数:C18柱,柱温40 ℃,进样量10.0 μL,流速0.50 mL·min-1,检测波长为280 nm,520 nm,535 nm,540 nm。流动相参数:A为体积分数为0.05%的甲酸水溶液,B为色谱级乙腈。梯度洗脱程序为:0~40 min,A 95%~0,B 5%~100%;40~60 min,A 0,B 100%[9]。检测结束后绘制标准曲线,并计算叶片中各单体酚的质量分数(mg·kg-1)。
-
参照并改进周文彬等[16]的方法对紫叶李叶片细胞液的pH值进行测定,重复3次。
1.1. 试验材料
1.2. 试剂与主要仪器
1.3. 试验方法
1.3.1. 材料的预处理
1.3.2. 色素萃取
1.3.3. 紫外分光光度计检测
1.3.4. 薄层层析色谱法(TLC)鉴定色素色素分离
1.3.5. 高效液相色谱-二极管阵列检测法(HPLC-DAD)检测
1.3.6. pH值测定
-
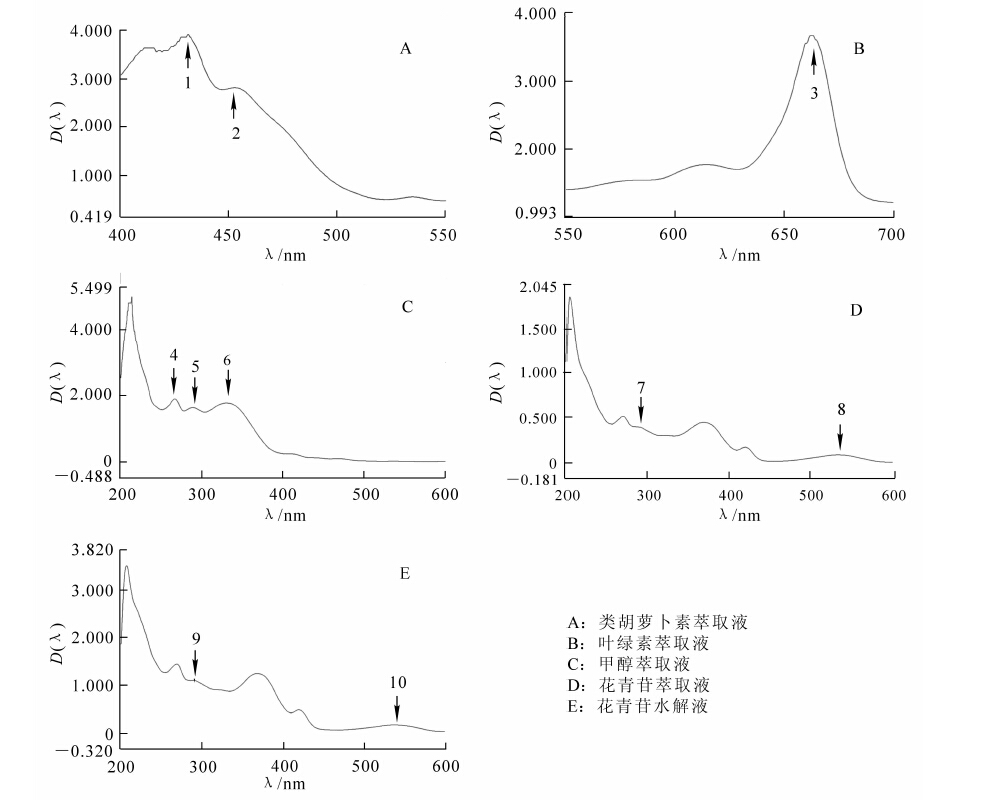
类胡萝卜素的吸收峰位于400~500 nm[8]。紫外分光光度计检测结果表明,紫叶李叶片的类胡萝卜素萃取液在这个区间内有2个吸收峰(图 1A,峰1和峰2),表明叶片中含有类胡萝卜素(图 1A,峰2),根据类胡萝卜素定量方法计算得到类胡萝卜为0.76 mg·g-1。叶绿素的吸收峰区间为600~700 nm[7]。紫叶李叶片的叶绿素萃取液在662 nm处检测到吸收峰(图 1B,峰3),这与叶绿素a的特征吸收峰(663 nm)相符,表明紫叶李叶片中有叶绿素的存在,且叶绿素a较多。根据叶绿素定量方法计算得到叶绿素a为1.69 mg·g-1,叶绿素b为1.06 mg·g-1,叶绿素总为2.74 mg·g-1。花青苷萃取液的紫外分光光度计检测结果表明:在283 nm(图 1D,峰7)和533 nm(图 1D,峰8)处有2个特征吸收峰,这2个峰均位于类黄酮化合物的特征吸收峰区间内(280 nm附近和 500~550 nm),说明紫叶李叶片内含有黄酮类化合物[17]。将紫叶李叶片水解液也进行紫外分光光度计检测。结果显示:紫叶李叶片水解液在283 nm(图 1E,峰9)和536 nm(图 1E,峰10)处有吸收高峰,说明可能存在花青素类的矢车菊素和飞燕草素[18]。向上述水解液中加入体积分数为5% 氯化铝后,可见光区的最大吸收峰波长由533 nm移动到535 nm,说明紫叶李叶片中所含花青苷可能是矢车菊素、矮牵牛素和飞燕草素中的一种或多种[12]。类黄酮化合物除了花青苷/素之外,还包括黄酮、黄酮醇、二氢黄酮醇等[19]。对甲醇萃取液在200~600 nm 范围内进行紫外光谱扫描,结果显示:在270 nm(图 1C,峰4),290 nm(图 1C,峰5)和369 nm(图 1C,峰6)处有吸收峰,说明紫叶李叶片中可能含有二氢黄酮醇、黄酮醇和黄烷酮类物质[20]。根据总黄酮测定方法,得到标准品芦丁的吸光度D(λ)与标准液质量浓度(c)的标准曲线方程:c =0.537 8 D(λ)-0.008,R2=0.999 9,计算得到紫叶李叶片甲醇萃取液中总黄酮的质量分数为 38.68 mg·g-1。据此初步推测,紫叶李叶片呈现红色的主要原因可能是花青素大量积累的结果,同时也伴有其他黄酮类化合物的存在。
-
将紫叶李水解萃取液在5种流动相中展开,观察到薄层板上均有1个红色斑点(图 2),其对应Rf值如表 1所示。与矢车菊素和矢车菊素半乳糖苷标准品的Rf值对比发现,紫叶李叶片中主要的花青素种类可能为矢车菊素半乳糖苷及其他矢车菊素衍生物。
流动相 体积比 Rf值 花青素萃取液 矢车菊素半乳糖苷 矢车菊素 30% HoAc V(冰乙酸):V(水)=3:7 0.64 0.57 0.38 Forestal V(浓盐酸 ):V(冰乙酸 ):V(水 )=2:5:3 0.63 0.57 0.22 Forestal V(浓盐酸 ):V(冰乙酸 ):V(水 )=3:30:10 0.73 0.6 0.44 BAW V(正丁醇 ):V(冰乙酸 ):V(水 )=6:1:2 0.44 0.34 0.88 BuHCL V(正丁醇 ):V(2 mol.L-1 盐酸 )=1:1 0.27 0.28 0.85 Table 1. Rf values of anthocyanin extracts of Prunus cerasifera leaves in five mobile phase
-
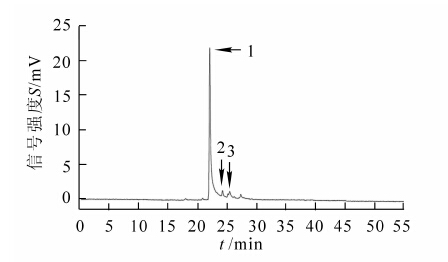
将经薄层层析分析后刮板并重复萃取的紫叶李叶片花青苷水解液用HPLC-DAD进行检测,在22.09,24.38,25.05 min处检测到3个吸收峰,这与标准品矢车菊素、矮牵牛素、天竺葵素的出峰时间基本一致,推断萃取液中有矢车菊素、矮牵牛素和天竺葵素(图 3,峰1~3)的存在。确定母体色素后,进而检测其自然状态下花青苷的组成,在18.50,19.30,19.72 min处检测到吸收峰,与标准品矢车菊素半乳糖苷、芸香苷、阿拉伯糖苷的出峰时间基本一致,推断为矢车菊素半乳糖苷、芸香苷、阿拉伯糖苷(图 4,峰4~6),其中大部分是矢车菊素的衍生物,还有少量糖苷和矮牵牛素及天竺葵素结合成花青苷。除花青苷外,还有其他类黄酮化合物在紫叶李叶片成色过程中起辅助作用,甲醇萃取液检测到10种我们已鉴定出的类黄酮(图 5,峰7~16),其保留时间依次为26.89,30.90,31.62,32.01,33.53,34.44,38.02,39.32,44.97,46.55 min,与标准品表儿茶素、二氢杨梅酮、芦丁、对香豆酸、香豆酸、二氢槲皮素、根皮苷、杨梅素、槲皮素、芹菜素的保留时间是相同的,推断萃取液中存在这10种化合物。根据所得标准曲线方程对这些化合物进行定量分析,结果如表 2所示。图 5中出现的s1和s2等2个吸收峰尚未鉴定出其对应的化合物种类,还需后续试验进行进一步的鉴定分析。单体酚标准样品液相图谱见图 6。
编号 中文名称 英文名称 保留时间t/min 标准曲线方程 质量分数/(mg·kg-1) 1 矢车菊素 cyanidin 22.09 y=7E-08x+0.001 2,R2=0.999 3 168.00 ± 0.34 2 矮牵牛素 petunidin 24.38 y=3E-07x+0.005 2,R2=0.999 3 156.00 ± 0.23 3 天竺葵素 pelargonidin 25.05 y=3E-08x+0.000 3,R2=0.999 6 67.65 ± 0.37 4 矢车菊素半乳糖苷 cyanidin-galactoside 18.5 y=7E-08x+0.000 9,R2=0.999 8 4 600.00 ± 11.50 5 矢车菊素云香苷 cyanidin-rutin 19.3 y=7E-08x+0.000 9,R2=0.999 8 100.25 ± 0.19 6 阿拉伯糖苷 arabinopyranoside 19.72 y=7E-08x+0.000 9,R2=0.999 0 165.50 ± 0.34 7 表儿茶素 epicaetchin 26.89 y=2E-07x-0.014 1,R2=0.999 9 2 294.00 ± 9.80 8 二氢杨梅酮 dihydromyricetin 30.93 y=3E-08x-0.000 3,R2=0.999 6 650.30 ± 1.20 9 芦丁 rutin 31.62 y=8E-07x-0.032 6,R2=0.999 2 6 500.00 ± 13.55 10 香豆酸 coumalic acid 32.01 y=1E-07x-0.001 5,R2=0.999 9 460.00 ± 0.66 11 对香豆酸 p-coumaric acid 33.53 y=1E-07x-0.001 8,R2=0.999 7 2 336.00 ± 10.56 12 二氢槲皮素 dihydroquercetin 34.44 y=6E-08x+0.003 3,R2=0.999 3 540.00 ± 0.97 13 根皮苷 phlorizin 38.02 y=2E-08x+0.002 6,R2=0.999 2 487.38 ± 2.00 14 杨梅素 myricetin 39.32 y=6E-08x+0.000 9,R2=0.999 5 369.00 ± 0.65 15 槲皮素 ouecetin 44.97 y=2E-08x+0.000 4,R2=0.999 7 5 700.00 ± 15.17 16 芹菜素 apigenin 46.55 y=2E-08x+0.003 5,R2=0.999 6 489.60 ± 0.69 Table 2. The monomeric phenol contents in Prunus cerasifera leaves
2.1. 紫外可见分光光度计检测
2.2. 薄层层析色谱检测
2.3. 高效液相色谱检测
-
紫叶李初春芽为红色,展叶后颜色逐渐加深,盛夏满株娇艳紫红,是园林绿化树种中红色叶保持时间最为持久的树种之一。植物叶片所含主要成色色素有叶绿素、类胡萝卜素、类黄酮和甜菜碱色素等[21]。到目前为止,甜菜碱色素只在少数几种植物中分离得到,并且尚未发现其与花青苷同时存在于同一植物细胞组织中。在对紫叶李叶片的不同萃取液进行分析时,均未检测到甜菜碱色素的特征吸收峰,据此推断,紫叶李叶片中不存在有甜菜碱类色素。通过高效液相色谱仪-二极管阵列检测器对紫叶李叶片的甲醇盐酸萃取液及水解液进行分析,检测到矢车菊素与矢车菊素半乳糖苷同时存在于萃取液中,数据显示,矢车菊素半乳糖苷的质量分数(4 600.00 ± 11.50 mg·kg-1)远远高于矢车菊素质量分数(168.00 ± 0.34 mg·kg-1),而薄层层析分析中只观察到1个斑点(矢车菊素半乳糖苷),可能是因为紫叶李中花青苷多以矢车菊素衍生物的形式存在,而矢车菊素太少导致无法在层析板上观察到。此外,除含有矢车菊素半乳糖苷和矢车菊素外,紫叶李叶片中还含有少量的矮牵牛素和天竺葵素。花青苷类色素是红色叶植物成色的主要色素,但其他黄色或无色色素也起着重要作用,在它们的辅助下,植物叶片才呈现出饱满的色彩[22]。在植物中,花青苷和叶绿素的质量分数比会影响其所在器官颜色的呈现[23],因此,紫叶李中两者的存在及相对含量对其叶片颜色的加深有很大影响。经检测,紫叶李叶片细胞液的pH 5.20,通常来说,偏酸性(pH 5.00~5.50)环境下矢车菊素半乳糖苷的颜色为亮红色[24],而紫叶李成熟叶片的颜色为紫红色,导致这种现象的原因可能是叶绿素(2 744.00 mg·kg-1)与矢车菊素半乳糖苷(4 600.00 mg·kg-1)的共同存在与相互作用。紫叶李叶片中还含有槲皮素、杨梅素、芦丁、芹菜素、二氢杨梅素、二氢槲皮素、表儿茶素、根皮苷、类胡萝卜素等物质,它们作为辅助色素对紫叶李叶色的形成也起着一定的作用。















 DownLoad:
DownLoad: