-
慈竹Neosinocalamus affinis属禾本科Poaceae竹亚科Bambusoideae植物,别称大叶慈竹、绵竹等,主要分布在中国西南部地区,包括四川、贵州、云南、陕西南部及甘肃南部等地[1−2]。慈竹有着适应性强、生长快、竹笋产量高等特点,栽植3~5 a后即可成林,可持续利用百年,是优良的笋竹两用品种[3]。慈竹竹叶在中医中被广泛使用,主要用于清热利尿、除烦止渴、小便短赤和口舌生疮等症,此外慈竹竹叶中含有的黄酮类化合物(槲皮素、芦丁等)、多糖等物质具有显著抗氧化、降血糖以及抗炎等活性[4−5]。中国作为全球竹资源最丰富的国家之一,竹产业整体开发水平仍显不足,占竹体总量约35%的竹叶资源长期被视作生产废弃物,若将其充分利用,可提升慈竹的资源利用率[6−7]。
黄酮类化合物(flavonoids)是一种广泛存在于植物体内的天然产物,是多种药用植物的有效成分[8−9]。竹叶黄酮(BLF)作为多效生物活性物质,其功能特性涵盖抗氧化、抗炎及增强免疫力等方面[10−11]。YANG等[12]通过高脂血症大鼠模型发现:竹叶黄酮能随剂量升高而降低血清总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)水平,其作用机制与调节AMPK/SREBP-2信号通路相关。区少碧等[13]研究表明:竹叶黄酮能降低活性氧(ROS)水平,并通过增加超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)等相关酶活性来抑制氧化应激。黄酮类化合物有着调节血糖水平的功效,可以通过选择性抑制α-葡萄糖苷酶和α-淀粉酶来减缓肠道黏膜对葡萄糖的摄取速率,从而有效控制餐后血糖波动,达到平稳降糖的治疗效果[14−15]。然而,关于慈竹竹叶黄酮类化合物降血糖的物质基础及作用机制还未见报道。
为分析慈竹竹叶黄酮的化学组成,并探究其在降血糖活性方面的作用,本研究采用超高效液相色谱-四极杆-飞行时间串联质谱(UPLC-QTOF-MS/MS)技术对纯化竹叶黄酮(PBLF)进行鉴定,并探究其对α-淀粉酶和α-葡萄糖苷酶的抑制作用。同时,通过Lineweaver-Burk和Dixon方程构建酶动力学模型,解析慈竹竹叶黄酮降血糖活性的抑制类型及其协同作用机制,以期为慈竹资源的开发利用提供科学依据。
-
慈竹竹叶于2024年11月采自西南林业大学树木园,样本保存于西南林业大学生物与食品工程学院。
试验所用试剂包括:α-葡萄糖苷酶(7×105 μmol·mL−1·min−1,江苏伊势久生物有限公司);阿卡波糖及对硝基苯-α-D-葡萄糖苷(PNPG)(合肥千盛生物科技有限公司);α-淀粉酶(4×103 μmol·g−1·min−1)、淀粉显色反应配置DNS溶液(上海源叶生物技术有限公司)与配套磷酸盐缓冲体系(Na2HPO4/KH2PO4,天津科密欧化学试剂有限公司);可溶性淀粉及碳酸钠(郑州津北化工);色谱级乙腈/甲酸(安捷伦科技)。其余化学试剂均为分析纯。
-
慈竹鲜叶经清洗后放入烘箱中,在60.0 ℃下干燥18 h,烘干后粉碎过筛制得慈竹竹叶粉末。取定量样品按料液比1∶20加入体积分数为80%的乙醇,在50.0 ℃、309 kW下超声62 min辅助浸提。提取液经真空抽滤及旋蒸脱醇得粗提液,−18.0 ℃预冻后在−65.5 ℃下冷冻干燥(2 Pa)获得粗黄酮。经AB-8型大孔树脂层析(体积分数为70%的乙醇梯度洗脱),洗脱液2次脱醇冻干后得纯化竹叶黄酮粉末。
-
精确称取纯化样品125 mg,经1 mL预冷甲醇涡旋震荡溶解,12 000 r·min−1离心20 min后,上清液通过0.22 μm有机滤膜完成无菌化处理,制得液相色谱-质谱(LC-MS)进样溶液。
-
配置Waters BEH C18色谱柱(2.1 mm×100.0 mm×1.7 μm),流动相为质量分数0.1%的甲酸水溶液(A)-乙腈(B)体系,流速为0.3 L·min−1,柱温箱设定为40 ℃。采用梯度洗脱模式(程序见表1),自动进样器定量注入5 μL待测样品。
洗脱时间/min 流动相A体积分数/% 流动相B体积分数/% 0 95 5 2 95 5 20 5 95 25 5 95 26 95 5 30 95 5 Table 1. Elution procedure
-
采用电喷雾电离(ESI)进行正离子和负离子模式检测。使用加热电喷雾离子(HESI)源进行离子化,电离参数设定:喷雾电压(+4 kV/−3.2 kV);毛细管温度为350 ℃;鞘气/辅助气流速为40/5 L·min−1,扫描范围为50~1 200 m/z。应用 UPLC-QTOF-MS/MS技术获取相应色谱质谱数据。黄酮类化合物的鉴定采用多反应监测(MRM)模式检测待测离子对。对数据中缺失值超过50%的代谢物离子峰进行去除;采用MultiQuant软件提取色谱峰面积及保留时间。利用混标、保留时间、Q1/Q3离子对、二级质谱等相关条件进行纯化竹叶黄酮成分鉴定。
-
基于mzCloud、mzVault及PubChem多数据库联用技术,并参考王倩等[16]的方法完成黄酮类化合物的结构解析。
-
参照俞遴等[17]的方法对α-葡萄糖苷酶进行测定,实验流程如下:用磷酸盐缓冲液(PBS,0.1 mol·L−1,pH 6.8)配制不同浓度梯度的待测样品溶液。取25 μL α-葡萄糖苷酶溶液(2 μmol·mL−1·min−1)与120 μL PBS于反应体系中,混合均匀后在37 ℃恒温水浴15 min。随后加入25 μL PNPG溶液(2.5 mmol·L−1,PBS配制),继续在37 ℃条件下反应25 min。终止反应时加入100 μL碳酸钠溶液(0.2 mol·L−1),再使用酶标仪检测波长405 nm下的吸光值(A1)。设置2组对照:空白组以等体积PBS替代酶液,对照组以PBS代替样品溶液,分别测得吸光值A2和A0。按公式(1)计算样品对酶活性的抑制率(H)。
式(1)中:A0为pH=6.8时的磷酸盐缓冲液吸光值;A1为所加入样品的吸光值;A2为用磷酸盐缓冲液代替α-葡萄糖苷酶溶液的吸光值。
-
参照潘玥等[18]的方法进行试验。步骤如下:固定纯化竹叶黄酮溶液质量浓度梯度(0.02~0.10 mg·mL−1,PBS配制),底物PNPG浓度梯度(0.5~2.5 mmol·L−1)。参照1.4.1方法测定不同底物浓度下的酶促反应速率,其中酶促反应速率以单位时间的吸光度变化值表示。通过比较不同抑制剂浓度下斜率与纵截距的变化规律,结合米氏方程动力学参数分析,判定纯化竹叶黄酮对α-葡萄糖苷酶的抑制模式。
式(2)中:V为酶促反应速率;Vmax为最大反应速率;S为底物质量浓度(mg·mL−1);Km为米氏常数(g·L−1)。
混合型抑制类型Dixon方程可进一步验证抑制类型并确定相关抑制常数。
式(3)中:I为抑制剂质量浓度(g·L−1);KI为抑制剂对酶的抑制常数;KIS为抑制剂对酶-底物复合物的抑制常数。
-
参照温柔等[19]的方法采用3,5-二硝基水杨酸(DNS)显色法进行试验。
-
参照刘承毅等[20]的方法。α-淀粉酶抑制动力学机制研究采用Lineweaver-Burk双倒数法。试验设计:设置纯化竹叶黄酮溶液质量浓度梯度(0.1~0.5 mg·mL−1,PBS配制),底物可溶性淀粉质量浓度梯度(2.0~10.0 g·L−1)。参照1.4.2试验流程,测定不同底物质量浓度下的酶促反应速率,其中酶促反应速率以单位时间的吸光度变化值表示。
-
采用SPSS 21.0进行数据处理,Origin 2021进行绘图,每组实验平行测定3次,所得结果以平均值±标准差表示。
-
通过PubChem、ChemSpider等数据库,查阅相关文献,对比图1相关化合物的采集时间和离子丰度,共鉴别出18种黄酮类化合物(表2)。将这些化合物的峰面积对比得知:黄酮含量较高的化合物主要包括甘草黄酮醇、异鼠李素-7-芸香糖苷、宝藿苷Ⅰ、穿心莲素F、表紫草氰苷Ⅱ、矢车菊素3-O-β-D-半乳糖苷、5,7,2',4',6'-五甲氧基黄酮,5-羟基-6,7,3-三甲氧基黄酮-8-O-β-D-葡萄糖苷等。其中已有研究表明:部分化合物有着抗氧化、降血糖等功效,如甘草黄酮醇可抑制餐后血糖,在2型糖尿病模型中,可有效降低模型的空腹血糖值、糖化血红蛋白(HbA1c)及尿糖水平,同时升高高密度脂蛋白胆固醇(HDL-C)[21]。此外,体外试验表明:甘草黄酮醇可显著抑制α-葡萄糖苷酶活性,延缓碳水化合物的水解与吸收,降低餐后血糖峰值[22]。甘草黄酮醇还可通过清除自由基、提升超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,以及增加还原型谷胱甘肽(GSH)含量,显著改善尿酸诱导的氧化应激损伤[23]。同时,甘草黄酮醇能降低丙二醛(MDA)和过氧化氢(H2O2)水平,减轻细胞氧化损伤。曹文洁等[24]对异鼠李素-7-芸香糖苷的抗炎、抗氧化、抗肿瘤、调节血糖等作用进行过介绍,异鼠李素-7-芸香糖苷是一种广泛存在于药用植物的黄酮醇类化合物,核心机制是改善胰岛素敏感性,能激活AMPK信号通路,促进骨骼肌和脂肪组织的葡萄糖摄取与利用;同时通过激活PPAR-γ受体,增强胰岛素信号传导,改善胰岛素抵抗,从而抑制血糖水平。此外还有研究表明:异鼠李素-7-芸香糖苷在糖尿病模型中可显著降低空腹血糖、糖化血红蛋白(HbA1c)及血脂紊乱指标[25]。体外实验进一步证实:主要活性成分异鼠李素-7-芸香糖苷可显著抑制α-葡萄糖苷酶活性,这些结果都表明:纯化竹叶黄酮具有潜在的降糖生物活性[26]。宝藿苷Ⅰ是一种多羟基黄酮苷类化合物,蔡钊萌等[27]研究发现:宝藿苷Ⅰ具有降血糖、心血管保护、抗肿瘤、免疫调节等作用。宝藿苷Ⅰ作为雌激素受体激动剂,在雌性糖尿病模型中效果更显著,试验表明其在卵巢切除的糖尿病小鼠中,降糖效果减弱,补充雌激素后恢复[28]。宝藿苷Ⅰ还通过PPARγ/AMPK双路径激活、β细胞保护及G蛋白偶联雌激素受体 (GPER)介导的雌激素作用多靶点调控糖代谢,在动物模型中表现出显著的降糖功效。
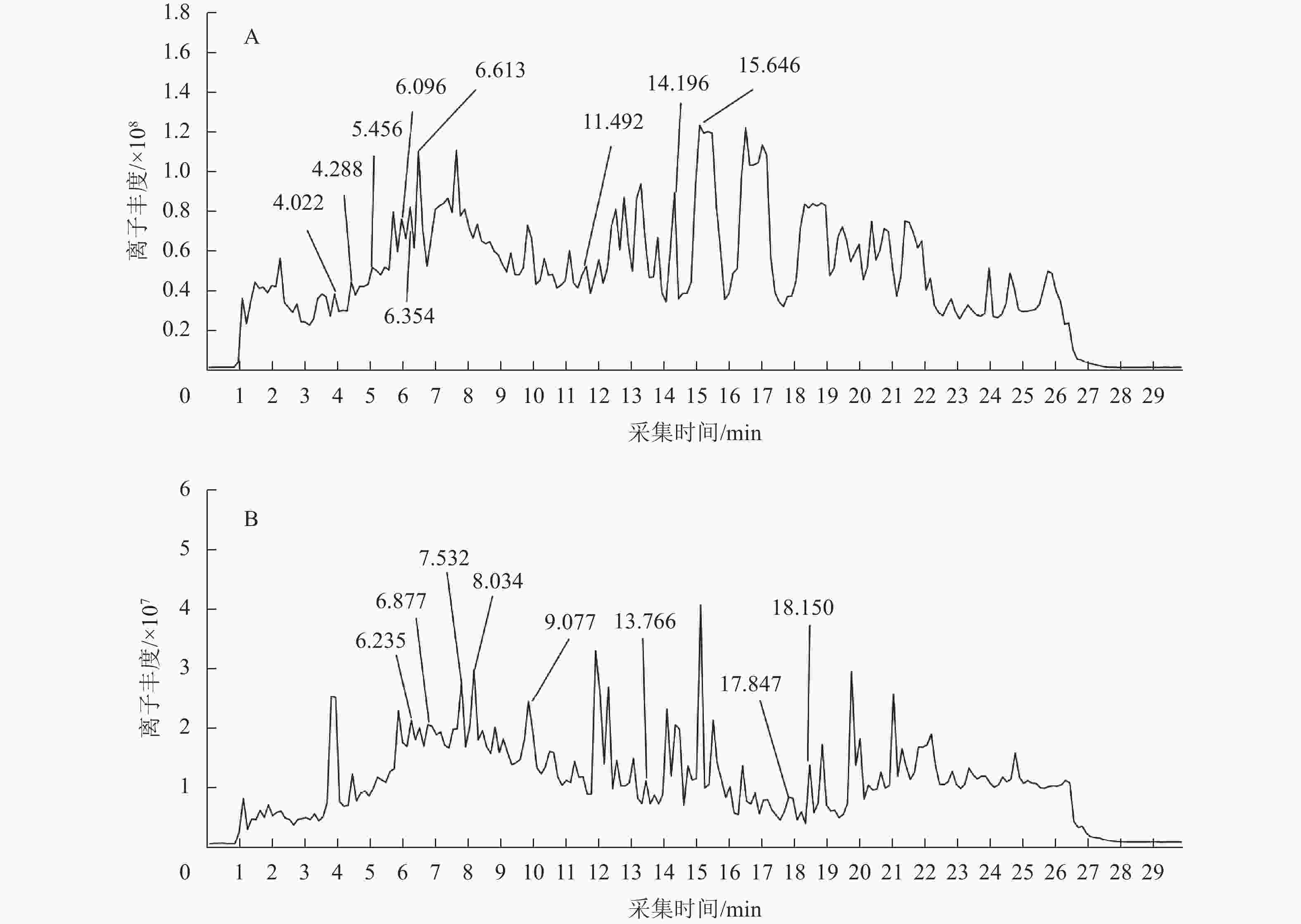
Figure 1. Total ion flow diagrams of purified bamboo leaf flavonoids in positive ion mode (A) and negative ion mode (B)
序号 化合物名称 离子模式 保留时间/
min分子式 分子m/z 碎片m/z 1 5,7,4'-三羟基-6-C-阿拉伯糖苷-8-C-葡萄糖苷黄酮trihydroxy-6-C-arabinoside-8-C-glucoside flavone [M-H]− 6.235 C26H28O14 563.139 7 561.162 1 2 3,4',5,7-四羟基黄酮-3-L-鼠李糖苷3,4',5,7-tetrahydroxyflavone-3-L-rhamnoside [M-H]− 6.877 C21H20O10 431.098 7 533.261 6 3 3,6,8,3',4'-五甲氧基-5,7-二羟基黄酮3,6,8,3',4'-Pentamethoxy-5,7-dihydroxyflavone [M-H]− 7.137 C20H20O9 403.104 1 769.219 7 4 5,7,2',4',6'-五甲氧基黄酮5,7,2',4',6'-Pentamethoxyflavone [M-H]− 7.532 C20H20O7 371.114 6 93.035 0 5 5-羟基-6,7,3-三甲氧基黄酮-8-O-β-D-葡萄糖苷5-Hydroxy-6,7,3-trimethoxyflavone-8- O-β-D-glucoside [M-H]− 8.034 C24H26O12 505.136 3 517.266 4 6 甘草黄酮醇A glycyrrhiza-flavonol A [M-H]− 9.077 C20H18O7 369.097 7 115.320 4 7 5,7,2',3'-四羟基黄酮5,7,2',3'-tetrahydroxyflavone [M-H]− 13.766 C15H10O6 285.041 3 165.019 5 8 5,7,2',3'-四羟基黄酮5,7,2',3'-tetrahydroxyflavone [M-H]− 17.847 C15H10O6 285.041 2 373.075 7 9 5,7,2',3'-四羟基黄酮5,7,2',3'-tetrahydroxyflavone [M-H]− 18.150 C15H10O6 285.041 9 323.132 9 10 异鼠李素-7-芸香糖苷isosakuranetin-7-rutinoside [M+H]+ 4.022 C28H34O14 595.202 1 277.217 8 11 异鼠李素-7-芸香糖苷isosakuranetin-7-rutinoside [M+H]+ 4.288 C28H34O14 595.202 5 275.202 6 12 1-O-龙胆二糖基-3,7-二甲氧基-8-羟基黄酮1-O-gentiobiosyl-3,7-dimethoxy-8-hydroxyxanthone [M+H]+ 5.456 C27H32O16 612.167 9 331.251 2 13 1-O-龙胆二糖基-3,7-二甲氧基-8-羟基黄酮1-O-gentiobiosyl-3,7-dimethoxy-8-hydroxyxanthone [M+H]+ 6.096 C27H32O16 612.168 6 371.248 1 14 2,3,4,7-四甲氧基黄酮-1-O-β-D-吡喃木糖-(1-6)-β-D-吡喃葡萄糖苷2,3,4,7-tetramethoxyxanthone-1- O-β-D-xylopyranosyl-(1-6)- β-D-glucopyranoside [M+H]+ 6.354 C28H34O16 626.183 7 277.182 2 15 穿心莲素F andrographin F [M+H]+ 6.613 C25H28O13 536.151 6 539.214 2 16 宝藿苷Ⅰ baohuoside Ⅰ [M+H]+ 11.492 C27H30O10 515.192 0 328.251 0 17 表紫草氰苷Ⅱ epimedokoreanoside Ⅱ [M+H]+ 14.196 C36H44O16 733.268 9 279.233 8 18 矢车菊素3-O-β-D-半乳糖苷cyanidin 3- O-β-D-galactoside [M+H]+ 15.646 C21H21O11 449.109 6 291.179 5 Table 2. Compositional information of purified bamboo leaf flavonoids
穿心莲素F在动物模型中显示出降血糖和调脂作用,通过激活AMPK信号通路改善胰岛素抵抗,或通过抑制脂肪生成酶(如FAS)调节脂代谢,常用于糖尿病或非酒精性脂肪肝的辅助治疗[29]。表紫草氰苷Ⅱ能激活脑内胰岛素通路,通过AMPK/PGC-1α介导的线粒体修复、胰岛β细胞保护及肝肾并发症干预发挥多维度降糖作用,这对糖尿病神经性病变具有重要意义[30]。同时,本研究的竹叶经纯化后,竹叶中黄酮类化合物纯度明显提升,可使这18种竹叶黄酮化合物在降血糖方面的协同作用增加,其协同性体现在3个维度:第一是作用靶点互补。例如甘草黄酮醇和异鼠李素-7-芸香糖苷侧重肠道α-葡萄糖苷酶抑制(控制餐后血糖),宝藿苷Ⅰ和紫草氰苷Ⅱ强化AMPK通路(改善胰岛素敏感性),穿心莲素F则激活μ受体(肠促胰岛素效应)。这种靶点分布覆盖了糖代谢全过程。第二是器官保护协同。矢车菊素3-O-β-D-半乳糖苷的肾脏保护与5,7,2',4',6'-五甲氧基黄酮的β细胞抗氧化形成并发症防御网,而宝藿苷Ⅰ的神经保护与其他成分的肝糖调控共同维护多器官功能。第三是药代动力学增效。比如宝藿苷Ⅰ的自组装胶束技术可迁移应用于其他成分,甘草黄酮醇的分散片工艺也能提升整体生物利用度[31]。因此慈竹竹叶黄酮是一种具有降血糖潜力的活性成分。
-
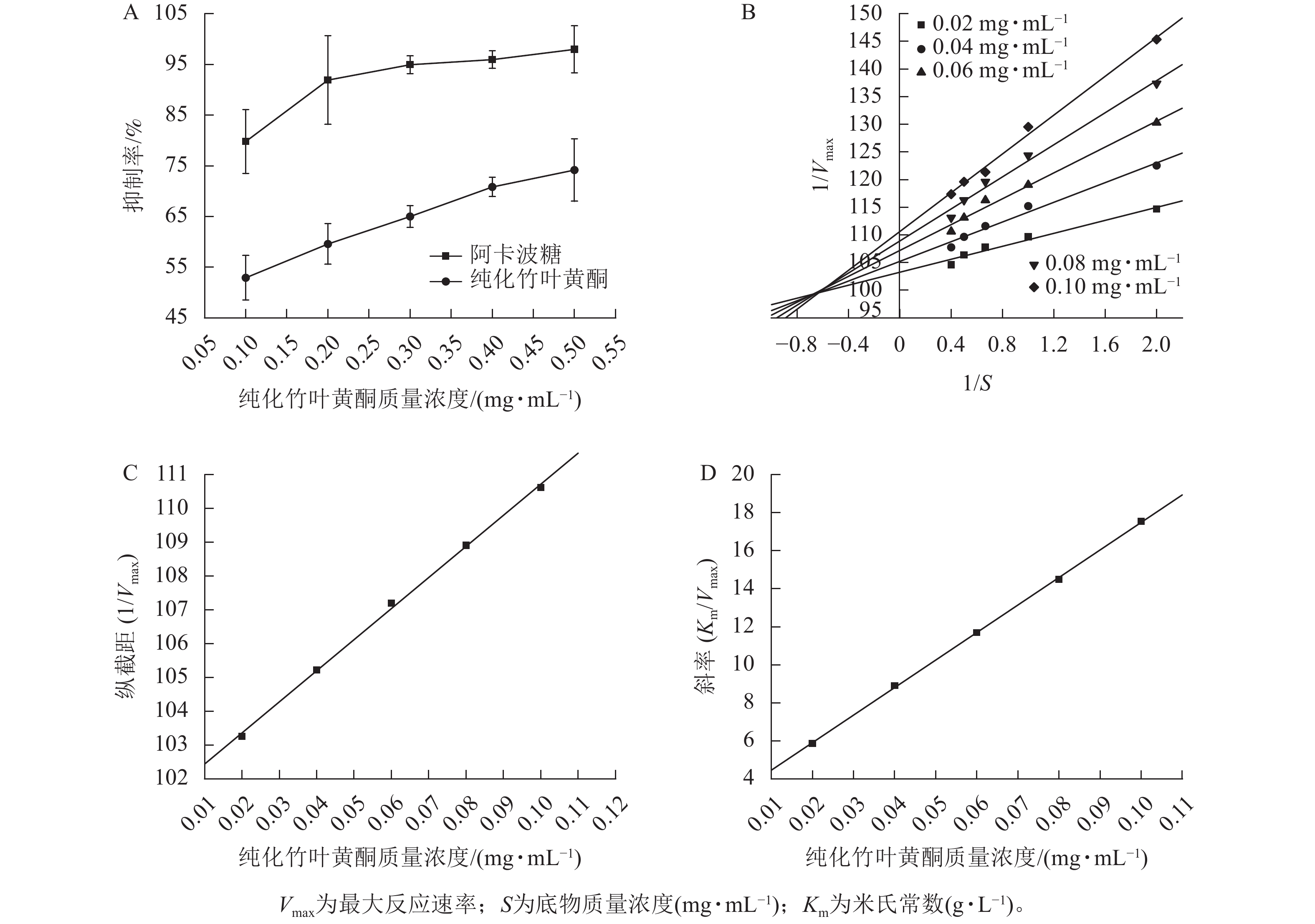
α-葡萄糖苷酶抑制剂作为口服型抗高血糖药物,其作用机制是通过选择性抑制小肠上皮细胞的多种α-葡萄糖苷酶,延缓食物中碳水化合物分解为单糖的生化过程,同时减缓肠道黏膜对葡萄糖的摄取速率,从而有效控制餐后血糖波动,达到平稳降糖的治疗效果[32]。
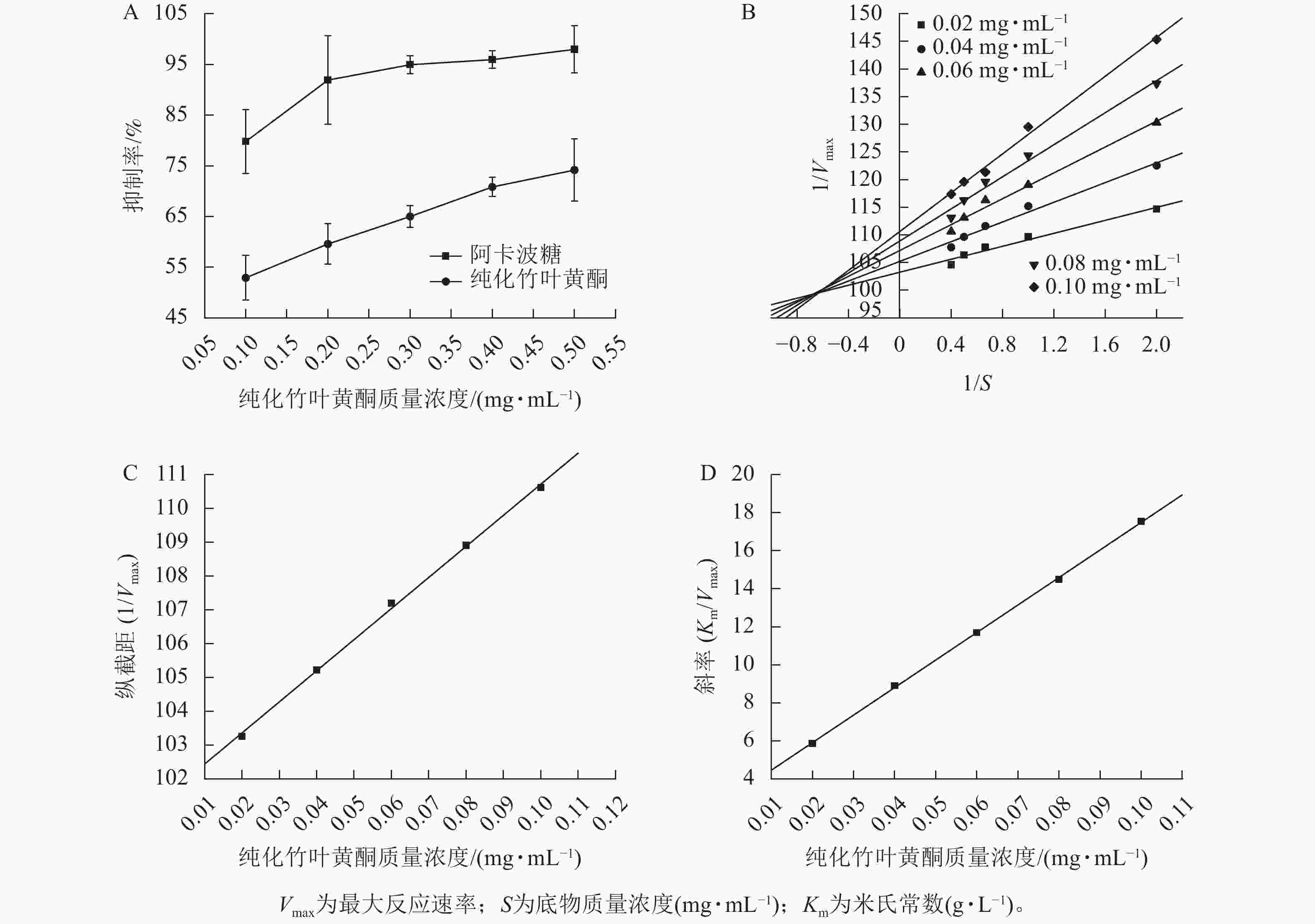
图2A所示:纯化竹叶黄酮对α-葡萄糖苷酶的抑制活性呈现剂量依赖性增强趋势,其抑制率随质量浓度的升高而明显提升。当与阳性对照药物阿卡波糖进行相同质量浓度比较时,阿卡波糖表现出更强的酶抑制效应。同时,随着纯化竹叶黄酮质量浓度的梯度增加,两者间的抑制活性差异趋于缩小。酶抑制活性评价结果表明:纯化竹叶黄酮对α-葡萄糖苷酶的半抑制质量浓度(IC50)为(0.071±0.004) mg·mL−1,阿卡波糖的IC50为(0.034±0.002) mg·mL−1,虽然纯化竹叶黄酮高于阿卡波糖,但在0.5 mg·mL−1质量浓度下,阿卡波糖与纯化竹叶黄酮对α-葡萄糖苷酶的抑制率分别为97.97%±4.62%和74.17%±6.17%,表明纯化竹叶黄酮在此浓度阈值下已具备作为α-葡萄糖苷酶抑制剂的潜力。李翱翔等[33]研究显示:流苏香竹Chimonocalamus fimbriatus叶黄酮在0.5 mg·mL−1质量浓度下,对α-葡萄糖苷酶的抑制率只有30%,而本研究表明:纯化竹叶黄酮在相同质量浓度下对α-葡萄糖苷酶的抑制率达74.17% (图2A),表明慈竹相比于其他常见竹种,在降血糖方面有着更明显的优势。
双倒数动力学分析结果(图2B)表明:纯化竹叶黄酮对α-葡萄糖苷酶抑制动力学特征呈现明显剂量依赖性。随着纯化竹叶黄酮质量浓度梯度的升高,Lineweaver-Burk曲线的斜率呈现规律性递增,而x轴截距则随质量浓度上升逐步向原点偏移。分析表明:米氏常数(Km)随着抑制剂质量浓度的增加呈线性升高趋势,而最大反应速率(Vmax)则随着质量浓度的增加而下降。此外,不同质量浓度拟合直线在第二象限形成交点,呈现出竞争性-非竞争性混合抑制的特点。综合上述特征,可判定纯化竹叶黄酮对α-葡萄糖苷酶的抑制属于混合型抑制机制,其同时具备竞争性和非竞争性抑制的动力学特征。
根据纯化竹叶黄酮抑制α-葡萄糖苷酶的动力学参数分析(表3),其作用机制通过双倒数作图法计算,通过构建不同抑制剂质量浓度下的纵截距(1/Vmax)和斜率(Km/Vmax)以及作用质量浓度的二次线性回归模型(图2C、D),计算获得酶抑制常数(KI=0.020 7 mg·mL−1)及酶-底物复合物抑制常数(KIS=1.103 1 mg·mL−1)。动力学特征显示:KI低于KIS,表明纯化竹叶黄酮更倾向于与游离态α-葡萄糖苷酶发生高亲和力结合,这种选择性结合优势通过竞争性占据酶活性中心,从而降低底物催化转化效率,实现有效的降血糖作用。
纯化竹叶黄酮质量浓度/(mg·mL−1) Michaelis-Menten方程 R2 0.02 $ \dfrac{1}{V}= $$ \dfrac{103.258\;5}{S}+5.864\;2 $ 0.960 6 0.04 $ \dfrac{1}{V}= $$ \dfrac{105.223\;7}{S}+8.902\;0 $ 0.974 0 0.06 $ \dfrac{1}{V}= $$ \dfrac{107.194\;5}{S}+11.692\;1 $ 0.980 9 0.08 $ \dfrac{1}{V}= $$ \dfrac{108.909\;4}{S}+14.499\;0 $ 0.982 0 0.10 $ \dfrac{1}{V}= $$ \dfrac{110.618\;0}{S}+17.548\;9 $ 0.992 2 说明:V为酶促反应速率;S为底物质量浓度(mg·mL−1)。 Table 3. Michaelis-Menten equation for inhibition effect of α-glucosidase by purified bamboo leaf flavonoids
-
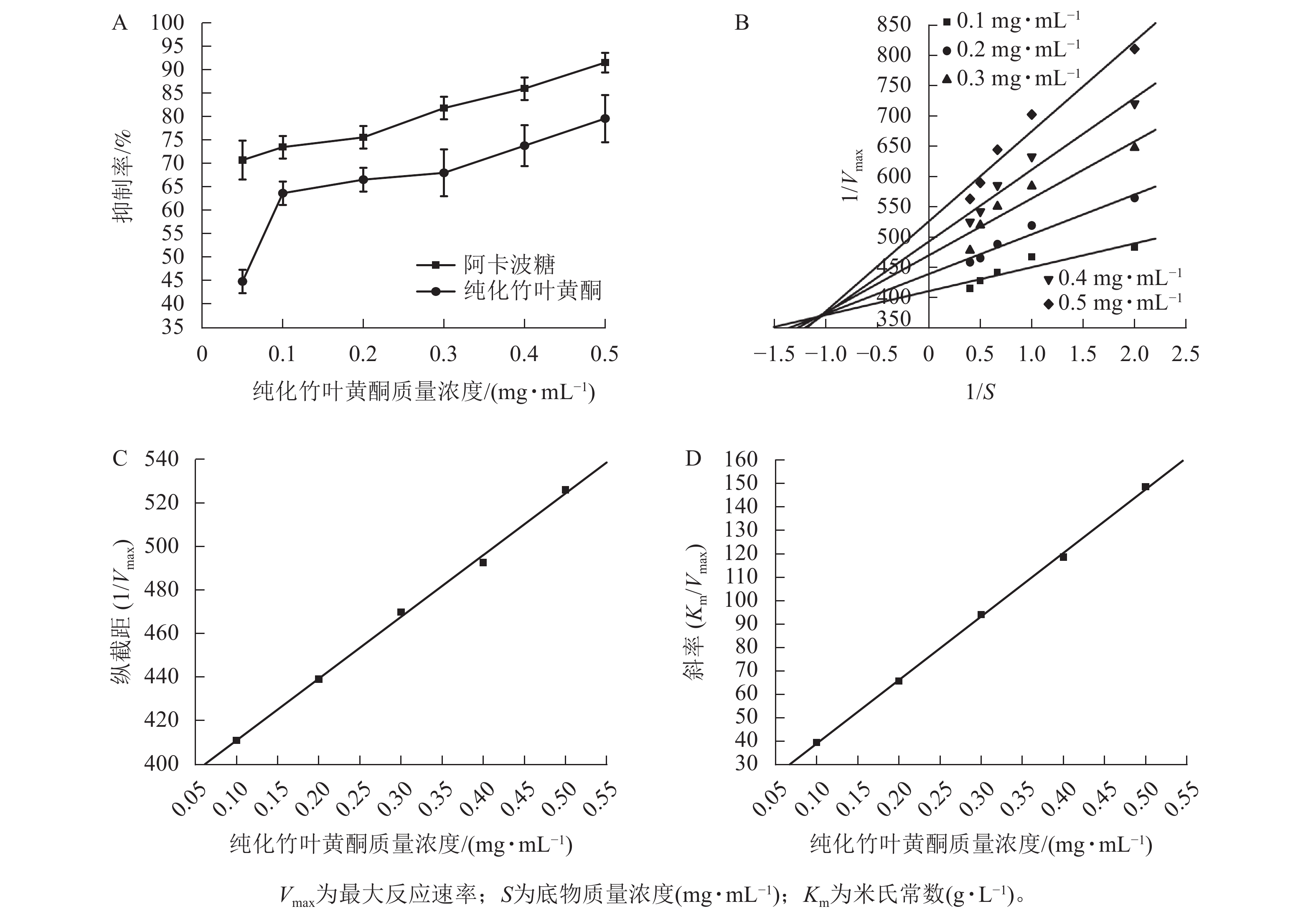
通过抑制α-淀粉酶的催化活性,可有效阻断食物中淀粉类碳水化合物的酶解进程,使其裂解为可被肠道直接吸收的双糖(如麦芽糖、异麦芽糖等)。这种酶活性调控能够延长碳水化合物的消化时间,降低葡萄糖的吸收,从而实现对餐后血糖波动的干预。该作用机制从源头上控制葡萄糖的生成与吸收速率,为2型糖尿病患者提供了基于碳水化合物代谢调控的新型治疗路径[34]。
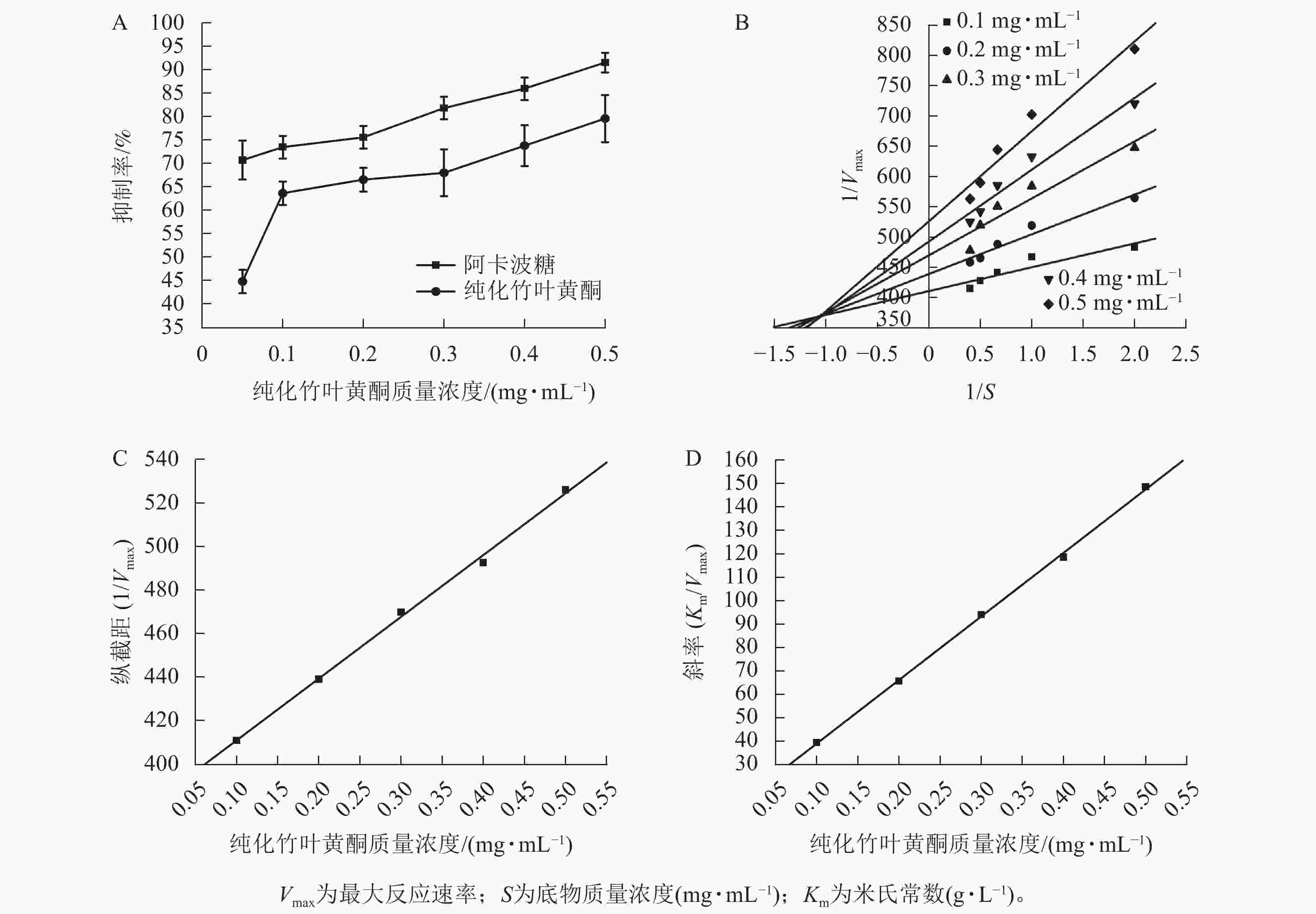
图3A所示:纯化竹叶黄酮对α-淀粉酶的抑制活性呈现剂量依赖效应,其抑制效率与样品质量浓度呈正相关。在0.1~0.5 mg·mL−1质量浓度区间内,阳性对照阿卡波糖的IC50为(0.011±0.003) mg·mL−1,低于纯化竹叶黄酮[IC50为(0.057±0.005) mg·mL−1],表明阿卡波糖具有更强的酶结合亲和力,然而当质量浓度达0.5 mg·mL−1时,阿卡波糖对α-淀粉酶的抑制率为91.67%±2.08%,与纯化竹叶黄酮对α-淀粉酶的抑制率(79.71%±5.02%)差异缩小,表明纯化竹叶黄酮在此质量浓度下具有与临床药物相近的α-淀粉酶抑制效率。
根据纯化竹叶黄酮对α-淀粉酶的双倒数动力学解析(图3B),通过双倒数作图法构建了纵截距(1/Vmax)和斜率(Km/Vmax)随着抑制剂质量浓度变化的线性回归模型。由图3C、D表明:Km随着抑制剂质量浓度的增加呈线性升高趋势,而Vmax则随着质量浓度的增加而下降。动力学参数计算显示:纯化竹叶黄酮抑制动力学呈现出随着样品质量浓度的递增,Lineweaver-Burk拟合直线在第二象限形成收敛交点,同时伴随Vmax的降低以及Km的升高。这种动力学参数的协同变化符合混合型抑制的核心判据,说明纯化竹叶黄酮可能通过双重作用机制干扰酶催化过程。
根据表4所示:纯化竹叶黄酮对游离酶的抑制常数(KI=0.043 6 mg·mL−1)低于对酶-底物复合物的抑制常数(KIS=1.346 9 mg·mL−1),其与游离酶的结合效率较ES复合物提升约31倍。这种选择性结合特性通过优先占据酶活性位点,有效阻断底物催化进程,使Km增加3.2倍的同时,Vmax下降58%,从分子层面揭示了其通过竞争-变构双模调控实现碳水化合物消化延滞的降糖机制。
纯化竹叶黄酮质量浓度/(mg·mL−1) Michaelis-Menten方程 R2 0.1 $ \dfrac{1}{V} $= $ \dfrac{411.062\;5}{S} $+ 39.402 3 0.789 9 0.2 $ \dfrac{1}{V} $= $ \dfrac{439.264\;6}{S} $+ 65.628 9 0.937 0 0.3 $ \dfrac{1}{V} $= $ \dfrac{470.117\;1}{S} $+ 94.076 8 0.862 2 0.4 $ \dfrac{1}{V} $= $ \dfrac{492.898\;6}{S} $+ 118.5849 0.942 9 0.5 $ \dfrac{1}{V} $= $ \dfrac{526.309\;6}{S} $+ 148.6065 0.934 6 说明:V为酶促反应速率;S为底物质量浓度(mg·mL−1)。 Table 4. Michaelis-Menten equation of α-amylase inhibition effect by purified bamboo leaf flavonoids
-
本研究表明:纯化竹叶黄酮对α-葡萄糖苷酶和α-淀粉酶均表现出剂量依赖性混合型抑制特性。通过Lineweaver-Burk双倒数作图验证了纯化竹叶黄酮对2种酶的抑制机制及竞争性与非竞争性特征,说明纯化竹叶黄酮在降血糖方面有着良好的表现,可为慈竹竹叶纯化黄酮在糖尿病临床及日常应用方面提供有益指导。
Identification of flavonoid constituents and inhibitory effects on α-amylase and α-glucosidase in the leaves of Neosinocalamus affinis
doi: 10.11833/j.issn.2095-0756.20250261
- Received Date: 2025-04-21
- Accepted Date: 2025-12-26
- Rev Recd Date: 2025-12-18
-
Key words:
- Neosinocalamus affinis /
- flavonoids /
- component identification /
- α-amylase /
- α-glucosidase /
- inhibition
Abstract:
| Citation: | FU Zhengjian, DONG Shihao, XU Ningmeng, et al. Identification of flavonoid constituents and inhibitory effects on α-amylase and α-glucosidase in the leaves of Neosinocalamus affinis[J]. Journal of Zhejiang A&F University, 2025, 43(X): 1−10 doi: 10.11833/j.issn.2095-0756.20250261 |









 DownLoad:
DownLoad: