-
彩色马蹄莲Zantedeschia elliottiana是珍贵观赏植物,常被用作切花,具有很高的经济价值。彩色马蹄莲在生长过程中可能会受到各种病原体的影响,其中最严重的是由胡萝卜果胶杆菌Pectobacterium carotovorum引起的细菌性软腐病[1−2]。该病常使被侵染器官薄壁组织发生浸渍腐烂,最终导致植株死亡[3]。当前,尚未找到根治马蹄莲软腐病的办法。在生产上只能在栽培管理、物理、化学和生物等方面采取系列措施减少马蹄莲软腐病带来的危害[4]。邹丽婷[5]研究发现:柠檬草精油(lemongrass essential oil,LEO)对彩色马蹄莲软腐病具有一定的防治作用。蒙盼盼[6]认为:微生物群落可以通过招募其他有益菌群协同控制魔芋Amorphophallus konjas软腐病。
多聚半乳糖醛酸酶抑制蛋白(polygalacturonase-inhibiting protein,PGIP)于1971年被首次发现,在单子叶及双子叶植物中均呈现保守性[7]。PGIP的结构通常由10个不完美的富含亮氨酸的重复序列(LRR)形成,每个重复序列有24个残基,形成2个β-折叠,其中1个折叠占据分子的凹形内侧,并包含对与内切多聚半乳糖醛酸酶(endo-PG)相互作用至关重要的残基[8]。多聚半乳糖醛酸酶和PGIP之间的相互作用促进了寡半乳糖醛酸苷(OG)的形成,寡半乳糖醛酸苷是各种防御反应的诱导剂[9−11]。植物PGIP基因在基因组上多以串联重复排列[12],基因家族未经历大规模扩张,成员为2~16个不等,如:拟南芥Arabidopsis thaliana中有2个成员,水稻Oryza sativa中有7个成员,油菜Brassica napus中有16个成员[13−15]。除个别成员包含1个较短内含子外,大多数PGIP基因无内含子[12]。虽然同一物种不同成员基因序列具有高度相似性,但它们在植物的不同生长发育阶段以及应对不同病原菌或逆境时,表达量都有显著差异[16−18]。为抵御病原物的侵袭,植物常依靠其细胞表层及细胞间隙中的受体来辨识病原物种类,并随即触发相应的防御机制。PGIP便是这类受体中的一员,它能特异性地阻断病原物所分泌的多聚半乳糖醛酸酶活性,有效阻止病原物的入侵与扩散;同时,PGIP还能促进植物体内寡聚半乳糖醛酸的累积,进而激活特定的防御反应,最终遏制病害的发生[19]。纯化的GhPGIP1是棉花Gossypium hirsutum枯萎病的2种真菌病原体黄萎病和尖孢镰刀菌Fusarium oxysporum的功能性抑制剂[20];通过根瘤农杆菌Bacterium tumefaciens介导法将PGIP转入菊花Chrysanthemum × morifolium品种中,可以提高菊花对真菌病害的抗性[21];PgPGIP1的表达增强了转基因小麦Triticum aestivum对全蚀病与根腐病的抗性[22]。由此可见:深入研究PGIP基因家族的功能,对于促进植物生长和抗病抗虫能力,提高植物次生代谢物产量具有重要意义。
本研究在全基因组水平上对彩色马蹄莲ZePGIP基因家族进行了系统鉴定和分析,强调了ZePGIP基因在彩色马蹄莲软腐病响应中的作用,并为深入解析PGIP基因家族的功能奠定了理论基础。
-
所用材料为彩色马蹄莲‘京彩阳光’Zantedeschia elliottiana ‘Jingcai Yangguang’,栽培于温室内。栽培条件为:温度25 ℃,相对湿度60%,光周期16 h光照/8 h黑暗。取盆栽植株叶柄基部切下的完全展开叶片,先在质量分数为0.5%次氯酸钠溶液中浸泡20 min,再用无菌蒸馏水冲洗2次,置于无菌环境下风干备用。胡萝卜果胶杆菌Pectobacterium carotovorum的接种参考LUZZATTO等[23]的方法进行。胡萝卜果胶杆菌菌株最初从发病的彩色马蹄莲植株上分离,并保存在−80 ℃冰箱中。试验前,将冻存菌株接种于Luria-Bertani (LB)固体培养基,28 ℃培养16 h。取单个菌落接入4.0 mL LB液体培养基中,28 ℃、150 r·min−1条件下摇床培养10 h。随后取2.0 mL细菌培养物,于室温下12 000 r·min−1离心3 min,弃去上清液后加入1.0 mL新鲜LB培养基(记作C1)。充分涡旋混匀后,取0.1 mL C1加入0.9 mL新鲜LB培养基(C2),再次涡旋混匀。使用分光光度计测定吸光度[D(600)],并根据公式 D(600)= 1.0 (≈ 109 CFU)[24] 计算C1的菌液比例。将C1稀释至107 CFU·mL−1作为工作比例[25],用于接种。接种方法为沿叶片下侧主脉的6个对称点注射0.1 mL细菌悬浮液。接种后植株置于28 ℃下培养,并在0、6、12、24 和 48 h 观察并记录表型。所有样品迅速投入液氮中冷冻,并储存于−80 ℃冰箱备用。
-
从植物基因组数据库(https://plants.ensembl.org/index.html)获取水稻OsPGIP基因序列,并通过BLASTP软件筛选候选基因。随后在保守结构域数据库(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)中检索分析,以确认所鉴定序列均包含完整的结构域。以水稻OsPGIP基因为参考,对ZePGIP基因进行分类。使用MUSCLE软件(默认参数)对全长蛋白序列进行多序列比对,并基于比对结果在IQ-TREE 2中构建系统发育树。
-
获得ZePGIP基因的全长蛋白质序列,并分析其保守基序。为此,采用多序列基序分析工具 MEME (Multiple Em for Motif Elicitation,v5.5.0;http://meme-suite.org)。参数设置:在每条序列中基序的出现次数设定为“0次或1次”,最大基序数为20。保守基序结果通过TBtools软件进行可视化。
-
基于彩色马蹄莲的全基因组数据和基因注释文件,采用MCScanX软件在默认参数下鉴定串联重复基因及基因共线性关系[26],利用Circos软件对结果进行可视化。ZePGIP基因在染色体上的分布位置由MapChart软件绘制。进一步开展彩色马蹄莲种内共线性分析、串联重复基因对分析,以及彩色马蹄莲与水稻的种内共线性比较。分别使用天南星科Araceae植物:红掌Anthurium andraeanum、虎掌Pinellia pedatisecta、大薸Pistia stratiotes、芋Colocasia esculenta和魔芋Amorphophallus konjac与彩色马蹄莲进行种间基因共线性分析。
-
ZePGIP基因的结构信息(包括外显子、内含子和非翻译区)从基因组注释文件中获得,利用Gene Structure Display Server (GSDS)网站(https://gsds.gao-lab.org/)进行可视化。启动子顺式作用元件通过PlantCARE数据库(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测,分析范围为起始密码子上游2 kb序列。利用TBtools软件对启动子中的顺式作用元件进行可视化[27]。
-
在接种软腐病菌后0、6、12、24和48 h,收集病斑周围约2 cm的彩色马蹄莲叶片组织。总RNA提取使用EASYspin Plus植物RNA提取试剂盒(Aidlab,中国),并通过琼脂糖凝胶电泳和Nanodrop 2000光谱仪检测其质量和浓度。合格RNA样品经NEBNext Ultra RNA Library Prep Kit(NEB,美国)构建文库,并在Illumina NovaSeq 6000平台上进行双端测序(PE150)。获得的测序数据经质量控制后,利用HISAT2软件比对至彩色马蹄莲参考基因组。比对结果通过FeatureCounts软件进行定量分析,以获得各基因的原始count值。随后,使用TBtools将count值转换为FPKM,并据此绘制ZePGIP基因在接菌后的表达热图。ZePGIP基因间的表达相关性基于各样品的FPKM值,使用R包绘制基因表达相关性图。
-
RT-qPCR进一步用于验证ZePGIP基因在接种胡萝卜果胶杆菌后0~48 h的表达量,每个基因在各时间点均设3个独立生物学重复和3个技术重复。使用HiScript II 1st Strand cDNA Synthesis Kit(Vazyme)合成cDNA,RT-qPCR反应依照ChamQ SYBR qPCR Master Mix(Vazyme)体系操作。荧光定量引物通过美国国家生物技术信息中心(NCBI)的primer-BLAST工具(https://www.ncbi.nlm.nih.gov/)设计。相对表达量采用2−ΔΔCt方法计算,并以ZeActin作为内参基因进行标准化。表达柱状图由GraphPad Prism 9.5绘制,差异显著性通过独立t检验分析,并在P<0.05时标注。
-
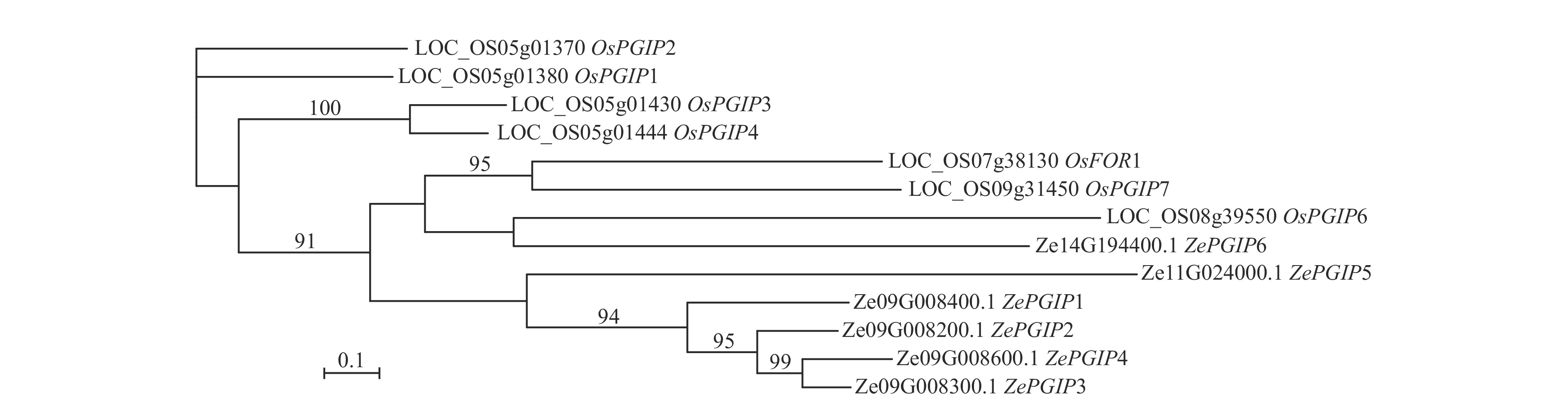
为鉴定彩色马蹄莲中的ZePGIP基因,首先以水稻OsPGIP基因序列为参考,利用BLAST软件在彩色马蹄莲的基因序列中筛选候选基因。随后,对水稻与彩色马蹄莲的PGIP基因进行多序列比对,并基于最大似然法构建系统发育树(图1)。结果表明:彩色马蹄莲基因组中共鉴定出6个ZePGIP基因,大部分聚集在同一分支。其中ZePGIP3与ZePGIP4相似度最高,其次为ZePGIP2与ZePGIP1。这4个基因与ZePGIP5的相似度均高于与ZePGIP6。
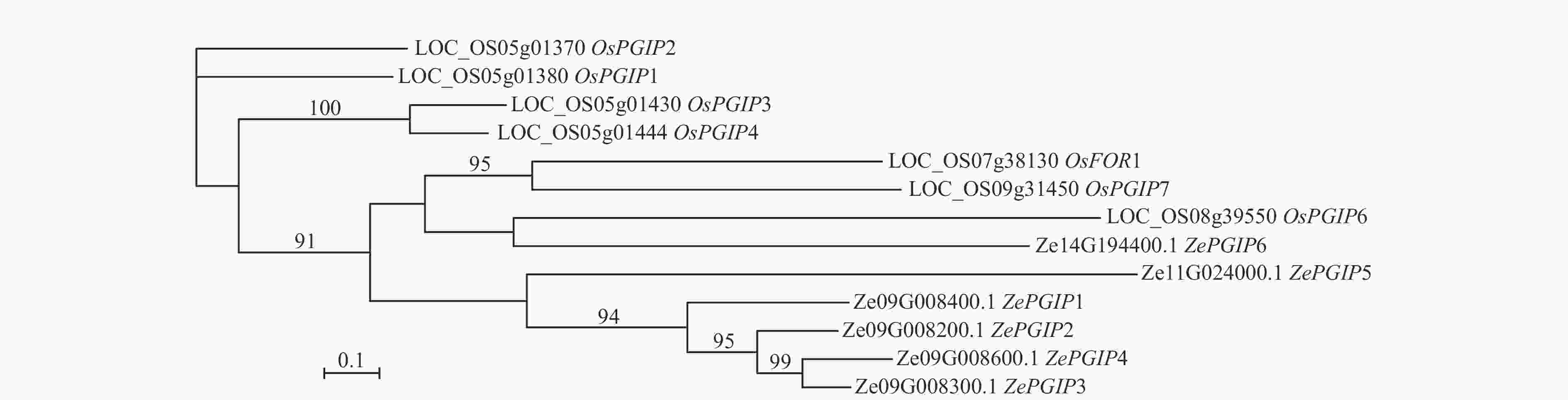
图 1 彩色马蹄莲和水稻PGIP基因的系统发育关系
Figure 1. Phylogenetic relationship between PGIP genes in colored Z. elliottiana and O. sativa
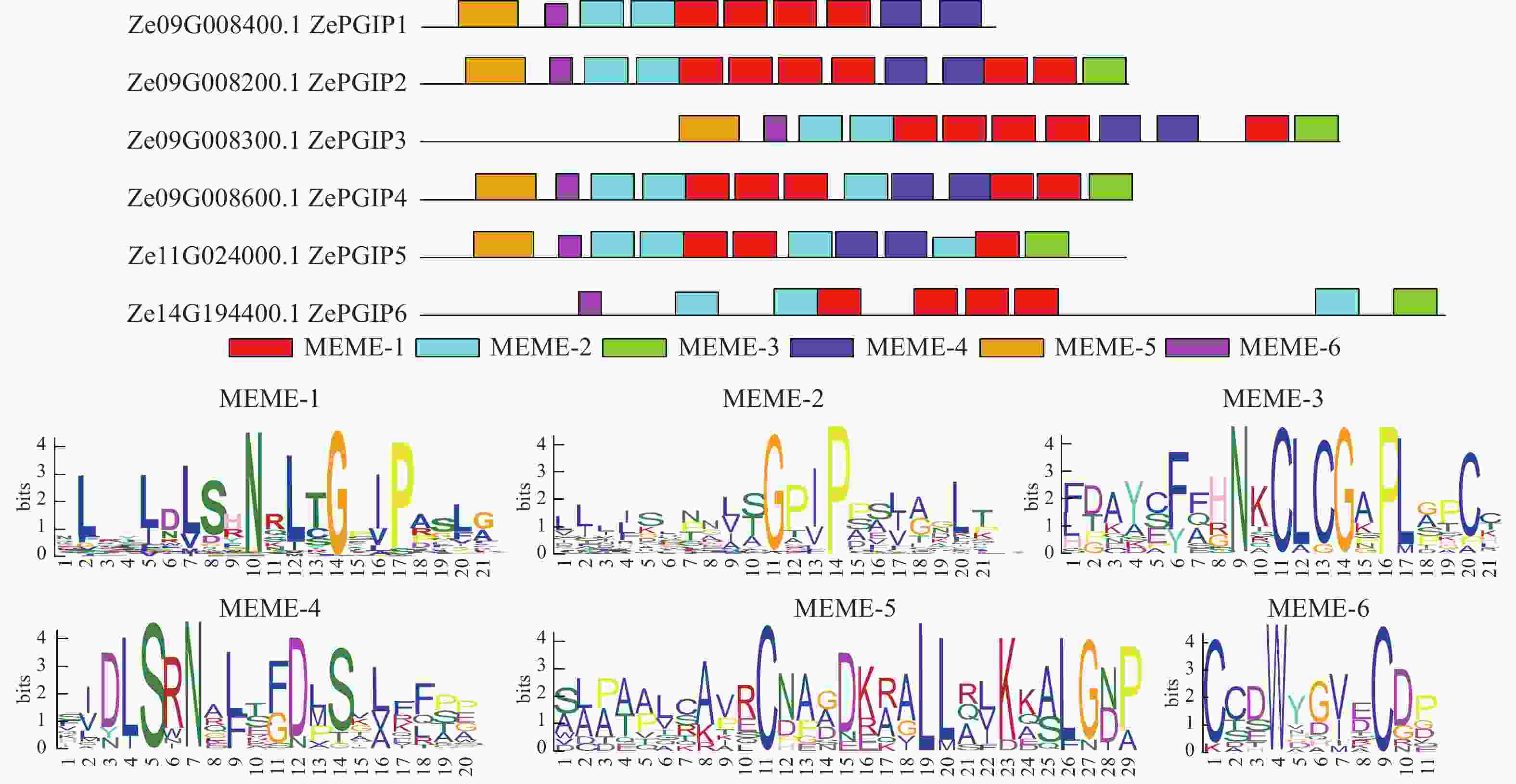
为进一步解析ZePGIP蛋白的特征基序,进行保守基序分析(图2)。结果表明:尽管基因长度存在差异,但每个ZePGIP蛋白均至少含有4个保守基序,且整体结构高度保守。除了ZePGIP1和ZePGIP6,其余ZePGIP蛋白均包含亚家族内共享的6种保守基序,其中MEME-1和MEME-2序列高度相似,在所有基因中均检测到MEME-1、MEME-2或MEME-6,说明这些基序具有较高保守性。同时,不同ZePGIP基因间的基序排列顺序基本一致,揭示其保守区域差异很小,蛋白相似度较高。
-
在彩色马蹄莲的16条染色体中,ZePGIP基因仅分布于Chr09、Chr11和Chr14上(图3A)。其中,Chr09上已鉴定出的基因Ze09G008400.1 (ZePGIP1)、Ze09G008200.1 (ZePGIP2)和Ze09G008300.1 (ZePGIP3)构成了一组串联重复基因。在进化过程中,基因的串联重复不仅有助于基因家族的扩张,还可能通过产生新型或功能增强的同源基因而促进物种适应性进化。
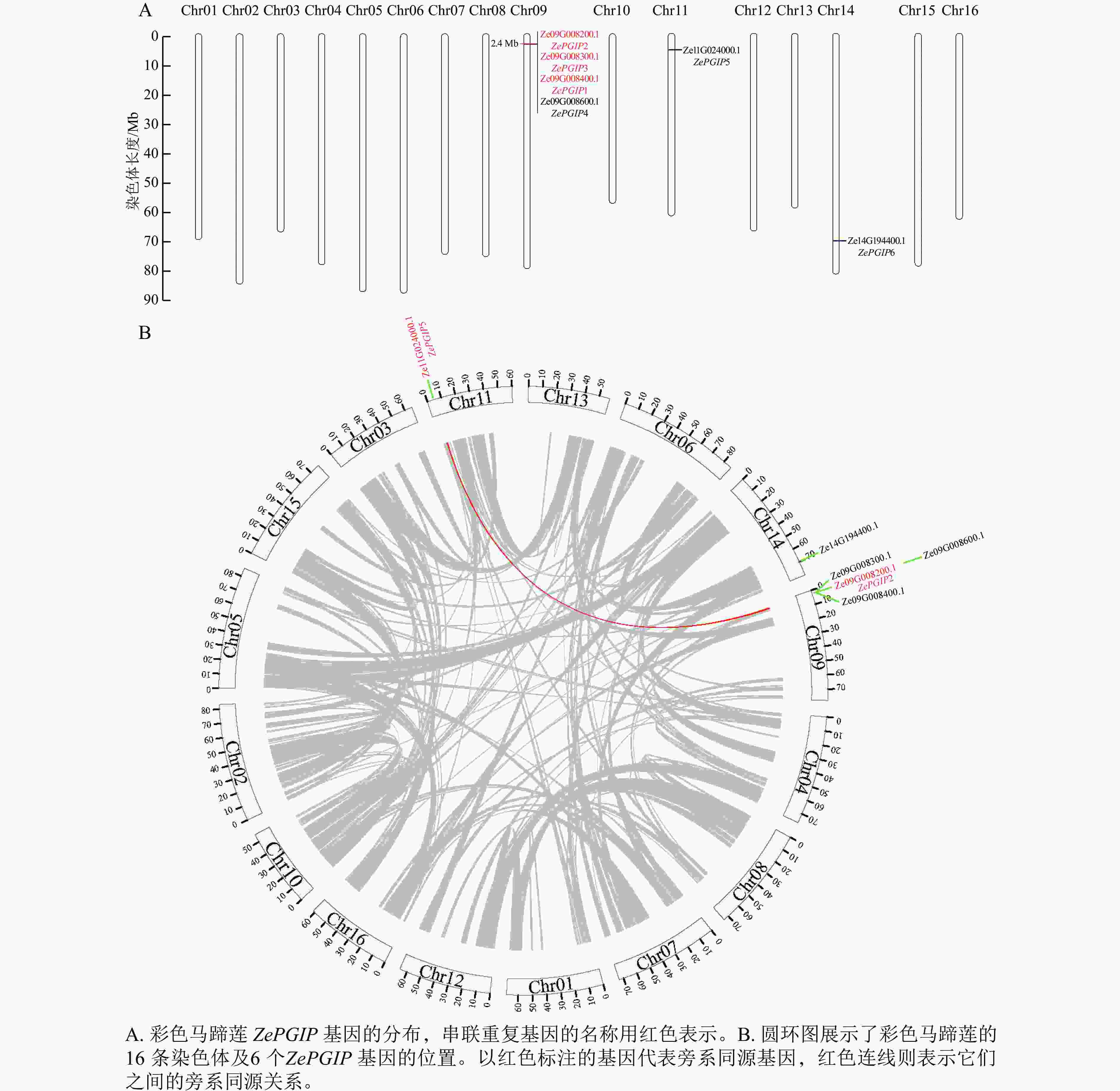
图 3 彩色马蹄莲6个ZePGIP基因的串联重复及基因共线分析
Figure 3. Analysis of tandem duplication and gene synteny of six ZePGIP genes in Z. elliottiana
为了更全面地检验ZePGIP基因在染色体上的分布特征及其共线关系,绘制了覆盖全基因组的染色体圆环图,直观展示基因间的旁系同源关系及其进化关联(图3B)。结果表明:位于Chr11的Ze11G024000.1 (ZePGIP5)与Chr09上的Ze09G008200.1 (ZePGIP2)构成一对旁系同源基因,提示两者可能源自全基因组复制事件并在进化过程中形成功能上的分化或互补。
-
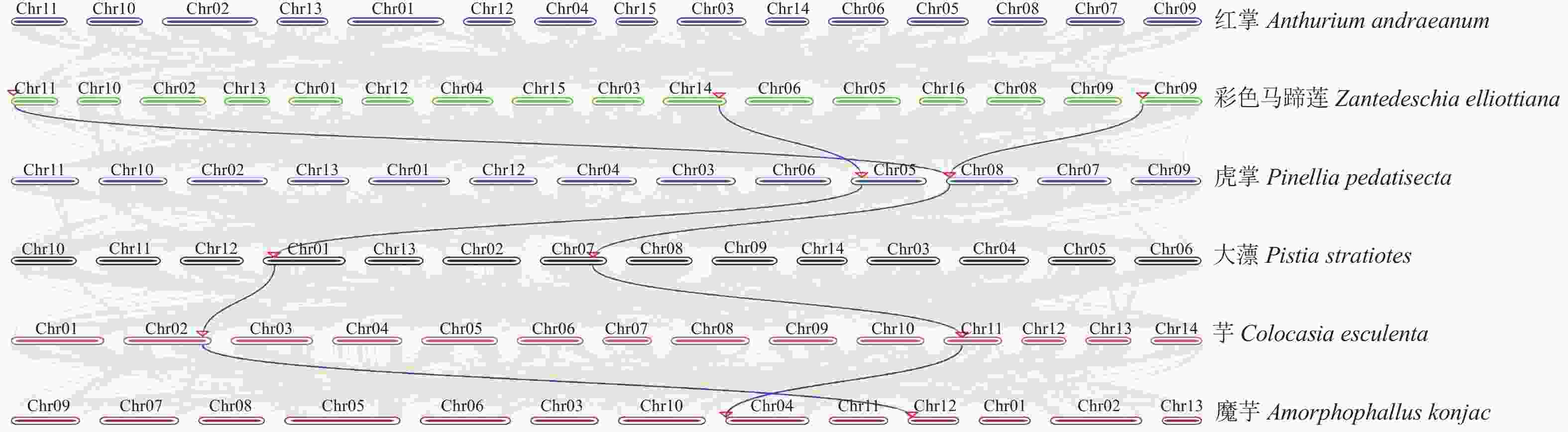
共线性分析结果(图4)显示:除红掌外,其余物种的PGIP基因均与彩色马蹄莲存在2对同源基因对。红掌的物种分化时间早于其他天南星科物种。在本研究中未能鉴定到红掌PGIP基因与彩色马蹄莲之间的共线性,推测红掌的PGIP基因经历了相对独立的分化过程。彩色马蹄莲的Ze11G024000.1 (ZePGIP5)、Ze09G008200.1 (ZePGIP2)以及Ze14G194400.1 (ZePGIP6)均与虎掌、大薸、芋和魔芋的PGIP基因呈现出共线性关系。分析结果也表明:ZePGIP2与ZePGIP5之间的旁系同源关系并未在虎掌、大薸、芋和魔芋的PGIP基因中得到体现。这种基因复制可能是在物种分化后产生的。
-
基因结构示意图(图5A)显示:不同基因的外显子和内含子数量存在差异,部分基因仅包含1个外显子。6 个基因均具有完整的外显子结构,但多数ZePGIP基因缺乏内含子,仅Ze09G008300.1 (ZePGIP3)和Ze11G024000.1 (ZePGIP5)含有内含子结构。此外,值得注意的是:ZePGIP3含有1个超长的内含子。长内含子在植物基因组中常与复杂的转录调控相关,其序列可能包含多种顺式作用元件或调控基序,为转录因子结合提供更多潜在位点。同时,长内含子区域还可能与组蛋白修饰、染色质重塑及RNA剪接效率等过程相关,从而在转录活性与基因表达的时空特异性中发挥重要作用。因此,ZePGIP3中超长内含子的存在提示该基因可能具有更加复杂的调控机制,并可能在响应环境信号或发育调控中发挥独特功能。
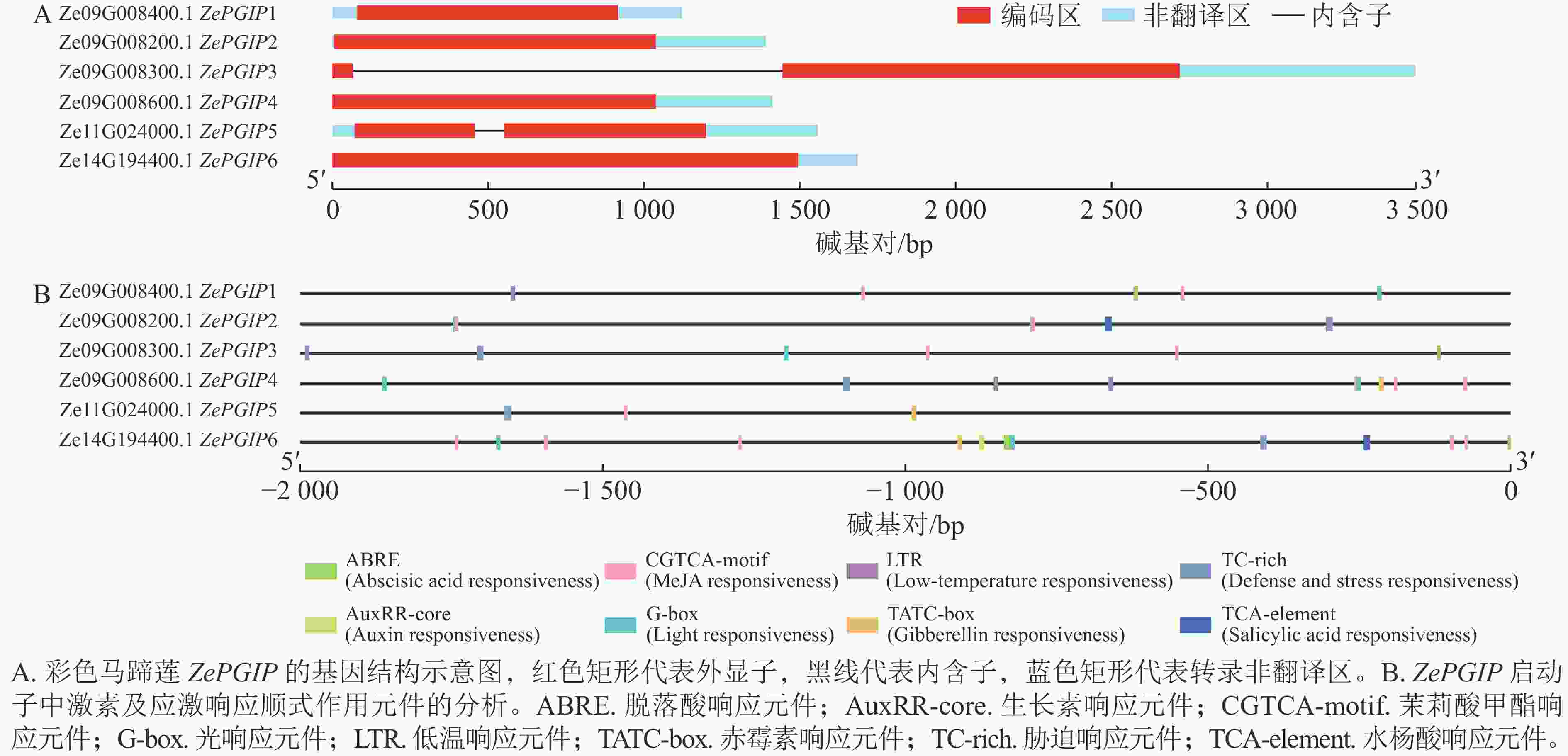
图 5 彩色马蹄莲ZePGIP的基因结构与启动子顺式作用元件分析
Figure 5. Analysis of gene structure and promoter cis-acting elements of ZePGIP genes in Z. elliottiana
基因表达的显著调控通常发生在转录起始阶段,而启动子序列中的顺式作用元件在其中发挥关键作用。启动子的一般结构包括核心启动子元件与上游调控元件。提取ZePGIP启动子序列并对潜在的调控基序进行了预测分析(图5B)。结果发现:在ZePGIP启动子序列中分布有多种与激素和胁迫相关的响应元件,包括脱落酸响应元件(ABRE)、生长素响应元件(AuxRR-core)、茉莉酸甲酯响应元件(CGTCA-motif)、光响应元件(G-box)、低温响应元件(LTR)、赤霉素响应元件(TATC-box)、胁迫响应元件(TC-rich repeats)以及水杨酸响应元件(TCA 元件)。其中,茉莉酸甲酯响应元件在多个ZePGIP启动子中广泛存在(图5B),因此推测茉莉酸可能是调控ZePGIP基因表达的重要激素。
-
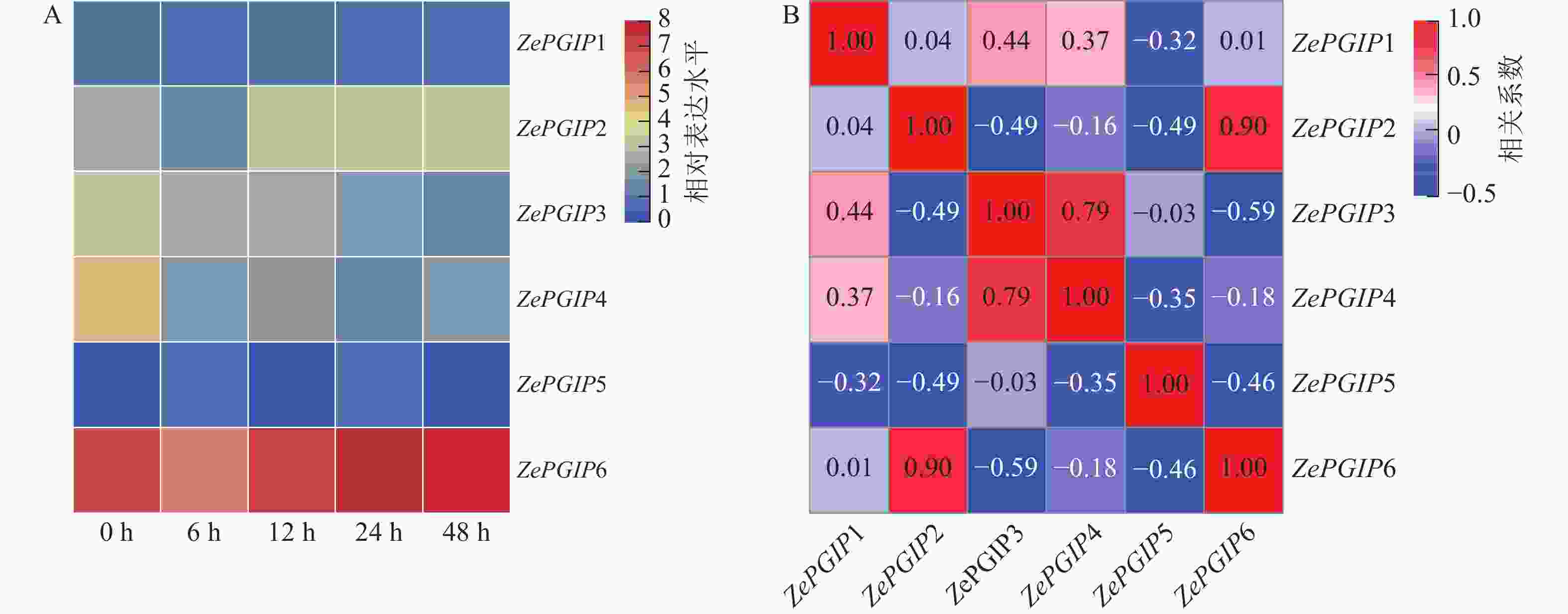
在彩色马蹄莲叶片上接种了胡萝卜果胶杆菌(图6),并对接种后0、6、12、24和48 h各ZePGIP基因的转录组表达水平进行了分析。结果显示:ZePGIP6的表达量始终显著高于其他家族成员,而ZePGIP5表达水平最低,几乎处于接近0的状态(图7A)。值得注意的是,除ZePGIP5外,其余基因在接菌后早期均出现不同程度的下调,说明胡萝卜果胶杆菌的侵染可能通过抑制PGIP基因的表达来削弱寄主的防御反应,从而促进病原菌的侵染过程。

图 6 彩色马蹄莲‘京彩阳光’叶片上接种胡萝卜果胶杆菌后不同时间点的病害表型
Figure 6. Phenotypes of diseases on the leaves of the colorful water chestnut ‘Jingcai Sunshine’ after inoculation with P. carotovorum at different time points
相关性分析表明:ZePGIP2与ZePGIP6以及ZePGIP3与ZePGIP4表现出较强的共表达关系(图7B),提示这些基因可能协同参与特定的生物学过程。RT-qPCR验证结果与转录组趋势基本一致:ZePGIP2与ZePGIP6在6~48 h随感染时间逐渐升高,表现出典型的诱导表达模式,呈现波动趋势;ZePGIP4表达则在侵染过程中受到明显抑制(图8)。
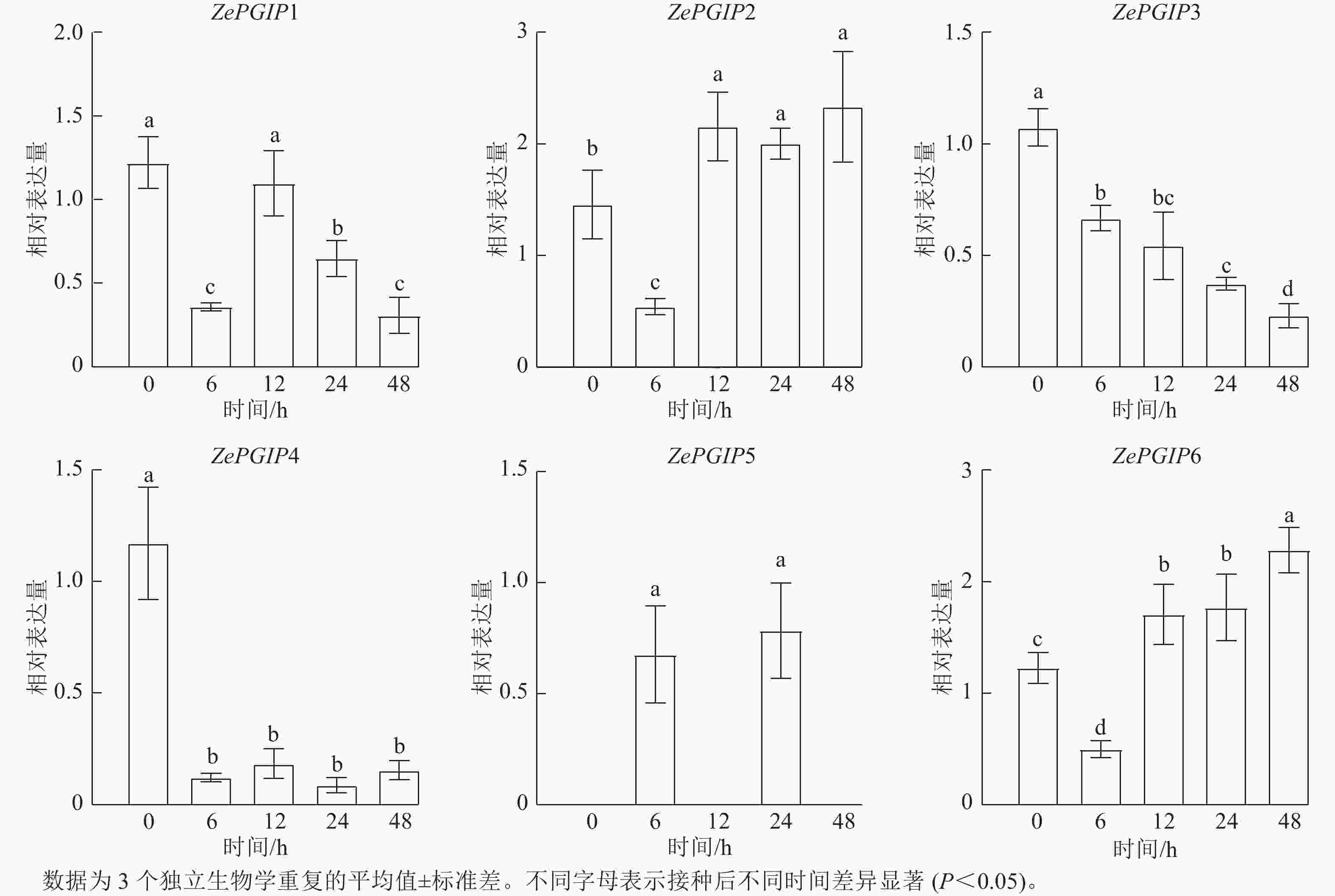
图 8 接种胡萝卜果胶杆菌彩色马蹄莲ZePGIP基因的相对表达水平
Figure 8. Relative expression levels of ZePGIP genes in Z. elliottiana leaves after inoculation with P. carotovorum
综上所述,彩色马蹄莲ZePGIP基因家族在胡萝卜果胶杆菌与寄主的互作过程中呈现出显著的差异化响应模式,尤其是ZePGIP2与ZePGIP6,其表达水平在胡萝卜果胶杆菌侵染早期受到抑制,而在后期则被显著诱导,表现出典型的防御相关转录特征。由此推测,这2个基因在彩色马蹄莲抗软腐病过程中可能发挥关键作用。ZePGIP2与ZePGIP6可作为潜在的抗病功能基因,为后续抗性机制解析及抗病育种提供重要参考。
-
目前已对许多植物,如水稻[28]、桃Prunus persica [29]、梅Prunus mume [30]的PGIP基因进行了分析,但未在基因组水平上充分掌握彩色马蹄莲ZePGIP基因家族的进化动力学和功能。
本研究对彩色马蹄莲PGIP基因进行了全面分析,共鉴定出6个ZePGIP基因家族成员。系统发育及保守结构域分析表明:这些基因均包含同一亚家族内保守的基序,其中MEME-1和MEME-2序列高度相似,并在所有基因中均可检测到MEME-1、MEME-2或MEME-6,显示出较高保守性,且在彩色马蹄莲6个保守的ZePGIP基因中,ZePGIP1、ZePGIP2、ZePGIP3是由串联重复产生的。这与前人的研究结果一致,PGIP家族成员主要以串联形式组织而成,串联多少不一,且高度保守。例如,在滇龙胆Gentiana scabra中共鉴定到10条PGIPs基因家族成员,这些基因主要以串联重复的状态分布于2号染色体上,且与拟南芥、葡萄Vitis vinifera的PGIP家族成员各有2对同源基因[31]。在大豆Glycine max中,PGIP基因家族数量较少且高度保守,为独立的串联重复事件[17]。
基因结构分析表明:6个ZePGIP基因均具有完整的外显子结构,但仅ZePGIP3和ZePGIP5含有内含子。此外,ZePGIP3含有1个超长的内含子,这类结构在植物基因组中通常与基因表达调控的复杂性相关。一方面,长内含子区域可能富含顺式作用元件或结合位点,从而为转录因子、非编码 RNA 或表观遗传修饰提供调控平台;另一方面,超长内含子在进化过程中可能通过转座元件插入或序列重排积累而成,从而为基因功能分化与新性状的出现提供潜在的分子基础。此外,已有研究表明:长内含子还可能在转录效率、mRNA剪接精确性以及染色质高级结构的形成中发挥作用。前人的研究表明:内含子增加基因的长度和基因重组的频率;虽然内含子较少的基因在物种进化或基因重组中没有优势,但它们能够快速响应外部非生物胁迫[32]。LIU等[33]对拟南芥和水稻的研究表明:无内含子的亚家族基因在 “转录调控”中最为丰富,可能在应对干旱和盐胁迫方面发挥重要作用。这表明不同的ZePGIP基因根据其内含子是否存在及内含子的长度,有着不同的功能。
启动子顺式作用元件分析发现:MeJA响应元件在多个ZePGIP启动子中广泛存在,推测茉莉酸可能是调控ZePGIP基因表达的重要激素。陈夕军等[18]研究发现:在粳稻‘中花11’Oryza sativa subsp. japonica ‘Zhonghua 11’中,使用脱落酸、芸薹素内酯、赤霉素、生长素、激动素、茉莉酸和水杨酸处理后,随着时间的推移,绝大多数OsPGIP基因的表达量均上调。王秀云等[34]研究发现:桃PpPGIP1启动子中乙烯相关调控元件在PpPGIP1转录调控功能中可能具有重要的作用。前人的研究表明:茉莉酸信号不敏感突变体易感黑斑病菌、灰霉病菌Botrytis cinerea及胡萝卜果胶杆菌亚种等多种死体型病菌,胡萝卜果胶杆菌感染拟南芥后,茉莉酸的防御反应会被激活[35]。在本研究中,ZePGIP2 和 ZePGIP6 在胡萝卜果胶杆菌侵染后表现出显著的诱导表达。结合启动子分析结果,可以推测其上游含有多种与茉莉酸信号相关的顺式作用元件。茉莉酸是植物抵御坏死营养型或半坏死营养型病原菌的重要信号分子。因此,ZePGIP2 和 ZePGIP6 的表达动态很可能受到茉莉酸途径的调控,进而介导对胡萝卜果胶杆菌侵染的防御反应。这一假设提示 ZePGIP2和 ZePGIP6可能在茉莉酸依赖型抗性网络中发挥关键作用。这为后续功能验证提供了研究方向。
基因共线性分析显示:ZePGIP2与ZePGIP5为旁系同源基因;天南星科物种的共线性比较发现:彩色马蹄莲与虎掌、大薸、芋和魔芋存在2对直系同源基因。这表明它们的祖先基因可能来源于同一个基因。表达分析表明:胡萝卜果胶杆菌侵染下不同ZePGIP基因呈现差异性表达,其中ZePGIP2和ZePGIP6对胡萝卜果胶杆菌表现出强烈响应。因此推测,彩色马蹄莲PGIP基因家族参与胡萝卜果胶杆菌与彩色马蹄莲互作过程,并发挥着不同的作用。
病原细菌或真菌要扩大对植物的感染必须先突破植物细胞壁这第一道防线。为抵御病原物的侵袭,植物常依靠其细胞表层及细胞间隙中的受体来辨识病原物种类,并随即触发相应的防御机制。PGIP作为这类受体中的一员,可以减缓病原细菌或真菌的生长繁殖速度[19]。本研究认为ZePGIP2与ZePGIP6可作为潜在的抗病功能基因,在彩色马蹄莲抗软腐病过程中可能发挥关键作用,与前人对PGIP的研究结果一致。江翱等[36]研究发现:表达的烟草Nicotiana tabacum PGIP蛋白能够明显抑制辣椒疫霉多聚半乳糖醛酸酶(PGs)的活性;邓婕等[37]研究发现:LrPGIP可能是岷江百合Lilium regale抵御尖孢镰刀菌侵染的重要抗病基因。
-
本研究基于全基因组数据对彩色马蹄莲ZePGIP基因家族进行了系统鉴定,共发现6 个成员,包括ZePGIP1、ZePGIP2、ZePGIP3、ZePGIP4、ZePGIP5和ZePGIP6。系统发育与保守基序分析表明:每个基因至少含有4 个保守基序,其中MEME-1、MEME-2和MEME-6最为普遍,显示该家族在进化过程中具有较高的保守性。6 个基因分布于Chr09、Chr11和Chr14,其中ZePGIP1、ZePGIP2、ZePGIP3和ZePGIP4位于Chr09,并形成一组串联重复基因,而ZePGIP2与ZePGIP5构成一对旁系同源基因。进一步的跨物种共线性分析显示:除红掌外,其余天南星科物种的PGIP基因均与彩色马蹄莲形成2对同源关系,提示该基因家族在天南星科中具有一定的保守性与分化特征。基因结构分析发现:大多数ZePGIP基因不含内含子,仅ZePGIP3和ZePGIP5含有内含子,其中ZePGIP3具有超长内含子,可能参与复杂的转录调控。启动子分析表明:ZePGIP基因含有多种激素和胁迫响应元件,其中茉莉酸相关位点普遍存在,提示其可能通过激素信号途径介导防御反应。在胡萝卜果胶杆菌侵染过程中,ZePGIP2和ZePGIP6的表达由早期受抑制转为后期显著诱导,提示其在彩色马蹄莲抗性中具有关键作用。这一结果为抗病机理解析与分子育种提供了重要候选靶点。
Identification of polygalacturonase-inhibiting protein gene family in colored Zantedeschia elliottiana and its response to Pectobacterium carotovorum
-
摘要:
目的 揭示PGIP基因家族在彩色马蹄莲Zantedeschia elliottiana中的结构特征及在胡萝卜果胶杆菌Pectobacterium carotovorum侵染下的表达差异,为ZePGIP基因功能研究和彩色马蹄莲抗胡萝卜果胶杆菌机制解析提供理论依据。 方法 采用生物信息学方法在全基因组范围内鉴定并分析彩色马蹄莲ZePGIP基因家族成员,并通过实时荧光定量PCR(RT-qPCR)检测ZePGIP基因在胡萝卜果胶杆菌侵染下的表达模式。 结果 在彩色马蹄莲基因组中共鉴定出6个ZePGIP基因:ZePGIP1、ZePGIP2、ZePGIP3、ZePGIP4、ZePGIP5和ZePGIP6。系统发育及保守结构域分析表明:这些基因均包含同一亚家族内保守的基序,其中MEME-1和MEME-2序列高度相似,并在所有基因中均可鉴定到MEME-1、MEME-2、MEME-6,显示出较高保守性。启动子顺式作用元件分析发现:ZePGIP基因启动子区含有与脱落酸、生长素、茉莉酸甲酯、光、低温、赤霉素、胁迫及水杨酸相关的响应元件。基因共线性分析显示:ZePGIP2与ZePGIP5为旁系同源基因。跨天南星科Araceae物种的基因共线性分析发现:彩色马蹄莲与虎掌Pinellia pedatisecta、大薸Pistia stratiotes、芋Colocasia esculenta和魔芋Amorphophallus konjac存在2对直系同源基因。胡萝卜果胶杆菌接菌处理和相关性分析表明:在胡萝卜果胶杆菌侵染下彩色马蹄莲ZePGIP基因呈现差异性表达,其中ZePGIP2和ZePGIP6在胡萝卜果胶杆菌侵染早期表达水平受到抑制,而在后期则被显著诱导。 结论 PGIP基因家族在彩色马蹄莲中主要以串联重复形式存在,整体结构高度保守。ZePGIP2和ZePGIP6对胡萝卜果胶杆菌具有显著响应,揭示其可能在抗胡萝卜果胶杆菌中发挥关键作用。图8参37 Abstract:Objective This objective is to reveal the structural characteristics of the PGIP gene family in colored Zantedeschia elliottiana (calla lily) and their differential expression under Pectobacterium carotovorum (soft rot bacteria) infection, so as to provide a theoretical basis for functional studies of ZePGIP genes as well as the elucidation of the resistance mechanism to P. carotovorum in Z. elliottiana. Method Bioinformatics methods were employed to identify and analyze the members of the PGIP gene family across the entire genome of Z. elliottiana. The expression patterns of ZePGIP genes under infection by P. carotovorum were detected by real-time quantitative PCR (RT-qPCR). Result A total of 6 ZePGIP genes, namely ZePGIP1, ZePGIP2, ZePGIP3, ZePGIP4, ZePGIP5, and ZePGIP6, were identified in the genome of the colored Z. elliottiana. Phylogenetic and conserved domain analysis revealed that these genes contained conserved motifs within the same subfamily. Among them, MEME-1 and MEME-2 exhibited high sequence similarity, and MEME-1, MEME-2, MEME-6 could be detected in all members, demonstrating a high degree of conservation. Promoter cis-element analysis showed that ZePGIP promoters contained response elements associated with abscisic acid, auxin, methyl jasmonate, light, low temperature, gibberellin, stress, and salicylic acid. Gene collinearity analysis indicated that ZePGIP2 and ZePGIP5 were paralogous genes. Gene collinearity analysis across species in the Araceae family identified two pairs of orthologous genes between Z. elliottiana and Pinellia pedatisecta, Pistia stratiotes, Colocasia esculenta, and Amorphophallus konjac. The inoculation and correlation analysis of P. carotovorum indicated that ZePGIP genes displayed differential responses to P. carotovorum infection, among which ZePGIP2 and ZePGIP6 were inhibited in the early stage of infection but significantly induced in the later stage. Conclusion The PGIP gene family mainly exists in the form of tandem repeats in colored Z. elliottiana and exhibits a highly conserved structure. ZePGIP2 and ZePGIP6 show significant responses to P. carotovorum infection, suggesting that they may play a crucial role in resisting P. carotovorum. [Ch, 8 fig. 37 ref.] -
-
[1] CHO H R, LIM J H, YUN K J, et al. Virulence variation in 20 isolates of Erwinia carotovora subsp. carotovora on Zantedeschia cultivars in Korea [J]. Acta Horticulturae, 2005(673): 653−659. [2] SNIJDER R C, van TUYL J M. Breeding for resistance in Zantedeschia spp. (Araceae) against soft rot caused by Erwinia carotovora ssp. carotovora [J]. Acta Horticulturae, 2002(570): 263−266. [3] 王雪皎, 郭彦斌, 李紫薇, 等. 彩色马蹄莲栽培品种对软腐病的抗性鉴定[J]. 热带农业科学, 2018, 38(6): 69−73. WANG Xuejiao, GUO Yanbin, LI Ziwei, et al. Resistance identification of Zantedeschia hybrida cultivars against the soft rot [J]. Chinese Journal of Tropical Agriculture, 2018, 38(6): 69−73. [4] 喻洪伟. 马蹄莲响应软腐病菌侵染的转录组分析和相关基因挖掘[D]. 昆明: 云南农业大学, 2022. YU Hongwei. Transcriptome Analysis and Related Genes Mining in Response to Pectobacterium carotovora Subsp. carotovora in Colored Zantedeschia[D]. Kunming: Yunnan Agricultural University, 2022. [5] 邹丽婷. 柠檬草精油对彩色马蹄莲软腐病菌群体感应的抑制作用[D]. 福州: 福建农林大学, 2020. ZOU Liting. Study on Quorum Sensing of Soft Rot Bacteria of Colored Calla Lily Inhibitory Effect by Lemongrass Essential Oil[D]. Fuzhou: Fujian Agriculture and Forestry University, 2020. [6] 蒙盼盼. 基于魔芋根相关微生物群落分析构建合成微生物群落防控魔芋软腐病[D]. 杨凌: 西北农林科技大学, 2025. MENG Panpan. Construction of Synthetic Microbial Community based on Analysis of Konjac Root-related Microbial Community to Prevent and Control Konjac Soft Rot[D]. Yangling: Northwest A&F University, 2025. [7] ALBERSHEIM P, ANDERSON A J. Proteins from plant cell walls inhibit polygalacturonases secreted by plant pathogens [J]. Proceedings of the National Academy of Sciences of the United States of America, 1971, 68(8): 1815−1819. [8] Di MATTEO A, FEDERICI L, MATTEI B, et al. The crystal structure of polygalacturonase-inhibiting protein (PGIP), a leucine-rich repeat protein involved in plant defense [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(17): 10124−10128. [9] CERVONE F, HAHN M G, de LORENZO G, et al. Host-pathogen interactions: XXXIII. a plant protein converts a fungal pathogenesis factor into an elicitor of plant defense responses [J]. Plant Physiology, 1989, 90(2): 542−548. [10] RIDLEY B L, O’NEILL M A, MOHNEN D. Pectins: structure, biosynthesis, and oligogalacturonide-related signaling [J]. Phytochemistry, 2001, 57(6): 929−967. [11] FERRARI S, SAVATIN D V, SICILIA F, et al. Oligogalacturonides: plant damage-associated molecular patterns and regulators of growth and development[J/OL]. Frontiers in Plant Science, 2013, 4: 49[2025-07-31]. DOI: 10.3389/fpls.2013.00049. [12] KALUNKE R M, TUNDO S, BENEDETTI M, et al. An update on polygalacturonase-inhibiting protein (PGIP), a leucine-rich repeat protein that protects crop plants against pathogens[J/OL]. Frontiers in Plant Science, 2015, 6: 146[2025-07-31]. DOI: 10.3389/fpls.2015.00146. [13] LU Liaoxun, ZHOU Fei, ZHOU Yong, et al. Expression profile analysis of the polygalacturonase-inhibiting protein genes in rice and their responses to phytohormones and fungal infection [J]. Plant Cell Reports, 2012, 31(7): 1173−1187. [14] JANG S, LEE B, KIM C, et al. The OsFOR1 gene encodes a polygalacturonase-inhibiting protein (PGIP) that regulates floral organ number in rice [J]. Plant Molecular Biology, 2003, 53(3): 357−372. [15] JANNI M, Di GIOVANNI M, ROBERTI S, et al. Characterization of expressed Pgip genes in rice and wheat reveals similar extent of sequence variation to dicot PGIPs and identifies an active PGIP lacking an entire LRR repeat [J]. Theoretical and Applied Genetics, 2006, 113(7): 1233−1245. [16] JOUBERT D A, de LORENZO G, VIVIER M A. Regulation of the grapevine polygalacturonase-inhibiting protein encoding gene: expression pattern, induction profile and promoter analysis [J]. Journal of Plant Research, 2013, 126(2): 267−281. [17] KALUNKE R M, CENCI A, VOLPI C, et al. The pgip family in soybean and three other legume species: evidence for a birth-and-death model of evolution[J/OL]. BMC Plant Biology, 2014, 14: 189[2025-07-31]. DOI: 10.1186/s12870-014-0189-3. [18] 陈夕军, 唐滔, 李丽丽, 等. 水稻多聚半乳糖醛酸酶抑制蛋白家族OsPGIP结构及基因表达特征分析[J]. 作物学报, 2020, 46(12): 1884−1893. CHEN Xijun, TANG Tao, LI Lili, et al. Analysis on the structures of polygalacturonase-inhibiting proteins and the expression profile of its encoding genes in rice [J]. Acta Agronomica Sinica, 2020, 46(12): 1884−1893. [19] 桂枝, 高建明, 袁庆华. 多聚半乳糖醛酸酶抑制蛋白(PGIP)的研究进展概述[J]. 天津农学院学报, 2011, 18(3): 36−41. GUI Zhi, GAO Jianming, YUAN Qinghua. Progress of researches on polygalacturonase inhibiting protein [J]. Journal of Tianjin Agricultural University, 2011, 18(3): 36−41. [20] LIU Nana, ZHANG Xueyan, SUN Yun, et al. Molecular evidence for the involvement of a polygalacturonase-inhibiting protein, GhPGIP1, in enhanced resistance to Verticillium and Fusarium wilts in cotton[J/OL]. Scientific Reports, 2017, 7: 39840[2025-07-31]. DOI: 10.1038/srep39840. [21] 于淼, 刘兆磊, 陈素梅, 等. 转梅PGIP基因增强菊花抗病性研究[J]. 西北植物学报, 2010, 30(6): 1111−1116. YU Miao, LIU Zhaolei, CHEN Sumei, et al. Expression of P. mume PGIP gene in transgenic Dendranthema morifolium increased tolerance to disease resistance [J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(6): 1111−1116. [22] 杨丽华, 王金凤, 杜丽璞, 等. 抗全蚀病、根腐病的转PgPGIP1基因小麦的获得与鉴定[J]. 作物学报, 2013, 39(9): 1576−1581. YANG Lihua, WANG Jinfeng, DU Lipu, et al. Generation and characterization of PgPGIP1 transgenic wheat plants with enhanced resistance to take-all and common root rot [J]. Acta Agronomica Sinica, 2013, 39(9): 1576−1581. [23] LUZZATTO T, YISHAY M, LIPSKY A, et al. Efficient, long-lasting resistance against the soft rot bacterium Pectobacterium carotovorum in calla lily provided by the plant activator methyl jasmonate [J]. Plant Pathology, 2007, 56(4): 692−701. [24] YISHAY M, BURDMAN S, VALVERDE A, et al. Differential pathogenicity and genetic diversity among Pectobacterium carotovorum ssp. carotovorum isolates from monocot and dicot hosts support early genomic divergence within this taxon [J]. Environmental Microbiology, 2008, 10(10): 2746−2759. [25] WANG Yi, YANG Tuo, WANG Di, et al. Salicylic acid influences the resistance of colored calla lily to soft rot (Pectobacterium carotovorum) via the TGA2-LNC88940-miR528-SOD module[J/OL]. The Plant Journal, 2025, 123(3): e70392[2025-07-31]. DOI: 10.1111/tpj.70392. [26] WANG Yupeng, TANG Haibao, DeBARRY J D, et al. MCScanX: a toolkit for detection and evolutionary analysis of gene synteny and collinearity[J/OL]. Nucleic Acids Research, 2012, 40(7): e49[2025-07-31]. DOI: 10.1093/nar/gkr1293. [27] CHEN Chengjie, CHEN Hao, ZHANG Yi, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data [J]. Molecular Plant, 2020, 13(8): 1194−1202. [28] 朱梦琳. 水稻PGIP基因家族部分成员抗真菌功能研究[D]. 武汉: 华中农业大学, 2017. ZHU Menglin. Functional Analysis of Several OsPGIP Genes on Protecting Plants Against Fungal Pathogens[D]. Wuhan: Huazhong Agricultural University, 2017. [29] 谌悦, 张军科, 熊帅. 桃PGIP基因及cDNA的克隆及序列分析[J]. 安徽农业科学, 2009, 37(32): 15738−15740, 15778. CHEN Yue, ZHANG Junke, XIONG Shuai. Cloning and sequence analysis of PGIP gene and cDNA from Prunus persica [J]. Journal of Anhui Agricultural Sciences, 2009, 37(32): 15738−15740, 15778. [30] 李广平, 房经贵, 蔡斌华, 等. 梅PGIP基因的克隆及全序列分析[J]. 园艺学报, 2006, 33(1): 125−127. LI Guangping, FANG Jinggui, CAI Binhua, et al. Cloning and sequencing of PGIP gene from Prunus mume Sieb. [J]. Acta Horticulturae Sinica, 2006, 33(1): 125−127. [31] 徐梦恒, 袁文雪, 陈丹, 等. 滇龙胆PGIP基因家族全基因组鉴定及表达模式[J]. 云南农业大学学报(自然科学), 2025, 40(3): 97−107. XU Mengheng, YUAN Wenxue, CHEN Dan, et al. Genome-wide identification and expression pattern of PGIP gene family in Gentiana rigescens [J]. Journal of Yunnan Agricultural University (Natural Science), 2025, 40(3): 97−107. [32] SHABALINA S A, OGURTSOV A Y, SPIRIDONOV A N, et al. Distinct patterns of expression and evolution of intronless and intron-containing mammalian genes [J]. Molecular Biology and Evolution, 2010, 27(8): 1745−1749. [33] LIU Hui, LYU Haimeng, ZHU Kaikai, et al. The emergence and evolution of intron-poor and intronless genes in intron-rich plant gene families [J]. The Plant Journal, 2021, 105(4): 1072−1082. [34] 王秀云, 张计育, 古咸彬, 等. 桃PpPGIP1启动子的分离与功能分析[J]. 园艺学报, 2012, 39(7): 1263−1270. WANG Xiuyun, ZHANG Jiyu, GU Xianbin, et al. Isolation and functional analysis of PpPGIP1 promoter in peach [J]. Acta Horticulturae Sinica, 2012, 39(7): 1263−1270. [35] NORMAN-SETTERBLAD C, VIDAL S, PALVA E T. Interacting signal pathways control defense gene expression in Arabidopsis in response to cell wall-degrading enzymes from Erwinia carotovora [J]. Molecular Plant-Microbe Interactions, 2000, 13(4): 430−438. [36] 江翱, 吴辉, 袁梦思, 等. 烟草PGIP基因在枯草芽孢杆菌中的表达[J]. 湖北农业科学, 2015, 54(11): 2767−2772. JIANG Ao, WU Hui, YUAN Mengsi, et al. Recombinant expression of tobacco PGIP gene in Bacillus subtilis [J]. Hubei Agricultural Sciences, 2015, 54(11): 2767−2772. [37] 邓婕, 王瀚林, 李有玉, 等. 岷江百合多聚半乳糖醛酸酶抑制蛋白基因及其启动子的克隆与分析[J]. 华北农学报, 2022, 37(4): 45−52. DENG Jie, WANG Hanlin, LI Youyu, et al. Cloning and analysis of a polygalacturonase inhibiting protein gene and its promoter from Lilium regale Wilson [J]. Acta Agriculturae Boreali-Sinica, 2022, 37(4): 45−52. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250463






 下载:
下载: