-
香榧Torreya granids ‘Merrillii’为中国南方特有的珍稀树种,其种仁富含不饱和脂肪酸(高达80%),尤其是富含裸子植物特有不饱和脂肪酸——金松酸[1],能预防动脉粥样硬化[2],改善肠道菌落[3]。然而,高不饱和脂肪酸的坚果易发生油脂酸败,即坚果中不饱和脂肪酸在储藏过程中受到温度、光照、氧化、水分等因素的影响,最终被氧化成小分子的脂肪酸[4]。油脂酸败可分为水解酸败和氧化酸败。水解酸败指不饱和脂肪酸经脂肪酶水解后产生大量的游离脂肪酸,使酸价、皂化值升高[5],碘价降低[6],易产生不良气味。游离脂肪酸则进一步被脂肪氧合酶(LOX)氧化生成氢过氧化物[7],过氧化值(POV)是反映初级氧化酸败程度的重要指标[8]。氢过氧化物等中间氧化产物很容易被裂解成醛、酮、酸类物质等含羰基的二级产物[9],羰基价升高[10],茴香胺值增加[11],导致油质发生改变。通常,完成后熟进程的香榧籽含水量较高,约33%[7]。因此,高含水量、高不饱和脂肪酸的香榧生籽在储藏过程极易氧化,油脂发生氧化酸败,严重影响其风味和营养价值,导致储藏期短,这已成为实现香榧周年供应的技术瓶颈。
大量研究表明:真空包装或充氮包装能有效地抑制核桃、吊瓜子、香榧等坚果储藏过程中的油脂氧化,延长其保质期[12−15]。然而,2007年中国颁发了“限塑令”,呼吁重复与减少使用塑料产品,因此,新型的生物基包装材料逐渐成为研究热点[16]。生物基膜按基质大分子类型可以分为多糖膜、蛋白质膜与脂肪膜[17−19],由于纯膜功能单一,机械性能与阻隔性能差,无抗菌功能等缺点,需要通过添加抗氧化剂等功能性材料改性成为多功能复合膜。如狄建兵[20]通过在大豆蛋白中添加抗氧化剂涂膜核桃坚果,发现复合膜可以很好地作用于脂肪酶与脂氧合酶,降低过氧化值,抑制了油脂的酸败。纳米合成技术的发展,使得纳米材料被越来越多应用于食品和农业领域,在可降解的生物基膜中加入具有抗菌性纳米材料[21],可以改善膜性能。通过水热法获得的金针菇碳点(CDs),加入到明胶-卡拉胶膜中,形成了具有抗氧化性的膜[22];在壳聚糖-明胶膜中添加了单宁酸和细菌纳米纤维素,可明显改善膜的机械性能[23]。
本课题组利用提取精油后的香榧假种皮残渣为材料,通过进一步水热法合成了CDs,利用酸水解法合成了纤维素纳米纤维(CNF),并在精油中加入活性剂进行高压均质得到了纳米精油乳液(EON),通过多种测定研制出最佳配比的G/10%CDs/3%CNF/EON纳米复合膜,即在鱼鳞明胶甘油液(FSG)中分别加入质量分数为10%的CDs溶液、3%的CNF凝胶和1 mL 质量分数为5%的EON[24]。目前,有关生物基膜对水果与肉类储藏的研究较多,然而,在坚果上的应用较少。因此,本研究通过设置直接涂膜和成膜袋装2种包装形式,通过Schaal烘箱法对样品进行加速氧化,测定各处理下储藏过程中香榧籽失质量率、酸价、碘值、皂化值、脂氧合酶活性、过氧化值、羰基价、茴香胺和硫代巴比妥酸的变化,旨在探索新型纳米复合膜在香榧籽储藏中的应用,延长储藏期。这不仅可为坚果包装乃至食品包装提供新思路,还可提升香榧副产品的附加值,实现香榧假种皮的高值化利用,缓解环境压力,对实现香榧产业的可持续发展具有现实的意义。
-
香榧籽于2023年9月采自浙江农林大学潘母岗香榧基地。该基地于2016年采用培育了4 a的嫁接苗(砧木为2年生榧树Torreya granids,穗条为1年生香榧,嫁接后再培育4 a)造林,2016年开始结实。于2023年9月18日采摘假种皮开裂的香榧籽,去除假种皮后,放置于温度为(25±2) ℃和湿度为(90±2)%的定温定湿后熟库,放置15 d完成其后熟过程,取出储藏于4 ℃冰箱备用。
保鲜膜材料:①纳米复合膜液,即在20 mL FSG中分别加入质量分数为10 %的CDs溶液、3%的纤维素纳米纤维(CNF)凝胶和1 mL质量分数为 5%的EON;②塑料膜(PE),0.04 mm塑料膜;③纳米复合膜,即将①中获得的纳米复合膜液,在37 ℃鼓风箱中干燥24 h成膜。纳米复合膜各组分制备见表1。
表 1 纳米复合膜各组分的详细制备方法
Table 1. Detailed methods of nanocomposite membranes
材料 制备方法 鱼鳞明胶甘油溶液(FSG) ① 向40 g鱼鳞中加入300 mL蒸馏水煮沸3 h,使用真空抽滤机去除残渣后得鱼鳞明胶溶液;② 以体积比1.0:0.5加入甘油,磁力搅拌交联20 min,取20 mL倒入直径9 cm的平板中备用,即为鱼鳞明胶甘油溶液(FSG) 10%碳点(CDs) ① 将提取精油的香榧假种皮残渣磨粉,再经200目筛子;② 取2 g香榧假种皮粉末加入聚四氟乙烯反应釜中,加入30 mL超纯水,再在180 ℃下分别反应6 h,等待冷却至室温后,先用滤纸分离残渣,离心5 000 r·min﹣1后取上清液,再用0.22 μm的滤膜除去杂质,最后通过透析24 h去除大颗粒,得到黄色透明的CDs溶液;③ 再将CDs溶液按10%质量分数加入前期得到的明胶甘油溶液,即为FSG/10%CDs 纤维素纳米纤维(CNF)凝胶 ① 将香榧假种皮粉末加入到质量分数为4%氢氧化钠中,在80 ℃下加热机械搅拌4 h,去除半纤维素、果胶和淀粉,用pH 6.8磷酸缓冲液洗至中性;为了脱去木质素,用2%亚氯酸钠、pH 4.6的醋酸缓冲液漂白4 h,重复3次。漂白后的样品再过滤,用缓冲液洗至中性;接着用质量分数为65%硫酸酸水解,60 ℃加热和机械搅拌持续2 h,加入冷水停止反应,过滤掉多余的酸,使用pH 6.8磷酸缓冲液调节pH至中性,超声分散1 h,得到CNF凝胶。② 再将CNF凝胶以质量分数为3%加入到前期获得的FSG/10%CDs溶液中,搅拌使其分散均匀,即获得FSG/10%CDs/3%CNF溶液 纳米精油乳液(EON) ① 按共水蒸馏法提取假种皮的精油;② 在5 mL香榧精油中加入2.5 g的吐温80和92.5 g的去离子水,在高压均质器中混合20 min后获得纳米精油乳液(EON);③ 往FSG/10%CDs/3%CNF溶液中加入1 mL 5% EON -
为了进一步研究新研制的纳米复合膜的保鲜作用,采取直接涂膜和成膜袋装2种方式。具体操作如下:挑选形状、大小和颜色较一致的香榧籽均匀分为2份,分别进行以下2种处理:①纳米复合膜液涂膜处理(Coating),即将香榧坚果浸入制备的复合膜液,拿出晾干之后再浸入膜液1次,风干;将复合膜液换为水,作为对照组(ck);②纳米复合膜袋包装(Film),即将香榧坚果装入纳米复合膜包装袋;以香榧籽用塑料袋包装作为对比处理,简称为PE。每个处理3个重复,每个重复250 g香榧籽。
通过Schaal烘箱法对样品进行加速氧化:即所有的处理被放置于60 ℃烘箱储藏,每隔1周取样测定油脂品质各项指标。
-
称量储藏前的香榧籽质量(W0),在储藏期间,每周定期测定香榧籽的质量(W1)。失质量率=(W0−W1)/ W0×100%。
-
酸价和过氧化值的测定参照杨蕾等[25]方法和GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》中的滴定法测定[25];碘值参照GB 5009.267—2020《食品安全国家标准 食品中碘的测定》中的氧化还原滴定法测定[26];皂化值参照GB/T 5534—2008《动植物油脂 皂化值的测定》测定[27];脂氧合酶参照夏宁等[28]的方法测定;羰基价参照GB 5009.230—2016《食品安全国家标准 食品中羰基价的测定》测定[29];茴香胺参照GB/T 24304—ISO 6885: 2016 Animal and Vegetable Fat and Oils; Determinatior of Anisidline Value测定[30];硫代巴比妥酸值参照GB/T 35252—2017《动植物油脂 硫代巴比妥酸值的测定 直播法》测定[31]。
-
各项参数均采用SPSS 16.0进行数据处理,运用方差分析法(ANOVA)分析,利用SigmaPlot 15.0 版专业绘图和数据分析软件进行相关性分析及作图。利用主成分分析(PCA)分析不同储藏基同不同包装处理对香榧油脂品质的影响。
-
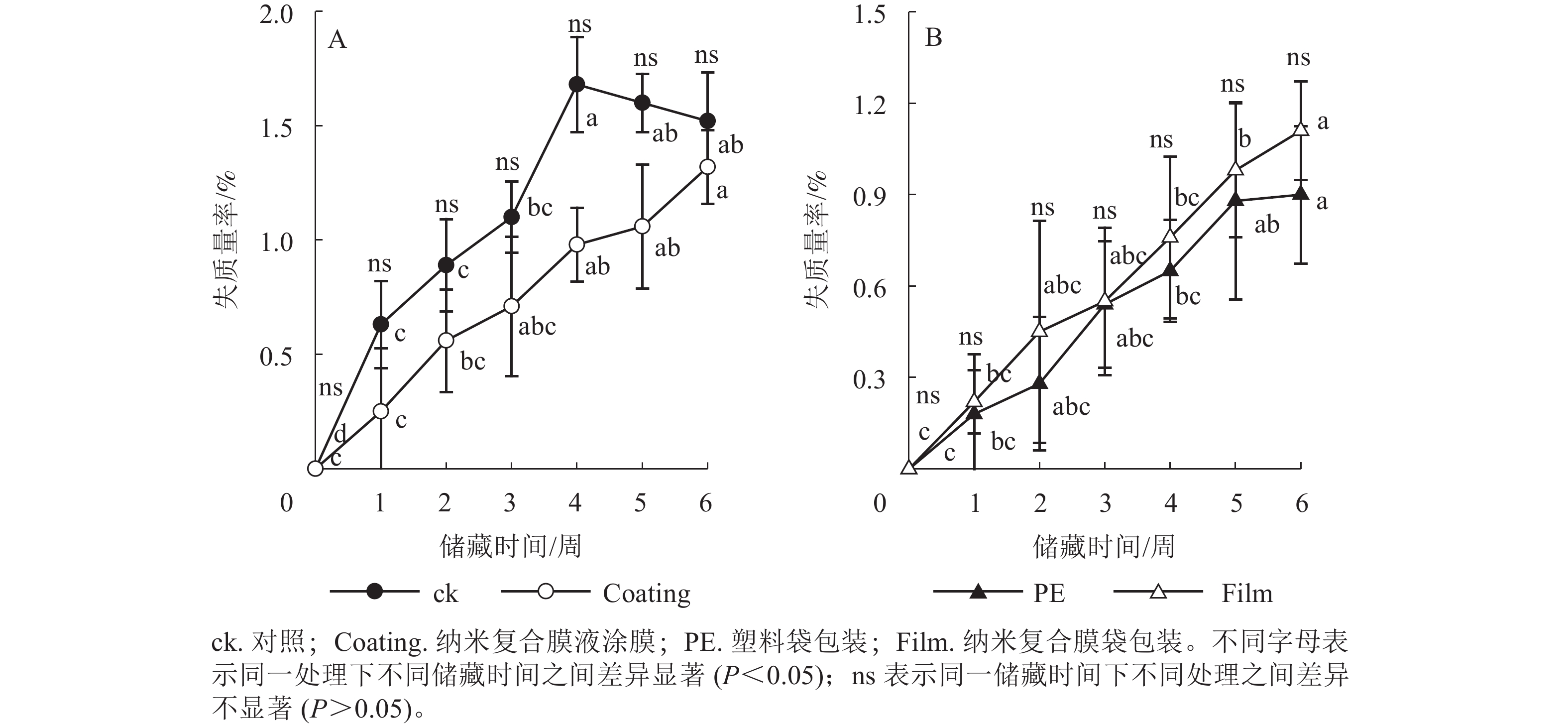
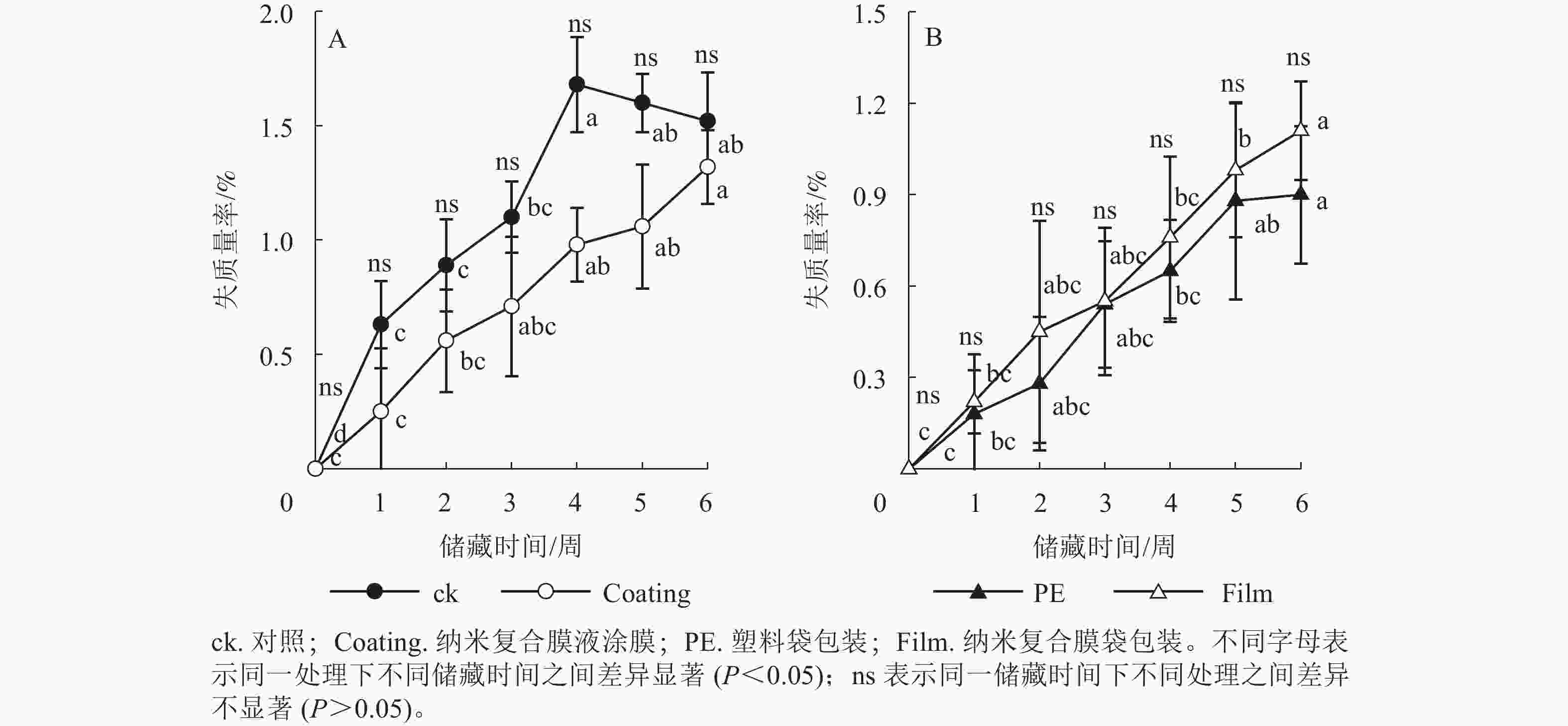
由图1可见:随储藏时间的延长,各组香榧籽的失质量率均呈显著增加趋势。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽失质量率依次显著增加了1.52%、1.32%、0.90%和1.11%(P<0.05)。然而,在整个储藏期内,ck与Coating、PE与Film处理的香榧籽失质量率之间无显著差异(P>0.05)。综上结果表明:无论是纳米复合液直接涂膜还是成袋包装,对储藏期香榧籽的失质量率均无显著影响。
-
由图2可见:随储藏时间的延长,各组香榧籽的酸价和皂化值均呈显著增加趋势,而其碘值则呈显著降低趋势。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽的酸价显著增加了6.8、5.6、6.0和5.0倍(P<0.05);从开始储藏至储藏4周,Coating处理的香榧籽的酸价显著低于ck(P<0.05),但此后两者之间无显著差异(P>0.05);从开始储藏至储藏5周,PE和Film处理的香榧籽之间的酸价无显著差异(P>0.05),但储藏6周时,Film处理的香榧籽酸价显著低于PE处理的(P<0.05)。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽碘值显著降低了8.7%、5.3%、7.7%和5.0%(P<0.05);从储藏2~6周,Coating处理的香榧籽碘值显著高于ck(P<0.05);储藏3~6周,Film处理的香榧籽碘值显著高于PE(P<0.05)。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽皂化值显著增加了11.0%、3.4%、8.2%和4.9%(P<0.05);储藏2~6周,Coating处理的香榧籽皂化值显著高于ck(P<0.05);储藏3~6周,Film处理的香榧籽皂化值均显著高于PE(P<0.05)。综上结果表明:无论是纳米复合液直接涂膜还是成袋包装,均能显著降低其香榧籽的游离脂肪酸含量,有效降低其不饱和脂肪酸的氧化。
-
由图3可见:随储藏时间的延长,各组香榧籽的脂氧合酶活性和过氧化值均呈显著增加趋势(图3)。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽脂氧合酶活性显著增强了2.5、1.3、2.0和1.1倍(P<0.05);储藏2~6周,Coating处理的香榧籽脂氧合酶活性显著低于ck(P<0.05);储藏0~4周,PE和Film处理的香榧籽之间脂氧合酶活性无显著差异(P>0.05),但储藏5~6周时,Film处理的香榧籽脂氧合酶活性显著低于PE的(P<0.05)。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽过氧化值显著增加了16.9、13.5、14.5和13.5倍(P<0.05);储藏2~6周,Coating香榧籽的过氧化值显著低于ck(P<0.05,除储藏2周外);储藏2~5周,Film处理的香榧籽过氧化值显著低于PE的(P<0.05)。综上结果表明,无论是纳米复合液直接涂膜还是成袋包装,均能显著降低香榧籽中的油脂氧化。
-
由图4可知:各组香榧籽中的羰基价随储藏时间延长均呈显著增加趋势。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽羰基价显著增强了3.2、4.1、8.8和5.5倍(P<0.05);储藏2~6周,Coating处理的香榧籽的羰基价显著低于ck(P<0.05);储藏0~1周,PE和Film处理的香榧籽之间的羰基价无显著差异(P>0.05),但储藏2~5周时,Film处理的香榧籽羰基价均显著低于PE (P<0.05)。随储藏时间的延长, ck和PE处理的香榧籽的茴香胺值均呈先增后降的趋势,而Coating和Film处理的茴香胺值则呈逐渐增加趋势。与储藏前相比,储藏6周后ck、Coating、PE和Film香榧籽的茴香胺值分别显著增强了88.5%、66.7%、104.2%和62.5%(P<0.05);储藏前期,ck和Coating香榧籽的茴香胺值之间无显著差异,而储藏2~5周,Coating处理的香榧籽茴香胺值均显著低于ck(P<0.05);储藏0~2周,PE和Film香榧籽之间的羰基价无显著差异(P>0.05),但储藏3~5周时,Film处理的香榧籽的羰基价均显著低于PE的(P<0.05,除储藏5周外)。
-
由图5可知:各组香榧籽中的硫代巴比妥酸质量分数随储藏时间延长均呈显著增加趋势。与储藏前相比,储藏6周后ck、Coating、PE和Film处理的香榧籽的硫代巴比妥酸质量分数显著增强了2.4、1.3、2.2和0.8倍(P<0.05);储藏1~6周,Coating处理的香榧籽的硫代巴比妥酸质量分数显著低于ck(P<0.05);储藏2~6周时,Film处理的香榧籽的硫代巴比妥酸质量分数均显著低于PE(P<0.05)。
-
主成分分析(图6)可知:不同储藏期PC1和PC2总和均达72%,解释率很好。储藏1~6周,Coating与Film处理较近,表明纳米复合膜液涂膜和成袋包装对香榧籽油脂品质的作用效果基本一致;而它们与PE、ck处理之间均存在明显的分离,表明纳米复合膜液无论是直接涂膜还是成膜袋装对香榧籽的储藏效果要优于未包装和普通塑料袋包装。
-
失质量率是衡量包装材料密封性的重要指标[32]。本研究结果表明:随储藏期延长,各组香榧籽均在失水,但纳米复合膜处理(包括纳米复合膜液和纳米复合膜袋包装)在密封性上未表现明显的优势。酸价是表示油脂水解酸败程度的指标,反映脂肪水解的程度[5]。本研究中,储藏1~4周纳米复合膜液涂膜处理的香榧籽的酸价显著低于对照,而储藏6周后纳米复合膜袋包装处理的香榧籽的酸价显著低于塑料膜包装处理。碘值是衡量油脂不饱和度大小的参数[6],不饱和程度越高,碘价越大,其折射率就越大,皂化值就越低[5]。本研究结果显示:储藏4~6周,无论是纳米复合膜液涂膜还是成膜包装,均能使香榧籽的碘值显著增大,皂化值显著降低,表明纳米复合膜可明显减少香榧籽中不饱和脂肪酸的氧化程度,储藏效果较好。已有研究表明:在复合涂层中添加天然抗氧化剂抗坏血酸(VC)、转丁基对苯二酚(TBGQ)、半胱氨酸(Cys)能有效抑制核桃仁中皂化物的产生,其碘价均显著升高[20]。碳点CDs是具有良好抗氧化活性的纳米材料[22],因此,纳米复合膜中添加CDs,能有效抑制香榧籽的油脂酸败。
氢过氧化物是油脂酸败过程中的间产物,主要是由脂氧合酶催化生成的[7],但这些氢过氧化物极不稳定,积累到一定浓度,就自动分解,形成醛、酮、醇、酸等小分子物质,常具不愉快、刺激性的气味[9],还可能在过氧化物酶的作用下形成不良气味的羰基化合物[10]。茴香胺值能评价油脂中不饱和醛的含量,是二次脂质氧化程度的重要指标[11]。本研究结果显示:储藏5~6周,无论是纳米复合膜液涂膜还是成膜包装,均能显著降低香榧籽的脂氧合酶活性,使其过氧化值较小,羰基价较低,表明纳米复合膜中的CDs能有效抑制脂氧合酶活性,从而降低其过氧化值,有效抑制香榧籽生成羰基类化合物。这与叶舒等[33]的研究结果一致,在鱼油里添加CDs,能显著减缓过氧化值的升高,有效抑制鱼油的氧化劣变。本研究结果显示:储藏6周,各组香榧籽的茴香胺值无显著差异,表明纳米复合膜对抑制香榧籽中不饱和醛类物质的生成无显著影响。硫代巴比妥酸(TBA)是测定不饱和脂肪酸发生氧化反应终产物丙二醛含量[34]。本研究结果显示:储藏2~6周,无论是纳米复合膜液涂膜还是成膜包装,均能显著降低香榧籽的硫代巴比妥酸,表明纳米复合膜能有效抑制香榧籽中不饱和脂肪酸的氧化。
生产上,含纳米材料的复合膜用于食品储藏保鲜通常有2种方式,即直接涂膜[35]和成膜包装[36]。本研究通过主成分分析进一步分析不同包装处理对香榧籽油脂品质的影响,发现纳米复合膜液直接涂膜和成袋包装对Schaal烘箱法储藏期香榧籽的油脂品质无显著差异,但其储藏效果均明显优于普通塑料袋包装。因此,本研究所制备的G/10%CDs/3%CNF/EON纳米复合膜无论是涂层还是成膜均能使香榧籽保持较好的油脂品质,未来可应用于香榧籽的生籽或成品储藏。
-
利用提取精油后的香榧假种皮残渣及香榧精油为材料制备的纳米复合膜液,直接涂层和成膜包装均能缓减储藏期香榧籽油脂的氧化程度,维持较好的油脂品质。储藏5~6周,无论是纳米复合膜液涂膜还是成膜包装,均能使香榧籽的碘值显著增大,皂化值显著降低,且香榧籽的脂氧合酶活性显著降低,过氧化值较小,羰基价较低。这是由于纳米复合膜中添加了具有良好抗氧化活性的碳点CDs。本研究结果可为开发香榧籽的新型包装提供参考,也为其他坚果的储藏包装提供新思路。
Effect of nanocomposite film on oil quality of Torreya grandis ‘Merrillii’ nuts during storage
-
摘要:
目的 研究新型纳米复合膜包装香榧Torreya grandis ‘Merrillii’籽在储藏过程中油脂品质的变化规律,为开发香榧等其他坚果的新型包装材料提供理论依据。 方法 以提取精油后的香榧假种皮残渣和香榧精油为原料制备的纳米复合膜液为包装原材料,采用Schaal烘箱法加速香榧储藏期的氧化试验,设置2种包装形式[直接涂膜:对照(ck)和纳米复合膜液(Coating);成膜袋装:塑料袋包装(PE)和纳米复合膜袋包装(Film)],测定各处理下0~6周储藏过程中香榧籽失质量率、酸价、碘值、皂化值、脂氧合酶活性、过氧化值、羰基价、茴香胺和硫代巴比妥酸质量分数。 结果 ①储藏4~6周,Coating处理的香榧籽的碘值显著高于ck(P<0.05),且Film处理的香榧籽的碘值显著高于PE处理(P<0.05)。②储藏5~6周,Coating处理的香榧籽的脂氧化酶活性、过氧化值、羰基价和硫代巴比妥酸质量分数均显著低于ck(P<0.05),且Film处理的香榧籽的以上指标均显著低于PE处理。③PCA分析显示:储藏1~6周,Coating与Film处理的香榧籽之间无明显的分离,但它们与PE、ck之间则存在明显的分离。 结论 新型制备的纳米复合膜液无论是直接涂层还是成膜包装,均可显著延缓储藏香榧籽的油脂酸败,使其保持较好的油脂品质。图6参36 Abstract:Objective This study aims to study the changes of oil quality in nano-film packaged Torreya grandis ‘Merrillii’ nuts during storage, and provide theoretical basis for searching new packaging material. Method The nanocomposite film solution prepared from pseudoseed residue after essential oil extraction and its essential oil were used as packaging raw materials. The oxidation experiment of the nuts during storage (0−6 weeks) was conducted by Schaal oven method. Two packaging types were set up (direct coating: control, short for ck; nanocomposite film solution coating, short for Coating; film bagged: plastic bag, short for PE; nanocomposite film bag, short for Film). Result (1) During 4 to 6 week of storage time, the iodine value of the nuts with Coating was significantly higher than that of ck (P<0.05), but it of the nuts with Film was significantly lower than that of PE (P<0.05). (2) During 5 to 6 week of storage time, the lipid oxidase activity, peroxidation value, carbonyl value and thiolbarbituric acid content of the nuts with Coating were significantly higher than those of ck (P<0.05), and the above indicators of the nuts with Film were significantly lower than those of PE. (3) PCA analysis showed that there was no obvious separation between the nuts with Coating and Film, however, the two treatments clearly separated from PE and ck. Conclusion The newly prepared nanocomposite film solution, whether directly coating or film bagged can significantly delay the rancidity of the nuts, with better oil quality during storage. [ Ch, 6 fig. 36 ref.] -
表 1 纳米复合膜各组分的详细制备方法
Table 1. Detailed methods of nanocomposite membranes
材料 制备方法 鱼鳞明胶甘油溶液(FSG) ① 向40 g鱼鳞中加入300 mL蒸馏水煮沸3 h,使用真空抽滤机去除残渣后得鱼鳞明胶溶液;② 以体积比1.0:0.5加入甘油,磁力搅拌交联20 min,取20 mL倒入直径9 cm的平板中备用,即为鱼鳞明胶甘油溶液(FSG) 10%碳点(CDs) ① 将提取精油的香榧假种皮残渣磨粉,再经200目筛子;② 取2 g香榧假种皮粉末加入聚四氟乙烯反应釜中,加入30 mL超纯水,再在180 ℃下分别反应6 h,等待冷却至室温后,先用滤纸分离残渣,离心5 000 r·min﹣1后取上清液,再用0.22 μm的滤膜除去杂质,最后通过透析24 h去除大颗粒,得到黄色透明的CDs溶液;③ 再将CDs溶液按10%质量分数加入前期得到的明胶甘油溶液,即为FSG/10%CDs 纤维素纳米纤维(CNF)凝胶 ① 将香榧假种皮粉末加入到质量分数为4%氢氧化钠中,在80 ℃下加热机械搅拌4 h,去除半纤维素、果胶和淀粉,用pH 6.8磷酸缓冲液洗至中性;为了脱去木质素,用2%亚氯酸钠、pH 4.6的醋酸缓冲液漂白4 h,重复3次。漂白后的样品再过滤,用缓冲液洗至中性;接着用质量分数为65%硫酸酸水解,60 ℃加热和机械搅拌持续2 h,加入冷水停止反应,过滤掉多余的酸,使用pH 6.8磷酸缓冲液调节pH至中性,超声分散1 h,得到CNF凝胶。② 再将CNF凝胶以质量分数为3%加入到前期获得的FSG/10%CDs溶液中,搅拌使其分散均匀,即获得FSG/10%CDs/3%CNF溶液 纳米精油乳液(EON) ① 按共水蒸馏法提取假种皮的精油;② 在5 mL香榧精油中加入2.5 g的吐温80和92.5 g的去离子水,在高压均质器中混合20 min后获得纳米精油乳液(EON);③ 往FSG/10%CDs/3%CNF溶液中加入1 mL 5% EON -
[1] WU Jiasheng, HUANG Jiandiao, HONG Yiwei, et al. De novo transcriptome sequencing of Torreya grandis reveals gene regulation in sciadonic acid biosynthesis pathway [J]. Industrial Crops and Products, 2018, 120: 47 − 60. [2] 陈振德, 陈志良, 侯连兵, 等. 香榧子油对实验性动脉粥样硬化形成的影响[J]. 中药材, 2000, 23(9): 551 − 553. CHEN Zhende, CHEN Zhiliang, HOU Lianbing, et al. The preventive effect of the oil from the seed of Torreya grandis cv. Merrillii on experimental atherosclerosis in rats [J]. Chinese Medicinal Herbs, 2000, 23(9): 551 − 553. [3] XIAO Minghui, HUANG Minjie, HUAN Weiwei, et al. Effects of Torreya grandis kernel oil on lipid metabolism and intestinal flora in C57BL/6J mice [J/OL]. Oxidative Medicine and Cellular Longevity, 2022: 4472751[2024-02-01]. doi: 10.1155/2022/4472751. [4] BURANASOMPOB A, TANG J, POWERS J R, et al. Lipoxygenase activity in walnuts and almonds [J]. LWT Food Science and Technology, 2007, 40: 893 − 899. [5] MATTHAUS B. Utilization of high-oleic rapeseed oil for deep-fat frying of French fries compared to other commonly used edible oils [J]. European Journal of Lipid Science and Technology, 2006, 108(3): 200 − 211. [6] 段如雁, 韦小丽, 冯明桥. 不同贮藏处理对麻疯树种子油脂特性的影响[J]. 仓储与物流, 2019, 44(7): 60 − 63. DUAN Ruyan, WEI Xiaoli, FENG Mingqiao. Effects of different storage treatment on oil characteristics of Jatropha curcas L. seeds [J]. Warehousing and Logistics, 2019, 44(7): 60 − 63. [7] ZHANG Zuying, JIN Hangbiao, SUO Jinwei, et al. Effect of temperature and humidity on oil quality of harvested Torreya grandis cv. Merrillii nuts during the after-ripening stage [J/OL]. Froniters in Plant Science, 2020, 11: 573681[2024-02-01]. doi: 10.3389/fpls.2020.573681. [8] PHUONG N N M, LE T T, NGUYEN M V T, et al. Antioxidant activity of rambutan (Nephelium lappaceum L. ) peel extract in soybean oil during storage and deep fryin [J/OL]. European Journal of Lipid Science and Technology, 2020, 122(2): 1900214[2024-02-01]. doi: 10.1002/ejlt.201900214. [9] XU Tingting, LI Jing, FAN Yawei, et al. Comparison of oxidative stability among edible oils under continuous frying conditions [J]. International Journal of Food Properties, 2015, 18(7): 1478 − 1490. [10] 骆小凡, 金清馨, 许光治, 等. 天然复合抗氧化剂对精炼栀子果油抗氧化性影响[J/OL]. 中国粮油学报, 2023-12-01 [2024-02-01]. doi: 10.20048/j. cnki. issn. 1003-0174.000686. LUO Xiaofan, JIN Qingxin, XU Guangzhi, et al. Effects of natural complex antioxidants on the antioxidant properties of refined gardenia fruit oil [J/OL]. Journal of the Chinese Cereals and Oils Association, 2023-12-01 [2024-02-01]. doi: 10.20048/j.cnki.issn.1003-0174.000686. [11] 池桂良, 凌森, 申雪然, 等. ARA在加速实验过程中过氧化值、茴香胺值及风味评价的研究[J]. 产业与科技论坛, 2017, 16(4): 73 − 74. CHI Guiliang, LING Sen, SHEN Xueran, et al. Study on peroxidation value, anisamine value and flavor evaluation of ARA in the accelerated experiment [J]. Inductrial &Science Tribune, 2017, 16(4): 73 − 74. [12] 王克建, 郝艳宾, 张烨, 等. 不同包装处理对碎核桃仁中抗氧化物质的影响[J]. 食品科学, 2015, 26(8): 418 − 421. WANG Kejian, HAO Yanbin, ZHANG Ye, et al. Effect on the antioxidant substances variation in fragment walnut kernel by different package [J]. Food Science, 2015, 26(8): 418 − 421. [13] 史奎春, 张卫明, 赵伯涛, 等. 不同包装处理对炒制吊瓜子贮藏保鲜效果的研究[J]. 食品科技, 2006(9): 269 − 272. SHI Kuichun, ZHANG Weiming, ZHAO Botao, et al. Study on effects of preserving stir-fried diaoguazi with different packages [J]. Food Science and Technology, 2006(9): 269 − 272. [14] 宋丽丽, 郜海燕, 葛林梅, 等. 包装对香榧坚果贮藏中的油脂酸败和抗氧化能力的影响[J]. 林业科学, 2009, 45(3): 49 − 53. SONG Lili, GAO Haiyan, GE Linmei, et al. Effects of different packaging on lipid peroxidation and antioxidant ability of Torreya grandis nuts during storage at room temperature [J]. Scientia Silvae Sinicae, 2009, 45(3): 49 − 53. [15] MEXIS S F, BADEKA A V, RIGANAKOS K A, et al. Effect of packaging and storage conditions on quality of shelled walnuts [J]. Food Control, 2009, 20: 743 − 751. [16] THONGSRIKHEN N, TAOKAEW S, SRIARIYANUN M, et al. Antibacterial activity in gelatin-bacterial cellulose composite film by thermally crosslinking with cinnamaldehyde towards food packaging application [J/OL]. Food Packaging and Shelf Life, 2022, 31: 100766[2024-02-01]. doi: 10.1016/J.FPSL.2021.100766. [17] LI Xiaona, WEI Yanqiang, JIANG Shuaicheng, et al. Full bio-based soy protein isolate film enhanced by chicken feather keratin [J/OL]. Macromolecular Materials and Engineering, 2021, 306(5): 2100004[2024-02-01]. doi: 10.1002/MAME.202100004. [18] FERNÁNDEZ-DE C L, MENGÍBAR M, SÁNCHEZ Á, et al. Films of chitosan and chitosan-oligosaccharide neutralized and thermally treated: effects on its antibacterial and other activities [J]. LWT Food Science and Technology, 2016, 73: 368 − 374. [19] PHADTARE S, D’ BRITTO V, PUNDLE A, et al. Invertase-lipid biocomposite films: preparation, characterization, and enzymatic activity [J]. Biotechnology Progress, 2004, 20: 156 − 161. [20] 狄建兵. 涂膜抑制核桃哈败的研究[D]. 太原: 山西农业大学, 2005. DI Jianbing. Study on Inhibiting of Coating to Walnut Rancidity [D]. Taiyuan: Shanxi Agricultural University, 2005. [21] SHIV S, JONG-WHAN R. Preparation of sulfur nanoparticle-incorporated antimicrobial chitosan films [J]. Food Hydrocolloids, 2018, 82: 116 − 123. [22] ROY S, EZATI P, RHIM J. Gelatin/carrageenan-based functional films with carbon dots from Enoki mushroom for active food packaging applications [J]. ACS Applied Polymer Materials, 2021, 3(12): 6437 − 6445. [23] TAHERI P, JAHANMARDI R, KOOSHA M, et al. Physical, mechanical and wound healing properties of chitosan/gelatin blend films containing tannic acid and/or bacterial nanocellulose [J]. International Journal of Biological Macromolecules, 2020, 154: 421 − 432. [24] BAO Junjun, HU Yuanyuan, FARAG M A, et al. Carbon dots, cellulose nanofiber, and essential oil nanoemulsion from Torreya grandis aril added to fish scale gelatin film for tomato preservation [J/OL]. International Journal of Biological Macromelecules, 2023, 245: 125482[2024-02-01]. doi: 10.1016/j.ijbiomac.2023.125482. [25] 杨蕾, 赵获, 胡渊渊, 等. 不同加工方式香榧香气物质和油脂品质的比较分析[J]. 浙江农林大学学报, 2022, 39(1): 22 − 31. ZHAO Lei, ZHAO Huo, HU Yuanyuan, et al. Comparative analysis of aroma components and oil quality of Torreya grandis ‘Merrillii’ nuts with different processing techniques [J]. Journal of Zhejiang A&F University, 2022, 39(1): 22 − 31. [26] 中华人民共和国国家卫生健康委员会. 食品安全国家标准食品中碘的测定: GB 5009.267—2020. 北京: 中国标准出版社, 2020. National Health Commission of the People’s Republic of China. Determination of Iodine in Food of National Standard for Food Safety: GB 5009.267−2020[S]. Beijing: Standards Press of China, 2020. [27] 中华人民共和国国家卫生健康委员会. 动植物油脂皂化值的测定: GB/T 5534—2008 [S]. 北京: 中国标准出版社, 2008. National Health Commission of the People’s Republic of China. Determination of Saponification Value of Animal and Vegetable Oils: GB/T 5534−2008 [S]. Beijing: Standards Press of China, 2008. [28] 夏宁, 王晓琪, 严文冰, 等. 豆浆脂肪氧合酶测定方法的优化及酶动力学的研究[J]. 大豆科学, 2018, 37(5): 769 − 775. XIA Ning, WANG Xiaoqi, YAN Wenbing, et al. Method optimization for the determination of lipoxyganase in soybean milk and evaluation of its kinetics [J]. Soybean Science, 2018, 37(5): 769 − 775. [29] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中羰基价的测定: GB 5009.230—2016. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission, People’s Republic of China. Determination of Carbonyl Value in Food of National Standard for Food Safety: GB 5009.230−2016 [S]. Beijing: Standards Press of China, 2016. [30] 中国国家标准化管理委员会. 动植物油脂茴香胺值的测定: GB/T 24304—2009 [S]. 北京: 中国标准出版社, 2009. Standardization Administration of China. Determination of Anisidine Value in Animal and Vegetable Oils: GB/T 24304−2009 [S]. Beijing: Standards Press of China, 2009. [31] 中国国家标准化管理委员会. 动植物油脂2-硫代巴比妥酸值的测定直接法: GB/T 35252—2017 [S]. 北京: 中国标准出版社, 2017. Standardization Administration of China. Direct Method for Determination of2 -Thiobarbituric Acid Value of Animal and Vegetable Oils: GB/T 35252−2017 [S]. Beijing: Standards Press of China, 2017. [32] 郝琳, 贠建民, 赵雨萱, 等. 聚乙烯纳米包装对金针菇贮藏过程中品质特性和营养成分的影响[J]. 甘肃农业大学学报, 2023, 58(5): 218 − 226. HAO Lin, YUN Jianmin, ZHAO Yuxuan, et al. Effects of nano-polyethylene film packaging on quality characteristics and nutritional components of Flammulina velutipes during storage [J]. Journal of Gansu Agricultural University, 2023, 58(5): 218 − 226. [33] 叶舒, 刘国琴. 废茶渣碳点的制备及对鱼油氧化稳定性的影响[J/OL]. 中国油脂, 2023-12-25 [2024-02-01]. doi: 10.19902/j.cnki.zgyz.1003-7969.230510. YE Shu, LIU Guoqin. Preparation of carbon dots from tea residue and its effect on oxidation stability of fish oil [J/OL]. China Oil and Fats, 2023-12-25 [2024-02-01]. doi: 10.19902/j.cnki.zgyz.1003-7969.230510. [34] 袁施彬, 陈代文, 韩飞. 氧化时长对不同油脂过氧化指标的影响研究[J]. 饲料工业, 2007, 28(11): 33 − 34. YUAN Shibin, CHEN Daiwen, HAN Fei. Study on the effect of oxidation time on different lipid peroxidation indexes [J]. Feed Industry, 2007, 28(11): 33 − 34. [35] JUNG S, CUI Y F, BARNES M, et al. Multifunctional bio-nanocomposite coatings for perishable fruits [J/OL]. Advanced Materials, 2020, 32(26): 2070199[2024-02-01]. doi: 10.1002/adma.201908291. [36] LIU Jian, LI Kai, CHEN Yinglong, et al. Active and smart biomass film containing cinnamon oil and curcumin for meat preservation and freshness indicator [J/OL]. Food Hydrocolloids, 2022, 133: 107979[2024-02-01]. doi: 10.1016/J.FOODHYD.2022.107979. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20240177






 下载:
下载: