-
二氧化碳(CO2)等温室气体排放增加以及全球变暖日益加剧,如何减缓大气“温室效应”,是人类目前面临的重要问题之一。土壤被认为是陆地生态系统中最大的碳库[1],其中土壤有机碳储量为1 500~2 000 Pg,无机碳储量为700~1 000 Pg[2],是土壤CO2排放的主要来源[3]。土壤碳库在全球碳循环中起着重要的碳源、碳汇作用,具有巨大的碳汇潜力,其微小变化将可能对大气CO2产生显著影响,在全球碳循环过程中扮演着非常重要的角色[4]。农田是陆地生态系统重要的组成部分,约占全球陆地面积的10.62%[5];农田土壤作为陆地生态系统最活跃的碳库,其CO2排放量约占全球人为温室气体排放总量的21%~25%[6]。由此可见,深入开展农田土壤呼吸作用及其影响因素研究,对准确评估陆地生态系统碳收支具有重要的理论和现实意义。
土壤干湿交替被认为是土壤呼吸的重要影响因素,通过激发或抑制土壤呼吸来改变陆地生态系统碳储量,进而影响土壤呼吸时空特征及碳通量[7−18]。研究表明:受降水量、土壤初始含水量、降水格局、生态系统类型、干旱持续事件及干湿交替频率和强度的影响[19],土壤干湿交替引起的土壤碳排放呈现不同的变化规律。在全球气候变化大背景下,极端干旱/降水事件和人类活动会使土壤发生频繁的干湿交替过程[20−22];未来随着气候变化及降水格局的改变,土壤干湿交替现象及其发生频率会进一步提高[23−25]。中国西南喀斯特区碳酸盐岩出露面积达51.36 万km2[26],区内农田面积占比21.6%[27],对于喀斯特地区碳循环具有举足轻重的作用。由碳酸盐岩发育的石灰性土壤是该区农田主要土壤类型之一,不同于其他农田土壤类型,具有明显的区域特色。一方面,喀斯特地区土壤干湿交替特征鲜明,干旱、半干旱地区土壤干湿交替主要由降水量少引起,喀斯特地区降水充沛,但土层浅薄,储水能力低,岩石渗漏性强,导致土壤干湿交替发生更加频繁[28];另一方面,土壤无机碳对土壤CO2排放具有一定的贡献[29−33],以往的研究较少的考虑这一贡献。现有的非喀斯特地区土壤碳循环过程对干湿交替的响应规律,可能并不适用于喀斯特地区。因此,开展喀斯特地区农田石灰性土壤CO2排放对干湿交替的响应研究,可提升喀斯特地区土壤CO2排放通量评估的准确性。
本研究以喀斯特农田土壤为研究对象,通过室内控制实验,分析喀斯特农田土壤呼吸对不同干湿交替的响应规律,为深入理解气候变化下喀斯特农田土壤碳固持和减少碳排放提供理论依据。
-
研究区位于贵州省贵阳市乌当区(26°38N,106°48′E),属于亚热带季风气候,年平均气温为14.9 ℃,年均降水量为1 130.4 mm。该地区是喀斯特地貌发育区,碳酸盐类岩层分布广,地貌类型以山地、丘陵为主,岩石类型以石灰岩为主,土壤类型主要由黄壤、黄棕壤、石灰土组成。本研究区内土壤类型为石灰土, pH为7.21,有机碳质量分数为55.40 g·kg−1,速效氮为87.36 mg·kg−1,速效磷为1.87 mg·kg−1。该区土壤干湿交替主要由降水事件导致。
-
以研究区内石灰性农田作为研究对象,采取表层土(0~20 cm) 带回实验室,放在通风状况良好、阴凉的地方风干。风干后的土壤挑出石块和可见植物残体样品,研磨,过2 mm筛备用。
-
试验于2022年8—9月在贵州师范学院温室大棚进行。将处理好的风干土充分混合均匀,平铺到聚氯乙烯(PVC)管底部(PVC管底部密封,高15 cm,内径10 cm,土层厚度5 cm,上部留有10 cm的空间)。根据贵阳市多年降水特征(该区以小于10 mm的降水为主)模拟2个降水量处理,分别是10和25 mm降水量,试验持续30 d (720 h)。在每个降水量处理下设置3个以10 d为降水周期的干湿循环周期,每个处理设置6个重复,其中3个重复用于测量土壤CO2排放,另外3个重复用于同步测量土壤含水量。对用于测量土壤CO2排放通量的PVC管,整个实验期间,只对其进行CO2监测,不对其进行破坏性采样。采用喷壶喷洒的方式模拟降水,向土壤表面均匀喷洒蒸馏水,喷水当天记作第1 天,第11 天、第21 天分别采用相同方法向土壤表面喷洒蒸馏水。第1天喷水后至第10天喷水前记作第1个周期,第11天加水后至第20天加水前记作第2个周期,第21天加水后至第30天记作第3个周期。洒水后第1天,在不同的时间(喷水后1、2、4、6、8、12、24 h)测定土壤呼吸速率,再在第4天、第7天和第10天各测定土壤呼吸速率1次。每次测定土壤呼吸速率时,用密封盖对PVC管进行密封,形成采样气室,每次监测持续时间为15 min,分别监测罩箱内0、5、10和15 min时的CO2浓度。在每次土壤呼吸速率监测结束后,打开密封盖,保持PVC管处于自然通风状态。土壤CO2使用CO2测定仪器-红外传感器(Vaisala GMP252)测定。土壤体积含水量(5 cm)用土壤温湿度速测仪(JL-19-2)测定。
CO2排放通量利用式(1)计算:
$$ F = \frac{M}{{{V_0}}} \times \frac{P}{{{P_0}}} \times \frac{{{T_0}}}{T} \times H \times \frac{{{\rm{d}}c}}{{{\rm{d}}t}} 。 $$ (1) 式(1)中:F为CO2排放通量(mg·m−2·h−1);M为标准状态下CO2的摩尔质量(44 g·mol−1);H为采样箱高度 (m);P为采样点大气压强 (kPa);P0和T0分别是标准状态下的大气压强和空气绝对温度(101.325 kPa和273.15 K);V0是标准状态下气体摩尔体积22.41 L·mol−1;T是采样时该点的温度 (K);dc/dt是CO2浓度随时间变化的速率。干湿交替处理CO2累计排放量计算公式为:
$$ E = \sum_{i=1}^n {\left(\frac{{{F_i} + {F_{i - 1}}}}{2}\right)} \times ({t_i} - {t_{i - 1}}) 。 $$ (2) 式(2)中:E为CO2累计排放量(mg·m−2);F为CO2排放通量(mg·m−2·h−1);i为采样次数(i=1,2$, \cdots ,n $);t为采样时间(h)。
-
数据前期处理、统计分析及绘图分别用Excel 2013、SPSS 18.0和Origin 9完成。采用单因素方差分析(one-way ANOVA) 分别对不同干湿交替强度下土壤呼吸速率与土壤累计CO2排放量的影响进行差异性检验,采用Pearson相关分析法分析土壤呼吸和土壤湿度的相关性。
-
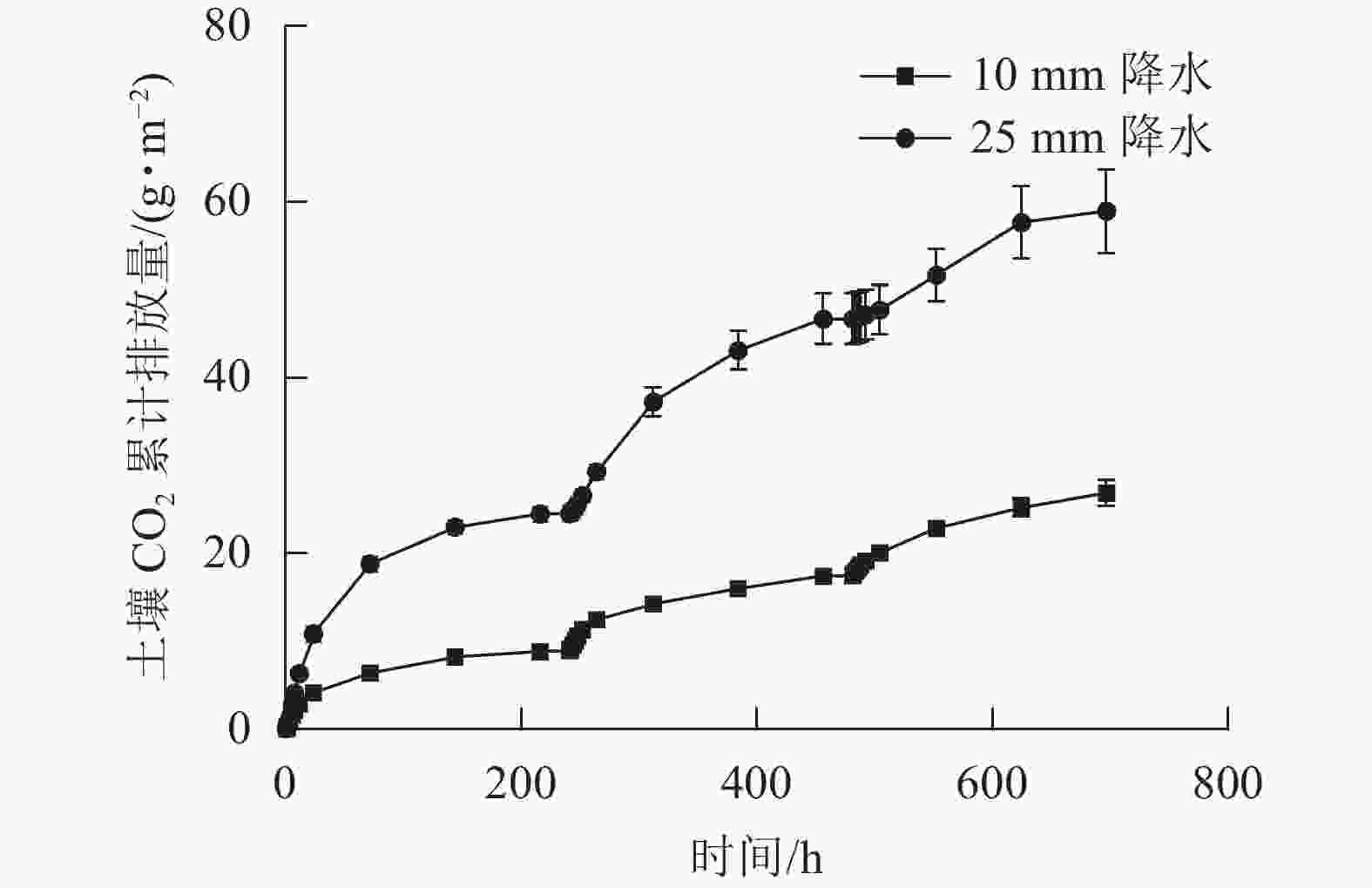
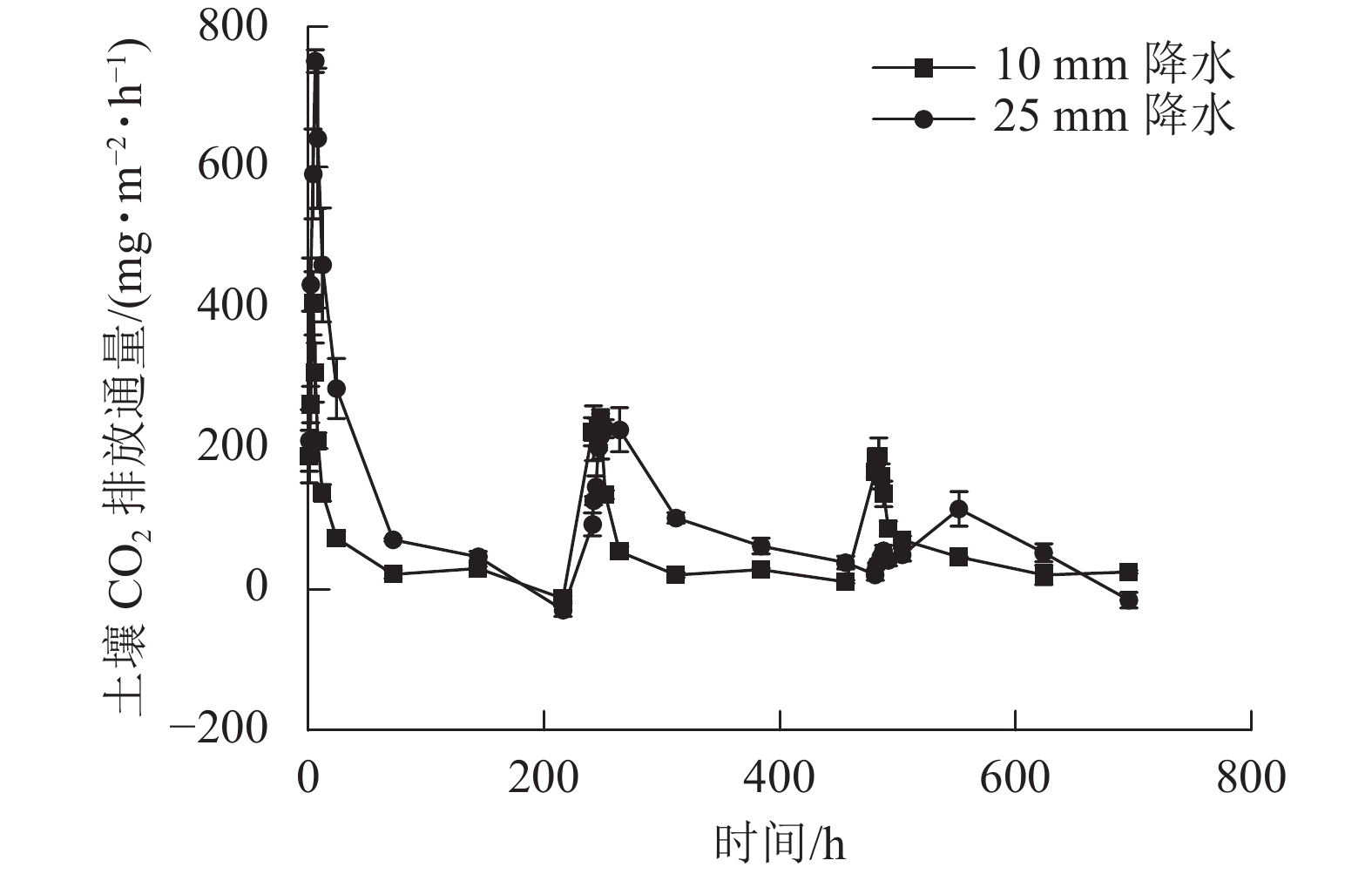
2种干湿交替强度下,随着水分的施加,土壤CO2排放通量短时间内达到最大值,随后逐渐下降(图1)。其中,25 mm降水干湿交替强度下,土壤CO2排放通量达到最大值的时间要明显晚于10 mm降水干湿交替强度。土壤含水量变化基本与水分的施加同步,随周期性的水分施加土壤湿度呈现从大到小的趋势(图2)。
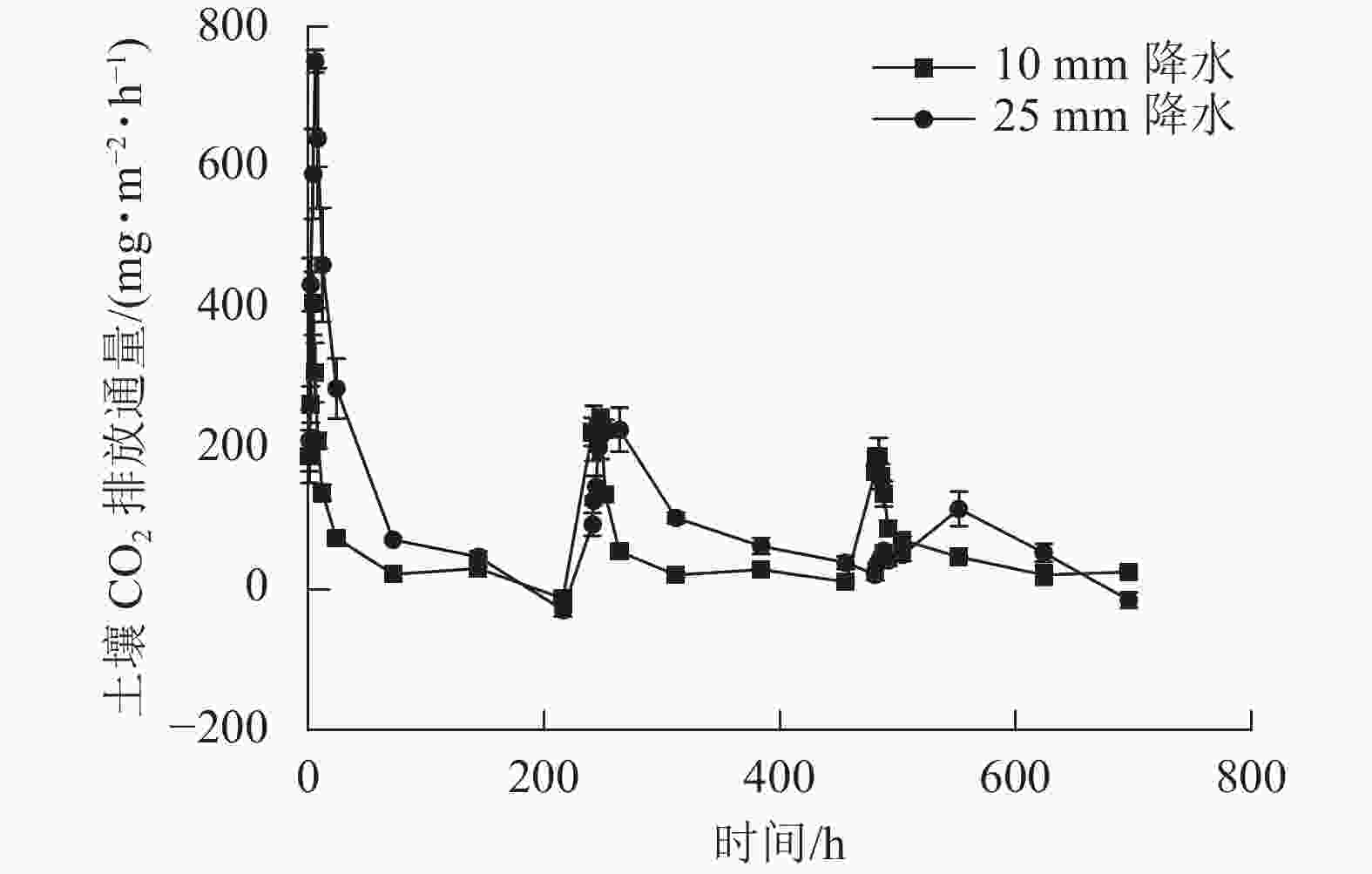
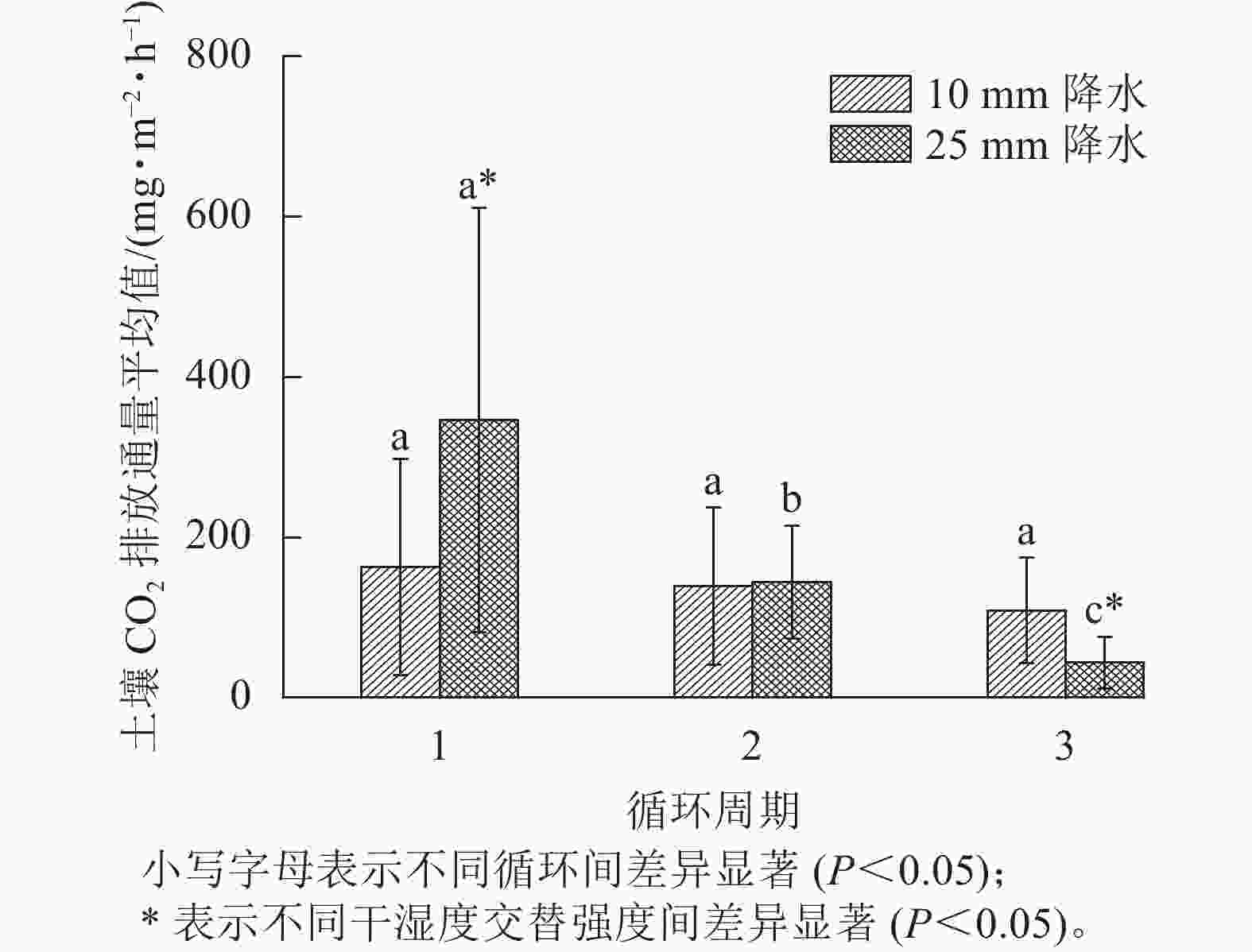
图 1 2 种干湿交替强度下土壤 CO2排放通量随时间的变化特征
Figure 1. Dynamics of soil CO2 emission flux under two different intensities of wet-dry alternation
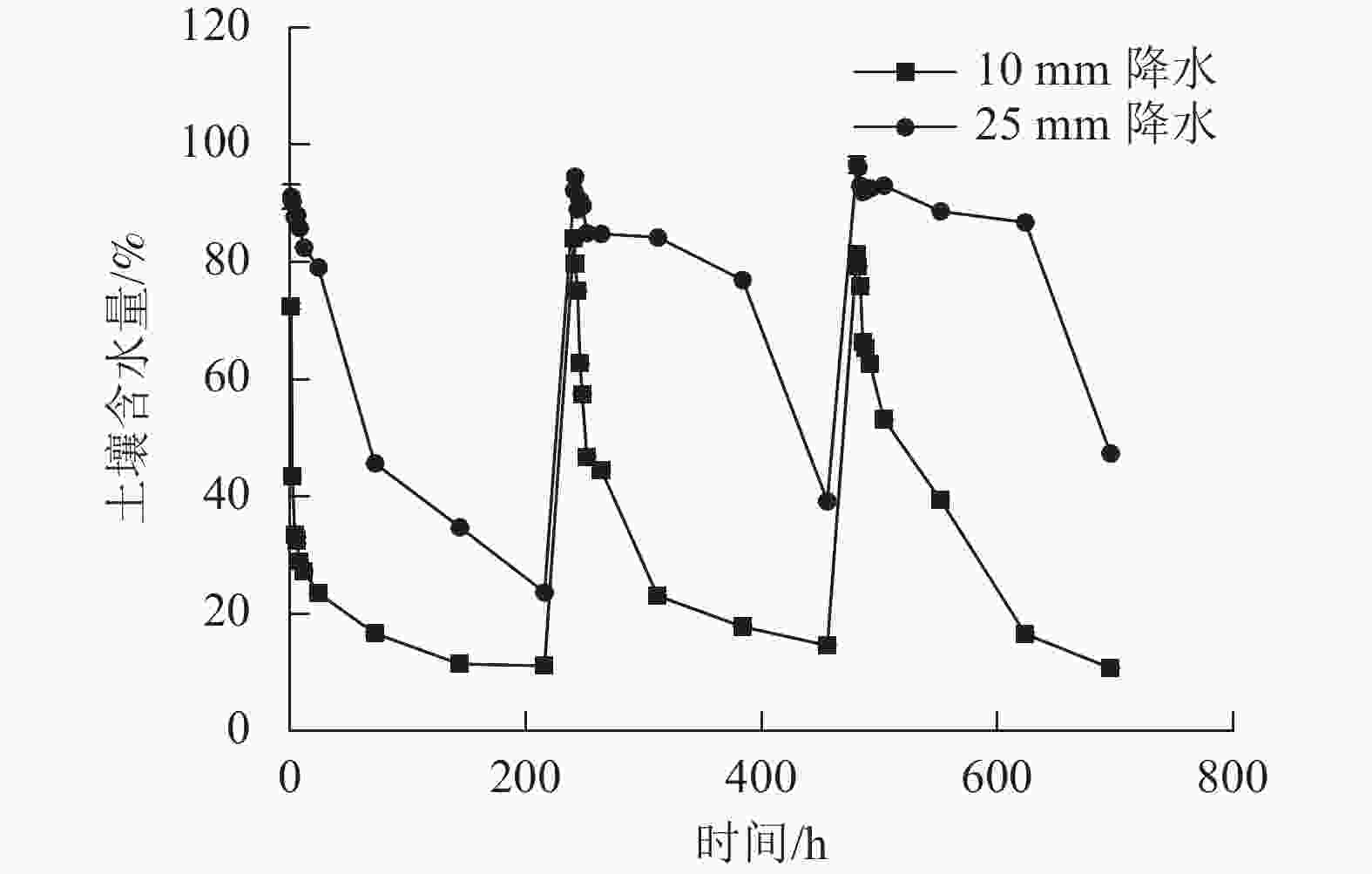
图 2 2 种干湿交替强度下土壤含水量随时间的变化特征
Figure 2. Dynamics of soil moisture under two different intensities of wet-dry alternation
如图3所示:在第1个周期中,10和25 mm降水干湿交替强度下,平均土壤CO2排放通量分别是162.62、346.28 mg·m−2·h−1;第2个周期中2种干湿交替强度下,平均土壤CO2排放通量分别是139.15、 144.00 mg·m−2·h−1,比第1个周期分别降低了14.17%、58.42%;第3个周期的2种干湿交替强度下,平均土壤CO2排放通量分别是108.85、43.54 mg·m−2·h−1,比第1个周期分别降低了32.86%、87.43%。方差分析结果显示:10 mm降水干湿交替强度下,不同周期土壤CO2排放通量之间差异不显著;25 mm降水干湿交替强度下,不同循环周期间土壤CO2排放通量差异显著(P<0.05);第1个和第3个周期土壤CO2排放通量在不同干湿交替强度下显著不同(P<0.05),而第2个周期干湿交替强度对土壤CO2排放通量影响不显著(P>0.05,图3)。
-
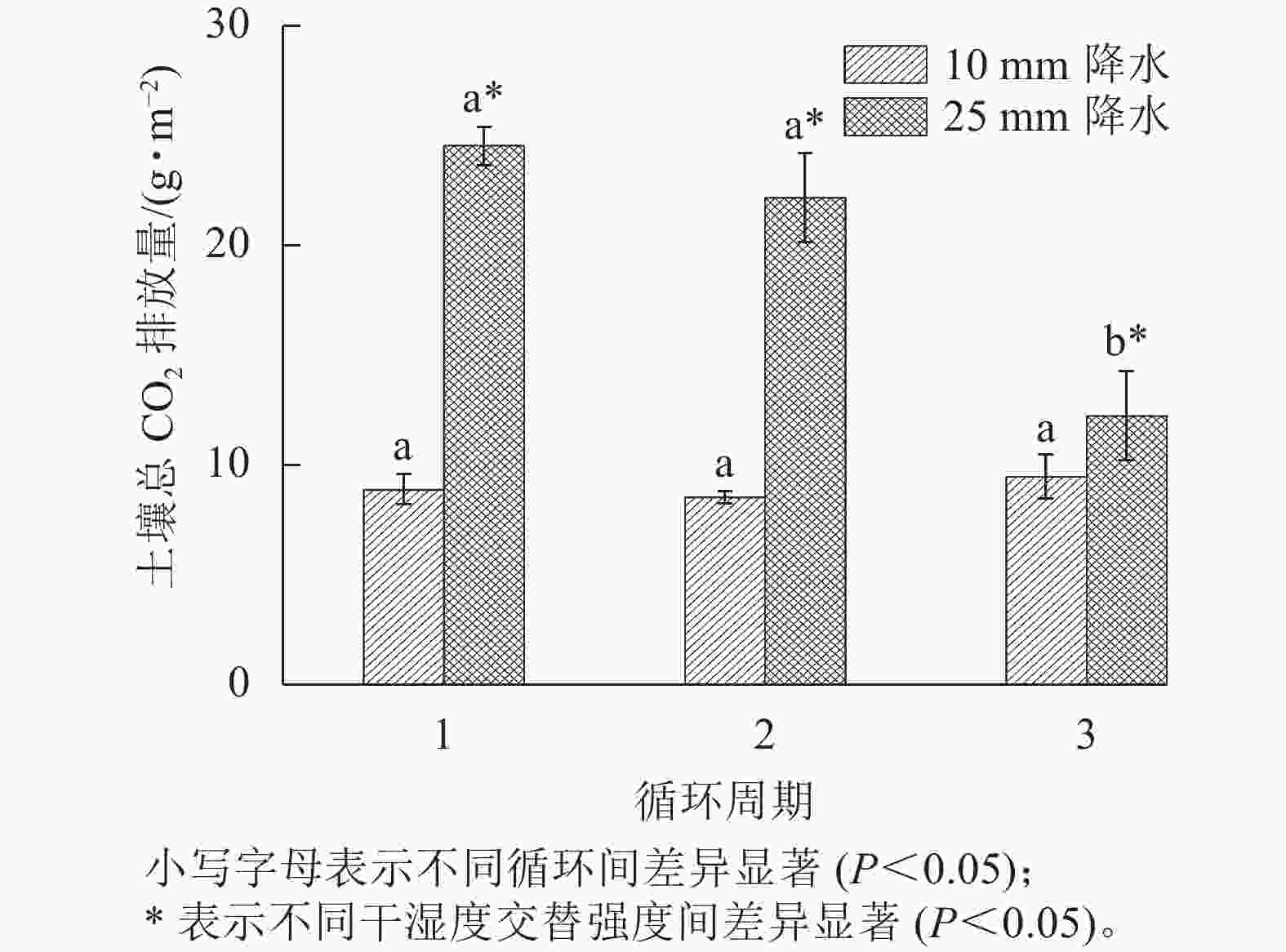
在整个干湿交替周期中,25 mm降水干湿交替强度的土壤CO2累计排放量比10 mm降水干湿交替强度更多。土壤CO2累计排放量在每个周期中都是在水分施加后先是快速增大,之后增大的趋势减缓(图4)。图5表明:在不同周期,25 mm降水干湿交替强度下,第1个周期土壤总CO2排放量和第2个循环周期差异不显著,第1个周期和第2个周期土壤总CO2排放量与第3个周期差异均显著(P<0.05)。10 mm降水干湿交替强度下,不同周期土壤总CO2排放量之间差异不显著;不同的干湿交替强度下,各周期之间土壤总CO2排放量差异显著(P<0.05)。
-
由表1可知:第1个和第2个干湿交替周期的土壤含水量和土壤CO2排放通量之间有极显著的相关关系(P<0.001),而第3个干湿交替周期土壤含水量和土壤CO2排放通量之间相关不显著。干湿交替多个周期作用下,土壤含水量和土壤CO2排放通量之间的相关程度不断降低。
表 1 土壤CO2排放通量与土壤湿度的相关关系
Table 1. Correlation between soil CO2 emission flux respiration and soil moisture
周期 样本数/个 拟合方程 相关系数 P 1 60 y =0.001 9x2+5.998 2x−41.743 0.75 0.000 2 60 y =−0.054 1x2+8.147 1x−124.87 0.64 0.000 3 60 y =−0.049 2x2+6.103 0x−76.911 0.18 0.170 说明:y为土壤CO2排放通量,x为土壤体积含水量。 -
1958年,BIRCH[34]最早观测到降水导致的土壤水分变化能够激发土壤呼吸,该现象被称为“Birch效应”。干旱土壤再湿润过程引起的CO2脉冲可持续20 d以上[35],且土壤呼吸速率可提高5倍以上(与恒湿土壤相比)[36],因此,干湿交替被认为是影响土壤呼吸的重要因素[37]。研究表明:受降水量、土壤初始含水量、降水格局、生态系统类型、干旱持续事件和干湿交替频率和强度的影响[19],土壤干湿交替引起的土壤碳排放可能呈现不同的变化规律。本研究结果表明:干湿交替强度显著影响土壤呼吸。2种干湿交替强度下,随着水分的施加,土壤CO2排放通量均从较低水平逐渐达到最大值,然后再逐渐降低。这是因为随着水分的施加,土壤水分达到饱和或者积水状态,较高的土壤水分使土壤透气性变差,微生物呼吸的氧气利用受到限制[38]。而后,随着时间的推移,土壤水分降低,土壤透气性得到改善,氧气的利用率提高,土壤CO2排放通量迅速提高[39]。其原因,一方面可能是干湿交替引起的空气压迫以及土壤的膨胀-收缩过程,导致土壤团聚体发生物理破坏并促使有机质暴露于微生物,最终通过加速微生物对有机质的分解而排放大量CO2[40−41]。另一方面在极端干旱环境下,微生物通过休眠或者细胞脱水等方式存活[42−43],当土壤水分增加时,微生物得到水分补给,其活性增强[44−45],且总量和丰度升高[46]。
此外,2种不同强度干湿交替下不同周期土壤CO2排放通量也具有一定的差异。在不同的周期内,25 mm降水干湿交替强度每个周期土壤CO2排放通量差异显著,而10 mm降水干湿交替强度下的不同周期土壤CO2排放通量差异不显著。有研究表明:土壤呼吸短时间内升高后逐渐下降的原因可能是由于经过多次的干湿交替过程中,土壤可利用有机质被消耗减少[47],从而影响了土壤的生物活性,使土壤呼吸下降。在没有外源有机碳输入的情况下,土壤经过反复的干湿交替后,土壤团聚体稳定性得到提高,释放有机质的能力减弱,土壤有机质释放量减少[48]。25 mm降水干湿交替强度下,第1个周期土壤可利用有机质得到充分释放利用,而在第2个和第3个周期这种可利用有机质被消耗后不断减少,因此,该干湿交替强度下,从第1个周期到第3个周期,土壤CO2排放通量下降趋势明显。10 mm降水干湿交替强度下,3个周期的土壤CO2排放通量差异不显著。这有2个原因:一方面,土壤可利用有机质可能并未得到充分释放,反复的干湿交替作用下,土壤仍能释放出可利用有机质被微生物利用;另一方面,本研究所涉及的土壤类型为喀斯特地区的石灰性土壤,在10 mm降水干湿交替强度下,土壤碳酸盐溶解/沉淀过程排放的土壤CO2占比可能较大,从而导致喀斯特地区石灰性土壤对干湿交替的响应与其他土壤类型存在一定差异,如赵蓉等[11]研究了固沙植被区土壤呼吸对反复干湿交替的响应,表明5、10和20 mm降水3个干湿交替强度下,不同循环周期土壤CO2排放通量均呈下降之势。
-
干湿交替强度显著影响土壤CO2累计排放量。25 mm降水干湿交替强度的土壤CO2累计排放量明显比10 mm降水干湿交替强度大。土壤从干旱状态到湿润后,土壤团聚体等结构被破坏,增加了土壤中有机质,土壤微生物消耗更多氧气,排放出更多的CO2[49]。这种增加的可利用有机质和干湿交替强度有关。在较强的干湿交替强度下,土壤释放的可利用有机质可能更多。同时,施加较少的水分时,不能使水分渗入到土壤内部,土壤水分很容易被蒸发,下层土壤并没有水分渗入,土壤环境变化较小,大部分土壤微生物依然处于休眠状态,使得土壤CO2累计排放量较小;水分施加量增大时,可以使下层土壤有更多的水分渗入,土壤环境发生较大变化,打破了土壤微生物的休眠状态,使得微生物更加活跃[50]。另外,本研究的土壤类型为喀斯特地区的石灰性土壤。近年的研究结果表明:土壤无机碳对土壤CO2排放具有一定的贡献[28−32],增加土壤湿度通常会导致碳酸盐排放的CO2增加[51−53]。这种现象可以通过2个主要途径解释:首先,增加土壤湿度会促进有机碳的矿化并减少CO2的扩散[54−55],从而导致土壤中CO2浓度的增加,可能进一步促使碳酸盐系统的溶解/沉淀过程发生[53, 56]。其次,土壤湿度本身会推动碳酸盐与CO2之间的平衡反应[52−53, 56]。
-
土壤含水量是影响土壤呼吸的另一个重要非生物因子,对土壤呼吸影响相当复杂。土壤含水量既可以直接影响根和微生物呼吸,也可以通过影响土壤物理特性等其他环境因子间接影响土壤呼吸速率。关于土壤呼吸和土壤湿度的关系,不同的研究者在自己特定的条件下得出完全不同的结论。有研究发现:土壤呼吸和土壤含水量有着显著的相关关系[57−59],但也有研究指出:土壤呼吸和土壤湿度相关关系不显著[60−62]。本研究中,第1个和第2个干湿交替周期的土壤含水量和土壤CO2排放通量的相关关系显著,第3个周期,土壤含水量和土壤呼吸之间的相关关系不显著,整体上表现出随干湿交替过程的发生,土壤含水量和土壤呼吸之间的相关关系减弱。原因可能是,第1个周期,土壤从最开始的干旱状态变湿润,短期之内土壤团聚体遭受破坏,土壤中与土壤水分条件密切相关的可利用有机质增加[40−41]。同时,水分条件也可以对微生物的代谢活动产生影响,如水分的变化迅速改变了微生物生长速率[63]。随着多次干湿交替的进行,土壤团聚体的稳定性不断增强,土壤微生物活性降低[64],从而减弱了土壤含水量变化对土壤呼吸的影响,致使土壤呼吸和土壤湿度的相关性不断变弱。
-
①干湿交替强度显著影响土壤呼吸。2种干湿交替强度下,随着水分的施加,土壤CO2排放通量较短时间内达到最大值,然后再逐渐降低。在不同周期内,10 mm降水干湿交替强度下,不同周期土壤CO2排放通量之间差异不显著;25 mm降水干湿交替强度下,不同周期土壤CO2排放通量之间差异显著。第1个和第3个周期土壤CO2排放通量在不同干湿交替强度下显著不同,而第2个周期表现出干湿交替强度对土壤CO2排放通量影响不显著。②2种干湿交替强度对土壤CO2累计排放量影响显著 。在整个干湿交替循环过程中,25 mm降水干湿交替强度的土壤CO2累计排放量比10 mm降水干湿交替强度多。在不同周期,25 mm降水干湿交替强度下,第1个周期土壤总CO2排放量和第2个周期差异不显著,与第3个周期土壤总CO2排放量差异显著,10 mm降水干湿交替强度下不同周期土壤总CO2排放量之间差异不显著。不同的干湿交替强度下,各周期之间土壤总CO2排放量差异显著。③干湿交替多个周期作用下,土壤含水量和土壤CO2排放通量之间的相关程度不断降低。
Response of soil respiration to dry-wet alternation in karst farmland
-
摘要:
目的 探究中国西南喀斯特地区农田石灰性土壤二氧化碳(CO2)排放通量对该区频繁发生的干湿交替的响应规律。 方法 以喀斯特农田石灰性土壤为研究对象,设计2种干湿交替强度(模拟降水量为10和25 mm),以干湿交替循环周期10 d为1个循环过程,研究喀斯特农田土壤呼吸对干湿交替的响应。 结果 干湿交替强度显著影响土壤呼吸速率和土壤总CO2排放量(P<0.05)。在2种干湿交替强度下,随着水分施加,土壤CO2排放通量会在短时间内达到最大值,然后逐渐下降。对于10 mm降水干湿交替强度,不同循环周期下的土壤CO2排放通量和土壤总CO2排放量之间的差异并不显著。然而,对于25 mm降水干湿交替强度,大多数循环周期下的土壤CO2排放通量和土壤总CO2排放量之间的差异显著(P<0.05)。相关分析表明:干湿交替多重周期作用下,土壤含水量和土壤CO2排放通量之间的相关关系不断降低。 结论 干湿交替强度和干湿交替过程是影响喀斯特农田土壤呼吸排放的重要因素。图5表1参64 Abstract:Objective The objective of this study is to explore the response of soil CO2 emission flux from calcareous soil to frequent dry-wet alternation in farmland of karst areas in southwest China. Method Taking calcareous soil in karst farmland as the research object, two dry-wet alternation intensities (simulated precipitation of 10 and 25 mm) were designed, with a dry-wet alternation cycle of 10 days as one cycle process, to investigate the response of soil respiration to dry-wet alternation in karst farmland. Result The intensity of dry-wet alternation significantly affected soil CO2 emission flux and total soil CO2 emissions (P<0.05). Under two different dry-wet alternation intensities, soil CO2 emission flux reached its maximum shortly after water was applied, and then gradually decreased. For the 10 mm dry-wet alternation intensity, there was no significant difference between soil CO2 emission flux and total soil CO2 emissions under different cycles. However, for the 25 mm dry-wet alternation intensity, the difference between soil CO2 emission flux and total soil CO2 emissions under most cycles was significant (P< 0.05). Correlation analysis revealed that the correlation between soil water content and soil CO2 emission flux decreased continuously under the multiple cycles of dry-wet alternation. Conclusion The intensity and process of dry-wet alternation are important factors affecting soil respiration release in karst farmland. [Ch, 5 fig. 1 tab. 64 ref.] -
Key words:
- karst farmland /
- soil respiration /
- dry-wet alternation /
- response
-
表 1 土壤CO2排放通量与土壤湿度的相关关系
Table 1. Correlation between soil CO2 emission flux respiration and soil moisture
周期 样本数/个 拟合方程 相关系数 P 1 60 y =0.001 9x2+5.998 2x−41.743 0.75 0.000 2 60 y =−0.054 1x2+8.147 1x−124.87 0.64 0.000 3 60 y =−0.049 2x2+6.103 0x−76.911 0.18 0.170 说明:y为土壤CO2排放通量,x为土壤体积含水量。 -
[1] AHIRWAL J, MAITI S K, SINGH A K, et al. Changes in ecosystem carbon pool and soil CO2 flux following post-mine reclamation in dry tropical environment, India [J]. Science of Total Environment, 2017, 583: 153 − 162. [2] DENG Lei, LIU Guobin, SHANGGUAN Zhouping. Land-use conversion and changing soil carbon stocks in China’s ‘Grain-for-Green’ Program: a synthesis [J]. Global Change Biology, 2014, 20(11): 3544 − 3556. [3] ZAMANIAN K, ZAREBANADKOUKI M, KUZYAKOVY Y. Nitrogen fertilization raises CO2 efflux from inorganic carbon: a global assessment [J]. Global Change Biology, 2018, 24(7): 2810 − 2817. [4] 田娜, 王义祥, 翁伯琦. 土壤碳储量估算研究进展[J]. 亚热带农业研究, 2010, 6(3): 193 − 198. TIAN Na, WANG Yixiang, WENG Boqi. Advances in estimating soil carbon storage [J]. Subtropical Agriculture Research, 2010, 6(3): 193 − 198. [5] 谢高地, 肖玉. 农田生态系统服务及其价值的研究进展[J]. 中国生态农业学报, 2013, 21(6): 645 − 651. XIE Gaodi, XIAO Yu. Review of agro-ecosystem services and their values [J]. Chinese Journal of Eco-Agriculture, 2013, 21(6): 645 − 651. [6] 林而达. 气候变化与农业可持续发展[M]. 北京: 北京出版社, 2001. LIN Erda. Climate Change and Agricultural Sustainable Development [M]. Beijing: Beijing Publishing House, 2001. [7] AUSTIN A T, YAHDJIAN L, STARK J M, et al. Water pulses and biogeochemical cycles in arid and semiarid ecosystems [J]. Oecologia, 2004, 141: 221 − 235. [8] 牛百成, 赵成义, 冯广龙, 等. 干湿交替对新疆绿洲农田土壤CO2排放的影响[J]. 水土保持通报, 2016, 36(3): 74 − 80. NIU Baicheng, ZHAO Chengyi, FENG Guanglong, et al. Effects of alternate drying and wetting on soil CO2 emissions in oasis farmland of Xinjiang region [J]. Bulletin of Soil and Water Conservation, 2016, 36(3): 74 − 80. [9] CHEN Ruirui, SENBAYRAM M, BLAGODATSKY S, et al. Soil C and N availability determine the priming effect: microbial N mining and stoichiometric decomposition theories [J]. Global Change Biology, 2014, 20(7): 2356 − 2367. [10] 赵蓉, 李小军, 赵洋, 等. 固沙植被区两类结皮斑块土壤呼吸对不同频率干湿交替的响应[J]. 生态学杂志, 2015, 34(1): 138 − 144. ZHAO Rong, LI Xiaojun, ZHAO Yang, et al. CO2 efflux from two biologically-crusted soils in response to drying-rewetting cycles with different frequencies in the Tengger Desert [J]. Chinese Journal of Ecology, 2015, 34(1): 138 − 144. [11] 赵蓉, 李小军, 赵洋, 等. 固沙植被区土壤呼吸对反复干湿交替的响应[J]. 生态学报, 2015, 35(20): 6720 − 6727. ZHAO Rong, LI Xiaojun, ZHAO Yang, et al. Response of soil respiration to repeated cycles of drying and rewetting in soils of the sand-fixed region of the Tengger Desert [J]. Acta Ecologica Sinica, 2015, 35(20): 6720 − 6727. [12] 张传更, 高阳, 王广帅, 等. 干湿交替和外源氮对农田土壤CO2和N2O释放的影响[J]. 农业环境科学学报, 2018, 37(9): 2079 − 2090. ZHANG Chuangeng, GAO Yang, WANG Guangshuai, et al. Effects of drying-wetting and additional nitrogen on CO2 and N2O emissions from farmland soils [J]. Journal of Agro-Environment Science, 2018, 37(9): 2079 − 2090. [13] 包振宗, 侯艳艳, 朱新萍, 等. 干湿交替和模拟氮沉降对巴音布鲁克高寒湿地土壤CO2排放的影响[J]. 农业环境科学学报, 2018, 37(3): 598 − 604. BAO Zhenzong, HOU Yanyan, ZHU Xinping, et al. Effect of alternating wetting and drying and simulated nitrogen deposition on soil CO2 emission in alpine wetlands of Bayinbulak [J]. Journal of Agro-Environment Science, 2018, 37(3): 598 − 604. [14] 乐艺, 张晓雅, 高俊琴, 等. 模拟干湿交替对若尔盖高寒湿地土壤呼吸及可溶解性碳氮稳定性的影响[J]. 水土保持研究, 2020, 27(1): 81 − 87. YUE Yi, ZHANG Xiaoya, GAO Junqin, et al. Effect of simulated drying-rewetting cycles on soil respiration and dissolved organic carbon and nitrogen stability in Zoige Alpine Wetlands [J]. Research of Soil and Water Conservation, 2020, 27(1): 81 − 87. [15] 高雅晓玲, 苗淑杰, 乔云发, 等. 干湿循环促进风沙土土壤有机碳矿化[J]. 干旱区资源与环境, 2020, 34(1): 140 − 147. GAO Yaxiaoling, MIAO Shujie, QIAO Yunfa, et al. Dry-wet cycles promote soil organic carbon mineralization in aeolian sandy soil [J]. Journal of Arid Land Resources and Environment, 2020, 34(1): 140 − 147. [16] 黄石德, 叶功富, 林捷, 等. 干湿交替对武夷山不同海拔土壤碳矿化的影响[J]. 生态学杂志, 2018, 37(2): 312 − 321. HUANG Shide, YE Gongfu, LIN Jie, et al. Effects of drying-wetting cycles on soil organic carbon mineralization along an elevation gradient in Wuyi Mountain [J]. Chinese Journal of Ecology, 2018, 37(2): 312 − 321. [17] GAO Junqin, FENG Jin, ZHANG Xuewen, et al. Drying-rewetting cycles alter carbon and nitrogen mineralization in litter-amended alpine wetland soil [J]. Catena, 2016, 145: 285 − 290. [18] 李勇. 喀斯特地区土壤呼吸对干湿交替的响应规律及其微生物学机制研究[D]. 北京: 中国科学院大学, 2019. LI Yong. Response of Soil Respiration to Drying and Rewetting Alternations and Microbiological Mechanism in Karst Area [D]. Beijing: University of Chinese Academy of Sciences, 2019. [19] 王融融, 余海龙, 李诗瑶, 等. 干湿交替对土壤呼吸和土壤有机碳矿化的影响述评[J]. 水土保持研究, 2022, 29(1): 78 − 85. WANG Rongrong, YU Hailong, LI Shiyao, et al. Review on the effects of soil alternate drying-rewetting cycle on soil respiration and soil organic carbon mineralization [J]. Research of Soil and Water Conservation, 2022, 29(1): 78 − 85. [20] 李峰平, 章光新, 董李勤. 气候变化对水循环与水资源的影响研究综述[J]. 地理科学, 2013, 33(4): 457 − 464. LI Fengping, ZHANG Guangxin, DONG Liqin. Studies for impact of climate change on hydrology and water resources [J]. Scientia Geographica Sinica, 2013, 33(4): 457 − 464. [21] 张雪雯, 莫熠, 张博雅, 等. 干湿交替及凋落物对若尔盖泥炭土可溶性有机碳的影响[J]. 湿地科学, 2014, 12(2): 134 − 140. ZHANG Xuewen, MO Yi, ZHANG Boya, et al. Effect of wetting-drying cycle and litter on dissolved organic carbon in peat soil in Zoigê Plateau [J]. Wetland Science, 2014, 12(2): 134 − 140. [22] ZEPPEL M J B, WILKS J V, LEWIS J D. Impacts of extreme precipitation and seasonal changes in precipitation on plants [J]. Biogeosciences, 2014, 11(11): 3083 − 3093. [23] SENEVIRATNE S I, LÜTHI D, LITSCHI M, et al. Land-atmosphere coupling and climate change in Europe [J]. Nature, 2006, 443(7108): 205 − 209. [24] WU Zhuoting, DIJKSTRA P, KOCH G W, et al. Responses of terrestrial ecosystems to temperature and precipitation change: a meta-analysis of experimental manipulation [J]. Global Change Biology, 2011, 17(2): 927 − 942. [25] BLOIS J L, ZARNETSKE P L, FITZPATRICK M C, et al. Climate change and the past, present, and future of biotic interactions [J]. Science, 2013, 341(6145): 499 − 504. [26] 袁道先. 岩溶石漠化问题的全球视野和我国的治理对策与经验[J]. 草业科学, 2008, 25(9): 19 − 25. YUAN Daoxian. Global view on karst rock desertification and integrating control measures and experiences of China [J]. Pratacultural Science, 2008, 25(9): 19 − 25. [27] 吕妍, 张黎, 闫慧敏, 等. 中国西南喀斯特地区植被变化时空特征及其成因[J]. 生态学报, 2018, 38(24): 1 − 13. LÜ Yan, ZHANG Li, YAN Huimin, et al. Spatial and temporal patterns of changing vegetation and the influence of environmental factors in the karst region of southwest China [J]. Acta Ecologica Sinica, 2018, 38(24): 1 − 13. [28] 李周, 高凯敏, 刘锦春, 等. 西南喀斯特地区2种草本对干湿交替和N添加的生长响应[J]. 生态学报, 2016, 36(11): 3372 − 3380. LI Zhou, GAO Kaimin, LIU Jinchun, et al. Growth response of two annual herb species to alternating drying-wetting and nitrogen addition in the karst area of southwest China [J]. Acta Ecologica Sinica, 2016, 36(11): 3372 − 3380. [29] AHMAD W, SINGH B, DIJKSTRA F A, et al. Temperature sensitivity and carbon release in an acidic soil amended with lime and mulch [J]. Geoderma, 2014, 214/215: 168 − 176. [30] BERTRAND I, DELFOSSE O, MARY B. Carbon and nitrogen mineralization in acidic, limed and calcareous agricultural soils: apparent and actual effects [J]. Soil Biology and Biochemistry, 2007, 39(1): 276 − 272. [31] KUNGIKRISHNAN A, THANGARAJAN R, BOLAN N S, et al. Functional relationships of soil acidification, liming, and greenhouse gas flux [J]. Advances in Agronomy, 2016, 139: 1 − 71. [32] CARDINAEL R, CHEVALLIER T, GUENET B, et al. Organic carbon decomposition rates with depth and contribution of inorganic carbon to CO2 emissions under a Mediterranean agroforestry system [J]. European Journal of Soil Science, 2020, 71(5): 909 − 923. [33] RAMNARINE R, WAGNER-RIDDLE C, DUNFIELD K E, et al. Contributions of carbonates to soil CO2 emissions [J]. Canadian Journal of Soil Science, 2012, 92(4): 599 − 607. [34] BIRCH H F. The effect of soil drying on humus decomposition and nitrogen availability [J]. Plant and Soil, 1958, 10: 9 − 31. [35] CANARINI A, KIAER L P, DIJKSTRA F A. Soil carbon loss regulated by drought intensity and available substrate: a meta-analysis [J]. Soil Biology and Biochemistry, 2017, 112: 90 − 99. [36] FIERER N, SCHIMEL J P. A proposed mechanism for the pulse in carbon dioxide production commonly observed following the rapid rewetting of a dry soil [J]. Soil Science Society of America Journal, 2003, 67(3): 798 − 805. [37] LUO Yiqi, ZHOU Xuhui. Soil Respiration and the Environment [D]. San Diego: Academic Press, 2006. [38] LIU Yanchun, LIU Shirong, WANG Jingxin, et al. Variation in soil respiration under the tree canopy in a temperate mixed forest, central China, under different soil water conditions [J]. Ecological Research, 2014, 29(2): 133 − 142. [39] ZHANG Xiang, ZHANG Yiping, SHA Liqing, et al. Effects of continuous drought stress on soil respiration in a tropical rainforest in southwest China [J]. Plant and Soil, 2015, 394: 343 − 353. [40] DENEF K, ZOTARELLI L, BODDEY R M, et al. Microaggregate-associated carbon as a diagnostic fraction for management-induced change in soil organic carbon in two Oxisols [J]. Soil Biology and Biochemistry, 2007, 39(5): 1165 − 1172. [41] GORDON H, HAYGARTH P M, BARDGETT R D, et al. Drying and rewetting effects on soil microbial community composition and nutrient leaching [J]. Soil Biology and Biochemistry, 2008, 40(2): 302 − 311. [42] SCHJØNNING P, THOMSEN I K, MOLDRUP P, et al. Linking soil microbial activity to water-and air-phase contents and diffusivities [J]. Soil Science Society of America Journal, 2003, 67(1): 156 − 165. [43] STARK J M, FIRESTONE M K. Mechanisms for soil moisture effects on activity of nitrifying bacteria [J]. Applied and Environmental Microbiology, 1995, 61(1): 218 − 221. [44] DOUGHTY C E, METCALFE D B, GIRARDIN C A J, et al. Drought impact on forest carbon dynamics and fluxes in Amazonia [J]. Nature, 2015, 519: 78 − 82. [45] HINKO-NAJERA N, FEST B, LIVESLEY S Y, et al. Reduced throughfall decreases autotrophic respiration, but not heterotrophic respiration in a dry temperate broadleaved evergreen forest [J]. Agricultural and Forest Meteorology, 2015, 200: 66 − 77. [46] SHI Andong, MARSCHNER P. Soil respiration and microbial biomass in multiple drying and rewetting cycles: effect of glucose addition [J]. Geofisica Internacional, 2017, 305: 219 − 227. [47] CHOW A T, TANJI K K, GAO Suduan, et al. Temperature, water content and wet-dry cycle effects on DOC production and carbon mineralization in agricultural peat soils [J]. Soil Biology and Biochemistry, 2006, 38(3): 477 − 488. [48] DENEF K, SIX J, BOSSUYT H, et al. Influence of dry-wet cycles on the interrelationship between aggre-gate, particulate organic matter, and microbial community dynamics [J]. Soil Biology and Biochemistry, 2001, 33(12/13): 1599 − 1611. [49] RUSER R, FLESSA H, RUSSOW R, et al. Emission of N2O, N2 and CO2 from soil fertilized with nitrate: effect of compaction, soil moisture and rewetting [J]. Soil Biology and Biochemistry, 2006, 38(2): 263 − 274. [50] 吴亚华, 郭丽, 陈敏, 等. 干湿交替对城市绿地土壤CO2排放的影响[J]. 广东化工, 2018, 45(10): 70 − 72. WU Yahua, GUO Li, CHEN Min, et al. Effect of alternating drying-wetting on CO2 emission of urban green space soil [J]. Guangdong Chemical Industry, 2018, 45(10): 70 − 72. [51] STEVENSON B A, VERBURG P S J. Effluxed CO2-13C from sterilized and unsterilized treatments of a calcareous soil [J]. Soil Biology and Biochemistry, 2006, 38(7): 1727 − 1733. [52] DONG Yanjie, CAI Miao, ZHOU Jianbin. Effects of moisture and carbonate additions on CO2 emission from calcareous soil during closed-jar incubation [J]. Journal of Arid Land, 2014, 6(1): 37 − 43. [53] LARDNER T, GEORGE S, TIBBETT M. Interacting controls on innate sources of CO2 efflux from a calcareous arid zone soil under experimental acidification and wetting [J]. Journal of Arid Environments, 2015, 122: 117 − 123. [54] NOBEL P S, PALTA J A. Soil O2 and CO2 effects on root respiration of cacti [J]. Plant and Soil, 1989, 120: 263 − 271. [55] SERRANO-ORTIZ P, ROLAND M, SANCHEZ-MORAL S, et al. Hidden, abiotic CO2 flows and gaseous reservoirs in the terrestrial carbon cycle: review and perspectives [J]. Agricultural and Forest Meteorology, 2010, 150(3): 321 − 329. [56] INGLIMA I, ALBERTI G, BERTOLINI T, et al. Precipitation pulses enhance respiration of Mediterranean ecosystems: the balance between organic and inorganic components of increased soil CO2 efflux [J]. Global Change Biology, 2009, 15(5): 1289 − 1301. [57] 富利, 张勇勇, 赵文智. 荒漠-绿洲区生长季不同土地覆被类型土壤呼吸对水热因子的响应[J]. 草业科学, 2019, 36(1): 37 − 46. FU Li, ZHANG Yongyong, ZHAO Wenzhi. Response of soil respiration to hydrothermal factors under different land cover types in a desert-oasis ecotone, northwest China [J]. Pratacultural Science, 2019, 36(1): 37 − 46. [58] YANG Xiaodong, ALI A, XU Yilu, et al. Soil moisture and salinity as main drivers of soil respiration across natural xeromorphic vegetation and agricultural lands in an arid desert region [J]. Catena, 2019, 177: 126 − 133. [59] 竹万宽, 许宇星, 王志超, 等. 尾巨桉人工林土壤呼吸对林下植被管理措施的响应[J]. 浙江农林大学学报, 2023, 40(1): 164 − 175. ZHU Wankuan, XU Yuxing, WANG Zhichao, et al. Response of soil respiration to understory vegetation management in Eucalyptus urophylla × E. grandis plantation [J]. Journal of Zhejiang A&F University, 2023, 40(1): 164 − 175. [60] 刘鹏, 贾昕, 杨强, 等. 毛乌素沙地油蒿灌丛生态系统的土壤呼吸特征[J]. 林业科学, 2018, 54(5): 10 − 17. LIU Peng, JIA Xin, YANG Qiang, et al. Characterization of soil respiration in a shrubland ecosystem of Artemisia ordosica in Mu Us Desert [J]. Scientia Silvae Sinicae, 2018, 54(5): 10 − 17. [61] 刘宝, 吴文峰, 何盛强, 等. 不同林龄闽楠林土壤呼吸与碳储量研究[J]. 森林与环境学报, 2018, 38(4): 431 − 438. LIU Bao, WU Wenfeng, HE Shengqiang, et al. Study on the soil respiration and carbon reserve in different age stands of Phoebe bournei [J]. Journal of Forest and Environment, 2018, 38(4): 431 − 438. [62] 陈炎根, 胡艳静, 黄莎, 等. 不同间伐强度对杉木人工林土壤呼吸速率的短期影响[J]. 浙江农林大学学报, 2023, 40(5): 1054 − 1062. CHEN Yangen, HU Yanjing, HUANG Sha, et al. Short-term effects of different thinning intensities on soil respiration rate in the Cunninghamia lanceolata plantation [J]. Journal of Zhejiang A&F University, 2023, 40(5): 1054 − 1062. [63] CRUZ-PAREDES C, TÁJMEL D, ROUSK J. Can moisture affect temperature dependences of microbial growth and respiration? [J/OL]. Soil Biology and Biochemistry, 2021, 156: 108223[2023-09-21]. doi: 10.1016/j.soilbio.2021.108223. [64] MIKHA M M, RICE C W, MILLIKEN G A. Carbon and nitrogen mineralization as affected by drying and wetting cycles [J]. Soil Biology and Biochemistry, 2005, 37(2): 23 − 95. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230522






 下载:
下载: