-
石蒜科Amaryllidaceae石蒜属Lycoris植物为多年生草本,鳞茎类球根花卉[1],全世界有20余种,主要分布在中国和日本,中国约有16种和1个变种[2],主要分布于长江以南,尤以温暖地区种类较多。石蒜属植物花型独特、花色丰富,自然野生状态易发生天然杂交,形成较多的变异类型和生态型,观赏价值极高,是园林中常用的林下花卉[3]。杂交育种是石蒜属植物重要的育种手段,在花期可观察到种间杂交种花色和花型多样,但因自然花期较短,种子播种至开花周期长,仅靠种球和叶片形态难以辨别,对石蒜属植物分类、种质快速鉴定和品种选育造成一定的困扰[2]。为更好地开展石蒜属植物优新品种的选育工作,有必要对石蒜属植物进行早期鉴定。
细胞遗传学是研究物种进化、植物分类和了解染色体大小、形态、核型和结构等关系的重要手段。染色体数目和形态是植物最稳定的细胞学特征之一[4],可利用染色体核型分析了解物种起源、系统进化、亲缘关系和杂交种的鉴定[5−7]。已有研究证实石蒜属植物中国石蒜 L. chinensis、安徽石蒜 L. anhuiensis、长筒石蒜 L. longituba、换锦花 L. sprengeri、石蒜 L. radiata 和矮小石蒜 L. radiata var. pumila等常见种的染色体形态[8−11],但大量天然和人工杂交种染色体的数目和核型复杂,未能得到有效鉴定,因此分析石蒜属植物天然和人工杂交种的染色体数目和核型,对了解石蒜属植物种间和种内杂交过程中亲本染色体分配具有重要意义。石蒜属植物染色体多数为A型染色体,尚无法通过核型公式判断杂交后代的染色体来源和易位情况。荧光原位杂交(FISH)技术作为植物分子生物学和细胞遗传学研究的重要技术,提供的多样化信息能够揭示染色体重排、基因组变化,已成为研究植物进化的重要工具,被广泛应用于染色体的物理定位和基因组研究[12−14]。
目前石蒜属植物细胞遗传学研究多集中在石蒜、忽地笑Lycoris aurea、换锦花和长筒石蒜等原生种,对杂交种的研究较少。通过常规染色体制片和荧光原位杂交技术深入研究石蒜属植物细胞遗传学,分析不同种间杂交种的染色体差异,进一步了解杂交过程中产生的遗传差异,对了解石蒜属植物物种演化和分化情况有重要的意义。为此,本研究通过对石蒜属植物种间杂交种的细胞遗传学分析,对杂交种进行鉴定并探究其亲缘关系,在细胞遗传学方面为石蒜属植物的种质资源鉴定、杂交育种亲本选择、新品种选育提供理论参考。
-
供试植物材料为石蒜、换锦花、长筒石蒜、石蒜和换锦花杂交种(008、014、030、034、048、067、094)、长筒石蒜和换锦花杂交种(015、019、020、097)以及石蒜和长筒石蒜杂交种(066、098),种植于浙江农林大学石蒜属种质资源苗圃基地,于2022年夏季开花期,根据开花先后对其编号并挖出鳞茎进行后续试验。探针小麦Triticum aestivum 45S rDNA由浙江农林大学徐川梅老师赠与。
-
将石蒜属植物鳞茎洗净后,去除外壳和根,置于培养皿中保持湿润生根,待根长至3~5 cm时,于7∶00—11∶00剪取新生嫩根,利用8-羟基喹啉(0.002 mol·L−1)或饱和对二氯苯溶液对根尖分别进行预处理(避光2.5或4.0 h)后,用卡诺氏固定液[V(甲醇)∶V(冰乙酸)=3∶1]固定后,转移至体积分数为75%的乙醇中,于4 ℃冰箱保存备用。
-
采用酸解和酶解2种方法解离根尖。(1)酸解:取根尖于1 mol·L−1 的盐酸(HCl)常温解离30 min,及时制片观察。(2)酶解:①前低渗,用蒸馏水浸泡根尖2次,每次10 min;② 酶解,吸干水分,用不同质量分数纤维素酶和离析酶混合液,于37 ℃水浴解离100 min;③后低渗:用蒸馏水后低渗30 min;④固定,用卡诺氏固定液固定1.0 h后,转移至体积分数为75%的乙醇中,于4 ℃冰箱保存备用。
-
将解离液于干净的载玻片制片,改良苯酚品红染色,于荧光显微镜(Leica DM4000)下镜检。荧光原位杂交制片用低渗火焰干燥法[15],在相差显微镜(SOPTOP EX21)下观察,记录较好分裂相和清晰染色体坐标并计数,至少5~10个,制备好的染色体制片冷藏备用。
-
为了减少杂信号的干扰,用于荧光原位杂交分析的染色体制片需经过预处理去除RNA和蛋白质干扰。染色体制片于37 ℃烘箱烘干后,用RNase A溶液(10 g·L−1) 37 ℃孵育1.0 h,加胃蛋白酶(5 mg·L−1)孵育15 min;质量分数为 4% 的多聚甲醛室温固定15 min,用体积分数为70%、90%和100%的乙醇进行梯度脱水,每级5 min,制片于常温干燥后备用。
采用缺口平移法标记45S rDNA探针,杂交液(20 μL:探针2 μL,鲑鱼精DNA 4 μL,20×SSC 2 μL,去离子甲酰胺10 μL,质量分数为50%硫酸葡聚糖2 μL)高温热变性处理后,染色体制片进行碱变性,37 ℃杂交避光过夜,2×SSC和1×PBS常温洗片,加抗体于37 ℃杂交1.5 h,1×PBS洗片,DAPI溶液(5 mg·L−1)复染,封片,于荧光显微镜下观察并拍照。
-
选取染色清晰、染色体聚缩适宜、分散良好的中期染色体进行观察并拍照,利用Leica图像捕获工作站处理图像,使用Adobe Photoshop 2020进行染色体排列,用Image J折线工具测量染色体臂长。染色体核型分析参照文献[16−17],核型类别参照STEBBINS等[18]的标准。
-
采用不同取样时间进行处理,确定最适宜的取材时间,由表1和图1可知:8:00—10:00为石蒜属植物根尖细胞分裂周期中最旺盛的时间,可获得较多处于有丝分裂的细胞,为有丝分裂高峰期,能观察到较多的中期染色体,8:00—9:00 染色体分散,而9:00—10:00染色体之间有黏连。7:00—8:00多处于染色体分裂前期,10:00—11:00多处于染色体分裂后期,细胞较多。因此,8:00—9:00为石蒜属植物染色体制片取材的最佳时期。
表 1 根尖的不同取样时间
Table 1. Different sampling times of root tips
取样时间 有丝分裂时期细胞数 分辨程度 7:00—8:00 前期较多,中期较少 清晰 8:00—9:00 中期多 清晰 9:00—10:00 中期较多 清晰 10:00—11:00 中期较少,后期较多 模糊 -
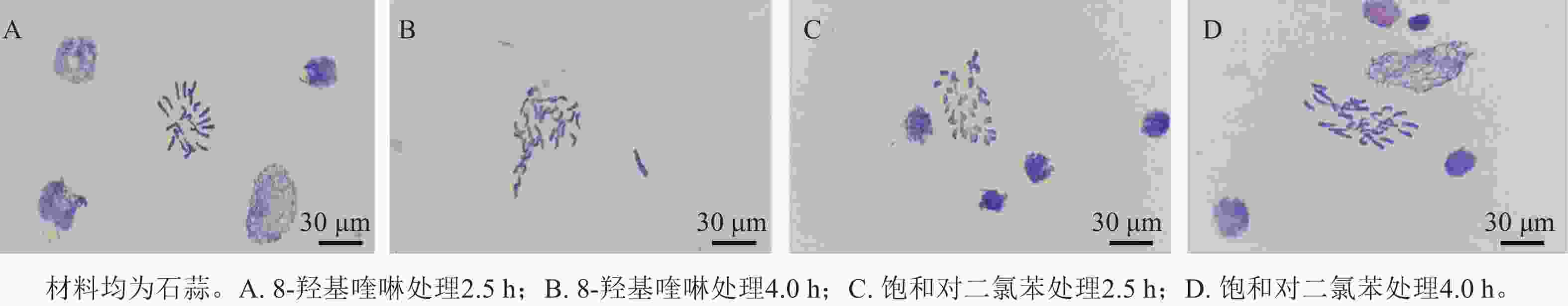
预处理试剂和处理时间对染色体中期分裂相状态有明显影响(表2),8-羟基喹啉和饱和对二氯苯预处理4.0 h 后均出现拖尾现象,其中饱和对二氯苯处理的染色体有黏连现象。8-羟基喹啉预处理2.5 h的染色体聚缩程度适中,清晰分散且无拖尾现象(图2A),为最佳预处理方案。
表 2 不同预处理试验结果
Table 2. Results of different pretreatment tests
预处理试剂 预处理时间/h 染色体聚缩程度 染色体拖尾情况 染色体清晰度 染色体分散度 8-羟基喹啉 2.5 适中 无 清晰 分散 4.0 适中 多数拖尾 清晰 较分散 饱和对二氯苯 2.5 皱缩 无 较清晰 分散 4.0 适中 多数拖尾 清晰 较分散 -
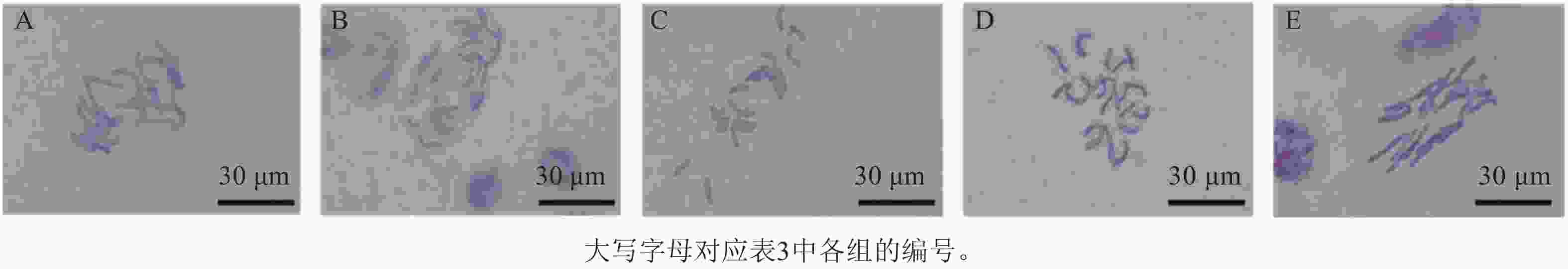
分别用1 mol·L−1 HCl、纤维素酶和离析酶混合液对石蒜属植物根尖进行解离,发现HCl解离后杂质较多,不易观察染色体形态。根据不同质量分数纤维素酶和离析酶配比对石蒜属植物根尖解离时间和温度进一步筛选(表3),结果发现:质量分数分别为5.0%的纤维素酶和0.3%的离析酶的混合酶液于37 ℃处理100 min,染色体更加清晰和分散,效果最佳(图3D),而于25 ℃ (常温)解离360 min,染色体形态清晰,但染色体间有黏连,分散较差(图3E)。因此,酶解能够有效去除细胞壁对植物染色体的束缚,使染色体更分散,有利于进行染色体荧光原位杂交试验。
表 3 不同比例混合酶液温度和时间试验结果
Table 3. Results of temperature and time tests for mixed enzyme solutions with different proportions
编号 解离试剂 解离温度/
℃解离时间/
min染色体清晰度/
分散度A 2.0%纤维素酶 37 100 较清晰/不分散 B 2.0%纤维素酶+
1.0%离析酶37 100 模糊/较分散 C 2.5%纤维素酶+
2.5%离析酶37 100 清晰/较分散 D 5.0%纤维素酶+
0.3%离析酶37 100 清晰/分散 E 5.0%纤维素酶+
0.3%离析酶25 360 清晰/不分散 说明:表中解离试剂前的数值代表其质量分数。 综上,本研究最佳染色体制片体系为:于8:00—9:00取石蒜属植物根尖,0.002 mol·L−1的8-羟基喹啉在常温下对根尖预处理2.5 h,卡诺氏固定液固定后于4 ℃冰箱保存;质量分数5.0%纤维素酶和0.3%离析酶混合酶液37 ℃ 酶解1.5 h,低渗20 min后,固定液固定1.0 h 后,用于染色体制片。
-
对石蒜属植物亲本石蒜、换锦花和长筒石蒜及8个杂交种染色体数目和形态进行分析。石蒜和换锦花核型染色体为2n=2x=22,长筒石蒜染色体核型为2n=2x=16 (图4和表4)。
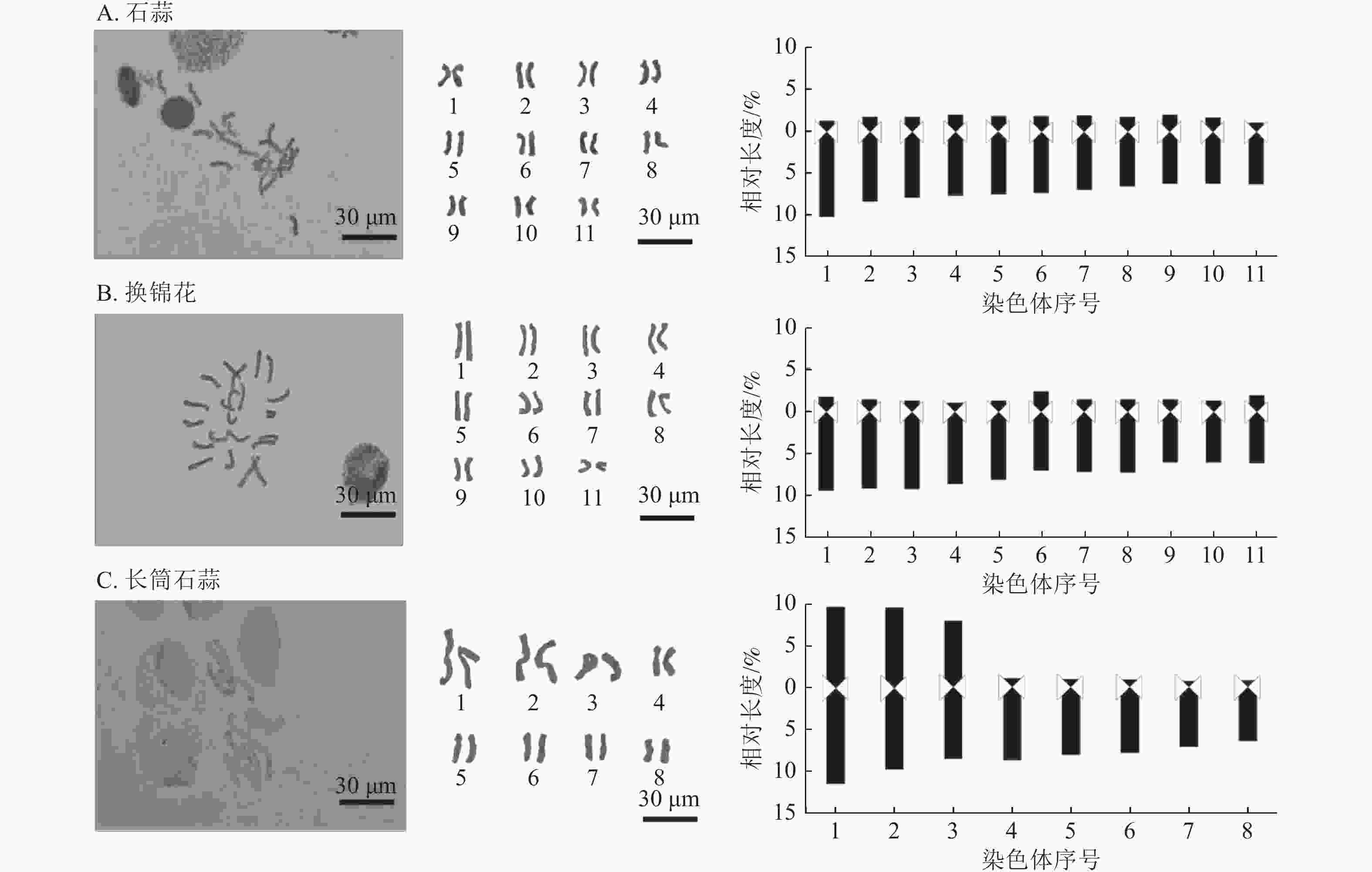
图 4 3种石蒜属植物染色体形态及核型模式
Figure 4. Chromosome morphology and karyotype pattern diagram of 3 Lycoris species
表 4 石蒜属8个种间杂交种核型特征
Table 4. Karyotype characteristics of 8 interspecific hybrids of Lycoris
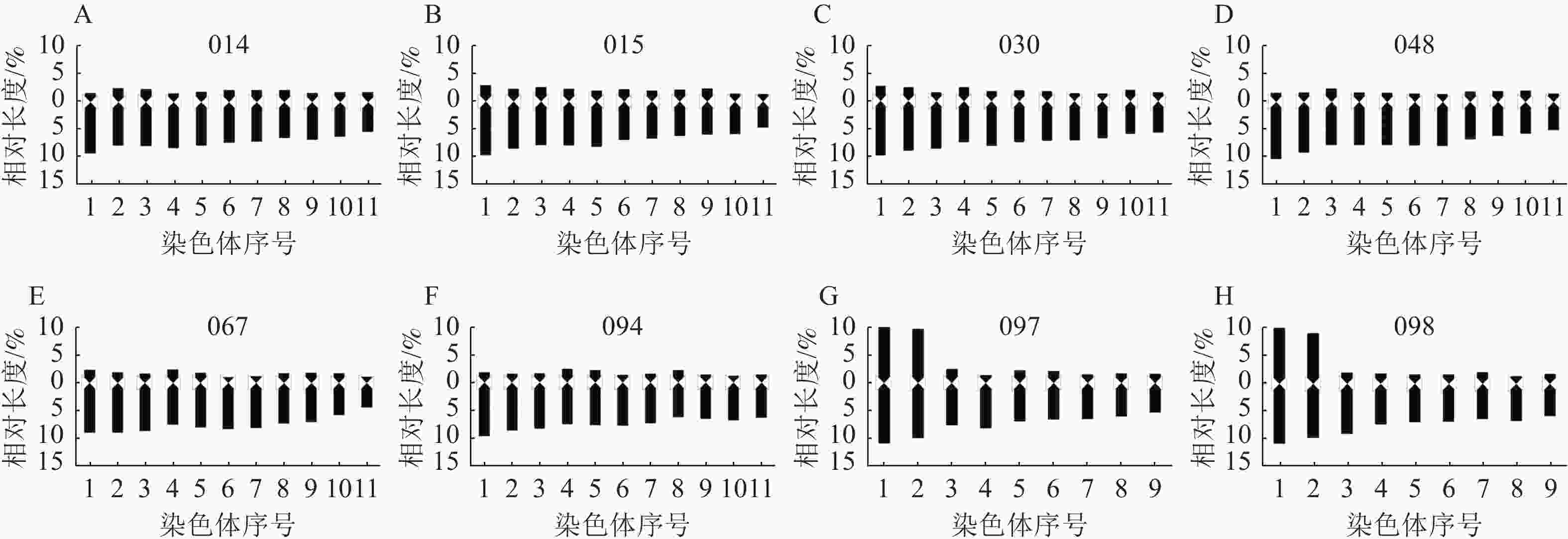
材料 平均臂比值 核型不对称系数/% 最长染色体/最短染色体 臂比大于2的染色体比例/% 核型类型 核型公式 石蒜 4.68 81.71 1.57 100 4A 2n=22=22A 换锦花 5.92 84.84 1.57 100 4A 2n=22=22A 长筒石蒜 5.28 47.62 2.92 62.50 3B 2n=16=6m+10A 014 4.53 81.42 1.54 100 4A 2n=22=22A 015 3.72 78.43 2.13 90.90 3B 2n=22=2sm+20A 030 4.34 80.66 1.75 100 4A 2n=22=22A 048 5.15 83.22 1.84 100 4A 2n=22=22A 067 4.95 82.33 2.06 100 4A 2n=22=22A 094 4.55 81.35 1.48 100 4A 2n=22=2sm+20A 097 3.19 67.11 3.11 77.77 3B 2n=18=4m+14A 098 3.78 70.21 2.78 77.77 3B 2n=18=4m+14A 由图5和图6可知:8个杂交种染色体数目主要为2n=22和2n=18,染色体基数为 x=11和9,为二倍体植物,多数为近端着丝粒染色体(st型)和端着丝粒染色体(t型),着丝粒靠近端部,臂比较大;杂交种097和098有中间着丝粒染色体(m型),且m型染色体较大较长,极易分辨。

图 5 石蒜属8个种间杂交种有丝分裂中期染色体
Figure 5. Metaphase chromosome diagram of 8 interspecific hybrids of Lycoris
8个杂交种的平均臂比、核型不对称系数、最长染色体/最短染色体、臂比大于2的染色体比例、核型类型、核型公式等指标均存在明显差异。由表4可知:石蒜和换锦花杂交种014、015、030、048、067、094染色体数目为22条,其中014、030、048、067染色体核型公式均2n=22=22A,核型类型为4A,核型不对称系数为80.66%~83.22%,介于石蒜和换锦花之间,但最长染色体/最短染色体相差较大,为1.54~2.06,说明杂交种染色体间存在较大差异,而染色体核型类型为st和t型,说明着丝粒均位于染色体末端。杂交种015染色体数目为2n=22,但核型为3B,杂交种015和094染色体核型公式为2n=22=2sm+20A,有1对同源染色体为近中着丝粒染色体。
长筒石蒜核型公式为2n=2x=16=6m+10A,亲本为长筒石蒜的杂交种097和098染色体数目为2n=18,包括4条m型染色体和14条A型染色体(包括st和t型),核型类型为3B,最长染色体/最短染色体分别为3.11和2.78,为8个杂交种中比值最大的种。
杂交种染色体核型以4A和3B为主,杂交种097的最长染色体/最短染色体最大(3.11),杂交种094比值最小(1.48)。杂交种048的核型不对称系数最大(83.22%),杂交种097最小(67.11%)。杂交种014、030、048、067、094染色体臂比均全部大于2,杂交种015和094各有1对sm型染色体。
-
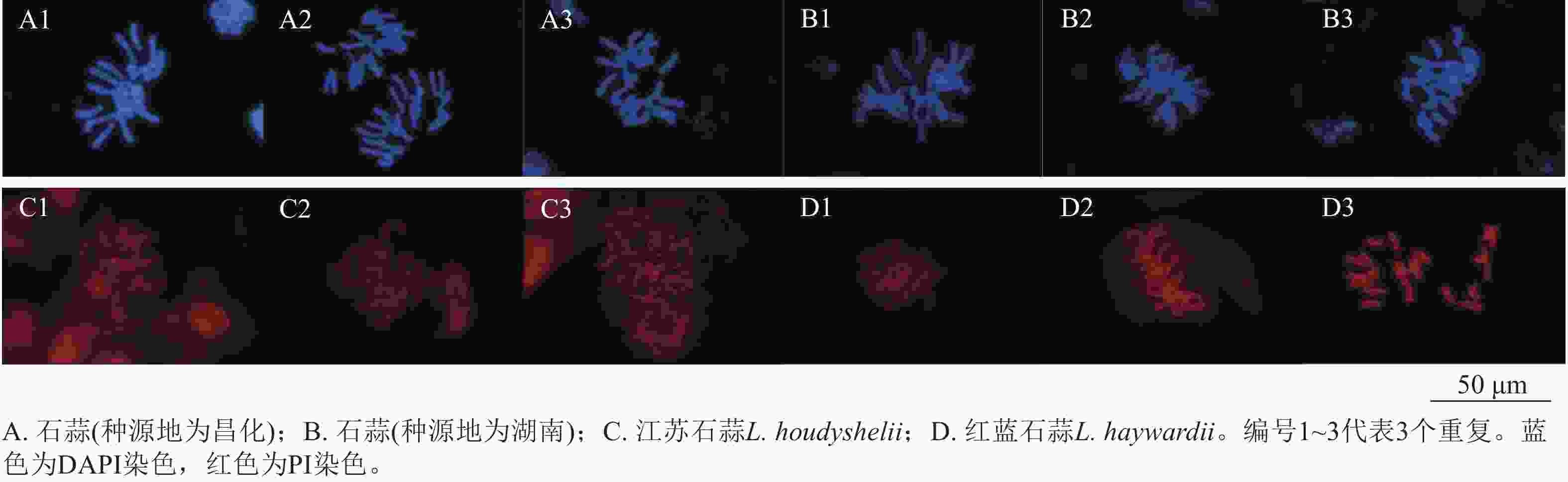
采用荧光复染剂DAPI (4,6-二脒基-2-苯基吲哚)和PI (碘化丙啶)对石蒜属植物染色体进行染色,与PI染色相比,经DAPI染色的染色体形态更加清晰,背景干净(图7);由于PI发出红色荧光,与地高辛标记的探针荧光相同,不便于双色荧光原位杂交信号的观察,而DAPI复染后能同时观察到生物素和地高辛标记的荧光信号,因此DAPI更适合作为荧光原位杂交的复染剂。
-
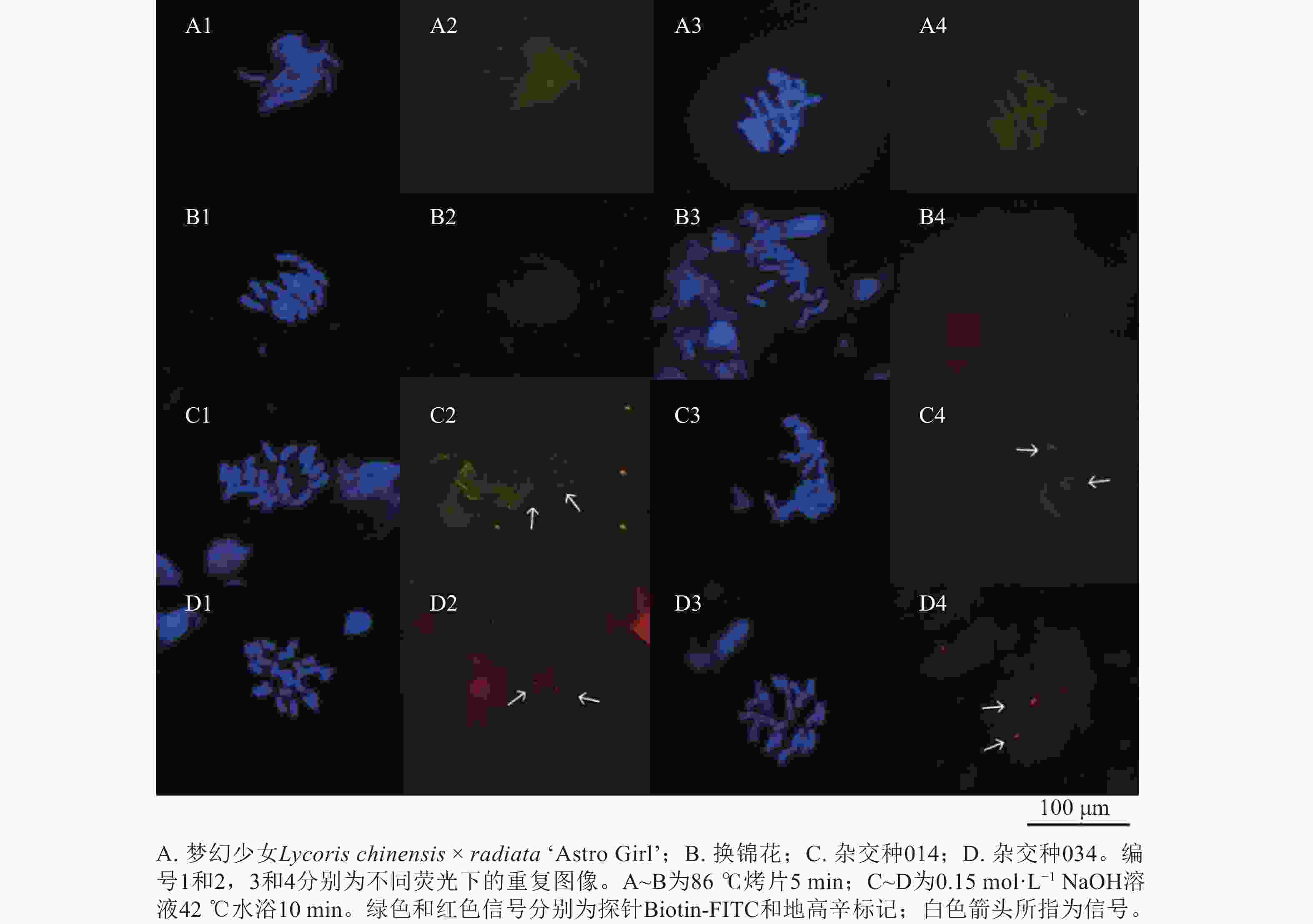
染色体变性是影响荧光原位杂交的关键,一般用高温变性和碱变性进行染色体变性。为更好地观察到荧光原位杂交信号,对高温变性(即86 ℃烤片5 min)和碱变性(0.15 mol·L−1 NaOH溶液42 ℃水浴10 min)下的45S rDNA探针信号进行比较,高温变性的染色体荧光原位杂交观察到的信号不稳定,未观察到探针信号(图8A4和8B2),说明探针并未与染色体成功杂交;而图8A2和8B4的45S rDNA探针信号较弱。碱变性10 min,能观察到清晰明亮的45S rDNA探针信号,说明碱变性使探针与染色体更好的杂交,更加稳定。
-
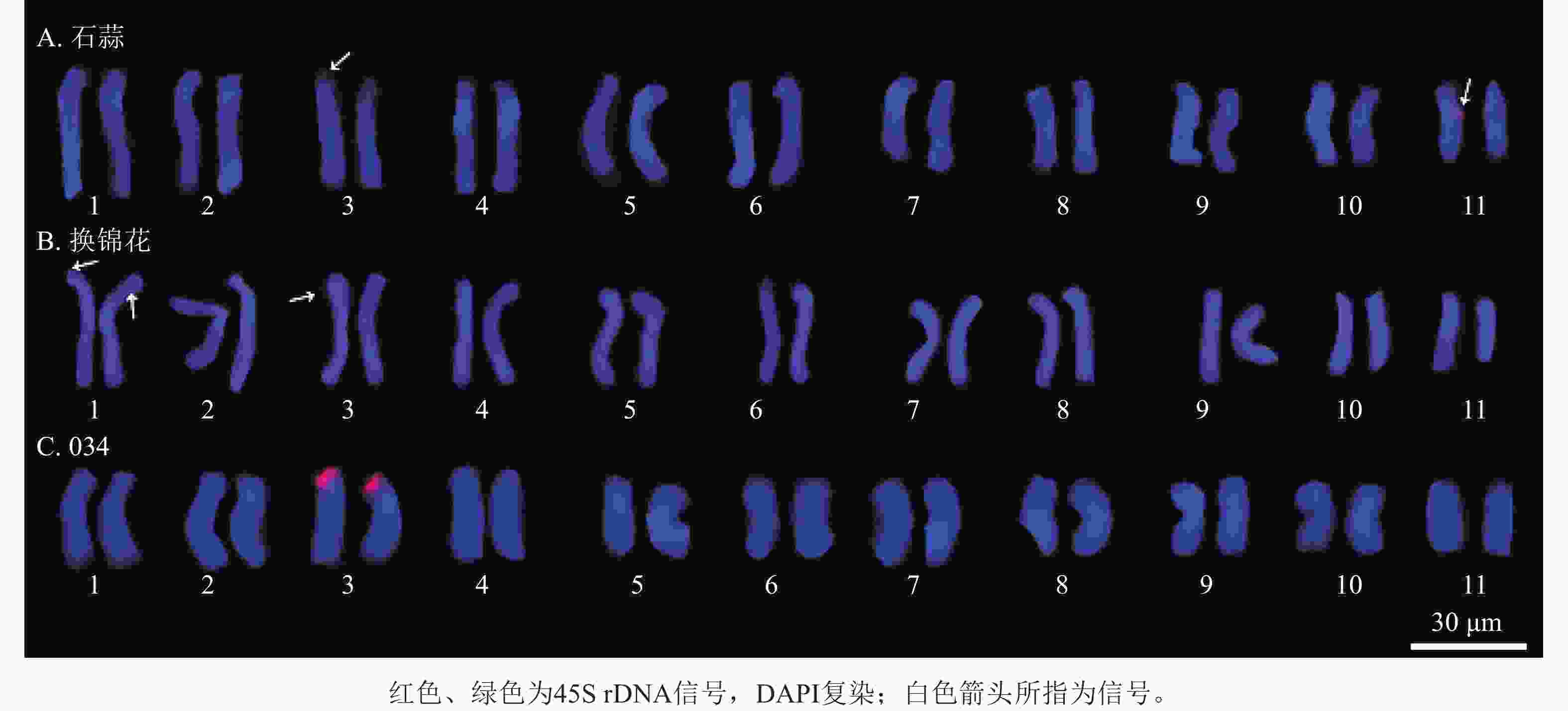
以地高辛标记的45S rDNA为探针,对石蒜和换锦花染色体进行荧光原位杂交,结果发现石蒜染色体上有2个45S rDNA信号(图9A),分别位于染色体长臂和端着丝粒处。换锦花染色体上有3个45S rDNA杂交信号,分别位于染色体短臂末端和靠近着丝粒区域(图9B)。
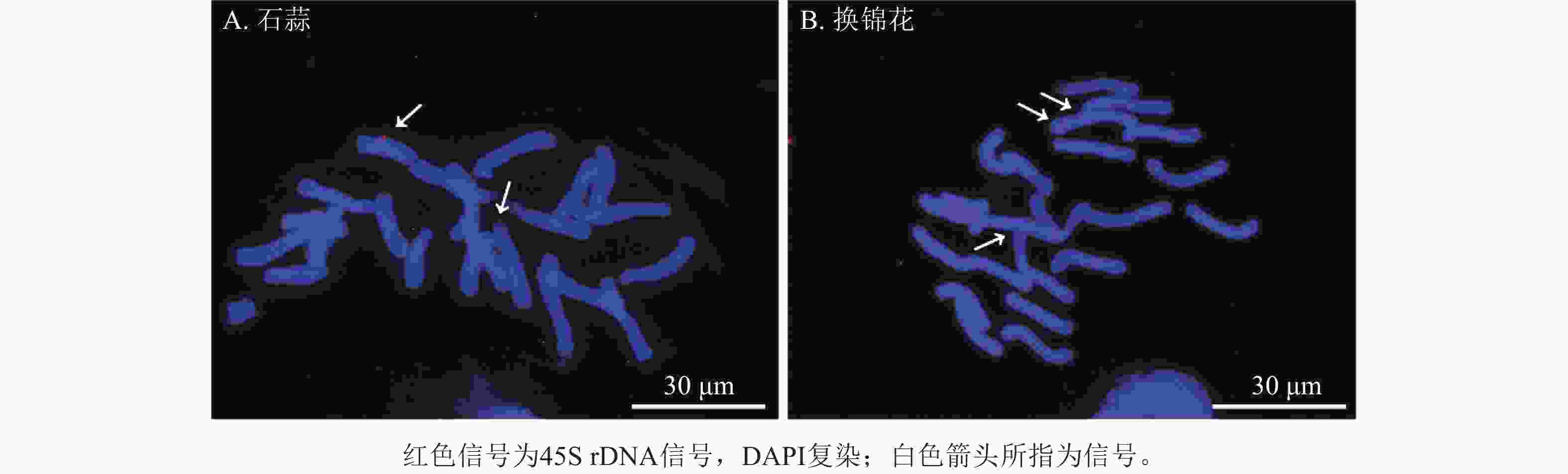
图 9 45S rDNA探针标记的石蒜和换锦花染色体
Figure 9. Chromosome diagrames of L. radiata and L. sprengeri labeled by 45S rDNA probe
利用45S rDNA探针对石蒜属种间杂交种染色体进行荧光原位杂交分析,发现45S rDNA位点数差异较大,杂交种(008、014、019、020、034、066和067)染色体上有2~8个信号(图10),008染色体有2个杂交信号,其中一个信号位于端着丝粒呈单个点状分布,另一个呈点状分布在染色体长臂上(图10A);014染色体有2个杂交信号(图10B);杂交种019和020染色体的端着丝粒处分别有8个清晰的45S rDNA信号(图10C和10D);杂交种034染色体端着丝粒处有2个杂交信号(图10E);杂交种066的4条染色体上有5个杂交信号,均位于端着丝粒处(图10F);杂交种067染色体的3个杂交信号位于3条染色体端着丝粒处(图10G)。
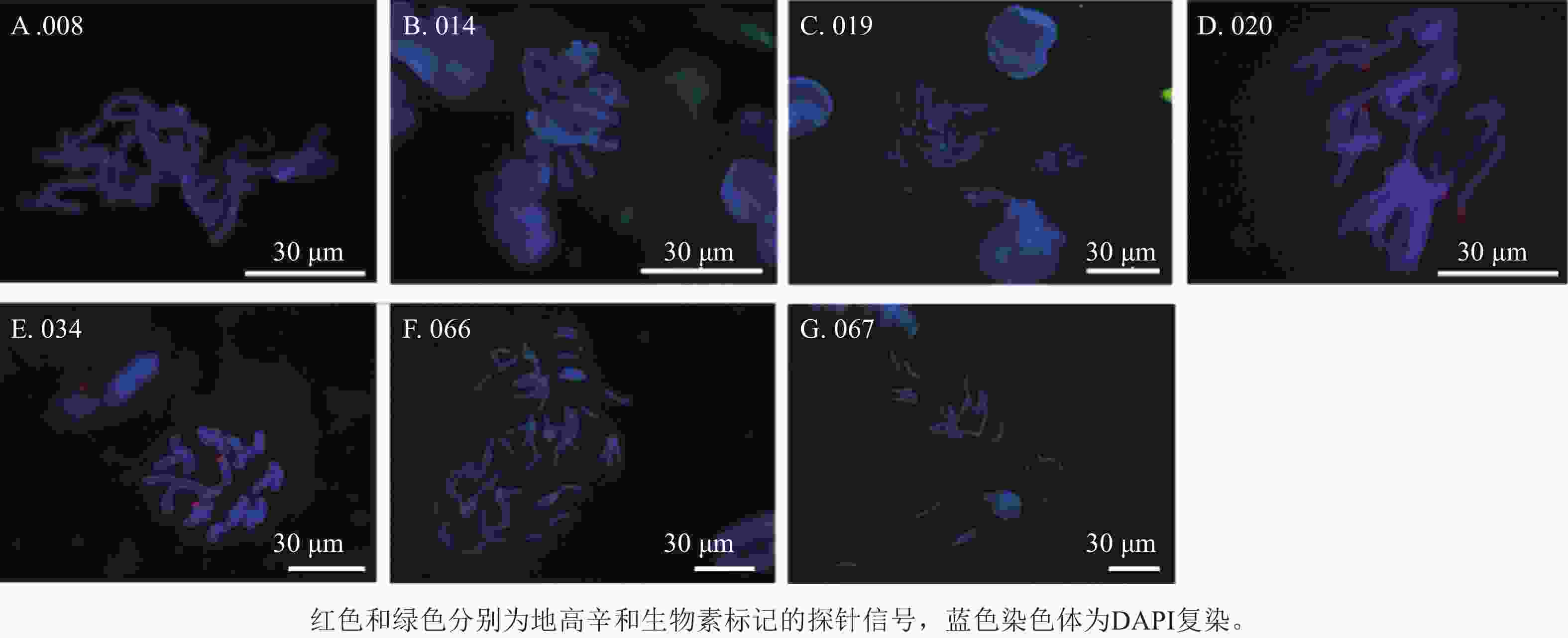
图 10 部分石蒜属种间杂交种的45S rDNA信号
Figure 10. 45S rDNA signal diagram of partial interspecific hybrids of Lycoris
石蒜的1条3号同源染色体短臂末端和1条11号同源染色体长臂上观察到45S rDNA信号(图11A);在换锦花1号和3号染色体上分别有1个杂交信号,但信号较弱(图11B)。杂交种034的1对3号同源染色体上均观察到清晰的45S rDNA杂交信号,因此推测杂交种034的杂交信号分别来自石蒜和换锦花的3号染色体(图11C)。
-
染色体融合和裂变易位被认为是石蒜属植物核型多样性变化的原因,A型染色体中出现罗伯逊融合现象,其中m型染色体可能是罗伯逊变化形成的[19]。石蒜属植物染色数目和核型之间差异较大,有整倍体和非整倍体,二倍体、三倍体和多倍体,染色体基数为6~11[11, 19]。石蒜和换锦花染色体核型公式为2n=22=22A[11],长筒石蒜和中国石蒜染色体核型公式为2n=2x=16=6m+10T[8],而张悦等[10]发现中国石蒜的染色体核型公式为2n=24=4M+10T。本研究中石蒜和换锦花及部分杂交种染色体核型为2n=22=22A,而杂交种015和094的染色体核型公式为2n=22=2sm+20A,长筒石蒜和换锦花杂交种核型公式为2n=18=4m+14A,说明石蒜和换锦花在杂交过程中sm染色体可能由A型染色体的罗伯逊变化产生[11, 19]。此外,研究还表明石蒜属植物存在较多异常核型,如ZHOU等[20]发现石蒜核型公式为2n=21=1m+ 20st和2n=25=1m+20st+2t+2T;LIU等[19]研究发现114个石蒜种群98.6%的核型为A型,其余少量为由A型染色体衍生的m、m’和B型异常染色体。尽管石蒜在种群内和种群间出现了一定程度的变异现象,但仍被认为具有相对稳定的核型。长筒石蒜和换锦花杂交种染色体核型公式为2n=18=4m+14A,m型染色体可能来自长筒石蒜。染色体核型在一定程度上能够反映物种间的遗传差异和亲缘关系,因此,亲本为石蒜和换锦花的杂交种亲缘关系较近,而长筒石蒜和换锦花为亲本的杂交种亲缘关系更近,花色和花型更相似。
染色体核型不对称系数能够反映植物的进化程度,染色体进化的整体趋势表现为不对称程度和倍性的提高,越古老和原始的植物核型越对称,繁衍或者进化程度越高的物种,核型越不对称[21],因此根据核型不对称系数可判断物种的进化。本研究中长筒石蒜和换锦花的杂交种097和098不对称系数最小,可认为长筒石蒜比石蒜和换锦花更原始,进一步说明石蒜和换锦花的进化程度更高,可能与长期自然选择和人工杂交选择的进程有关。在分析和利用种质资源中,形态学会受气候和人为因素的影响,而细胞学遗传分析更可靠稳定。石蒜属植物种间杂交种的核型分析结果,丰富了石蒜属植物的核型信息,可以进一步了解石蒜属植物在杂交时亲本染色体分配情况。
荧光原位杂交实验会受到染色体制备、变性、探针杂交及荧光染料复染等因素的影响,因此筛选适合石蒜属植物的荧光原位杂交体系十分重要。本研究筛选的优化体系为使用前低渗火焰干燥法制片,0.15 mol·L−1的NaOH 42 ℃使染色体变性,DAPI作为复染剂。探针是荧光原位杂交的基础性元件,探针信号对研究植物进化起源及染色体融合和易位现象具有极其重要的作用。目前除了以45S rDNA、5S rDNA保守序列作为探针外,还有端粒、着丝粒、重复串联序列和oligo探针,其中,端粒探针 (AG3T3)3和(TTG)6等已在油橄榄科Oleaceae植物中作为染色体计数和染色体变异的重要依据[22];在石蒜和忽地笑及其杂交种中检测到着丝粒CENH3探针信号,并揭示了1个M型染色体的易位融合现象[23]。本研究在石蒜、换锦花和杂交种034染色体上45S rDNA杂交信号稳定,可初步判断杂交种034信号分别来自石蒜和换锦花,其余杂交种的45S rDNA位点数量和位置也有差异。玫瑰Rosa rugosa及其种间杂交种的45S rDNA杂交信号不同[24],与本研究结果相似,这可能是由于45S rDNA位点在不同种间的差异造成的。
-
本研究优化了石蒜属植物种间杂交种染色体制片技术体系:0.002 mol·L−1 8-羟基喹啉于8:00—9:00预处理石蒜属植物根尖2.5 h,卡诺氏固定液固定,37 ℃酶解1.5 h,火焰干燥法制片。石蒜属种间杂交种染色体核型多样,染色体数目为2n=18和22,染色体核型为4A和3B。石蒜和换锦花3号染色体分别有2和3个45S rDNA杂交信号。杂交种45S rDNA杂交信号大多位于染色体端着丝粒处,不同杂交种信号数不同,说明杂交过程中染色体分配不均等,导致杂交种性状各异。因此,染色体核型分析和荧光原位杂交技术能够有效鉴定石蒜属种间杂交种及亲本染色体的分配,可为石蒜属新品种选育提供理论依据。
Chromosome preparation system optimization and cytogenetic analysis of interspecific hybrids of Lycoris
-
摘要:
目的 从细胞遗传学角度分析石蒜属Lycoris种间杂交种的染色体核型特征,探究杂交种亲本染色体分配,进一步创建和选育石蒜属优新品种。 方法 利用常规染色体制片和荧光原位杂交技术,对石蒜属种间杂交种和亲本染色体数目、核型公式及核型类型等进行分析。 结果 ①最佳染色体制片体系:8:00—9:00取石蒜属植物根尖,0.002 mol·L−1的8-羟基喹啉预处理2.5 h,卡诺氏固定液固定,质量分数为5.0%的纤维素酶和0.3%的离析酶混合酶液于37 ℃酶解1.5 h,采用火焰干燥法制备染色体制片。②石蒜L. radiata和换锦花L. sprengeri杂交种染色体核型公式为2n=22=22A和2n=22=2sm+20A,以长筒石蒜L. Longituba为亲本的杂交种染色体核型公式为2n=2x=18=4m+14A,杂交种染色体核型以4A和3B为主,介于亲本石蒜、换锦花和长筒石蒜之间。③荧光原位杂交发现:石蒜和换锦花染色体上分别有2和3个45S rDNA杂交信号,其中3号染色体上均能发现45S rDNA杂交信号,供试杂交种45S rDNA信号数目各不相同,信号多位于染色体末端。 结论 本研究优化了石蒜属植物染色体制片和荧光原位杂交体系,并应用于石蒜属杂交种的鉴定和亲本染色体的分配,可为石蒜属植物新种质创制和新品种选育提供理论依据。图11表4参24 Abstract:Objective The chromosomal karyotype characteristics of interspecific hybrids and chromosomal allocation of their parents in genus Lycoris are analyzed, which will further provide a basis for hybrid breeding in Lycoris. Method Conventional chromosome preparation and fluorescence in situ hybridization were used to analyze chromosome numbers and karyotypes of interspecific hybrids and parents in the genus Lycoris. Result (1) The optimum chromosome section system: from 8:00 to 9:00 AM, the root tips of Lycoris plants were pretreated with 0.002 mol·L−1 8-hydroxyquinoline for 2.5 h, fixed with Carnoy’s fixative, and then digested with a mixture of 5.0% cellulase and 0.3% pectinase at 37 ℃ for 1.5 h. The chromosome slides were prepared using the flame-drying method. (2) Chromosome karyotype analysis revealed 2 types of karyotype formulas for the hybrids between L. radiata and L. sprengeri, which were 2n=22=22A and 2n=22=2sm+20A. The karyotype formula for the hybrids with L. longituba as the parent was 2n=2x=18=4m+14A. The chromosome karyotype was primarily composed of 4A and 3B, which was intermediate between the parent species L. radiata, L. sprengeri, and L. longituba. (3) Fluorescence in situ hybridization revealed that there were 2 and 3 45S rDNA hybridization signals on the chromosomes of L. radiata and L. sprengeri, respectively. The 45S rDNA signals were found on chromosome 3 in both species. The numbers of 45S rDNA signals varied in the tested hybrids whose most signals located at the chromosome ends. Conclusion The karyotyping and fluorescence in situ hybridization system of Lycoris have been optimized and applied to the identification of hybrids in Lycoris and the distribution of parental chromosomes. These results will provide a theoretical basis for the creation of new germplasm resources and the breeding of new varieties of Lycoris genus. [Ch, 11 fig. 4 tab. 24 ref.] -
表 1 根尖的不同取样时间
Table 1. Different sampling times of root tips
取样时间 有丝分裂时期细胞数 分辨程度 7:00—8:00 前期较多,中期较少 清晰 8:00—9:00 中期多 清晰 9:00—10:00 中期较多 清晰 10:00—11:00 中期较少,后期较多 模糊 表 2 不同预处理试验结果
Table 2. Results of different pretreatment tests
预处理试剂 预处理时间/h 染色体聚缩程度 染色体拖尾情况 染色体清晰度 染色体分散度 8-羟基喹啉 2.5 适中 无 清晰 分散 4.0 适中 多数拖尾 清晰 较分散 饱和对二氯苯 2.5 皱缩 无 较清晰 分散 4.0 适中 多数拖尾 清晰 较分散 表 3 不同比例混合酶液温度和时间试验结果
Table 3. Results of temperature and time tests for mixed enzyme solutions with different proportions
编号 解离试剂 解离温度/
℃解离时间/
min染色体清晰度/
分散度A 2.0%纤维素酶 37 100 较清晰/不分散 B 2.0%纤维素酶+
1.0%离析酶37 100 模糊/较分散 C 2.5%纤维素酶+
2.5%离析酶37 100 清晰/较分散 D 5.0%纤维素酶+
0.3%离析酶37 100 清晰/分散 E 5.0%纤维素酶+
0.3%离析酶25 360 清晰/不分散 说明:表中解离试剂前的数值代表其质量分数。 表 4 石蒜属8个种间杂交种核型特征
Table 4. Karyotype characteristics of 8 interspecific hybrids of Lycoris
材料 平均臂比值 核型不对称系数/% 最长染色体/最短染色体 臂比大于2的染色体比例/% 核型类型 核型公式 石蒜 4.68 81.71 1.57 100 4A 2n=22=22A 换锦花 5.92 84.84 1.57 100 4A 2n=22=22A 长筒石蒜 5.28 47.62 2.92 62.50 3B 2n=16=6m+10A 014 4.53 81.42 1.54 100 4A 2n=22=22A 015 3.72 78.43 2.13 90.90 3B 2n=22=2sm+20A 030 4.34 80.66 1.75 100 4A 2n=22=22A 048 5.15 83.22 1.84 100 4A 2n=22=22A 067 4.95 82.33 2.06 100 4A 2n=22=22A 094 4.55 81.35 1.48 100 4A 2n=22=2sm+20A 097 3.19 67.11 3.11 77.77 3B 2n=18=4m+14A 098 3.78 70.21 2.78 77.77 3B 2n=18=4m+14A -
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1985: 16−27. Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1985: 16−27. [2] 王黎, 周琪, 高燕会. 石蒜属种间杂交种的鉴定和分子身份证构建[J]. 浙江农林大学学报, 2022, 39(3): 562−570. WANG Li, ZHOU Qi, GAO Yanhui. Construction of molecular identification card of Lycoris interspecific hybrids[J]. Journal of Zhejiang A&F University, 2022, 39(3): 562−570. [3] 张兆金. 石蒜属植物在园林绿化中的应用研究[J]. 农村经济与科技, 2021, 32(21): 56−57. ZHANG Zhaojin. Research on the application of Lycoris plants in landscape greening[J]. Rural Economy and Science-Technology, 2021, 32(21): 56−57. [4] 刘建霞, 王文庆, 薛乃雯, 等. 14个不同产地藜麦种质染色体核型分析[J]. 作物杂志, 2024(3): 82−89. LIU Jianxia, WANG Wenqing, XUE Naiwen, et al. Chromosome karyotype analysis of 14 Quinoa germplasms from different habitats[J]. Crops, 2024(3): 82−89. [5] 曲荣举, 刘玉萍, 陈金元, 等. 苦马豆(Sphaerophysa salsula) 6个不同居群的染色体核型分析[J]. 草地学报, 2024, 32(8): 2469−2477. QU Rongju, LIU Yuping, CHEN Jinyuan, et al. Chromosome karyotype analysis from six different populations of sphaerophysa salsula (Fabaceae)[J]. Acta Agrestia Sinica, 2024, 32(8): 2469−2477. [6] 马军, 宋承泽, 丁海燕, 等. 油用型向日葵矮大头杂交种染色体核型分析[J]. 东北农业科学, 2022, 47(5): 47−49. MA Jun, SONG Chengze, DING Haiyan, et al. Karyotype analysis of oil sunflower hybrid Aaidatou[J]. Journal of Northeast Agricultural Sciences, 2022, 47(5): 47−49. [7] 夏雪,辜金花,刘丹, 等. 黄花芥蓝染色体制片优化及核型分析[J]. 浙江大学学报(农业与生命科学版), 2016, 42(5): 527−534. XIA Xue, GU Jinhua, LIU Dan, et al. Optimization of chromosome preparation and karyotype analysis of yellow-flower Chinese kale[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2016, 42(5): 527−534. [8] 柯丽霞, 孙叶根, 郑艳, 等. 石蒜属三种植物的核型研究[J]. 安徽师大学报(自然科学版), 1998, 21(4): 343−348. KE Lixia, SUN Yegen, ZHENG Yan, et al. Karyotype analysis of three species of Lycoris Herb.[J]. Journal of Anhui Normal University (Natural Science), 1998, 21(4): 343−348. [9] 徐炳声, 黄少甫, 赵治芬, 等. 安徽石蒜和中国石蒜染色体核型的分析[J]. 云南植物研究, 1984, 6(1): 79−83. HSU Bingsheng, HUANG Shaofu, ZHAO Zhifen, et al. Karyotype analyses in Lycoris anhweiensis and L. chinensis[J]. Acta Botanica Yunnanica, 1984, 6(1): 79−83. [10] 徐炳声, 黄少甫, 赵治芬, 等. 石蒜Lycoris radiata (L’Her. ) Herb. 及其矮小变种var. pumila Gery染色体核型的分析[J]. 植物研究, 1984, 4(1): 112−117. HSU Bingsheng, HUANG Shaofu, ZHAO Zhifen, et al. Karyotype analyses in Lycoris radiata (L’Her. ) Herb. var. pumila Gery[J]. Bulletin of Botanical Research, 1984, 4(1): 112−117. [11] 张悦, 王兴达, 吴云燕, 等. 基于荧光原位杂交的7种石蒜属植物的核型分析[J/OL]. 分子植物育种, 2025, 23(5): 1586−1593. ZHANG Yue, WANG Xingda, WU Yunyan, et al. Karyotype analysis of seven Lycoris species based on fluorescence in situ hybridization[J/OL]. Molecular Plant Breeding, 2025, 23(5): 1586−1593. [12] CHEN H, CONTRERAS R N. Near-hexaploid and near-tetraploid aneuploid progenies derived from backcrossing tetraploid parents Hibiscus syriacus × (H. syriacus × H. paramutabilis)[J/OL]. Genes, 2022, 13(6): 1022[2024-07-01]. DOI: 10.3390/genes13061022. [13] CUI Litao, CHEN Tai, ZHAO Xin, et al. Karyotype analysis, genomic and fluorescence in situ hybridization (GISH and FISH) reveal the ploidy and parental origin of chromosomes in Paeonia itoh hybrids[J/OL]. International Journal of Molecular Sciences, 2022, 23(19): 11406[2024-07-01]. DOI: 10.3390/ijms231911406. [14] PARK I, CHOI B, WEISS-SCHNEEWEISS H, et al. Comparative analyses of complete chloroplast genomes and karyotypes of allotetraploid Iris koreana and its putative diploid parental species (Iris series chinenses, Iridaceae)[J/OL]. International Journal of Molecular Sciences, 2022, 23(18): 10929[2024-07-01]. DOI: 10.3390/ijms231810929. [15] 高燕会. 四个栽培棉种间的种间杂交及其遗传与系统发育研究[D]. 杭州: 浙江大学, 2004. GAO Yanhui. Study on the Interspecies Hybrid and Genetics and Systematic Development between the Four Cultivated Cotton Species[D]. Hangzhou: Zhejiang University, 2004. [16] 李懋学, 陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究, 1985, 3(4): 297−302. LI Maoxue, CHEN Ruiyang. A suggestion on the standardization of karyotype analysis in plants[J]. Journal of Wuhan Botanical Research, 1985, 3(4): 297−302. [17] LEVAN A, FREDGA K, SANDBERG A A. Nomenclature for centromeric position on chromosomes[J]. Hereditas, 2009, 52(2): 201−220. [18] STEBBINS G L. Chromosomal Evolution in Higher Plants[M]. London: Edward Arnold, 1971: 85−104. [19] LIU Kun, MENG Weiqi, ZHENG Lu, et al. Cytogeography and chromosomal variation of the endemic East Asian herb Lycoris radiata[J]. Ecology and Evolution, 2019, 9(12): 6849−6859. [20] ZHOU Shoubiao, YU Benqi, LUO Qi, et al. Karyotypes of six populations of Lycoris radiata and discovery of the tetraploid[J]. Acta Phytotaxonomica Sinica, 2007, 45(4): 513−522. [21] 马誉, 康晓玲, 郑明燕, 等. 6种蔷薇属植物的染色体核型分析[J/OL]. 分子植物育种, 2023-03-31[2024-07-01]. https://kns.cnki.net/kcms/detail/46.1068.S.20230331.1358.016.html. MA Yu, KANG Xiaoling, ZHENG Mingyan, et al. Karyotype analysis of six species of Rosa plants[J/OL]. Molecular Plant Breeding, 2023-03-31[2024-07-01]. https://kns.cnki.net/kcms/detail/46.1068.S.20230331.1358.016.html. [22] LUO Xiaomei, LIU Juncheng. Fluorescence in situ hybridization (FISH) analysis of the locations of the oligonucleotides 5S rDNA, (AGGGTTT)3, and (TTG)6 in three genera of Oleaceae and their phylogenetic framework[J/OL]. Genes, 2019, 10(5): 375[2024-07-01]. DOI: 10.3390/genes10050375. [23] LIU Maosen, TSENG S H, TSAI C C, et al. Chromosomal variations of Lycoris species revealed by FISH with rDNAs and centromeric histone H3 variant associated DNAs[J/OL]. PLoS One, 2021, 16(9): e0258028[2024-07-01]. DOI: 10.1371/journal.pone.0258028. [24] DING Xiaoliu, XU Tingliang, WANG Jing, et al. Distribution of 45S rDNA in modern rose cultivars (Rosa hybrida), Rosa rugosa, and their interspecific hybrids revealed by fluorescence in situ hybridization[J]. Cytogenetic and Genome Research, 2016, 149(3): 226−235. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20240428







 下载:
下载: