-
白玉兰Yulania denudata和望春玉兰Y. biondii是中国北方常见的园林绿化树种,其树形优美、枝叶茂密、花香宜人,具有较高的观赏价值。植物光合作用效率与叶片的叶绿素密切相关,叶绿素是评估植物生理状态的重要指标[1−2]。氮素作为植物生长发育所必需的大量营养元素,参与植物细胞的形态建成与生理代谢[3]。
测量植物叶绿素和氮素的传统方法有分光光度计法、荧光分析法、高效液相色谱法和原子吸收光谱法。分光光度计法操作相对简单,但要在实验环境下进行[4]。荧光分析法、高效液相色谱法和原子吸收光谱法的仪器设备价格昂贵,且需要专业的操作,不适合大量数据的采集[5]。叶绿素测定仪通过测量叶绿素相对含量SPAD (soil and plant analyzer development)值,可间接表示植物的叶绿素及氮素[6]。这种方法快速且具有较高的精度,但在操作时需要专业仪器[7]。在数字化浪潮下,借助数码相机、手机等便携的设备进行图像处理的技术不断迭代升级。已有研究通过绿萝Epipremnum aureum灰度图像分析技术提取植被颜色特征参数,并探讨与叶片叶绿素的相关性[8]。在植物生理监测领域,基于RGB色彩空间数值构建叶绿素预测模型是经典的研究方法,已应用于生菜Lactuca sativa、黄瓜Cucumis sativus的叶绿素估算[9−10]。通过建立RGB三通道吸光度与叶绿素指标间的定量回归模型,可实现非破坏性快速检测,依托图像处理技术测定叶绿素和氮素已成为近年来的研究热点。李修华等[11]开发了智能手机RGB图像系统,集成主动光源与色差校正,构建多机型通用叶绿素无损检测模型,通过微信小程序实现田间实时诊断。李丽等[12]基于RGB模型开发的番茄Solanum lycopersicum叶片叶绿素无损检测方法,通过图像归一化与分割处理,验证了模型的高度适配性,实现了高精度原位检测。目前,基于RGB图像技术无损检测植物叶绿素与氮素的研究已取得显著进展,但高度集中于叶片结构相对简单、冠层规整的1年生大田作物。然而,基于大田作物建立的叶绿素测定方法是否适用于白玉兰、望春玉兰等园林木本观赏植物还不清楚。尽管叶绿素的光学特性具有普适性,但木本植物与大田作物在叶片解剖结构、叶色动态变化等存在差异,这些因素会显著影响RGB图像的光谱反射特征与信息提取。园林观赏植物的精细化养护管理中,迫切需要对树体营养状况进行高效、无损的诊断,因此构建基于智能手机RGB图像快速预测白玉兰和望春玉兰叶片叶绿素和氮素模型具有重要的理论价值与实践意义。
本研究以白玉兰和望春玉兰叶片为材料进行叶绿素、氮素测定,利用2种常见智能手机拍摄植物叶片图像,通过图像处理获取颜色RGB特征参数值,建立基于智能手机RGB图像快速预测白玉兰和望春玉兰叶片叶绿素和氮素模型,以期为玉兰属植物叶片生长状态评估提供科学参考。
-
图像采集设备直接影响数据质量与分析的准确性[13]。本研究选取智能手机iPhone13和荣耀70Pro+作为图像采集设备。iPhone13的主摄像头为1 200万像素,光圈f/1.6,索尼IMX703传感器;荣耀70Pro+的主摄像头为5 400万像素,光圈f/1.9,索尼IMX800传感器。
-
研究区位于河南省郑州市金水区河南农业大学文化路校区内(34.78°N,113.65°E),该区属暖温带大陆性季风气候。2024年8—10月采集健康成年的白玉兰和望春玉兰叶片,此时期叶片叶色较深。9:00—11:00进行叶片采集,此时光照强度适中均匀,能够最大程度减少光照度与遮光度对叶片叶绿素的影响[14]。从不同高度、不同方向剪取每种玉兰叶片150片。选取叶色均匀、无病虫害、无损伤的叶片,迅速放入黑色收集袋中,防止叶片水分蒸发及意外损伤[15]。在实验室对叶片表面进行清洁,去除叶表灰尘和杂质,避免对后续研究造成干扰。最后,用标签纸对叶片的图片特征参数和生理参数进行记录与分析。
-
采用叶绿素测定仪进行叶绿素和氮素测定。在实际测量过程中,为确保测量结果的准确性,在叶片上随机均匀选取5个不同点进行测量,取其平均值作为该叶片的叶绿素和氮素平均值,有效减小了叶片内部叶绿素和氮素分布不均匀造成的误差,提高了数据的可靠性[16]。
-
在利用手机进行叶片图像采集过程中,不同的环境光线会导致叶片图像明暗不一,对后续的RGB值提取造成干扰,影响叶绿素预测模型的准确性[17]。如图1所示:本研究选用1款常见的手机补光灯,功率为3 W,拥有3档亮度,涵盖2 700~6 500 K不同色温,在0.5 m内光照度可达250 lx。使用时将补光灯夹在手机摄像头处,选用低档白光,在拍摄时为其提供稳定的光源。采用黑色哑光材料摄影布铺设拍摄背景,减少反光和杂光的影响,提高叶片与背景的对比度,以便后续图像分割处理。在实际拍摄时,将使用叶绿素仪采集完叶片信息后的叶片置于拍摄区域,将2种设备水平放置于操作台,手机镜头与叶片垂直相距约20 cm,确保完整拍摄叶片的同时,获得清晰、不失真的图像。
-
本研究将Python语言与OpenCV库相结合,开发了一套自动提取感兴趣区域叶片颜色特征参数的图像处理方法。该方法涵盖图像预处理、叶面高光处理、感兴趣区域提取和颜色特征参数分离4个关键步骤,通过一系列算法实现对叶片图像的精准处理和特征提取。图像特征参数提取流程如下:①图像预处理。采用中值滤波(median filter)进行平滑处理。②叶面高光处理。基于HSV(色相、饱和度、明度)颜色空间分离亮度通道,通过分析亮度信息来检测高光区域[18]。采用自适应阈值检测高光区域,根据图像的实际亮度分布自动确定高光范围,提高检测的准确性。结合Telea图像修复算法对高光区域进行重建,恢复被高光覆盖的叶片信息,确保叶片颜色特征的完整性[19]。③提取叶片感兴趣区域。利用BGR2GRAY进行图像转换,将彩色图像转换为灰度图像,再采用Otsu二值化方法对灰度图像进行处理[20]。将二值掩码与原始彩色图像逐像素进行位与运算,保留叶片区域的真实色彩,将非目标区域置黑,实现高精度背景去除,准确提取出叶片感兴趣区域(图2)。④颜色特征参数分离。通过对大量叶片样本进行分析,确定并构建HSV双色域动态阈值,其中绿色H∈[35, 85]。最后,在RGB空间计算叶片像素的平均值作为提取的RGB颜色特征值,包括21种颜色特征,分别为R, G, B, R−G, R−B, G−B, R/G, R/B, G/B, B−R−G, R−G−B, G−R−B, G/R−B, B/R−G, B/G−R, R/G−B, G/B−R, R/B−G, (G+B)/R, (B+R)/G, (G+R)/B,这些特征值将作为叶绿素和氮素预测模型的输入参数,用于建立叶片颜色与叶绿素、氮素之间的关系。其中3种标准化RGB (r、g、b)计算公式为r=R/(R+G+B),g=G/(R+G+B),b=B/(R+G+B)。
-
将RGB 3个颜色通道特征作为输入数据,对数据进行标准化处理,以消除RGB通道量纲差异对模型训练的影响。对于线性回归模型,采用7∶3固定划分方式将数据集分为训练集与测试集[21]。通过梯度下降法对模型权重进行优化,使其能够更好地拟合数据[22]。人工神经网络模型使用ReLU激活函数和L2正则化(alpha参数)平衡模型的拟合能力与泛化性能。通过网格搜索结合5折交叉验证对隐藏层规模、正则化强度进行系统优化[23−24]。支持向量回归模型验证采用嵌套交叉验证策略,外层采用5折交叉验证评估模型的泛化性能,内层采用10折交叉验证结合网格搜索方法优化超参数。基于RGB特征分布,在对数空间设置参数网格,通过遍历不同的参数组合,找到使模型性能最优的超参数设置,提高模型的拟合能力和泛化能力[25−26]。人工神经网络和支持向量回归模型结构如图3所示。
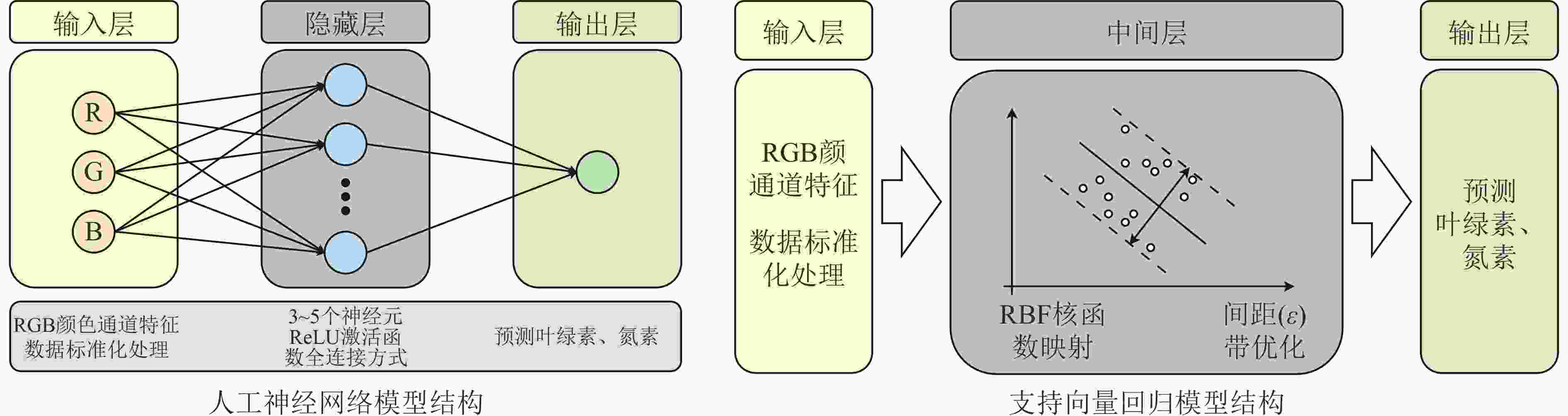
图 3 人工神经网络和支持向量回归模型结构图
Figure 3. Structure diagram of Artificial Neural Network and Support Vector Regression model
模型评估采用训练集($ {R}_{\mathrm{c}}^{2} $)、测试集($ {R}_{{\mathrm{}}_{\mathrm{p}}}^{2} $)、训练集均方根误差(RMSEC)、测试集均方根误差(RMSEP)作为标准。$ {R}_{\mathrm{c}}^{2} $用于衡量模型对训练数据的拟合能力,$ {R}_{{\mathrm{}}_{\mathrm{p}}}^{2} $反映模型在实际应用中的预测能力,其值越接近1,模型对训练数据的拟合效果越好;RMSEC与RMSEP值越小,说明模型的预测结果越接近真实值[27]。通过综合分析这些指标,能够全面评估模型的精度及稳定性,为模型的优化和改进提供依据,从而构建出更可靠的植物叶片叶绿素和氮素预测模型。
$$ {R}_{\mathrm{c}}^{2}=\sum _{i=1}^{{n}_{\mathrm{c}}}{\left({Y}_{\mathrm{p}i}-{Y}_{i}\right)}^{2}/\sum _{i=1}^{{n}_{\mathrm{c}}}{\left({Y}_{\mathrm{p}i}-\overline{Y}\right)}^{2}; $$ $$ {R}_{{\mathrm{}}_{\mathrm{p}}}^{2}=\sum _{i=1}^{{n}_{\mathrm{p}}}{\left({Y}_{{}_{\mathrm{p}}i}-{Y}_{i}\right)}^{2}/\sum _{i=1}^{{n}_{\mathrm{p}}}{\left({Y}_{{}_{\mathrm{p}}i}-\overline{Y}\right)}^{2}; $$ $$ {R}_{\mathrm{M}\mathrm{S}\mathrm{E}\mathrm{C}}=\sqrt{\frac{1}{{n}_{\mathrm{c}}}\sum _{i=1}^{{n}_{\mathrm{c}}}{\left({Y}_{\mathrm{p}i}-{Y}_{i}\right)}^{2}}; $$ $$ {R}_{\mathrm{M}\mathrm{S}\mathrm{E}\mathrm{P}}=\sqrt{\frac{1}{{n}_{\mathrm{p}}}\sum _{i=1}^{{n}_{\mathrm{p}}}{\left({Y}_{\mathrm{p}i}-{Y}_{i}\right)}^{2}}。 $$ 其中:$ {Y}_{\mathrm{p}i} $表示第i个叶片叶绿素/氮素的预测值;$ {Y}_{i} $表示第i个叶片叶绿素/氮素的实测值;$ \overline{Y} $表示对应模型集中的叶片叶绿素/氮素的平均值;$ {n}_{\mathrm{c}} $表示训练集中的计算数量;$ {n}_{\mathrm{p}} $表示预测集中的计算数量。
-
使用Excel 2021和SPSS 27.0进行数据整理与分析,使用Origin 2021绘图,采用Pearson分析不同颜色组合特征与叶绿素和氮素的相关性。
-
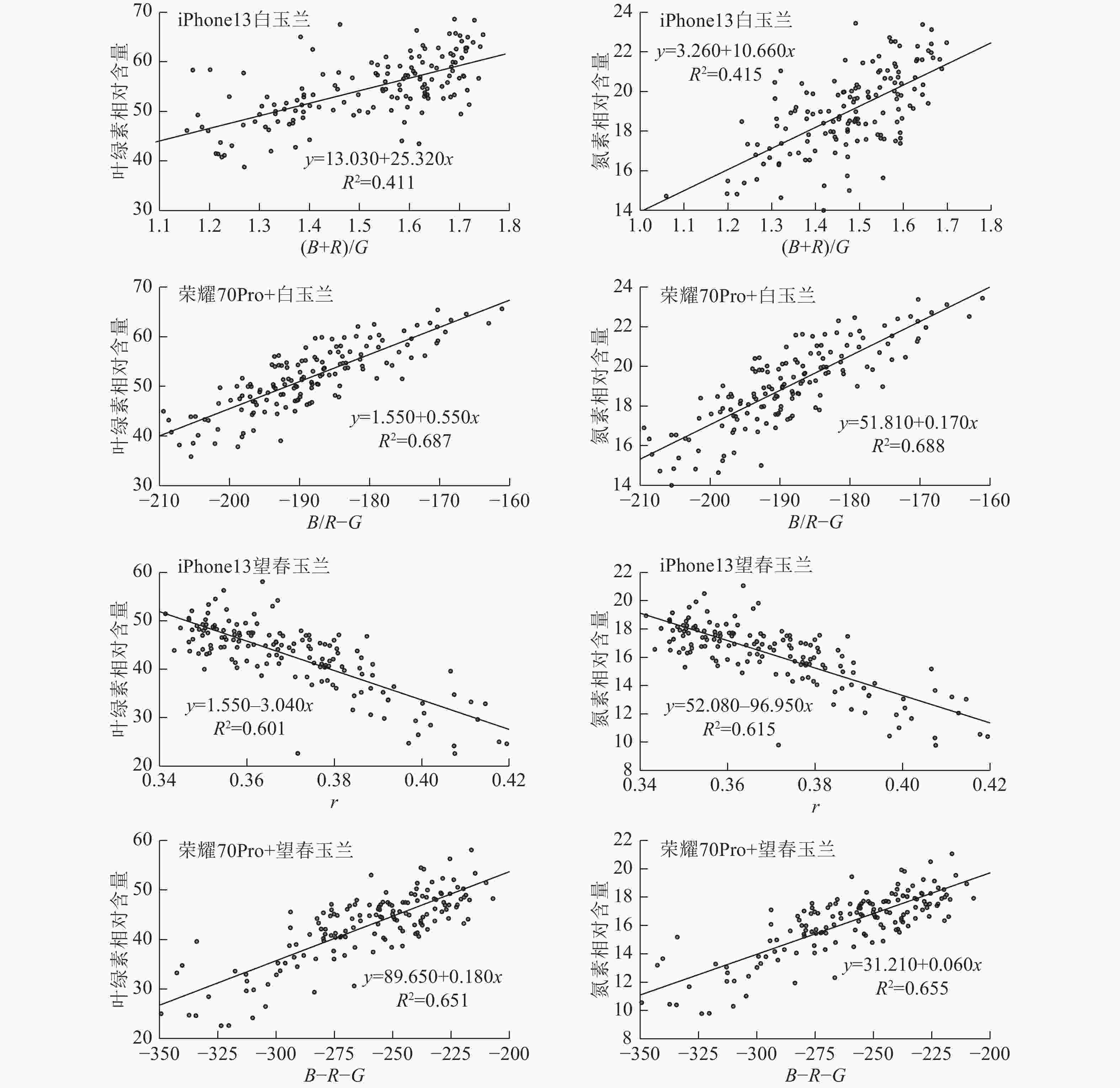
相关性分析发现:iPhone13拍摄的白玉兰颜色特征值与叶绿素值、氮素值的相关性均较低。如表1所示:在叶绿素的相关性方面,iPhone13拍摄的白玉兰叶片最敏感的颜色特征组合为(B+R)/G;拍摄的望春玉兰叶片最敏感的颜色特征组合为r。荣耀70Pro+拍摄的白玉兰叶片最敏感的颜色特征组合为B/R−G;拍摄的望春玉兰叶片最敏感的颜色特征组合为B−R−G。在氮素的相关性方面,iPhone13拍摄的白玉兰叶片最敏感的颜色特征组合为(B+R)/G;拍摄的望春玉兰叶片最敏感的颜色特征组合为r。荣耀70Pro+拍摄的白玉兰叶片最敏感的颜色特征组合为B/R−G;拍摄的望春玉兰叶片最敏感的颜色特征组合为B−R−G。
表 1 选取的颜色特征与叶绿素、氮素的相关性分析
Table 1. Correlation analysis of selected color features with chlorophyll and nitrogen
颜色
特征与叶绿素的相关系数 与氮素的相关系数 白玉兰 望春玉兰 白玉兰 望春玉兰 iPhone13 荣耀70Pro+ iPhone13 荣耀70Pro+ iPhone13 荣耀70Pro+ iPhone13 荣耀70Pro+ R −0.156 −0.484 −0.306 −0.455 −0.156 −0.484 −0.230 −0.446 G −0.467 −0.828 −0.584 −0.629 −0.468 −0.829 −0.562 −0.599 B 0.484 0.478 0.652 0.643 0.484 0.478 0.666 0.655 r −0.369 −0.505 −0.777 −0.765 −0.369 −0.506 −0.786 −0.772 g −0.640 −0.642 −0.615 −0.518 −0.640 −0.642 −0.631 −0.529 b 0.599 0.679 0.706 0.706 0.599 0.680 0.717 0.715 R−G 0.614 0.499 0.274 0.007 0.615 0.499 0.304 −0.002 R−B −0.570 −0.706 −0.768 −0.793 −0.570 −0.707 −0.775 −0.799 G−B −0.637 −0.742 −0.702 −0.695 −0.637 −0.743 −0.712 −0.701 R/G 0.584 0.370 0.240 −0.056 0.585 0.370 0.272 −0.062 R/B −0.530 −0.552 −0.738 −0.695 −0.530 −0.553 −0.749 −0.703 G/B −0.581 −0.587 −0.703 −0.637 −0.581 −0.587 −0.716 −0.646 B−R−G 0.577 0.827 0.776 0.808 0.577 0.827 0.781 0.811 R−G−B −0.258 −0.277 −0.701 −0.724 −0.258 −0.277 −0.713 −0.733 G−R−B −0.573 −0.536 −0.592 −0.505 −0.573 −0.537 −0.609 −0.517 G/R−B −0.484 −0.478 −0.652 −0.642 −0.485 −0.479 −0.666 −0.654 B/R−G 0.470 0.830 0.590 0.635 0.470 0.831 0.569 0.607 B/G−R 0.162 0.491 0.320 0.464 0.162 0.491 0.244 0.455 R/G−B −0.483 −0.477 −0.653 −0.644 −0.484 −0.478 −0.666 −0.656 G/B−R 0.140 0.461 0.247 0.413 0.140 0.461 0.170 0.402 R/B−G 0.462 0.824 0.555 0.603 0.462 0.824 0.530 0.570 (G+B)/R 0.357 0.510 0.768 0.759 0.357 0.510 0.777 0.766 (B+R)/G 0.644 0.647 0.615 0.528 0.645 0.647 0.630 0.537 (G+R)/B −0.561 −0.574 −0.720 −0.666 −0.561 −0.575 −0.733 −0.675 对各组与叶绿素实测值和氮素实测值相关性最高的颜色特征组合进行线性回归分析。其中荣耀70Pro+拍摄的白玉兰叶片特征方程与叶绿素(R2=0.687)、氮素(R2=0.688)的R2最高;iPhone13拍摄的白玉兰叶片特征方程与叶绿素(R2=0.411)、氮素(R2=0.415)的R2最低,表明不同智能手机对特征方程的拟合效果有明显影响(图4)。
-
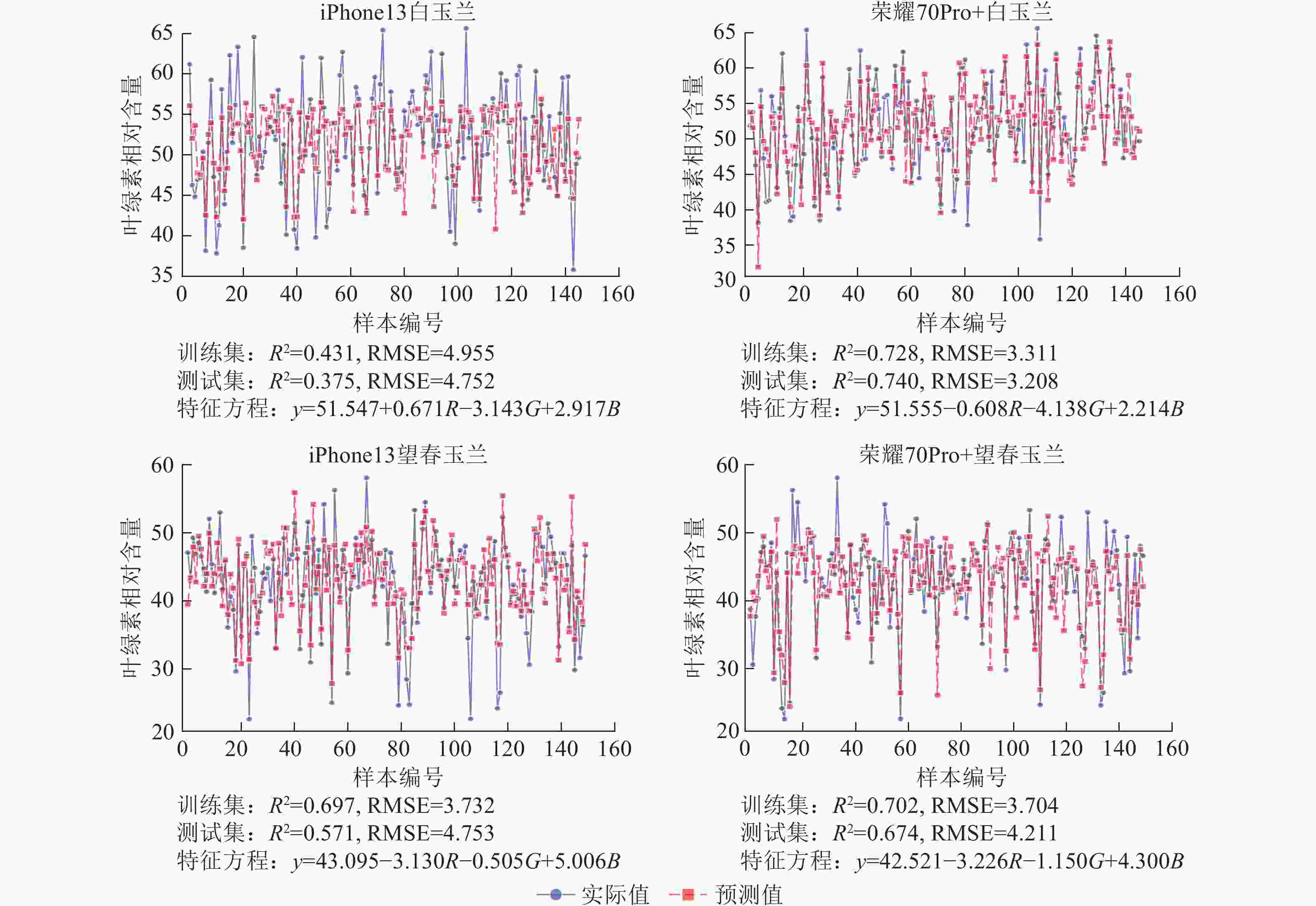
使用荣耀70Pro+拍摄白玉兰和望春玉兰叶片时,模型训练集和测试集的R2均高于iPhone13,且均方根误差(RMSE)整体较低,表明由荣耀70Pro+拍摄的图片构建的模型拟合效果和预测精度较iPhone13更优。其中荣耀70Pro+拍摄的白玉兰所构建的线性回归模型预测精度最高(R2=0.740),iPhone13拍摄的白玉兰构建的线性回归模型预测精度最低(R2=0.375)(图5)。
-
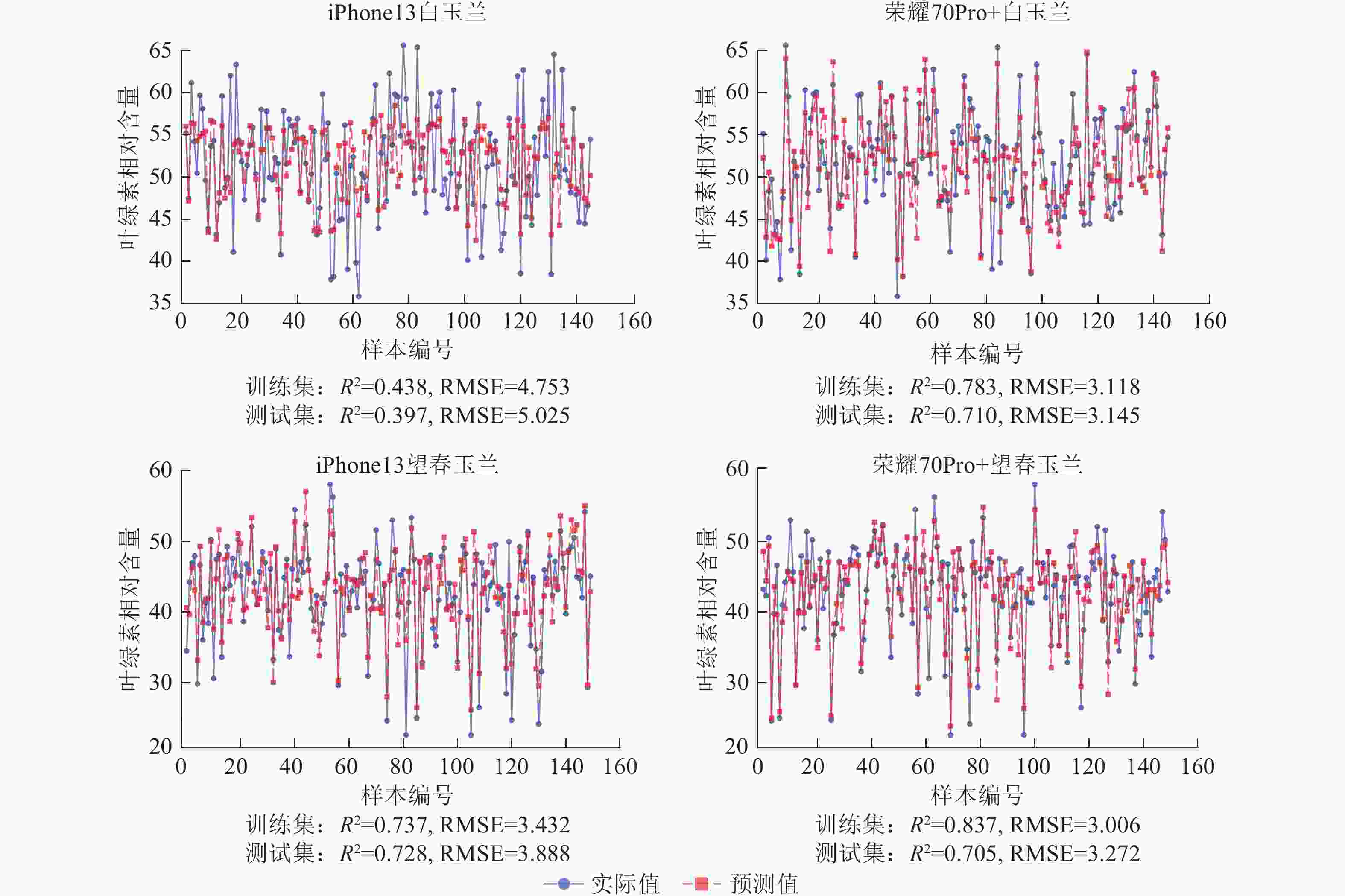
使用荣耀70Pro+拍摄白玉兰和望春玉兰叶片时,模型训练集的R2均高于iPhone13,且RMSE整体更低,表明由荣耀70Pro+拍摄的图片构建的模型拟合效果较iPhone13更优。其中iPhone13拍摄的望春玉兰所构建的人工神经网络模型预测精度最高(R2=0.728),iPhone13拍摄的白玉兰构建的人工神经网络模型预测精度最低(R2=0.397)(图6)。
-
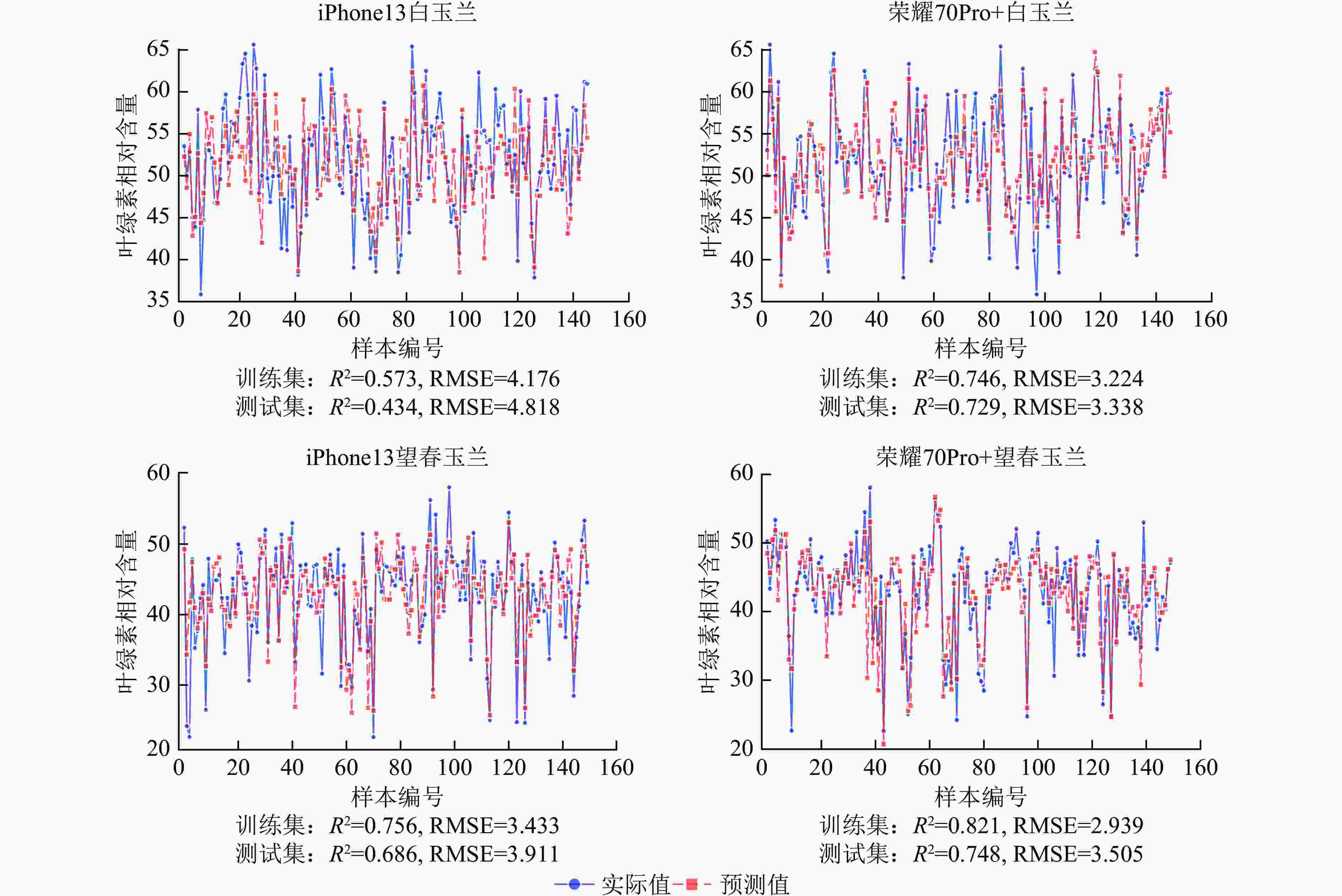
使用荣耀70Pro+拍摄白玉兰和望春玉兰叶片时,模型的R2均高于iPhone13,且RMSE整体更低,表明由荣耀70Pro+拍摄的图片构建的模型拟合效果和预测精度较iPhone13更优。其中荣耀70Pro+拍摄的望春玉兰所构建的支持向量回归模型预测精度最高(R2=0.748),iPhone13拍摄的白玉兰构建的支持向量回归模型预测精度最低(R2=0.434)(图7)。
-
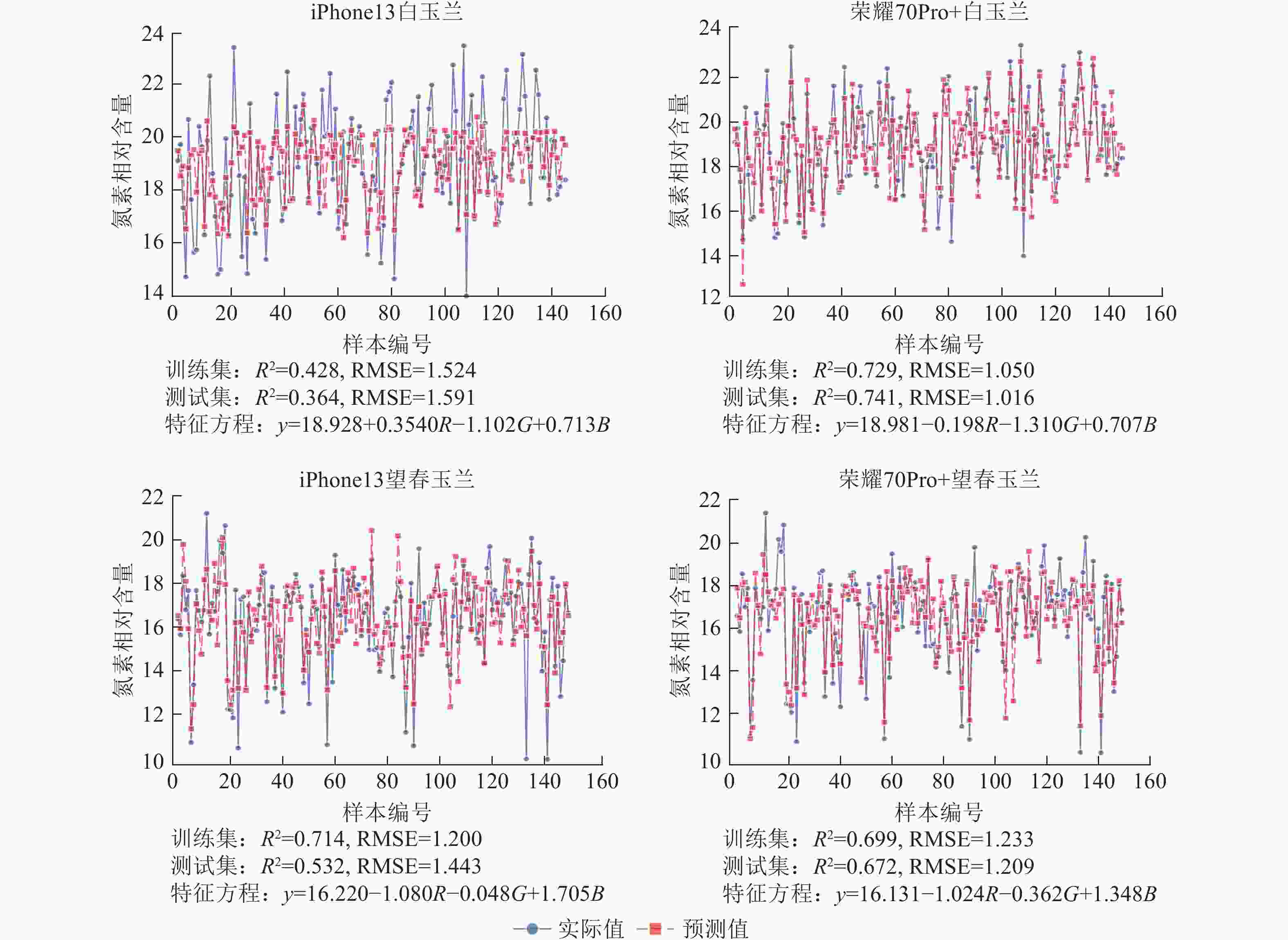
使用荣耀70Pro+拍摄白玉兰和望春玉兰叶片时,模型测试集的R2均显著高于iPhone13,且RMSE整体更低,表明由荣耀70Pro+拍摄的图片构建的模型预测精度较iPhone13更优。其中荣耀70Pro+拍摄的白玉兰所构建的线性回归模型预测精度最高(R2=0.741),iPhone13拍摄的白玉兰构建的线性回归模型预测精度最低(R2=0.364)(图8)。
-
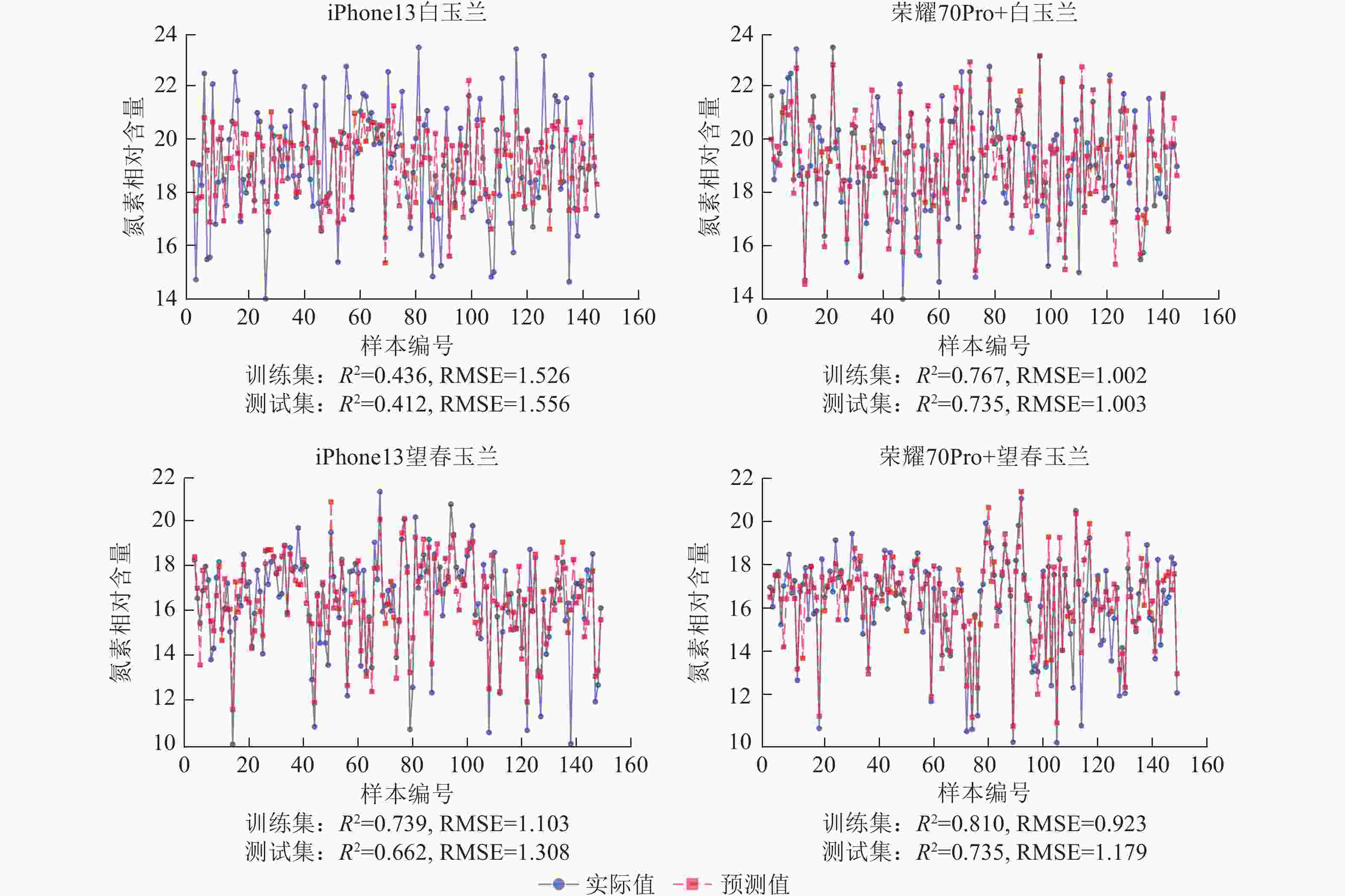
使用荣耀70Pro+拍摄白玉兰和望春玉兰叶片时,模型训练集和测试集的R2均高于iPhone13,且RMSE整体更低,表明由荣耀70Pro+拍摄的图片构建的模型拟合效果和预测精度较iPhone13更优。其中荣耀70Pro+拍摄的白玉兰所构建的人工神经网络模型预测精度最高(R2=0.735),iPhone13拍摄的白玉兰构建的人工神经网络模型预测精度最低(R2=0.412)(图9)。
-
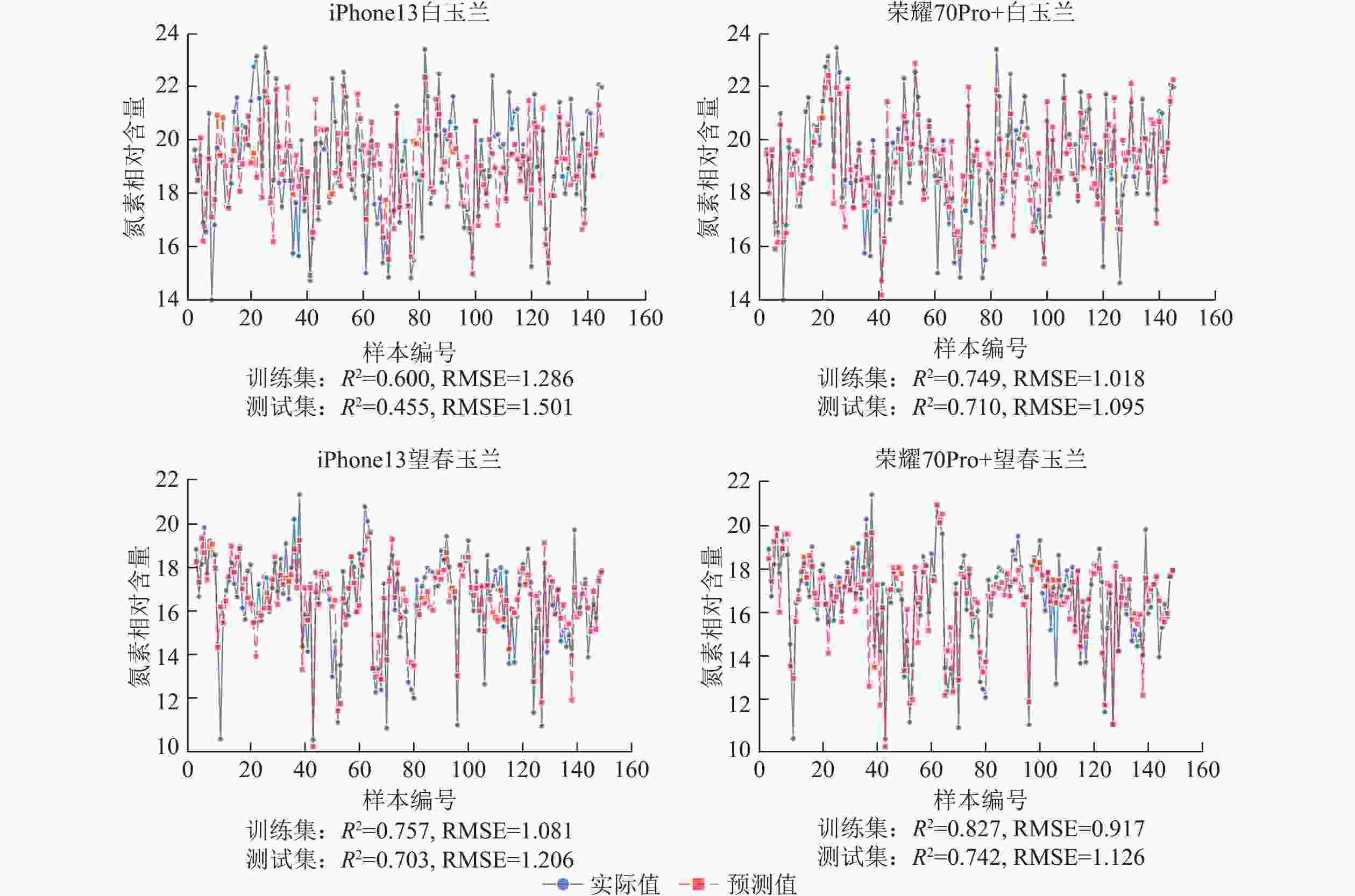
使用荣耀70Pro+拍摄白玉兰和望春玉兰叶片时,模型的R2均高于iPhone13,且RMSE整体更低,表明由荣耀70Pro+拍摄的图片构建的模型拟合效果和预测精度较iPhone13更优。其中荣耀70Pro+拍摄的望春玉兰所构建的支持向量回归模型预测精度最高(R2=0.742),iPhone13拍摄的白玉兰构建的支持向量回归模型预测精度最低(R2=0.455)(图10)。
-
本研究发现图像颜色特征值与叶绿素及氮素均存在显著相关性,这与毛竹Phyllostachys edulis[16]、黄瓜[9]、番茄[12]等物种的研究结论一致。此外,本研究发现不同型号手机的成像性能差异会显著影响预测模型的准确性, 这一结果与郜锦茹[13]的研究一致,即智能手机摄像模组的传感器质量、内置图像处理算法(如自动优化、降噪)会系统性扭曲原始色彩信息,从而引入误差。本研究使用荣耀70Pro+拍摄数据构建的模型比iPhone13的R2普遍更高,RMSE更低。该结果与严志雁等[28]指出的高像素、优质传感器设备利于植物生理指标图像检测的结论一致。说明设备硬件性能的提升能够为模型提供更准确的特征信息,从而有效提升模型的拟合度和预测准确性。
线性回归模型在数据线性关系明显时(如荣耀70Pro+数据)表现稳健,且多变量线性回归始终优于单变量模型,表明融合多个颜色特征能更全面地捕捉植物叶片生理变化。王建华[2]利用无人机多光谱多个波段监测玉米Zea mays叶绿素的研究中也有类似报道。然而,植物生理参数与图像特征间的关系多为复杂的非线性映射。在处理望春玉兰数据时,发现支持向量回归模型在使用荣耀70Pro+拍摄叶片的叶绿素(R2=0.748)和氮素(R2=0.742)预测中效果最佳。这一结果与PRANGA等[25]提出的“支持向量回归模型在处理高维、非线性数据时具有独特优势”的结论相呼应,说明支持向量回归模型能够更好地挖掘叶片图像特征与生理指标之间的复杂非线性联系,并提高预测精度。相比之下,人工神经网络模型在本研究的小样本数据上易受噪声干扰,表现稳定性不及支持向量回归模型,这表明在实际应用中需根据数据规模与特性进行算法优化与选择。
此外,不同玉兰叶片的预测效果有差异,反映出植物的生理特性对模型性能有重要影响。白玉兰和望春玉兰的叶片组织结构、色素组成及氮素代谢过程存在差异,导致叶片对光线的反射和吸收特性不同,进而影响图像特征的提取和模型的拟合效果。在望春玉兰叶片的叶绿素预测中,支持向量回归模型表现更为突出,这可能是因为望春玉兰叶片的生理特性使得其图像特征与叶绿素之间的关系更适合由支持向量回归模型进行拟合。综上所述,在建立植物生理指标预测模型时,需要充分考虑植物种特性,针对不同植物的特性优化模型参数,甚至开发专属模型,以提高模型的适用性和准确性。
-
荣耀70Pro+所拍摄的图像构建的模型在多数情况下优于iPhone13。不同模型在不同场景下表现各异,线性回归在荣耀70Pro+拍摄白玉兰叶片的叶绿素和氮素预测中效果最佳;人工神经网络模型在iPhone13拍摄望春玉兰叶片的叶绿素、荣耀70Pro+拍摄白玉兰的氮素预测中效果最佳;支持向量回归模型在使用荣耀70Pro+拍摄望春玉兰叶片预测叶绿素和氮素时表现最佳。玉兰属植物种间差异会导致模型拟合效果不同。
Prediction of chlorophyll and nitrogen contents in leaves of Yulania based on smartphone RGB images
-
摘要:
目的 旨在开发基于智能手机RGB图像的白玉兰Yulania denudata和望春玉兰Y. biondii叶片叶绿素和氮素预测的方法。 方法 以白玉兰和望春玉兰的成熟叶片为研究对象,利用iPhone13和荣耀70Pro+智能手机采集叶片图像,并通过Python语言与OpenCV库提取叶片颜色特征参数,结合叶绿素仪测定叶片的叶绿素和氮素,构建基于线性回归、人工神经网络和支持向量回归的预测模型。 结果 线性回归模型在荣耀70Pro+拍摄白玉兰叶片的叶绿素(R2=0.740)和氮素(R2=0.741)预测中效果最佳;人工神经网络模型在iPhone13拍摄望春玉兰叶片的叶绿素(R2=0.728)、荣耀70Pro+拍摄白玉兰叶片的氮素(R2=0.735)预测中效果最佳;支持向量回归模型在使用荣耀70Pro+拍摄望春玉兰叶片的叶绿素(R2=0.748)和氮素(R2=0.742)预测中效果最佳。 结论 基于智能手机RGB图像的叶绿素与氮素预测方法在玉兰属Yulania植物叶片中具备良好的可行性,所有模型的预测性能均达到较高水平。玉兰属植物种间差异会导致模型拟合效果不同。图10表1参28 Abstract:Objective This study aims to develop a method for predicting chlorophyll and nitrogen in leaves of Yulania denudata and Y. biondii based on smartphone RGB images. Method Mature leaf of Y. denudata and Y. biondii were used as the research objects. Leaf images were collected using 2 smartphone models, namely iPhone13 and Honor 70Pro+. The color feature parameters of the leaves were extracted via Python and the OpenCV library. Combined with the leaf chlorophyll and nitrogen measured by a chlorophyll meter, prediction models were constructed based on three algorithms: Linear Regression, Artificial Neural Network, and Support Vector Regression. Result Among the constructed models, the Linear Regression model achieved the best performance in predicting chlorophyll (R2=0.740) and nitrogen (R2=0.741) of Y. denudata leaves imaged by the Honor 70Pro+. The Artificial Neural Network model exhibited the optimal performance in predicting chlorophyll (R2=0.728) of Y. biondii leaves captured by the iPhone13 and nitrogen (R2=0.735) of Y. denudata leaves imaged by the Honor 70Pro+. For the Support Vector Regression model, it showed the best predictive ability for both chlorophyll (R2=0.748) and nitrogen (R2=0.742) of Y. biondii leaves captured by the Honor 70Pro+. Conclusion The prediction method of chlorophyll and nitrogen based on smartphone RGB images shows good feasibility in the leaves of Yulania plants, and the prediction performance of all models reaches a relatively high level. Interspecific differences among Yulania species result in variations in the fitting performance of the prediction models. [Ch, 10 fig. 1 tab. 28 ref.] -
Key words:
- RGB image /
- Yulania denudata /
- Y. biondii /
- chlorophyll /
- nitrogen /
- prediction
-
表 1 选取的颜色特征与叶绿素、氮素的相关性分析
Table 1. Correlation analysis of selected color features with chlorophyll and nitrogen
颜色
特征与叶绿素的相关系数 与氮素的相关系数 白玉兰 望春玉兰 白玉兰 望春玉兰 iPhone13 荣耀70Pro+ iPhone13 荣耀70Pro+ iPhone13 荣耀70Pro+ iPhone13 荣耀70Pro+ R −0.156 −0.484 −0.306 −0.455 −0.156 −0.484 −0.230 −0.446 G −0.467 −0.828 −0.584 −0.629 −0.468 −0.829 −0.562 −0.599 B 0.484 0.478 0.652 0.643 0.484 0.478 0.666 0.655 r −0.369 −0.505 −0.777 −0.765 −0.369 −0.506 −0.786 −0.772 g −0.640 −0.642 −0.615 −0.518 −0.640 −0.642 −0.631 −0.529 b 0.599 0.679 0.706 0.706 0.599 0.680 0.717 0.715 R−G 0.614 0.499 0.274 0.007 0.615 0.499 0.304 −0.002 R−B −0.570 −0.706 −0.768 −0.793 −0.570 −0.707 −0.775 −0.799 G−B −0.637 −0.742 −0.702 −0.695 −0.637 −0.743 −0.712 −0.701 R/G 0.584 0.370 0.240 −0.056 0.585 0.370 0.272 −0.062 R/B −0.530 −0.552 −0.738 −0.695 −0.530 −0.553 −0.749 −0.703 G/B −0.581 −0.587 −0.703 −0.637 −0.581 −0.587 −0.716 −0.646 B−R−G 0.577 0.827 0.776 0.808 0.577 0.827 0.781 0.811 R−G−B −0.258 −0.277 −0.701 −0.724 −0.258 −0.277 −0.713 −0.733 G−R−B −0.573 −0.536 −0.592 −0.505 −0.573 −0.537 −0.609 −0.517 G/R−B −0.484 −0.478 −0.652 −0.642 −0.485 −0.479 −0.666 −0.654 B/R−G 0.470 0.830 0.590 0.635 0.470 0.831 0.569 0.607 B/G−R 0.162 0.491 0.320 0.464 0.162 0.491 0.244 0.455 R/G−B −0.483 −0.477 −0.653 −0.644 −0.484 −0.478 −0.666 −0.656 G/B−R 0.140 0.461 0.247 0.413 0.140 0.461 0.170 0.402 R/B−G 0.462 0.824 0.555 0.603 0.462 0.824 0.530 0.570 (G+B)/R 0.357 0.510 0.768 0.759 0.357 0.510 0.777 0.766 (B+R)/G 0.644 0.647 0.615 0.528 0.645 0.647 0.630 0.537 (G+R)/B −0.561 −0.574 −0.720 −0.666 −0.561 −0.575 −0.733 −0.675 -
[1] 于宇璇, 刘储睿, 唐文竹, 等. 利用蛋白质组学技术探究叶绿素含量对植物生长的影响[J]. 质谱学报, 2023, 44(4): 545−555. YU Yuxuan, LIU Churui, TANG Wenzhu, et al. Using protein omics technology to explore the influence of chlorophyll content on plant growth [J]. Journal of Chinese Mass Spectrometry Society, 2023, 44(4): 545−555. [2] 王建华. 基于无人机多光谱遥感的玉米叶绿素含量监测研究[D]. 太谷: 山西农业大学, 2023. WANG Jianhua. Monitor on the Chlorophyll Content of Maize by Using UAV Multispectral Remote Sensing [D]. Taigu: Shanxi Agricultural University, 2023. [3] 刘学英, 李姗, 吴昆, 等. 提高农作物氮肥利用效率的关键基因发掘与应用[J]. 科学通报, 2019, 64(25): 2633−2640. LIU Xueying, LI Shan, WU Kun, et al. Sustainable crop yields from the coordinated modulation of plant growth and nitrogen metabolism [J]. Chinese Science Bulletin, 2019, 64(25): 2633−2640. [4] 刘伟, 丁红红, 王韦斌, 等. 分光光度计量值比对的实施和结果分析[J]. 科技资讯, 2024, 22(19): 246−250. LIU Wei, DING Honghong, WANG Weibin, et al. Implementation and result analysis of value comparison of spectrophotometer [J]. Science & Technology Information, 2024, 22(19): 246−250. [5] WANG Huan, ZHU Rong, ZHANG Jia, et al. A novel and convenient method for early warning of algal cell density by chlorophyll fluorescence parameters and its application in a highland lake[J/OL]. Frontiers in Plant Science, 2018, 9: 869[2025-08-01]. DOI:10.3389/fpls.2018.00869. [6] MARKWELL J, OSTERMAN J C, MITCHELL J L. Calibration of the Minolta SPAD-502 leaf chlorophyll meter [J]. Photosynthesis Research, 1995, 46(3): 467−472. [7] 王磊, 卢艳丽, 白由路, 等. 主要粮食作物基于SPAD的氮素营养诊断方法研究进展[J]. 植物营养与肥料学报, 2022, 28(3): 546−554. WANG Lei, LU Yanli, BAI Youlu, et al. Research progress on nitrogen nutrition diagnosis method based on SPAD for main grain crops [J]. Plant Nutrition and Fertilizer Science, 2022, 28(3): 546−554. [8] SPOMER L A, SMITH M A L, SAWWAN J S. Rapid, nondestructive measurement of chlorophyll content in leaves with nonuniform chlorophyll distribution [J]. Photosynthesis Research, 1988, 16(3): 277−284. [9] 张玉. 基于RGB图像的黄瓜叶片叶绿素含量估测研究[D]. 泰安: 山东农业大学, 2024. ZHANG Yu. Research on Estimation of Chlorophyll Content in Cucumber Leaves Based on RGB Images[D]. Tai’an: Shandong Agricultural University, 2024. [10] 陆声链, 李沂杨, 李帼, 等. 基于RGB与深度图像融合的生菜表型特征估算方法[J]. 农业机械学报, 2025, 56(1): 84−91, 101. LU Shenglian, LI Yiyang, LI Guo, et al. Lettuce phenotype estimation using integrated RGB-depth image synergy [J]. Transactions of the Chinese Society for Agricultural Machinery, 2025, 56(1): 84−91, 101. [11] 李修华, 卢显杰, 奚金阳, 等. 智能手机RGB图像检测植物叶片叶绿素含量的通用方法[J]. 农业工程学报, 2021, 37(22): 145−151. LI Xiuhua, LU Xianjie, XI Jinyang, et al. Univeisal method to detect the chlorophyll content in plant leaves with RGB images captured by smart phones [J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(22): 145−151. [12] 李丽, 程灵. 基于RGB模型建立快速检测番茄叶片叶绿素含量的方法[J]. 分子植物育种, 2021, 19(20): 6906−6909. LI Li, CHENG Ling. A method for rapid detection of chlorophyll content in tomato leaves based on RGB model [J]. Molecular Plant Breeding, 2021, 19(20): 6906−6909. [13] 郜锦茹. 智能手机成像模组的质量评价方法[D]. 杭州: 杭州电子科技大学, 2018. GAO Jinru. Quality Evaluation Methods of Smart Phone Imaging Module[D]. Hangzhou: Hangzhou Dianzi University, 2018. [14] CHEN Jiaming, WU Shuhua, DONG Fang, et al. Mechanism underlying the shading-induced chlorophyll accumulation in tea leaves[J/OL]. Frontiers in Plant Science, 2021, 12: 779819[2025-08-01]. DOI: 10.3389/fpls.2021.779819. [15] 吴际友, 李志辉, 刘球, 等. 干旱胁迫对红椿无性系幼苗叶片相对含水量和叶绿素含量的影响[J]. 中国农学通报, 2013, 29(4): 19−22. WU Jiyou, LI Zhihui, LIU Qiu, et al. Response of drought stress on relative water content of leaf and cholorophyll content of young Toona ciliata Roem. clones seedlings [J]. Chinese Agricultural Science Bulletin, 2013, 29(4): 19−22. [16] 邓颖. 基于叶片颜色特征的毛竹林营养诊断研究[D]. 杭州: 浙江农林大学, 2021. DENG Ying. Nutrition diagnosis of Phyllostachys pubescens Forest Based on Leaf Color Characteristics[D]. Hangzhou: Zhejiang A&F University, 2021. [17] 李莉, 蓝天, 赵奇慧, 等. 基于加权随机森林的番茄氮元素缺乏分级模型研究[J]. 农业机械学报, 2021, 52(11): 219−225, 262. LI Li, LAN Tian, ZHAO Qihui, et al. Discriminant model of tomato nitrogen deficiency based on weighted random forest [J]. Transactions of the Chinese Society for Agricultural Machinery, 2021, 52(11): 219−225, 262. [18] WANG Yujue, JIA Yuna, BAI Yang, et al. Digital image-based method of leaf color and area feature recognition [J]. Advances in Computer and Communication, 2024, 5(2): 122−127. [19] LEE J, JEONG I, KIM K, et al. Design and implementation of embedded-based vein image processing system with enhanced denoising capabilities[J/OL]. Sensors, 2022, 22(21): 8559[2025-08-01]. DOI: 10.3390/s22218559. [20] DOMB M, LESHEM G. Secured key distribution by concatenating optical communications and inter-device hand-held video transmission[J/OL]. Applied System Innovation, 2020, 3(1): 11[2025-08-01]. DOI: 10.3390/asi3010011. [21] OLALERE M, AIMUFUA G I O, ABDULLAHI M U, et al. Ensemble-based predictive model for crop recommendation [J]. Dutse Journal of Pure and Applied Sciences, 2024, 10(2c): 391−409. [22] ZAIDI N, WEBB G, CARMAN M, et al. Deep broad learning-big models for big data [J]. Journal of Machine Learning Research, 2015, 1: 1−24. [23] 余德炤, 江晓东, 杨莹颖, 等. 基于RGB与高光谱图像的小麦低温胁迫评估模型[J]. 南方农业学报, 2025, 56(1): 97−110. YU Dezhao, JIANG Xiaodong, YANG Yingying, et al. Assessment model for low temperature stress in wheat based on RGB and hyperspectral images [J]. Journal of Southern Agriculture, 2025, 56(1): 97−110. [24] 马彦鹏, 边明博, 樊意广, 等. 基于无人机RGB影像的马铃薯植株钾含量估算[J]. 农业机械学报, 2023, 54(7): 196−203, 233. MA Yanpeng, BIAN Mingbo, FAN Yiguang, et al. Estimation of potassium content of potato plants based on UAV RGB images [J]. Transactions of the Chinese Society for Agricultural Machinery, 2023, 54(7): 196−203, 233. [25] PRANGA J, BORRA-SERRANO I, APER J, et al. Improving accuracy of herbage yield predictions in perennial ryegrass with UAV-based structural and spectral data fusion and machine learning[J/OL]. Remote Sensing, 2021, 13(17): 3459[2025-08-01]. DOI: 10.3390/rs13173459. [26] 邓再春, 张超, 朱夏力, 等. 基于无人机多光谱影像的云南松林蓄积量估测模型[J]. 浙江农林大学学报, 2024, 41(1): 49−56. DENG Zaichun, ZHANG Chao, ZHU Xiali, et al. Pinus yunnanensis volume estimation model based on UAV multispectral image [J]. Journal of Zhejiang A& F University, 2024, 41(1): 49−56. [27] 李龙杰, 史勇, 刘彦岑, 等. 基于RGB图像处理预测哈密瓜叶片叶绿素研究[J]. 中国农机化学报, 2024, 45(6): 149−155. LI Longjie, SHI Yong, LIU Yancen, et al. Research on predicting Hami melon leaf chlorophyll based on RGB image processing [J]. Journal of Chinese Agricultural Mechanization, 2024, 45(6): 149−155. [28] 严志雁, 王芳东, 郭熙, 等. 高光谱估测稻叶SPAD值预处理方法与模型比较[J]. 江西农业大学学报, 2020, 42(6): 1130−1138. YAN Zhiyan, WANG Fangdong, GUO Xi, et al. Comparison of pre-processing methods and models for estimating SPAD of rice leaves by hyperspectrum [J]. Acta Agriculturae Universitatis Jiangxiensis, 2020, 42(6): 1130−1138. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250460







 下载:
下载: